-
化学品的生产与使用改善了人类生活质量,但与此同时引发的环境问题和健康危害也不容忽视[1],化学物质可以通过多种途径排放到大气和水体中,母体化合物在环境中发生各种反应,可能会产生毒性更强的污染物[2]. 目前的毒性评价研究更多关注母体化学物质的毒性效应,需进一步研究其在环境中转化产物的毒性和健康效应[3].
吡啶类化合物广泛应用于燃料、农药和医药等生产中[4],被大量排放到环境中,在大气、水和土壤介质中广泛存在. 吡啶是一种高水溶性的含氮芳香族有机化合物,环境中的吡啶类污染物可通过化学和生物方式降解为羟基吡啶[5-6]. 研究表明,许多吡啶化合物具有较强的生物活性,容易诱导急性、亚急性和遗传毒性效应[7]. 遗传毒性特别重要,它与致突变性、致癌性以及癌症有关,氧化应激和DNA损伤修复是遗传毒性中的两条通路,由环境中化学物质引起细胞氧化应激或DNA损伤均可能导致可遗传的性状改变,如细胞突变,可进一步引发癌症[8],有研究表明羟基吡啶可对细胞造成氧化应激,进一步诱导遗传毒性[9]. 突变型和致癌性的生态健康问题越来越凸显,因此需要具有高效率和低成本的遗传毒性筛查评估方法. 大肠杆菌是一种被充分研究的模式生物,基于大肠杆菌的高通量基因毒性评估已经成为DNA损伤修复和氧化应激的重要手段,在环境污染物的暴露下,大肠杆菌中的基因会编码蛋白质进行相关修复,并生成绿色荧光蛋白. 该方法可以检测和量化DNA损伤修复以及氧化应激通路中蛋白质的分子水平变化,涵盖了29种基因标志物,可以对环境污染物进行快速、定量的毒性评估[10-11]. 有机污染物在环境中的降解产物可能表现出比原始污染物更大的毒性效应[12]. 目前,对于吡啶类化合物在光降解过程的中间产物的毒性效应了解甚少,是否会产生毒性更强的转化产物尚未可知,因此运用基于遗传毒性的评价方法评估化学物质的损伤效应能为保护人体健康提供一定的参考价值.
太阳中的紫外线根据波长可以分为UVA(315—400 nm),UVB(280—315 nm)和UVC(200—290 nm),UVC大部分被平流层中的臭氧吸收,到达地面的主要为UVA和UVB[13],2-py、3-py、4-py和2,6-dm-3-py在大气环境中广泛存在,可以在紫外线的作用下发生变化,4种吡啶类化合物对紫外线的吸收峰值距离365 nm和312 nm较近,对这两种波长的紫外线吸收效果较好. 本文利用天然发光菌(费氏弧菌)和重组发光大肠杆菌,研究4种吡啶类化合物经365 nm和312 nm紫外线照射后急性毒性、遗传毒性和氧化应激毒性变化规律.
-
4-羟基吡啶(4-py)、3-羟基吡啶(3-py)、2-羟基吡啶(2-py)、2,6-二甲基-3-羟基吡啶(2,6-dm-3-py)购自阿拉丁公司,具体信息如表1所示. 利用多管涡流器和超纯灭菌水,配制浓度分别为1000、500、200、100、50、20、10、5、2.5、1.25、0.625 mg·L−1C的水溶液.
-
整个光照实验过程在4 oC冰箱中进行. 将装有不同浓度羟基吡啶样品的96孔板放置在距离紫外灯管3 cm处. 分别使用365 nm和312 nm波长的紫外线照射0、1、2、4、8 h,所有样品均保存在4 ℃冰箱内,用于后续毒性测试.
-
费氏弧菌(Vibrio fischeri)在自然状态下会产生光,污染物通过抑制其代谢活动减少荧光强度,因此可通过检测其发光抑制率来评估污染物急性毒性[14]. 本次实验的费氏弧菌冻干粉购自中国海洋文化馆.
将费氏弧菌冻干粉用2% NaCl溶液复苏,在黑色96孔板中每孔加入100 μL菌液,然后再加入100 μL待测样品溶液,设置 2%的NaCl作为空白对照. 将96孔板置于22 °C恒温摇床300 r·min−1孵育30 min,然后使用多功能酶标仪(Synergy Multi-Mode,Biotek)检测费氏弧菌发光强度. 利用公式1计算待测样品和对照组的发光抑制率,每个测试至少设置3个平行样.
EC50是指能引起50%发光抑制效应时对应的暴露浓度,是急性毒性评价中常见的一项指标[15],使用Origin软件(Origin 2021)中的剂量-效应响应曲线拟合吡啶类化合物对费氏弧菌发光抑制的剂量-响应曲线,并计算出50%发光抑制浓度(EC50),即费氏弧菌发光抑制率达到50% 时的样品浓度.
-
本研究所用重组大肠杆菌为K12MG1655[16],每株重组菌携带一个质粒,该质粒含有大肠杆菌功能基因的启动子和绿色荧光蛋白基因(GFP),当重组大肠杆菌暴露于污染物时,其基因表达会受到影响,进而影响启动子和GFP表达,通过检测GFP荧光强度来检测环境污染物对大肠杆菌基因表达的影响[17-18]. 本研究所用重组大肠杆菌来源于Thermo,所选重组大肠杆菌重组基因信息如表2所示.
-
重组E. coli K12 MG1655在37 ℃ LB培养基(1 L溶液中包括10 g胰蛋白胨、5 g酵母提取物和10 g氯化钠)中培养12 h后,将菌液1:100稀释在M9培养基(1 L溶液体系中2 mL 1 mol·L−1 MgSO4、0.1 mL 1 mol·L−1 CaCl2、12.8 g Na2PO4·12H2O、3.0 g KH2PO4、0.5 g NaCl、1.0 g NH4Cl和20 mL 20%葡萄糖)中,以避免LB液体培养基对荧光强度的检测造成干扰. 在M9培养基中培养约2 h后,将处于对数生长期(OD600为0.2—0.3)的重组E. coli转移到透明底的黑色96孔板中,每孔加入180 μL菌液. 同时,迅速将配好的20 μL样品溶液加入重组大肠杆菌菌液中,最终暴露浓度分别为100、20、4、0.8、0.16、0.032、0.0064 mg·L−1C. 空白对照组仅加入M9培养基,每个浓度至少有3个平行样. 在37 ℃培养2 h后,使用多功能酶标仪测量细胞密度OD600(吸光度600 nm)和荧光强度(激发光485 nm,吸收光525 nm)[19].
-
暴露于样品的重组大肠杆菌称为实验组,实验组重组大肠杆菌的荧光强度为Pe,菌体密度表示为ODe,仅加入PBS缓冲液的重组大肠杆菌称为空白对照组,空白对照组大肠杆菌的荧光强度为Pb,菌体密度表示为ODb.
污染物对重组大肠杆菌基因表达的诱导倍数(I),利用公式2计算:
利用转录效应水平指数(TELI)量化和比较不同毒物诱导基因表达之间的差异,TELI利用公式3计算[20]:
其中,Time是指重组大肠杆菌暴露于样品的时间,e是指数学常数e.
-
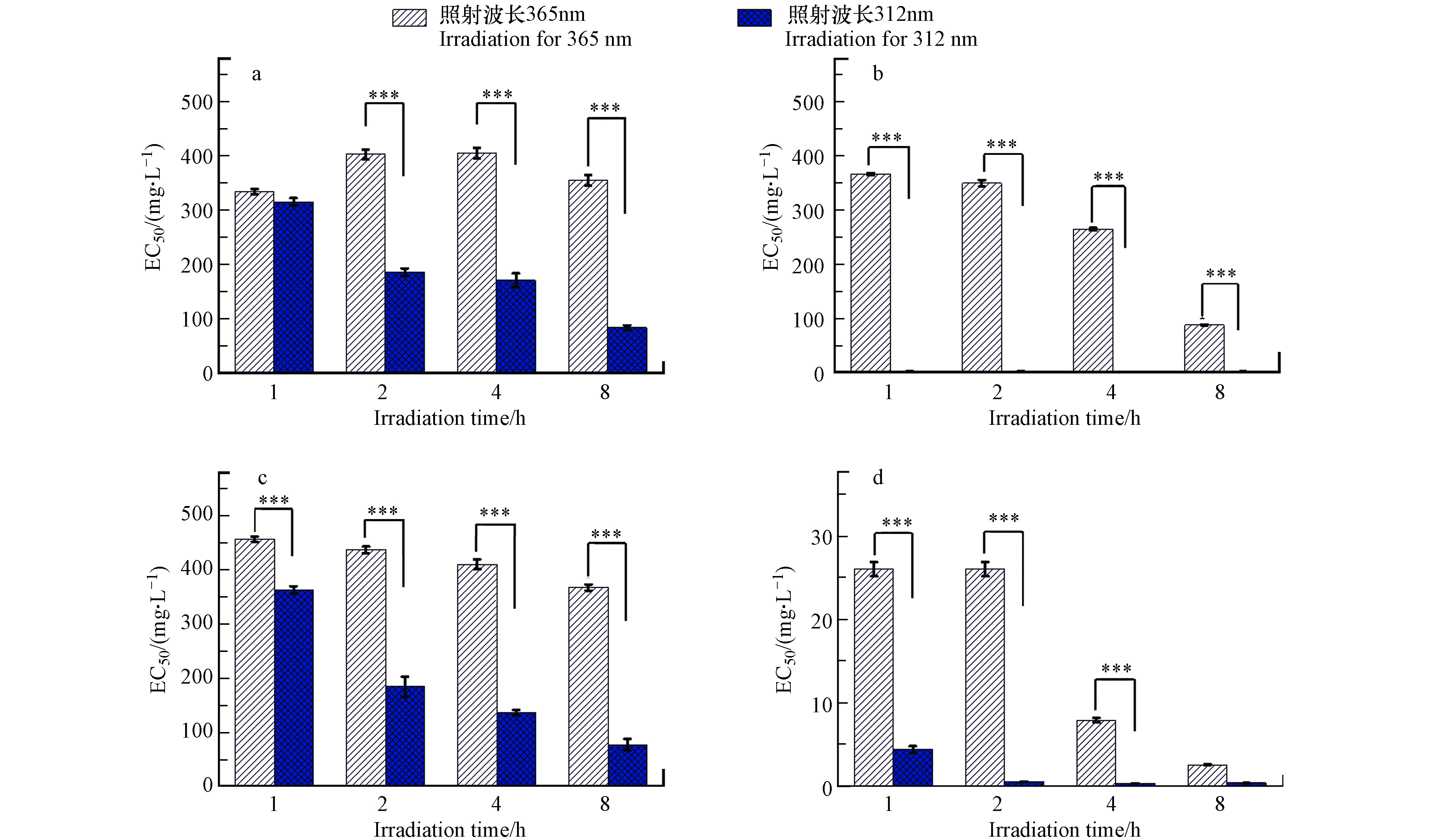
由图1可见,经过365 nm和312 nm 紫外线照射后,4种吡啶化合物的EC50发生了显著变化. 4-py 经365 nm 紫外线照射后EC50小幅升高,而经312 nm 紫外线照射后,4-py的EC50从339.80 mg·L−1C 降低到83.24 mg·L−1C,表明其光降解产物毒性增强,说明4-py经365 nm和312 nm 紫外线照射后产生了不同的降解产物,且312 nm 紫外线照射后降解产物急性毒性显著升高. 有研究表明,草甘膦暴露于365 nm 紫外线后对试验生物的毒性作用没有明显变化,暴露于312 nm 紫外线可造成光解作用降低草甘膦的浓度,从而降低其生态毒性[21].
在所测浓度范围内(64 μg·L−1C—100 mg·L−1C),2-py对费氏弧菌的发光抑制率未达到50%,说明其对费氏弧菌的毒性作用较小,这可能是由于2-py的酸性要弱于其它同分异构体[22],而费氏弧菌一般生活在偏弱碱性的海水中[23],所以其对酸性较小的2-py耐受能力更强. 3-py和2-py经365 nm和312 nm 紫外线照射后,急性毒性均增强. 经312 nm紫外线照射后的毒性增强更为明显,这可能是3-py和2-py经312 nm 紫外线照射后的光降解效率更高造成的. 经365 nm和312 nm 紫外线照射1 h后,2,6-dm-3-py急性毒性急剧增强,这表明2,6-dm-3-py能快速发生光化学反应,且光解产物诱导更强的急性毒性.
-
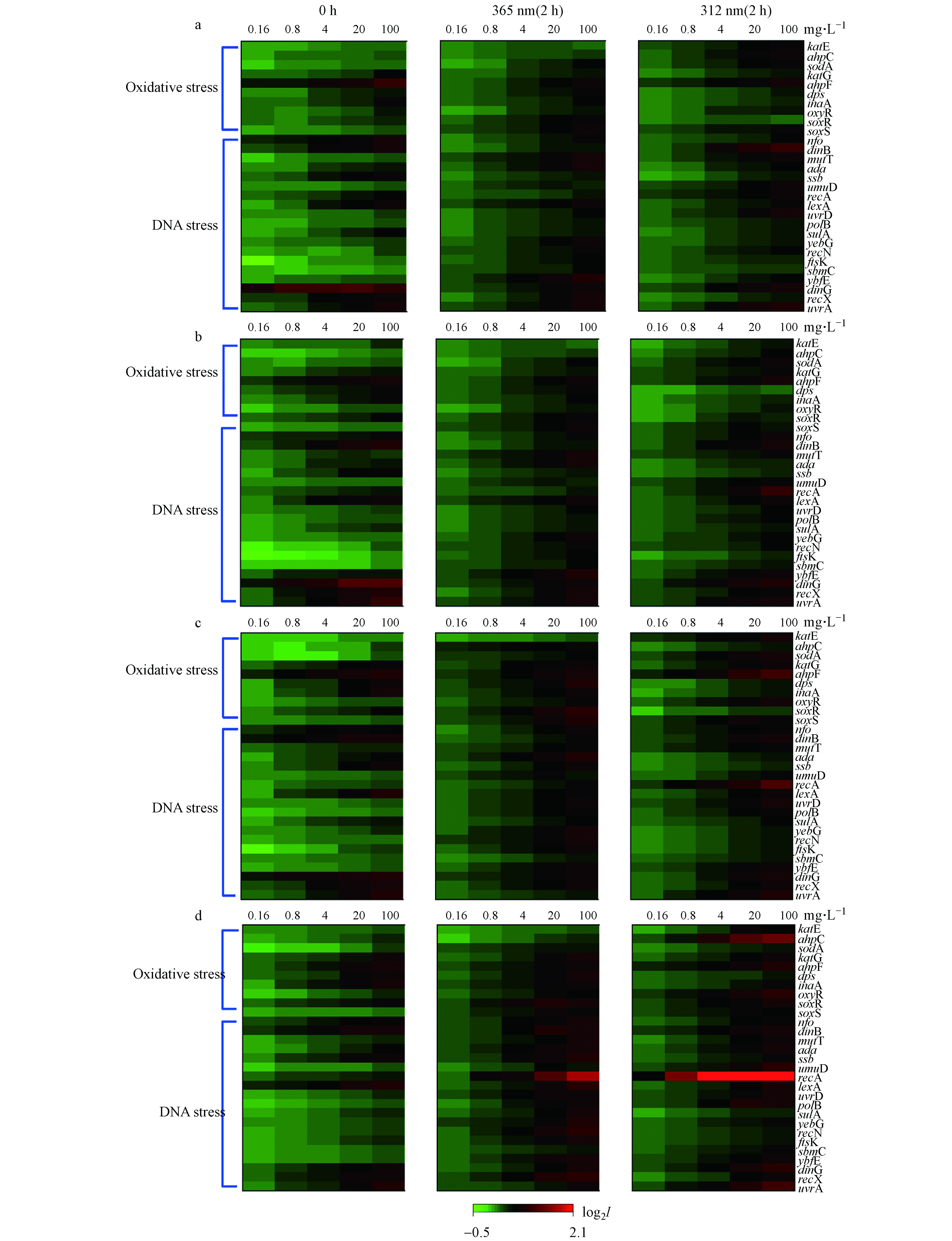
如图2所示,4种吡啶类化合物经紫外线照射后,均可诱导重组大肠杆菌毒性相关基因表达改变,基因表达变化程度会随着浓度增加而增大,有研究报道暴露浓度会影响基因激活程度[24]. 4-py和3-py能够诱导较强的DNA损伤效应,其中lexA、nfo、uvrA基因表达显著增强,但经紫外线照射后,其DNA损伤效应减弱,表明其光降解产物的遗传毒性减弱. 2-py和2,6-dm-3-py对遗传毒性和氧化应激相关基因表达影响较小,但经紫外线照射后,两条通路的相关基因(lexA、recA、oxyR和ahpF等)的表达均被明显激活,表明其光降解产物具有较强的DNA损伤和氧化应激毒性(图2).
4-py具有明显的遗传毒性,可激活lexA基因(参与细菌SOS反应的一种调节蛋白)[25],经紫外线照射后表现出更强的DNA损伤和氧化应激毒性,有一半以上的DNA修复基因(lexA、mutT、uvrA、uvrD和ssb等)和氧化应激相关基因(soxS、soxR和ahpF)显著表达. 3-py经312 nm紫外线照射后,遗传毒性和氧化应激效应更强,可能因为其对312 nm的紫外线吸收能力较强[9].
-
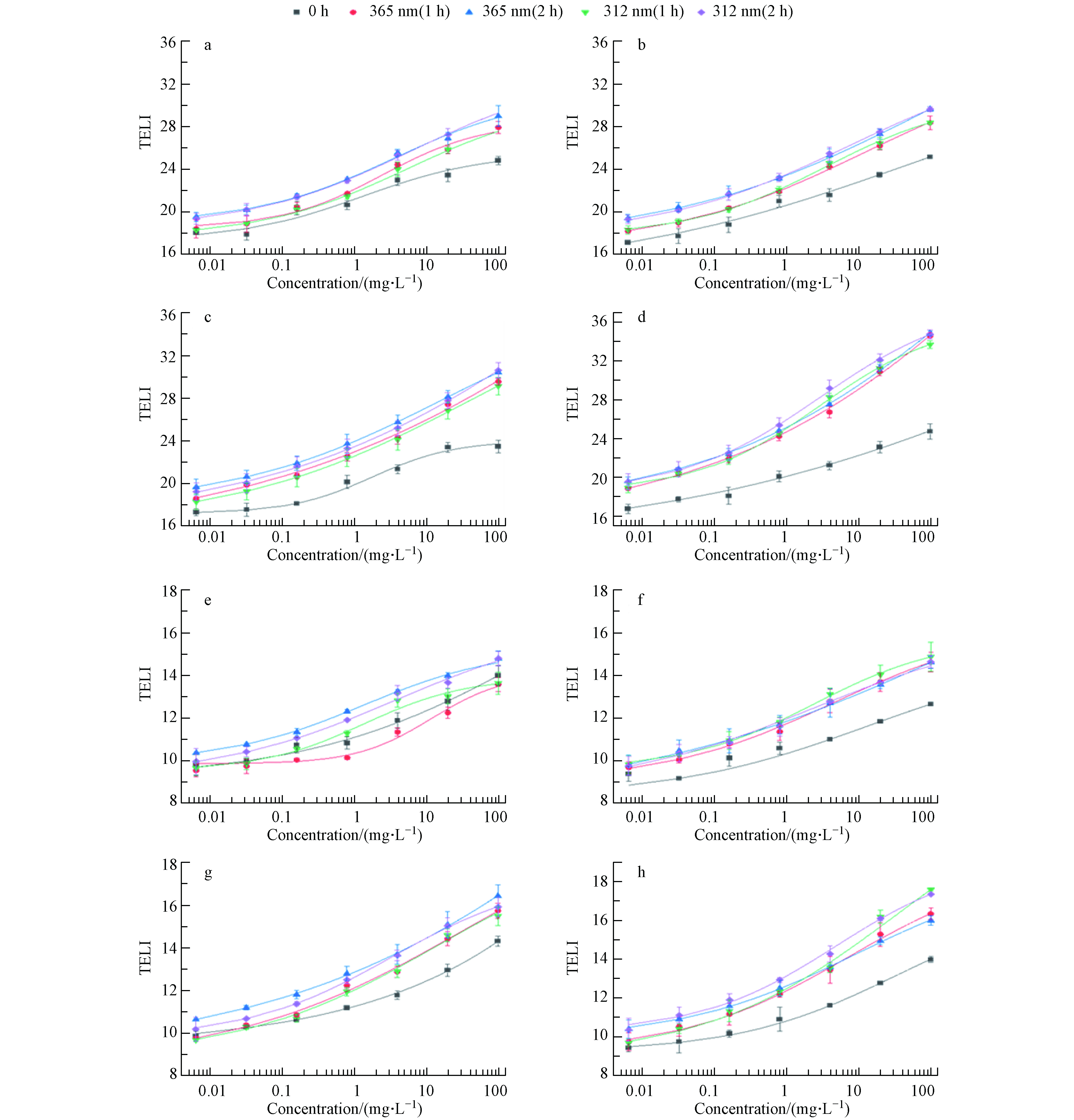
基因表达检测方法从深层次揭示了污染物对生物体遗传信息的影响,探究母体化合物及其降解产物的毒性机制区别. 根据TELI(Transcriptional Effect Level Index)测定的定义和原理,可以计算DNA损伤和氧化应激相关基因的TELI值,以量化各类通路对应的转录水平响应[20].
图3(a、b、c和d)显示了DNA应激相关基因TELI值的剂量响应曲线,这些基因在细胞DNA受到损伤时起到修复的功能. 未经紫外线照射,2-py在DNA应激类别中的TELI最大值为23.4,表明其造成的DNA损伤较弱,其余3种吡啶类化合物TELI值差异不大. 经365 nm 紫外线照射,2-py、4-py和2,6-dm-3-py的TELI值扩大,能激活参与DNA损伤和修复途径的基因(lexA和recA),包括双链断裂修复基因,表明其降解产物能够造成严重的DNA胁迫效应. 4种吡啶类化合物均能激活ada基因,细胞面对DNA损伤时进行直接修复. 2-py、2,6-dm-3-py及其降解产物能够导致参与碱基切除修复基因mutT、nfo、polB表达的上调,表明其降解产物造成了多种结构的DNA损伤. 经312 nm紫外线照射后,3-py的TELI最大值为29.6,是未经照射的1.2倍,导致一些DNA修复通路的基因表达水平发生变化,包括碱基切除修复,核苷酸切除修复等相关基因,表明可能产生了未知基因毒性的降解产物.
RecA和LexA是参与细菌SOS反应的两种重要蛋白,调控DNA修复和突变的基因以响应DNA损伤[25, 26]. mutT、polB、nfo基因参与了碱基切除修复的过程. uvrA能够识别细菌中的损伤,dinG是超家族II解旋酶的成员,参与了核苷酸切除修复和重组DNA修复途径[27],dinB编码特殊的DNA聚合酶应对DNA的断裂[28]. 高度稳定的细菌单链DNA结合蛋白ssb也在定向错配修复中起着关键性的作用,它可以参与双链断裂的损伤反应,促进DNA复制、重组和修复过程[29, 30].
-
图3(e、f、g、h)显示了氧化应激相关基因TELI值的剂量-响应曲线,这些基因在细胞中起到抵制氧化应激的作用,还会通过上调抗氧化及相关酶的合成清除氧化自由基,以消除活性氧对细胞的毒性效应[31]. 未经紫外线照射,3-py在氧化应激类别中的TELI最大值为12.6,表明其引起的氧化应激水平最低,但经312 nm 紫外线照射后,TELI值是未经照射的1.2倍,表明其造成的氧化应激胁迫增强. 2-py未经紫外线照射时表现出显著的氧化应激,这与过往的研究一致[22]. 经紫外线照射后,2-py的TELI最大值由14.3变为16.4,表明其诱导的氧化损伤随光降解作用而增强,可能是由于2-py经紫外线照射后降解产生了杜瓦吡啶酮[23]. 3-py经紫外线照射后TELI值扩大1.3倍,其可作为内源性敏化剂,经紫外线照射对细胞造成光氧化应激,具有细胞抑制作用[25]. 经紫外线照射后,4-py的TELI值变化不大,可能是4-py经紫外线照射后未发生明显降解. 经365 nm 紫外线照射后,2,6-dm-3-py改变了一些氧化应激基因表达,包括oxyR、ahpC、inaA等,表明其降解产物氧化能力增强.
在所选的氧化应激通路相关基因中,oxyR、soxR和soxS是调控活性氧传感器的关键基因,面对外界过氧化氢活性氧的干扰,重组大肠杆菌中oxyR系统会调节相关基因的表达,在感知氧化信号的同时还能上调具有保护细胞免受活性氧干扰的基因产物[32]. ahpC和ahpF是两个参与过氧化物解毒过程的基因,调节烷基氢过氧化物还原酶的生成[33]. katE和katG基因在过氧化氢浓度高的时候起主要作用[34, 35]. sodA基因是保护细胞免受活性氧损害的第一道防线,由它调控的超氧化物歧化酶可以将超氧自由基转化为过氧化氢和水[36]. inaA基因编码一种蛋白酶来应对氧化,但它的诱导依赖于ph[37].
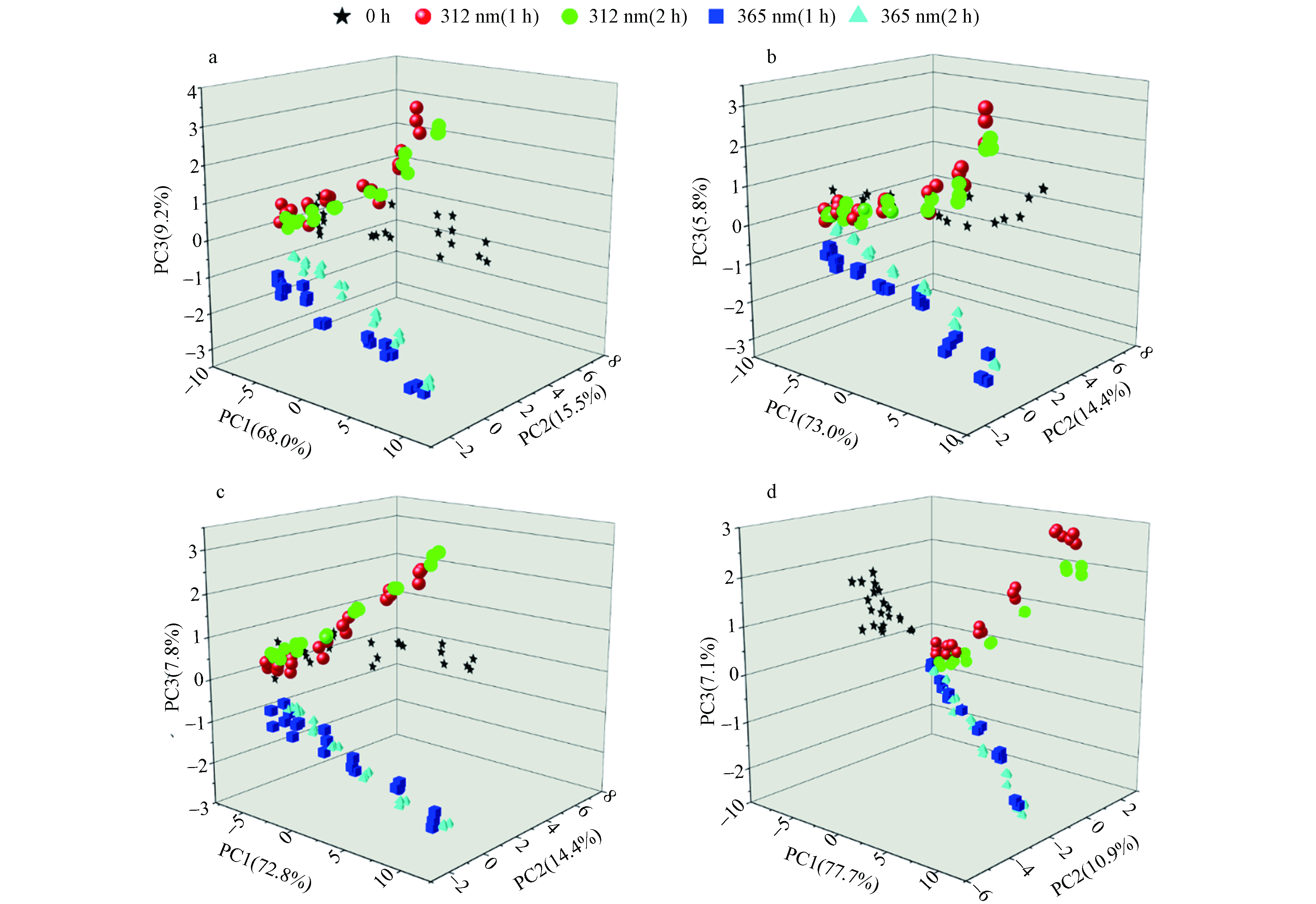
图4为基于4种吡啶类化合物诱导重组大肠杆菌中基因表达数据的PCA分析图. 结果显示,4种吡啶类化合物及其光降解产物的基因表达可以根据遗传毒性机制进行区分. 对于4种吡啶类化合物,紫外线波长、紫外线照射时间和浓度条件都能改变DNA应激和氧化应激相关的基因表达. 如图4所示,未经紫外线照射的点与其他点存在分离,表明紫外线照射能够增强吡啶类化合物诱导DNA损伤的能力. 对于3-py(b),经312 nm紫外线照射1 h和2 h的点距离较近,表明照射时间对其造成的毒性效应影响较小. 对于2,6-dm-3-py,未经紫外线照射的条件下,7个浓度的点聚集在一起,表明其在所选范围浓度内激活相关基因的数量比较相似,造成的损伤效应较弱.
-
(1)羟基吡啶合物光降解产物对费氏弧菌的抑制率随浓度、紫外线波长和辐射时间而变化. 经365 nm和312 nm 紫外线照射后,3-py、2-py和2,6-dm-3-py的EC50随着辐照时间的增加而降低,表明其诱导的毒性作用增强. 经365 nm紫外线照射后,4-py的EC50随着辐照时间先上升后下降. 相反,经312 nm紫外线辐照后,其EC50随辐照时间的增加而降低.
(2)不同的羟基吡啶化合物诱导不同的遗传毒性和氧化应激效应,2-py在DNA应激的TELI值为23.4,只能激活部分DNA损伤修复基因(uvrA和recX等),造成轻微的DNA损伤,3-py在DNA应激的TELI值为25.1,能激活recA、mutT和nfo等基因,造成的DNA损伤较为强烈;2,6-dm-3-py具有显著的遗传毒性和氧化应激效应,能够诱导半数以上的DNA损伤修复和氧化应激毒性通路相关基因(recA、dinG和oxyR等),表明其对重组大肠杆菌具有强烈的胁迫效应.
(3)羟基吡啶化合物经365 nm和312 nm 紫外线照射后,改变DNA应激和氧化应激相关基因表达,其TELI值是未经照射下的1.2—1.4倍,表明其在紫外线辐照作用下的降解产物造成更为严重的DNA损伤和氧化应激毒性.
(4)采用基于DNA损伤和修复途径的遗传毒性评估方法,能够快速、定量筛选以及评估环境中可能对人体造成遗传毒性的化学物质,这种方法更具有成本效应,并且可以获得更多关于DNA损伤和氧化应激潜在机制的信息.
紫外线照射对羟基吡啶毒性效应的影响
Study on mechanism of toxicity of pyridine compounds under ultraviolet irradiation
-
摘要: 吡啶类化合物广泛存在于各种环境介质中,本文以羟基吡啶(2-羟基吡啶(2-py)、3-羟基吡啶(3-py)、4-羟基吡啶(4-py)和2,6-二甲基-3-羟基吡啶(2,6-dm-3-py))为研究对象,利用费氏弧菌和基因重组大肠杆菌,评估4种羟基吡啶经紫外线照射后急性毒性、遗传毒性和氧化应激效应变化规律. 结果表明,2-py、3-py和2,6-dm-3-py经365 nm和312 nm紫外线照射后,毒性随照射时间延长而增强,其急性毒性相较于未照射前,分别增强了24.7%—99.4%和84.0%—99.9%(照射8 h后). 而4-py 经两种波长的紫外线照射后毒性变化不同,经365 nm紫外线照射后,急性毒性降低;但经312 nm紫外线照射8 h后,急性毒性增强77.7%,说明4-py经两种波长紫外线照射后生成了不同的降解产物. 遗传毒性测试结果表明,4种羟基吡啶及其降解产物对DNA损伤和修复过程具有浓度依赖性,在20—100 mg·L−1C浓度下,细胞SOS响应和氧化还原应激相关基因表达显著,但在6.4 —10 mg·L−1C 浓度范围内,毒性相关基因表达变化不大,说明4种羟基吡啶及其降解产物在20—100 mg·L−1 C内可引起DNA损伤和氧化应激效应.Abstract: Pyridine compounds are widely found in various environments. In order to understand the toxic effects in the environment and reveal the influence of ultraviolet (UV) light on their toxicity, the toxicities of 4 pyridine compounds (2-hydroxypyridine (2-py), 3-hydroxypyridine (3-py), 4-hydroxypyridine (4-py) and 2,6-dimethyl-3-hydroxypyridine (2,6-dm-3-py) and their degradation products after UV irradiation were evaluated by both Vibrio fischeri luminescence inhibition assay and genotoxicity assay using recombinant Escherichia coli, respectively. The results showed that the acute toxicities of 2-py, 3-py and 2, 6-dm-3-py increased by 24.7%—99.4% and 84.0%—99.9% after 365 nm and 312 nm UV irradiation for 8 h, respectively. The acute toxicity of 4-py was unchanged after irradiated by 365 nm UV for 8 h, on the contrary, increased by 77.7% after irradiation at 312 nm for 8 h. The DNA damage and repair process induced by the four pyridine compounds and their degradation products was concentration-depended. At the concentration of 20—100 mg·L−1C, the SOS response and Redox stress-related genes were significantly expressed, but at the concentration of 6.4 mg·L−1 to 10 mg·L−1C, the expression of toxicity-related genes showed little change, indicating that the four pyridine compounds and their degradation products at 20—100 mg·L−1C could cause DNA damage and oxidative stress.
-
铅锌矿在中国矿产资源体系中占据着至关重要的地位,是工业领域的“关键基石”. 我国已勘铅锌资源主要集中于7个省区,储量约占全国66%,其中就包含甘肃省[1]. 在矿业开采与工业加工进程中,废液未经妥善处理随意排放,废渣堆积成山,加上雨水冲刷,致使 Cd、Hg等有害成矿、伴矿元素不断迁移、扩散,对周边土壤造成污染. 同时,由于土壤重金属污染的累积性[2],使其在土壤中的浓度越来越高,最终对生态系统造成危害[3]. 统计数据显示,我国有超过2000万 hm2的农田土壤存在重金属污染情况,当中被工业废渣污染的农田约10万 hm2,因采矿而污染的土壤面积约20万 hm2[4]. 一旦土壤重金属富集至特定程度,便会对农作物质量产生直接影响,有研究表明,国内每年由于土壤重金属污染而导致的粮食安全损失高达1.2×108 t,直接造成的经济损失逾 200 亿元[5]. 其毒性效应可经食物链传递至人体,引发骨骼疼痛、肾脏疾病等健康问题,对人类健康构成了极大的威胁 [6].
目前国内外学者对土壤重金属源解析的方法主要包括判别污染源类别和精准解析污染源两部分[7 − 9],前者包括相关性分析法、主成分分析法和聚类分析法等,后者包括绝对因子得分-多元线性回归法和正定矩阵因子分解法(positive matrix factorization,PMF)等. PMF是对污染源进行精确分析的首选方法,该方法操作简单,可同时满足不确定性和非负性约束[10],能够自动化地处理错误和缺失数据,不需要源组分图就能得到精确、可信的结果,因此被美国环保署优先推荐使用[11]. PMF 源解析虽能识别土壤重金属污染源,但难以精准量化其生态风险和健康风险,从而无法确定首要管控要素[11]. 为此,学者们将PMF模型与生态风险、健康风险评价模型进行整合,成功提出重金属污染特定源的风险评价方法[12]. 马杰等[13]将PMF模型和健康风险模型结合,探讨了不同污染源影响下重庆市农产品主产区的土壤健康风险,确定研究区工业源和As为首要管控要素,重金属源解析成为后期尾矿库及其周围土壤修复或复垦的重要依据.
甘肃省陇南市矿产资源丰富,尾矿库数量多,以铅锌矿和金矿尾矿为主,占比分别为72.54%和15.5%[14]. 当前,铅锌尾矿库及周边农田是土壤重金属污染的重点关注区域. 本文以此为研究对象,测定其土壤重金属含量,分析其污染状况,并在源解析的基础上结合生态风险和健康风险评估模型来量化各污染源相应风险贡献率,从而确定首要控制因素. 研究结果将为尾矿库周边农田土壤污染现状的调查和评价提供科学有效的理论依据.
1. 材料与方法(Materials and methods)
1.1 研究区概况
研究区地处徽县江洛镇赵湾村,隶属于甘肃省陇南市. 县名源自城北徽山之下的徽山驿,在北纬33°32'—34°10'、东经105°34'—106°26'之间,东接两当县,南连陕西省略阳县,西接成县,北通天水市秦州区与麦积区,西北衔西和县,总面积
2699 km2. 江洛镇处于徽县北部山地向中部河谷丘陵过渡区域,地势自北向南渐次降低,地形分为东南部河谷区,西北部山区;境内最高峰海拔2002 m. 江洛镇属暖温带大陆性气候;多年来气温的平均值为11 ℃,无霜期平均每年可达180 d,降水量的平均值为700 mm,降雨每年集中在7—9月. 2022年全县耕地总面积38.98万亩. 江洛镇境内已探明地下矿藏有铅、锌、硫、铁、金、煤等矿产资源,特别是铅、锌矿储量较大[15]. 该尾矿库为山谷型,采用湿式排放方式,尾矿库现状总坝高26 m,初期坝坝高为15 m,堆积坝坝高11 m,库内堆存尾砂量约为23万m3. 该尾矿库未填埋,在工矿生产和矿渣储存过程中,土壤中的粉尘会在大气中沉积,受降雨和径流的影响,对矿区周围环境造成了严重影响,从而可能会引发一系列的生态环境安全问题.1.2 样品的采集与处理
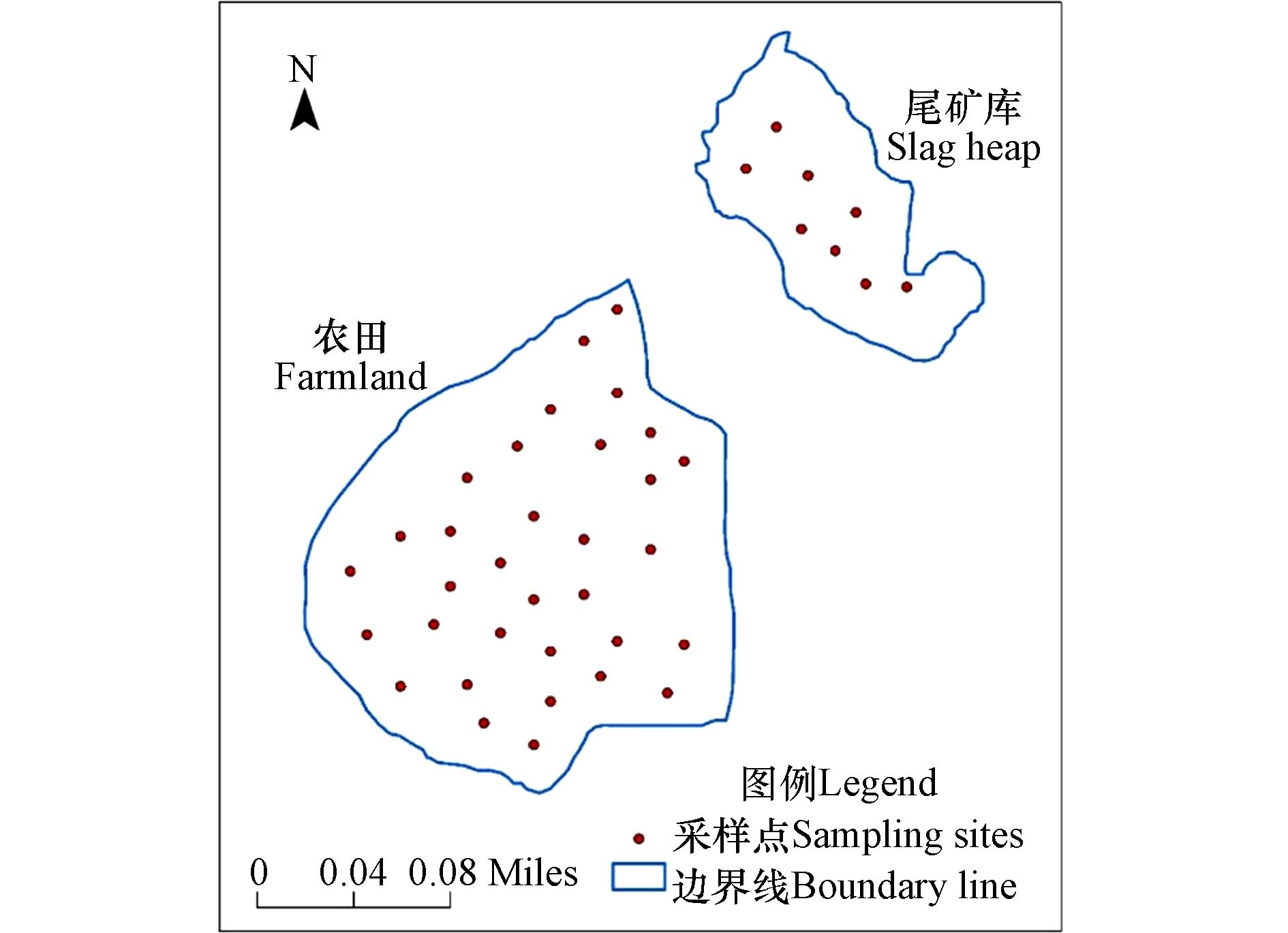
本文于2023年8月在甘肃省陇南市某铅锌尾矿库及其周边农田(北纬33°53'27''—33°53'43''、东经105°48'27''—105°48'41'')进行样品采集. 采用了简单随机布点法并结合专业判断法来布点. 为确保采样点布局的科学性与均匀性,本研究充分借助了地理信息系统的空间分析能力,结合网格化精密的划分手段,对整个研究区域进行布局(采样面积约为3.22 km2)[1]. 采样时用GPS定位采样点经纬度,并根据样点采集顺序对其编号,在现场共布置了41个采样点,其中尾矿库8个,周边农田33个,如图1所示. 在每个采样点采集表层土壤(0—20 cm),样品放在密封袋里保存. 采集的样品经自然风干、去除杂物、研磨和筛分后,一份用于测定土壤pH,一份用于测定土壤重金属含量. 采用电感耦合等离子体质谱仪(ICP-MS,NexION 2000)测定经盐酸-硝酸-氢氟酸-高氯酸微波消解(CEM MARS6)后样品中的镉(Cd)、铬(Cr)、铜(Cu)、镍(Ni)、铅(Pb) 和锌(Zn) 含量,其检出限分别为0.03、2.00、0.70、2.00、1.00 mg·kg−1和5.00 mg·kg−1;采用原子荧光光度计(AFS-930d)测定经硝酸-盐酸消解后样品中的砷(As)和汞( Hg)含量,其检出限分别为0.20 mg·kg−1和0.002 mg·kg−1. 样品测试环节均进行空白实验与平行样测定,结果精密度符合实验允许误差要求,同时用国家标准土样予以质量管控,所测元素的加标回收率为95%—106%,分析误差为±5%.
1.3 评价标准
由于农田研究区土壤pH值范围为6.00—8.18,平均值为7.85,中位数为7.75,其中pH > 7.5占比达93.94%,且变异系数小于0.1. 故选用《土壤环境质量农用地土壤污染风险管控标准》(GB15618-2018)中pH>7.5的风险筛选值(mg·kg−1)和风险管制值(mg·kg−1)分别作为农田土壤的一级和二级评价标准. 《土壤环境质量建设用地土壤污染风险管控标准》(GB36600-2018)中第二类用地的风险筛选值(mg·kg−1)和风险管制值(mg·kg−1)分别作为尾矿库土壤的一级和二级评价标准,如表1所示.
表 1 土壤环境质量评价标准Table 1. Soil environmental quality evaluation criteria指标Index 风险筛选值Risk filter value 风险管制值Risk control value 尾矿库(第二类用地) 农田(pH>7.5) 尾矿库(第二类用地) 农田(pH>7.5) Cu 18000 100 36000 − Cr − 250 − 1300 Ni 900 190 2000 − Zn − 300 − − As 60 25 140 100 Cd 65 0.60 172 4.0 Pb 800 170 2500 1000 Hg 38 3.40 82 6.0 注:“−”表示无此项,下同. Note: "−" means that there is no such item, the same below. 1.4 污染负荷指数法
污染负荷指数法在土壤重金属污染水平评估中应用广泛,既能考量单个样点污染状况,又可评定多重金属污染区域状况[16]. 污染负荷指数法的计算如下式(1–3):
stringUtils.convertMath(!{formula.content}) (1) stringUtils.convertMath(!{formula.content}) (2) stringUtils.convertMath(!{formula.content}) (3) 式中,
CFi Ci Bi PLIzone 表 2 污染负荷指数分级标准Table 2. Classification standard of the pollution load indexCF PLI 等级Level 污染程度Contamination degrees CF<1 PLI<1 0 无污染 1≤CF<3 1≤PLI<3 1 轻度污染 3≤CF<6 3≤PLI<6 2 中度污染 6≤CF 6≤PLI 3 重度污染 1.5 PMF源解析
PMF模型是将重金属含量矩阵分解为因子得分矩阵、因子载荷矩阵和残差矩阵[19]. 见式(4–7):
stringUtils.convertMath(!{formula.content}) (4) 式中,
Xij Gjk Fki Eij stringUtils.convertMath(!{formula.content}) (5) 式中,
Uij Uij stringUtils.convertMath(!{formula.content}) (6) 当土壤重金属含量高于MDL时,则由式(6)计算得出:
stringUtils.convertMath(!{formula.content}) (7) 式中,
c δ 1.6 基于源导向的土壤重金属生态风险评估
本研究将PMF模型与综合生态风险评价指数法(Nemerow integrated risk index,NIRI)有机结合,来量化各污染源对生态风险的贡献[20]. 具体计算公式如下(8–12):
stringUtils.convertMath(!{formula.content}) (8) 式中,
Ck∗ij Ci stringUtils.convertMath(!{formula.content}) (9) stringUtils.convertMath(!{formula.content}) (10) 式中,
ERkij Bi Eir Tir stringUtils.convertMath(!{formula.content}) (11) stringUtils.convertMath(!{formula.content}) (12) 式中,
EIRIkij NIRIij ERkijmax Eirmax ERkijave Eirave Eir NIRI 表 3 生态风险指数分级标准Table 3. Ecological risk index classification criteriaEir 生态风险等级Ecological risk level NIRI 生态风险等级Ecological risk level Eir 轻微 NIRI<40 轻微 40≤ Eir 中等 40≤NIRI<80 中等 80≤ Eir 强 80≤NIRI<160 强 160≤ Eir 很强 160≤NIRI<320 很强 Eir 极强 NIRI≥320 极强 1.7 基于源导向的土壤重金属健康风险评估
采用美国环保署(USEPA)推荐的健康风险评估模型,量化土壤重金属对人体健康造成的风险[23]. 土壤重金属健康风险评估模型中暴露参数和不同暴露途径的参考剂量(RfD)和致癌斜率因子(SF)值参照中国生态环境部发布的HJ 25.3-2019中的风险评估模型参数推荐值和美国环保署发布的相关参数[24 − 26]. 对于致癌风险,致癌风险值低于10−6时,表示对人体健康风险不显著,视为风险可以忽略不计;致癌风险值为10−6—10−4时,表示对人体健康有风险;致癌风险值大于10−4时,表示有显著风险,认为风险是不可接受的[27]. 基于源导向的土壤重金属风险评估是先根据PMF模型得到不同源的贡献率,并结合研究区健康风险评估结果,计算不同源对人体健康风险的贡献率[28],具体计算公式如下(13–16):
stringUtils.convertMath(!{formula.content}) (13) stringUtils.convertMath(!{formula.content}) (14) stringUtils.convertMath(!{formula.content}) (15) stringUtils.convertMath(!{formula.content}) (16) 式中,
HQj Fij HQi Dj,HQ CRj CRi Dj,CR 1.8 数据处理与分析
研究数据处理采用SPSS 27和EXCEL,进行描述性统计分析,利用EPA PMF 5.0软件进行溯源解析,使用Origin 2024和ArcGIS软件处理数据并绘制图形.
2. 结果与讨论(Results and discussion)
2.1 土壤重金属污染评价
土壤中As、Cd、Cr、Cu、Ni、Pb、Zn和Hg元素含量描述性统计结果如表4所示,研究区尾矿库土壤中As、Cd、Cr、Cu、Ni、Pb、Zn和Hg含量范围分别为21.64—43.69、0.25—1.04、11.23—16.95、26.07—51.85、7.13—14.61、653.99—925.67、412.96—603.57 mg·kg−1和7.65—9.45 mg·kg−1,其中只有Pb有50.00%的样点超出一级标准. 研究区农田土壤中As、Cd、Cr、Cu、Ni、Pb、Zn和Hg的含量范围分别为10.20—26.85、1.35—3.30、68.76—134.98、12.64—23.60、11.44—29.20、39.12—92.61、66.65—139.35 mg·kg−1和2.48—4.33 mg·kg−1. 根据评价标准(表1),农田土壤中Cd所有样点的含量均超过一级标准,As有3.03%的样点超过了一级标准,Hg有39.39%的样点超过了一级标准,Cr、Cu、Ni、Pb和Zn含量均未超过一级标准. 尾矿库和农田土壤中所有重金属含量均未超过二级标准. 污染负荷指数法结果(图2)表明,农田土壤中8种重金属的
CFi PLI — CFi PLI 1000 万亩[29],农业活动频繁,结合PMF的结果,说明这2种重金属污染与农业活动和成土母质有关. 这与李多杰等[30]对内蒙古兴安盟某铅锌矿的研究结果相似,矿区周围的土壤受到明显的Zn和Pb污染,而铅锌矿周边土壤中的Cd和Cr污染归因于成土母岩风化和人为活动的共同作用.表 4 土壤重金属含量描述性统计分析Table 4. Descriptive statistical analysis of soil heavy metal content项目Item 采样地Sampling site 最小值/( mg·kg−1)Minimum 最大值/( mg·kg−1)Maximum 平均值/( mg·kg−1)Average value 标准差Standard deviation 变异系数Standard deviation 超标率Excess ratio 以一级标准为评价标准 以二级标准为评价标准 As 尾矿库 21.64 43.69 32.04 7.26 22.66% 0% 0% 农田 10.20 26.85 16.04 2.86 17.83% 3.03% 0% Cd 尾矿库 0.25 1.04 0.67 0.25 37.31% 0% 0% 农田 1.35 3.30 2.25 0.41 18.22% 100% 0% Cr 尾矿库 11.23 16.95 14.57 2.38 16.33% − − 农田 68.76 134.98 98.66 18.37 18.62% 0% 0% Cu 尾矿库 26.07 51.85 43.70 10.23 23.41% 0% 0% 农田 12.64 23.60 18.17 1.98 10.89% 0% − Ni 尾矿库 7.13 14.61 10.19 2.48 24.34% 0% 0% 农田 11.44 29.20 20.04 4.61 23.01% 0% − Pb 尾矿库 653.99 925.67 795.70 101.05 12.70% 50% 0% 农田 39.12 92.61 56.68 12.93 22.81% 0% 0% Zn 尾矿库 412.96 603.57 508.20 60.45 11.89% − − 农田 66.65 139.35 90.25 17.36 19.23% 0% − Hg 尾矿库 7.65 9.45 8.28 0.60 7.24% 0% 0% 农田 2.48 4.33 3.37 0.50 14.84% 39.39% 0% pH 尾矿库 8.26 8.58 8.42 0.16 1.90% − − 农田 6.00 8.18 7.85 0.75 9.59% − − 变异系数(coefficient of variance,CV)是一种反映重金属元素含量空间分布离散程度的指标[31],根据CV值的大小,可分为低度变异(CV<0.1)、中度变异(0.1≤CV<0.36)、高度变异(0.36≤CV<1)和极度变异(CV>1)[32]. 由表4可知,尾矿库研究区域土壤中Cd属于高度变异;As、Cu、Ni、Cr、Pb和Zn属于中度变异;Hg属于低度变异. 农田研究区域表层土壤中重金属的变异系数均在0.1—0.36之间,均属于中度变异. 因此,研究区域土壤中重金属含量的空间分布差异显著,地理环境和人类活动对其影响较大.
2.2 农田土壤重金属污染源解析
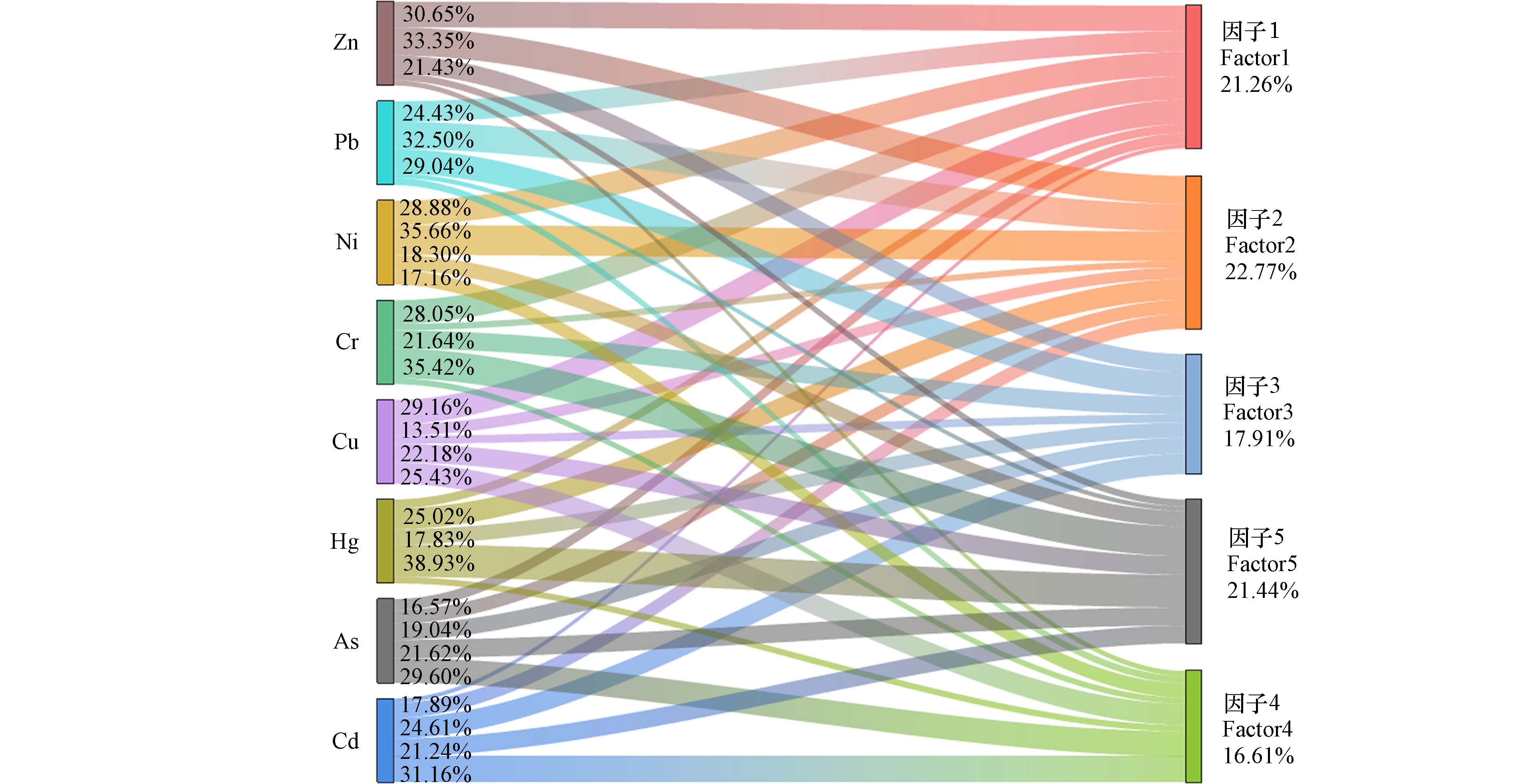
本研究设定4至7个因子数量,经多番运行调试,最终选定5个因子,获取了较低的Q值 42.43,此时实测值与预测值拟合效果最好,且多数残差处于−3—3区间. 8 种元素的R2系数为0.545—0.951,表明PMF的整体拟合效果较好,能够很好地满足研究需求,并解释了原始数据中包含的信息. PMF模型的解析结果如图3所示,5个污染源的占比分别为 21.26%、22.77%、17.91%、16.61%和 21.44%.
由图3可知,因子1主要载荷元素包括Cr、Cu、Ni、Pb和Zn,其贡献率分别为28.05%、29.16%、28.88%、24.43%和30.65%. 据报道,Ni和Cr含量的变化与成土母质、成土过程和地质活动密切相关[33]. 农田土壤中Cr、Cu和Ni均未超过一级评价标准,且含量较低,这表明Cr、Cu和Ni主要是受成土母质的影响,属于自然源. 而农田土壤中Pb和Zn的含量较高,且有研究表明铅锌矿影响区土壤中Pb、 Zn和Cu主要来自于矿山开采活动[34],故污染主要来源于周边的铅锌尾矿库. 故因子1是由自然源和尾矿库源的混合源.
因子2主要载荷元素包括Ni、Pb、Zn和Hg,其贡献率分别为35.66%、32.50%、33.35%和25.02%,变异系数分别为0.23、0.23、0.19和0.15,均属于中度变异,受人类活动影响较大. 有研究表明,铅锌矿区在开采和冶炼活动中所产生的三废中含有大量的Zn、Pb、Cd、As和Hg等元素[7],排放后通过大气降尘进入周围土壤,导致土壤污染. 经调查,农田研究区右侧是废弃工厂,工矿活动及矿渣堆存期间的扬尘会通过大气沉降在土壤中积累,受降雨等影响导致Ni、Pb、Zn和Hg的二次富集. 故因子2是工业降尘源.
因子3 主要载荷元素包括Pb、Cd、Zn和Cr,其贡献率分别为29.04%、24.61%、21.43%和21.64%. 汽车发动机、镀锌构件及轮胎等因机械摩擦、化学侵蚀引发的磨损与腐蚀,以及燃油燃烧或泄露和尾气排放等交通活动,都会将Cd、Pb和Zn元素释放到周边环境中[35,36]. 由因子1可知,Cr含量变化与成土过程显著相关,但研究区Cr的超标率96.97%,表明受到了人类活动的影响. 研究发现Cr还与金属零件和镀铬配件磨损有关[37]. 考虑研究区农田周围有交通运输道路及汽修厂,故因子3是交通源.
因子4主要载荷元素包括As、Cd 和Cu,其贡献率分别为29.60%、31.16%和25.43%,变异系数分别0.18、0.18和0.11,属于中度变异,受人类活动影响较大. 除草剂和杀虫剂的大量使用会造成As的大量积累,磷肥中含有的微量As也是土壤As的重要来源之一[38]. 农家肥中含有较多的Cu、Cd元素,农药、化肥长期投入到农用地中会导致重金属Cu、Cd元素的大量积累[39]. 故因子4是农业源.
因子5主要载荷元素包括As、Cd、Cr、Cu、Ni和Hg,其贡献率分别为21.62%、21.24%、35.42%、22.18%、18.30%和38.93%. Cd污染的主要来源包括汽油燃烧、农药和化肥、垃圾堆积、铅锌矿开采和冶炼等[40]. Cr、Cu、Ni主要受成土母质的影响,同时也有研究表明,农业投入品 (化肥、农药、有机肥等)中含有的Hg、As、Cu、Zn、Cd、Cr等元素易残留在土壤中,如磷肥中Cr含量在几十到几百mg·kg−1[8],As含量在20到50 mg·kg−1,施用不合理时,土壤中Cr、As这类元素含量会升高[39, 41]. 长期的尾矿库堆存、物料转运及加工等人为活动也会向周围环境释放Cd、Hg、As等元素[42],故因子5是由多种类型的活动组成的综合源.
2.3 农田土壤重金属特定源-综合生态风险评估
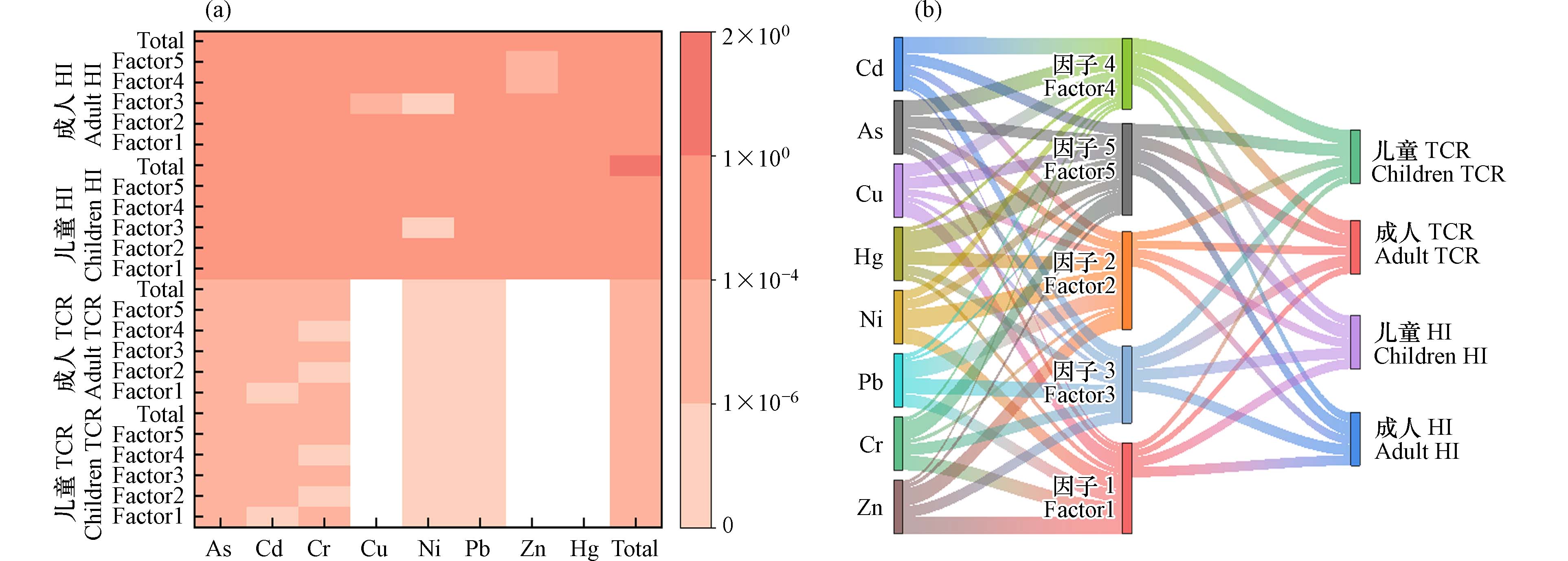
研究区农田土壤中重金属的
Eir NIRI Eir 2243.04 )>Cd(582.06)>Pb(15.08)>As(12.73)>Cu(3.77)>Ni(2.85)>Cr(2.82)>Zn(1.30). 除了属于极强生态风险的Hg和Cd元素之外,其余元素均属于轻微生态风险,说明造成研究区生态风险的首要污染元素为Hg和Cd. 这与陈希瑶等[43]人研究中国土壤重金属的生态风险结果一致,对土壤造成生态风险的主要元素是Hg和Cd. 此外,研究区农田土壤重金属的综合生态风险指数(NIRI 1673.76 —2921.86 ,平均值为2271.48 ,属于极强生态风险.表 5 农田土壤重金属潜在生态危害系数(Eir Table 5. Evaluation results of potential ecological hazard coefficients (Eir As Cd Cr Cu Ni Pb Zn Hg Eir 8.10 348.44 1.96 2.62 1.62 10.40 0.96 1651.74 Eir 21.31 853.45 3.86 4.90 4.15 24.63 2.01 2883.33 Eir 12.73 582.06 2.82 3.77 2.85 15.08 1.30 2243.04 NIRI 1673.76 — 2921.86 研究区特定源-综合生态风险的评价结果如图4所示,按其贡献率的高低对5 种污染源进行排序:因子5(综合源)(38.37%)> 因子2(工业降尘源)(24.67%)> 因子3(交通源)(17.62%)> 因子1(自然源和尾矿库源的混合源)(10.47%)> 因子4(农业源)(8.86%),表明综合源对农田研究区影响的贡献率最大. 由于Hg元素自身毒性很高,且在研究区土壤中,Hg为首要的生态危害元素,在因子5中贡献率达到了38.93%,导致因子5是对综合生态风险贡献最高的污染源. 本研究中对综合生态风险贡献最高的污染源与以工业降尘源为主要污染源的PMF源解析结果不一致. 这与李军等[21]对敦煌市主城区的土壤重金属的研究结果一致,Hg元素负荷高的工业降尘源虽然不是重金属的最高贡献源,但却是综合生态风险的最高贡献源. 这表明重金属贡献率高的污染源并不一定具有高生态风险.
2.4 农田土壤重金属特定源-人体健康风险评估
图5a 显示了针对特定来源的人体健康风险评估模型的结果. 对于非致癌风险,不同污染源对儿童总
HI HI HI HI HI TCR TCR 对于研究区农田土壤重金属、污染源与健康风险关系如图5b所示,就致癌风险而言,因子4(农业源)是导致成人和儿童致癌风险的首要污染源,贡献率分别为25.87%和26.92%. 其次是因子5(综合源),对成人的贡献率是23.77%,对儿童的贡献率是23.12%,污染因子以As为主,对成人的贡献率是51.79%,对儿童的贡献率是54.70%;对于非致癌风险而言,污染源贡献率的排列顺序:因子5(综合源)> 因子3(交通源)> 因子1(自然源和尾矿库源的混合源)> 因子4(农业源)> 因子2(工业降尘源). 因子5(综合源)是导致儿童非致癌风险的首要污染源,贡献率为25.17%,最主要的污染因子也是As元素,贡献率为43.57%. 这可能与As元素本身毒性有关,其有较低的RfD和较高的SF [46]. 这一结果不仅与杨杰等[47]研究鄂西某铜铅锌尾矿库周边农田土壤重金属风险评估的结果一致,还与张丽瑞等[48]研究甘肃省农田土壤潜在有毒元素污染的典型区域白阴市东大沟的健康风险评价结果一致,As元素是造成当地人群致癌风险影响的主要因子. 考虑到农业源和多种类型活动共同作用的综合源是造成研究区人体健康风险的主要因子,因而工业和农业等人类活动排放的重金属对人体存在健康风险,未来可通过提升工业废物排放标准,建立合适的管控机制以及减少农药和化肥用量等途径减少污染物进入环境的量,从而减少重金属对人体的危害 [45].
3. 结论(Conclusion)
1)研究区尾矿库和农田土壤中重金属含量均低于国家风险管制值,但尾矿库土壤中Pb有50.00%的样点超出国家风险筛选值,农田土壤中Cd、As和Hg分别有100%、3.03%和39.39%的样点超出国家风险筛选值. 总体而言,尾矿库土壤中重金属的污染程度较农田土壤明显偏高,其中尾矿库土壤以Hg、Pb、Zn和Cd污染为主,整体上属于中度污染水平,占比为100%;农田土壤以Hg和Cd污染为主,整体上属于轻度污染水平,占比为93.94%.
2)研究区农田土壤重金属分别受自然源及尾矿库源的混合源(贡献率为21.26%)、工业降尘源(贡献率为22.77%)、交通源(贡献率为17.91%)、农业源(贡献率为16.61%)和由多种类型活动组成的综合源(贡献率为 21.44%)的共同影响.
3)综合源对研究区生态风险贡献率为38.37%,为优先控制污染源,Hg为生态风险优先控制污染元素;农田重金属对成人不构成非致癌健康风险,但综合源是引起当地儿童非致癌风险的优先控制污染源,贡献率为25.17%,农业源是引起当地成人和儿童致癌风险的优先控制污染源,贡献率分别为25.87%和26.92%,健康风险的优先控制污染元素均为As.
-
图 2 4种羟基吡啶(a: 4-py, b: 3-py, c: 2-py, d: 2,6-dm-3-py,未经辐照、经365 nm和312 nm紫外线辐照2 h)对重组菌遗传毒性及氧化应激毒性通路相关基因表达谱的影响
Figure 2. Effects of 4 kinds of pyridine compounds (a: 4-py, b: 3-py, c: 2-py, d: 2,6-dm-3-py, unirradiated, irradiated for 2 h with 365 and 312 nm) on the expression of genes involved in genotoxicity and oxidative stress pathways in recombinant bacteria.
图 3 羟基吡啶化合物(a-d: DNA应激相关基因TELI值,其中a: 4-py, b: 3-py, c: 2-py, d: 2,6-dm-3-py,e-f: 氧化应激相关基因TELI值,其中e: 4-py, f: 3-py, g: 2-py, h: 2,6-dm-3-py,未经辐照、经365 nm和312 nm紫外线照射1h、2 h)基于TELI值的剂量响应曲线
Figure 3. Dose response curves(The TELI value of the blank control group during DNA stress was 19, and that of the blank control group during oxidative stress was 10) based on TELI values for 4 kinds of pyridine compounds
表 1 四种羟基吡啶样品
Table 1. Four hydroxypyridine samples
中文名称 Chinese name 英文名称 English name 简称 Abbreviation 分子式 Molecular formula CAS 4-羟基吡啶 4-pyridone 4-py C5H5NO 626-64-2 3-羟基吡啶 3-pyridone 3-py C5H5NO 109-00-2 2-羟基吡啶 2-pyridone 2-py C5H5NO 142-08-5 2,6-二甲基-3-羟基吡啶 2,6-Dimethyl-3-pyridone 2,6-dm-3-py C7H9NO 1122-43-6 表 2 所选重组大肠杆菌重组基因及其功能
Table 2. Endpoints and functions of genes selected by genotoxicity tests
基因通路 Gene pathways 基因 Genes 功能 Functions DNA应激 DNA stress uvrA 识别细胞内的损伤 recX 调控基因 dinG 超家族II解旋酶之一 ybfE DNA损伤耐受 sbmC 调节基因 ftsK 编码ATP酶 recN 维持染色体结构 yebG 受到lexA基因的调控 sulA 为受损DNA修复提供时间 polB 参与碱基切除修复 uvrD 超家族I DNA解旋酶 lexA 调控DNA修复和突变 DNA应激 DNA stress recA 调控DNA修复和突变 umuD 参与基因突变 ssb 参与定向错配修复 ada 参与DNA烷基化修复基因转录 mutT 参与碱基切除修复 dinB 编码DNA聚合酶 nfo 参与碱基切除修复 氧化还原应激 Redox stress soxS 活性氧传感器,编码抗氧化酶 soxR 活性氧传感器,编码抗氧化酶 oxyR 活性氧传感器,保护细胞 inaA 编码蛋白酶 dps 非特异性DNA结合蛋白 ahpF 调节烷基氢过氧化物还原酶 katG 消除过氧化氢 sodA 调控超氧化物歧化酶 ahpC 调节烷基氢过氧化物还原酶 katE 消除过氧化氢 -
[1] LAN J Q, GOU N, RAHMAN S M, et al. A quantitative toxicogenomics assay for high-throughput and mechanistic genotoxicity assessment and screening of environmental pollutants [J]. Environmental Science & Technology, 2016, 50(6): 3202-3214. [2] JONES K C. Persistent organic pollutants (POPs) and related chemicals in the global environment: Some personal reflections [J]. Environmental Science & Technology, 2021, 55(14): 9400-9412. [3] LIU Q F, LI L, ZHANG X M, et al. Uncovering global-scale risks from commercial chemicals in air [J]. Nature, 2021, 600(7889): 456-461. doi: 10.1038/s41586-021-04134-6 [4] ZHANG Y M, CHANG L, YAN N, et al. UV photolysis for accelerating pyridine biodegradation [J]. Environmental Science & Technology, 2014, 48(1): 649-655. [5] SUN J Q, XU L, TANG Y Q, et al. Bacterial pyridine hydroxylation is ubiquitous in environment [J]. Applied Microbiology and Biotechnology, 2014, 98(1): 455-464. doi: 10.1007/s00253-013-4818-9 [6] VASUDEVAN D, DORLEY P J, ZHUANG X. Adsorption of hydroxy pyridines and quinolines at the metal oxide-water interface: Role of tautomeric equilibrium [J]. Environmental Science & Technology, 2001, 35(10): 2006-2013. [7] JO Y W, BIN IM W, RHEE J K, et al. Synthesis and antibacterial activity of oxazolidinones containing pyridine substituted with heteroaromatic ring [J]. Bioorganic & Medicinal Chemistry, 2004, 12(22): 5909-5915. [8] CHU M J, SUN C Q, CHEN W H, et al. Personal exposure to PM2.5, genetic variants and DNA damage: A multi-center population-based study in Chinese [J]. Toxicology Letters, 2015, 235(3): 172-178. doi: 10.1016/j.toxlet.2015.04.007 [9] WONDRAK G T, ROBERTS M J, JACOBSON M K, et al. 3-hydroxypyridine chromophores are endogenous sensitizers of photooxidative stress in human skin cells [J]. Journal of Biological Chemistry, 2004, 279(29): 30009-30020. doi: 10.1074/jbc.M404379200 [10] GOU N, YUAN S H, LAN J Q, et al. A quantitative toxicogenomics assay reveals the evolution and nature of toxicity during the transformation of environmental pollutants [J]. Environmental Science & Technology, 2014, 48(15): 8855-8863. [11] GEURTSEN J, de BEEN M, WEERDENBURG E, et al. Genomics and pathotypes of the many faces of Escherichia coli [J]. FEMS Microbiology Reviews, 2022, 46(6): fuac031. doi: 10.1093/femsre/fuac031 [12] La FARRÉ M, PÉREZ S, KANTIANI L, et al. Fate and toxicity of emerging pollutants, their metabolites and transformation products in the aquatic environment [J]. TrAC Trends in Analytical Chemistry, 2008, 27(11): 991-1007. doi: 10.1016/j.trac.2008.09.010 [13] SOUAK D, BARREAU M, COURTOIS A, et al. Challenging cosmetic innovation: The skin microbiota and probiotics protect the skin from UV-induced damage [J]. Microorganisms, 2021, 9(5): 936. doi: 10.3390/microorganisms9050936 [14] PIPES B L, NISHIGUCHI M K. Nocturnal acidification: A coordinating cue in the Euprymna scolopes- Vibrio fischeri symbiosis [J]. International Journal of Molecular Sciences, 2022, 23(7): 3743. doi: 10.3390/ijms23073743 [15] STEPNIEWSKA K, CHOTIVANICH K, BROCKMAN A, et al. Overestimating resistance in field testing of malaria parasites: Simple methods for estimating high EC50 values using a Bayesian approach [J]. Malaria Journal, 2007, 6: 4. doi: 10.1186/1475-2875-6-4 [16] AGARWAL A, ALLAMANENI S S R. Sperm DNA damage assessment: A test whose time has come [J]. Fertility and Sterility, 2005, 84(4): 850-853. doi: 10.1016/j.fertnstert.2005.03.080 [17] JANG J, HUR H G, SADOWSKY M J, et al. Environmental Escherichia coli: Ecology and public health implications-a review [J]. Journal of Applied Microbiology, 2017, 123(3): 570-581. doi: 10.1111/jam.13468 [18] MOREB E A, HOOVER B, YASEEN A, et al. Managing the SOS response for enhanced CRISPR-cas-based recombineering in E. coli through transient inhibition of host RecA activity [J]. ACS Synthetic Biology, 2017, 6(12): 2209-2218. doi: 10.1021/acssynbio.7b00174 [19] REIFFERSCHEID G, BUCHINGER S. Cell-based genotoxicity testing: Genetically modified and genetically engineered bacteria in environmental genotoxicology [J]. Advances in Biochemical Engineering/Biotechnology, 2010, 118: 85-111. [20] GOU N, GU A Z. A new Transcriptional Effect Level Index (TELI) for toxicogenomics-based toxicity assessment [J]. Environmental Science & Technology, 2011, 45(12): 5410-5417. [21] PAPAGIANNAKI D, MEDANA C, BINETTI R, et al. Effect of UV-A, UV-B and UV-C irradiation of glyphosate on photolysis and mitigation of aquatic toxicity [J]. Scientific Reports, 2020, 10: 20247. doi: 10.1038/s41598-020-76241-9 [22] SKOUTELIS C G, VLASTOS D, KORTSINIDOU M C, et al. Induction of micronuclei by 2-hydroxypyridine in water and elimination of solution genotoxicity by UVC (254 nm) photolysis [J]. Journal of Hazardous Materials, 2011, 197: 137-143. doi: 10.1016/j.jhazmat.2011.09.065 [23] STAPLETON D R, KONSTANTINOU I K, KARAKITSOU A, et al. 2-Hydroxypyridine photolytic degradation by 254 nm UV irradiation at different conditions [J]. Chemosphere, 2009, 77(8): 1099-1105. doi: 10.1016/j.chemosphere.2009.08.026 [24] NORTH M, TANDON V J, THOMAS R, et al. Genome-wide functional profiling reveals genes required for tolerance to benzene metabolites in yeast [J]. PLoS One, 2011, 6(8): e24205. doi: 10.1371/journal.pone.0024205 [25] MO C Y, CULYBA M J, SELWOOD T, et al. Inhibitors of LexA autoproteolysis and the bacterial SOS response discovered by an academic-industry partnership [J]. ACS Infectious Diseases, 2018, 4(3): 349-359. doi: 10.1021/acsinfecdis.7b00122 [26] SCHLACHER K, PHAM P, COX M M, et al. Roles of DNA polymerase V and RecA protein in SOS damage-induced mutation [J]. Chemical Reviews, 2006, 106(2): 406-419. doi: 10.1021/cr0404951 [27] REN B B, DUAN X W, DING H G. Redox control of the DNA damage-inducible protein DinG helicase activity via its iron-sulfur cluster [J]. Journal of Biological Chemistry, 2009, 284(8): 4829-4835. doi: 10.1074/jbc.M807943200 [28] UCHIDA K, FURUKOHRI A, SHINOZAKI Y, et al. Overproduction of Escherichia coli DNA polymerase DinB (Pol IV) inhibits replication fork progression and is lethal [J]. Molecular Microbiology, 2008, 70(3): 608-622. doi: 10.1111/j.1365-2958.2008.06423.x [29] CUBEDDU L, WHITE M F. DNA damage detection by an archaeal single-stranded DNA-binding protein [J]. Journal of Molecular Biology, 2005, 353(3): 507-516. doi: 10.1016/j.jmb.2005.08.050 [30] LU D, WINDSOR M A, GELLMAN S H, et al. Peptide inhibitors identify roles for SSB C-terminal residues in SSB/exonuclease I complex formation [J]. Biochemistry, 2009, 48(29): 6764-6771. doi: 10.1021/bi900361r [31] KESELER I M, COLLADO-VIDES J, SANTOS-ZAVALETA A, et al. EcoCyc: A comprehensive database of Escherichia coli biology [J]. Nucleic Acids Research, 2011, 39(Suppl_1): D583-D590. [32] CHRISTMAN M F, STORZ G, AMES B N. OxyR, a positive regulator of hydrogen peroxide-inducible genes in Escherichia coli and Salmonella typhimurium, is homologous to a family of bacterial regulatory proteins [J]. Proceedings of the National Academy of Sciences of the United States of America, 1989, 86(10): 3484-3488. doi: 10.1073/pnas.86.10.3484 [33] OCHSNER U A, VASIL M L, ALSABBAGH E, et al. Role of the Pseudomonas aeruginosa oxyR-recG operon in oxidative stress defense and DNA repair: OxyR-dependent regulation of katB-ankB, ahpB, and ahpC-ahpF [J]. Journal of Bacteriology, 2000, 182(16): 4533-4544. doi: 10.1128/JB.182.16.4533-4544.2000 [34] KAKU N, HIBINO T, TANAKA Y, et al. Effects of overexpression of Escherichia coli katE and bet genes on the tolerance for salt stress in a freshwater Cyanobacterium Synechococcus sp. PCC 7942 [J]. Plant Science, 2000, 159(2): 281-288. doi: 10.1016/S0168-9452(00)00353-8 [35] KARIMOV I F, DERYABIN D G, KARIMOVA D N, et al. Evaluation of oxidative metabolism in leukocytes during phagocytosis of Escherichia coli carrying genetic constructs soxS: Lux or katG: Lux [J]. Bulletin of Experimental Biology and Medicine, 2016, 161(2): 276-280. doi: 10.1007/s10517-016-3394-2 [36] ZHANG M M, QIN Y X, HUANG L X, et al. The role of sodA and sodB in Aeromonas hydrophila resisting oxidative damage to survive in fish macrophages and escape for further infection [J]. Fish & Shellfish Immunology, 2019, 88: 489-495. [37] LEE S, MITCHELL R J. Detection of toxic lignin hydrolysate-related compounds using an inaA: LuxCDABE fusion strain [J]. Journal of Biotechnology, 2012, 157(4): 598-604. doi: 10.1016/j.jbiotec.2011.06.018 期刊类型引用(5)
1. 邓威,翟健梁,赖淏,陆福洋,宗有杰,熊锐,关博文,常明丰. 微生物-碳化改性钢渣及其对水泥水化特性影响研究进展. 复合材料学报. 2025(01): 119-132 .  百度学术
百度学术
2. 王鹏伟,樊恒辉,任冠洲,谢非含,张星宇,霍江茹. 碳酸酐酶对仿岩溶碳酸氢钙生成速率的影响及其作用机理. 水利与建筑工程学报. 2025(01): 118-124+199 .  百度学术
百度学术
3. 王玉杰,张艳梅,栾金义,赵之平. 酶催化固碳过程及其强化技术研究进展. 化工进展. 2024(01): 232-245 .  百度学术
百度学术
4. 谢昕,王春辉,于荣珍,徐恒,周昊,孙志明,王建兵. CO_2干式生物甲烷化试验研究. 能源环境保护. 2024(03): 109-116 .  百度学术
百度学术
5. 刘鹏,曹源兴,程钰,白云波. 碳酸酐酶增强微生物矿化固土效果的试验研究. 岩土力学. 2024(09): 2554-2564 .  百度学术
百度学术
其他类型引用(0)
-






 下载:
下载: