-
制定水质标准的科学依据是水质基准[1],但目前的研究中,很少有针对我国水域的水质基准研究报道[2],我国现行水质标准的确定主要是依据国外的水质基准数值[3-4],但不同的生物区系与水质状况各不相同,这会导致水质基准产生明显差异[5-6]. 因此,基于我国水环境管理的迫切需求,应依据我国国情开展水质基准研究[7].
荧蒽(fluoranthene,FLU),是多环芳烃中4环芳烃的代表性化合物[8],也是水体中多环芳烃污染物的一个主要成分[9]. 然而,目前我国尚缺乏有关本土水生生物荧蒽的生态毒性数据,因此通过实验开展荧蒽的水生生物基准阈值研究工作,获得有关数据是十分必要的,同时对荧蒽在我国的水生生物基准的建立以及水环境相关工作等具有一定的现实意义与科学意义. 本研究进行了急性与慢性毒理学试验,参考美国的水质基准“指南”要求(“三门八科”最低毒性数据),以及对我国淡水生物区系特征和影响因素等具体分析,最终选取了符合物种筛选规定的9种具有典型代表性的中国本土水生生物进行试验. 根据实验结果得出荧蒽本土水生生物基准阈值,同时,本文分析比较了本土物种与美国物种毒性敏感度是否一致,其中美国物种毒性敏感度基于美国水生生物毒性数据,分析结果可表明在进行我国本土水生生物基准研究时,是否可以直接采用非本土水生生物毒性数据.
-
一般来说,复杂水生态系统的功能、基本结构特征可通过鱼类、底栖动物、浮游生物和植物所表征[10-11]. 在推导我国水质基准时,试验生物的确定可依据美国水质基准“指南”中的规定,即“三门八科”最低毒性数据要求,同时参考《中国脊椎动物大全》[12]和《中国生物多样性国情研究报告》[13]等文献资料,试验生物必须包括鲤科鱼类;另外鉴于我国鲤科种类丰富、数量庞大[14],因此本文选用两种鲤科鱼. 如上所述,物种选择应具体分析中国淡水生物群的特点,同时根据源自欧盟和美国水质基准的物种选择原则,本次荧蒽基准研究初步选择了9个本地水生生物物种作为受试物种,它们分别是锦鲤、麦穗鱼、泥鳅、泽蛙蝌蚪,大型溞、青虾、摇蚊幼虫,霍甫水丝蚓,水螅属. 其中锦鲤和麦穗鱼为脊索动物门鲤科,其余依次为鳅科、蛙科、节肢动物门溞科、虾科、摇蚊科、环节动物门颤蚓科和腔肠动物门水螅虫科,共“四门八科”. 另外对照毒性数据筛选原则[15],本研究在搜集荧蒽的水生植物毒性数据数据的过程中,发现所得结果很少能够满足上述筛选原则.
在“朝来春及大森林水产市场”购入试验所需的9种本土水生动物(既包括淡水,也包括海水),正式试验前均在实验室驯养至少7 d;在中国环境科学研究院环境基准与风险评估国家重点实验室可获得试验所需的大型溞(Daphnia magna),其龄期在24 h之内[15]. 水生生物培养条件为:pH 8.0±0.2,DO (8.3±0.3) mg·L−1,温度(22±2)℃,试验类型采用换水式,每24 h进行一次换水,急性试验不喂食,慢性试验按照0.1%生物重量一天喂食2次;溞类光照周期为12 h:12 h.
在筛选受试物种时,不同种类的受试生物对其龄期有着不同的要求,其中对于水溞或其他水溞类动物要求为24 h内,蚊类,要求为第二代、三代幼虫,对于鱼类或其他物种,要求为至少先于性腺发育前60 d的幼龄阶段生物[15].
在“美国Sigma Aldrich化学品公司”购入实验所用荧蒽,其化学式为C16H10,纯度≥98%(HPLC)为色谱纯;其他试剂均为分析纯. 为了确保浓度配置的准确性,在第一次实验之前,通过中国计量学院校准了用于制备蒽溶液的移液枪,对每个浓度组进行了气相色谱测试. 为了避免试验过程中的任何干扰,实验者严格遵循操作规范,在气相色谱分析之前,所有未使用的玻璃器皿都用高价的酸溶液进行冲洗. 在3组空白实验中加入内标荧蒽-d10,96 h后测定其回收率,结果显示,荧蒽-d10的回收率为74.3%—89.6%. US EPA[15]公布的回收率为70%—130%,试验结果满足其要求,证明了本实验结果的可靠性和准确性.
-
根据美国材料与试验协会[16]标准方法[17-18]进行急性实验,设空白对照组、助溶剂(二甲基亚砜, DMSO)对照组、浓度组,每组3个重复. 急性实验的时间设置为:溞类48 h,其余水生生物96 h. 具体实验信息如表1所示.
在急性毒性实验结束后,参考荧蒽对麦穗、泥鳅和大型溞的急性实验结果开展慢性实验,设空白对照组、助溶剂(二甲基亚砜, DMSO)对照组、浓度组,每组3个重复. 慢性实验的组次中,其最高浓度不得高于急性毒性LC50值. 受试液和喂食的频率为1 d,采用静态更新试液法. 慢性毒理学实验时间设置为:溞类不得少于21 d,麦穗、泥鳅不得少于8 d. 具体实验浓度设置如下:麦穗为0.00、0.42、0.55、0.72、0.94、1.22、1.59 mg·L−1 FLU;泥鳅为0.00、0.35、0.46、0.60、0.78、1.01、1.32 mg·L−1 FLU;大型溞为0.00、0.42、0.55、0.72、0.94、1.22、1.59 mg·L−1 FLU. 试验中需要记录的内容如下:大型溞的产卵数量、时间(第一窝及总数)、麦穗和泥鳅的生长指标(体重、体长等),以上数据每天记录一次.
-
数据选自ELSEVIER数据库(http://www.sciencedirect.com)、US EPA ECOTOX 毒性数据库(http://cfpub.epa.gov/ecotox/)、和CNKI数据库(http://www.cnki.net)等. 在进行筛选数据时应满足以下要求:①数据无法使用的情况有:使用受权限、信息保密、测试信息不完全、由于其他因素而无法传播、试验缺少对照组、试验生物受污染、试验设计不科学等;②可以使用具有不稳定性质(易挥发、易水解、易降解)的物质进行试验,但一般仅可采用流水式试验的结果;③若慢性NOEC和LOEC值均出现在测试终点中,NOEC值的选取具有优先权[19]. 另外,对于水生植物,前人研究发现FLU对淡水藻[20](Scenedesmus subspicatus)的96-h EC50为7.447 mg·L−1,本文选用此数据.
另外,实验数据的正态分布检验方法有如下两种:K-S检验、T检验. 本文选用前者检验表2中数据是否符合正态分布,检验结果表明美国水生生物毒性数据对FLU毒性敏感的总体分布情况是大致吻合的,符合正态分布(P =0.08>0.05).
EC/LCx可通过概率单位直线回归法和95%置信区间来计算,按照测试标准所规定的浓度规定,若实测浓度与名义浓度的差值在20%以内,即可采用名义浓度,x值分别取50(急性毒性实验)和10(慢性毒性实验),通过在试验开始的前后,对溶液中的FLU浓度进行检测,对比检测结果后计算实测和名义浓度的比率,结果为90.03%—99.15%,满足要求[21],因此本文在计算EC/LCx时,浓度采用名义浓度.
-
表3显示了9种本土水生生物的急性毒性试验结果,其中空白对照组和助溶剂对照组在试验期间中没有出现死亡现象. 窗体顶端结果表明泥鳅对FLU暴露最为敏感,其96-h LC50为1.887 mg·L−1, 其次是水螅属、青虾、麦穗鱼、大型溞、锦鲤、霍甫水丝蚓和摇蚊幼虫,对FLU最不敏感的是泽蛙蝌蚪,其96-h LC50为8.695 mg·L−1.
-
在慢性毒性实验中各试验浓度组均未出现死亡现象. 对于慢性毒性数据(表4),Barata等[22]研究表明大型溞的存活率21-d NOEC为0.937 mg·L−1,这一结果与本试验中大型溞总繁殖数量的21-d EC10为0.881 mg·L−1十分接近. 根据表4,对于大型溞,对FLU暴露的产卵总数量试验终点相比于其存活率,表现出更为敏感的趋势. 在慢性毒性试验中,3种水生生物中对FLU暴露的敏感性最低的为大型溞,最高的为泥鳅. 结果表明泥鳅在急性与慢性实验中,对FLU暴露都表现出最高的敏感性.
-
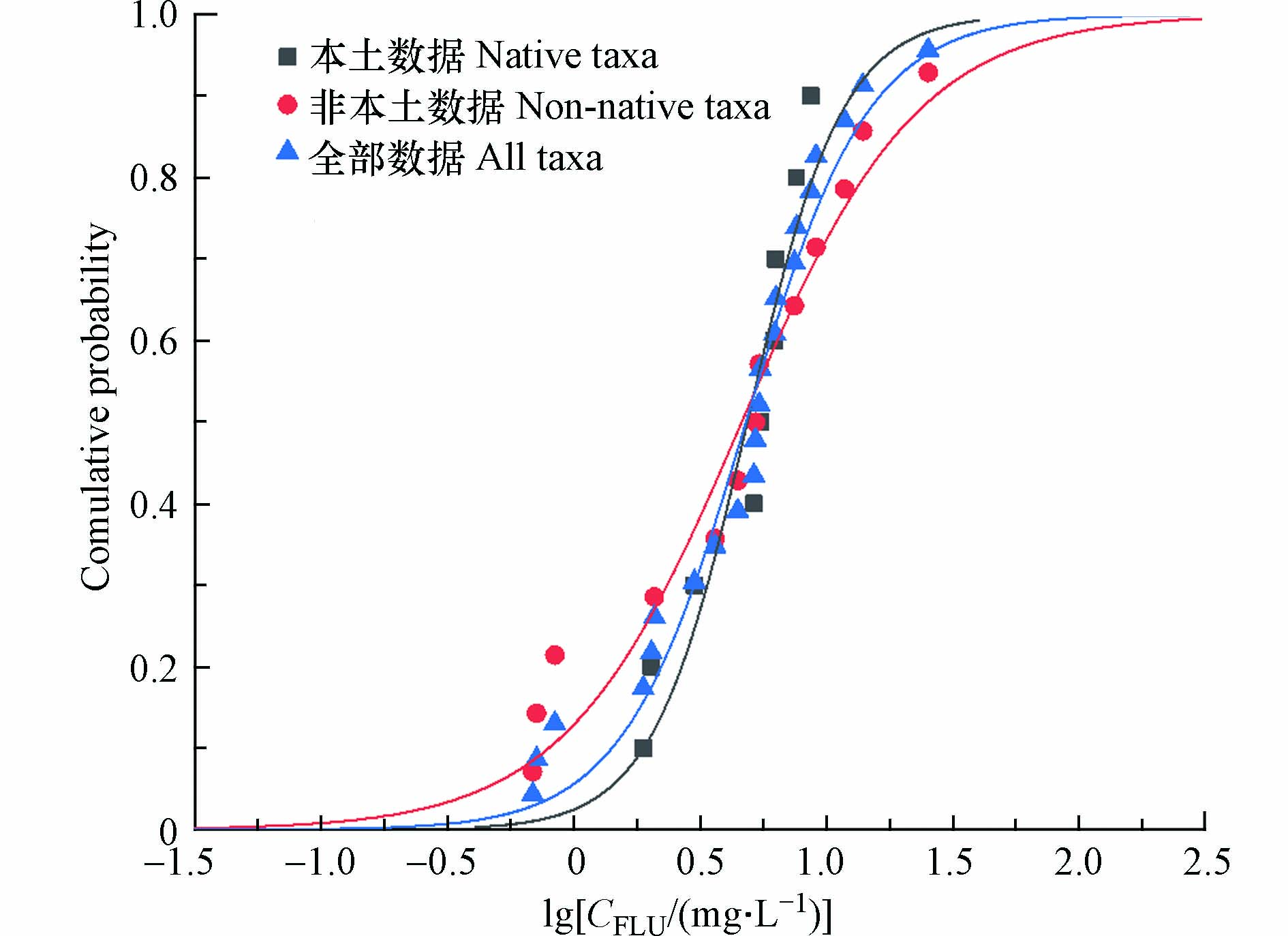
Davies等提出“灵活使用毒性数据”的设想[23],即在某一地区进行生态风险评估时,可使用其他地区的生物毒性数据. 但由于不同地区的水中溶解氧浓度、水温差别较大,且不同种类生物对于相同有害物质的敏感程度也各不相同[24],因此这一设想在提出后受到多方面质疑. 本研究将本地(表2)和美国(表3)的生物毒性数据进行SSD曲线拟合,并进行比较讨论,探讨 "灵活使用毒性数据 "这一概念的可行性. 受限于相对缺少慢性数据,本研究仅采用急性毒性数据. 本研究以本土、美国、本土+美国的FLU毒性数据为基础,共得出3条SSD拟合曲线(图1). 在对FLU暴露的敏感性方面,图中本土数据(黑)、总体数据(蓝)与美国数据(红)从左到右存在显著的位移分布,意味着美国生物比本土生物表现出更加敏感的趋势. 经过计算,总体数据、本土数据及非本土数据三条曲线的HC5值分别是1.527、1.869、2.142 mg·L−1.
Two-sample Kolmogorov-Smirnov(K-S test)检验常用于数学统计中,可用于对两样本总体分布差异性的检验[24]. 利用此方法,研究美国毒性数据和本土毒性数据是否存在较为明显的不同具有十分重要的学术和科学意义:若二者差异明显,则在本土进行相关的基准阈值研究时,应选取本土水生生物;若二者较为一致,那么证明美国水生生物毒性数据可用于本土基准阈值的推导过程,从而降低受试生物的消耗以及节省资源的投入. K-S结果如下:(ks = 1.342, n1 = 9, n2 = 13, P = 0.01). P= 0.0114<0.05,按a=0.05水准,结果表明两组数据在FLU毒性敏感的总体分布上并为呈现较高的一致性,两组数据之间存在的差异十分显著(图1). 另外,由于浮游类不被包含在非本土生物毒性数据中,因此在本土生物数据中浮游类大型溞的毒性数据暂时去除之后,对数据再次进行K-S检验,两者之间仍然存在较为显著的差异(ks= 0.830, n1 = 8, n2= 13, P = 0.0183). 因此我们可以初步判断本土对FLU的敏感性与非本土生物有着较大差别,需要进一步开展针对本土化的相关研究工作(图1).
-
以实测数据为基础,在计算FLU水生生物基准阈值时,本文采用了USEPA“指南”推荐的SSR方法[15],9种本土物种的SMAV值和GMAV值及其排序如表5所示,CMC(FLU的急性基准阈值)=FAV/评价因子,其中FAV取1.141 mg·L−1,评价因子通常取值为2,最后计算出我国FLU的急性基准阈值结果为0.570 mg·L-1[25-26]. 鉴于我国FLU慢性毒性数据较少,FCV值可通过“指南”所推荐的方法计算,即FCV=FAV/FACR,FACR的值是3种水生生物SACR的几何平均值(如表所示,3种水生生物的SAVR值分别为:大型溞6.23、麦穗6.49、泥鳅7.01),最终计算得出FACR值为6.57,FCV值为0.174 mg·L−1,已知淡水藻的FLU植物毒性值为7.447 mg·L−1,远远大于计算所得的FCV值,因此对植物的保护作用得到验证[27]. CCC的确定按“指南”所指出的方法,即由FPV、FCV和FRV三者中最小的值所确定[28]. 相比于动物,植物的敏感性要低得多,且我国缺少相应的BCF和MPC值,因而CCC可直接通过FCV值计算,在很多情况下FRV则不被考虑,最后计算出我国FLU的慢性基准阈值CCC为0.174 mg·L−1.
另外,本文也对比了FLU对美国水生生物的毒性. 例如,本研究中本土代表性鱼类敏感性相对较高,泥鳅、麦穗鱼和锦鲤的96-h LC50分别为1.887、5.177、6.251 mg·L−1 FLU,而作为非本土鱼类的蓝鳃太阳鱼[29]、斑点叉尾鮰[30]、虹鳟[31]和呆头鲦鱼[32]的96-h LC50分别为20.90、36.00、91.00、118.3 mg·L−1 FLU,数值不在一个数量级,本土鱼类更加敏感;已经报道的非本土两栖类动物非洲爪蟾[33]的96-h LC50为52.00 mg·L−1FLU,远远高于本土两栖类泽蛙蝌蚪的实测值(8.695 mg·L−1 FLU);本土底栖动物节肢动物门的摇蚊幼虫96-h LC50为7.628 mg·L−1 FLU,而已报道的非本土昆虫类生物是端足虫[30]和伸展摇蚊[34],96-h LC50分别为44.00 mg·L−1和250.00 mg·L−1 FLU,差异较为明显,本土节肢动物门相对敏感. 综上所述,可以确定本土水生生物中鱼类、两栖类对FLU和底栖节肢动物门比非本土同类生物更加敏感.
本土底栖动物中环节动物门受试生物为霍甫水丝蚓,96-h LC50为6.313 mg·L−1 FLU,非本土浅绛单孔蚓[30]96-h LC50为0.700 mg·L−1 FLU,此外还有底栖甲壳类生物差异较大,本土青虾96-h LC50为3.011 mg·L−1FLU,而非本土底栖甲壳类动物美洲海螯虾[35]和俄勒冈虾[35]96-h LC50相对较低,为0.600 mg·L−1及0.800 mg·L−1 FLU. 因此可以确定非本土水生生物中底栖环节动物及甲壳类动物对FLU比本土生物更加敏感.
另外,借助荷兰RIVM公布的ETX2.0软件及逻辑斯蒂SSD曲线求出HC5值,分别是1.657 mg·L−1和1.869 mg·L−1. 因此当评价因子取值为2时,CMC在这两种SSD曲线下,计算的结果分别为0.829 mg·L−1和0.935 mg·L−1,上文采用US EPA“指南”中推荐的SSR法计算的CMC值为0.570 mg·L−1,由此可见,计算结果都同在一个数量级.
-
(1) 基于US EPA“指南”推荐的方法,荧蒽本土水生生物急性基准阈值(CMC)为0.570 mg·L−1,慢性基准阈值(CCC)为0.174 mg·L−1;另外,通过荷兰RIVM公布的ETX2.0软件及欧盟推荐的SSD方法所得的基准阈值与本文所得结果(SSR方法得出)在数量级上一致,本文结果得到验证.
(2) 在敏感性方面,通过比较分析本土与美国物种的一致性较低,说明在进行我国荧蒽水生生物基准阈值的推导时,可利用美国水生生物毒性数据的概率很小.
致谢:感谢中国环境科学研究院刘征涛研究员在文章修改中给予的帮助.
中国本土水生生物荧蒽水质基准研究
Development of native aquatic life water quality criteria for fluoranthene in China
-
摘要: 荧蒽是一种对水生生物有害的优控多环芳烃,在国内外水体中广泛存在. 然而,在目前关于荧蒽的科学研究中,其基准阈值报告较为少见,由于本土物种生态毒理学数据对荧蒽基准阈值的研究分析尤为重要,数据的缺失成为阻碍其发展的主要原因. 本文通过开展急性生态毒理学和慢性生态毒理学实验,并利用US EPA“指南”推荐的方法,推导了荧蒽的基准阈值,其中急性实验对象为9种本土水生生物,慢性实验为3种. 推导结果表明:荧蒽本土水生生物急性基准阈值(CMC)为0.570 mg·L−1,慢性基准阈值(CCC)为0.174 mg·L−1;另外,鉴于本土和非本土物种之间的巨大差别,文章中采用了SSD(species sensitivity distribution),即物种敏感性分布法,根据对二者敏感度分布的分析结果,可以发现本土与美国物种在敏感性分布上一致性较低,这也表明在推导我国荧蒽水生生物基准阈值时,可直接利用美国水生生物毒性数据的可能性很小.Abstract: Fluoranthene (FLU) is a priority polycyclic aromatic hydrocarbon (PAH) which is toxic to aquatic organisms. However, there has been no paper dealing with water quality criteria (WQC) of FLU due to the shortage of its toxicity data of different taxonomic levels. In the present study, toxicity data were obtained from 9 acute toxicity tests and 3 chronic toxicity tests using 9 Chinese native aquatic species from different taxonomic levels. Based on these toxicity data, the criterion maximum concentration and criterion continuous concentration were developed according to US EPA guidelines, and the values were 0.570 mg·L−1 and 0.174 mg·L−1, respectively. Furthermore, the comparison of the differences of species sensitivity distributions (SSD) between native and non-native species shows significant difference in the sensitivity distribution between native and non-native species, which indicated that using toxicity data of American species directly to derive the water quality criteria of FLU was impossible.
-
制定水质标准的科学依据是水质基准[1],但目前的研究中,很少有针对我国水域的水质基准研究报道[2],我国现行水质标准的确定主要是依据国外的水质基准数值[3-4],但不同的生物区系与水质状况各不相同,这会导致水质基准产生明显差异[5-6]. 因此,基于我国水环境管理的迫切需求,应依据我国国情开展水质基准研究[7].
荧蒽(fluoranthene,FLU),是多环芳烃中4环芳烃的代表性化合物[8],也是水体中多环芳烃污染物的一个主要成分[9]. 然而,目前我国尚缺乏有关本土水生生物荧蒽的生态毒性数据,因此通过实验开展荧蒽的水生生物基准阈值研究工作,获得有关数据是十分必要的,同时对荧蒽在我国的水生生物基准的建立以及水环境相关工作等具有一定的现实意义与科学意义. 本研究进行了急性与慢性毒理学试验,参考美国的水质基准“指南”要求(“三门八科”最低毒性数据),以及对我国淡水生物区系特征和影响因素等具体分析,最终选取了符合物种筛选规定的9种具有典型代表性的中国本土水生生物进行试验. 根据实验结果得出荧蒽本土水生生物基准阈值,同时,本文分析比较了本土物种与美国物种毒性敏感度是否一致,其中美国物种毒性敏感度基于美国水生生物毒性数据,分析结果可表明在进行我国本土水生生物基准研究时,是否可以直接采用非本土水生生物毒性数据.
1. 材料与方法(Materials and methods)
1.1 实验材料
一般来说,复杂水生态系统的功能、基本结构特征可通过鱼类、底栖动物、浮游生物和植物所表征[10-11]. 在推导我国水质基准时,试验生物的确定可依据美国水质基准“指南”中的规定,即“三门八科”最低毒性数据要求,同时参考《中国脊椎动物大全》[12]和《中国生物多样性国情研究报告》[13]等文献资料,试验生物必须包括鲤科鱼类;另外鉴于我国鲤科种类丰富、数量庞大[14],因此本文选用两种鲤科鱼. 如上所述,物种选择应具体分析中国淡水生物群的特点,同时根据源自欧盟和美国水质基准的物种选择原则,本次荧蒽基准研究初步选择了9个本地水生生物物种作为受试物种,它们分别是锦鲤、麦穗鱼、泥鳅、泽蛙蝌蚪,大型溞、青虾、摇蚊幼虫,霍甫水丝蚓,水螅属. 其中锦鲤和麦穗鱼为脊索动物门鲤科,其余依次为鳅科、蛙科、节肢动物门溞科、虾科、摇蚊科、环节动物门颤蚓科和腔肠动物门水螅虫科,共“四门八科”. 另外对照毒性数据筛选原则[15],本研究在搜集荧蒽的水生植物毒性数据数据的过程中,发现所得结果很少能够满足上述筛选原则.
在“朝来春及大森林水产市场”购入试验所需的9种本土水生动物(既包括淡水,也包括海水),正式试验前均在实验室驯养至少7 d;在中国环境科学研究院环境基准与风险评估国家重点实验室可获得试验所需的大型溞(Daphnia magna),其龄期在24 h之内[15]. 水生生物培养条件为:pH 8.0±0.2,DO (8.3±0.3) mg·L−1,温度(22±2)℃,试验类型采用换水式,每24 h进行一次换水,急性试验不喂食,慢性试验按照0.1%生物重量一天喂食2次;溞类光照周期为12 h:12 h.
在筛选受试物种时,不同种类的受试生物对其龄期有着不同的要求,其中对于水溞或其他水溞类动物要求为24 h内,蚊类,要求为第二代、三代幼虫,对于鱼类或其他物种,要求为至少先于性腺发育前60 d的幼龄阶段生物[15].
在“美国Sigma Aldrich化学品公司”购入实验所用荧蒽,其化学式为C16H10,纯度≥98%(HPLC)为色谱纯;其他试剂均为分析纯. 为了确保浓度配置的准确性,在第一次实验之前,通过中国计量学院校准了用于制备蒽溶液的移液枪,对每个浓度组进行了气相色谱测试. 为了避免试验过程中的任何干扰,实验者严格遵循操作规范,在气相色谱分析之前,所有未使用的玻璃器皿都用高价的酸溶液进行冲洗. 在3组空白实验中加入内标荧蒽-d10,96 h后测定其回收率,结果显示,荧蒽-d10的回收率为74.3%—89.6%. US EPA[15]公布的回收率为70%—130%,试验结果满足其要求,证明了本实验结果的可靠性和准确性.
1.2 实验方法
根据美国材料与试验协会[16]标准方法[17-18]进行急性实验,设空白对照组、助溶剂(二甲基亚砜, DMSO)对照组、浓度组,每组3个重复. 急性实验的时间设置为:溞类48 h,其余水生生物96 h. 具体实验信息如表1所示.
表 1 FLU 9种本土水生生物急性毒性实验信息Table 1. Acute toxicity tests information of FLU to nine resident aquatic organisms分类Classification 生物科Families 物种Species 生长阶段Growth phase 体重/gWeight 体长/cmLength 实验时间/hTime 浓度设置/ (mg·L−1)Concentration 脊索动物门 鲤科 锦鲤(Rhodens sinensis) 幼龄期(<30 d) 0.25 ± 0.05 3.0 ± 0.5 96 0.00, 2.40, 3.10, 4.00, 5.20, 6.80, 8.80, 11.40 麦穗(Pseudorasbora parva) 幼龄期(<30 d) 0.25 ± 0.02 2.5 ± 0.2 96 0.00, 2.40, 3.10, 4.00, 5.20, 6.80, 8.80, 11.40 鳅科 泥鳅(Misgurnus anguillicaudatus) 幼龄期(<30 d) 0.70 ± 0.05 6.0 ± 0.5 96 0.00, 0.96, 1.16, 1.39, 1.67, 2.00, 2.40, 2.88 蛙科 泽蛙蝌蚪(Rana limnocharis) 幼龄期(<10 d) 0.20 ± 0.02 1.6 ± 0.2 96 0.00, 3.50, 4.60, 5.50, 7.80, 10.10, 13.20, 17.10 节肢动物门 溞科 大型溞(Daphnia magna) <24 h — — 48 0.00, 2.70, 3.60, 4.70, 6.20, 8.00, 10.40, 13.50 虾科 青虾(Macrobrachium nipponense) 幼龄期(<10 d) 0.25 ± 0.05 3.0 ± 0.2 96 0.00, 2.40, 3.10, 4.00, 5.20, 6.80, 8.80, 11.40 摇蚊科 摇蚊幼虫(Chironomus plumosus) 第3代(幼虫) 0.03 ± 0.01 1.0 ± 0.2 96 0.00, 2.70, 3.60, 4.70, 6.20, 8.00, 10.40, 13.50 环节动物门 颤蚓科 霍甫水丝蚓(Limnodrilus hoffmeisteri) 幼龄期(<10 d) 0.05 ± 0.01 1.5 ± 0.2 96 0.00, 3.40, 4.40, 5.70, 7.40, 9.60, 12.50, 16.20 腔肠动物门 水螅虫科 水螅属(Hydra sp.) 幼龄期(<10 d) 0.03 ± 0.01 1.0 ± 0.2 96 0.00, 1.39, 1.67, 2.00, 2.40, 2.88, 3.74, 4.87 在急性毒性实验结束后,参考荧蒽对麦穗、泥鳅和大型溞的急性实验结果开展慢性实验,设空白对照组、助溶剂(二甲基亚砜, DMSO)对照组、浓度组,每组3个重复. 慢性实验的组次中,其最高浓度不得高于急性毒性LC50值. 受试液和喂食的频率为1 d,采用静态更新试液法. 慢性毒理学实验时间设置为:溞类不得少于21 d,麦穗、泥鳅不得少于8 d. 具体实验浓度设置如下:麦穗为0.00、0.42、0.55、0.72、0.94、1.22、1.59 mg·L−1 FLU;泥鳅为0.00、0.35、0.46、0.60、0.78、1.01、1.32 mg·L−1 FLU;大型溞为0.00、0.42、0.55、0.72、0.94、1.22、1.59 mg·L−1 FLU. 试验中需要记录的内容如下:大型溞的产卵数量、时间(第一窝及总数)、麦穗和泥鳅的生长指标(体重、体长等),以上数据每天记录一次.
1.3 数据搜集与分析
数据选自ELSEVIER数据库(http://www.sciencedirect.com)、US EPA ECOTOX 毒性数据库(http://cfpub.epa.gov/ecotox/)、和CNKI数据库(http://www.cnki.net)等. 在进行筛选数据时应满足以下要求:①数据无法使用的情况有:使用受权限、信息保密、测试信息不完全、由于其他因素而无法传播、试验缺少对照组、试验生物受污染、试验设计不科学等;②可以使用具有不稳定性质(易挥发、易水解、易降解)的物质进行试验,但一般仅可采用流水式试验的结果;③若慢性NOEC和LOEC值均出现在测试终点中,NOEC值的选取具有优先权[19]. 另外,对于水生植物,前人研究发现FLU对淡水藻[20](Scenedesmus subspicatus)的96-h EC50为7.447 mg·L−1,本文选用此数据.
另外,实验数据的正态分布检验方法有如下两种:K-S检验、T检验. 本文选用前者检验表2中数据是否符合正态分布,检验结果表明美国水生生物毒性数据对FLU毒性敏感的总体分布情况是大致吻合的,符合正态分布(P =0.08>0.05).
表 2 FLU美国水生生物急性毒性数据Table 2. Acute toxicity data of FLU to American aquatic organisms排序 Rank 物种 Species (LC50/EC50)/(mg·L−1) t/h 1 美洲海螯虾 0.6 96 2 浅绛单孔蚓 0.7 96 3 俄勒冈虾 0.8 96 4 蓝鳃太阳鱼 20.9 96 5 斑点叉尾鮰 36.0 96 6 端足虫 44.0 96 7 非洲爪蟾 52.0 96 8 隐居蜾嬴蜚 54.0 96 9 沙蟹 74.0 96 10 虹鳟 91.0 96 11 呆头鲦鱼 118.3 96 12 宽纹北箭蜓 139.9 96 13 伸展摇蚊 250.0 96 EC/LCx可通过概率单位直线回归法和95%置信区间来计算,按照测试标准所规定的浓度规定,若实测浓度与名义浓度的差值在20%以内,即可采用名义浓度,x值分别取50(急性毒性实验)和10(慢性毒性实验),通过在试验开始的前后,对溶液中的FLU浓度进行检测,对比检测结果后计算实测和名义浓度的比率,结果为90.03%—99.15%,满足要求[21],因此本文在计算EC/LCx时,浓度采用名义浓度.
2. 结果与讨论(Results and discussion)
2.1 急性毒性实验
表3显示了9种本土水生生物的急性毒性试验结果,其中空白对照组和助溶剂对照组在试验期间中没有出现死亡现象. 窗体顶端结果表明泥鳅对FLU暴露最为敏感,其96-h LC50为1.887 mg·L−1, 其次是水螅属、青虾、麦穗鱼、大型溞、锦鲤、霍甫水丝蚓和摇蚊幼虫,对FLU最不敏感的是泽蛙蝌蚪,其96-h LC50为8.695 mg·L−1.
表 3 FLU本土水生生物急性试验结果Table 3. Results of acute toxicity tests of FLU to resident aquatic organisms物种 Species 暴露时间/h Exposure time 公式 Formula R2 P LC50/(mg·L−1) 锦鲤 96 y = 3.4458x + 2.2589 0.9268 <0.01 6.251 (5.748—6.443) 泥鳅 96 y = 1.4976x + 4.5875 0.9436 <0.01 1.887 (1.594—2.258) 大型溞 48 y = 3.8675x –2.0147 0.9850 <0.01 5.487 (5.012—5.897) 青虾 96 y = 2.5612x + 3.7744 0.9089 <0.01 3.011 (2.412—3.647) 霍甫水丝蚓 96 y = 1.5825x + 3.7347 0.9065 <0.01 6.313 (5.688—6.578) 麦穗 96 y = 1.6443x + 3.8262 0.854 <0.01 5.177 (4.231—5.593) 摇蚊幼虫 96 y = 2.3053x + 2.9664 0.9243 <0.01 7.628 (7.390—8.159) 水螅属 96 y = 1.3879x + 1.9976 0.9017 <0.01 2.032 (1.785—3.074) 泽蛙蝌蚪 96 y = 1.9267x + 3.1911 0.9044 <0.01 8.695(8.393—90.145) 2.2 慢性毒性数据
在慢性毒性实验中各试验浓度组均未出现死亡现象. 对于慢性毒性数据(表4),Barata等[22]研究表明大型溞的存活率21-d NOEC为0.937 mg·L−1,这一结果与本试验中大型溞总繁殖数量的21-d EC10为0.881 mg·L−1十分接近. 根据表4,对于大型溞,对FLU暴露的产卵总数量试验终点相比于其存活率,表现出更为敏感的趋势. 在慢性毒性试验中,3种水生生物中对FLU暴露的敏感性最低的为大型溞,最高的为泥鳅. 结果表明泥鳅在急性与慢性实验中,对FLU暴露都表现出最高的敏感性.
表 4 FLU本土水生生物慢性试验结果Table 4. Results of chronic toxicity tests of FLU to resident aquatic organisms.物种 Species 暴露时间/d Exposure time 终点 Endpoint 公式 Formula R2 P EC10/( mg·L−1) 锦鲤 28 生长(t/d) y = 4.5521x +2.8004 0.9930 <0.01 0.798 泥鳅 28 生长(t/d) y = 5.3131x –1.989 0.9743 <0.01 0.269 大型溞 28 生长(t/d) y = 4.7745x+ 1.667 0.8971 <0.05 1.187 第一窝时间 (t/d) y = 2.8499x+ 1.525 0.9572 <0.01 1.243 第一窝数量 (n) y = 3.8261x+ 0.657 0.9315 <0.01 0.987 总数量 (n) y= 3.7966x+ 1.0801 0.9203 <0.01 0.881 总窝数 (n) y= 3.7450x+ 1.4623 0.9364 <0.01 1.471 2.3 基于本土与美国生物毒性数据拟合SSD曲线比较
Davies等提出“灵活使用毒性数据”的设想[23],即在某一地区进行生态风险评估时,可使用其他地区的生物毒性数据. 但由于不同地区的水中溶解氧浓度、水温差别较大,且不同种类生物对于相同有害物质的敏感程度也各不相同[24],因此这一设想在提出后受到多方面质疑. 本研究将本地(表2)和美国(表3)的生物毒性数据进行SSD曲线拟合,并进行比较讨论,探讨 "灵活使用毒性数据 "这一概念的可行性. 受限于相对缺少慢性数据,本研究仅采用急性毒性数据. 本研究以本土、美国、本土+美国的FLU毒性数据为基础,共得出3条SSD拟合曲线(图1). 在对FLU暴露的敏感性方面,图中本土数据(黑)、总体数据(蓝)与美国数据(红)从左到右存在显著的位移分布,意味着美国生物比本土生物表现出更加敏感的趋势. 经过计算,总体数据、本土数据及非本土数据三条曲线的HC5值分别是1.527、1.869、2.142 mg·L−1.
Two-sample Kolmogorov-Smirnov(K-S test)检验常用于数学统计中,可用于对两样本总体分布差异性的检验[24]. 利用此方法,研究美国毒性数据和本土毒性数据是否存在较为明显的不同具有十分重要的学术和科学意义:若二者差异明显,则在本土进行相关的基准阈值研究时,应选取本土水生生物;若二者较为一致,那么证明美国水生生物毒性数据可用于本土基准阈值的推导过程,从而降低受试生物的消耗以及节省资源的投入. K-S结果如下:(ks = 1.342, n1 = 9, n2 = 13, P = 0.01). P= 0.0114<0.05,按a=0.05水准,结果表明两组数据在FLU毒性敏感的总体分布上并为呈现较高的一致性,两组数据之间存在的差异十分显著(图1). 另外,由于浮游类不被包含在非本土生物毒性数据中,因此在本土生物数据中浮游类大型溞的毒性数据暂时去除之后,对数据再次进行K-S检验,两者之间仍然存在较为显著的差异(ks= 0.830, n1 = 8, n2= 13, P = 0.0183). 因此我们可以初步判断本土对FLU的敏感性与非本土生物有着较大差别,需要进一步开展针对本土化的相关研究工作(图1).
2.4 FLU水生生物水质基准阈值推导
以实测数据为基础,在计算FLU水生生物基准阈值时,本文采用了USEPA“指南”推荐的SSR方法[15],9种本土物种的SMAV值和GMAV值及其排序如表5所示,CMC(FLU的急性基准阈值)=FAV/评价因子,其中FAV取1.141 mg·L−1,评价因子通常取值为2,最后计算出我国FLU的急性基准阈值结果为0.570 mg·L-1[25-26]. 鉴于我国FLU慢性毒性数据较少,FCV值可通过“指南”所推荐的方法计算,即FCV=FAV/FACR,FACR的值是3种水生生物SACR的几何平均值(如表所示,3种水生生物的SAVR值分别为:大型溞6.23、麦穗6.49、泥鳅7.01),最终计算得出FACR值为6.57,FCV值为0.174 mg·L−1,已知淡水藻的FLU植物毒性值为7.447 mg·L−1,远远大于计算所得的FCV值,因此对植物的保护作用得到验证[27]. CCC的确定按“指南”所指出的方法,即由FPV、FCV和FRV三者中最小的值所确定[28]. 相比于动物,植物的敏感性要低得多,且我国缺少相应的BCF和MPC值,因而CCC可直接通过FCV值计算,在很多情况下FRV则不被考虑,最后计算出我国FLU的慢性基准阈值CCC为0.174 mg·L−1.
表 5 FLU水生生物种平均值及急慢性比Table 5. Ranked GMAVs with SACRs.排序 Rank 物种 Species SMAVs/(mg·L−1) GMAVs/(mg·L−1) SACRs 来源 Source 1 泥鳅 1.887 1.887 7.01 本研究 2 水螅属 2.032 2.032 本研究 3 青虾 3.011 3.011 本研究 4 麦穗 5.177 5.177 6.49 本研究 5 大型溞 5.487 5.487 6.23 本研究 6 锦鲤 6.251 6.251 本研究 7 霍甫水丝蚓 6.313 6.313 本研究 8 摇蚊幼虫 7.628 7.628 本研究 9 泽蛙蝌蚪 8.695 8.695 本研究 植物 淡水藻 7.447 7.447 [20] 另外,本文也对比了FLU对美国水生生物的毒性. 例如,本研究中本土代表性鱼类敏感性相对较高,泥鳅、麦穗鱼和锦鲤的96-h LC50分别为1.887、5.177、6.251 mg·L−1 FLU,而作为非本土鱼类的蓝鳃太阳鱼[29]、斑点叉尾鮰[30]、虹鳟[31]和呆头鲦鱼[32]的96-h LC50分别为20.90、36.00、91.00、118.3 mg·L−1 FLU,数值不在一个数量级,本土鱼类更加敏感;已经报道的非本土两栖类动物非洲爪蟾[33]的96-h LC50为52.00 mg·L−1FLU,远远高于本土两栖类泽蛙蝌蚪的实测值(8.695 mg·L−1 FLU);本土底栖动物节肢动物门的摇蚊幼虫96-h LC50为7.628 mg·L−1 FLU,而已报道的非本土昆虫类生物是端足虫[30]和伸展摇蚊[34],96-h LC50分别为44.00 mg·L−1和250.00 mg·L−1 FLU,差异较为明显,本土节肢动物门相对敏感. 综上所述,可以确定本土水生生物中鱼类、两栖类对FLU和底栖节肢动物门比非本土同类生物更加敏感.
本土底栖动物中环节动物门受试生物为霍甫水丝蚓,96-h LC50为6.313 mg·L−1 FLU,非本土浅绛单孔蚓[30]96-h LC50为0.700 mg·L−1 FLU,此外还有底栖甲壳类生物差异较大,本土青虾96-h LC50为3.011 mg·L−1FLU,而非本土底栖甲壳类动物美洲海螯虾[35]和俄勒冈虾[35]96-h LC50相对较低,为0.600 mg·L−1及0.800 mg·L−1 FLU. 因此可以确定非本土水生生物中底栖环节动物及甲壳类动物对FLU比本土生物更加敏感.
另外,借助荷兰RIVM公布的ETX2.0软件及逻辑斯蒂SSD曲线求出HC5值,分别是1.657 mg·L−1和1.869 mg·L−1. 因此当评价因子取值为2时,CMC在这两种SSD曲线下,计算的结果分别为0.829 mg·L−1和0.935 mg·L−1,上文采用US EPA“指南”中推荐的SSR法计算的CMC值为0.570 mg·L−1,由此可见,计算结果都同在一个数量级.
3. 结论(Conclusion)
(1) 基于US EPA“指南”推荐的方法,荧蒽本土水生生物急性基准阈值(CMC)为0.570 mg·L−1,慢性基准阈值(CCC)为0.174 mg·L−1;另外,通过荷兰RIVM公布的ETX2.0软件及欧盟推荐的SSD方法所得的基准阈值与本文所得结果(SSR方法得出)在数量级上一致,本文结果得到验证.
(2) 在敏感性方面,通过比较分析本土与美国物种的一致性较低,说明在进行我国荧蒽水生生物基准阈值的推导时,可利用美国水生生物毒性数据的概率很小.
致谢:感谢中国环境科学研究院刘征涛研究员在文章修改中给予的帮助.
-
表 1 FLU 9种本土水生生物急性毒性实验信息
Table 1. Acute toxicity tests information of FLU to nine resident aquatic organisms
分类Classification 生物科Families 物种Species 生长阶段Growth phase 体重/gWeight 体长/cmLength 实验时间/hTime 浓度设置/ (mg·L−1)Concentration 脊索动物门 鲤科 锦鲤(Rhodens sinensis) 幼龄期(<30 d) 0.25 ± 0.05 3.0 ± 0.5 96 0.00, 2.40, 3.10, 4.00, 5.20, 6.80, 8.80, 11.40 麦穗(Pseudorasbora parva) 幼龄期(<30 d) 0.25 ± 0.02 2.5 ± 0.2 96 0.00, 2.40, 3.10, 4.00, 5.20, 6.80, 8.80, 11.40 鳅科 泥鳅(Misgurnus anguillicaudatus) 幼龄期(<30 d) 0.70 ± 0.05 6.0 ± 0.5 96 0.00, 0.96, 1.16, 1.39, 1.67, 2.00, 2.40, 2.88 蛙科 泽蛙蝌蚪(Rana limnocharis) 幼龄期(<10 d) 0.20 ± 0.02 1.6 ± 0.2 96 0.00, 3.50, 4.60, 5.50, 7.80, 10.10, 13.20, 17.10 节肢动物门 溞科 大型溞(Daphnia magna) <24 h — — 48 0.00, 2.70, 3.60, 4.70, 6.20, 8.00, 10.40, 13.50 虾科 青虾(Macrobrachium nipponense) 幼龄期(<10 d) 0.25 ± 0.05 3.0 ± 0.2 96 0.00, 2.40, 3.10, 4.00, 5.20, 6.80, 8.80, 11.40 摇蚊科 摇蚊幼虫(Chironomus plumosus) 第3代(幼虫) 0.03 ± 0.01 1.0 ± 0.2 96 0.00, 2.70, 3.60, 4.70, 6.20, 8.00, 10.40, 13.50 环节动物门 颤蚓科 霍甫水丝蚓(Limnodrilus hoffmeisteri) 幼龄期(<10 d) 0.05 ± 0.01 1.5 ± 0.2 96 0.00, 3.40, 4.40, 5.70, 7.40, 9.60, 12.50, 16.20 腔肠动物门 水螅虫科 水螅属(Hydra sp.) 幼龄期(<10 d) 0.03 ± 0.01 1.0 ± 0.2 96 0.00, 1.39, 1.67, 2.00, 2.40, 2.88, 3.74, 4.87 表 2 FLU美国水生生物急性毒性数据
Table 2. Acute toxicity data of FLU to American aquatic organisms
排序 Rank 物种 Species (LC50/EC50)/(mg·L−1) t/h 1 美洲海螯虾 0.6 96 2 浅绛单孔蚓 0.7 96 3 俄勒冈虾 0.8 96 4 蓝鳃太阳鱼 20.9 96 5 斑点叉尾鮰 36.0 96 6 端足虫 44.0 96 7 非洲爪蟾 52.0 96 8 隐居蜾嬴蜚 54.0 96 9 沙蟹 74.0 96 10 虹鳟 91.0 96 11 呆头鲦鱼 118.3 96 12 宽纹北箭蜓 139.9 96 13 伸展摇蚊 250.0 96 表 3 FLU本土水生生物急性试验结果
Table 3. Results of acute toxicity tests of FLU to resident aquatic organisms
物种 Species 暴露时间/h Exposure time 公式 Formula R2 P LC50/(mg·L−1) 锦鲤 96 y = 3.4458x + 2.2589 0.9268 <0.01 6.251 (5.748—6.443) 泥鳅 96 y = 1.4976x + 4.5875 0.9436 <0.01 1.887 (1.594—2.258) 大型溞 48 y = 3.8675x –2.0147 0.9850 <0.01 5.487 (5.012—5.897) 青虾 96 y = 2.5612x + 3.7744 0.9089 <0.01 3.011 (2.412—3.647) 霍甫水丝蚓 96 y = 1.5825x + 3.7347 0.9065 <0.01 6.313 (5.688—6.578) 麦穗 96 y = 1.6443x + 3.8262 0.854 <0.01 5.177 (4.231—5.593) 摇蚊幼虫 96 y = 2.3053x + 2.9664 0.9243 <0.01 7.628 (7.390—8.159) 水螅属 96 y = 1.3879x + 1.9976 0.9017 <0.01 2.032 (1.785—3.074) 泽蛙蝌蚪 96 y = 1.9267x + 3.1911 0.9044 <0.01 8.695(8.393—90.145) 表 4 FLU本土水生生物慢性试验结果
Table 4. Results of chronic toxicity tests of FLU to resident aquatic organisms.
物种 Species 暴露时间/d Exposure time 终点 Endpoint 公式 Formula R2 P EC10/( mg·L−1) 锦鲤 28 生长(t/d) y = 4.5521x +2.8004 0.9930 <0.01 0.798 泥鳅 28 生长(t/d) y = 5.3131x –1.989 0.9743 <0.01 0.269 大型溞 28 生长(t/d) y = 4.7745x+ 1.667 0.8971 <0.05 1.187 第一窝时间 (t/d) y = 2.8499x+ 1.525 0.9572 <0.01 1.243 第一窝数量 (n) y = 3.8261x+ 0.657 0.9315 <0.01 0.987 总数量 (n) y= 3.7966x+ 1.0801 0.9203 <0.01 0.881 总窝数 (n) y= 3.7450x+ 1.4623 0.9364 <0.01 1.471 表 5 FLU水生生物种平均值及急慢性比
Table 5. Ranked GMAVs with SACRs.
排序 Rank 物种 Species SMAVs/(mg·L−1) GMAVs/(mg·L−1) SACRs 来源 Source 1 泥鳅 1.887 1.887 7.01 本研究 2 水螅属 2.032 2.032 本研究 3 青虾 3.011 3.011 本研究 4 麦穗 5.177 5.177 6.49 本研究 5 大型溞 5.487 5.487 6.23 本研究 6 锦鲤 6.251 6.251 本研究 7 霍甫水丝蚓 6.313 6.313 本研究 8 摇蚊幼虫 7.628 7.628 本研究 9 泽蛙蝌蚪 8.695 8.695 本研究 植物 淡水藻 7.447 7.447 [20] -
[1] 武江越, 许国栋, 林雨霏, 等. 我国淡水生物菲水质基准研究 [J]. 环境科学学报, 2017, 37(12): 1-8. doi: 10.13671/j.hjkxxb.2017.0350 WU J Y, XU G D, LIN Y F, et al. Development of freshwater aquatic life water quality criteria for phenanthrene in China [J]. Acta Scientiae Circumstantiae, 2017, 37(12): 1-8(in Chinese). doi: 10.13671/j.hjkxxb.2017.0350
[2] 闫振广, 孟伟, 刘征涛, 等. 我国淡水水生生物镉基准研究 [J]. 环境科学学报, 2009, 29(11): 2393-2406. YAN Z G, MENG W, LIU Z T, et al. Biological criteria for freshwater Cd in China [J]. Acta Scientiae Circumstantiae, 2009, 29(11): 2393-2406(in Chinese).
[3] 金小伟, 雷炳莉, 许宜平, 等. 水生态基准方法学概述及建立我国水生态基准的探讨 [J]. 生态毒理学报, 2009, 4(5): 609-616. JIN X W, LEI B L, XU Y P, et al. Methodologies for deriving water quality criteria to protect aquatic life(ALC)and proposal for development of ALC in China: A review [J]. Asian Journal of Ecotoxicology, 2009, 4(5): 609-616(in Chinese).
[4] 罗茜, 查金苗, 雷炳莉, 等. 三种氯代酚的水生态毒理和水质基准 [J]. 环境科学学报, 2009, 29(11): 2241-2249. LUO Q, ZHA J M, LEI B L, et al. Review of the aquatic ecotoxicology and water quality criteria of three chlorophenols [J]. Acta Scientiae Circumstantiae, 2009, 29(11): 2241-2249(in Chinese).
[5] 吴丰昌, 孟伟, 宋永会, 等. 中国湖泊水环境基准的研究进展 [J]. 环境科学学报, 2008, 28(12): 2385-2393. WU F C, MENG W, SONG Y H, et al. Research progress in lake water quality criteria in China [J]. Acta Scientiae Circumstantiae, 2008, 28(12): 2385-2393(in Chinese).
[6] 闫振广, 孟伟, 刘征涛, 等. 我国典型流域镉水质基准研究 [J]. 环境科学研究, 2010, 23(10): 1221-1228. YAN Z G, MENG W, LIU Z T, et al. Development of aquatic criteria for cadmium for typical basins in China [J]. Research of Environmental Sciences, 2010, 23(10): 1221-1228(in Chinese).
[7] WU F C, MENG W, ZHAO X L, et al. China embarking on development of its own national water quality criteria system [J]. Environmental Science & Technology, 2010, 44(21): 7992-7993. [8] 焦婷婷. 多环芳烃荧蒽对植物和土壤生物毒害的剂量—效应关系及其土壤环境基准初探[D]. 南京: 南京农业大学, 2009. JIAO T T. Preliminary study on dose-effect relationship for fluoranthene’s toxicity to plant and soil organisms and TTS soil environmental criteria[D]. Nanjing: Nanjing Agricultural University, 2009 (in Chinese).
[9] 王丽平, 郑丙辉, 孟伟. 荧蒽对两种海洋硅藻生长、SOD活力和MDA含量的影响 [J]. 海洋通报, 2008, 27(4): 53-58. WANG L P, ZHENG B H, MENG W. Effects of fluoranthene on growth, SOD activity and MDA content of two marine diatoms [J]. Marine Science Bulletin, 2008, 27(4): 53-58(in Chinese).
[10] JIN X W, ZHA J M, XU Y P, et al. Derivation of aquatic predicted no-effect concentration (PNEC) for 2, 4-dichlorophenol: Comparing native species data with non-native species data [J]. Chemosphere, 2011, 84(10): 1506-1511. doi: 10.1016/j.chemosphere.2011.04.033 [11] 武江越, 刘征涛, 冯流, 等. 辽河水体中多环芳烃的分布特征及风险评估 [J]. 环境化学, 2012, 31(7): 1116-1117. WU J Y, LIU Z T, FENG L, et al. Distribution characteristics and risk assessment of polycyclic aromatic hydrocarbons in Liaohe River [J]. Environmental Chemistry, 2012, 31(7): 1116-1117(in Chinese).
[12] 刘明玉. 中国脊椎动物大全[M]. 沈阳: 辽宁大学出版社, 2000. LIU M Y. China vertebrate complete collection[M]. Shenyang: Liaoning University Publishing House, 2000(in Chinese).
[13] ANYAKORA C, OGBECHE A, PALMER P, et al. Determination of polynuclear aromatic hydrocarbons in marine samples of Siokolo Fishing Settlement [J]. Journal of Chromatography A, 2005, 1073(1/2): 323-330. [14] 伍献文. 中国经济动物志-淡水鱼类[M]. 北京: 科学出版社, 1963. WU X W. Fauna of economic animals in China-Freshwater fish[M]. Beijing: Science Press, 1963(in Chinese).
[15] EPA U S. Guidelines for deriving numerical national water quality criteria for the protection of aquatic organisms and their uses[R]. Minnesota, U. S. : Environmental Protection Agency, 1985 [16] BORJA A, FRANCO J, PÉREZ V. A marine biotic index to establish the ecological quality of soft-bottom benthos within European estuarine and coastal environments [J]. Marine Pollution Bulletin, 2000, 40(12): 1100-1114. doi: 10.1016/S0025-326X(00)00061-8 [17] ASTM. Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates and Amphibians[M]. Philadelphia, USA, 1993. [18] BUHL K J, HAMILTON S J, SCHMULBACH J C. Chronic toxicity of the bromoxynil formulation Buctril® to Daphnia magna exposed continuously and intermittently [J]. Archives of Environmental Contamination and Toxicology, 1993, 25(2): 152-159. [19] FENG C L, WU F C, ZHAO X L, et al. Water quality criteria research and progress [J]. Science China Earth Sciences, 2012, 55(6): 882-891. doi: 10.1007/s11430-012-4384-5 [20] SMITH S B, SAVINO J F, BLOUIN M A. Acute toxicity to Daphnia pulex of six classes of chemical compounds potentially hazardous to great lakes aquatic biota [J]. Journal of Great Lakes Research, 1988, 14(4): 394-404. doi: 10.1016/S0380-1330(88)71572-5 [21] ALDENBERG T, JAWORSKA J S. Uncertainty of the hazardous concentration and fraction affected for normal species sensitivity distributions [J]. Ecotoxicology and Environmental Safety, 2000, 46(1): 1-18. doi: 10.1006/eesa.1999.1869 [22] BARATA C, CALBET A, SAIZ E, et al. Predicting single and mixture toxicity of petrogenic polycyclic aromatic hydrocarbons to the copepod Oithona davisae [J]. Environmental Toxicology and Chemistry, 2005, 24(11): 2992-2999. doi: 10.1897/05-189R.1 [23] DAVIES P E, COOK L S J, GOENARSO D. Sublethal responses to pesticides of several species of Australian freshwater fish and crustaceans and rainbow trout [J]. Environmental Toxicology and Chemistry, 1994, 13(8): 1341-1354. doi: 10.1002/etc.5620130816 [24] HOSE G C, van den BRINK P J. Confirming the species-sensitivity distribution concept for endosulfan using laboratory, mesocosm, and field data [J]. Archives of Environmental Contamination and Toxicology, 2004, 47(4): 511-520. doi: 10.1007/s00244-003-3212-5 [25] 吴丰昌, 冯承莲, 曹宇静, 等. 锌对淡水生物的毒性特征与水质基准的研究 [J]. 生态毒理学报, 2011, 6(4): 367-382. WU F C, FENG C L, CAO Y J, et al. Toxicity characteristic of zinc to freshwater biota and its water quality criteria [J]. Asian Journal of Ecotoxicology, 2011, 6(4): 367-382(in Chinese).
[26] YAN Z G, ZHANG Z S, WANG H, et al. Development of aquatic life criteria for nitrobenzene in China [J]. Environmental Pollution, 2012, 162: 86-90. doi: 10.1016/j.envpol.2011.11.007 [27] VERBRUGGEN E M J, Van H R. Environmental risk limits for fluoranthene[R]. National Institute for Public Health and the Environment, 2012. [28] MARCHAL G, SMITH K E C, REIN A, et al. Impact of activated carbon, biochar and compost on the desorption and mineralization of phenanthrene in soil [J]. Environmental Pollution, 2013, 181: 200-210. doi: 10.1016/j.envpol.2013.06.026 [29] BLACK J A, BIRGE W J, WESTERMAN A G, et al. Comparative aquatic toxicology of aromatic hydrocarbons [J]. Fundamental and Applied Toxicology, 1983, 3(5): 353-358. doi: 10.1016/S0272-0590(83)80004-9 [30] GENDUSA T C, BEITINGER T L. External biomarkers to assess chromium toxicity in adult Lepomis macrochirus [J]. Bulletin of Environmental Contamination and Toxicology, 1992, 48(2): 237-242. [31] TURNER C H. The retention of dental posts [J]. Journal of Dentistry, 1982, 10(2): 154-165. doi: 10.1016/S0300-5712(82)80011-0 [32] BLAUSTEIN A R, KIESECKER J M, CHIVERS D P, et al. Effects of ultraviolet radiation on amphibians: Field experiments [J]. Integrative and Comparative Biology, 1998, 38(6): 799-812. [33] WEINSTEIN J E, GARNER T R. Piperonyl butoxide enhances the bioconcentration and photoinduced toxicity of fluoranthene and benzo[a]pyrene to larvae of the grass shrimp (Palaemonetes pugio) [J]. Aquatic Toxicology, 2008, 87(1): 28-36. doi: 10.1016/j.aquatox.2008.01.002 [34] SUEDEL B C, DEAVER E, RODGERS J H Jr. Experimental factors that may affect toxicity of aqueous and sediment-bound copper to freshwater organisms [J]. Archives of Environmental Contamination and Toxicology, 1996, 30(1): 40-46. doi: 10.1007/BF00211327 [35] SPEHAR R L, POUCHER S, BROOKE L T, et al. Comparative toxicity of fluoranthene to freshwater and saltwater species under fluorescent and ultraviolet light [J]. Archives of Environmental Contamination and Toxicology, 1999, 37(4): 496-502. doi: 10.1007/s002449900544 期刊类型引用(1)
1. 杨虎成,莫春雷,李亚云,周艳松,王艺霖,郭静. 吡虫啉的本土物种敏感性分布及水质基准研究. 湖泊科学. 2024(01): 177-186 .  百度学术
百度学术
其他类型引用(0)
-






 DownLoad:
DownLoad: