-
燃放烟花爆竹是国内外在重大宗教和文化节日期间的传统习俗之一,如印度排灯节、法国巴士底日、英国盖伊·福克斯之夜、美国独立日等都要燃放烟花爆竹[1-2]. 我国在春节和元宵节期间烟花爆竹燃放量最大、时间最集中. 烟花爆竹的燃放为节日增添了喜庆气氛,也同时带来了很多负面的影响,如易引起火灾、产生噪声污染,并且向大气中排放了大量的气溶胶污染物等. 污染物在短时间内大量排放造成了空气质量急剧恶化,能见度降低[3],影响了人民群众的生产生活也会对人体健康造成危害[4-5],特别是对易感人群,引起哮喘和癌症等疾病[6-9]. 污染物中的水溶性离子会增加有毒有机物的溶解性[10],难以被生物降解的重金属可以使人体内的蛋白质和酶等失去活性,重金属在人体的某些器官中积累,造成慢性中毒[11-14]. 因此,近年来各地政府出台了一系列相应的禁限放规定,划定了禁燃区,比如北京市2017年规定五环路以内为禁止燃放烟花爆竹区域[15],《上海市烟花爆竹安全管理条例》规定2017年起禁止在外环线以内区域燃放烟花爆竹等. 针对秋冬季重污染事件频发的问题,2018年汾渭平原首次被纳入大气污染综合治理攻坚行动中,汾渭平原各城市加大了禁燃禁放的控制范围和管控力度. 2018年春节期间宝鸡市区全面禁止燃放烟花爆竹,2019年底规定在2020/1/1—2020/3/31期间,除市区为禁售禁燃区域之外,凤翔、岐山、扶风、眉县政府也将全域列入烟花爆竹禁燃禁放区域,而其余区县只将其县城建成区列入禁燃禁放区域. 但是各地主要针对主城区或主干道周边提出了禁限放措施,而对大多农村地区和城乡结合部没有禁限放要求,导致春节期间烟花爆竹的燃放量仍较大,对宝鸡市及周边地区空气质量仍存在较明显的影响.
尽管在2019年生态环保部通报的汾渭平原11个重点城市中宝鸡的空气质量综合排名第一,整体空气质量较好,但仍有一些空气污染事件发生,并且在全国169个城市中,宝鸡排名倒数第67位[16],情况不容乐观. 2014年徐衡等[17]分析了春节期间烟花爆竹对宝鸡市区颗粒物浓度的影响,张婷等[18]对2012年3月—2013年3月宝鸡市大气PM2.5中水溶性离子组分污染特征进行了分析,大多数以往研究主要集中在对宝鸡某个季节和近几年的常规污染物及某一次污染事件的研究分析[19-21],或者气象条件对宝鸡污染的影响等[22]. 随着近年来对空气污染问题的重视和“蓝天保卫战”的顺利实施,宝鸡市大气气溶胶污染的趋势和特征都较之以前发生了很大的变化.
本文选取2020年春节期间烟花爆竹燃放对空气质量的影响进行研究,获得了2020年春节采样期间大气颗粒物及其主要化学组分的浓度变化特征,对烟花爆竹中五种成分的化学组分进行了分析,评价了通过呼吸途径造成的人群健康风险(致癌风险和非致癌风险),从而为宝鸡市大气污染防治及制定有针对性的烟花爆竹禁限放等规定提供科学依据和数据支持.
-
宝鸡市常规大气污染物PM10、PM2.5、SO2、NO2浓度及气象数据(包括风速、风向、气温、相对湿度)均来自于陕西省环境空气质量监测联网管理平台(http://221.11.17.250:9000/Home),边界层高度来源于ERA5(欧洲中期天气预报中心发布的第五代全球天气气候再分析资料)的逐小时数据(https://cds.climate.copernicus.eu/#!/home). 目前宝鸡市共设有8个国控空气质量自动监测站点. 本研究中各项常规污染物浓度为7个国控点位的算数平均值(对照点除外),数据时间分辨率为1 h.
研究时间段为2020年1月23日16时—1月25日16时(1月24日为除夕),其中烟花爆竹燃放期定义为1月24日16时—1月25日10时,非烟花爆竹燃放期为1月23日16时—1月24日10时.
-
宝鸡位于汾渭平原,关中盆地最西端,南西北三面环山,地貌差异较大,全年受东亚季风控制,当冬季持续东风时,污染就会被推送至盆地最西端,使宝鸡成为污染压力最重的城市. 此研究将采样点布设于宝鸡市高新大道69号(107.24°E,34.36°N)高新君悦国际酒店楼顶,距地面约90 m,位于商业交通居民混合区,周围无明显遮挡,且无明显特定的单一污染源影响,能够代表该市大气颗粒物的污染状况.
-
采用S-611型在线气体与气溶胶成分监测仪(中国台湾章嘉企业,In-situ Gas And Aerosol Compositions Monitor)连续24 h全自动地监测气溶胶中水溶性离子成分(SO42−、NO3−、NH4+、Cl−、Mg2+、K+),时间分辨率为1 h,可实现远程监控,故障主动通知. IGAC系统抽取外界空气后,先后通过湿式同心圆管气固分离器和凝结微粒采样器,收集的颗粒物水溶液样品再进入离子色谱仪进行分析,得到颗粒物中无机离子的浓度[23]. 具体仪器原理和质控措施见参考文献[24].
使用AMMS-100型大气重金属分析仪(中国聚光科技公司),可同时监测30种元素(Hg、Ag、Sc、Pd、Te、Cs、Ni、Sb、Sn、Pb、Se、Al、Si、As、Ca、K、Co、Mo、Tl、Br、Ga、Cr、Cd、Zn、Cu、Fe、Mn、Ti、V、Ba). 该设备采用精密恒流采样系统,精确控制采集的空气体积,通过滤膜富集空气中的颗粒物,利用X射线荧光技术得出元素浓度(单位ng·m−3),时间分辨率为1 h,元素检出限最低可达0.01 ng·m−3. 仪器需定期清洗采样头、PM2.5切割器和采样管,并定期更换滤膜,检查真空泵及气密性等,具体质控措施见参考文献[25].
-
研究表明,阴阳离子平衡通常可以用来判断颗粒物的酸碱性,SO42−、NO3−和Cl−等阴离子为致酸性离子,阳离子则可以增加颗粒物的碱性[26]. 当阴阳离子当量的比值小于1时,颗粒物偏碱性;比值大于1时,颗粒物偏酸性[27]. 阴阳离子当量计算公式为:
式中,
ρ 均为质量浓度(μg·m−3). -
硫氧化率(SOR)和氮氧化率(NOR)是影响大气化学性质的主要参数,SOR和NOR分别代表硫氧化物和氮氧化物转化为硫酸盐和硝酸盐的转化率. SOR、NOR值越高,表示大气中存在明显的二次转化过程,有越多的SO2、NO2转化为二次无机离子. 在一次污染物中,SOR和NOR值通常小于0.1,因此可以认为SOR和NOR大于0.1作为大气中发生二次转化的分界值[28]. 使用下面公式计算SOR和NOR:
式中,
ρ 均为质量浓度(μg·m−3). -
大气中重金属元素进入人体的暴露途径有3种:呼吸、口和皮肤暴露,其中呼吸摄入为主要途径[29]. 因此,本文仅对呼吸途径的暴露风险进行评估. 根据US EPA推荐的健康风险评价暴露模型,可以用来估算经呼吸途径摄入人体的重金属暴露剂量、非致癌物质的非致癌风险及致癌物质的致癌风险. 本研究主要评价细颗粒物中V、Cr、Mn、Co、Ni、Cu、As、Cd、Sb、Ba、Pb等11种重金属通过呼吸途径对人体引起的健康风险,其中Cr、Co、Ni、As、Cd为致癌物质[30].
对于非致癌物质,暴露剂量用日均暴露剂量(ADD,mg·(kg·d)−1)来表示[31],公式如下:
对于致癌物质,暴露剂量用终生日均暴露剂量(LADD,mg·(kg·d)−1)来表示[32],公式如下:
其中,相关暴露参数参考2013年生态环境部《中国人群暴露参数手册》[33],如表1.
-
健康风险评价指标有两类:一类为非致癌风险,包括某种单一重金属元素暴露的非致癌风险(HQ,其值大小与风险成正比)[34]、多种重金属元素暴露的非致癌风险(HI,为多种重金属元素的非致癌风险之和);另一类为致癌风险,包括某种单一重金属元素暴露的终生致癌风险(LCR,表示发生癌症的概率,是致癌元素的终生日均暴露剂量与致癌斜率因子SF的乘积)[35]、多种重金属元素的致癌风险(ILCR,为多种重金属元素的致癌风险之和).
其中,RfD为非致癌重金属元素单位体重人体在单位时间通过呼吸途径进入人体的不会引起不良反应的污染物的最大量,即参考剂量,mg·(kg·d)−1;当HQ或HI>1时,表示存在非致癌风险,需要进行污染物治理[36];SF为人体暴露于一定剂量的某种重金属下产生致癌效应的最大概率,即经呼吸暴露的致癌斜率系数,(kg·d)·mg−1,ILCR指终生致癌风险,表示发生癌症的概率. 当ICR或ILCR>10−4时,表示存在较高致癌风险,需要对污染物进行治理;当ICR或ILCR在10−6—10−4时,存在一定的致癌风险;当ICR或ILCR<10−6时,无明显致癌风险[37]. 参数值见表2[38-40].
-
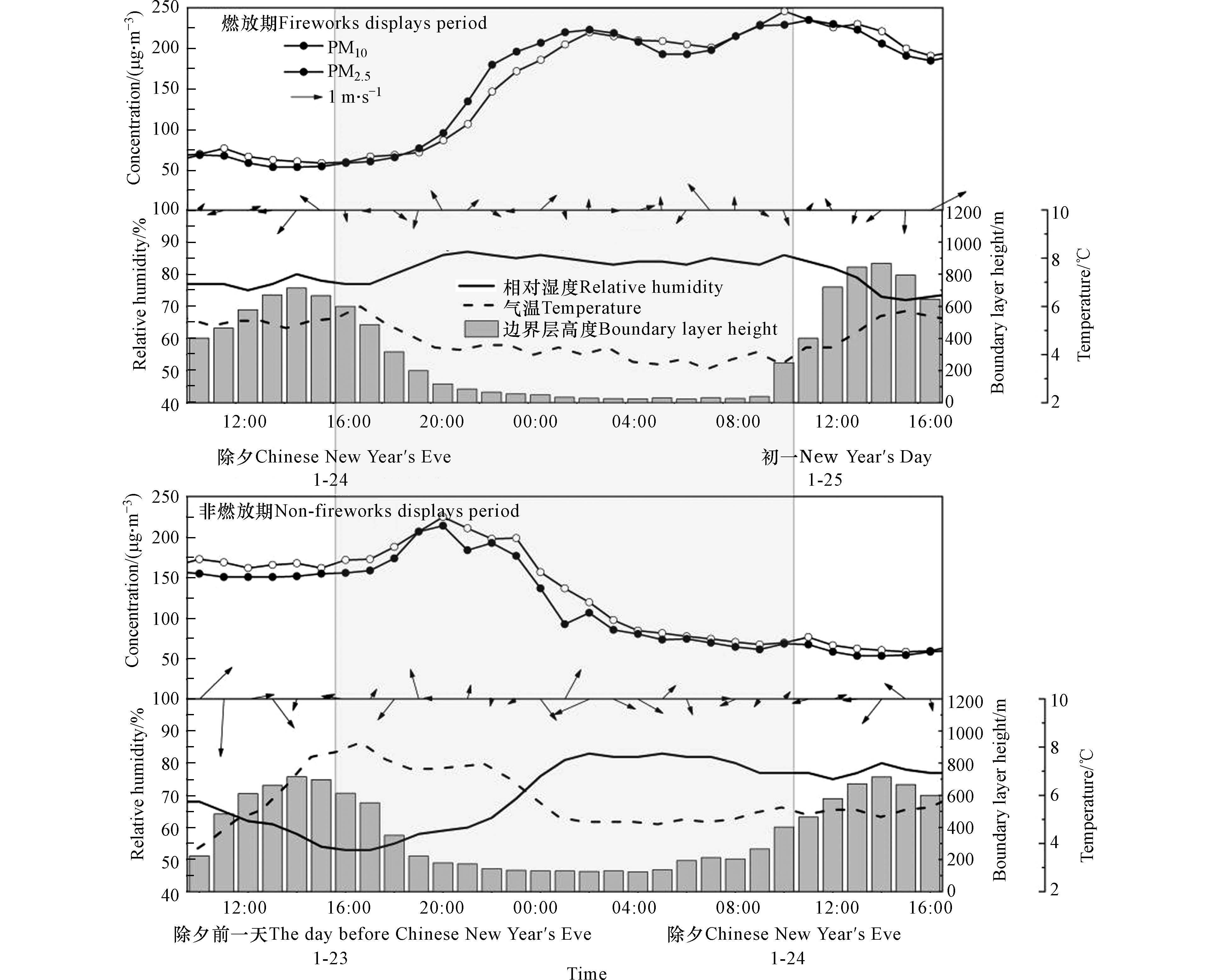
根据中国春节的传统习俗,烟花爆竹燃放的集中时间为农历除夕和初一(即2020年1月24日和 2020年1月25日). 将监测期间包含两次升高过程的时间段(除夕16:00 —初一10:00)定义为烟花爆竹燃放期,前一天同一时段定义为非烟花爆竹燃放期. 图1为2020年宝鸡市燃放期和非燃放期颗粒物质量浓度(PM10和PM2.5)及气象要素的小时变化情况. 可以看出,PM10和PM2.5变化趋势基本一致,其在燃放期的变化情况见表3,分析发现第一次升高过程与第二次升高过程相比,涨幅大且增长快. 结合气象要素数据分析可知,非燃放期和燃放期相对湿度均较高,分别为71.3%和83.6%;且气温相差不大(温差在2 ℃左右). 从图1可见,两个时期边界层高度降低,风向多变且风速较低(平均风速在1 m·s−1 以下),大气扩散条件不利. 除夕夜加之烟花爆竹燃放的影响导致大气污染物浓度急剧上升,出现了第一个高峰,尽管初一上午边界层有所升高,扩散条件改善,但是由于烟花爆竹的集中燃放导致污染物浓度继续升高,其峰值明显大于除夕夜晚的高峰. 而非燃放期在同样处于边界层降低、高湿静稳的气象条件下,却呈现出完全不同的变化趋势(图1),可以推测烟花爆竹燃放是该时段空气质量变差的主要原因. 烟花爆竹燃放期PM2.5质量浓度均值为168.6 μg·m−3,是非燃放期的(125.4 μg·m−3)1.3倍,其他城市也表现为燃放期PM2.5浓度值大于非燃放期,如西安市[9,41]、厦门市[13]、北京市[42]等,说明烟花爆竹燃放会导致PM2.5浓度的升高. 燃放期PM10质量浓度均值(164.3 μg·m−3)是非燃放期(137.6 μg·m−3)的1.2倍,说明在本研究期间烟花爆竹燃放对PM2.5质量浓度影响更为显著.
-
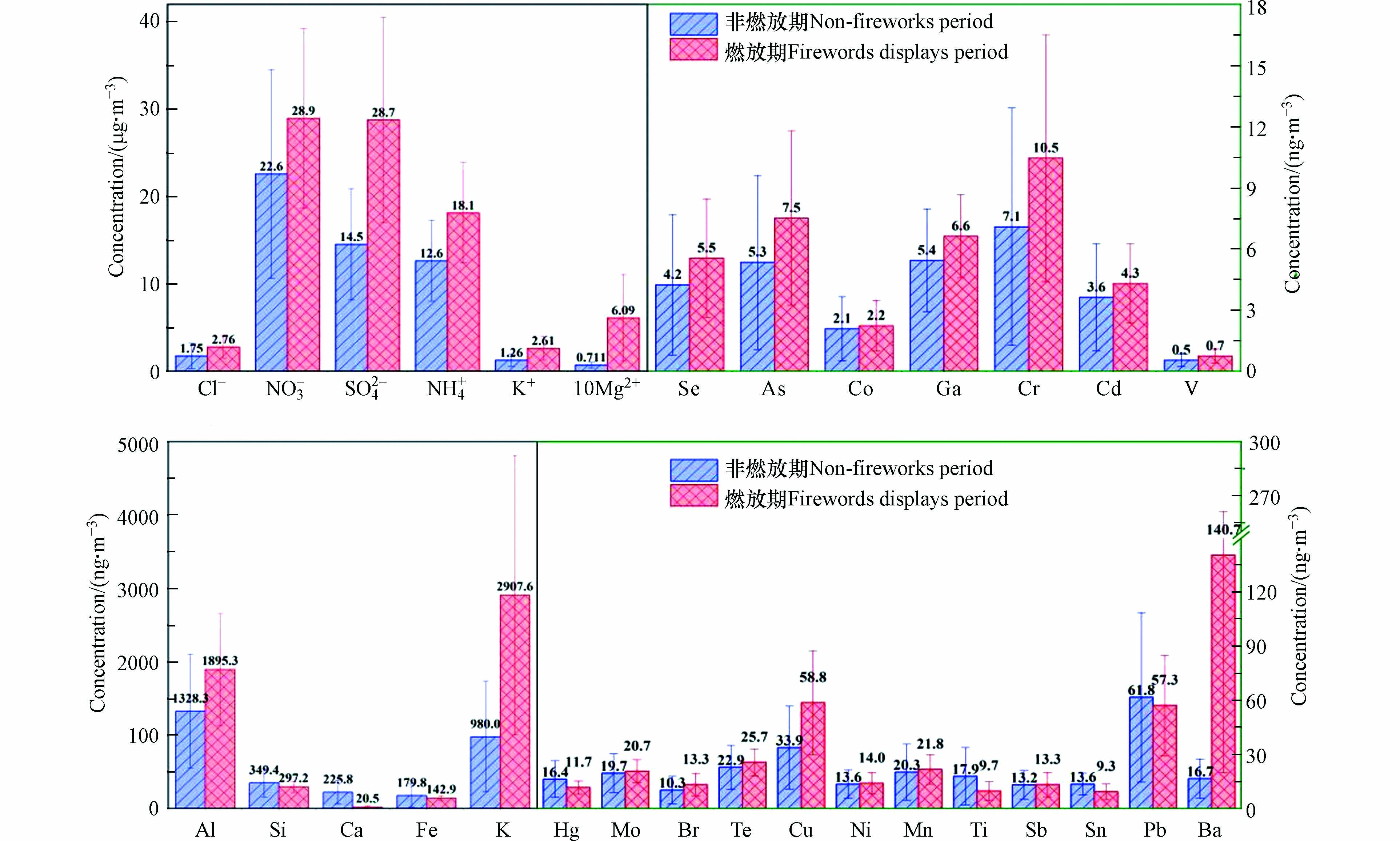
本研究选取SO42−、NO3−、NH4+、Cl−、Mg2+、K+、Pb、Se、Hg、Al、Si、As、Ca、K、Co、Mo、Br、Te、Ga、Cr、Cd、Cu、Fe、Mn、Ti、Sb、Sn、V、Ba来进行研究. 将研究期间各组分的异常值及数据量不足50%的组分(Ag、Sc、Cs、Pd、Zn和Tl)进行了剔除. 图2显示了在所研究时段内非烟花爆竹燃放期和燃放期各组分浓度均值,其中NO3−、SO42−、NH4+平均质量浓度最高,分别为22.6、14.5、12.6 μg·m−3和28.9、28.7、18.1 μg·m−3. 而明显升高(增长倍数>1)的组分为Mg2+、Ba、K和K+,增长倍数分别为7.6、7.4、2.0和1.1,从非燃放期的71.1、16.7、980.0 ng·m−3和1.26 μg·m−3,升高为609.0、140.7、2907.6 ng·m−3和2.61 μg·m−3;其次是SO42−和Cu,SO42−增长倍数接近于1,Cu燃放期和非燃放期质量浓度分别为58.8、33.9 ng·m−3,增长倍数为0.7,其他元素变化幅度较小. 这是由于通常将Mg作为可燃剂和着色剂,Ba、K、Cu作为着色剂加入烟花爆竹中;而SO42−则是黑火药中的硫磺燃烧生成物;其余有一定程度上升的其他组分,推测可能来自于烟花爆竹生产的其他工业材料,如再生纸、砂石等. 其中燃放期地壳元素Si、Ca、Fe和Ti浓度分别为297.2、20.5、142.9和9.7 ng·m−3,较非燃放期分别下降14.9%、90.0%、20.5%和45.8%,表明在此次烟花爆竹燃放期受地壳来源的扬尘影响小于非燃放期. 而受人为因素影响较大的元素Pb、Hg、Sn,分别从非燃放期的61.8、16.4、13.6 ng·m−3降至燃放期的57.3、11.7、9.3 ng·m−3,可能是因为燃放期受疫情管控影响,人为源排放显著减少,而非燃放期处于疫情管控初期,仍受部分人为活动的影响.
-
烟花爆竹的药剂由多种成分混合组成,主要成分是黑火药,包含硝酸钾、硫磺、木炭[43]. 根据不同成分在烟花爆竹中的作用,可将其分为五类,分类结果及主要化学组成见表4.
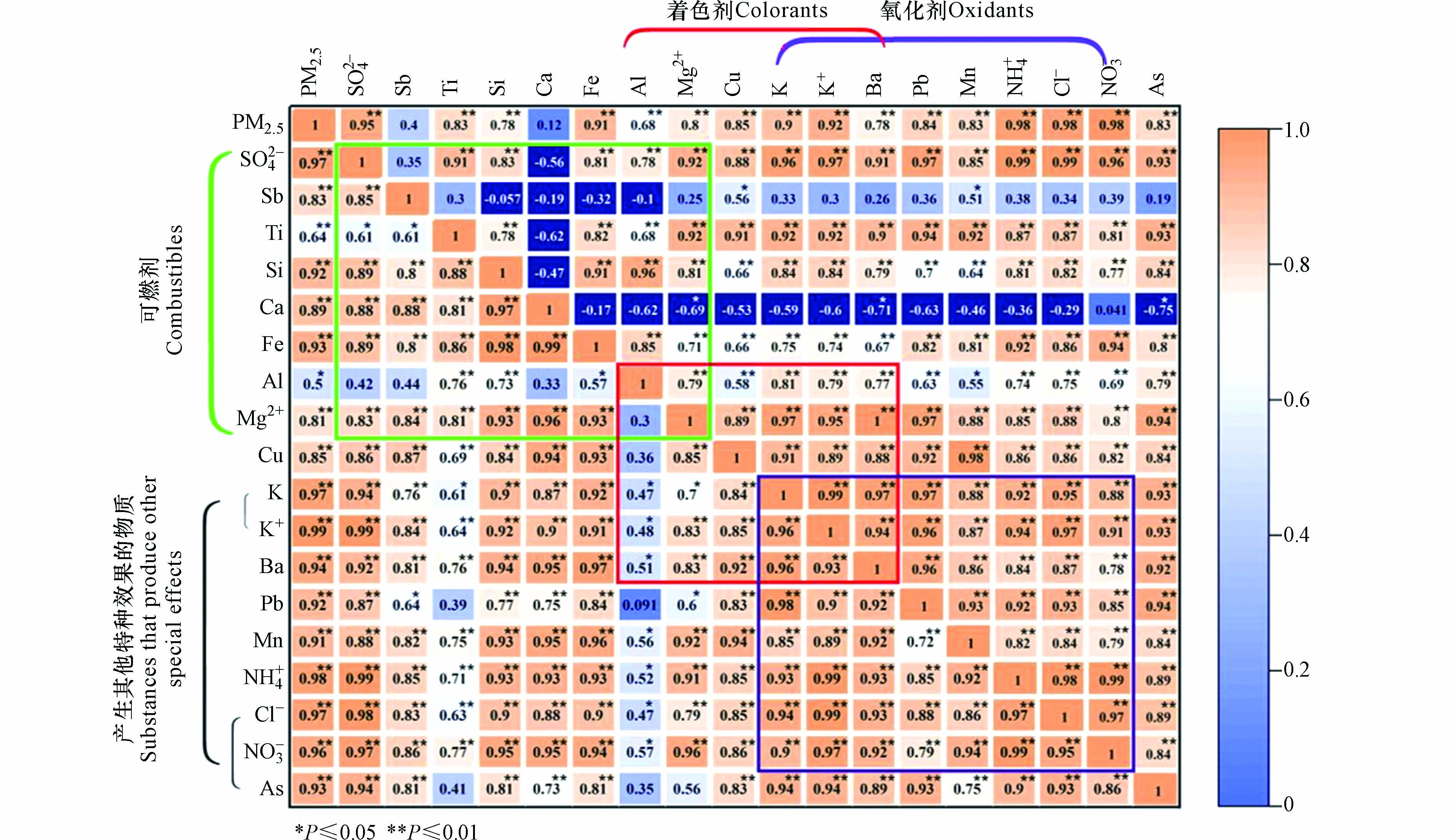
通过对获得的所有组分进行Pearson相关性分析,得到结果如图3所示,左下和右上分别为本研究期间非燃放期和燃放期各组分的相关性.
可燃剂(即通常所说的燃料)是烟花爆竹的最重要成分. 在本研究期间,燃放期只有元素Ca、Sb与PM2.5的相关性与非燃放期相比明显下降,从非燃放期的0.89、0.83(均P≤0.01)下降至0.12、0.40(均P>0.05). 而地壳元素Ti、Si、Ca、Fe、Al之间的相关性中只有Al与Si、Fe在非燃放期相关系数由0.73(P≤0.01)、0.57(P≤0.05)迅速上升为燃放期的0.96、0.85(均P≤0.01),达到高度相关,而其余各元素之间相关性均下降. 由前面的论述可知,燃放期Si、Fe、Ca浓度下降,说明Al浓度的升高及Al与其他组分(SO42−、Mg2+)相关性的增强可以排除扬尘的影响,可能为烟花爆竹中加入铝粉及铝合金粉作为可燃剂所致. 燃放期元素Sb与其余可燃剂组分的相关系数显著下降,相关性均较低(R<0.40,P>0.05),表明宝鸡燃放的烟花爆竹中很少加入Sb相关化合物作为可燃剂,Sb存在其他来源.
当烟花爆竹点燃后,氧化剂为燃烧提供所需的氧. 燃放期Cl−、NO3−、NH4+与PM2.5的相关性较非燃放期持平或上升,K+、Pb、K、Mn、Ba与PM2.5的相关性较非燃放期下降,说明Cl−、NO3−、NH4+是主要污染物,且三种离子之间高度相关(R>0.95,P≤0.01),有着相同的形成过程和相同的变化趋势,具有同源性. 因K+被认为是烟花爆竹燃放的标识性元素,研究发现,非燃放期K+与Pb、K、Ba的相关系数由0.90、0.96、0.93(均P≤0.01)上升为燃放期的0.96、0.99、0.97(均P≤0.01),存在强线性相关,说明他们有共同的来源,且主要来源于烟花爆竹的集中燃放. 而Mn与各组分在燃放期的相关性发生下降,因为Mn除了可以作为氧化剂相关组分,还来源于土壤二次扬尘,这与前面分析结果一致,说明燃放期受扬尘的影响下降.
着色剂是使火焰着色的物质. 镁和铝相关化合物既充当了可燃剂也可以作为着色剂. 燃放期,着色剂相关组分中只有Al与PM2.5的相关性(R=0.68,P≤0.01)较非燃放期(R=0.50,P≤0.05)上升,表明燃放期Al对PM2.5浓度的贡献更大. 但是Al与其他着色剂的相关性整体弱于Al与其他可燃剂组分的相关性,说明Al有关物质可能主要在烟花爆竹中充当可燃剂的作用;而Mg2+与其他着色剂的相关性整体强于它与其他可燃剂组分的相关性,说明Mg有关物质主要充当着色剂的作用. 而K、K+、Cu、Ba四者的相关系数范围为0.88—0.99(P≤0.01),达到了高度相关,具有同源性可以用来指示烟花爆竹的燃放,这与Kong等[47]的研究结果一致.
粘合剂等有机物在剧烈氧化还原反应下,反应生成CO2和H2O. 除此之外,有时会根据要求和需要添加能产生其他某种特种效果的物质. 从图3可以看出,在显著性水平0.01前提下,燃放期Cl−、NO3−与PM2.5的相关性较非燃放期上升,K+、As、K与PM2.5的相关性较非燃放期下降,说明燃放期Cl−、NO3−对PM2.5浓度的贡献更大. 而As与其他几种相关组分的相关性低于K+、K与其他组分的相关性,可能是因为As属于禁用药物,只可用于烟雾类烟花爆竹,与其他组分存在不同的来源.
综上,部分组分燃放期的相关性明显升高,如Al、Mg2+、K+、K、Ba等,这是因为烟花爆竹中通常加入铝粉及铝合金粉作为可燃剂,Mg2+、K+、K、Ba相关物质作为着色剂所致. 但是部分组分相关性却降低,如Sb、Ca、As等,这是由于不同种类的烟花爆竹对成分有不同要求,如As化合物在礼花弹中是禁用药物,但是却可以用在烟雾类产品中.
-
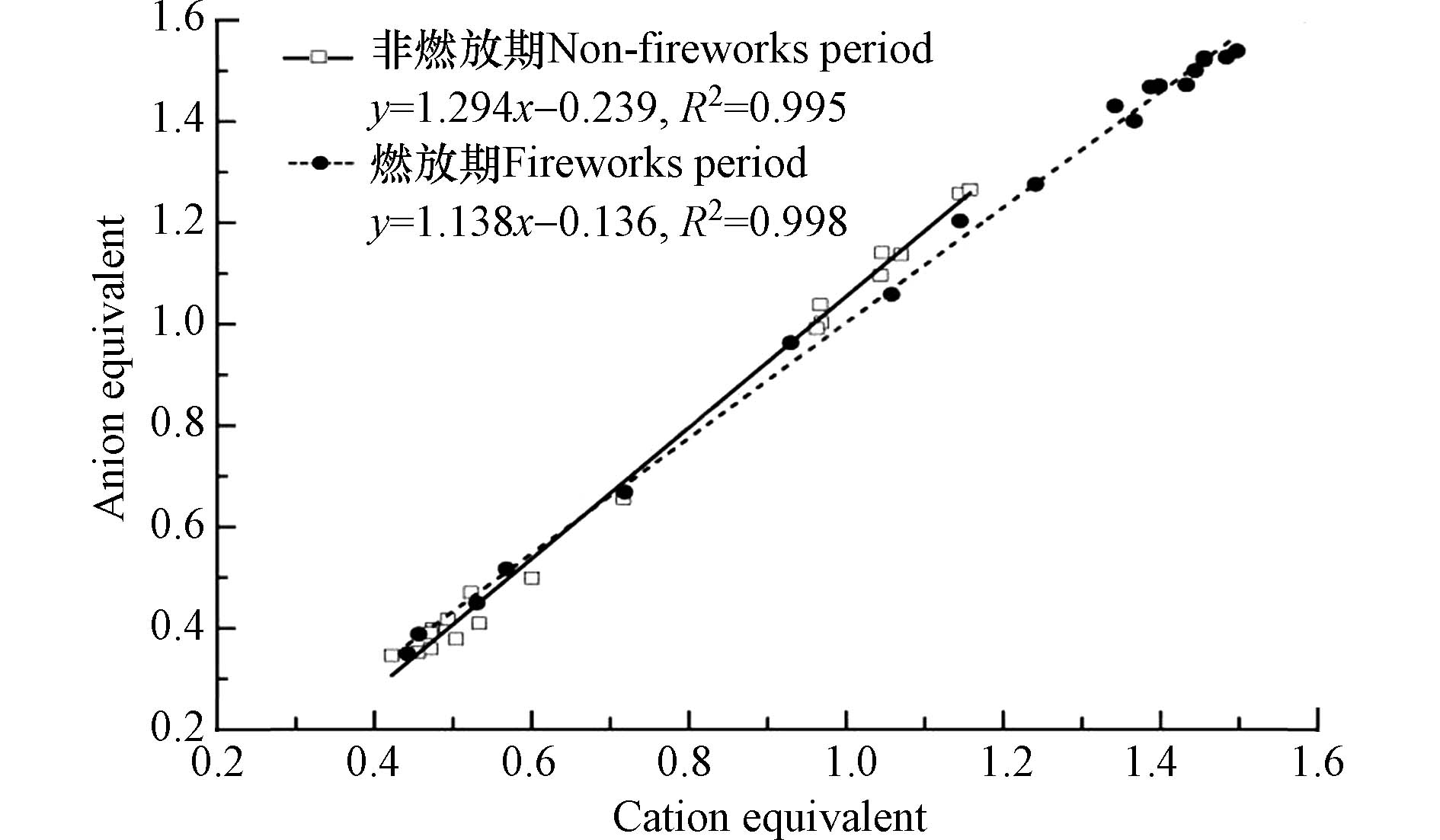
由图4可知,在所研究时段内阴阳离子相关性高达0.99,非燃放期和燃放期阴阳离子平衡的斜率分别为1.29和1.14,说明阴离子当量与阳离子当量的比值大于1,颗粒物呈偏酸性,且燃放期PM2.5的酸性减小,这与相关研究结果一致,在秋冬季随着污染加重,PM2.5的酸性减小[21]. 燃放期SOR、NOR分别为0.74和0.53,而非燃放期分别为0.51、0.34,与非燃放期相比转化率有明显的升高,且二次无机颗粒物在PM2.5中的占比由非燃放期的39.7%上升至燃放期的45.0%,说明烟花爆竹的燃放会促进SO2、NO2向SO42−和NO3−转化,相较于非燃放期酸性离子SO42−和NO3−含量更为丰富.
-
二次无机颗粒物为颗粒物中主要的水溶性离子,有多种存在形式,可以以NH4NO3、NH4HSO4或(NH4)2SO4等形式存在. NH4+和SO42−的质量比在一定程度上能够反映两种离子的结合方式. 当NH4+/SO42−比值小于等于0.19时,主要以NH4HSO4的形式存在;当比值大于等于0.38时,主要以(NH4)2SO4的形式存在[48]. 从表5可知,采样期间燃放期和非燃放期NH4+/SO42−比值均高于0.38,由前面分析可知NH4+与SO42−和NO3−的相关性较好,说明宝鸡市春节采样期间二次无机颗粒物主要以(NH4)2SO4、NH4NO3形式存在,这与宝鸡市秋季污染时段主要的存在形式一致[49].
-
根据US EPA推荐的健康风险评估模型,估算研究时段内宝鸡市烟花爆竹燃放期儿童、成年女性、成年男性经呼吸暴露途径的重金属暴露剂量、非致癌风险和致癌风险,研究中的Cr浓度为总Cr浓度,但US EPA将其中的Cr(Ⅲ)列为非致癌物、Cr(Ⅵ)列为致癌物,而Cr(Ⅲ)与Cr(Ⅵ)之比是6∶1,所以本研究Cr(Ⅵ)的浓度取总Cr浓度的七分之一[50]. Ni有多种化合物如NiO、NiS、Ni(OH)2、NiSO4等,NiS是其中致癌性最强的一种,按照测量值的50%进行估算[51]. 结果如表6和表7所示.
烟花爆竹燃放期,宝鸡市PM2.5中重金属非致癌风险均呈现出儿童>成年男性>成年女性的趋势,儿童的非致癌风险分别是成年男性和成年女性的1.83、1.98倍,成年男性的非致癌风险是成年女性的1.08倍. 对于所有的人群而言,重金属非致癌风险的顺序一致:Mn > Co > Pb > Cu > V > Cr > Cd > Sb > As > Ba > Ni,且单一重金属元素暴露的非致癌风险和多种重金属元素暴露的非致癌风险均小于1,说明重金属非致癌风险小,可以忽略.
烟花爆竹燃放期,宝鸡市PM2.5中重金属致癌风险呈现出与非致癌风险完全不同的趋势:成年男性>成年女性>儿童,成年男性的致癌风险分别是成年女性和儿童的1.06、3.19倍. 对于所有的人群而言,重金属致癌风险按照As > Cr > Cd > Co > Ni逐渐减小. Cd、Co对儿童、Ni对所有人群的致癌风险<10−6,不具备致癌风险;As、Co、Cr和Cd对成年人的致癌风险及As和Cr对儿童的致癌风险均在10−6—10−4之间,可能存在一定的致癌风险;多种重金属元素暴露的致癌风险在10−6—10−4之间,说明存在一定的致癌风险.
-
(1)通过对研究期间宝鸡市颗粒物浓度时间变化序列的研究,发现烟花爆竹会加重空气污染程度,使PM10、PM2.5浓度明显升高,分别是非燃放期的1.2倍和1.3倍. 大多数离子和元素浓度都随之增长.
(2)相关性分析表明,燃放期Mg2+、K+、Al、K、Ba等组分之间的相关性明显升高,但Ca、As、Sb等组分的相关性却降低,呈弱正相关或负相关,说明烟花爆竹会根据不同的需求加入不同的组分. 烟花爆竹燃放期与非燃放期阴阳离子当量比值均小于1,颗粒物呈酸性;烟花爆竹的燃放会促进SO2、NO2向SO42−和NO3−转化,SOR和NOR由非燃放期0.51和0.34增长为燃放期的0.74和0.53,燃放期酸性离子SO42−和NO3−含量更为丰富.
(3)烟花爆竹燃放期,宝鸡市PM2.5中经呼吸途径暴露的重金属非致癌风险均呈现出儿童>成年男性>成年女性;且风险值均小于1,说明重金属非致癌风险小. 重金属致癌风险按照As > Cr > Cd > Co > Ni逐渐减小,呈现成年男性>成年女性>儿童,其中Cd、Co对儿童,Ni对所有人群均不具备致癌风险;As、Co、Cr和Cd对成年人,As和Cr对儿童存在一定的致癌风险.
(4)为防止燃放烟花爆竹带来的环境污染和对身体带来的危害,建议在春节、婚宴等节日使用烟花爆竹的替代品,如电子鞭炮等.
烟花爆竹燃放事件对宝鸡市空气质量的影响及健康风险评估
Impact of fireworks displays events on air quality and health risk assessment in Baoji
-
摘要: 基于宝鸡市2020年春节期间高时间分辨率大气颗粒物及主要化学组分数据(包括PM10、PM2.5、水溶性离子和重金属元素等),针对燃放烟花爆竹对关键污染组分的影响及重金属呼吸暴露健康风险评价进行了分析. 结果表明,烟花爆竹燃放期和非燃放期PM2.5质量浓度均值分别为168.6 μg·m−3和125.4 μg·m−3. 其中浓度升高较为明显(增长倍数>1)的组分为Mg2+、Ba、K和K+,从非燃放期的71.1、16.7、980.0 ng·m−3和1.26 μg·m−3,升高至609.0、140.7、2907.6 ng·m−3和2.61 μg·m−3. 相较于非燃放期,燃放烟花爆竹期间SO2和NO2二次无机转化提高,酸性离子SO42−和NO3−含量更为丰富;二次无机离子在细颗粒物中的占比由非燃放期39.7%增高至燃放期45.0%. 相关性分析可以发现,Al、Mg2+、K+、K和Ba等组分燃放期相关性明显升高,但是有一部分组分(如Sb、Ca、As等)相关性却降低,这归因于烟花添加物质不同. 利用健康风险评估模型,发现重金属非致癌风险呈现出儿童>成年男性>成年女性,风险值均小于1,说明对人体健康影响较小;而重金属致癌风险呈现:成年男性>成年女性>儿童,多种重金属元素暴露的致癌风险在10−6—10−4之间,存在一定的致癌风险. 烟花爆竹燃放不仅会引起空气质量恶化,还会对人体造成一定的危害. 因此,烟花爆竹禁燃对改善城市空气质量至关重要.Abstract: Based on the measurements of atmospheric particulate matter and the major chemical components (including PM10, PM2.5, water-soluble ions, and heavy metal elements) during the Spring Festival in Baoji in 2020, the variations of major components, effects of fireworks, and the health risk evaluation of heavy metal respiratory exposure were analyzed with high temporal resolution data. The results showed that the average concentrations of PM2.5 were 168.6 μg·m−3 and 125.4 μg·m−3 during fireworks displays and non-fireworks period, respectively. The concentrations of Mg2+, Ba, K and K+ were increased significantly (growth multiple >1) from 71.1, 16.7, 980.0 ng·m−3 and 1.26 μg·m−3 during non-fireworks period, to 609.0, 140.7, 2907.6 ng·m−3 and 2.61 μg·m−3 during fireworks period. The secondary inorganic conversion of SO2 and NO2 increased during the firework period, and heightened contributions of SO42− and NO3− were observed. The proportion of secondary inorganic ions increased from 39.7% (non-fireworks period) to 45.0% (firework period) in fine particulate matter. The correlations among Al, Mg2+, K+, K, and Ba increased significantly during the firework period, while these for some components (e.g., Sb, Ca, As, etc.) decreased, which may be attributed to the material added. By using the health risk assessment model recommended by the US EPA, the non-carcinogenic risk of heavy metals elements showed that: child > adult male > adult female, and the risk values were less than 1, indicating the impact on human health was small. The carcinogenicity risk of heavy metal was as follows: adult male > adult female > children. The carcinogenic risk of exposure to multiple heavy metal elements was between 10−6 and 10−4 with a certain carcinogenic risk. Fireworks can not only cause air quality deterioration but also cause certain harm to health. Therefore, the establishment of strict measures to ban the fireworks is crucial to improving urban air quality.
-
Key words:
- Baoji /
- fireworks displays period /
- non-fireworks period /
- PM2.5 /
- health risks.
-
纳米银(silver nanoparticles, AgNPs)是三维空间中至少有一维处于1—100 nm的单质银颗粒[1],其拥有高效、广谱的杀菌性能,因此广泛应用于医药、食品、化妆品、纺织品等领域[2]. 随着近年来AgNPs技术的不断发展[3],越来越多的AgNPs产品在生产、使用和废弃过程中释放进入水环境[4-5],并对水生生物产生毒害[6],因此有必要深入了解其环境归宿及潜在危害.
AgNPs化学性质活泼,进入水环境后很容易在氧气(O2)和质子(H+)的作用下发生氧化溶解,释放出银离子(silver ions, Ag+)[7]. 由于银的氧化还原电位适中(Ψ(Ag+/Ag0=0.80 V)),自然界中Ag+也可被环境中普遍存在的天然有机质以及一些动物、植物和微生物等还原成零价的AgNPs[8-10]. 因此,水环境中AgNPs与Ag+会相互转化,呈高度动态性. 而由于形态不同,AgNPs和Ag+的毒性效应存在较大差异[11-12]. 例如,虽然AgNPs和Ag+都会对蚯蚓产生细胞毒性,但Ag+主要积聚在含胞质溶胶的部分,而AgNPs主要破坏细胞膜隔室[13]. 此外,AgNPs和Ag+的生物利用度及在生物体的富集过程也存在差异[14-15]. 因此,研究水环境中的AgNPs与Ag+的转化过程对评估AgNPs的生态风险具有重要意义.
溶解性有机物(dissolved organic matter, DOM) 是一类广泛存在于自然水体,由各种活性有机物(如腐殖酸(humic acid, HA)和富里酸(fluvic acid, FA)、蛋白质、多糖和胞外聚合物(extracellular polymeric substances, EPS))组成的非均质复合物[16]. DOM具有多种活性官能团,如硫醇(—SH)、醇/酚羟基(—OH)、醛、羰基、酮、醚基、羧基(—COOH)、胺和甲氧基等,因此其具有较强的氧化还原性,能够介导水体中重金属的迁移转化、毒性和生物利用度的改变[17-18].
现有研究表明,DOM是影响AgNPs和Ag+相互转化的重要因素之一[19-21]. 然而DOM对AgNPs/Ag+的氧化还原存在双面性[22-24],既可氧化AgNPs释放Ag+,又可还原Ag+生成AgNPs,因此,在含有DOM的水环境中AgNPs/Ag+如何转化,环境风险会有多大,目前仍难以预测.
本文首先介绍了DOM促进/抑制AgNPs氧化溶解的机理,然后阐述了DOM还原Ag+形成AgNPs的机理,在此基础上总结了环境因素对DOM介导AgNPs与Ag+相互转化的影响. 最后提出了目前研究存在的不足,并为未来研究方向提供一定的建议.
1. DOM对纳米银转化为银离子的影响(The effect of DOM on the conversion of silver nanoparticles into silver ions)
1.1 DOM抑制AgNPs氧化释放Ag+
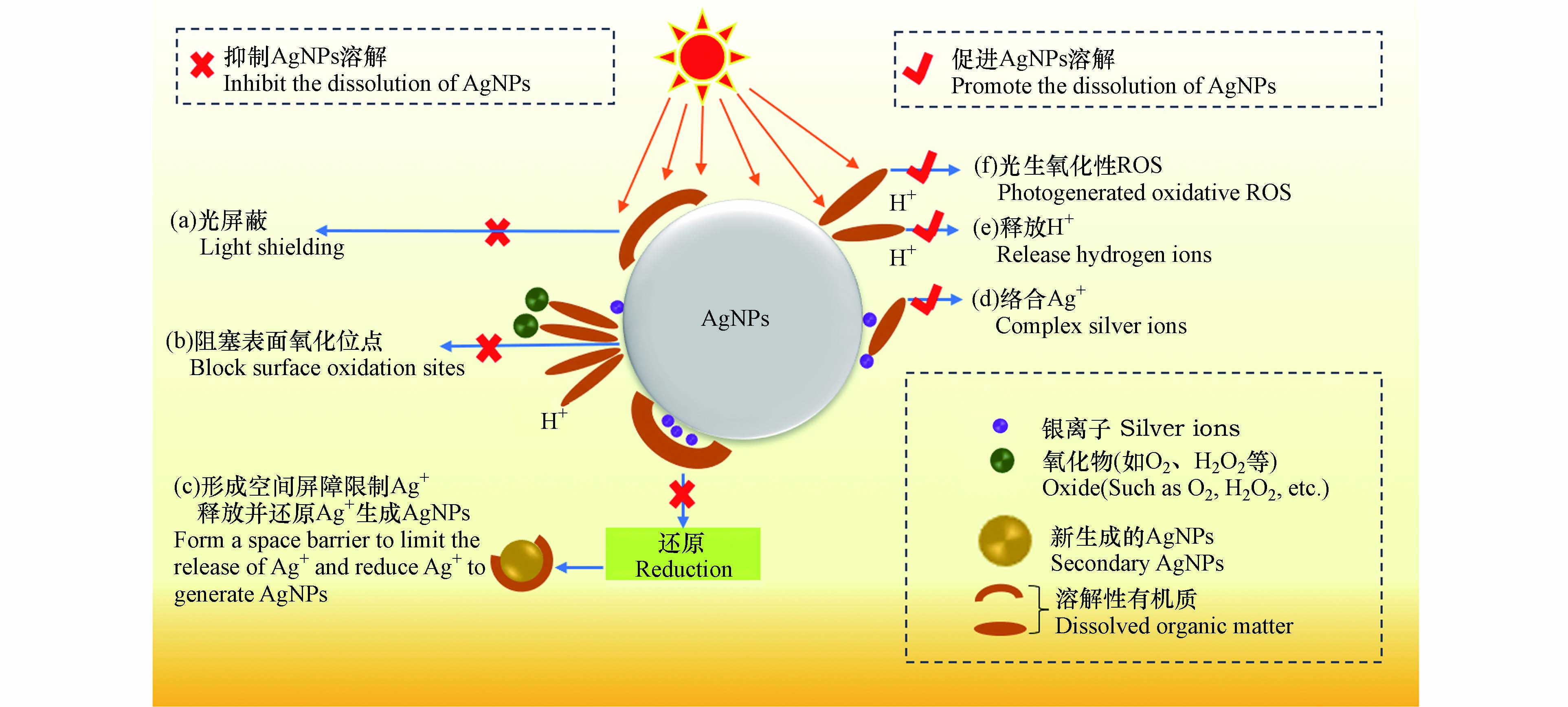
DOM可通过氢键、静电引力、疏水性作用、配体交换和离子架桥等方式吸附在无涂层AgNPs、聚乙烯吡咯烷酮包埋的AgNPs(PVP-AgNPs)或柠檬酸盐包埋的AgNPs(Cit-AgNPs)表面,改变其界面特性,进而影响AgNPs的溶解速率及溶解平衡[25-26]). 多数研究表明,DOM在AgNPs表面的吸附抑制了AgNPs的氧化溶解和Ag+的释放,其机理可总结为以下3点:
(a)吸附在AgNPs表面的DOM会屏蔽AgNPs对光子的吸收,进而抑制AgNPs的氧化蚀刻及Ag+释放[27-28]. Zhang等[29]研究发现,由于光屏蔽效应,AgNPs在含有聚苯乙烯微塑料溶液中光氧化释放的Ag+浓度显著低于纯水环境.
(b)阻塞AgNPs表面活性位点并降低其与水体氧化剂(如O2、H2O2和·OH)及H+的反应性[30],这是DOM抑制AgNPs氧化溶解的主要机理. Li等[31]发现,AgNPs的氧化与DOM在其表面的覆盖率呈反比,当全氟羧酸在Cit-AgNPs表面覆盖率为0、20%和50%时,Ag+释放量分别为35.5、31.4、18.8 µg·L−1.
(c)形成物理屏障限制AgNPs表面的Ag+扩散到溶液中,并将氧化释放的Ag+还原为新的AgNPs[32-33]. Fernando等[34]研究发现,HA介导下AgNPs在短时间内释放大量的Ag+,然而在较长时间后,溶液中Ag+会被还原成AgNPs,导致溶液中Ag+浓度降低.
1.2 DOM促进AgNPs氧化释放Ag+
DOM也可促进AgNPs氧化释放Ag+. 如Ostermeyer、Zhang和Yang [35-37]等研究发现,添加600 mg·L−1的牛血清白蛋白、10 mg·L−1的HA和总有机碳含量(Total Organic Carbon, TOC)为10 mg·L−1 C的EPS后,溶液中Ag+含量分别是未加DOM时的2倍、2.5倍和3倍. DOM促进AgNPs氧化溶解的机理可总结为以下3点:
(a)DOM可通过官能团(如—COOH、—OH和—SH等)与AgNPs、Ag2O相互作用形成复合物,削弱Ag—Ag键和Ag—O键,从而促进Ag+的释放[38]. 而且,DOM还可以通过与吸附在AgNPs表面的Ag+络合,使反应(1)平衡右移,促进AgNPs氧化溶解[39].
4Ag0+O2+4H+⇌Ag++2H2O (1) Gondikas等[40]发现,半胱氨酸(cysteine, Cys)能通过—SH与AgNPs释放的Ag+配位结合,促进溶液中AgNPs的氧化溶解.
(b)DOM中含量较多的酸性官能团(如羧基和酚羟基等)在水环境中会电离释放H+,较高的H+浓度会促进AgNPs表面氧化层的溶解,释放Ag+[41]. Zhang等[36]研究发现,HA在溶液中的酸释放促进了AgNPs的氧化溶解. 虽然吸附在AgNPs表面的DOM一定程度上阻碍了AgNPs与O2和H+的相互作用,但吸附层是可渗透的,AgNPs依然可与O2和H+反应[31].
(c)DOM具有很强的光化学活性,其在光照下可生成H2O2、1O2和·OH等强氧化性的活性氧物质(reactive oxygen species, ROS),氧化AgNPs[42]. Tong等[43]证实了光照下聚苯乙烯微塑料产生的1O2和·OH可诱导AgNPs氧化溶解.
DOM介导下促进/抑制AgNPs氧化释放Ag+的机理可总结为图1.
1.3 环境条件对DOM介导AgNPs氧化释放Ag+的影响
1.3.1 DOM/Ag浓度(物质的量)比
DOM/Ag浓度(物质的量)比会影响DOM对AgNPs表面活性位点的占用以及DOM-Ag配体的形成,进而影响AgNPs的氧化溶解. 一般来说,当DOM/Ag较高时,DOM会占据AgNPs更多反应活性位点,抑制AgNPs与O2和H+作用,Ag+释放显著减少[44]. 当系统中萨旺尼河腐殖酸(Suwannee River humic acid, SRHA)的TOC浓度由0增加至6.6 mg·L−1C时,2.78 mg·L−1的AgNPs释放Ag+浓度由1383 µg·L−1降低至339 µg·L−1[45]. 同样,Ag+的释放也随其他组分DOM(如多糖、蛋白质和胞外聚合物等)浓度的增加而显著降低[46-48].
而当DOM/Ag浓度比较低时,DOM占据AgNPs表面活性位点较少,其还可以通过鳌合Ag+而促进AgNPs氧化溶解[35]. Cáceres-Vélez等[49]研究发现,20 mg·L−1的HA促进了10 mg·L−1 AgNPs的溶解(DOM/Ag=2),而抑制了0.5、1、3 mg·L−1 AgNPs (DOM/Ag > 6)的溶解. Boehmler等[50]同样发现,当牛血清白蛋白浓度由0增加至2 nmol·L−1时,其可通过—SH鳌合Ag+使得粒径为10 nm的 Cit-AgNPs的溶解速率增加1.5倍.
1.3.2 DOM种类
DOM是非均质的混合物,其种类复杂,性质多变,如元素含量、官能团和芳香性会存在差异. 因此不同DOM种类作用下,AgNPs的氧化溶解差异明显. Gunsolus等[51]研究发现,小马湖富里酸(Pony Lake fluvic acid, PLFA)对Cit-AgNPs氧化溶解的抑制作用强于同样浓度的SRHA和萨旺尼河富里酸(Suwannee River fluvic acid, SRFA),进一步探究发现DOM介导下Ag+释放量与DOM的S、N含量呈负相关. 高S、N元素的DOM对AgNPs/Ag+有很强的亲和性,因此会占据更多AgNPs表面活性位点进而抑制AgNPs氧化溶解[52]. 而对Ag+有强亲和力的官能团也可促进AgNPs的氧化溶解. Liu[39]和Gondikas[40]均研究发现,DOM可通过—SH络合Ag+从而促进AgNPs的氧化溶解. 芳香性较强的DOM不会占据太多AgNPs的活性位点,进而增强AgNPs的反应性. Pokhrel等[53]研究发现,溶液中较高芳香性的风化褐煤腐殖酸(Leonardite humic acid, LHA)作用下Ag+释放量是无LHA条件下的4—5倍.
1.3.3 共存离子及浓度
离子浓度会影响DOM的分子结构,改变DOM在AgNPs表面的吸附[54],进而影响DOM介导的AgNPs氧化释放Ag+. 较低离子浓度下,DOM分子结构较膨胀,DOM在AgNPs表面的吸附会占据更多氧化位点,且许多环境阴离子(
CO2−3 SO2−4 PO3−4 在较高离子浓度环境中,DOM分子结构紧凑,吸附在AgNPs表面的DOM占据表面氧化位点较少,并且与释放的Ag+络合促进AgNPs氧化溶解[49, 57]. 高浓度的Cl−对AgNPs氧化溶解的影响最为显著[58]. 当Cl−/Ag <26750时,反应主要生成AgCl(s)沉淀;当Cl−/Ag ≥26750时,主要生成溶解性的配合物
AgCl1−xx AgCl2−3 AgCl3−4 AgCl1−x 阳离子(如Na+、Ca2+、Mg2+)会促使AgNPs聚集,减小比表面积,从而抑制AgNPs氧化释放Ag+[60]. 虽然有研究证明DOM抑制了AgNPs的聚集,但在二价阳离子(如Ca2+、Mg2+)作用下,吸附在AgNPs表面的DOM会通过络合Ca2+、Mg2+而桥连,发生更强烈的聚集,使Ag+释放量显著降低[61]. Huang等[62]研究发现, AgNPs在HA与Ca2+共同作用下氧化释放Ag+的浓度依次低于其在HA作用下、Ca2+作用下和纯水中的Ag+释放量.
1.3.4 pH
pH会影响AgNPs向Ag+的转化过程,且会改变DOM在水体中的分子结构,影响DOM的光化学反应,因此pH显然会影响DOM介导下AgNPs的氧化溶解. 在低pH条件下溶液中H+含量较高,会促进AgNPs的氧化溶解平衡(反应式1)右移[63];并且低pH时DOM的分子结构较紧凑,占据AgNPs氧化位点较少,削弱了其对Ag+释放的抑制作用[64];此外,相比碱性条件下,酸性溶液中DOM光生氧化性自由基显著增加[65]. 因此,低pH条件下促进了AgNPs的氧化溶解;反之,高pH条件下会抑制Ag+的释放.
1.3.5 光照
AgNPs具有很强的光吸收能力,短时间光照会促进AgNPs的光裂解及氧化蚀刻,迅速释放Ag+. Shi等[28]研究发现,光照下三磷酸腺苷包埋的AgNPs会在短时间内(≤1 h)迅速氧化,其Ag+释放量显著高于黑暗条件. 但长时间光照会破坏AgNPs表面涂层,使AgNPs失稳聚集,表面活性位点减少,进而氧化速率降低. Yu等[32]研究发现在短时间光照(≤ 12 h)下,Cit-AgNPs的平均溶解速率常数是长时间光照(70 h)下的4.5倍,且AgNPs发生明显聚集.
光照会促进DOM介导的AgNPs氧化或降低DOM对AgNPs氧化溶解的抑制作用. Rong等[66]发现,当SRFA的浓度为0、5、10 mg·L−1时,10 min光照可使Cit-AgNPs氧化率分别比黑暗条件下提高了3.4%、4.6%和6.0%. Yu等[67]研究发现,黑暗条件下,TOC浓度为5 mg·L−1 C的SRHA使1.02 mg·L−1的AgNPs在20 h后的Ag+释放量由830 µg·L−1降至100 µg·L−1;而20 h的光照后,Ag+释放量由738 µg·L−1降至225 µg·L−1.
2. DOM对银离子转化为纳米银的影响(The effect of DOM on the conversion of silver ions into silver nanoparticles)
2.1 DOM介导Ag+还原生成AgNPs
在黑暗/光照条件下,DOM均可介导Ag+还原成AgNPs,其还原机理可概括为以下3点,见图2
(1)黑暗条件下的自催化. 溶液中游离的Ag+通过沉积在Ag2O/AgNPs簇表面进而提高其氧化还原电位(游离状态:Ψ(Ag+/Ag0 = −1.8 V);吸附在固态表面的Ag+:Ψ(Ag+/Ag0 = 0.7996 V),进而使DOM还原Ag+的反应在热力学上是可行的,如式(2,3)所示[68].
Ag+−Solidsurface+HA(red)→Ag0+HA(ox)E0=∼0.1Vvs.NHE (2) Ag+−Solidsurface+FA(red)→Ag0+FA(ox)E0=∼0.3Vvs.NHE (3) 自催化过程可以被描述为以下几个步骤[69]:
2Ag++2OH−→Ag2O+H2Ofast (4) Ag2O+(Ag+)n→Ag2O−(Ag+)nfast (5) Ag2O−(Ag+)n+DOM⇌Ag2O−(Ag+)n−DOMKad (6) Ag2O−(Ag+)n−DOM⇌Ag2O−(Ag+)n−1+Ag0+DOM−(ox)Kred (7) DOM首先发生脱质子化,然后通过静电作用/络合作用与Ag+结合[70-71],DOM-Ag复合物通过还原性官能团(如—COOH、—OH、—SH、醛基和酮基等)将e−转移给Ag+,生成AgNPs[39, 72].
(2)光照生成还原性自由基. 在光照条件下,DOM充当光吸收体,产生强还原性自由基(如
e−aq O•−2 O•−2 O•−2 O•−2 (3)光照条件下配体-金属电荷转移(ligand-to-metal charge transfer, LMCT). 当Ag+吸附到DOM表面后,光照促进DOM配体将e−转移至Ag+,进而生成AgNPs[75]. Hou等[76]研究发现,HA光还原Ag+生成AgNPs的速率随着溶液中Na+浓度的增加而显著降低,证实了Na+通过竞争HA表面金属离子结合位点进而抑制了HA通过LMCT还原Ag+.
2.2 环境条件对DOM介导Ag+还原生成AgNPs的影响
2.2.1 DOM浓度
DOM介导的AgNPs形成速率可由以下式子表示[74]:
r=k[Ag+][DOM] (8) r=(dA/dt)t→0 (9) 其中,r为AgNPs形成速率,单位h−1;[Ag+]为Ag+浓度,单位mg·L−1;[DOM]为DOM浓度,单位mg·L−1;A为AgNPs表面等离子体共振(Surface Plasmon Resonance, SPR)峰吸光度.
由于DOM介导的AgNPs/Ag+氧化还原是同时进行的,当DOM浓度一定时,需要足够的Ag+浓度才能实现AgNPs团簇的快速生长,这个浓度称为临界诱导浓度. 低于临界诱导浓度时,Ag+还原生成AgNPs不稳定,会马上被氧化,无法实现AgNPs团簇的生长[77];而高于该浓度时,AgNPs生成速率与DOM浓度呈正相关. Xiong等[78]研究发现,初始浓度为30 µg·L−1的Ag+无法被EPS被还原成AgNPs;而Yin等[79]研究发现,初始浓度为0.2 mmol·L−1的Ag+会随DOM浓度的升高而加速转化为AgNPs.
2.2.2 DOM组分
不同组分DOM的性质差异(比如对Ag+的吸附能力、芳香性、分子量和官能团)会影响DOM介导的Ag+还原成AgNPs. 高Ag+吸附性的DOM能更好地通过LMCT还原Ag+. Liu等[75]比较了吸附性很强的溶解性黑炭和吸附性较弱的SRHA对Ag+的光还原能力,发现溶解性黑炭介导的AgNPs生成速率显著高于SRHA. Nie等[80]研究发现,DOM的芳香成分会限制Ag+与DOM的还原性官能团结合. 低芳香性的泥炭HA 和泥炭FA可在24 h内介导Ag+还原成AgNPs;而同等浓度的高芳香性商用HA需要120 h才能介导Ag+还原成AgNPs. 由于低分子量的DOM光屏蔽能力较弱,Guo等[81]研究发现,分子量<3 kDa的DOM作用下Ag+光还原效率远高于>3 kDa DOM. 此外,DOM官能团的还原性会影响Ag+的还原. Nie等[80]研究发现,酚基比羰基具有更强的还原性,其利用NaBH4将羰基转化为酚基后,发现DOM介导的AgNPs生成速率和浓度均显著增加.
2.2.3 共存离子及浓度
环境共存离子会影响Ag+还原为AgNPs. 其中环境中常见的阴离子如
CO2−3 SO2−4 PO3−4 SO2−4 CO2−3 PO3−4 此外,一些具有光敏性的银盐(如AgCl)被认为是AgNPs的前体物质,在光照下其会激发出从价带跃迁到导带的电子e−,e−通过界面电子转移至AgCl表面的Ag+,从而生成AgNPs[83]. Cl−介导下Ag+还原可以由以下式子表示[84]:
AgCl(aq)+hѵ→h++e− (10) Ag++e−→Ag0 (11) 离子浓度对Ag+转化成AgNPs影响很大. 当离子浓度较低时(如Cl−/Ag+ ≤5000),Cl−与Ag+结合主要生成AgCl,在光照下可被还原成AgNPs;而在高离子浓度下(Cl−/Ag+ > 1.8×105),则AgCl会转化为光活性较弱的
AgCl1−xx 环境中常见的阳离子(如Ca2+、Mg2+、Na+、Fe2+和Fe3+)也会影响环境中Ag+转化为AgNPs. 如在光照下DOM会与Fe2+/Fe3+形成氧化还原循环,催化DOM对Ag+的还原,如化学式(12—14)所示[85]. Yin等[86]研究表明,添加10 µmol·L−1的Fe2+/Fe3+可使DOM-Ag+溶液中还原生成的AgNPs浓度显著增加.
DOM+O2hѵ→DOM·++O·−2 (12) Fe3++O·−2→Fe2++O2 (13) Fe2++Ag+→Fe3++Ag0 (14) Ca2+、Mg2+和Na+等阳离子的存在会竞争DOM表面的吸附位点,抑制DOM对Ag+的吸附及还原,并且这些阳离子会压缩AgNPs表面的双电层,使其失稳聚集,导致溶液中AgNPs浓度降低[87]. Yin等[79]研究发现,溶液中 Ca2+浓度越高则DOM还原Ag+生成的AgNPs浓度越低,且AgNPs的粒径显著增大. 而其他贵重金属离子如(Au3+)对应的纳米粒子具有较高的内聚能,成核速率较快,因此这类金属会优先与DOM作用并生成相应的纳米粒子,吸附Ag+在其表面并提供成核位点,促进了Ag+转化为AgNPs[88].
2.2.4 pH
DOM还原Ag+受溶液pH影响显著. 随着pH的升高,DOM的氧化还原电位逐渐降低,这促进了Ag+转化为AgNPs[74];而且高pH条件下DOM的酸性官能团去质子化,其表面电性更负,带正电的Ag+与带负电的DOM之间的强静电引力增强了Ag+与DOM络合,促进了光照条件DOM通过LMCT途径还原Ag+或黑暗条件下DOM通过给电子官能团还原Ag+[76].
2.2.5 光照
黑暗条件下DOM还原Ag+需要很高的活化能,而光照可以加快DOM介导的Ag+还原生成AgNPs速率[89]. 光照可作为AgNPs生成的催化剂,既会诱导DOM产生
O•−2 e−aq 鉴于研究DOM介导AgNPs/Ag+转化会得到DOM促进/抑制AgNPs氧化释放Ag+以及还原Ag+生成AgNPs 3种不同的结论,可能源于这些研究中设计的特定实验条件影响了DOM对
Ag0⇄Ag+ 表 1 DOM介导下的AgNPs氧化或Ag+还原条件汇总Table 1. Summary of AgNPs oxidation or Ag+ reduction conditions mediated by DOM离子Ion Ag初始浓度Initial concentration of Ag species DOM种类及初始浓度DOM species and initial concentration 光照Illumination state pH 时间Time 结果Result 参考文献Reference 0.08—16.67 mg·L−1 盐度天然水 5 mg·L−1 AgNPs 3.8—7.2 mg·L−1 C 天然水体DOM 黑暗 — 7 d 高盐度↑低盐度↓ Li et al., 2020[57] 0、0.01、0.1、0.3 mol·L−1 NaCl 1 mg·L−1 AgNPs 1.5—2 mg·L−1 C 天然水体DOM — 5.5 168 h ↑/↓ Zhao et al., 2021[56] — 20 mg·L−1 Ag+ 5—20 mg·L−1 C HA 光暗交替 7 96 h 光: ←;暗:↑ Liu et al., 2020[92] 7 mmol·L−1 NaHCO310 mmol·L−1 NaNO3 8 µmol·L−1 AgNPs 400 µmol·L−1 Cys — 7.5— 8.1 50 h ↑ Gondikas et al., 2012[40] 280 mg·L−1 CaCO3 10 mg·L−1 AgNPs 2—20 mg·L−1 LHA — 7 4 h ↑ Pokhrel et al., 2014[53] — 1.08 mg·L−1 AgNPs 0—10 mg·L−1 C EPS 132 W·m−2 Xe灯 7.1 72 h ↑ Yang et al., 2021[37] 柠檬酸盐缓冲液 1 mg·L−1 AgNPs 0—2 nmol·L−1 BSA — 6.5 4 h ↑ Boehmler et al., 2020[50] 硼酸盐、硝酸根 20 mg·L−1 AgNPs 20 mg·L−1 PS MPs 550 W·m−2 Xe灯/黑暗 5.5 72 h ↑ Tong et al.,2022[43] 硼酸盐、硝酸根 20 mg·L−1 AgNPs 20 mg·L−1 PS MPs 550 W·m−2 Xe灯/黑暗 8.5 24 h ↓ Zhang et al.,2021[29] 0.1 mmol·L−1 KH2PO4 500 µg·L−1 AgNPs 0.1—10 µmol·L−1 Cys — 7 72 h ↓ Afshinnia et al., 2018[52] 人工介质ASW38 1 µg·L−1 AgNPs 0—50 µmol·L−1 BSA 自然光 8 15 h ↓ Levak et al., 2017[47] — 1.02 mg·L−1 AgNPs 5 mg·L−1 C SRHA 550 W·m−2 Xe灯/黑暗 5—8.3 48 h ↓ Yu et al., 2014[67] 0.1 mol·L−1 KH2PO4 5 mg·L−1 AgNPs 10 mg·L−1 PLFA、SRHA、 SRFA — 7 5 h ↓ Gunsolus et al., 2015[51] 硼酸盐缓冲液 1—1000 µg·L−1 Ag+ 25 mg·L−1 SRHA 黑暗 6—9 2 d ← Dong et al., 2019[82] 0—150 mg·L−1 NaCl 5 mg·L−1 Ag+ 20、40 mg·L−1 EPS 荧光灯/黑暗 8 36 h ← Xiong et al., 2021[78] 0—10 µmol·L−1 Fe2+/Fe3+ 1 mmol·L−1 Ag+ 30 mg·L−1 DOM 550 W·m−2Xe灯 6.3 8 h ← Yin et al., 2017[86] 12.7 mg·L−1 NaCl 10 mg·L−1 Ag+ 50 mg·L−1 DBC/SRHA 50 W Xe灯 7.3 2 h ← Liu et al., 2021[75] 磷酸盐–硼酸盐缓冲液 1 mmol·L−1 Ag+ 15—100 mg·L−1 HA 黑暗 8 5 d ← Nie et al., 2020[80] — 0.2 mmol·L−1 Ag+ 20 mg·L−1 C EPS Xe灯/黑暗 7.6 16 h ← Zhang et al., 2016[90] 注:↑,↓分别表示促进和抑制Ag+释放;←表示促进Ag+还原生成AgNPs;-为文献未提及该因素;PS MPs代表聚苯乙烯微塑料;DBC代表溶解性黑炭;BSA代表牛血清白蛋白. Note:↑ and ↓ respectively promote and inhibit the release of Ag+;← means promoting Ag+ reduction to generate AgNPs; - is not mentioned in the literature; PS MPs stands for polystyrene microplastics; DBC stands for dissolved black carbon; BSA stands for bovine serum albumin. 3. 结语(Conclusions and recommendations for further work)
目前研究表明DOM可通过占据氧化位点、还原Ag+、光衰弱来抑制AgNPs氧化,或释放H+、络合Ag+和光生氧化性ROS来促进Ag+释放,还可以通过自催化、光生还原性ROS和LMCT等途径将Ag+还原成AgNPs. 而环境因素(如DOM组分及浓度、AgNPs/Ag+浓度、离子、光照和pH等)会影响AgNPs/Ag+的转化过程,因此判断真实环境中DOM介导下AgNPs/Ag+的转化方向是比较困难的. 鉴于目前银基抗菌产品的市场在世界范围内进一步扩大,这将导致AgNPs与Ag+释放到生态环境中,并对生态系统和人体健康造成潜在危害,因此迫切需要更科学的理论基础去预测和评估其环境及健康风险.
目前DOM存在下AgNPs氧化/Ag+还原是AgNPs研究领域的热点之一,研究仍存在一些问题值得今后进一步研究:
(1)从表1可以看出,反应条件会显著影响DOM介导的AgNPs氧化及Ag+还原过程,区分和量化各种反应条件对这些过程的影响[26],将有利于判定AgNPs与Ag+转化的进行.
(2)光照对DOM介导的纳米银/银离子转化过程具有重要的影响,光照既可促进纳米银转化为银离子,也可促进Ag+还原生成纳米银,因此难以预测在现实环境中光暗交替下纳米银/银离子转化,未来可加强这方面的研究.
(3)目前关于DOM与AgNPs相互作用的研究存在使用的DOM模型简单(常将HA/FA作为DOM模型)的问题[93]. 未来研究中应考虑研究其他DOM组分(如溶解性黑炭[94]和人工合成类DOM)与AgNPs/Ag+相互作用的效应及作用机理.
(4)AgNPs粒径、形貌和表面包被等对AgNPs氧化溶解的影响已研究得较为透彻,但目前尚不清楚在DOM存在的条件下AgNPs粒径、形貌和表面包被会怎样影响DOM与AgNPs的相互作用及AgNPs的氧化溶解. 今后可研究上述因素与DOM耦合作用下的AgNPs氧化溶解,并深入探究其机理.
-
表 1 经呼吸途径进入人体的暴露参数
Table 1. Parameters of exposure that enter the human body through the respiratory route
参数Parameters 意义Meanings 单位Units 儿童Children 成年女性Adult female 成年男性Adult male C 重金属元素的浓度 mg·m−3 — — — InhR 呼吸速率 m3·d−1 7.6 14.5 18 EF 暴露频率 d·a−1 180 180 180 ED 持续暴露时间 a 6 24 24 BW 平均体重 kg 15 56.8 65 AT 非致癌物质平均暴露时间 d ED×365 ED×365 ED×365 AT 致癌物质平均暴露时间 d 70×365 70×365 70×365 表 2 通过呼吸途径进入人体的元素的反应参数
Table 2. Reaction parameters of elements that enter the human body through the respiratory pathway
元素Element 风险Risk 参考剂量/(mg·(kg·d)−1) RfD 经呼吸暴露的致癌斜率系数/((kg·d)·mg−1)SF V 非致癌 7.0×10−6 Mn 1.4×10−5 Cu 4.6×10−4 Sb 4.0×10−4 Ba 2.0×10−1 Pb 4.3×10−4 Cr 致癌 2.9×10−5 56.0 Co 5.7×10−6 9.8 Ni 2.0×10−2 1.2 As 3.0×10−4 20.7 Cd 1×10−4 6.3 表 3 2020年燃放期两次升高过程颗粒物浓度的变化情况
Table 3. Changes in the concentration of particulate matter during the two-time increase in fireworks displays period in 2020
开始时间Start time 开始浓度/(μg·m−3)Start concentration 结束时间End time 结束浓度/(μg·m−3)End concentration 增幅/(μg·m−3)Increase 增加速率/(μg·(m3·h)−1)Increase rate 第一次明显升高 PM10 除夕16:00 60 初一02:00 220 160 16.0 PM2.5 除夕16:00 59 初一02:00 223 164 16.4 第二次明显升高 PM10 初一06:00 205 初一10:00 247 41 10.3 PM2.5 初一06:00 193 初一10:00 229 36 9.0 表 4 烟花爆竹各种成分类别的相关组分
Table 4. The relevant components of various composition categories of fireworks
烟花爆竹成分类别Fireworks ingredient category 作用Function 相关物质Related substances 相关组分Related components 可燃剂 为燃烧、爆炸提供所需的热量,同时还可以产生光或烟雾 易燃金属粉、硫化锑、木炭、硫磺、硅铁等无机物和淀粉、乳糖、纤维素等有机化合物[44] SO42−、Mg2+、Al、Si、Ca、Fe、Ti、Sb 氧化剂 为燃烧提供所需的氧,可燃剂会在氧化剂的作用下,更容易且剧烈的燃烧 一类是硝酸盐、高氯酸盐、过氧化物、氧化物等含氧物质,如KNO3、NH4NO3、KClO4、NH4ClO4、BaO2、PbO、KMnO4、MnO2等;另一类是不含氧的物质,如CCl4、C2Cl6等[45] Cl−、NO3−、NH4+、K+、K、Pb、Mn、Ba 着色剂 在燃烧、爆炸所产生的高温激发下化合物中的金属离子可以辐射出不同波长的可见光,使火焰着色 红光剂、绿光剂、黄光剂、蓝光剂一般分别以锶盐、钡盐、钠盐、铜化合物为主要原料;钾盐是紫色着色物;镁和铝则可以释放大量的白光[46] Mg2+、Al、K、K+、Cu、Ba 粘合剂 将各成分彼此粘合,保证烟火药本身有一定的黏度,使烟花爆竹成型,从而得到所需要的燃烧或爆炸效果 常用的粘合剂有天然树脂(例如虫胶、松香等)和合成树脂(例如酚醛树脂等)、糯米粉、面粉、糊精以及油类等有机物 — 产生其他特种效果的物质 根据要求和需要进行添加,如发出啸叫声、产生烟雾、提高火焰颜色的纯度等;钝感剂和稳定剂的加入在一定程度上削弱了燃烧的剧烈程度,降低烟火药的敏感度,从而延迟烟火药燃烧速度;还有防潮剂和防腐剂等 啸声剂(也称为笛声剂),通常指可燃物对苯二甲酸氢钾或者邻苯二甲酸氢钾,还可加入硝酸钾得到类似的啸声;烟雾剂常用的物质有萘、蒽、六氢乙烷、硅藻土等,砷化合物为禁用药物,但是烟雾类除外;含氯的有机物可以提高火焰颜色的纯度 Cl−、NO3−、K+、K、As 表 5 烟花爆竹燃放期与非燃放期各相关参数
Table 5. The relevant parameters of the fireworks displays period and the non-fireworks period
非燃放期Non-fireworks period 燃放期Fireworks displays period PM2.5/(μg·m−3) 125.4 168.6 SO2/(μg·m−3) 9.16 6.89 NO2/(μg·m−3) 31.89 18.32 SNA/PM2.5 39.7% 45.0% SOR 0.51 0.74 NOR 0.34 0.53 NH4+/SO42− 0.87 0.63 注:SNA为硫酸盐、硝酸盐、铵盐浓度之和. Note:SNA is the sum of sulfate, nitrate, and ammonium concentrations. 表 6 经呼吸暴露途径的重金属暴露剂量及非致癌风险
Table 6. Heavy metal exposure doses through respiratory exposure and non-carcinogenic risk
元素Elements 参考剂量/(mg·(kg·d)−1) RfD 日均暴露剂量ADD/(mg·(kg·d)−1) 非致癌风险HQ 儿童Children 成年女性Adult female 成年男性Adult male 儿童Children 成年女性Adult female 成年男性Adult male Pb 4.30×10−4 1.43×10−5 7.21×10−6 7.83×10−6 3.33×10−2 1.68×10−2 1.82×10−2 As 3.01×10−4 1.88×10−6 9.46×10−7 1.03×10−6 6.24×10−3 3.14×10−3 3.41×10−3 Co 5.70×10−6 5.57×10−7 2.81×10−7 3.04×10−7 9.77×10−2 4.92×10−2 5.34×10−2 Cr 2.90×10−5 3.73×10−7 1.88×10−7 2.04×10−7 1.29×10−2 6.48×10−3 7.03×10−3 Cd 1.00×10−4 1.08×10−6 5.42×10−7 5.88×10−7 1.08×10−2 5.42×10−3 5.88×10−3 Cu 4.56×10−4 1.47×10−5 7.40×10−6 8.03×10−6 3.22×10−2 1.62×10−2 1.76×10−2 Ni 2.00×10−2 3.51×10−6 1.77×10−6 1.92×10−6 1.75×10−4 8.84×10−5 9.59×10−5 Mn 1.40×10−5 5.44×10−6 2.74×10−6 2.97×10−6 3.89×10−1 1.96×10−1 2.12×10−1 Sb 4.00×10−4 3.33×10−6 1.68×10−6 1.82×10−6 8.33×10−3 4.20×10−3 4.55×10−3 V 7.00×10−6 1.85×10−7 9.34×10−8 1.01×10−7 2.65×10−2 1.33×10−2 1.45×10−2 Ba 2.00×10−1 3.51×10−5 1.77×10−5 1.92×10−5 1.76×10−4 8.85×10−5 9.61×10−5 综合 6.17×10−1 3.11×10−1 3.37×10−1 表 7 经呼吸暴露途径的重金属终生暴露剂量及致癌风险
Table 7. Lifetime exposure doses of heavy metals through respiratory exposure pathways and carcinogenic risks
元素Elements 致癌斜率系数/ ((kg·d)·mg−1) SF 终生日均暴露剂量LADD/(mg·(kg·d)−1) 终生致癌风险ICR 儿童Children 成年女性Adult female 成年男性Adult male 儿童Children 成年女性Adult female 成年男性Adult male As 20.7 1.61×10−7 4.85×10−7 5.13×10−7 3.33×10−6 1.00×10−5 1.06×10−5 Co 9.8 4.77×10−8 1.44×10−7 1.52×10−7 4.68×10−7 1.41×10−6 1.49×10−6 Cr 56 3.20×10−8 9.64×10−8 1.02×10−7 1.79×10−6 5.40×10−6 5.71×10−6 Cd 6.3 9.22×10−8 2.78×10−7 2.94×10−7 5.81×10−7 1.75×10−6 1.85×10−6 Ni 1.19 3.01×10−7 9.07×10−7 9.59×10−7 1.79×10−7 5.40×10−7 5.70×10−7 综合 6.35×10−6 1.91×10−5 2.02×10−5 -
[1] SINGH A, PANT P, POPE FD. Air quality during and after festivals: Aerosol concentrations, composition and health effects [J]. Atmospheric Research, 2019, 227: 220-232. doi: 10.1016/j.atmosres.2019.05.012 [2] PANG N N, GAO J, ZHAO P S, et al. The impact of fireworks control on air quality in four Northern Chinese Cities during the Spring Festival [J]. Atmospheric Environment, 2021, 244: 117958. doi: 10.1016/j.atmosenv.2020.117958 [3] 胡荣章, 刘红年, 张美根, 等. 南京地区大气灰霾的数值模拟 [J]. 环境科学学报, 2009, 29(4): 808-814. doi: 10.3321/j.issn:0253-2468.2009.04.021 HU R Z, LIU H N, ZHANG M G, et al. Simulation of brownish haze in urban areas of Nanjing [J]. Acta Scientiae Circumstantiae, 2009, 29(4): 808-814(in Chinese). doi: 10.3321/j.issn:0253-2468.2009.04.021
[4] JI D S, CUI Y, LI L, et al. Characterization and source identification of fine particulate matter in urban Beijing during the 2015 Spring Festival [J]. Science of the Total Environment, 2018, 628/629: 430-440. doi: 10.1016/j.scitotenv.2018.01.304 [5] YAO L, WANG D F, FU Q Y, et al. The effects of firework regulation on air quality and public health during the Chinese Spring Festival from 2013 to 2017 in a Chinese megacity [J]. Environment International, 2019, 126: 96-106. doi: 10.1016/j.envint.2019.01.037 [6] HU X, ZHANG Y, DING Z H, et al. Bioaccessibility and health risk of arsenic and heavy metals (Cd, Co, Cr, Cu, Ni, Pb, Zn and Mn) in TSP and PM2.5 in Nanjing, China [J]. Atmospheric Environment, 2012, 57: 146-152. doi: 10.1016/j.atmosenv.2012.04.056 [7] CAO X Y, ZHANG X L, TONG D Q, et al. Review on physicochemical properties of pollutants released from fireworks: Environmental and health effects and prevention [J]. Environmental Reviews, 2018, 26(2): 133-155. doi: 10.1139/er-2017-0063 [8] ZENG X, XU X J, ZHENG X B, et al. Heavy metals in PM2.5 and in blood, and children's respiratory symptoms and asthma from an e-waste recycling area [J]. Environmental Pollution, 2016, 210: 346-353. doi: 10.1016/j.envpol.2016.01.025 [9] WU C, WANG G H, WANG J Y, et al. Chemical characteristics of haze particles in Xi'an during Chinese Spring Festival: Impact of fireworks burning [J]. Journal of Environmental Sciences, 2018, 71: 179-187. doi: 10.1016/j.jes.2018.04.008 [10] CHEN Y, HO K F, HO S S H, et al. Gaseous and particulate polycyclic aromatic hydrocarbons (PAHs) emissions from commercial restaurants in Hong Kong [J]. Journal of Environmental Monitoring, 2007, 9(12): 1402-1409. doi: 10.1039/b710259c [11] POPE C A 3rd, BURNETT R T, THUN M J, et al. Lung cancer, cardiopulmonary mortality, and long-term exposure to fine particulate air pollution [J]. JAMA, 2002, 287(9): 1132-1141. doi: 10.1001/jama.287.9.1132 [12] HUANG H, YING J, XU X Y, et al. In vitro bioaccessibility and health risk assessment of heavy metals in atmospheric particulate matters from three different functional areas of Shanghai, China [J]. Science of the Total Environment, 2018, 610/611: 546-554. doi: 10.1016/j.scitotenv.2017.08.074 [13] WANG S S, YU R L, SHEN H Z, et al. Chemical characteristics, sources, and formation mechanisms of PM2.5 before and during the Spring Festival in a coastal city in Southeast China [J]. Environmental Pollution, 2019, 251: 442-452. doi: 10.1016/j.envpol.2019.04.050 [14] LIU X T, ZHAI Y B, ZHU Y, et al. Mass concentration and health risk assessment of heavy metals in size-segregated airborne particulate matter in Changsha [J]. Science of the Total Environment, 2015, 517: 215-221. doi: 10.1016/j.scitotenv.2015.02.066 [15] 张章, 刘保献, 安欣欣, 等. 北京市传统春节假期空气质量特征研究 [J]. 中国环境科学, 2021, 41(1): 102-113. doi: 10.3969/j.issn.1000-6923.2021.01.012 ZHANG Z, LIU B X, AN X X, et al. A study on the air quality in Beijing during the Spring Festival [J]. China Environmental Science, 2021, 41(1): 102-113(in Chinese). doi: 10.3969/j.issn.1000-6923.2021.01.012
[16] 真气网. 国内城市排序[EB/OL]. [2022-12-24]. https://www.zq12369.com/environment.php?year=2019&tab=rank&order=DESC&nowtype=Complexindex&type=YEAR#rank. [17] 徐衡, 董卫民. 浅析燃放烟花爆竹对宝鸡市区颗粒物浓度的影响 [J]. 价值工程, 2015, 34(29): 185-187. doi: 10.14018/j.cnki.cn13-1085/n.2015.29.071 XU H, DONG W M. Influence on the particulate matter concentration in Baoji downtown caused by setting off fireworks [J]. Value Engineering, 2015, 34(29): 185-187(in Chinese). doi: 10.14018/j.cnki.cn13-1085/n.2015.29.071
[18] 张婷, 曹军骥, 刘随心. 宝鸡市PM2.5中水溶性离子组分污染特征及来源分析 [J]. 地球环境学报, 2017, 8(1): 46-54. doi: 10.7515/JEE201701006 ZHANG T, CAO J J, LIU S X. Pollution characteristics and sources of water-soluble ions in PM2.5 in Baoji [J]. Journal of Earth Environment, 2017, 8(1): 46-54(in Chinese). doi: 10.7515/JEE201701006
[19] 杨雪玲, 邢莉, 王颖, 等. 宝鸡市冬季一次持续性重污染过程特征分析 [J]. 环境科学研究, 2020, 33(10): 2256-2264. doi: 10.13198/j.issn.1001-6929.2020.05.19 YANG X L, XING L, WANG Y, et al. Characteristics and mechanism of a heavy haze episode in Baoji City [J]. Research of Environmental Sciences, 2020, 33(10): 2256-2264(in Chinese). doi: 10.13198/j.issn.1001-6929.2020.05.19
[20] 朱筱娟, 徐衡, 罗汉翔. 2017年宝鸡市区环境空气质量状况分析 [J]. 低碳世界, 2018, 3(3): 11-12. doi: 10.3969/j.issn.2095-2066.2018.03.007 ZHU X J, XU H, LUO H X. Analysis of ambient air quality in Baoji City in 2017 [J]. Low Carbon World, 2018, 3(3): 11-12(in Chinese). doi: 10.3969/j.issn.2095-2066.2018.03.007
[21] 周变红, 冯瞧, 王锦, 等. 宝鸡市城郊冬季水溶性离子在不同等级污染天的特征及来源分析 [J]. 环境化学, 2021, 40(9): 2796-2808. doi: 10.7524/j.issn.0254-6108.2021020102 ZHOU B H, FENG Q, WANG J, et al. Characteristics and source analysis of water-soluble ions in Baoji urban and suburban areas on different levels of polluted days [J]. Environmental Chemistry, 2021, 40(9): 2796-2808(in Chinese). doi: 10.7524/j.issn.0254-6108.2021020102
[22] 韩洁, 徐迎春, 庞翻, 等. 近4年早春宝鸡市区气象条件对空气污染的影响 [J]. 陕西气象, 2020(1): 20-25. HAN J, XU Y C, PANG F, et al. Influence of meteorological conditions on air pollution in early spring in Baoji City in latest 4 years [J]. Journal of Shaanxi Meteorology, 2020(1): 20-25(in Chinese).
[23] TIAN M, WANG H B, YANG C, et al. Highly time-resolved characterization of water-soluble inorganic ions in PM2.5 in a humid and acidic mega city in Sichuan Basin, China [J]. Science of the Total Environment, 2017, 580: 224-234. doi: 10.1016/j.scitotenv.2016.12.048 [24] CHANG S Y, LEE C T, CHOU C K, et al. The continuous field measurements of soluble aerosol compositions at the Taipei Aerosol Supersite, Taiwan [J]. Atmospheric Environment, 2007, 41(9): 1936-1949. doi: 10.1016/j.atmosenv.2006.10.051 [25] 尹婷, 胡世祥, 姜雪娇, 等. 基于X射线荧光分析原理的大气重金属在线分析仪的维护与质控 [J]. 中国环境监测, 2017, 33(5): 75-81. doi: 10.19316/j.issn.1002-6002.2017.05.11 YIN T, HU S X, JIANG X J, et al. Maintenance and quality control on the atmospheric heavy metal analyzer based on X-ray fluorescence spectroscopy [J]. Environmental Monitoring in China, 2017, 33(5): 75-81(in Chinese). doi: 10.19316/j.issn.1002-6002.2017.05.11
[26] XU L L, CHEN X Q, CHEN J S, et al. Seasonal variations and chemical compositions of PM2.5 aerosol in the urban area of Fuzhou, China [J]. Atmospheric Research, 2012, 104/105: 264-272. doi: 10.1016/j.atmosres.2011.10.017 [27] YANG Y J, ZHOU R, YU Y, et al. Size-resolved aerosol water-soluble ions at a regional background station of Beijing, Tianjin, and Hebei, North China [J]. Journal of Environmental Sciences, 2017, 55: 146-156. doi: 10.1016/j.jes.2016.07.012 [28] YANG L M, WANG S B, DUAN S G, et al. Characteristics and formation mechanisms of secondary inorganic ions in PM2.5 during winter in a central city of China: Based on a high time resolution data [J]. Atmospheric Research, 2020, 233: 104696. doi: 10.1016/j.atmosres.2019.104696 [29] DE MIGUEL E, IRIBARREN I, CHACóN E, et al. Risk-based evaluation of the exposure of children to trace elements in playgrounds in Madrid (Spain) [J]. Chemosphere, 2007, 66(3): 505-513. doi: 10.1016/j.chemosphere.2006.05.065 [30] 唐大镜, 常会云, 张莹, 等. 2017—2019年石家庄市PM2.5中重金属污染及健康风险评价 [J]. 现代预防医学, 2021, 48(7): 1177-1180,1197. TANG D J, CHANG H Y, ZHANG Y, et al. Pollution characteristics and health risk evaluation of heavy metal particles in PM2.5 in Shijiazhuang, 2017—2019 [J]. Modern Preventive Medicine, 2021, 48(7): 1177-1180,1197(in Chinese).
[31] USEPA. Risk assessment guidance for superfund: volume II. Environmental evaluation manual. Interim final[R]. Washington, DC. : Office of Emergency and Remedial Response, 1989. [32] 王珊珊. 厦门市大气PM2.5分布特征、来源解析及风险评价[D]. 泉州: 华侨大学, 2020. WANG S S. Distribution characteristic, source and risk assessment of atmospheric PM2.5 in Xiamen[D]. Quanzhou: Huaqiao University, 2020(in Chinese).
[33] 环境保护部. 中国人群暴露参数手册(成人卷)[M]. 北京: 中国环境出版社, 2013. Ministry of Environmental Protection. Exposure factors handbook of Chinese population (Adults Volume)[M]. Beijing: China Environmental Science Press, 2013(in Chinese).
[34] 王巍. 兰州市室内空气重金属污染水平与健康风险评价 [J]. 环境生态学, 2022, 4(Sup1): 76-82. WANG W. Pollution evaluation and health risk assessment of heavy metals from indoor air in Lanzhou City [J]. Environmental Ecology, 2022, 4(Sup1): 76-82(in Chinese).
[35] USEPA. Supplemental guidance for developing soil screening levels for superfund sites[R]. Washington, DC. : Office of Emergency and Remedial Response, 2001. [36] SHAH M H, SHAHEEN N. Seasonal behaviours in elemental composition of atmospheric aerosols collected in Islamabad, Pakistan [J]. Atmospheric Research, 2010, 95(2/3): 210-223. [37] 坑斌, 郭新彪, 孙利文. 2017年北京市怀柔区大气PM2.5中重金属污染特征及健康风险评价 [J]. 环境卫生学杂志, 2019, 9(2): 148-152. KENG B, GUO X B, SUN L W. Heavy metal pollution characteristics and health risk assessment of atmospheric PM2.5 in Huairou district of Beijing in 2017 [J]. Journal of Environmental Hygiene, 2019, 9(2): 148-152(in Chinese).
[38] 刘思序, 刘宝林, 吕林阳, 等. 长春市秋冬季大气PM2.5中重金属污染特征及健康风险评价 [J]. 长春师范大学学报, 2022, 41(2): 196-200. doi: 10.3969/j.issn.1008-178X.2022.02.036 LIU S X, LIU B L, LÜ L Y, et al. Pollution characteristics and health risk assessment of heavy metals in atmospheric PM2.5 during autumn and winter seasons in Changchun [J]. Journal of Changchun Normal University, 2022, 41(2): 196-200(in Chinese). doi: 10.3969/j.issn.1008-178X.2022.02.036
[39] 王伟, 孔少飞, 刘海彪, 等. 南京市春节前后大气PM2.5中重金属来源及健康风险评价 [J]. 中国环境科学, 2016, 36(7): 2186-2195. doi: 10.3969/j.issn.1000-6923.2016.07.041 WANG W, KONG S F, LIU H B, et al. Sources and risk assessment of heavy metals in PM2.5 around 2014 Spring Festival in Nanjing [J]. China Environmental Science, 2016, 36(7): 2186-2195(in Chinese). doi: 10.3969/j.issn.1000-6923.2016.07.041
[40] 朱焱涛. 西安市北郊大气细颗粒物重金属特征及健康风险评价研究[D]. 西安: 西安建筑科技大学, 2021. ZHU Y T. Heavy metal characteristics and health risk assessment of fine particulate matter in the northern suburb of Xi 'an City[D]. Xi'an: Xi'an University of Architecture and Technology, 2021(in Chinese).
[41] 徐红梅, 张婷, 刘随心. 春节期间燃放烟花对西安市PM2.5的影响 [J]. 地球环境学报, 2012, 3(5): 1037-1042. XU H M, ZHANG T, LIU S X. Impact of burning fireworks during Spring Festival to PM2.5 of Xi'an [J]. Journal of Earth Environment, 2012, 3(5): 1037-1042(in Chinese).
[42] LAI Y H, BRIMBLECOMBE P. Changes in air pollution and attitude to fireworks in Beijing [J]. Atmospheric Environment, 2020, 231: 117549. doi: 10.1016/j.atmosenv.2020.117549 [43] 胡清华, 陈晓秋, 张福旺, 等. 烟花爆竹燃放对福州大气PM2.5成分的影响 [J]. 环境科学与技术, 2019, 42(Sup2): 223-231. HU Q H, CHEN X Q, ZHANG F W, et al. Effects of fireworks on the composition of PM2.5 in Fuzhou [J]. Environmental Science & Technology, 2019, 42(Sup2): 223-231(in Chinese).
[44] 谢瑞加, 侯红霞, 陈永山. 烟花爆竹集中燃放的大气细颗粒物(PM2.5)成分图谱 [J]. 环境科学, 2018, 39(4): 1484-1492. XIE R J, HOU H X, CHEN Y S. Analysis of the composition of atmospheric fine particles(PM2.5) produced by burning fireworks [J]. Environmental Science, 2018, 39(4): 1484-1492(in Chinese).
[45] 韩林洁, 黄俊, 韩新宇, 等. 昆明市典型干季大气PM2.5中重金属污染特征与来源研究 [J]. 昆明理工大学学报(自然科学版), 2019, 44(2): 99-110. HAN L J, HUANG J, HAN X Y, et al. Characteristics and sources of heavy metals in atmospheric PM2.5 research during the dry season in Kunming [J]. Journal of Kunming University of Science and Technology (Natural Science), 2019, 44(2): 99-110(in Chinese).
[46] 邹强, 姚玉刚, 丁铭, 等. 春节烟花爆竹燃放期间苏州市区PM2.5中水溶性离子特征分析 [J]. 环境监测管理与技术, 2014, 26(2): 26-29,62. doi: 10.3969/j.issn.1006-2009.2014.02.009 ZOU Q, YAO Y G, DING M, et al. Characteristics of water-soluble ions bounded in PM2.5 during spring festival in Suzhou City [J]. The Administration and Technique of Environmental Monitoring, 2014, 26(2): 26-29,62(in Chinese). doi: 10.3969/j.issn.1006-2009.2014.02.009
[47] KONG S F, LI L, LI X X, et al. The impacts of firework burning at the Chinese Spring Festival on air quality: Insights of tracers, source evolution and aging processes [J]. Atmospheric Chemistry and Physics, 2015, 15(4): 2167-2184. doi: 10.5194/acp-15-2167-2015 [48] 张维, 李金娟, 张燕美, 等. 遵义PM2.5中二次水溶性无机离子分布特征与来源 [J]. 环境科学与技术, 2016, 39(5): 109-114. ZHANG W, LI J J, ZHANG Y M, et al. Distribution characteristics and sources of secondary water-soluble inorganic ions in PM2.5 in Zunyi City [J]. Environmental Science & Technology, 2016, 39(5): 109-114(in Chinese).
[49] 周变红, 冯瞧, 王锦, 等. 宝鸡市秋季清洁和污染时段水溶性离子污染特征及来源解析 [J]. 环境化学, 2022, 41(5): 1673-1683. doi: 10.7524/j.issn.0254-6108.2021102901 ZHOU B H, FENG Q, WANG J, et al. Characteristics and sources of water-soluble ion pollution during cleaning and pollution periods in Baoji City in autumn [J]. Environmental Chemistry, 2022, 41(5): 1673-1683(in Chinese). doi: 10.7524/j.issn.0254-6108.2021102901
[50] BROWN R J C, ASWEGEN S V, WEBB W R, et al. UK concentrations of chromium and chromium (VI), measured as water soluble chromium, in PM10 [J]. Atmospheric Environment, 2014, 99: 385-391. doi: 10.1016/j.atmosenv.2014.10.008 [51] 肖思晗, 蔡美君, 李香, 等. 厦门港大气PM2.5中重金属污染特征及健康风险评价 [J]. 环境科学, 2022, 43(7): 3404-3415. XIAO S H, CAI M J, LI X, et al. Characterization and health risk assessment of heavy metals in PM2.5 in Xiamen Port [J]. Environmental Science, 2022, 43(7): 3404-3415(in Chinese).
-






 下载:
下载: