-
目前,寻找一种可以替代传统化石燃料的可再生能源已成为能源领域的研究热点,绿色、健康、可持续发展是当前环保领域的关键词[1]. 微生物燃料电池( microbial fuel cells,MFCs) 是利用产电微生物(electroactive microorganisms,EABs)将有机污染物中的化学能转化为电能的装置[2]. MFCs 通常由两个电极室组成,在阳极室内,产电菌释放电子和质子,电子经过外电路转移到阴极释放携带的能量,而质子经过离子交换膜转移到阴极[3],在闭环条件下阳极室EABs发生电子转移产生电流,包括直接电子转移(direct electron transfer,DET)和介导电子转移(mediated electron transfer,MET)两种方式将微生物代谢产生的电子转移到阳极上[1]. 但MFCs低功率密度使其难以商业化,因此,优化MFCs的功率密度属于当前的研究热点之一. 在驱动MFCs运行的各种机制中,EABs与阳极之间的细胞外电子传递(extracellular electron transport,EET)成为最重要的机制之一,对EET过程的调控和优化已成为一种常见的策略.
为了提高MFCs的功率密度,研究人员从提高阳极性能、EABs提纯和富集等方面开发了一系列方法来增强阳极与EABs的相互作用,包括使用聚合物涂层和3D阳极材料、结构优化或掺杂导电金属离子、EABs基因工程等[4]. 其中,高性能的阳极材料因具有成本低、制备方法简单、导电性好、生物相容性好,稳定性高等[5]优点成为研究热点. 生物炭材料以稳定性高、易化学改性、成本低、易获得等优点成为公认的阳极材料. 已研究的生物碳材料有松果[6]、天然丝瓜海绵[7]和杏仁壳[8]等. 生物炭阳极材料具有均匀分布的大孔结构,有利于发电微生物的粘附,能避免堵塞问题[9].
已有研究表明,氮可以作为一种元素用于修饰阳极材料,增强产电微生物与电极之间的相互作用[10]. 据报道,He等[11]首次证明向碳纸中注入N+等离子体可以通过降低电荷转移阻力提高生物相容性,从而提高MFCs的发电能力. Wu等[12]使用氮掺杂碳材料,在原子上匹配介导电池外电子转移的扩散氧化还原物种的反应位点,证明氮的贡献. Yu等[13]将氮掺杂碳纳米颗粒引入到MFCs阳极中,证明氮可以促进产电微生物细胞外电子传递过程中黄素的分泌,增强细菌与电极之间的相互作用.
本文从改善阳极材料表面物理化学性质的角度出发,用吐司作为多孔碳前驱体,三聚氰胺为氮源,直接烧制氮掺杂三维碳材料,并将其与不掺杂氮的阳极材料和未改性的商用碳布材料进行比较. 用混合地杆菌Geobacter和希瓦氏菌Shewanella在MFCs中培养后,对其性能进行评价和分析. 三维多孔碳阳极材料与氮元素结合,可以同时提供更大的比表面积、更好的电导率和良好的生物相容性以及适应性强的混合微生物群落,使MFCs具有更好的功率密度,并进一步研究氮在促进EET过程中的作用机制.
-
吐司原材料购于昆明沃尔玛超市有限公司,主要成分是面粉、酵母、玉米油等,由碳、氮、氧等元素组成,吐司内部多孔且均匀分布,将购买的吐司切成2 cm3×2 cm3×1.5 cm3的小块于室温条件下风干一夜后保存备用,然后以三聚氰胺为氮源,在氩气气氛下,分别于700、800、900、1000、1100 ℃的管式炉中热解2 h,制备NBs材料,标记为NB700、NB800、NB900、NB1000和NB1100. 将切成小块的吐司置于1000 ℃的管式炉中热解2 h,不需要外部氮源,制成B1000. 相应地,将普通碳布型号W0S1009切成小块(1 cm2×1 cm2)制备CC电极. 将所有材料切成小块(1 cm3×1 cm3×1 cm3),用钛丝连接,制备NBs、B1000和CC阳极,最后用丙酮、异丙醇、乙醇和去离子水对所有材料进行洗涤,干燥.
-
本次研究利用热重分析仪(TGA)和差示扫描量热分析(DSC)在室温至1000 ℃,N2流量为60 mL·min−1,加热速度为2 ℃·min−1时进行测定;Brunner-Emmet-Teller (BET)测量由TriStar II(3020)仪器进行;利用X射线衍射仪(XRD)对材料的组成进行表征;扫描XPS微探针系统(PHI5000 Versaprobe-II)在15 kV、50 W条件下对吐司中成功掺杂的氮元素进行X射线光电子能谱(XPS)测定;在5 kV 5 μA的条件下,利用扫描电子显微镜(Hitachi SU8010)对电极的宏观形貌和生物膜的定殖进行表征,在进行SEM测量之前,所有材料都喷涂了铂以增强导电性;对于阳极材料的电化学表征、氮掺杂阳极促进电活性微生物EET能力的机理和循环伏安图(CV),在中国上海CHI660E电化学工作站(CHI Instrument, Shanghai, China)使用差示脉冲伏安法(DPVs)和电化学阻抗谱(EIS)测试评估,阳极材料的电化学性能测试在三电极体系中进行,三电极分别为工作电极、饱和甘汞参比电极(SCE)和铂丝对电极,在不同的扫描速率和各自的开路电压下进行了研究[14].
-
本实验使用的反应器是双室MFCs反应器,将所有组装好的阳极在磷酸缓冲盐溶液(phosphate buffer saline,PBS)中浸泡一夜,使电极材料和电解质之间充分接触,PBS溶液的主要成分为NaH2PO4·2H2O(2.77 g·L−1)、Na2HPO4·2H2O(11.55 g·L−1)、NH4Cl(0.31 g·L−1)、KCl(0.13 g·L−1). MFCs电池使用了经典的反应堆屏蔽双室,阳极室和阴极室的体积均为100 mL,阴极为市售的碳刷电极,使用前用无水乙醇和去离子水清洗干净后烘干备用. 阳极电解液的组成为NaH2PO4·2H2O (2.77 g·L−1)、Na2HPO4·2H2O(11.55 g·L−1)、NH4Cl(0.3 g·L−1)、KCl(0.13 g·L−1)、CH3COONa(2 g·L−1)、混合维生素(10 mol·L−1)和矿物质元素(12.5 mol·L−1),阴极电解液的组成为K3[Fe(CN)6](2 g·L−1)和KCl(3.715 g·L−1)[15]. 阳极液在使用前用氩气冲洗30 min,将氧气排尽.
实验开始时,从活性厌氧污泥中接种5 mL预培养细菌. MFCs连接一个1 kΩ外部加载电阻,并连接到数据采集器. 当MFCs电压降至50 mV时,更换新的阳极液和阴极液,测试电压循环稳定运行4个周期后的功率密度和极化曲线.
-
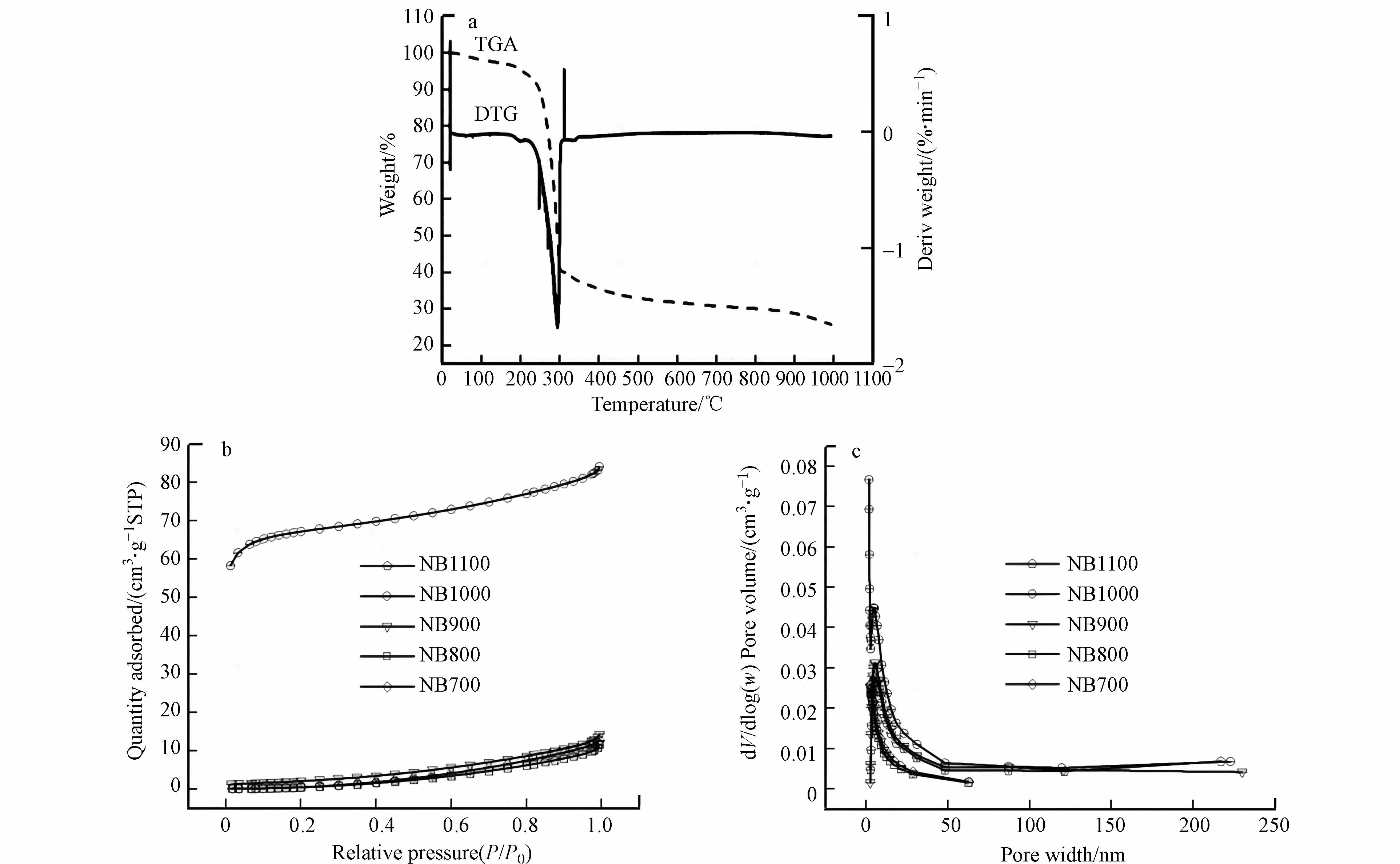
在氩气气氛下进行TGA-DSC分析,对吐司炭化过程进行监测. 如图1a所示,失重主要有3种原因,在第一阶段,200—250 ℃的温度区间内,主要是由于去除了吸附在孔结构中水分和空气;在第二阶段,250—350 ℃的温度区间内,主要是由于油脂类物质的分解,同时伴随着对孔结构中的已经吸附水分和残留空气的进一步移除;在第三阶段,325—1100 ℃的温度区间内,主要是样品的碳化,在这个期间内完成了石墨碳的形成以氮原子掺杂到碳材料表面的过程. NBs的比表面积和孔径分布见图1b、c. BET表面积在1000 ℃(216.664 m2·g−1)时达到最大值,在1100 ℃进一步升高后减小(表1). 此外,在1000 ℃时介孔数量达到最大值,有利于基体的扩散和产物的去除.
-
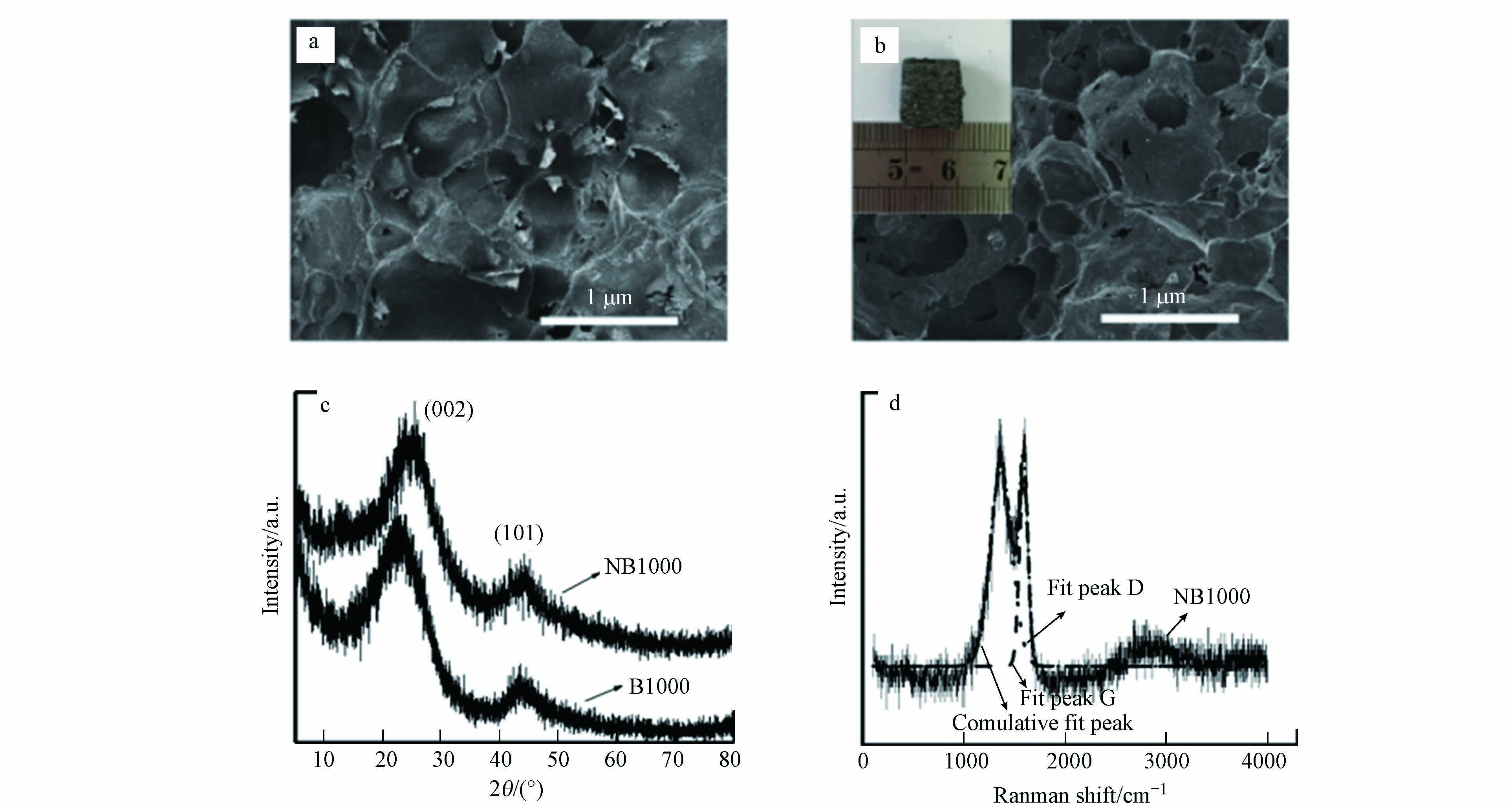
图2a和图2b分别为碳化前和1000 ℃下碳化后的吐司SEM图片. 碳化后的吐司具有孔结构均匀分布且相互连通的大孔开放结构,碳化过程中多孔结构保存良好,丰富的多孔性使电活性微生物更好的定殖,避免了代谢过程中的堵塞. 此外,该结构可以为暴露表面提供高活性的电荷储存位点,促进电子转移. NB1000和B1000的XRD谱图均显示出两个宽的XRD衍射峰,分别属于石墨碳在2θ角27.3°和43°处的晶面(002)和(101)衍射峰(图2c). 与B1000相比,NB1000的(002)发生了轻微的偏移,这是由于氮原子的掺入使晶体的规则性发生轻微的扭曲. 此外,通过拉曼光谱来确定样品的石墨化程度(图2d)[16]. 光谱中有2个峰位于1585 cm−1和1379 cm−1,峰面积比对应的ID/IG值反映了石墨化程度[17]. NB1000的ID/IG值小于1,说明样品的石墨化效果较好,这与XRD结果一致,进一步证明了对碳前驱体碳化操作的成功进行.
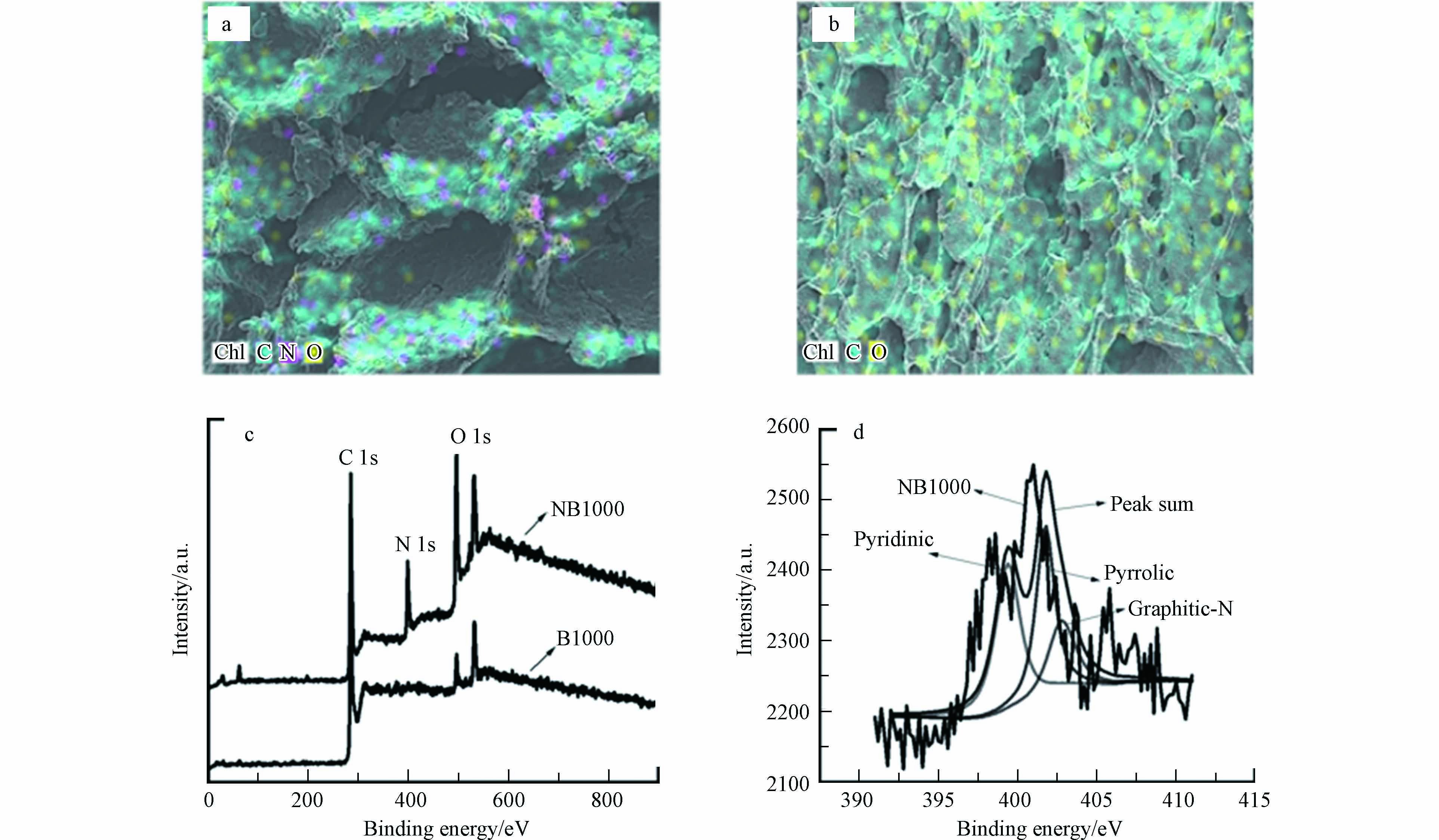
图3a和图3b中EDX模式的元素组成分析证实了三聚氰胺中的氮原子在焙烧过程中成功掺杂进入碳前驱体. 然后用XPS进一步研究合成的NB1000和B1000的元素组成,其中NB1000的氮含量为16%,高于氨通风法和热解法制备的掺氮碳材料[15,18-19]. 图3cXPS测量光谱进一步证实了NB1000中氮的存在,且与XRD和拉曼结果一致. 图3d的N1s光谱表明,NB1000中存在3种氮态,分别是吡啶氮(399 eV)、吡咯氮(401 eV)和石墨氮(401.8 eV),且3种氮态的比例相等[20-21]. 研究表明,通过氨和硝酸处理含氮官能团修饰碳材料或在碳基阳极中掺入氮元素是提高MFCs性能的有效策略[15]. 吡咯氮的存在容易使产电微生物分泌外膜c型细胞色素传递电子,从而增强电活性微生物的胞外电子传递功能[22].
-
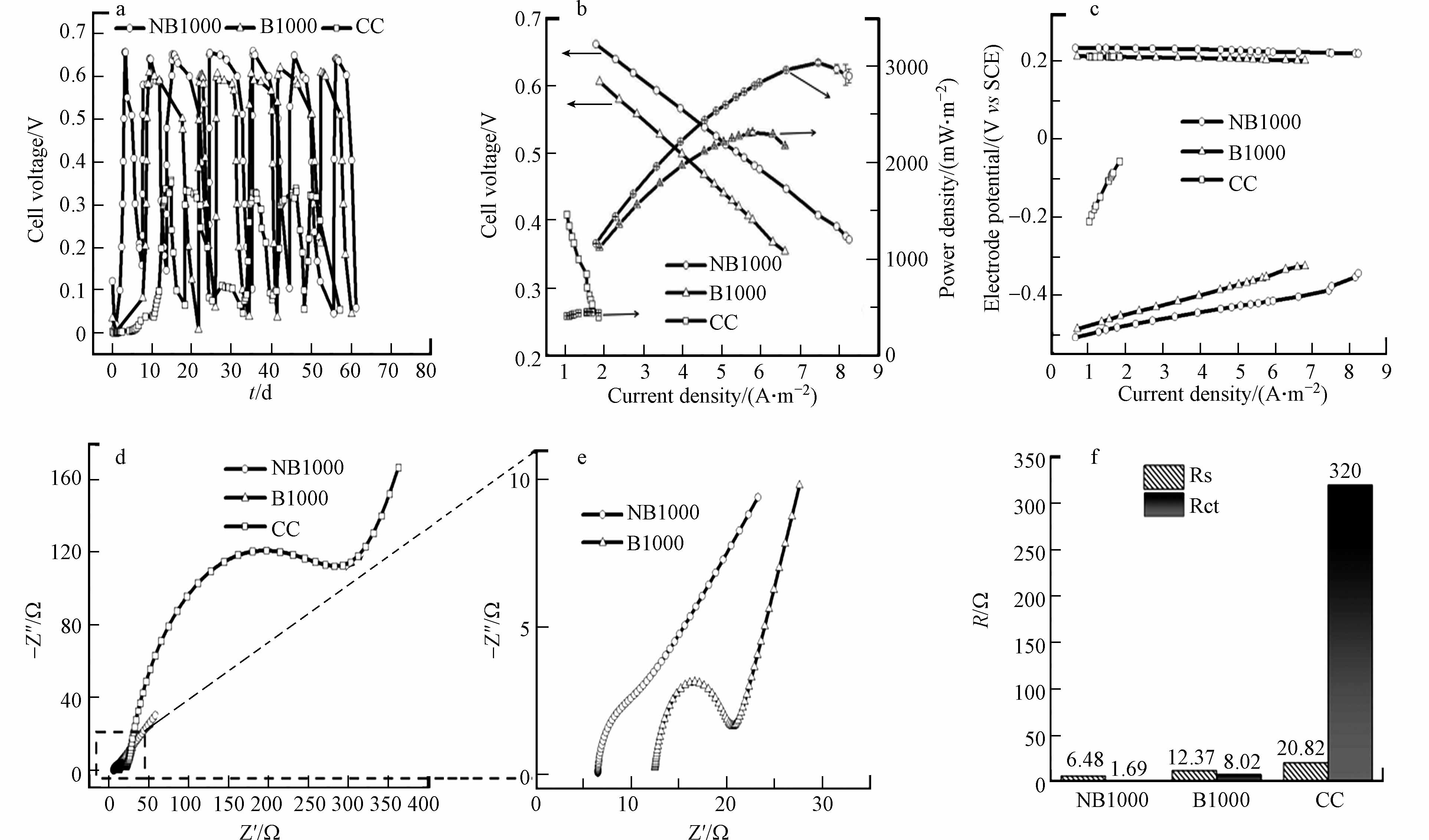
以NB1000和B1000作为阳极,接种典型的电活性微生物Shewanella oneidensis MR-1和Geobacter,以常用的plain carbon cloth (CC)电极作为对照参比,进一步研究了典型H型双室微生物燃料电池 (H-MFCs)的性能. 阴极是商用碳刷电极,包含100 mL铁氰化钾(50 mol·L−1 K3[Fe(CN)6]和50 mol·L−1 KCl),阳极室组分为90 mL PBS与乳酸钠溶液以及10 mL混菌MFCs阳极出水液. 图4a显示了MFCs的激活情况和输出电压分布图. 研究发现,配置NB1000阳极的MFCs需要大约3 d的激活和微生物富集才能达到稳定的输出电压,而配置B1000和CC阳极的MFCs分别需要9 d和12 d才能达到最大输出电压. H-MFCs表现出细胞电压的可重复性,NB1000的细胞电压最大值为(625±25) mV,分别是B1000((595±5) mV)和CC((325±5) mV)的1.05和1.92倍. 结果表明,NB1000电极的表面更适合电活性微生物的附着和生长,比B1000和CC电极具有更好的亲和力和生物相容性. 经过3次稳定循环后,测量MFC的极化和功率密度曲线(图4b)和电极电势曲线(图4c),评价其发电能力. 配备有NB1000阳极的MFCs在3个电极中具有最高的面积功率密度和最高面电流密度分别为3049.714 mW·m−2和7.4464 A·m−2,B1000阳极的面积功率密度和电流密度分别为2323.14 mW·m−2和5.77 A·m−2,CC阳极的面积功率密度和电流密度分别为465.88 mW·m−2和4.83 A·m−2,NB1000阳极的最大面积功率密度分别是B1000和CC阳极的1.31倍和6.54倍,NB1000阳极的最大面积电流密度分别是B1000和CC阳极的1.29倍和1.54倍. 图4c说明不同的MFCs中,阴极的电位几乎相同,而阳极电位有明显的变化. 与B1000和CC阳极相比,NB1000阳极产生更高的功率密度是由于阳极电位增加,这意味着在NB1000阳极中存在更低的过电势(包括活化极化和欧姆损耗),这是由于NB1000中有氮掺入. 图4d和4e所示,利用EIS测量MFCs的电阻进一步评价产电微生物附着后的阻抗大小. 由图4d和4e可以看出,在形成生物膜后的3个阳极中,NB1000阳极的欧姆电阻(Rs)和电荷转移电阻(Rct)最低,说明NB1000阳极的电极/电解质界面电子转移速度更快. 此外,图4f可以看出由于阳极材料上生物膜的形成,导致Rs和Rct降低,说明细菌与电极表面之间的电子传递速度加快[23].
-
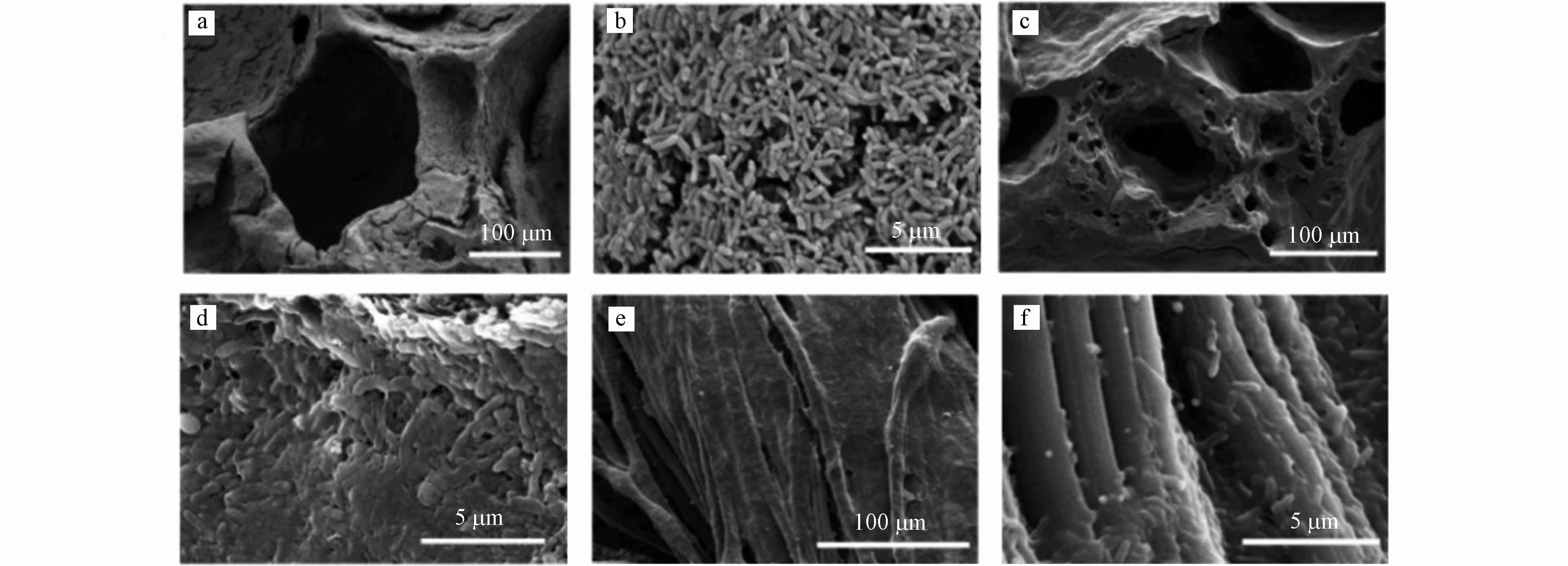
扫描电镜图像(图5a-b、5c-d和5e-f)显示了MFCs经过5个循环培养后((55±5) d),在NB1000、B1000和CC阳极表面上定殖的生物膜情况.
与B1000和CC阳极表面相比,NB1000阳极上生长的生物膜几乎覆盖了整个阳极. 而B1000和CC阳极的厚度和微生物分布均匀程度均不如NB1000阳极,这说明NB1000阳极表面对电活性微生物的更容易定殖,具有更好的生物相容性,这是由于NB1000阳极掺杂了氮.
-
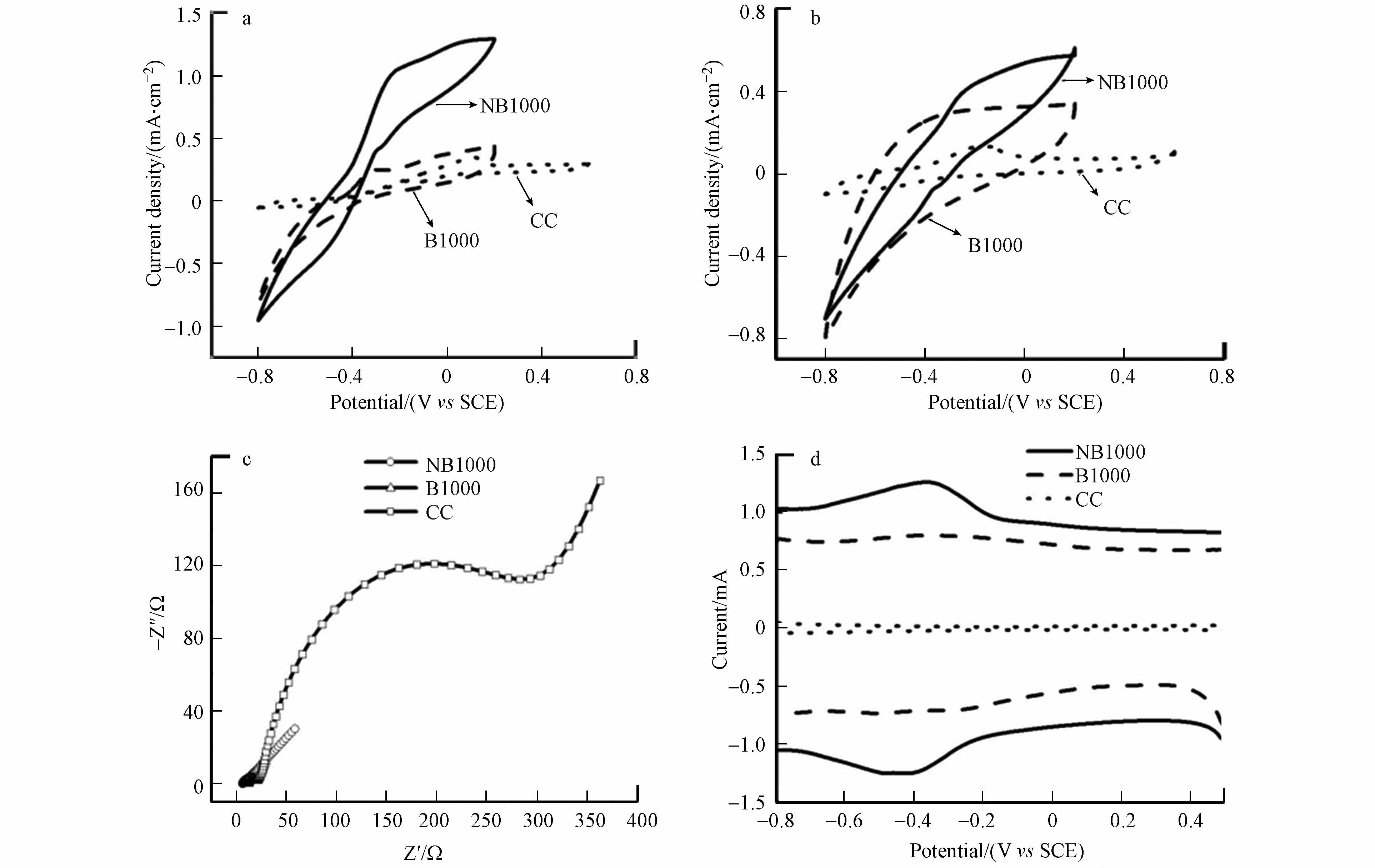
为了探讨NB1000阳极促进电极与电活性微生物间EET的机理,采用CVs(分别在有乙酸钠底物条件和无乙酸钠底物条件下)和DVPs电化学测试进行研究. 图6a显示了NB1000、B1000和CC阳极经过4个稳定的电压输出循环后在有底物条件下的CVs曲线. 结果表明,NB1000电极的电流密度为1.29 mA·cm−2,B1000电极的电流密度为0.44 mA·cm−2,CC电极的电流密度为0.30 mA·cm−2,NB1000电极的电流密度分别是B1000和CC阳极的2.9倍和4.3倍,表明NB1000阳极具有更好的电催化活性.
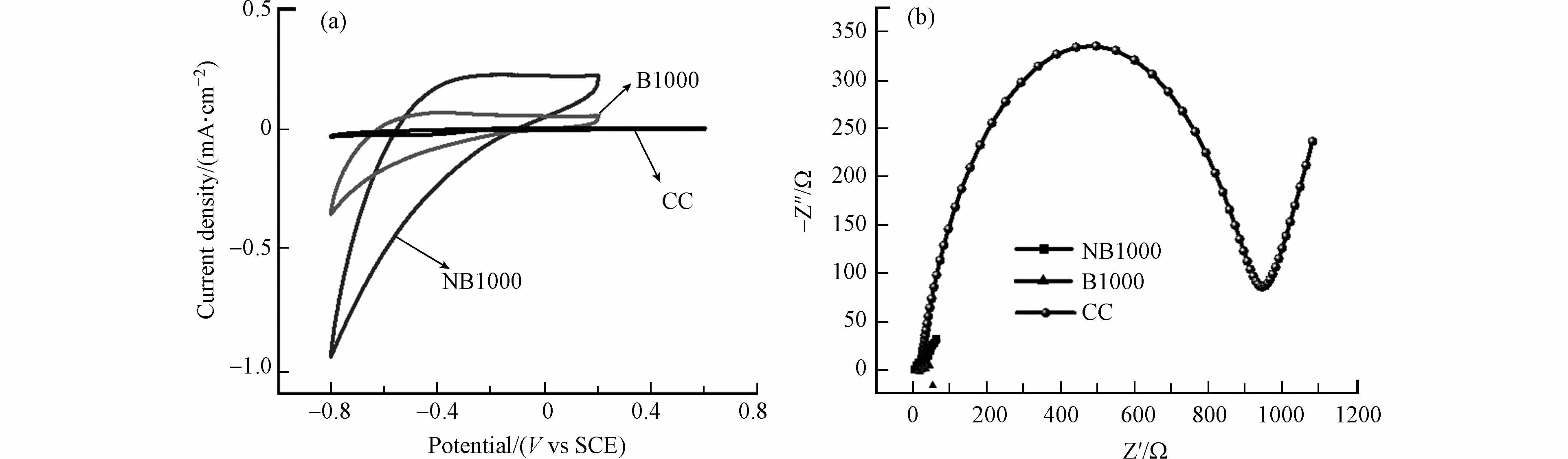
S形的CVs曲线是由阳极上的产电微生物Geobacter和Shewanella产生的,这表明了阳极上的电活性微生物对乙酸盐具有催化氧化作用[24]. 此外,在生物膜定殖前添加2 g·L−1乳酸和PBS溶液,CVs曲线没有呈现S形(图7),这一结果表明在阳极上定殖的产电微生物消耗的是乳酸而不是阳极材料. 乳酸耗尽后,进行无底物条件下的CVs来研究与微生物进行EET相关的氧化还原对(图6b),NB1000阳极有两对氧化还原峰,分别为−0.422 V(阴极峰)、−0.381 V(阳极峰)和 −0.0193 V(阴极峰)、−0.0482 V(阴极峰). NB1000和CC阳极均有一对氧化还原峰,分别为−0.422 V(阴极峰)和 −0.381 V(阳极峰). 为了消除包括溶液组分和背景信号等因素的干扰,用高灵敏度的DPVs对EET相关的氧化还原进行了研究测试(图6d)[25]. NB1000阳极存在两对氧化还原峰,分别为 −0.422 V(阴极峰)、−0.381 V(阳极峰)和−0.0193 V(阴极峰)、−0.0482 V(阴极峰). 其中−0.422 V(阴极峰)和−0.381 V(阳极峰)的氧化还原峰与外膜c型细胞色素OmcA[26]的电势一致. −0.019 V(阴极峰)和0.048 V(阴极峰)接近外膜c型细胞色素MtrC[27]的电位. 已有研究表明,外膜c型细胞色素OmcA和MtrC是与Geobacter和Shewanella[28]进行EET过程相关的必要蛋白[29],除外膜蛋白质外,产电微生物还会分泌电子介导体将电子转递到胞外,这也是产电微生物进行细胞外电子传递的重要途经[30]. 与NB1000阳极相比,B1000和CC阳极只出现一对氧化还原峰,这对峰与外膜c型细胞色素OmcA有关. 这一结果有力地证明了氮掺杂操作有利于电活性微生物分泌c型细胞色素,并通过c型细胞色素将电子转移到阳极上. 此外,石墨氮和吡咯氮是氮掺杂操作的主要贡献者,从分子水平上看,吡咯氮与卟啉铁(外膜c型细胞色素的结构中心)之间具有更好的亲和力[19,31].
-
(1)以吐司为碳前驱体,在1000 ℃下焙烧制备的NB1000电极具有最高的比表面积216.664 m2·g−1和均匀分布的中孔结构,因此选择1000 ℃作为最佳的碳化条件.
(2)氮掺杂的三维多孔碳阳极材料NB1000作为MFCs的阳极,最大功率密度可达3049.714 mW·m−2,分别是不掺杂氮的碳材料N1000和传统碳布阳极CC的1.31倍和6.54倍;最大面积电流密度为7.4464 A·m−2,分别是B1000和CC阳极的1.29倍和1.54倍.
(3)使用廉价的市售吐司成功制备了掺杂氮元素的三维多孔碳基材料,利用氮元素的生物相容性促进产电微生物分泌活度更高的OmcA和MtrC细胞色素从而促进细胞外电子传递. 其中,NB1000中的吡咯氮的结构中心卟啉铁具有较低的吸附能,因此吡咯氮对于产电微生物分泌外膜蛋白MtrC具有贡献作用.
氮掺杂多孔碳材料阳极制备及其在微生物燃料电池上的应用
Preparation of nitrogen-doped porous carbon anode and its application in microbial fuel cells
-
摘要: 微生物燃料电池(MFCs)作为一种可以替代传统能源的生物电化学系统引起研究者的极大兴趣,其阳极材料的构造是目前的研究热点. 本文从改善阳极材料表面物理化学性质的角度出发,用吐司作为多孔碳前驱体,三聚氰胺为氮源,直接烧制氮掺杂三维碳材料,并与不添加氮源的阳极材料和未改性的商用碳布进行比较. 制备的掺氮NB1000阳极具有较大的比表面积(216.664 m2·g−1)和优良的电导率. 利用Geobacter和Shewanella混合菌落在微生物燃料电池(MFCs)中进行培养和性能评价,NB1000阳极的微生物燃料电池最大面功率密度为3049.714 mW·m−2,电流密度为7.4464 A·m−2,分别是普通碳布阳极的6.54倍和1.54倍. 结果表明,NB1000作阳极的MFCs具有较高的功率密度,主要归因于阳极中引入氮掺杂,促进了产电微生物胞外电子传递过程所需的外膜c型细胞色素OmcA和MtrC的分泌.Abstract: Microbial fuel cells (MFCs), as a bioelectrochemical system that can replace traditional energy sources, have attracted great interest of researchers, and the construction of anode materials is the current research focus. In order to improve the physical and chemical properties of the surface of the anode material, the nitrogen-doped three-dimensional carbon material was directly sintered by using toast as the porous carbon precursor and melamine as the nitrogen source, and compared with the anode material without adding nitrogen source and the unmodified commercial carbon cloth. The nitrogen-doped NB1000 anode has a large specific surface area (216.664 m2·g−1) and excellent conductivity. A mixed Geobacter and Shewanella colony was used to culture and evaluate the performance of MFCs, and the maximum areal power density and current density of the microbial fuel cell with NB1000 anode were 3049.714 mW·m−2 and 7.4464 A·m−2. It is 6.54 times and 1.54 times that of ordinary carbon cloth anode, respectively. The results showed that the high power density of MFCs from NB1000 anode was due to the introduction of nitrogen into the anode, which promoted the secretion of c-type cytochromes OmcA and MtrC in the outer membrane, which were required for the extracellular electron transport process of electrogenic microorganisms.
-
我国重金属的生产量与消费量与日俱增,这带来了一系列环境污染问题[1-3]. 铬(Cr)具有高毒性、普遍性和持久性,被美国环保署(EPA)列为首要污染物之一[4]. Cr一般以两种形式存在于环境中:Cr(Ⅵ)和Cr(Ⅲ). Cr(Ⅲ)毒性较小且不溶,而Cr(Ⅵ)毒性是Cr(Ⅲ)的100倍,且具有高度的溶解性和流动性[5],对人体有严重危害[6]. 全球大约80%的Cr被开采后用于冶金行业[7],这些Cr废弃物的自然浸出会使得Cr(Ⅵ)在环境中迁移,造成污染[8]. 我国每年产出大量的Cr废弃物[9],土壤中Cr含量平均值已达78.94 mg·kg-1[10],高于规定要求,需要对Cr污染土壤进行有效治理.
零价铁(ZVI)具有比表面积大、反应活性高、还原能力强等优点,被广泛应用于Cr(Ⅵ)污染土壤的修复[11-12]. 黄铁矿(FeS2)常被用于吸附有机污染物和重金属,其成分为Fe2+和S22−还原基团,可以有效地促进Cr(Ⅵ)的还原与固定[13]. 但ZVI容易表面聚集,会降低其还原能力,且在施用过程中存在过度释放Fe的问题[14],导致土壤孔隙度降低并引起骨料胶结,影响土壤结构[15];天然黄铁矿表面钝化严重[16],导致其与Cr(Ⅵ)反应较慢,这些问题限制了二者的应用. 生物炭(Biochar)是由富含碳的生物质在缺氧条件下热解产生的[17],其原料来源广且价格低[18],是一种环境友好型材料[19]. 生物炭表面官能团丰富,其中羟基、氧羧基和酚类官能团可与土壤中的污染物结合[20],羧酸(COOH)、C=O等可与重金属结合[21]. 生物炭的多孔结构和大比表面积为重金属提供了可观的吸附位点[22],可降低其在土壤中的迁移性[23],已被广泛应用于土壤修复方面[24-25]. 此外,生物炭可作为ZVI等金属材料的载体[26],起到分散作用,减缓钝化现象,有利于重金属污染的治理. 水热炭(Hydrochar)是指一定湿度的生物质在较低温度和一定压力下进行炭化得到的生物炭[27]. 相比热解炭,水热炭无需预处理,耗能低,产率高,孔隙结构发达,有机质含量更高[28-29],对污染土壤具有良好的修复潜力. Teng等[30]利用Fe改性水热炭降低了土壤中Pb和Sb的生物有效性. Xia等[31]制备氨基改性水热炭,施用后土壤中Cu、Pb和Cd的生物有效性、淋溶毒性及在水稻中的富集量均不同程度下降. 然而相比于热解生物炭的广泛应用,水热炭针对特定土壤环境的改性应用研究较少,需要进一步进行实验探究.
机械球磨法[32]可将材料尺寸粉碎至纳米级,并使元素分布均匀,经济高效且操作简单. 本实验采用机械球磨法将ZVI、黄铁矿分别负载在玉米秸秆水热炭上,制备成两种铁改性水热炭,主要目的如下:(1)通过土壤提取实验,研究ZVI、黄铁矿、水热炭及改性炭对土壤中Cr的固定作用,并测定土壤中有效铁的含量,验证两种改性水热炭是否有助于解决过度释放Fe的问题;(2)通过土柱淋溶实验进一步探索改性水热炭对土壤中Cr的固化效能,分析土壤中Cr的纵向迁移规律,同时对实验材料进行表征分析,初步探究水热炭对Cr污染土壤的机制,得出最佳改性水热炭.
1. 材料与方法(Materials and methods)
1.1 土壤与材料
Cr污染土壤取自山东省某化工厂,土壤风干后,去除石子等杂质,研磨后过40目筛备用,同时取普通未污染土壤进行相同处理. 对两种土壤基本理化性质进行测定,结果见表1. 主要实验仪器见表2,实验所用零价铁(ZVI)平均粒径为48 μm;黄铁矿(FeS2)平均粒径为45 μm.
表 1 土壤理化性质Table 1. Soil physicochemical properties土壤Soil pH 有机质/(g·kg−1)Organic matter 阳离子交换容量/(cmol·kg−1)Cation exchange capacity 总铬/(mg·kg−1)Total chromium Cr(Ⅵ)/(mg·kg−1) 有效铁/(mg·kg−1)Available iron 污染土壤 8.49 ± 0.05 40.64 ± 0.05 21.84 ± 1.05 9540.51 ± 7.5 1059.51 ± 5 27.86 ± 2.51 未污染土壤 7.64 ± 0.05 20.51 ± 1.04 12.44 ± 0.75 ND ND 4.86 ± 1.05 注:ND未检出. ND, no detected. 表 2 主要实验仪器Table 2. Main experimental instruments名称Instrument name 型号Product model 厂家Manufacturer 火焰原子吸收分光光度计 ICE 3500 赛默飞世尔科技公司 行星式球磨仪 QXQM-80 长沙天创粉末技术有限公司 马弗炉 SX2-8-10Z 上海博迅实业有限公司医疗设备厂 反应釜 SLM100 北京世纪森朗实验仪器有限公司 恒温振荡摇床 SHA-CA 常州恒睿仪器设备制造有限公司 扫描电子显微镜 FEI Quanta 400 FEG 美国FEI公司 傅里叶变换红外光谱仪 TENSOR Ⅱ 德国布鲁克光谱仪器公司 X射线光电子能谱仪 K-Alpha 赛默飞世尔科技公司 1.2 生物炭的制备与表征
将玉米秸秆置于马弗炉中,在500 ℃下反应3 h,制得热解生物炭(BC);将玉米秸秆与水以1:20的质量比混合后置于反应釜中,在300 ℃下反应1 h,制得水热生物炭(SBC);将SBC分别与ZVI、黄铁矿以不同质量比置于球磨机中,以550 r·min−1运行3 h,制得不同炭铁质量比的ZVI改性水热生物炭(ZBC)和黄铁矿改性水热生物炭(HBC),所有制得的生物炭均过100目筛使其均质. 对改性水热炭的表面形貌、官能团以及施加到土壤前后的元素及价态的变化进行表征.
1.3 实验设计
1.3.1 土壤提取实验
(1)热解炭与水热炭对土壤中Cr赋存形态的影响
以8 g·kg−1 的投加量向20 g污染土壤分别投加BC、SBC,混匀后置于50 mL离心管,调土壤含水率为30%,静置15 d后采用Tessier法[33]对土壤的Cr进行提取分析,每个处理重复3次并作对照实验.
(2)改性水热炭对土壤中Cr固化效能的影响
以10 g·kg−1 的投加量向10 g污染土壤分别投加不同改性水热炭,混匀后置于锥形瓶中,再加入100 mL水后放置于摇床中,设置速度为120 r·min−1振荡48 h,分时间取上清液过0.45 μm滤膜后测定总铬浓度,每个处理重复3次并作对照实验.
(3)不同材料对土壤中Cr固化效能的影响
以不同投加量向20 g污染土壤分别投加不同材料,混匀后置于50 mL离心管,调土壤含水率为30%,静置15 d后测定土壤浸出液总铬浓度,并对投加ZVI、黄铁矿、ZBC和HBC的土壤有效铁含量进行测定,每个处理重复3次并作对照实验.
1.3.2 土柱淋溶实验
向Cr污染土壤中分别加入5 g·kg−1的ZBC和HBC,保持土壤含水率为30%,在恒温培养箱中培养20 d备用,并作未施加炭的对照实验(CK). 土柱装置为高20 cm、内径4 cm的圆型有机玻璃柱,底部开口连接橡胶管,用于收集浸出液. 向土柱下层填充10 cm的未污染土壤,上层分别填充8 cm不同处理的污染土壤,每个处理重复3次. 从底部注水使土壤饱和后静置24 h,随后从顶部进行淋洗,淋洗液总体积为900 mL,采用间歇浸出法. 得到的浸出液过0.45 μm滤膜后测定总铬浓度. 实验结束后将土柱上下层分段取出,将上层土壤风干后过100目筛得到施加到土壤中的炭,并进行表征;测定下层土壤总铬与Cr(Ⅵ)浓度,观察Cr的纵向迁移性.
1.4 测定方法
土壤总铬浓度的测定参照HJ 491—2019,Cr(Ⅵ)浓度的测定参照HJ 1082—2019,土壤浸出液中总铬浓度的测定参照HJ 749—2015;土壤有效铁含量的测定采用火焰原子吸收分光光度法测定,测定前使用二乙基三氨五乙酸法浸提.
2. 结果与讨论(Results and discussion)
2.1 热解炭与水热炭对土壤中Cr赋存形态的影响
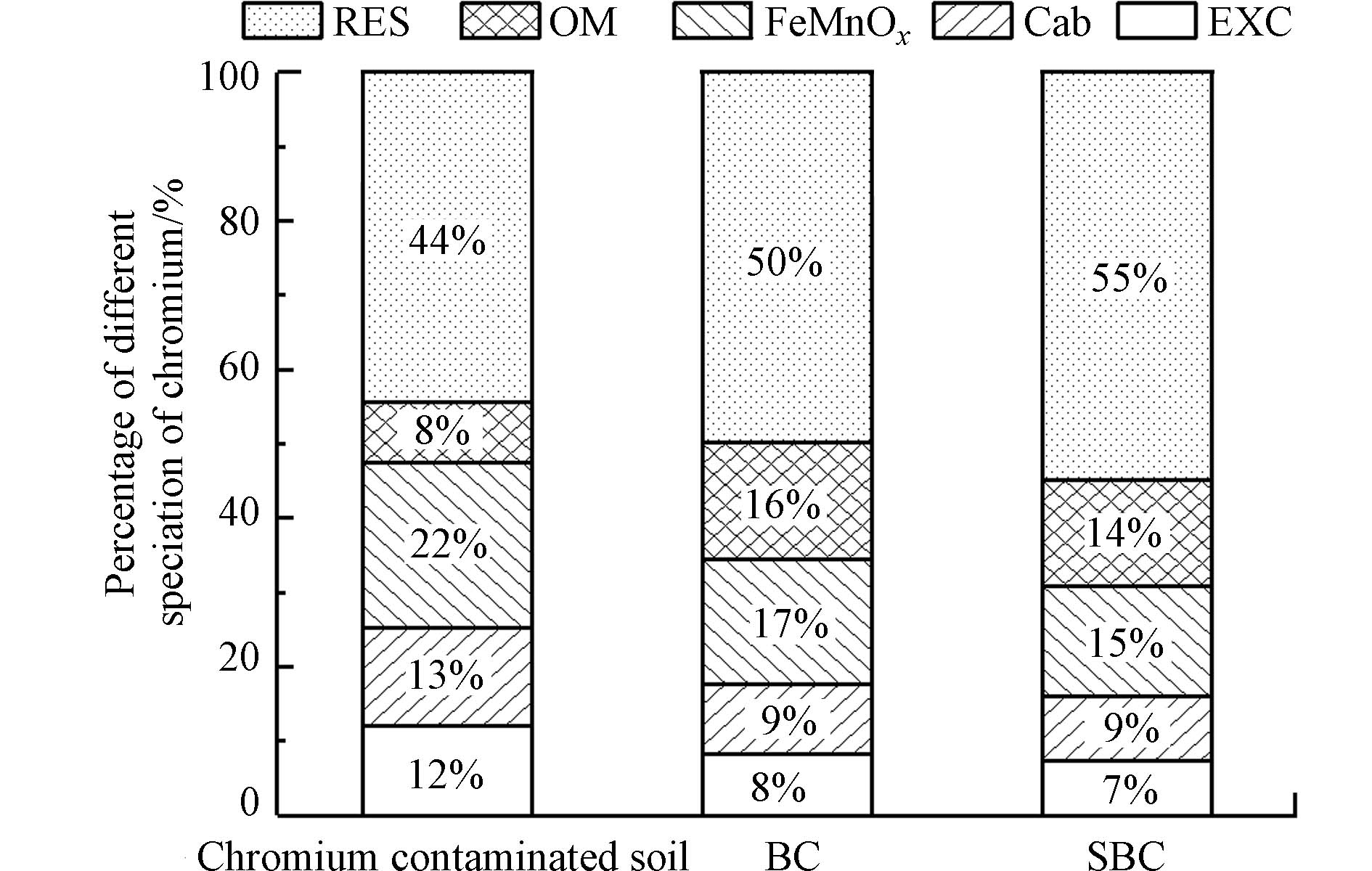
Tessier五步提取法可以把土壤中的Cr分为5种形态,这些形态按照生物利用度和其毒性大小由低到高依次为残渣晶格结合态(RES)、有机质及硫化物结合态(OM)、铁锰氧化物结合态(FeMnOx)、碳酸盐结合态(Cab)、金属可交换态(EXC). 结果如图1所示,与对照土壤相比,施用生物炭处理促进了EXC、Cab和FeMnOx向OM和RES转化,土壤中Cr的稳定性提高,毒性下降. EXC、Cab和FeMnOx组分主要由可溶性高、交换性较强的重金属离子及其碳酸盐态组成[34],这些组分的减少说明生物炭施用后土壤中Cr的稳定性提高. 除生物炭的吸附作用外[35],生物炭与Cr(Ⅵ)的静电吸引以及与Cr(Ⅲ)的络合反应[36]也可能是Cr稳定性提升的原因. 而与BC处理相比,SBC处理后(OM+RES)组分占比增加更为显著,这表明水热炭对土壤中Cr的固定效果更好,可能是由于水热炭拥有更丰富的表面官能团,通过配位键等作用将重金属由活性状态转化为惰性状态[37].
2.2 改性水热炭对土壤中Cr固化效能的影响
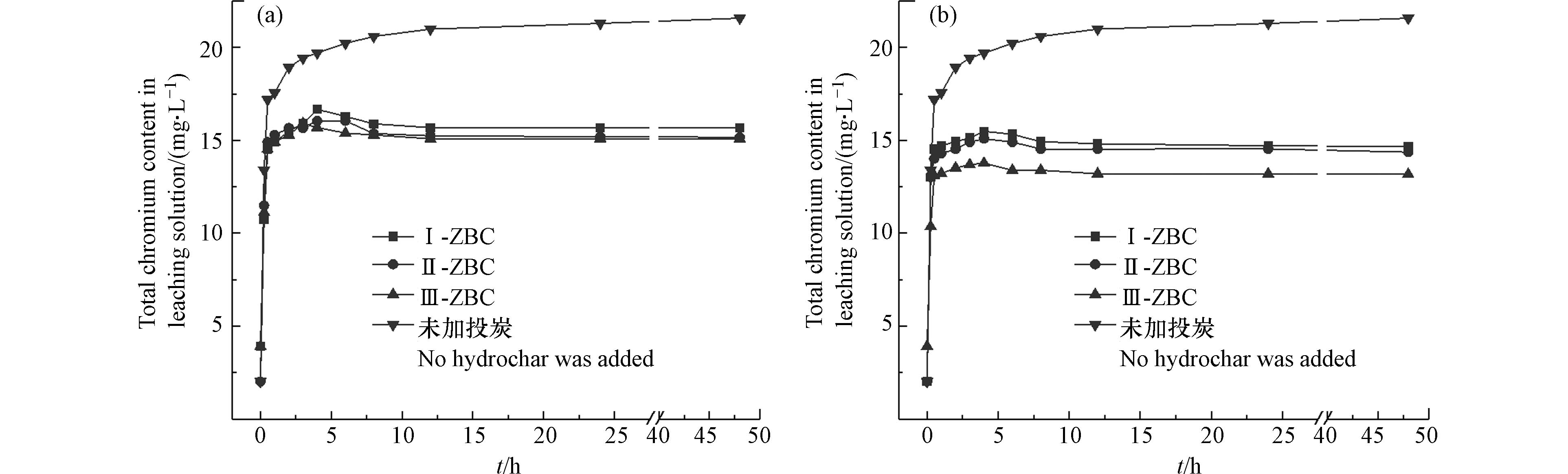
按炭铁质量比2:1、1:1、1:2,将ZVI改性水热炭依次记作Ⅰ-ZBC、Ⅱ-ZBC、Ⅲ-ZBC,将黄铁矿改性生物炭依次记作Ⅰ-HBC、Ⅱ-HBC、Ⅲ-HBC. 由图2可知,施用改性水热炭均降低浸出液总铬含量. 其中施用Ⅰ-ZBC、Ⅱ-ZBC、Ⅲ-ZBC浸出液总铬浓度分别下降27.4%、29.7%、30.0%,彼此无显著差异;施用Ⅰ-HBC、Ⅱ-HBC、Ⅲ-HBC浸出液总铬浓度分别下降32.0%、33.4%、38.9%,整体处理效果优于ZBC,Ⅲ-HBC处理效果突出.
从图2中看出,Cr的释放过程分为两个阶段[38]. 第一阶段土壤表面吸附的Cr和土壤中迁移性较强的Cr(Ⅵ)迅速释放到溶液中,浸出液总铬浓度快速升高. 与对照实验(CK)相比,添加ZBC、HBC后总铬含量显著降低,且增长速率减缓. 在反应进行1 h后进入第二阶段,此时Cr的释放由土壤颗粒表面转为内部,释放速度降低. 施加ZBC、HBC的土壤浸出液总铬浓度在4 h达到最大值后呈下降趋势. 而未投加炭的对照组总铬浓度在6 h后变化趋于平稳,但仍呈上升状态. 因此,施加ZBC、HBC对土壤中的Cr有固定作用. 根据实验结果,选择处理效果较好的Ⅲ-ZBC和Ⅲ-HBC进行后续实验研究,后续提到的ZBC、HBC均为Ⅲ-ZBC、Ⅲ-HBC.
2.3 不同材料对土壤中Cr固化效能的影响
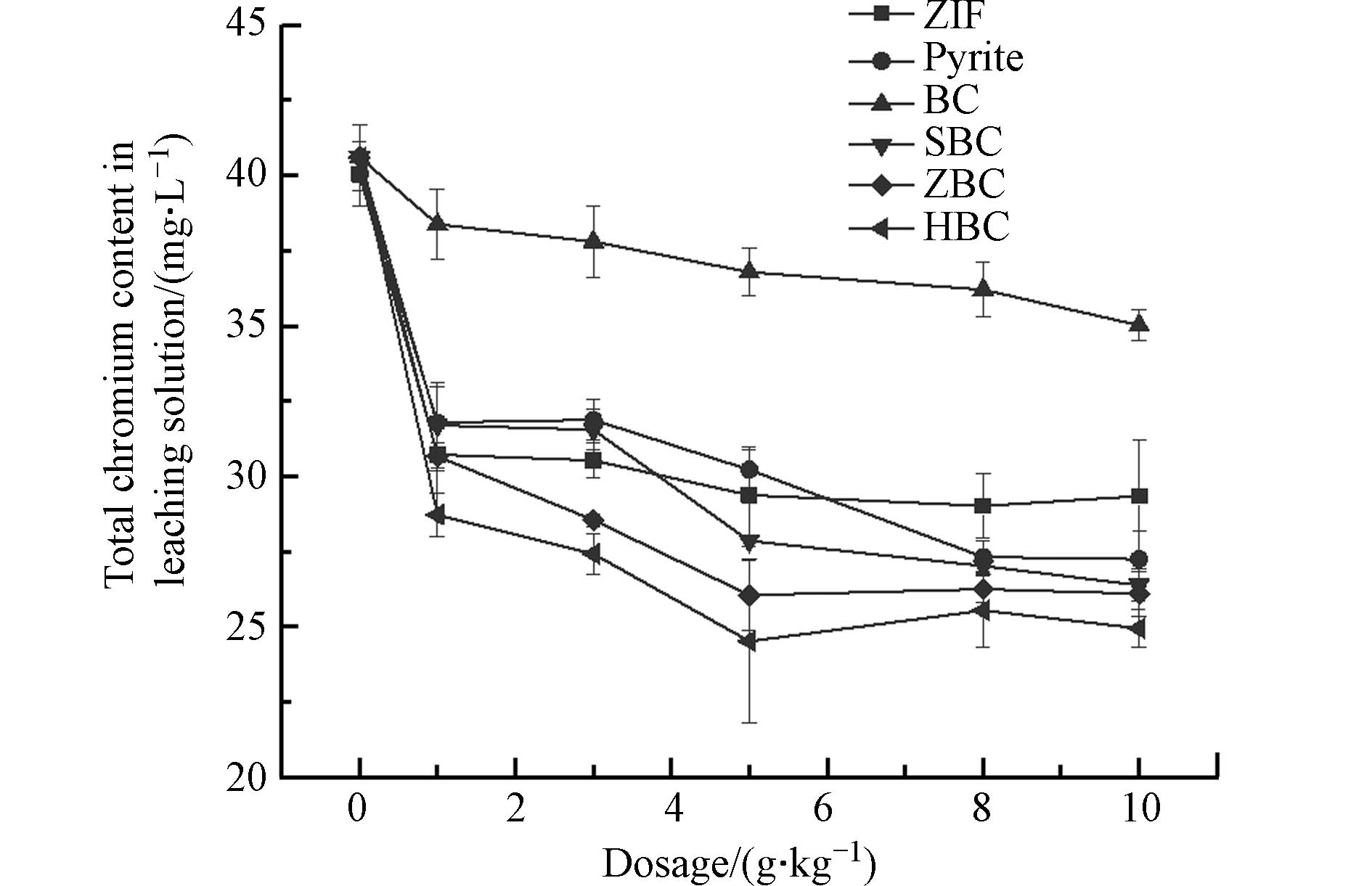
从图3可知,随材料投加量的增加,土壤浸出液中总铬含量整体均呈下降趋势. ZVI在投加量为8 g·kg−1时达到最佳处理效果,此时总铬含量为29.012 mg·L−1,与对照组相比降低27.5%. 增大投加量到10 g·kg−1时,总铬浓度反而上升,可能是高投加量下ZVI会因其磁性造成颗粒团聚,导致炭表面活性位点减少[14]. 且ZVI将Cr(Ⅵ)还原成Cr(Ⅲ)会在其表面形成氧化膜,阻碍活性位点与重金属接触[39]. 相比ZVI,黄铁矿处理效果更好,在投加量为8 g·kg−1时浸出液总铬含量降低到27.3 mg·L−1,与对照组相比降低31.8%. 在所有材料中,BC处理效果最差,投加量为10 g·kg−1时浸出液总铬含量仅降低13.4%,而SBC处理效果较好. 随SBC投加量的增加,其处理效果显著增强. 当投加量为10 g·kg−1时,浸出液总铬含量降低到26.4 mg·L−1,与对照组相比降低35.0%. 这可能是由于水热炭拥有更丰富的表面含氧官能团(如羧基、羟基等),对Cr有更强的吸附能力[40]. 两种改性水热炭处理效果更为优秀,且达到最佳处理效果所需投加量较低,节省材料使用量. 这可能是因为球磨改性后炭颗粒粒径变小,比表面积增大[41],ZVI、黄铁矿较好地负载到炭骨架上,且铁颗粒的团聚现象减弱,增强改性炭对土壤中Cr的吸附和还原能力[26]. 在5 g·kg−1最佳投加量下,ZBC处理后浸出液总铬含量降低到26.0 mg·L−1,比对照组降低35.8%;而HBC处理效果最好,其浸出液总铬含量降低到24.5 mg·L−1,比对照组降低39.6%.
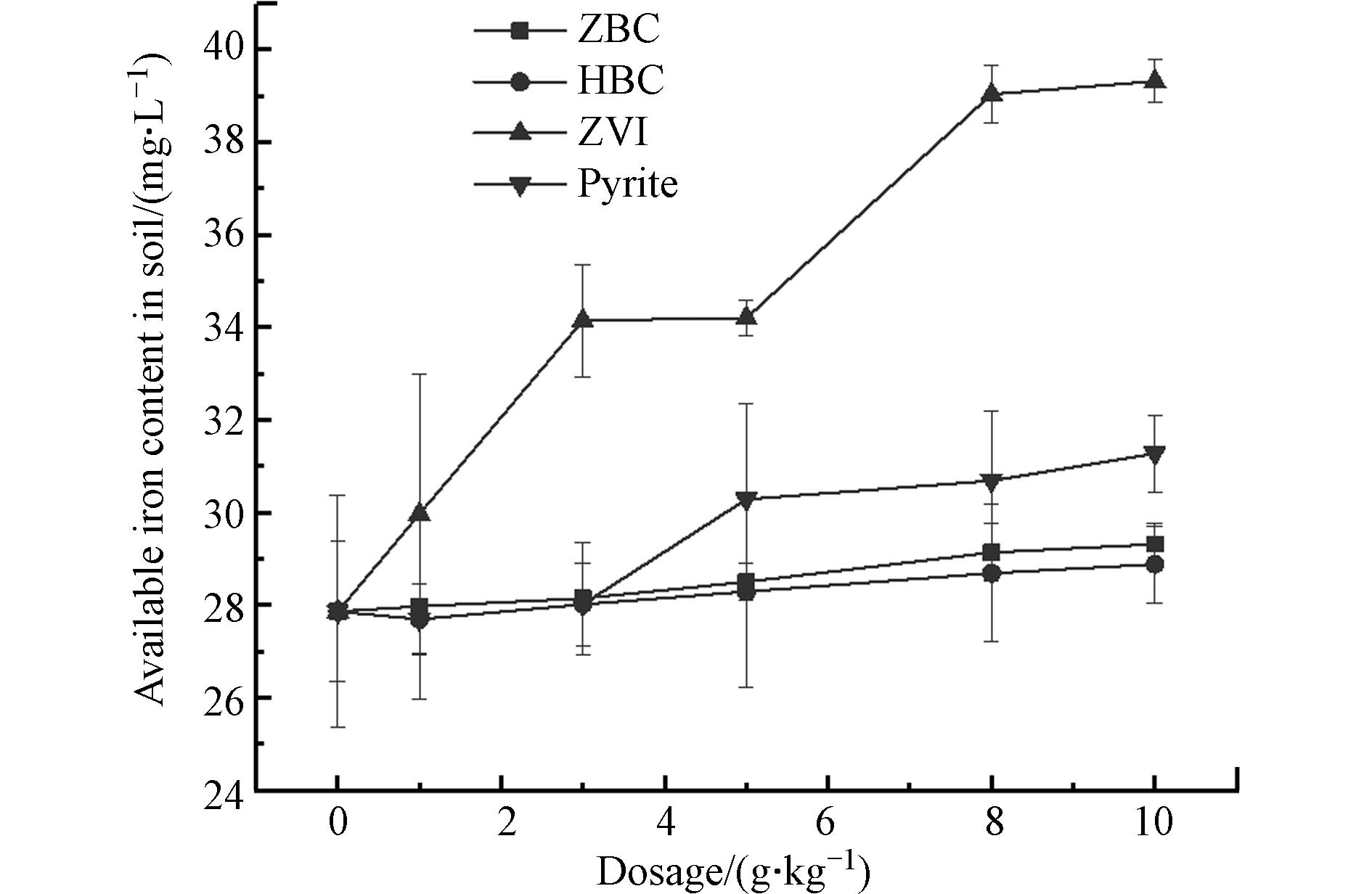
施用ZVI、黄铁矿等进行土壤修复时存在Fe释放过度的问题[14],因此对投加ZVI、黄铁矿、ZBC和HBC的土壤中的有效铁含量进行测定,结果如图4所示.
随ZVI、黄铁矿投加量的增加,土壤中有效铁含量增加. 在最佳投加量8 g·kg−1的条件下,ZVI处理使土壤中有效铁含量增加40.1%,黄铁矿处理使土壤中有效铁含量增加10.1%. 而ZBC、HBC投加量的增加对土壤中有效铁含量影响较小,在投加量为5 g·kg−1的条件下,土壤中有效铁含量的分别增长0.6 mg·L−1和0.4 mg·L−1,涨幅均小于0.1%,有效解决Fe释放过度的问题.
2.4 改性水热炭的表征及固化土壤中Cr的机制分析
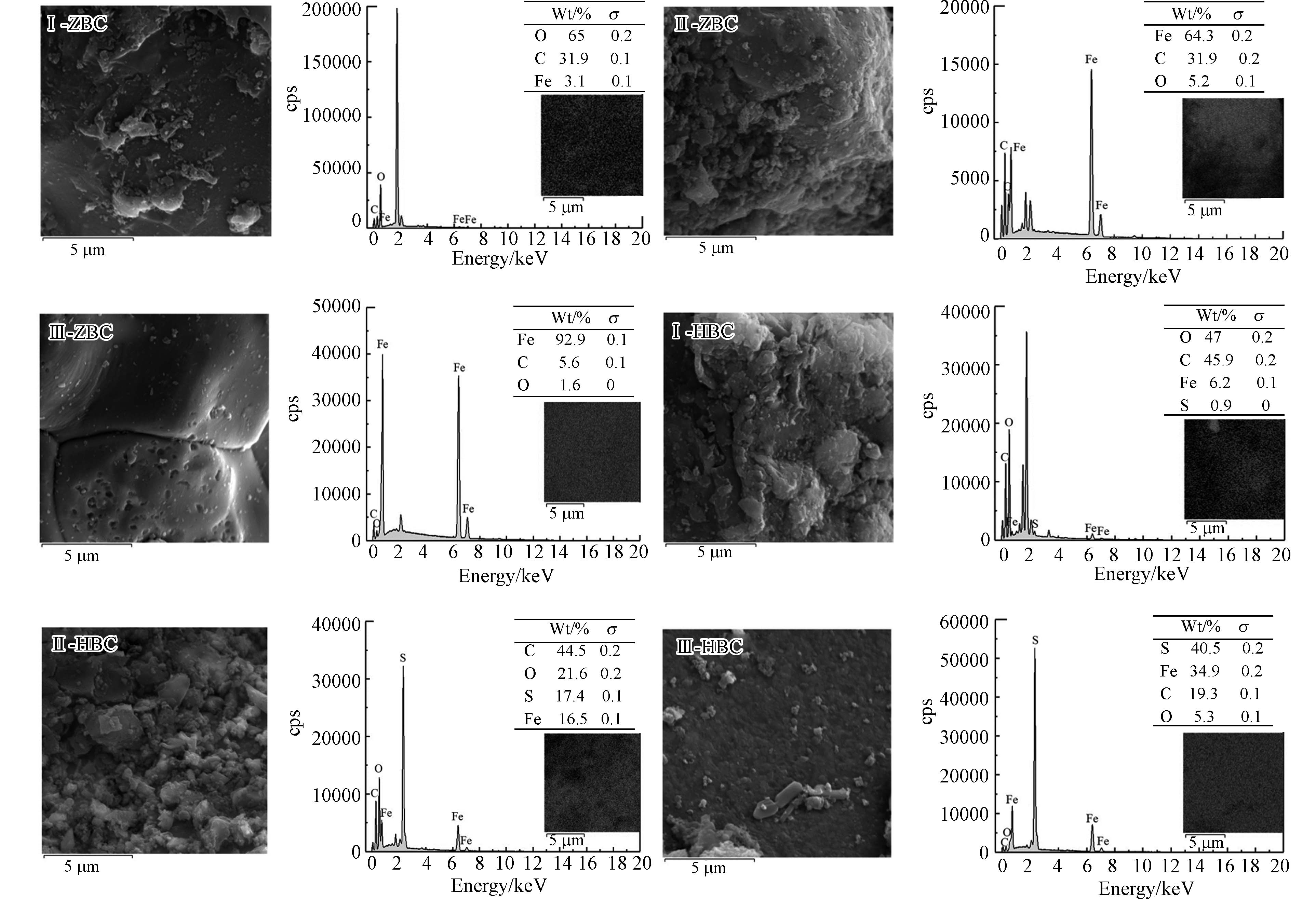
2.4.1 改性水热炭表面形貌及mapping分析
6种改性水热炭的表面形貌及对应的mapping测试结果见图5,可以看到经过球磨后,ZVI、黄铁矿在炭表面分散,炭的表面粗糙,结构不规则. 低铁炭掺杂比的炭存在着Fe元素分布较少或颗粒团聚的现象[14],这可能会导致炭有效孔隙和活性位点减少,降低炭的吸附能力. 随着铁炭掺杂比增大,Fe元素重量百分比上升,分布愈发均匀. 这可能是由于较多ZVI、黄铁矿可与水热炭在球磨过程中更充分地相互摩擦和碰撞,通过球磨介质的作用,使其在生物炭断裂、变形过程中分布到生物炭的表面及孔隙结构中[26],增加炭的活性位点,增强对Cr的吸附能力[42].
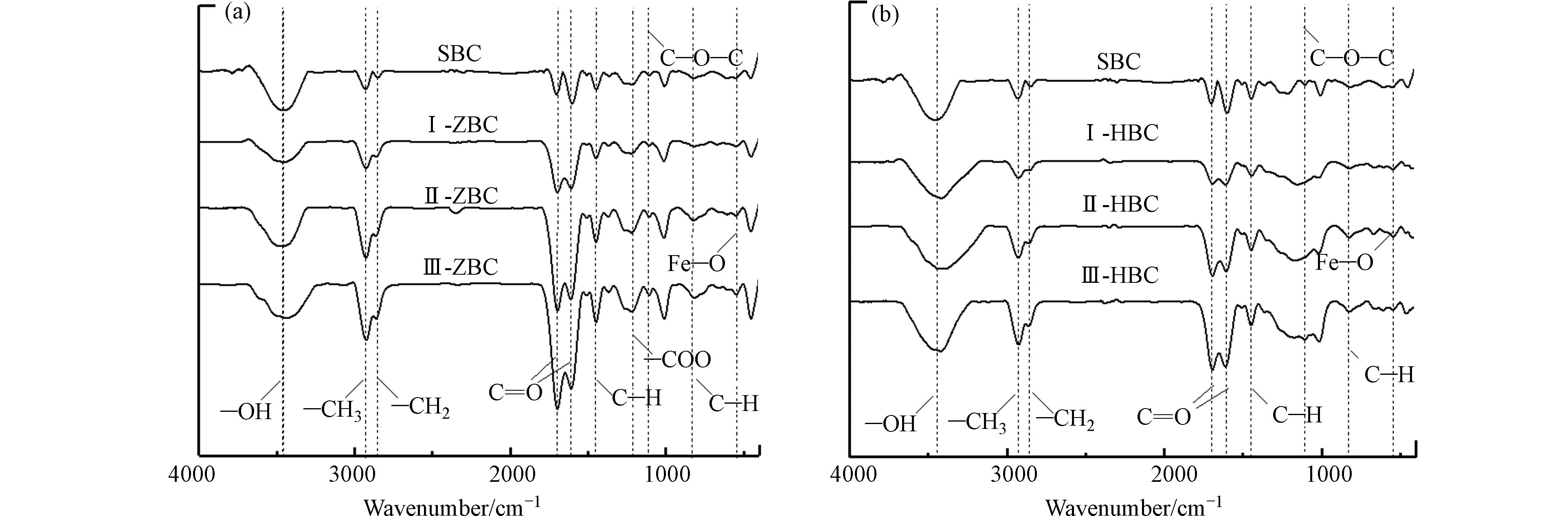
2.4.2 改性水热炭表面官能团分析
为进一步探究水热炭改性后对土壤中Cr的固定机理,对SBC和6种改性水热炭的红外特征峰进行分析(图6). O—H等氧化还原活性官能团被认为是生物炭氧化还原能力的驱动力[17],可与重金属阳离子交换[43]. 1730—1734 cm−1处羧基、醛、酮和酯类基团上的C=O峰和1612—1615 cm−1处C=C、C=O峰的强度随着铁炭掺杂比的增加而增大,说明改性后炭含氧官能团增加. C=O等含氧官能团可以为重金属提供大量结合位点,增加炭吸附能力,形成络合物[21]. 543 cm−1处为Fe—O的弱峰[44],证明Fe与含氧基团结合,成功地负载在水热炭表面.
2.4.3 改性水热炭元素价态分析
对两种改性水热炭施加到土壤前后的样品进行XPS测定,结果如图7所示. 观察全谱图可得,二者全谱图中均存在Fe峰,说明Fe成功负载到炭骨架上,其中HBC表面还存在S元素. 炭在施加到土壤后全谱图中均出现Cr峰,且O峰的强度增加,说明改性水热炭可能将Cr吸附在表面并形成铁铬氧化物. 对比施加前后的Fe2p谱图,代表Fe(Ⅱ)的峰强度均下降,Fe(Ⅲ)峰强度相对增强,表明ZBC、HBC中的Fe对土中的Cr(Ⅵ)具有还原能力. 在HBC的Fe2p谱图中,代表FeS2[45-46]的峰强度前后变化明显,这表明FeS2参与了对Cr(Ⅵ)的还原. Cr2p谱图中在577—579 eV处存在代表Cr(Ⅲ)的多重轨道分裂峰[47],表明炭表面存在Cr的氧化物和氢氧化物;在580 eV附近存在代表Cr(VI)的弱峰且拟合较差,进一步说明ZBC、HBC将污染土中的Cr(Ⅵ)还原成Cr(Ⅲ),炭表面不存在或存在极少量的Cr(Ⅵ).
 图 7 不同改性水热炭XPS谱图:Figure 7. XPS images of different modified hydrochar(a) ZBC施加到土壤前后的全谱图;(b) ZBC施加到土壤前的Fe2p谱图;(c) ZBC施加到土壤后的Fe2p谱图;(d) HBC施加到土壤前后的全谱图XPS谱图;(e) HBC施加到土壤前的Fe2p谱图;(f) HBC施加到土壤后的Fe2p谱图;(g) ZBC施加到土壤后的Cr2p谱图;(h) HBC施加到土壤后的Cr2p谱图(a) XPS survey of ZBC before and after it was placed to the soil; (b) Fe2p image of ZBC before it was placed to the soil; (c) Fe2p image of ZBC after it was placed to the soil; (d) XPS survey of HBC before and after it was placed to the soil; (e) Fe2p image of HBC before it was placed to the soil; (f) Fe2p image of HBC after it was placed to the soil; (g) Cr2p image of ZBC after it was placed to the soil; (h) Cr2p image of HBC after it was placed to the soil
图 7 不同改性水热炭XPS谱图:Figure 7. XPS images of different modified hydrochar(a) ZBC施加到土壤前后的全谱图;(b) ZBC施加到土壤前的Fe2p谱图;(c) ZBC施加到土壤后的Fe2p谱图;(d) HBC施加到土壤前后的全谱图XPS谱图;(e) HBC施加到土壤前的Fe2p谱图;(f) HBC施加到土壤后的Fe2p谱图;(g) ZBC施加到土壤后的Cr2p谱图;(h) HBC施加到土壤后的Cr2p谱图(a) XPS survey of ZBC before and after it was placed to the soil; (b) Fe2p image of ZBC before it was placed to the soil; (c) Fe2p image of ZBC after it was placed to the soil; (d) XPS survey of HBC before and after it was placed to the soil; (e) Fe2p image of HBC before it was placed to the soil; (f) Fe2p image of HBC after it was placed to the soil; (g) Cr2p image of ZBC after it was placed to the soil; (h) Cr2p image of HBC after it was placed to the soil2.5 土柱淋溶实验
2.5.1 土壤淋溶液中Cr的释放
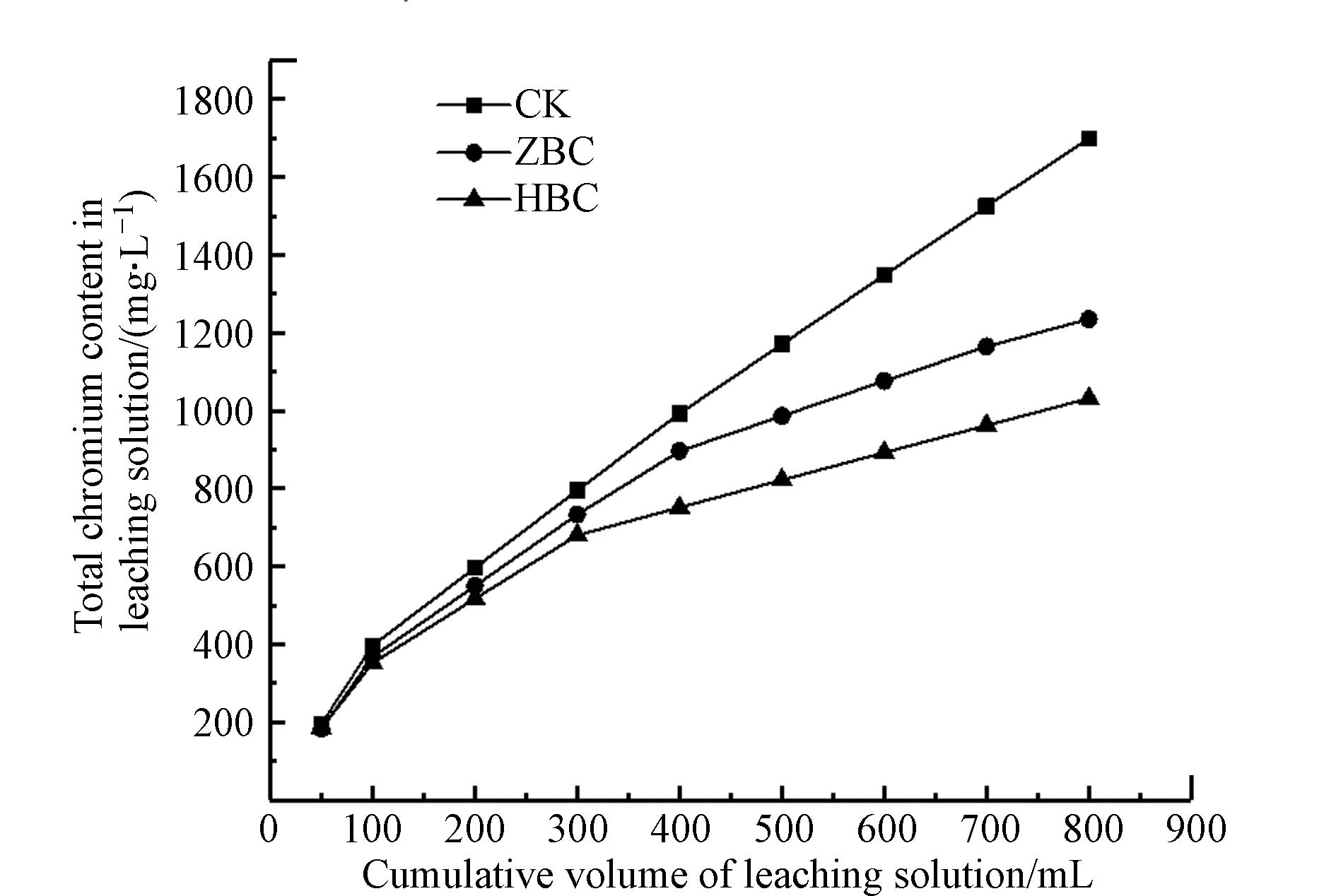
各土柱淋溶液中总铬累积含量变化如图8所示. 在淋溶初期,可溶态重金属快速释放到浸出液中[48],淋溶液中的重金属累积量均快速增加,当淋溶液体积达到300 mL时,ZBC、HBC凭借表面官能团和优秀的吸附性能,将土壤颗粒内部释放的Cr(Ⅵ)还原为较稳定的Cr(Ⅲ)并吸附在炭表面,使得淋溶液中总铬含量的增长速率减缓,而CK淋溶液中的总铬含量一直呈快速上升状态. 实验结束时CK、ZBC、HBC淋溶液总铬含量分别为1700.22、1235.22、1031.49 mg·L−1. 与CK相比,ZBC、HBC总铬含量分别下降27.3%、39.3%,均表现出良好的Cr固定效果,降低了Cr的迁移性.
土壤中重金属迁移、释放和转化的影响因素复杂,采用动力学模型拟合重金属的累积释放有助于了解过程,阐述机理. 双常数速率方程、抛物线扩散方程常用于描述土壤化学过程,表达式如下:
双常数速率方程:lny=a+blnx (1) 抛物线扩散方程:y=a+bx0.5 (2) 式中,y表示重金属释放量;x表示淋溶体积;a、b为常数.
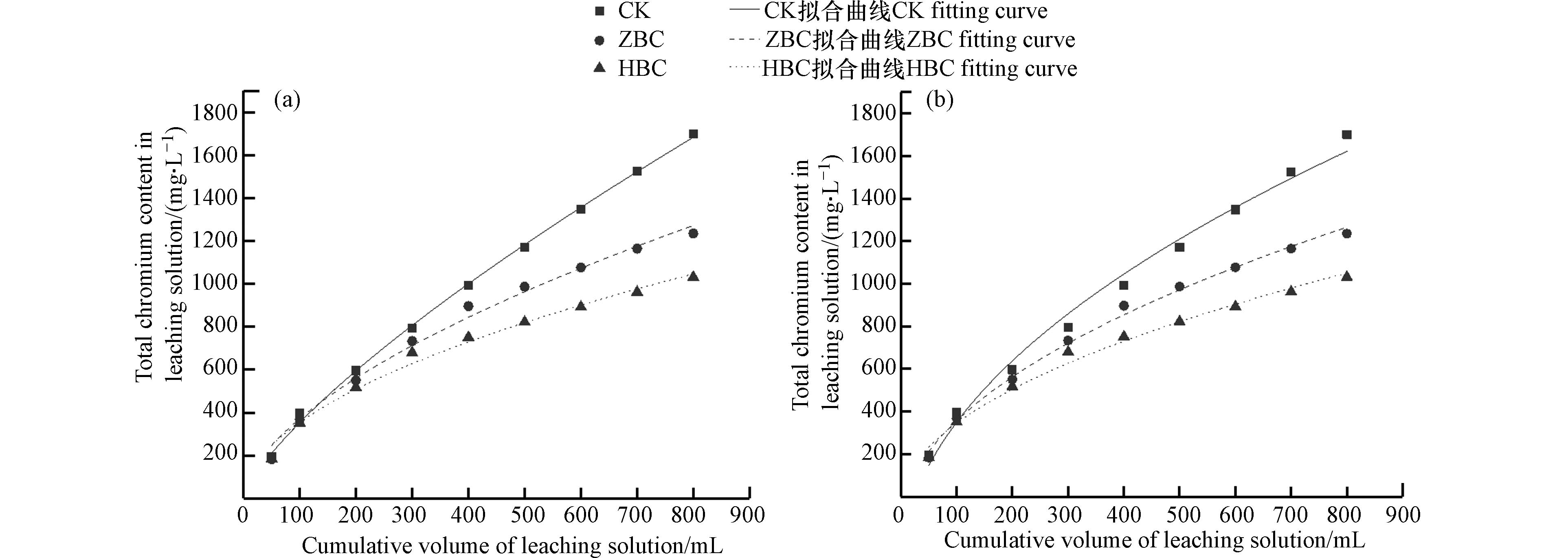
双常数速率方程是一种经验方程,可用于反映重金属与土壤表面吸附亲和力的差异[49]. 而抛物线扩散方程常用于描述土壤内部物质的扩散,反映多个扩散机制共同控制的动力学过程[50]. 采用这两种方程对土壤中Cr的累积释放过程进行拟合,得到结果如图9、表3所示. 总的来说两种动力学模型均能较好地描述各土柱淋溶时释放Cr的动力学过程,这说明Cr在炭土环境中的释放机制复杂. 其中双常数速率方程对CK的拟合效果更为优秀,其模拟结果R2值为0.9985. 这说明未投加改性水热炭时,土壤表面吸附点位对Cr亲和力的差异较大,不能有效固定Cr. 抛物线扩散方程对ZBC和HBC的拟合效果更为优秀,其模拟结果R2值分别为0.9954、0.9887. 这说明投加改性水热炭后,土壤表面的Cr被有效吸附,淋溶液中的Cr主要来自于土壤颗粒内部的扩散作用.
表 3 总铬累积释放的动力学拟合结果Table 3. Kinetic fitting results of cumulative release of total chromium土柱Soil column 双常数速率方程Two-constant rate equation 抛物线扩散方程Parabolic diffusion equation a b R2 a b R2 CK 11.1507 0.7506 0.9985 −346.6836 69.6050 0.9882 ZBC 24.3499 0.5919 0.9900 −140.8598 49.7365 0.9954 HBC 32.3184 0.5203 0.9865 −41.4815 38.5962 0.9887 2.5.2 Cr在土柱中的纵向迁移
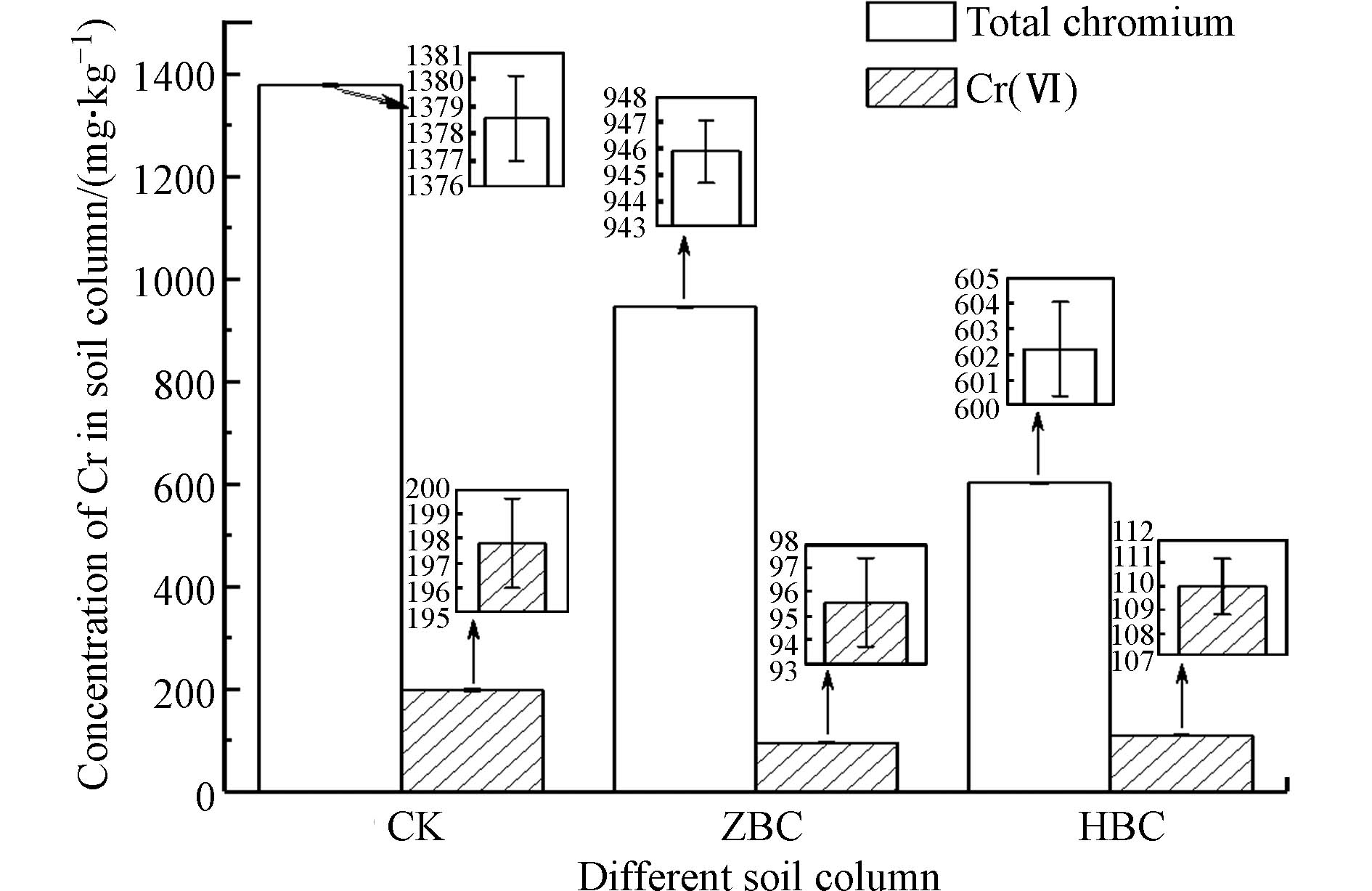
由图10可知,CK土柱中Cr表现出较强的纵向迁移性,在水的淋洗与重力沉降等作用下由上部污染土壤向下部未污染土壤迁移,最终CK土柱下部土壤中总铬浓度为1378.550 mg·kg−1,Cr(Ⅵ)浓度为197.802 mg·kg−1,污染严重. 与CK相比,施加ZBC和HBC后土柱下部土壤的总铬和Cr(Ⅵ)浓度明显下降,其中投加ZBC的土柱下部土壤中总铬含量相比CK降低31.4%,Cr(Ⅵ)浓度相比CK降低51.7%;投加HBC的土柱下部土壤中总铬含量相比CK降低56.3%,Cr(Ⅵ)浓度相比CK降低44.4%.
Cr(Ⅵ)在土壤中的离子态主要为HCrO4−和CrO4−,由于污染土壤pH为8.49,偏碱性,HCrO4−更多地转变为CrO4−. 负载ZVI的ZBC会与CrO4−在土壤中发生以下反应[51]:
2CrO2−4+3Fe0+16H+→2Cr3++3Fe2++8H2O (3) CrO2−4+3Fe2++8H+→Cr3++3Fe3++4H2O (4) (1−x)Fe3++xCr3++3H2O→CrxFe1−x(OH)3+3H+ (5) 通过Fe0、Fe2+的还原能力,最终将Cr(Ⅵ)还原成Cr(Ⅲ),并形成CrxFe1-x(OH)3,固定在土壤中. 从反应式可以看出,酸性条件更利于反应进行,而本实验污染土壤偏碱性,这可能是导致ZBC施加后总铬浓度降低效果较HBC差的一个原因. 而负载黄铁矿(FeS2)的HBC则与CrO4−在土壤中发生以下反应[52]:
FeS2+CrO2−4+4H2O→Fe3++Cr3++2S0+8OH− (6) 4S0+4OH−→S2O2−3+2HS−+H2O (7) HS−+S0→S2−2+H+ (8) 且最终Fe3+与Cr3+会发生式(5)反应. 其中S0及其水解产物(S2O32−、S22−)可长期保持土壤对Cr(Ⅵ)的还原能力[52]. 结合XPS表征结果,可知HBC中的FeS2参加反应,而在整个氧化过程中,FeS2可向Fe3+和SO42−提供15个电子,更有利于对Cr(Ⅵ)的还原,故施加HBC后土柱总铬浓度下降明显,更多的Cr(Ⅵ)被还原成Cr(Ⅲ)固定在土壤中. 但ZBC施加后Cr(Ⅵ)浓度降低效果优于HBC,结合浸出液总铬浓度进行分析,可能是由于土壤偏碱性,ZBC与土壤中的Cr(Ⅵ)反应较缓,未完全反应的Cr(Ⅵ)随淋洗液的冲洗快速下沉,使得浸出液中总铬浓度明显升高,而土柱中Cr(Ⅵ)浓度下降. 总的来看,施加HBC后土柱及其淋洗液中的总铬浓度下降程度更大,说明其对污染土壤中的Cr具有更好的固定效果.
3. 结论(Conclusion)
(1)施加水热炭(SBC)使土壤中稳定性高、毒性低的有机质及硫化物结合态(OM)和残渣晶格结合态(RES)的Cr增加17%,处理效果优于热解炭(BC).
(2)土壤提取实验表明,较大铁炭掺杂比(2:1)制备的改性水热炭ZBC、HBC在低投加量(5 g·kg−1)下对土壤中的Cr表现出更好的固定效果,与对照组相比其土壤浸出液中总铬浓度分别降低了35.8%、39.6%,既节省了材料用量,且不存在向土壤中过度释放铁的现象.
(3)土柱淋溶实验表明,Cr在炭土环境中的释放机制复杂,双常数速率方程对CK土柱拟合较好,表明未施加炭时,土壤表面吸附点位对Cr亲和力的差异较大,不能有效固定Cr;抛物线扩散方程对ZBC和HBC土柱拟合较好,表明投加炭后土壤表面的Cr被有效吸附,淋溶液中的Cr主要来自土壤颗粒内部的扩散作用.
(4)土柱实验结束后,ZBC土柱下部未污染土壤中总铬含量相比CK降低了31.4%,Cr(Ⅵ)浓度相比CK降低了51.7%;HBC土柱下部未污染土壤中总铬含量相比CK降低了56.3%,Cr(Ⅵ)浓度相比CK降低了44.4%. 结合表征结果可得,ZBC、HBC可吸附对土中的Cr,水热炭负载的Fe对土中的Cr(Ⅵ)具有还原能力,可将其还原成Cr(Ⅲ)固定在土壤中. HBC中存在FeS2,有效参与对Cr(Ⅵ)的还原,对污染土壤中Cr的固化效果更好. 此材料可为水热炭修复重金属污染土壤的应用提供思路与探索.
-
图 4 (a)输出电压曲线 (b)极化曲线和功率密度曲线 (c) 电极电位(vs SCE)与电流密度的关系 (d) 生物膜形成后的Nyquist图 (e)图d的Nyquist放大图 (f) 生物膜形成后的拟合欧姆电阻和电荷转移电阻
Figure 4. (a) Output voltage curve (b) Polarization curve and power density curve (c) Relation between electrode potential (VS SCE) and current density (d) Nyquist plot after biofilm formation (e) Nyquist magnification of Figure d (f) fitted ohmic resistance and charge transfer resistance after biofilm formation
图 6 N1000,B1000和CC阳极在有底物条件下的CVs曲线(a),在无底物条件下的CVs曲线(b),稳定培养四个周期后的EIS曲线(c),在底物耗尽后于PBS溶液中的DPV曲线(d)
Figure 6. CVs curves of NB1000, B1000 and CC anodes with substrate (a), CVs curves without substrate (b), EIS curves after four cycles of stable culture (c) ,DPV curves in PBS solution after substrate depletion (d)
表 1 NBs的比表面积
Table 1. Specific surface area of NBs
样品 Samples NB1100 NB1000 NB9000 NB800 NB700 SBET/(m2·g−1) 61.028 216.664 92.045 82.813 45.634 Note: SBET: the specific surface area. -
[1] SLATE A J, WHITEHEAD K A, BROWNSON D A C, et al. Microbial fuel cells: An overview of current technology [J]. Renewable and Sustainable Energy Reviews, 2019, 101: 60-81. doi: 10.1016/j.rser.2018.09.044 [2] 蒋杭城, 许蕾, 谢静, 等. 超声预处理对剩余污泥微生物燃料电池性能的影响 [J]. 环境化学, 2015, 34(5): 989-994. doi: 10.7524/j.issn.0254-6108.2015.05.2014091201 JIANG H C, XU L, XIE J, et al. The effect of ultrasonic pretreated excess sludge on the performance of microbial fuel cells [J]. Environmental Chemistry, 2015, 34(5): 989-994(in Chinese). doi: 10.7524/j.issn.0254-6108.2015.05.2014091201
[3] 刘岩婉晶, 赵倩楠, 葛润蕾, 等. 微生物燃料电池阳极产电菌电子转移主要机制及其影响因素 [J]. 环境化学, 2019, 38(8): 1745-1756. doi: 10.7524/j.issn.0254-6108.2018101005 LIU Y, ZHAO Q N, GE R L, et al. Research progress on electron transfer mechanism and its influencing factors on microbial fuel cells anode exoelectrogens [J]. Environmental Chemistry, 2019, 38(8): 1745-1756(in Chinese). doi: 10.7524/j.issn.0254-6108.2018101005
[4] PALANISAMY G, JUNG H Y, SADHASIVAM T, et al. A comprehensive review on microbial fuel cell technologies: Processes, utilization, and advanced developments in electrodes and membranes [J]. Journal of Cleaner Production, 2019, 221: 598-621. doi: 10.1016/j.jclepro.2019.02.172 [5] CHEN S, PATIL S A, BROWN R K, et al. Strategies for optimizing the power output of microbial fuel cells: Transitioning from fundamental studies to practical implementation[J]. Applied Energy, 2019, 233–234: 15-28. [6] WANG R W, LIU D, YAN M, et al. Three-dimensional high performance free-standing anode by one-step carbonization of pinecone in microbial fuel cells [J]. Bioresource Technology, 2019, 292: 121956. doi: 10.1016/j.biortech.2019.121956 [7] YUAN Y, ZHOU S G, LIU Y, et al. Nanostructured macroporous bioanode based on polyaniline-modified natural loofah sponge for high-performance microbial fuel cells [J]. Environmental Science & Technology, 2013, 47(24): 14525-14532. [8] LI M Z, CI S Q, DING Y C, et al. Almond shell derived porous carbon for a high-performance anode of microbial fuel cells [J]. Sustainable Energy & Fuels, 2019, 3(12): 3415-3421. [9] ZOU L, QIAO Y, WU Z Y, et al. Tailoring Unique Mesopores of Hierarchically Porous Structures for Fast Direct Electrochemistry in Microbial Fuel Cells [J]. Advanced energy materials, 2016, 6(4): 1501535.1-1501535.6. [10] CAI T, MENG L J, CHEN G, et al. Application of advanced anodes in microbial fuel cells for power generation: A review [J]. Chemosphere, 2020, 248: 125985. doi: 10.1016/j.chemosphere.2020.125985 [11] HE Y R, XIAO X, LI W W, et al. Enhanced electricity production from microbial fuel cells with plasma-modified carbon paper anode [J]. Physical Chemistry Chemical Physics:PCCP, 2012, 14(28): 9966-9971. doi: 10.1039/c2cp40873b [12] WU X X, QIAO Y, GUO C X. et al. Nitrogen doping to atomically match reaction sites in microbial fuel cells[J]. Communications Chemistry, 2020, 68(3). [13] YU Y Y, GUO C X, YONG Y C, et al. Nitrogen doped carbon nanoparticles enhanced extracellular electron transfer for high-performance microbial fuel cells anode [J]. Chemosphere, 2015, 140: 26-33. doi: 10.1016/j.chemosphere.2014.09.070 [14] WANG R W, YAN M, LI H D, et al. FeS2 Nanoparticles decorated graphene as microbial-fuel-cell anode achieving high power density[J]. Advanced Materials, 2018, 30(22): 1800618. [15] OH S, MIN B, LOGAN B E. Cathode performance as a factor in electricity generation in microbial fuel cells [J]. Environmental Science & Technology, 2004, 38(18): 4900-4904. [16] QU L T, LIU Y, BAEK J B, et al. Nitrogen-doped graphene as efficient metal-free electrocatalyst for oxygen reduction in fuel cells [J]. ACS Nano, 2010, 4(3): 1321-1326. doi: 10.1021/nn901850u [17] ENGLERT J M, VECERA P, KNIRSCH K C, et al. Scanning-Raman-microscopy for the statistical analysis of covalently functionalized graphene [J]. ACS Nano, 2013, 7(6): 5472-5482. doi: 10.1021/nn401481h [18] ZHU N W, CHEN X, ZHANG T, et al. Improved performance of membrane free single-chamber air-cathode microbial fuel cells with nitric acid and ethylenediamine surface modified activated carbon fiber felt anodes [J]. Bioresource Technology, 2011, 102(1): 422-426. doi: 10.1016/j.biortech.2010.06.046 [19] YOU S J, MA M, WANG W, et al. 3D macroporous nitrogen-enriched graphitic carbon scaffold for efficient bioelectricity generation in microbial fuel cells [J]. Advanced Energy Materials, 2017, 7(4): 1601364. doi: 10.1002/aenm.201601364 [20] GONG K P, DU F, XIA Z H, et al. Nitrogen-doped carbon nanotube arrays with high electrocatalytic activity for oxygen reduction [J]. Science, 2009, 323(5915): 760-764. doi: 10.1126/science.1168049 [21] ZHANG Y, WANG C W, HOU H S, et al. Sodium‐ion batteries: Nitrogen doped/carbon tuning yolk‐like TiO2 and its remarkable impact on sodium storage performances [J]. Advanced Energy Materials, 2016, 7(4): 1600173.1-1600173.12. [22] ZHANG L J, HE W H, YANG J C, et al. Bread-derived 3D macroporous carbon foams as high performance free-standing anode in microbial fuel cells [J]. Biosensors & Bioelectronics, 2018, 122: 217-223. [23] HU M H, LI X, XIONG J, et al. Nano-Fe3C@PGC as a novel low-cost anode electrocatalyst for superior performance microbial fuel cells [J]. Biosensors and Bioelectronics, 2019, 142: 111594. doi: 10.1016/j.bios.2019.111594 [24] CARMONA-MARTINEZ A A, HARNISCH F, FITZGERALD L A, et al. Cyclic voltammetric analysis of the electron transfer of Shewanella oneidensis MR-1 and nanofilament and cytochrome knock-out mutants [J]. Bioelectrochemistry (Amsterdam, Netherlands), 2011, 81(2): 74-80. doi: 10.1016/j.bioelechem.2011.02.006 [25] SHARMA M, JAIN P, VARANASI J L, et al. Enhanced performance of sulfate reducing bacteria based biocathode using stainless steel mesh on activated carbon fabric electrode [J]. Bioresource Technology, 2013, 150: 172-180. doi: 10.1016/j.biortech.2013.09.069 [26] HAO L, YU J, XU X, et al. Nitrogen-doped MoS2/carbon as highly oxygen-permeable and stable catalysts for oxygen reduction reaction in microbial fuel cells [J]. Journal of Power Sources, 2017, 339: 68-79. doi: 10.1016/j.jpowsour.2016.11.041 [27] ZHAO S, LIU P, NIU Y Y, et al. A novel early warning system based on a sediment microbial fuel cell for in situ and real time hexavalent chromium detection in industrial wastewater [J]. Sensors (Basel, Switzerland), 2018, 18(2): 642. [28] HUANG Y X, LIU X W, XIE J F, et al. Graphene oxide nanoribbons greatly enhance extracellular electron transfer in bio-electrochemical systems [J]. Chemical Communications (Cambridge, England), 2011, 47(20): 5795-5797. doi: 10.1039/c1cc10159e [29] HARTSHORNE R S, REARDON C L, ROSS D, et al. Characterization of an electron conduit between bacteria and the extracellular environment [J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(52): 22169-22174. doi: 10.1073/pnas.0900086106 [30] WHITE G F, EDWARDS M J, GOMEZ-PEREZ L, et al. Mechanisms of bacterial extracellular electron exchange [J]. Advances in Microbial Physiology, 2016, 68: 87-138. [31] JIMÉNEZ-RAMÍREZ L E, CAMACHO-MOJICA D C, MUÑOZ-SANDOVAL E, et al. First-principles study of transition metal adsorbed on porphyrin-like motifs in pyrrolic nitrogen-doped carbon nanostructures [J]. Carbon, 2017, 116: 381-390. doi: 10.1016/j.carbon.2017.02.018 -




 DownLoad:
DownLoad: