-
浮游生物是湖泊水库等水体中水生生物的重要组成部分,在水域生态系统的能量流动、物质循环和信息传递中起着至关重要的作用[1-2]. 一方面,作为水生态系统的初级生产者,浮游生物在湖泊水库生态系统中扮演着重要角色;另一方面,由于自身对环境因子变化响应敏感且迅速,浮游生物可作为反映水质变化的“指示剂”和水质评估的依据[3]. 因此,关注浮游生物的群落组成及变化对于揭示湖泊富营养化水平以及水质变化具有重要作用[4-5].
东平湖作为山东省第二大淡水湖泊,是黄河下游唯一重要蓄滞洪区、南水北调的重要枢纽、京杭大运河的重要节点,其水质质量对黄河流域的环境保护和高质量发展具有重要影响. 近年来,受流域内污染物输入以及南水北调东线工程影响,东平湖水质以及浮游生物群落发生明显变化[6-7]. Liu等[8]利用多元统计方法探讨了东平湖表层沉积物中硅藻类群与环境变量的关系,结果显示2014年东平湖全年均处于富营养化状态,生态污染较为严重. 董贯仓等[9]研究发现,东平湖水体多以蓝藻门、绿藻门及硅藻门为优势种,东平湖调水工程可通过物质带入影响水质,进而引起浮游植物量的升高. 辛未等[10]采用多样性指数法等生态评价法对2016—2017年东平湖水质与生物多样性进行评价,结果表明,东平湖浮游植物优势种群共计14种(属),以蓝藻门的伪鱼腥藻(Pseudoanabaena sp.)、拟浮丝藻(Planktothricoides sp.)为主,东平湖水质总体处于中污染水平. 高雯琪等[11]探究了调水后东平湖浮游动物时空响应,结果表明,东平湖水体多以桡足类(Copepoda, Cop.)、枝角类(Cladocerans, Cla.)及轮虫(Rotifers)为优势种,调水在一定程度上影响了东平湖浮游动物的群落结构,是东平湖浮游动物出现小型化趋势的可能原因之一,同时调水也有利于东平湖的水质改善. 然而,目前有关东平湖浮游生物的研究成果主要侧重于浮游植物或浮游动物单一群落,有关东平湖浮游植物与浮游动物两者相结合的研究较少.
本研究在前人的研究基础上,综合运用Shannon多样性指数法、Pielou均匀度指数法、优势度指数法、Margalef丰富度指数法等多种生态评价法以及Pearson相关性分析法与冗余分析法(RDA)等多元统计方法,分析东平湖秋季浮游植物以及浮游甲壳动物群落结构特征,探讨东平湖浮游生物群落结构的环境驱动因子,以期为东平湖湖区水质污染的治理与防控以及保障用水安全提供理论参考.
-
东平湖(116°00′—116°30′ E、35°30′—36°20′ N)位于山东省泰安市东平县,是山东省第二大淡水湖,黄河下游仅存的天然湖泊. 东平湖北与黄河通过小清河连接,东与主要补给源大汶河相连,且除特殊年份湖区开闸泄洪以及南水北调蓄水外,大汶河是湖区唯一入湖径流(图1). 东平湖总面积627 km2,分为新、老两个湖区. 老湖区面积209 km2,常年蓄水,即一般所称的东平湖,其中水域面积124 km2,多年平均水深2—4 m,是典型的浅水湖泊;新湖区为滞洪区,面积418 km2,大部分为农耕地,除特殊洪水年份,常年无水[6,12]. 本文研究区域为常年蓄水的老湖区.
东平湖属温带大陆性半湿润季风气候区,四季分明. 湖区水生植被丰富,其中以菹草、菱角等分布面积较广,且主要分布于湖区北部及东岸地带[13-14]. 丰富的水生植被为淡水鱼类、虾、蟹等提供了充足的食物以及多变的栖息环境,使得东平湖成为山东省重要的水产生产基地. 2002年,国务院正式批复《南水北调总体规划》,东平湖被确定为南水北调东线工程最后一个调蓄湖和胶东地区输水干线工程的起点湖;2013年,东平湖作为南水北调东线调蓄湖泊开始调水,且调水时间为每年12月至次年5月. 自此,东平湖对保障华北和胶东地区用水安全起到至关重要的作用.
-
于2021年9月底对全湖进行采样. 结合东平湖地理环境特征以及均匀性原则,全湖共设置采样点28个(图1). 各采样点样品采集包括水样及浮游生物(浮游植物与浮游甲壳动物)样品. 水样采集采用分层取样法,将水样按实际水深分为上、中、下层,用5 L采水器分别在3个层位上取样后混合均匀. 其中,取500 mL水样送至实验室进行水质指标检测;取1 L水样于聚乙烯瓶中,加入10 mL鲁哥试剂避光静置72 h,虹吸上清液浓缩至30 mL,用于浮游植物定量分析. 浮游甲壳动物定量采集使用5 L采水器分别在上、中、下层采集共15 L水,并过25号浮游生物网,将滤出液收集于聚乙烯小瓶中加入4%甲醛溶液保存. 浮游植物与浮游动物采集样液沉淀浓缩后分别使用0.1 mL和1 mL计数框进行镜检、计数和鉴定.
本研究分析的主要水质指标有总氮(TN)、硝态氮(NO3--N)、亚硝态氮(NO2--N)、氨氮(NH4+-N)、总磷(TP)、磷酸盐(PO4−-P)、叶绿素(Chl.a)、悬浮物浓度(SS)等. 水样的预处理及分析均参照国家相关标准方法. 其中,TN和TP浓度均采用过硫酸盐氧化法并通过紫外分光光度计UV-2450(HJ 636-2012)比色测定,NH4+-N浓度采用纳氏试剂光度法(HJ 535-2009)测定,NO3−-N浓度采用紫外分光光度法(HJ 636-2012)测定,NO2−-N浓度采用重氮-偶合分光光度法测定,Chl.a浓度采用热乙醇法提取,PO4−-P浓度采用钼蓝法测定,SS采用过滤-称重法测定,CODMn采用高锰酸钾指数法测定,总有机碳(TOC)浓度采用外加热-重铬酸钾氧化法测定. 透明度(SD)采用塞式罗盘测定,水温(Tem)、溶解氧(DO)、pH、盐度(Sal)、氧化还原电位(ORP)及电导率(SPC)等采用水质多参数仪(YSI-MP556)现场测定.
-
本文主要采用综合营养状态指数(TLI)[15]对水质进行综合评价.
-
采用Shannon-Wiener多样性指数[16]、Pielou均匀度指数[17]、优势度指数[18]、Margalef丰富度指数[19]分析东平湖浮游生物群落特征.
生物多样性是群落的主要特征之一,Shannon-Wiener多样性指数(H')能够反映出群落结构的复杂程度,指数越大,表明群落结构越复杂和稳定;Pielou 均匀度指数(J)指一个群落或生境中全部物种个体数目的分配状况,能够反映出各物种个体数目分配的均匀程度,指数越大,则群落越稳定,多样性越高;优势度指数(Y)是在群落的类群组成基础上进一步推算出来以表达群落组成状况的指标,指数越大,优势生物的生态功能越突出;Margalef丰富度指数(D)描述群落中所含物种丰富程度的数量指标,指数越大,群落丰富度越高. 各指数计算公式分别为:
式中,fi为物种i出现的频率,ni为物种i的个体数,N为全部样品的总个体数,S为样品中浮游植物物种总数,
Pi 为第 i 种生物的个体数与总体数的比值. 取优势度 Y ≥ 0.02 的物种作为优势种. 各生物多样性指数评价标准[3,10]如表1所示. -
采用SPSS 25.0软件基于Pearson相关性分析法对浮游生物群落结构特征与环境因子进行相关性分析,并运用R语言软件包进行绘图. 利用CANOCO 5.0软件包对浮游生物及环境因子进行去趋势对应分析(DCA),以探究显著影响浮游生物群落结构时空格局的驱动因子. DCA分析中,当4个轴中梯度最大值超过4,属于单峰型模型,使用典范对应分析(CCA);如果小于3,属于线性模型,使用冗余分析(RDA).
-
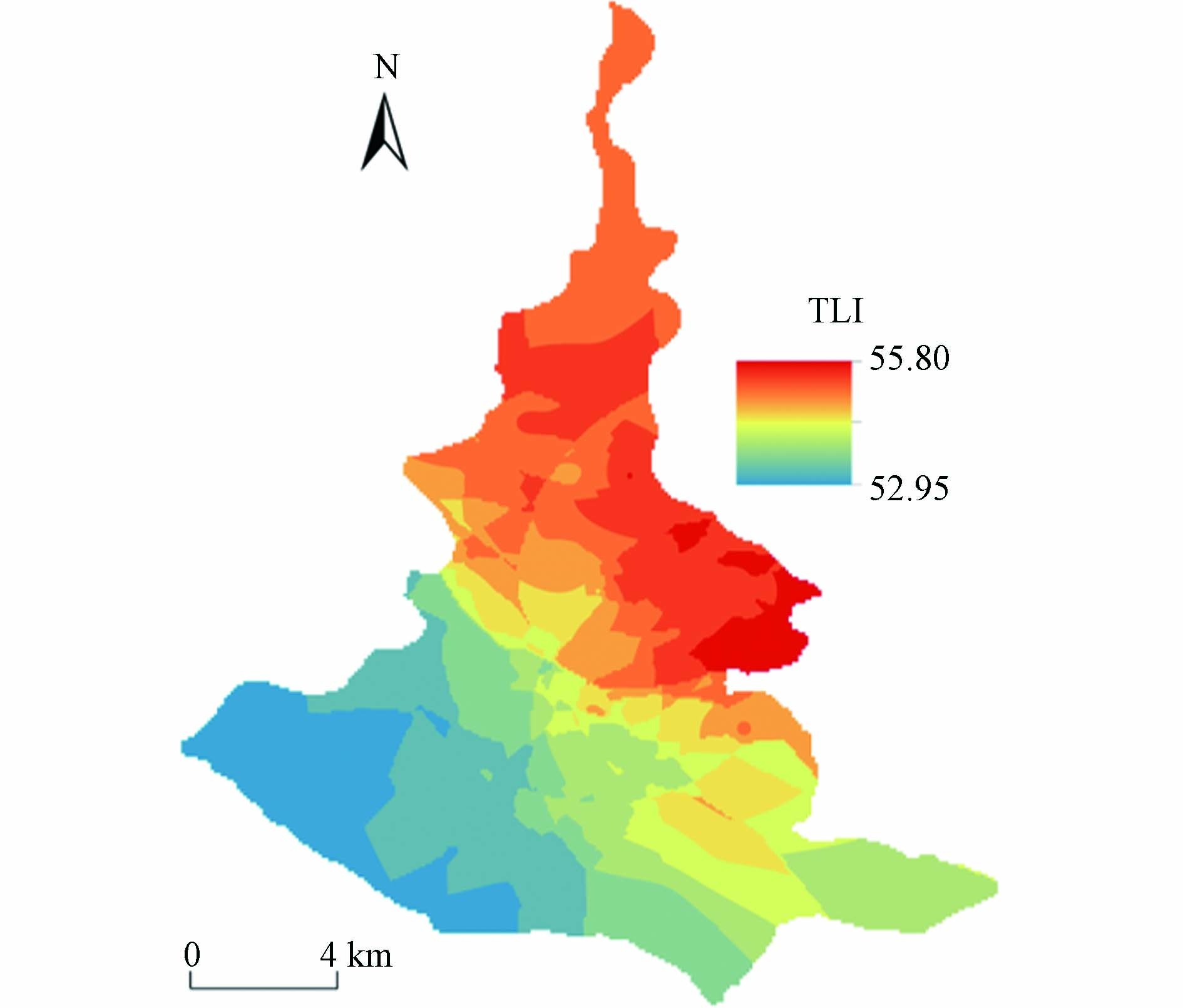
就全湖平均水平而言,东平湖秋季各水质因子平均浓度分别为3.14 mg∙L−1(TN)、2.40 mg∙L−1(NO3--N)、0.20 mg∙L−1(NH4+-N)、0.14 mg∙L−1(TP)、3.30 mg∙L−1(CODMn)、11.90 mg∙m−3(Chl.a)、0.12 mg∙L−1(NO2--N)、0.02 mg∙L−1(PO4−-P)、9.04 mg∙L−1(DO)、4.95 m(Depth)、0.73 m(SD)、9.01 mg∙L−1(TOC)、7.71(pH)、22.72 ℃(Tem)、0.83 mS∙cm−1(SPC)、271.54 mV(ORP)及0.43‰(Sal). 此外,东平湖秋季综合营养状态指数(TLI)全湖变化范围为51.05—62.26,平均值为54.31,呈轻度富营养化状态. 这与2010(TLI = 58,轻度富营养化)、2011(TLI = 50.97,轻度富营养化)、2012(TLI = 52.33,轻度富营养化)、2015(TLI = 53.83,轻度富营养化)、2017(TLI = 52.51,轻度富营养化)及2019(轻度富营养化)秋季水体营养状态相差不大[9,20-22],较2006—2010年(轻度富营养至中度富营养)较好[23]. 就空间分布而言,东平湖秋季TLI以湖区东北部较高,湖区西南部水平较低(图2).
-
本次共检出浮游植物8门73种(属). 其中,绿藻门(Chlorophyta, Chl.)种类最多,鉴定出32种,占总种数的43.8%;蓝藻门(Cyanophyta, Cya.)15种,占种类总种数的20.5%;硅藻门(Bacillariophyta, Bac.)14种,占总种数的19.2%;裸藻门(Euglenophyta, Eug.)、甲藻门(Pyrroptata, Pyr.)、金藻门(Chrysophyta, Chr.)、隐藻门(Cryptophyta, Cry.)与黄藻门(Xanthophyta, Xan.)种类数较少,分别为4种、4种、2种、1种与1种. 由于绿藻、蓝藻、硅藻 3 个门类浮游植物种类数之和超过浮游植物种类总数的80%,东平湖秋季浮游植物种类组成为绿藻-蓝藻-硅藻型.
东平湖秋季浮游植物生物密度(M)为2.30×108 cells∙L−1,其中蓝藻门的密度最大(M = 7.76×107 cells∙L−1),占比达33.71%,其次是绿藻门(M = 7.68×107 cells∙L−1)、硅藻门(M = 6.42×107 cells∙L−1)和隐藻门(M = 7.36×106 cells∙L−1),占比分别为33.37%、27.87%和3.20%. 甲藻门(M = 1.71×106 cells∙L−1)、金藻门(M = 1.09×106 cells∙L−1)、裸藻门(M = 7.46×105 cells∙L−1)、黄藻门(M = 7.20×105 cells∙L−1)的密度相对较小,占比分别为0.74%、0.47%、0.32%及0.31%. 此次监测中,容易引发蓝藻水华的微囊藻属的藻密度(M = 1.63×105 cells∙L−1)较低,且颤藻(M = 1.11×106 cells∙L−1)、束丝藻(M = 7.47×105 cells∙L−1)等常见的有害产毒蓝藻的藻密度也较低.
从东平湖秋季浮游植物生物密度的空间分布来看(图3),各样点间浮游植物密度变化范围为3.31×106—1.40×107 cells∙L−1,其中以湖区东部及东北沿岸密度较高,湖区中部与西部密度较低,且最高值与最低值相差4倍左右.
一般认为,水体营养水平状况对浮游植物种类和密度影响较大[24]. 本研究中,东平湖秋季水体TLI自湖区东北部向西南部逐渐减小(图2),使得浮游植物生物密度以湖区东北部较高、中西部较低. 东平湖秋季浮游植物结构空间差异较小,全湖浮游植物群落主要以蓝藻门、硅藻门和绿藻门为主,与辛未等[10]2016年监测结果一致. 其中,湖区北部及西南部多以蓝藻门为主,且湖区北部隐藻门等具有一定比重,多样性较为丰富,湖区南部主要以绿藻门为主,湖区东南部硅藻门占比较高,湖心区三者占比较为均衡.
以优势度Y ≥ 0.02为评价标准,本文计算了东平湖秋季浮游植物优势种及优势度值(表2). 东平湖秋季表现出多个优势种的群落结构,采样周期内浮游植物优势种共3门9种,主要为绿藻门、硅藻门和蓝藻门. 其中,绿藻门优势种数量占比最高(44.4%),蓝藻门的伪鱼腥藻(Pseudoanabaena spp.)优势度最大(Y = 0.205),其次为小环藻(Cyclotella spp.)、栅藻(Scendesmus sp.)、平裂藻 (Merismopedia sp.)、镰形纤维藻(Ankistrodesmus falcatus)、针杆藻(Synedra spp.)、小球藻(Chlorella spp.)、色球藻(Chroococcus spp.)与衣藻(Chlamydomonas spp.).
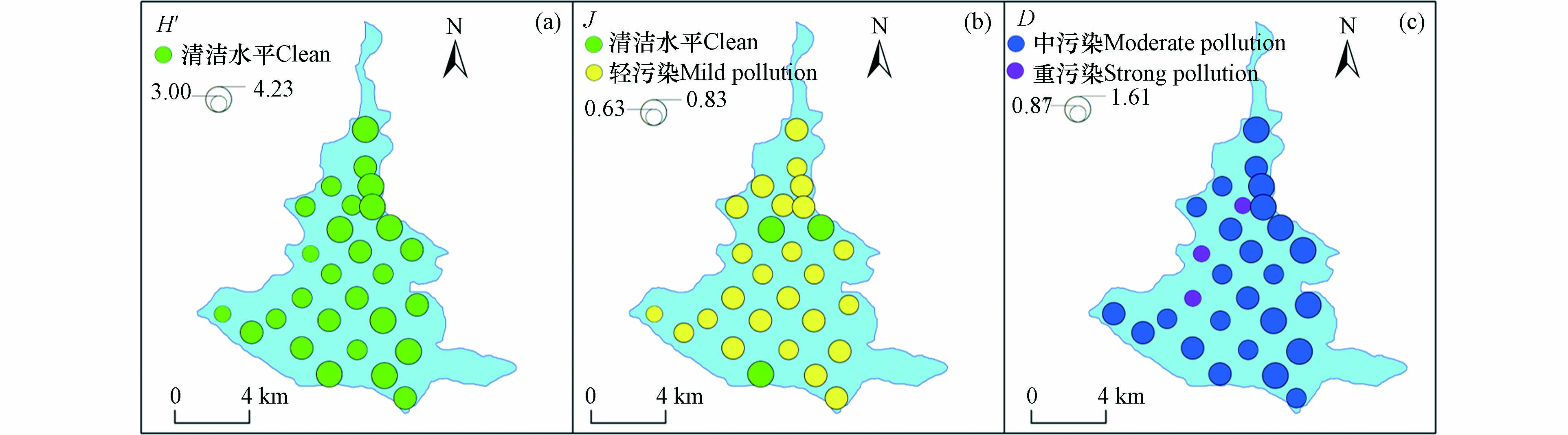
根据式(2)—(4),本文分别计算东平湖秋季各采样点浮游生物的Shannon-Wiener多样性指数(H')、Pielou均匀度指数(J)及Margalef丰富度指数(D),各指数空间分布特征如图4所示. 总体而言,各指数评价结果存在差异. 东平湖秋季浮游植物H' 指数变化范围为3.00—4.23,均值为3.70,评价结果为清洁水平(图4a);浮游植物J指数均值为0.75,评价结果为清洁-轻污染水平(图4b);浮游植物D指数变化范围为0.88—1.61,均值为1.29,评价结果为中污染水平(图4c).
通过与前人研究进行对比,21世纪以来东平湖秋季浮游植物优势物种、生物量(B)以及H'指数如表3所示. 近年来,东平湖秋季浮游植物优势种群组成处于相对稳定的状态,即主要以蓝藻门、绿藻门及硅藻门为主,同时出现蓝藻门的伪鱼腥藻、绿藻门的小球藻、硅藻门的小环藻及针杆藻为优势种的频次较高. 本研究中,东平湖秋季浮游植物生物量为9.02 mg∙L−1,略高于2013年秋季(5.97 mg∙L−1)[25]与2017年秋季(6.42 mg∙L−1)[9],明显低于2007年秋季(23.52 mg∙L−1)[26],时间变化上总体呈先下降后上升的趋势. 2013年以来,东平湖作为南水北调东线工程调蓄水库开始蓄水,为确保北调水质,其上游调蓄湖泊加大了对水质的管理[27],使得注入东平湖的水质较好,东平湖水体富营养化程度有所降低[21,23],浮游植物生物量也随之降低.
-
本次共检出浮游甲壳动物2门10种(属),其中桡足类(Copepoda, Cop.)3种,枝角类(Cladocerans, Cla.)7种,分别占总种数的30%与70%. 浮游甲壳动物密度与生物量分别为3.34×103 cells∙L−1与6.00×103 mg∙L−1. 其中,桡足类的密度最大(M = 2.04×103 cells∙L−1),占比达60.26%,枝角类(M =1.34×103 cells∙L−1)占比为39.74%. 浮游甲壳动物生物密度以湖区中部与西北部较高,湖区东部、南部沿岸生物密度较低(图5). 浮游甲壳动物H'变化范围为0.26 — 1.98,均值为1.76,J变化范围为0.13 — 0.95,均值为0.76,D指数变化范围为0.41 — 0.93,均值为0.61,分别对应中污染、清洁以及重污染水平. 这主要是由于本次实验中浮游植物检测物种数多于浮游甲壳动物,使得浮游植物评价结果较优于浮游动物.
浮游甲壳动物密度与水体营养水平以及浮游植物密度等关系密切[31]. 一方面,某些浮游动物(如桡足类)喜生活在富营养水体中[32];另一方面,浮游植物作为浮游动物的主要食物来源,对于浮游动物群落的分布具有重要影响[33]. 当浮游植物的丰度增加到一定程度时,充足的食物来源为浮游动物的生长繁殖提供有利条件,浮游动物的密度也随之增加;当浮游植物的丰度达到较高值时,对水体的SD、DO等因子产生一定影响,导致浮游动物密度下降[34]. 本研究中,浮游甲壳动物生物密度空间分布与TLI和浮游植物生物密度空间分布存在差异,即浮游甲壳动物集中分布于浮游植物生物密度与TLI较低的湖区中部以及西部地区,而非浮游植物与TLI较高的湖区东部与东北沿岸(图2). 这可能是由于东平湖秋季浮游植物的丰度达到较高值,对水体的溶解氧等环境因子产生一定影响,从而使得在浮游植物较丰富的湖区东部浮游甲壳动物生长受到抑制.
此次监测中浮游甲壳动物优势种共计2门4种(属),其中剑水蚤(Cyclops)优势度最高(Y = 0.305),其次为象鼻溞 (Bosmina spp.)、无节幼体(Nauplius)和网纹溞属 (Ceriodaphnia)(表2). 高雯琪等[11]对2016年秋季浮游动物优势种研究发现,东平湖水体多以桡足类、枝角类及轮虫为优势种,其中主要以真剑水蚤、剑水蚤、四齿单趾轮虫等为主;侯莉等[29]对2020年东平湖生物多样性研究发现,东平湖浮游动物主要以广布中剑水蚤、桡足幼体、无节幼体、汤匙华哲水蚤、枝角幼体、秀体溞、长额象鼻溞、针簇多肢轮虫、矩形龟甲轮虫等为优势种. 结合本研究来看,近年来东平湖秋季浮游甲壳动物优势种群组成主要以桡足类的剑水蚤为主,表明该种群变化一直处于相对稳定的状态.
-
通过对东平湖秋季浮游植物9个优势物种以及浮游甲壳动物4个优势物种进行DCA分析,由于排序轴梯度长度最大值小于3,因此本文采用线性模型(RDA)对东平湖秋季浮游生物群落特征的环境驱动因子进行分析. 通过对13个优势物种与TN、TP、Tem、DO等10个环境因子以及生物多样性指数、生物量(B)等进行RDA排序分析,采用蒙特卡拟合方法分别对浮游植物、浮游甲壳动物与环境因子间关系进行显著性检验,分析结果如图6所示.
对浮游植物而言,轴Ⅰ和轴Ⅱ分别解释了36.49%和3.47%的浮游植物优势种与环境因子关系;对浮游甲壳动物而言,轴Ⅰ和轴Ⅱ分别解释了18.55%和4.90%的优势种与环境因子关系,表明本次排序分析较好地解释了优势种与环境因子的关系. 经过筛选,对浮游植物及浮游甲壳动物群落结构多样性变化起重要作用的环境影响因子分别为TN与DO. 其中,TN解释率为 15.3%(P = 0.024,F = 4.7),DO解释率为14.4%(P = 0.03,F = 4.1). TN作为浮游植物生长繁殖的必需物质,影响着浮游植物的生长及生物量. 本研究中TN与衣藻等优势代表物种以及浮游植物群落的密度和生物量具有较高正相关性(图7),表明水体中TN浓度的增加会导致浮游植物密度的升高、浮游植物生物量增加及群落丰富度的增加. DO与pH、PO4--P具有协同影响作用,三者主要对象鼻溞等代表物种的密度及浮游甲壳动物生物量、物种数和浮游植物密度总量等指标产生较高正相关影响(图6),对浮游甲壳动物丰度及生物量的变化起重要作用.
-
通过对东平湖2021年9月份全湖28个采样点进行水样采集与检测,采用综合营养状态指数法、生态多样性指数法、相关性分析法以及冗余分析法等多种分析方法,本文系统分析了东平湖秋季浮游植物与浮游甲壳动物群落结构特征及其与环境因子的关系. TLI全湖平均值为54.31,呈轻度富营养化状态,且空间分布呈自湖区东北部向西南部逐渐递减趋势. 此次共检出浮游植物8门73种(属),浮游甲壳动物2门10种(属),其中浮游植物主要以绿藻、蓝藻和硅藻为主,浮游甲壳动物为桡足类和枝角类. 浮游植物生物密度空间分布与TLI相似,呈湖区东部与东北岸较高、中西部较低格局. 以优势度 Y ≥ 0.02 为评价标准,东平湖秋季表浮游植物优势种共9种,以蓝藻门的伪鱼腥藻(Pseudoanabaena spp)优势度最大(Y = 0.205),浮游甲壳动物优势种为4种,以剑水蚤(Cyclops)优势度最高(Y = 0.305). 东平湖秋季浮游植物Shannon-Wiener 多样性指数、Pielou均匀度指数以及Margalef 丰富度指数分别为3.70、0.75与1.29,其生态多样性污染评价结果分别为清洁水平、轻污染水平与中污染水平. 通过对浮游生物优势物种与环境因子以及生物多样性指数进行RDA排序分析与相关性分析,结果显示,TN与DO分别为影响东平湖浮游植物与浮游甲壳动物生长的主要环境驱动因子.
东平湖秋季浮游生物群落特征及其与环境因子的关系
Plankton community characteristics and its relationship with environmental factors in the autumn of Dongping Lake, China
-
摘要: 作为黄河下游仅存天然湖泊以及南水北调东线工程重要枢纽,东平湖生态环境安全对黄河流域生态环境保护与中国北方供水安全起到重要作用. 为明确东平湖秋季浮游生物群落结构特征及环境驱动因子,于2021年9月对全湖28个采样点进行水样采集与检测,并采用综合营养状态指数法、生态多样性指数法、相关性分析法以及冗余分析法等多种分析方法进行了分析研究. 此次研究共检出浮游植物8门73种(属),浮游甲壳动物2门10种(属),其中浮游植物主要以绿藻、蓝藻和硅藻为主,浮游甲壳动物主要以桡足类和枝角类为主. 浮游植物中,蓝藻门的伪鱼腥藻(Pseudoanabaena spp.)优势度最大(Y = 0.205),浮游甲壳动物中则以剑水蚤(Cyclops)优势度最高(Y = 0.305). 东平湖秋季浮游植物生物密度空间分布与综合营养状态指数(TLI)具有较强相关性,高值均分布于湖区东部与东北岸,而湖区中、西部较低. 浮游植物Shannon-Wiener多样性指数、Pielou均匀度指数以及Margalef丰富度指数分别为3.70、0.75与1.29,其生态多样性污染评价结果分别为清洁水平、轻污染水平与中污染水平. 冗余分析结果表明,TN为影响东平湖浮游植物生长的主要环境驱动因子,DO为影响东平湖浮游甲壳动物生长的主要环境驱动因子.Abstract: As the only natural lake in the lower Yellow River and an important hub of the eastern route of the South-to-North Water Diversion Project, its ecological environment security has great impacts on the ecological environment protection in the Yellow River basin and the security of water supply in the northern China. In order to clarify the plankton community characteristics and its environmental driving factors in the autumn of Dongping Lake, water samples from 28 sampling sites were collected in September 2021, and the comprehensive trophic level index method, ecological diversity index method, correlation analysis and redundancy analysis were used. In this study, a total of 73 taxa of phytoplankton (genera or species) in 8 phyla and 10 taxa of crustacean zooplankton (genera or species) in 2 phyla were identified among which Chlorophyta, Cyanophyta and Bacillariophyta were the main phytoplankton, and Copepoda and Cladocerans were the main crustacean zooplankton. Among phytoplankton, Pseudoanabaena spp had the highest dominance (Y = 0.205), and Cyclops had the highest dominance (Y = 0.305) in crustacean zooplankton. The comprehensive trophic level index (TLI) and the spatial distribution of the biological density of phytoplankton in the autumn of Dongping Lake was strongly correlated, with high values in the east part and northeast bank of the lake and low values in the center and west lake areas. The Shannon-Wiener diversity index, Pielou evenness index and Margalef richness index of phytoplankton were 3.70, 0.75 and 1.29, corresponding to the pollution conditions of clean, light pollution and moderate pollution, respectively. Redundancy analysis revealed that TN and DO were the main environmental driving factors affecting the growth of phytoplankton and crustacean zooplankton, respectively, in the autumn of Dongping Lake.
-
Key words:
- Dongping Lake /
- plankton /
- community characteristics /
- environmental driving factor.
-
自1929年发现青霉素来,抗生素作为一种能够有效对抗细菌感染的药物已被广泛应用于人类和牲畜疾病的预防与治疗. Klein等[1]的研究表明,在2000年至2015年间,全球抗生素的消费量增加了65%,并且预测在没有政策干预的情况下,2030年全球抗生素消费量可能比2015年高出200%. 由抗生素大量使用诱导产生的抗生素耐药问题是人类面临的重要公共卫生挑战之一. 据估计,每年死于抗生素耐药性问题的人数高达70万,如果不采取适当的预防措施,到2050年,每年的死亡人数将接近1000万,超过癌症的死亡人数[2]. 存在于抗生素耐药菌(antibiotic resistant bacteria, ARB)中的抗生素抗性基因(antibiotic resistance genes, ARGs),作为一种新污染物,与传统污染物不同,可以通过细菌的繁殖,进行垂直基因转移(vertical gene transfer, VGT),在环境中大量扩增,也可以通过水平基因转移(horizontal gene transfer, HGT)在不同细菌间扩散,进一步诱导抗生素耐药性的产生,因而引起了广泛的关注[3-4].
覆盖地球71%表面积的海洋对人类的生存和发展具有重要意义,反过来也受到了人类活动的广泛影响,它不仅是各类陆源污染物的汇,同样也是ARGs的重要天然储库. 海洋环境中的ARGs可以存在于细菌等微生物体内,也可以在微生物死亡后释放到海水和沉积物中并长期存在[5-6]. 这些ARGs可以在海洋生物之间传播,也可以在海洋生物与人类之间传播,显然海洋介质在ARGs的传播中发挥着重要作用,但这种作用在很大程度上无法量化[6-7]. 全球约40%的人口居住在海岸线100 km2以内的沿海地区,海洋环境中ARGs的存在会对这一区域的人类健康带来前所未有的挑战[8]. 但目前人们对于海洋环境中ARGs的来源、组成和影响因素,仍缺乏系统的认识. 本研究在总结国内外最新研究的基础上,重点讨论了海洋环境中ARGs的主要来源,对比分析了不同海域ARGs的优势类型、浓度水平,以及多个影响因子对海水和沉积物中ARGs的潜在影响,探讨了海洋环境中ARGs的传播扩散路径以及潜在影响等,为深入研究和治理海洋环境ARGs污染,降低ARGs的生态和健康风险提供参考.
1. 海洋环境中抗生素抗性基因的来源(Sources of antibiotic resistance genes in marine environment)
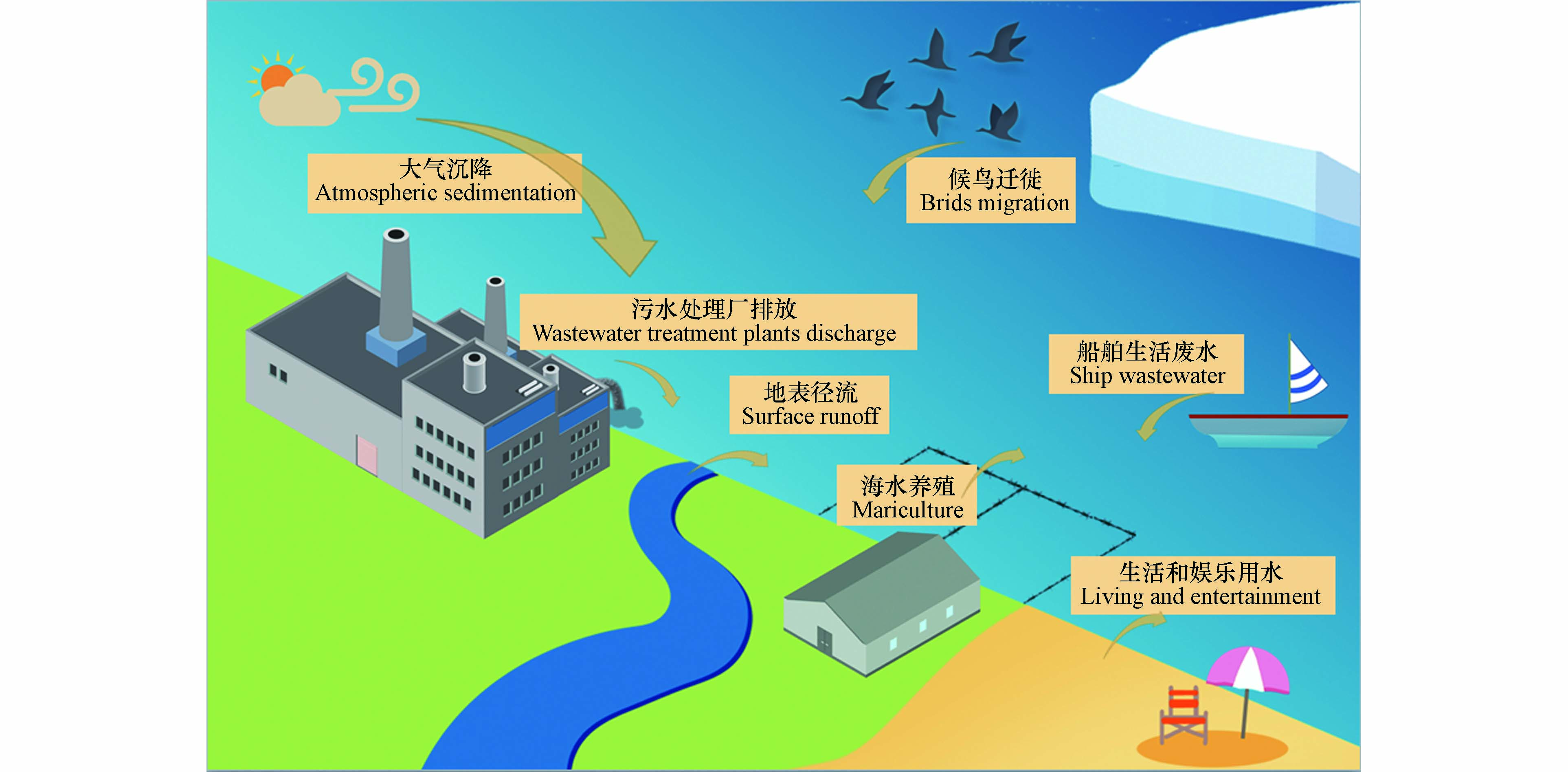
海洋环境中的污染物往往存在着复杂的来源,如污水处理厂排放、地表径流、船舶污染、人类近岸活动、大气远距离传输和候鸟迁徙等过程,这些过程给海洋环境带来了大量的污染物[9-12],其中就包括ARGs.
大多数污水处理厂的现有水处理方法不能有效地去除抗生素和ARGs,残留的抗生素和ARGs会通过污水处理厂的出水口排放到环境中,是河口和近海环境中ARGs的一大来源[13-15]. 在国内外许多海域,近海污水处理厂的废水排放是ARGs的重要来源之一. Huang等[16]的研究发现,市政污水处理厂的废水可能是福建九龙江口和闽江口的主要ARGs污染源. Makkaew等[17]的研究表明,污水直排输入会提高泰国邦盛和芭提雅海滩附近海水中ARGs的丰度. Fonti等[18]研究发现,在中亚得里亚海排放入海的废水中存在大量的ermB、qnrS、sul2和tetA等ARGs.
除此之外,地表径流也是海洋环境中ARGs的一个重要来源,人类和动物疾病治疗残留的大量抗生素和诱导产生的ARGs随着人为排放、雨水冲刷等途径直接入海或者进入河流,最终将排放到河口和近海环境中[13,19]. Dewi等[20]研究发现,澳大利亚悉尼海滩附近海水中的碳青霉素烯耐药菌很可能是通过雨水和其他淡水径流从陆源输入的. 河流排放是渤海[21]ARGs的重要来源之一,而胶州湾的ARGs则可能来自于河水和/或陆地废水排放[22].
包括近海海水养殖、居民生活、娱乐用水等的人类活动也会给海洋环境带来ARGs污染. 为了治疗和预防动物疾病,海水养殖过程中往往会投加大量的抗生素,这些抗生素将会导致海洋环境的ARGs污染[23-24]. 与自然海域相比,海水养殖场中ARGs丰度更高[25]. 在土耳其爱琴海居鲁克湾[26]进行的观测表明,水产养殖区具有更高的抗生素耐药风险. 韩国巨济附近海水中ARGs来源可能是沿海地区的港口和造船厂活动,而莞岛附近海水中ARGs的来源可能是水产养殖或农业活动[27].
候鸟尤其是海鸟在迁徙的过程中,也会携带ARGs并将其传播到更远的区域. 在美国东北部沿海水域,海鸟中分离出来的细菌的耐药性比在海洋哺乳动物中更普遍[28]. 斯瓦尔巴群岛朗伊尔城繁殖区的北极燕鸥泄殖腔内存在大量β-内酰胺类和喹诺酮类耐药菌[29]. 这些存在于海鸟体内的ARGs,将会随着海鸟的长距离迁移,传播到更远的区域.
除此之外,大气远距离传输和船舶生活污水排放等途径也将给海洋环境尤其是远洋环境带来ARGs污染,但目前仍缺乏相应的研究,人们对这些来源的贡献以及影响这些传播途径的因素知之甚少(图1).
2. 海洋环境中抗生素抗性基因的检测方法(Detection of antibiotic resistance genes in marine environment)
对于海洋环境中微生物抗生素耐药性的检测,主要包括传统的微生物培养-药敏试验的方法和采用分子生物学技术的聚合酶链式反应(polymerase chain reaction, PCR)、定量PCR(quantitative real-time PCR, qPCR)、高通量qPCR(high-throughput qPCR, HT-qPCR)以及宏基因组检测等方法. 前者仅能检测海洋环境中可培养的ARB,而后者分析的对象则包括了可培养和不可培养的微生物,并可以进一步检测海洋环境中的ARGs,使得到的结果更为全面.
在一些早期的研究中,大多采用细菌培养-药敏试验的方法对海洋环境中细菌的耐药性进行检测[30-32]. 这种方法较为简单,且成本较低,可以检测细菌的耐药率,鉴别多重耐药菌. 其中,药敏试验部分主要包括纸片扩散法(K-B琼脂法)和稀释法,前者主要通过测量含抗生素在琼脂平板培养基上形成的抑菌环的直径,测定细菌的耐药强度;后者则是通过配置药物浓度梯度稀释的培养基,测定抗生素的最小抑菌浓度(minimum inhibitory concentration, MIC),进而得到细菌耐药强度[33].
一些研究会对得到的细菌进行进一步的DNA提取,并进行PCR检测,以进一步鉴定其中的ARGs种类[34-36]. 也有一些研究直接对海水或沉积物进行DNA提取,进一步PCR检测[37-38]. PCR检测主要是对特定DNA片段进行指数扩增,再采用琼脂糖凝胶电泳对扩增产物进行检测,以鉴别原始样品中是否存在目标DNA片段,这种检测方法耗时短、准确性强,能够定性分析海水和沉积物中的ARGs,但不能对其定量. 因此,近年来的许多研究采用了qPCR方法,对ARGs进行定量检测[39-41]. qPCR检测是在PCR检测的基础上,通过分析荧光信号在特定DNA片段指数扩增过程中的累积,对目标DNA片段进行定量的检测方法,这种方法可以更直观的表征海洋环境中ARGs组成和丰度的变化. 随着检测技术的发展,也有一些新的研究采用微滴式数字PCR(droplet digital PCR, ddPCR)[42]和HT-qPCR[43-44]对海洋环境中ARGs的组成进行分析,这些方法的灵敏度和检测效率更高.
随着测序技术的逐步发展,越来越多的研究采用了宏基因组检测的方法对海洋环境中ARGs的组成进行分析[45-47]. 宏基因组又名微生物环境基因组或环境基因组,主要是从环境中直接提取全部的DNA,并构建宏基因组文库,进行测序,更全面地识别出环境中ARGs的组成;也可通过基因克隆,构建文库进行筛选分析,发现新的ARGs[48].
3. 海洋环境中抗生素抗性基因污染现状(Current status of antibiotic resistance gene pollution in marine environment)
3.1 海水中抗生素抗性基因污染现状
海洋环境中的污染物既会受到附近人为污染源的强烈影响,也会随着海洋环流不断扩散,对遥远的大洋和极地产生影响,并长期存在于海水和沉积物中(图2). 因此,不同区域海水中ARGs的组成和丰度往往存在较大的差异,但总的来说,多药耐药基因,β-内酰胺类抗性基因和磺胺类抗性基因是常被检出的类型(表1).
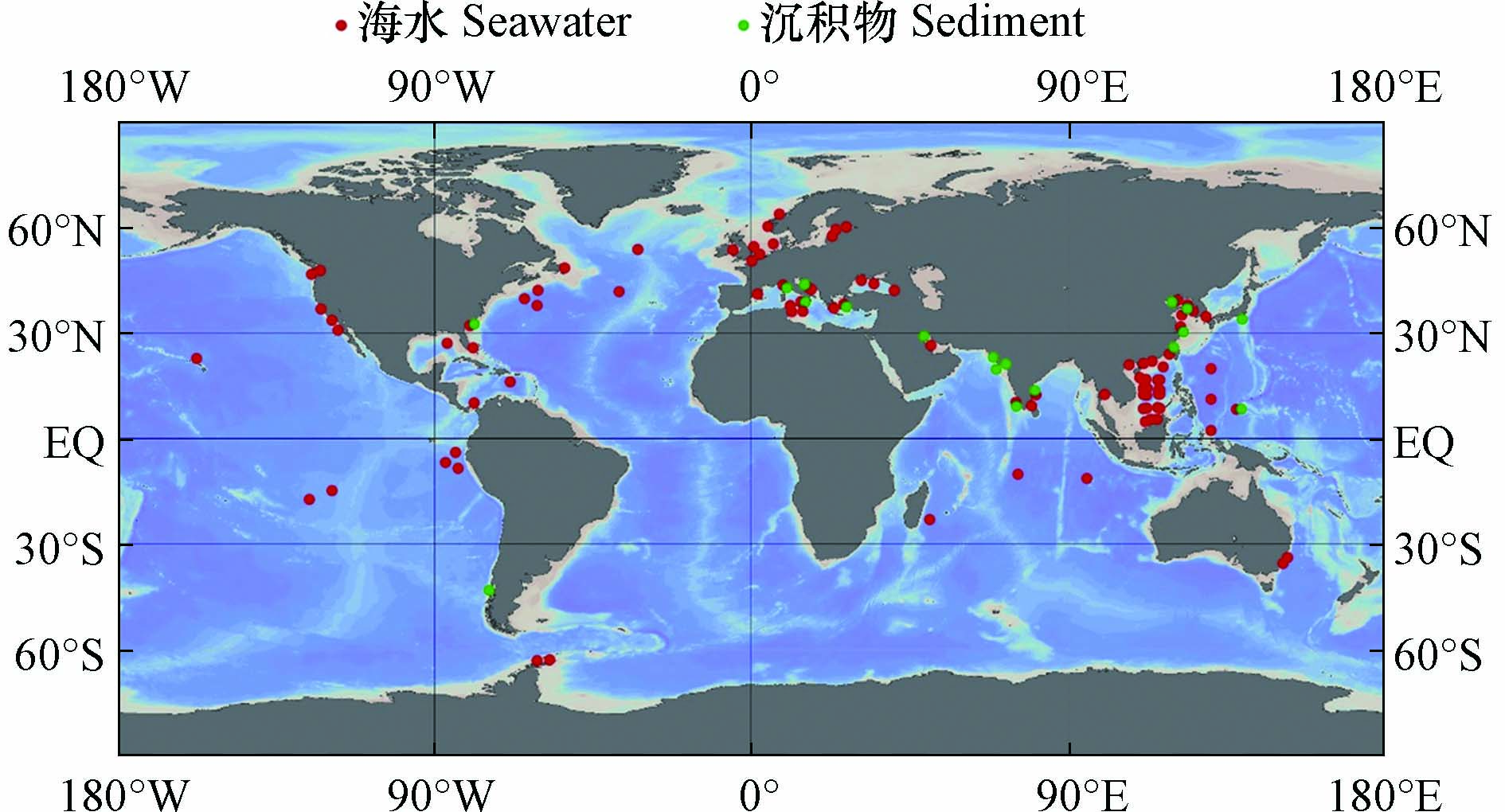 图 2 海水和沉积物中ARGs的相关研究(采用Ocean Data View[69]绘制)Figure 2. Researches of ARGs in seawater and sediments (Draw with Ocean Data View)
图 2 海水和沉积物中ARGs的相关研究(采用Ocean Data View[69]绘制)Figure 2. Researches of ARGs in seawater and sediments (Draw with Ocean Data View)河口和近海生态系统是陆源抗生素和ARGs入海的起点[39,49-50]. 对于印度洋附近海域,科钦河口肠外致病性大肠杆菌对β-内酰胺类抗生素氨苄西林耐药性最强(23.07%),其次是四环素(19.23%)[51]. 对于大西洋附近海域,西西里岛西北部近海地区的海水中β-内酰胺类抗性基因bla-TEM的检出率最高[38],亚得里亚海东部卡什泰拉湾的海水中β-内酰胺类抗生素耐药最强,其中检出率最高的抗性基因是bla-TEM[52],黑海近海地区海水中万古霉素类抗性基因vanB(2×10−1±1×10−1)和β-内酰胺类抗性基因bla-SHV(4×10−2±1×10−2)是相对丰度最高的ARGs[53],英吉利海峡和北海海域磺胺类抗性基因sul1占主导[54]. 在太平洋沿岸海域,泰国邦盛和芭堤雅海滩的海水中,bla-TEM在所有样品中均能检测到,磺胺类抗性基因sul1检出率为97.6%,四环素类抗性基因tetQ检出率为85.4%[17];我国通向南海的河口中,β-内酰胺类抗性基因和磺胺类抗性基因占主导[55-56];在渤海湾检出率最高的ARGs为磺胺类抗性基因sul1、sul2,β-内酰胺类抗性基因bla-TEM和四环素类抗性基因tetB,四者检出率均为100%[6]
而与近海环境相比,更开阔且受人类活动影响较小的大洋区域,ARGs的丰度相对较低. 在相对封闭的地中海,检测到的ARGs的平均相对丰度明显高于开阔的南大西洋[57]. 对于不同大洋区域,ARGs丰度也存在差异,西太平洋海水中ARGs的丰度((3.0×106±1.6×106) copies·mL−1)高于南大洋((1.7×106±1.0×106) copies·mL−1),ARGs丰度从最远的采样点到靠近陆地的采样点呈增加趋势,与人类活动或人为污染源有关[58]. 而对于同一区域,西太平洋中层和深层海水中观察到的ARGs丰度与在浅海中的差异并不显著,表明深海也是ARGs的汇[58]. 此外,在大西洋和北海的海水中,sul2基因在40年间无显著变化,但造成这一奇怪现象的原因仍不清楚[42].
极地通常被认为是脆弱且受人类影响最小的区域,但极地海洋环境中仍有ARGs的存在,不过南极海水中ARGs的丰度比地中海中低3—5个数量级,bla-TEM和tetW是地中海中最丰富的ARGs,而bla-TEM和bla-CTX-M-1是南极海域最丰富的ARGs,这种差异主要与人为污染有关. 地中海海水中ARGs的丰度更高,主要是由于受到沿岸人类活动带来的高抗生素选择压力和人类粪便污染的影响[63]. 在南极洲菲尔德斯地区,多肽、多药耐药和β-内酰胺抗性基因在海水中的含量也较为丰富.
表 1 不同海域海水中的ARGs的丰度Table 1. Abundance of ARGs in seawater of different areas海域Sea area 研究时间Time 研究方法Method ARGs 相对丰度(16S rRNA−1)Relative abundance 绝对丰度Absolute abundance 参考文献Reference 中国渤海湾 2015.07.12 qPCR tetM 5.15×10−5 [59] sul 10−5—10−3 泰国邦盛和芭堤雅海滩 2018.12, 2019.02—2019.08 qPCR bla-TEM 2.08—4.12 lg copies·100 mL−1 [17] 中国黄海和渤海 2018.08.18—2018.09.07 qPCR sul1, sul2, tetB, tetG, tetX, ermF, ermT, qnrA, qnrB, qnrS 21.1—8.00×103 copies·mL−1 [60] 西太平洋和南大洋 2019.10.31—2019.12.04 qPCR tetA, tetB, tetBP, tetD, tetZ, sul1, ermB, blaTEM, qnrD, oqxA (3.0×106±1.6×106) copies·mL−1 [58] 爱尔兰海 2018.09—2019.10 qPCR bla-TEM 2.6×103—6.3×103 GC·100 mL−1 [41] sul1 3.7×102—4.8×103 GC·100 mL−1 黑海 2019.07—08 qPCR vanB 2×10−1±1×10−1 [53] bla-SHV 4×10−2±1×10−2 bla-CMY 1×10−2±3×10−3 mcr-1 3×10−2±2×10−2 ermB 1×10−3±5×10−4 vanA 1×10−5±5×10−4 悉尼港河口玫瑰湾 2019.08—09 qPCR sul1 (7.96×101±2.16×102) copies·100 mL−1 [61] qnrS (1.38×103±3.23×103) copies·100 mL−1 tetA (9.98×103±3.03×103) copies·100 mL−1(2.87×105±2.50×105) copies·100 mL−1 波罗的海 2008.08,2009.09 qPCR tetB 1.8×102—7.3×102 copies·L−1 [62] bla-SHV 2.5×102—1.0×103 copies·L−1 ermB 5.0×101—3.0×102 copies·L−1 tetM 4.2×101—7.8×103 copies·L−1 sul1 2.5×101—1.7×104 copies·L−1 英吉利海峡和北海海域 2020.01 qPCR tetA 2.24 lg copies·mL−1 [54] sul1 1.52—3.55 lg copies·mL−1 3.2 沉积物中抗生素抗性基因污染现状
与流动的海水环境相比,沉积物更具有区域稳定性,因此ARGs更倾向于在沉积物中积累,沉积物中的ARGs丰富且持久[21,60](表2),所以沉积物的再悬浮也是海水中ARGs的一种重要来源[17,49,64]. 总的来说,多药耐药基因和磺胺类抗性基因是海洋沉积物中常被检出的类型(表2和图2).
表 2 不同海域沉积物中的ARGs丰度Table 2. Abundance of ARGs in sediment of different areas海域Sea area 研究时间Time 研究方法Method ARGs 相对丰度(16S rRNA−1)Relative abundance 绝对丰度(copies·g−1)Absolute abundance 参考文献Reference 中国渤海湾 2015.07.12 qPCR tetM 1.7×10−4 [59] sul 10−4—10−2 中国九龙江口和闽江口 2016.04 宏基因组 289种ARGs 1.05×10−1—2.93×10−1 [16] 中国黄海和渤海 2018.08.18—2018.09.07 qPCR sul1, sul2, tetB, tetG, tetX, ermF, ermT, qnrA, qnrB, qnrS 4.67×103—1.08×107 [60] 白令海北部 2007.05—06,2016.07,2015.11 qPCR sul1, sul2, sul3, tetA, tetB, tetM, tetC, tetD, aacC2, aacC3, aacC4, qepA, qnrB, qnrA, qnrS, qnrD, ermC, blaOXA-1, blaTEM-1, blaOXA-2, blaDHA-1, blaVIM-1, ampC, blaCMY-2, blaOXA-10, blaSHV-1, blaGES-1, blaNDM-1, blaKPC 10−9—10−5 [68] 中国渤海附近海河河口 2018.05 HT-qPCR 85种ARGs 9.06×106—2.93×108 [43] 对于印度洋周边海域,在科威特附近海域沉积物中β-内酰胺类、头孢菌素类和青霉素类抗性基因被频繁检出[65],而在库奇湾、康巴特湾和阿拉伯海的沉积物中,多药耐药抗性基因的占比几乎>40%[66]. 对于太平洋周边海域,多药耐药基因是东中国海九龙江口和闽江口主要的ARGs类型[16],氨基糖苷类、多药耐药和磺胺类耐药是渤海湾西部海河河口3种最主要的耐药类型,其主要的耐药机制为抗生素失活和外排泵(共占81.4%)[43].
在大洋区域的沉积物中,情况与近海不同,ARGs的检出率和种类数目明显低于海水中. Su等[67]在西太平洋雅浦海沟的一个沉积物样品中检出了杆菌肽抗性基因,在另外两个沉积物样品中则未检出任何ARGs,而在海水样品中则检出了包括万古霉素、大环内酯和多药耐药等多种ARGs,这可能与海沟的极端深度和远离人为污染有关.
在极地海洋沉积物中也检出了ARGs. 在北极和亚北极的白令海北部区域,sul1、sul2和sul3是最普遍存在的ARGs,但其丰度与渤海湾的海河河口和其他受人类严重影响的海域相比低约2—5个数量级[68].
4. 海洋环境中抗生素抗性基因的影响因素(Influencing factors of antibiotic resistance genes in marine environment)
除污水处理厂的排放、地表径流、船舶污染、人类近岸活动等常见ARGs污染源的影响外,海洋环境中ARGs的组成还受到多种生物和环境因素的影响.
微生物作为ARGs的直接宿主,其群落组成会对ARGs的组成产生重要影响,但在不同区域,ARGs往往有着不同的潜在宿主. 蛭弧菌门(Bdellovibrionota)、蓝细菌(Cyanobacteria)和Margulisbacteria是西太平洋和南大洋海水中ARGs的主要潜在宿主[58]. γ‐变形菌(Gammaproteobacteria)和α-变形菌(Alphaproteobacteria)是西太平洋和深海ARGs的主要潜在宿主[70]. 而拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)与黄海沉积物中大部分ARGs正相关,可能是其潜在宿主[71]. Yang等[57]通过对Tara Oceans项目收集的全球132个海水样品中ARGs组成分析发现,海杆菌(Marinobacter)、交替单胞菌(Alteromonas)、黄杆菌(Flavobacterium)和假交替单胞菌(Pseudoalteromonas)是这些样品中ARGs的主要潜在宿主. 这种差异可能是不同区域理化因子和优势菌群的差异导致的. 与大多数化学污染物不同,ARGs不仅能够长期存在于海洋环境中,而且还能够通过VGT随着宿主的增殖进一步扩增. Li等[72]对龟山岛附近浅海热液口海水的调查显示,细菌群落和物理化学因素对ARGs的组成存在较强的共同影响,细菌群落介导的VGT过程可能对浅海生态系统中ARGs的组成存在重要影响. 此外,它们还能通过HGT作用在不同细菌之间传递,在环境中逐渐增加[73-74]. 包括质粒、转座子、整合子等在内的可移动遗传元件(Mobile Genetic Elements, MGEs)通过接合、转化、转导等方式实现HGT[75]. 许多研究都发现intI1能够促进海水和沉积物中一些基因的传递[43,58-59,76]. 例如,Na等[77]研究显示,1类整合子intI1与sul1和sul2显著相关,表明1类整合子可以促进黄海海水和沉积物中这两种抗性基因的传播. 而亚得里亚海沉积物中,具有β-内酰胺抗性的大肠杆菌菌株则与IncF质粒之间表现出显著相关[78].
此外,抗生素作为诱导产生ARGs的直接驱动力,是许多区域ARGs组成和丰度的重要影响因素. 例如,在一些海水养殖区,抗生素的浓度与一些相应ARGs丰度呈显著正相关关系[64,79]. 在厦门西溪河口和台州椒江口也发现了相同的情况[44]. 在珠江口的沉积物、北黄海的海水和渤海湾水和沉积物中,sul1和sul2都与磺胺类抗生素均呈显著正相关[56,59,77],此外,在渤海湾的海水和沉积物中,tetW与土霉素也呈显著正相关[59]. 但这种情况并非是绝对的,同样是在黄、渤海沉积物中,Lu等[60]的研究则发现,ARGs与相应抗生素间无明显相关关系. 在辽河河口海水、泰国沿海海水、香港沿岸沉积物中,抗生素浓度也与ARGs无明显相关关系[39,80-81]. 这可能与抗生素浓度和水文动力学过程对污染物的影响有关,在抗生素浓度高的养殖等区域,对ARGs存在更强的选择压力,并且海水的运动也会稀释近海水体中的抗生素和ARGs,减弱二者的相关性[39].
非抗生素污染因素也可以通过共同选择过程等影响ARGs的组成和丰度[39,82]. 越来越多的证据表明,重金属[39]、微塑料[46]、有机污染物(包括苯扎氯铵消毒剂[83]、多环芳烃(polycyclic aromatic hydrocarbons, PAHs)[84]、多氯联苯(polychlorinated biphenyls, PCBs)[85]、杀虫剂[86]、等离子液体[87]、纳米粒子[88]等在内的多种因素都会影响环境中ARGs的组成和丰度. Yang等[46]研究发现,与海水相比,微塑料和大塑料中ARGs和MRGs的相对丰度均较高,塑料是ARGs的重要载体. Wang等[84]研究发现,PAHs促进了海水中intI1介导的ARGs的共轭转移. Li等[50]研究发现,有机污染物PAHs、PCBs和六溴环十二烷的浓度也与ARGs丰度呈正相关,这一结果可以通过上述污染物对intI1的上调来解释. 此外,也有许多研究表明,海水和沉积物中的重金属与ARGs间存在显著正相关,这与共选择机制作用有关[39,44,50].
与淡水环境相比,海洋具有独特的物理化学性质,包括pH、盐度、营养盐和微量元素水平等,这些因素也会影响ARGs的组成. Zhang等[6]研究表明,海水中溶解氧(dissolved oxygen, DO)和sul2、bla-TEM有强负相关,DO是表示海水自净能力的重要因素,ARGs与DO呈负相关,表明海水的自净能力越低,ARGs的丰度越高,即在低氧海水环境中,ARGs具有更高的浓度. 盐度是衡量海水性质的重要指标,不同研究区域地理位置和盐度变化范围存在差异,对ARGs的影响也就不同. 在大洋海域,盐度高且变化小,而河口和近海区域盐度低且变化幅度大[58]. 在西太平洋和南大洋海水中,盐度和ARGs丰度呈正相关关系[58]. 而在太平洋海域的南海珊瑚礁海域的海水中、渤海湾海河河口沉积物中、厦门西溪河口沉积物中,以及大西洋海域英吉利海峡和北海海水中,盐度和ARGs丰度则呈现负相关关系[43-44,90]. 这可能与污水排放和地表径流对海水的冲淡有关,携带有大量ARGs的污水和河水盐度较低,但会带来大量的ARGs输入,因而导致了这种负相关关系. 与盐度类似,不同海域海水和沉积物中ARGs与不同理化因子的关系也不同. 渤海和黄海海水中ARGs的组成主要受铵盐、硝酸盐和海水盐度的影响[60]. Lu等[44]研究表明,沉积物中ARGs的相对丰度与沉积物粒径和总有机碳(total organic carbon, TOC)含量呈正相关,与沉积物pH和氧化还原电位呈负相关,其中,沉积物粒径是影响ARGs丰度的主要因子. 英吉利海峡和北海海水中sul1与DO、pH和浊度显著正相关[54]. 福建闽江口沉积物中ARGs与TOC、总氮(Total Nitrogen, TN)和总磷(total phosphorus, TP)显著正相关,而九龙江口沉积物中ARGs则与TOC显著正相关,与TN和TP显著负相关[16]. 西太平洋和渤海海水中的糖肽、三氯生、磷霉素和大环内酯-林可酰胺-链阳菌素抗性基因与亚硝酸盐、硝酸盐、叶绿素a、DO呈正相关,而糖肽、三氯生、大环内酯-林可酰胺-链阳菌素和β-内酰胺抗性基因与盐度和DO呈负相关[70]. 总的来说,TOC与海水和沉积物中ARGs呈明显正相关,而不同区域营养盐和pH则对ARGs的组成呈现不同的影响. 有机碳作为微生物尤其是异养细菌的重要营养来源,可以影响微生物群落[90-91],因而与ARGs呈明显正相关;而不同区域营养盐浓度和微生物群落组成差异较大,因此对ARGs的影响也不同.
综上所述,ARGs与环境因子和生物因素的相关性存在区域差异,可能与不同环境中这些理化因子差异较大、以及微生物的适应过程不同有关. 在复杂的海洋生态系统中,存在多种影响ARGs组成和丰度的因素,但对此仍没有一致性认识,因此需要进一步的识别和量化,并揭示相关机制.
5. 海洋环境中抗生素抗性基因污染的生态与健康风险(Ecological and health risks of antibiotic resistance gene pollution in marine environment)
海洋微生物群落是地球上最丰富、最复杂的群落之一[92],因此海洋也成了ARGs巨大的汇. 虽然海洋环境中ARGs的污染目前可能是局部性的,但其后果具有全球相关性,这些首先存在于局域环境中的ARGs可以通过海洋环流运输、海鲜运输和消费、旅游等过程扩大污染范围,对公共卫生、生态系统功能和动物疾病防治等造成严重危害[93].
首先,沿海地区会受到ARGs污染,并给附近生活的人类造成健康威胁. 例如,公共海滩是潜在ARGs污染源,这些区域的休闲海水、沉积物和沙子中存在的ARGs会给海滩使用者带来潜在的健康风险[17,30,36,94-95]. 在大连的傅家庄海水浴场,海水中检出了多种抗生素耐药大肠杆菌,其中38%(26/69)的菌株对至少一种抗生素具有耐药性[96]. 在巴西的海滩,休闲水域的海水和沙子中,也检测出了多种ARGs[97].
其次,海洋环境中的ARGs可以通过洋流输送到遥远的地区,构成全球风险,最终对人类健康构成威胁. 例如,极地区域和深海中也检出了多种ARGs[47,63,70]. Tan等[68]研究发现,北极/亚北极区域存在多种ARGs,这些ARGs与人类特异性分子标记物显著相关,这意味着极地区域已受到人为源ARGs的污染,而这些人为源ARGs很可能是通过海洋环流等过程传输而来的. 除此之外,陆源ARGs可以通过大气传输影响海洋,而海洋环境中的ARGs也可以通过海-气交换进入大气环境,并通过大气长距离运输,进一步传播到更远的地区. 候鸟迁徙也是ARGs从海洋环境向外扩散的一个重要途径,多项研究表明,海鸟胃肠道和粪便中存在多种ARB和ARGs,它们即是环境中的被感染对象也是潜在的传播源[98-100].
此外,海水养殖设施对海水和沉积物中ARGs的积累和传播也具有重要作用. 随着海水养殖业的快速发展,使得大量投加抗生素治疗养殖生物的细菌感染等疾病成为了常态,这带来了大量的抗生素残留,而鱼、虾等海产品则会从海水养殖环境中摄取这些ARGs,并进一步通过食物链威胁人类健康[101-103]. 在不同国家的多种海产品中均检出了ARGs[104-106]. 例如,在印度孟买零售市场销售的海鲜中分离出了大肠杆菌,71.58%的菌株能够产生超广谱β-内酰胺酶[107]. 在中国12个沿海地区采集的虾的内脏中也检测到了114种ARGs,其中主要为多药耐药抗性基因(21.05%),其次是四环素类抗性基因(17.54%)[108]. 可见,这些存在于海水养殖环境及水产品中ARGs将会通过食用等途径,给人类健康带来风险.
6. 总结与展望(Summarization and prospect)
抗生素耐药性问题是一个全球性的公共卫生问题,也是整个世界,尤其是发展中国家面临的一个亟待解决的重要问题. 而海洋环境作为人类活动产生的污染物的重要归宿,也是ARGs的一个天然储库. 海洋环境中存在着多种ARGs,但目前关于海洋环境中ARGs种类组成和传播途径的相关研究较少,对ARGs的归趋及其影响因素还缺乏系统的认识,对海水和沉积物中ARGs的扩散机制仍有待进一步探索.
因此,建议在以下4个方面强化研究,以深入认识海洋环境中的ARGs污染过程及防控措施:(1)开展各个海域、各种模式下海洋环境中ARGs的来源、组成和丰度的相关研究,深入解析不同人为源和自然源对海洋环境ARGs的贡献. (2)丰富海洋环境中ARGs的相关数据,建立海洋ARGs污染数据库,调查抗生素污染以及由此引发的ARGs对海洋微生物的长期和短期影响,并建立和完善海洋环境中ARGs的生态风险和人类健康风险评价指标体系,研发近海海洋环境ARGs污染基准,为制定相应环境标准、规范海水养殖和近海污水处理排放提供理论依据. (3)深入探究海洋环境中各类理化因子和污染物对ARGs的选择压力及机制,研究海洋环境中ARGs的降解机制,明确ARGs与海洋微生物群落之间的关系,细化海洋生态系统中ARGs的环境行为,从而制定相应策略,以期遏制ARGs在海洋环境中的扩散. (4)明确海洋环境中ARGs扩散和传播的分子机制,基于基因组学、大数据分析和数值模型,预测海洋环境介质中ARGs的变化趋势.
-
表 1 不同生物多样性指数评价标准
Table 1. Evaluation criteria of different biodiversity indices
H' 水质类型Water quality J 水质类型Water quality D 水质类型Water quality H' > 3 清洁水平 J > 0.8 清洁水平 D > 4 清洁水平 2 ≤ H' ≤ 3 β -中污染型 0.5 ≤ J ≤ 0.8 轻污染型 3 ≤ D ≤ 4 轻度污染型 1 ≤ H' ≤ 2 α -中污染型 0.3 ≤ J ≤ 0.5 β -中污染型 1 ≤ D ≤ 3 中度污染型 H' < 1 重污染型 0.1 ≤ J < 0.3 α -中污染型 0 ≤ D < 1 重度污染型 表 2 东平湖秋季浮游生物优势种与优势度
Table 2. Dominant species and degree of dominance for plankton in autumn of Dongping Lake
优势种(属)Dominant species Y 浮游植物 蓝藻门 色球藻 (Chroococcus spp.) 0.045 平裂藻 (Merismopedia sp.) 0.058 伪鱼腥藻 (Pseudoanabaena spp.) 0.205 绿藻门 小球藻 (Chlorella spp.) 0.046 衣藻 (Chlamydomonas spp.) 0.022 镰形纤维藻 (Ankistrodesmus. falcatus) 0.054 栅藻 (Scendesmus sp.) 0.085 硅藻门 小环藻 (Cyclotella spp.) 0.184 针杆藻 (Synedra spp.) 0.051 浮游动物 桡足类 无节幼体 (Nauplius) 0.296 剑水蚤 (Cyclops) 0.305 枝角类 象鼻溞 (Bosmina spp.) 0.298 网纹溞属 (Ceriodaphnia) 0.095 表 3 21世纪以来东平湖秋季浮游植物群落特征对比
Table 3. Comparison of phytoplankton community characteristics in the autumn of Dongping Lake since 21 century
时间Years 优势种Dominant species B/ (mg∙L−1) H' 2007[26] 主要优势种群为蓝藻门、绿藻门、硅藻门及隐藻门 23.52 2.60 2007[28] 以蓝藻门的色球藻和席藻为主 — 1.73 2010[29] 伪鱼腥藻、尖尾蓝隐藻、卷曲纤维藻 — — 2010[20] 伪鱼腥藻、尖尾蓝隐藻、镰形纤维藻 — 3.9 2011[20] 伪鱼腥藻、依沙束丝藻、针形纤维藻 — 3.1 2012[20] 伪鱼腥藻、依沙束丝藻、尖针杆藻 — 3.7 2013[25] 色球藻、席藻、小球藻及针杆藻 5.97 1.49 2016 — 2017[10] 伪鱼腥藻、蓝纤维藻、拟浮丝藻、鱼腥藻、平裂藻、巨颤藻、浮丝藻、细小平裂藻、束丝藻、泽丝藻、席藻、四尾栅藻、湖生卵囊藻、纤维藻 — 2.73 2017[9] 漂浮泽丝藻、色球藻、小球藻、小环藻、舟形藻、针杆藻、普通黄丝藻 6.42 1.76 2020[30] 小环藻、平裂藻、颗粒直链藻 — — 2021(本研究) 伪鱼腥藻、小环藻、栅藻、平裂藻、镰形纤维藻、针杆藻、小球藻、色球藻及衣藻 9.02 3.7 -
[1] MARCHETTO A, PADEDDA B M, MARIANI M A, et al. A numerical index for evaluating phytoplankton response to changes in nutrient levels in deep Mediterranean reservoirs [J]. Journal of Limnology, 2009, 68(1): 106. doi: 10.4081/jlimnol.2009.106 [2] 秦伯强, 高光, 朱广伟, 等. 湖泊富营养化及其生态系统响应 [J]. 科学通报, 2013, 58(10): 855-864. doi: 10.1360/csb2013-58-10-855 QIN B Q, GAO G, ZHU G W, et al. Lake eutrophication and its ecosystem response [J]. Chinese Science Bulletin, 2013, 58(10): 855-864(in Chinese). doi: 10.1360/csb2013-58-10-855
[3] 王雅雯, 李迎鹤, 张博, 等. 嘉兴南湖不同湖区浮游动植物群落结构特征与环境因子关系 [J]. 环境科学, 2022, 43(6): 3106-3117. WANG Y W, LI Y H, ZHANG B, et al. Structural characteristics of zooplankton and phytoplankton communities and its relationship with environmental factors in different regions of Nanhu Lake in Jiaxing City [J]. Environmental Science, 2022, 43(6): 3106-3117(in Chinese).
[4] 符哲, 郭晶, 黄代中, 等. 洞庭湖的富营养演变特征及影响因素 [J]. 环境化学, 2022, 41(8): 2636-2645. doi: 10.7524/j.issn.0254-6108.2021042005 FU Z, GUO J, HUANG D Z, et al. The evolution and influencing factors of eutrophication in Dongting Lake [J]. Environmental Chemistry, 2022, 41(8): 2636-2645(in Chinese). doi: 10.7524/j.issn.0254-6108.2021042005
[5] 姜登岭, 赵昊, 邬喜红, 等. 嘉兴城市河网区高、低水位期浮游植物群落及其与环境因子的典范对应分析 [J]. 环境化学, 2020, 39(9): 2540-2550. doi: 10.7524/j.issn.0254-6108.2020040804 JIANG D L, ZHAO H, WU X H, et al. Model correspondence analysis of phytoplankton community and its environmental factors at high and low water levels in urban river network area of Jiaxing City [J]. Environmental Chemistry, 2020, 39(9): 2540-2550(in Chinese). doi: 10.7524/j.issn.0254-6108.2020040804
[6] CHEN Y Y, CHEN S Y, YU S Y, et al. Distribution and speciation of phosphorus in sediments of Dongping Lake, North China [J]. Environmental Earth Sciences, 2014, 72(8): 3173-3182. doi: 10.1007/s12665-014-3223-8 [7] ZHANG Y H, HUANG, L L, ZHANG Z B, et al. Assessment of nutrients and organic matter in sediments of Dongping Lake, China [J]. Fresenius Environmental Bulletin, 2016, 25(4): 2269-2277. [8] LIU S S, YAO M, CHEN S Y, et al. Surface sediment diatom assemblages response to water environment in Dongping Lake, North China [J]. Water, 2021, 13(3): 339. doi: 10.3390/w13030339 [9] 董贯仓, 冷春梅, 丛旭日, 等. 南水北调东线工程运行3年后东平湖浮游植物群落特征及环境驱动因子 [J]. 湖泊科学, 2022, 34(1): 61-73. doi: 10.18307/2022.0107 DONG G C, LENG C M, CONG X R, et al. Phytoplankton community and driving environmental factors in Lake Dongping after 3 years implementation of the east route of South-to-North Water Diversion Project [J]. Journal of Lake Sciences, 2022, 34(1): 61-73(in Chinese). doi: 10.18307/2022.0107
[10] 辛未, 高雯琪, 夏文彤, 等. 调水后东平湖浮游植物群落结构及水质生物评价 [J]. 中国环境监测, 2022, 38(1): 145-156. XIN W, GAO W Q, XIA W T, et al. Phytoplankton community structure and bioassessment of water quality in Dongping Lake after water diversion [J]. Environmental Monitoring in China, 2022, 38(1): 145-156(in Chinese).
[11] 高雯琪, 辛未, 夏文彤, 等. 东平湖浮游动物对南水北调东线运行的时空响应 [J]. 中国环境监测, 2022, 38(1): 114-123. GAO W Q, XIN W, XIA W T, et al. Spatio-temporal responses of zooplankton to the operation of the eastern route of the south-to-north water diversion project in Dongping Lake [J]. Environmental Monitoring in China, 2022, 38(1): 114-123(in Chinese).
[12] CHEN Y Y, CHEN S Y, LIU J Z, et al. Environmental evolution and hydrodynamic process of Dongping Lake in Shandong Province, China, over the past 150 years [J]. Environmental Earth Sciences, 2013, 68(1): 69-75. doi: 10.1007/s12665-012-1716-x [13] DENG H G, ZHANG J, CHEN S Y, et al. Metal release/accumulation during the decomposition of Potamogeton crispus in a shallow macrophytic lake [J]. Journal of Environmental Sciences, 2016, 42: 71-78. doi: 10.1016/j.jes.2015.07.004 [14] YU Q Z, MICKLER R A, LIU Y J, et al. Remote sensing of Potamogeton crispus L. in Dongping Lake in the North China plain based on vegetation phenology [J]. Journal of the Indian Society of Remote Sensing, 2020, 48(4): 563-573. doi: 10.1007/s12524-020-01103-w [15] 丁洋, 赵进勇, 张晶, 等. 松花湖水质空间差异及富营养化空间自相关分析 [J]. 环境科学, 2021, 42(5): 2232-2239. DING Y, ZHAO J Y, ZHANG J, et al. Spatial differences in water quality and spatial autocorrelation analysis of eutrophication in Songhua Lake [J]. Environmental Science, 2021, 42(5): 2232-2239(in Chinese).
[16] Shannon C E, Weaver W. The mathematical Theory of Communication [J]. Philosophical Review, 1949, 60(3): 144. [17] PIELOU E C. Species-diversity and pattern-diversity in the study of ecological succession [J]. Journal of Theoretical Biology, 1966, 10(2): 370-383. doi: 10.1016/0022-5193(66)90133-0 [18] MCNAUGHTON S J. Relationships among functional properties of Californian grassland [J]. Nature, 1967, 216(5111): 168-169. [19] 白海锋, 王怡睿, 宋进喜, 等. 渭河陕西段浮游动物群落结构时空特征及其驱动因子 [J]. 生态学杂志, 2022, 41(8): 1602-1610. BAI H F, WANG Y R, SONG J X, et al. Spatio-temporal characteristics and driving factors of zooplankton community structure in the Shaanxi section of Weihe River, China [J]. Chinese Journal of Ecology, 2022, 41(8): 1602-1610(in Chinese).
[20] 路学堂. 东平湖浮游植物群落结构与驱动因子及蓝藻水华可能性研究[D]. 济南: 山东大学, 2013. LU X T. The research on phytoplankton community, driving environmental factors and the possibility of cyanobacterial bloom in Dongping Lake, China[D]. Jinan: Shandong University, 2013(in Chinese).
[21] 胡尊芳, 宋印胜, 孙建峰, 等. 东平湖枯丰水期水质健康风险评价 [J]. 水电能源科学, 2016, 34(9): 31-34. HU Z F, SONG Y S, SUN J F, et al. Water quality health risk assessment of Dongping Lake in dry and wet seasons [J]. Water Resources and Power, 2016, 34(9): 31-34(in Chinese).
[22] 陈豪, 徐洪增, 路民, 等. 东平湖水体营养化状况综合评价 [J]. 人民黄河, 2022, 44(1): 83-88. CHEN H, XU H Z, LU M, et al. Comprehensive evaluation of water trophication status in Dongping Lake [J]. Yellow River, 2022, 44(1): 83-88(in Chinese).
[23] 刘红彩. 东平湖水环境状况与影响因素研究[D]. 济南: 山东大学, 2012. LIU H C. The research of water environment condition and the influencing factor of Dongping Lake[D]. Jinan: Shandong University, 2012(in Chinese).
[24] 韦丽琼, 郭芳, 姜光辉. 广西武鸣盆地岩溶泉口浮游生物群落对水环境变化的响应 [J]. 湖泊科学, 2022, 34(3): 777-790. doi: 10.18307/2022.0307 WEI L Q, GUO F, JIANG G H. Responses of plankton community to water environment changes in Karst springs in Wuming Basin, Guangxi Province [J]. Journal of Lake Sciences, 2022, 34(3): 777-790(in Chinese). doi: 10.18307/2022.0307
[25] 冷春梅, 董贯仓, 王亚楠, 等. 南水北调运行初期东平湖浮游植物群落特征分析 [J]. 水产学杂志, 2019, 32(1): 22-27. LENG C M, DONG G C, WANG Y N, et al. Phytoplankton community structure characteristics in Dongping Lake in initial stages of south-to-north water transfer project [J]. Chinese Journal of Fisheries, 2019, 32(1): 22-27(in Chinese).
[26] 王志忠, 巩俊霞, 陈述江, 等. 东平湖水域浮游植物群落组成与生物量研究 [J]. 长江大学学报(自然科学版), 2011, 8(5): 235-240,1. WANG Z Z, GONG J X, CHEN S J, et al. Studies on community characteristics and biomass of phytoplankton in Dongping Lake [J]. Journal of Yangtze University (Natural Science Edition), 2011, 8(5): 235-240,1(in Chinese).
[27] 王一舒, 逄勇, 罗缙, 等. 南水北调东线(江苏段)水质变化趋势分析 [J]. 水资源与水工程学报, 2014, 25(4): 104-107. WANG Y S, PANG Y, LUO J, et al. Analysis of change tendency of water quality in east line of south-to-north water diversion project of Jiangsu section [J]. Journal of Water Resources and Water Engineering, 2014, 25(4): 104-107(in Chinese).
[28] 冷春梅, 巩俊霞, 王亚楠, 等. 东平湖2007年浮游植物调查及分析 [J]. 山东农业大学学报(自然科学版), 2009, 40(4): 513-516. LENG C M, GONG J X, WANG Y N, et al. Analysis of phytoplankton biological quantity in Dongping Lake in 2007 [J]. Journal of Shandong Agricultural University (Natural Science Edition), 2009, 40(4): 513-516(in Chinese).
[29] TIAN C, LU X T, PEI H Y, et al. Seasonal dynamics of phytoplankton and its relationship with the environmental factors in Dongping Lake, China [J]. Environmental Monitoring and Assessment, 2013, 185(3): 2627-2645. doi: 10.1007/s10661-012-2736-4 [30] 侯莉, 张玲玲, 张倩. 东平湖水生生物资源调查与评估 [J]. 绿色科技, 2022, 24(2): 52-55. HOU L, ZHANG L L, ZHANG Q. Investigation and assessment of aquatic biological resources in Dongping Lake [J]. Journal of Green Science and Technology, 2022, 24(2): 52-55(in Chinese).
[31] 林青, 由文辉, 徐凤洁, 等. 滴水湖浮游动物群落结构及其与环境因子的关系 [J]. 生态学报, 2014, 34(23): 6918-6929. LIN Q, YOU W H, XU F J, et al. Zooplankton community structure and its relationship with environmental factors in Dishui Lake [J]. Acta Ecologica Sinica, 2014, 34(23): 6918-6929(in Chinese).
[32] 谢海莎, 邵瑞华, 王际焱, 等. 延河丰水期浮游生物群落分布及其与环境因子的关系 [J]. 环境保护科学, 2022, 48(1): 108-114. XIE H S, SHAO R H, WANG J Y, et al. Relationship between distribution of plankton community and environmental factors in Yanhe River during wet season [J]. Environmental Protection Science, 2022, 48(1): 108-114(in Chinese).
[33] LÉVESQUE S, BEISNER B E, PERES-NETO P R. Meso-scale distributions of lake zooplankton reveal spatially and temporally varying trophic cascades [J]. Journal of Plankton Research, 2010, 32(10): 1369-1384. doi: 10.1093/plankt/fbq064 [34] 徐梅, 吴芳仪, 刘靓靓, 等. 焦岗湖浮游甲壳动物群落结构的季节动态 [J]. 生态学杂志, 2016, 35(5): 1254-1262. XU M, WU F Y, LIU J J, et al. Seasonal variation of community structure of crustacean zooplanktons in Lake Jiaoganghu [J]. Chinese Journal of Ecology, 2016, 35(5): 1254-1262(in Chinese).
-






 下载:
下载: