-
土壤系统中生命与非生命的相互关系是人类与其它生物生存环境的重要组成部分对推动物质循环和能量流动具有重要作用. 土壤是人类生产生活的基础资源,它具有提供食物来源、控制温室气体排放、促进碳氮循环和维持生物多样性等多重功能,也是能量交换和物质循环最活跃的生命层,具有有毒污染物缓冲带、过滤器和聚集地的双重身份[1-3]. 即使我国每年土壤污染防治投入不断增加,但仍然面临水土流失严重、耕地质量平均等级偏低、土壤盐碱化和沙化严重等问题. 与此同时,随着我国正式开启全面建设社会主义现代化国家的进程,农业环境改善和矿产资源开发成为全球经济衰退后拉动全球经济增长的不竭动力[4].
来自于土壤系统功能中的生物多样性提供了全球价值最大的生态系统服务. 微生物作为土壤系统的核心在碳、氮、磷等物质分解、养分循环以及结构稳定等方面发挥着重要作用,其多样性也极易受pH、营养条件、重金属等土壤因子的影响[5-6]. 因此,本文分析土壤微生物对碳磷氮等及非金属污染物的代谢特征,并通过矿山土壤环境的微生物特征分析,提出外部物理场调控将有助于微生物群落向可控方向演变,对土壤污染物阻控和理化特性改善并进一步实现退化土壤生态结构与功能重塑具有重要意义.
-
土壤具有以植物、化能营养细菌和藻类为代表的生产者,以土壤中草食动物和肉食动物为代表的消费者及以细菌、真菌、放线菌和食腐动物等为代表的分解者,同时也具有进行物质迁移转化和能量传递的功能. 土壤系统生态功能中有机质分解、养分循环、生物扰动、病虫害控制都与土壤生物多样性密切相关,其中由根系-微生物构成的复杂系统承担了主要的生物化学过程[7]. 当土壤生态系统受外界干扰相对较少时,微生物种类可能演替成一个单一的、“功能最优”的群落,以适合有用资源的开发. 极端环境成为重要的微生物宝库,但环境异质性更容易引起土壤-微生物相互作用的变化,使土壤生态系统长期处于更迭演替的非平衡状态,这严重削弱了土壤系统生态功能. 由于抗干扰敏感性不同使各微生物群落对环境变化表现出巨大差异,土壤代谢等生物化学过程将更加难以捉摸.
微生物作为土壤与外界环境进行物质交换和信息传递的重要群体,是土壤生态系统响应外界胁迫的主导者及土壤微生态的核心驱动,同时它也可辅助植物根系的生长塑造[8]. 土壤微生物群落组成和功能的动态变化能及时反映土壤水分、pH值、温度和养分的状态,是土壤质量和健康的有效指标[9].
-
在生态系统中,物质循环于各生物体之间,能量嵌入食物链的物质中,而整个系统的唯一外部输入是太阳能,包括碳和其他养分在内的循环都与生态系统的主要物质流有关[10]. 能量流是复杂系统的重要组成部分,开放的个体生物、生态群落、生态系统和生物圈从环境中获取能量,能量驱动了系统的发展和演化过程. 树木和其他绿色植物在光合作用的过程中把入射的太阳辐射能转化成生物量,为复杂食物链中其它生物提供可利用的能量[11]. 化学能随生物质的呼吸作用在食物链不同营养级间进行复杂转移,即使能量在系统中不可避免地耗散,但最终都是以热量的形式结束,辐射回太空[12-13].
-
土壤颗粒和孔隙的空间结构以团聚或分散的形式排列,其中团聚结构的稳定性是土壤稳定性的一个重要特征[14]. 土壤团聚体的三大作用包括保证和协调土壤中的水肥气热、影响土壤酶的种类和活性、维持和稳定土壤疏松熟化层. 土壤团聚体稳定性主要由平均质量直径和几何平均直径判定,因此拥有较大粒径分布团聚体的土壤往往稳定性较高. 这种稳定性及聚集程度受微生物群、动物群、凋落物、环境因子和无机粘合剂等各种生物和非生物因素驱动. 如丛枝菌根真菌(AMF)产生的糖蛋白GRSP有助于土壤颗粒之间的联系和团聚体的稳定,其浓度与水稳性团聚体数量呈正相关 [15]. 与团聚体有关的土壤微生物在耕作或其他干扰后的碳和氮动态变化中发挥关键作用[16]. 如较小的团聚体具有较高的SOC、TN浓度和微生物活性,表明碳和氮的动态变化更活跃[17]. 土壤颗粒上孔隙和水膜的不均匀性导致了土壤微生物群落的多样性. 根生物量的变化直接影响土壤团聚体内的微生物类群和微生物残体在不同粒径团聚体内的分布情况[18].
-
营养条件在土壤生物驱动系统物质循环与能量流动中起着至关重要的作用,它控制了系统中相关微生物群落对物质和能量的更迭,成为土壤活性与土壤生态价值的决定性因素[19]. 无机和有机施肥均能增加土壤有机质和养分含量,其影响主要包括重塑微生物群落的组成、提高土壤活性和改善土壤结构. 超过66种有机肥对真核微生物群落具有剂量依赖效应[20-21]. 有机施肥可以使土壤环境中容纳更多的微生物,而无机施肥通过添加养分和改变土壤性质扰乱土壤生态系统. 微生物群落多样性和组成会随施肥过程中的化学性质不断变化,无机氮肥、秸秆和有机肥这3种类型的肥料对变形菌、放线菌和拟杆菌的生长有促进作用,而对酸杆菌和硝化螺旋菌的生长产生抑制作用[22].
土壤有机质在改善土壤结构、热状态或土壤水分动力学方面有重要作用,能显著影响土壤生物的养分循环、有害物质和元素的结合或分解等生化过程,是土壤生物学的重要特征[23]. 土壤较高的有机质含量增加了养分供给和缓冲调节能力,是陆地生态系统中重要的碳固存途径. 维持或增加土壤有机质含量对提高农业生产力和保障食品安全尤为重要[24]. 阳离子交换是由土壤颗粒表面过多负电荷引起的. 有机质引起的土壤阳离子含量变化最大,粘粒型土壤的阳离子含量变化最小,其中Ca2+、Mg2+、K+、Na+、NH4+的平衡变化不断改变着土壤胶体性质[25].
-
土壤是陆地生态系统最大的碳库,其碳储量相当于大气碳库和植物碳库的2—3倍,土壤碳库的增加或减少主要取决于土壤有机碳的输入和输出速率,微生物群落土壤有机库分解释放CO2进入土壤溶液会转化为无机碳. 无机碳库通过影响有机碳转变效率进而影响土壤团聚体稳定性、微生物活性、土壤pH、有机质的分解速率等.
-
土壤有机碳来源于动植物残体、根沉积物和微生物坏死[26],经众多微生物通过体外修饰或体内转化形成[27]. 植物根系和凋落物是植物型碳输入土壤的主要途径,其中高达21%的光合固定碳通过根系分泌物在根际富集,促进了根际微生物的碳循环过程[28]. 土壤吸收大气中CO2主要有地球化学系统吸收和有机碳积累两种形式. 微生物能在长时间内通过分解作用释放CO2,其中植物残枝、木质纤维、木炭等难降解有机物会在长达10年到100年时间内不断降解,同时土壤动物及植物也会通过呼吸作用将CO2随孔隙释放到大气,并且伴随着土壤-水系统的移动,以溶解有机物和HCO3-形式进行迁移和转化,形成丰富的土壤系统和其它系统碳循环形式.
-
土壤有机碳对气候变暖的稳定性与其初始数量和不稳定性有关,并可能因微生物生理的变化而降低,包括微生物碳利用效率和代谢酶活性的提高. 土壤有机质储量的数量和停留时间受气候、土壤质地、植物种类组成、土壤深度和干扰状况等因素的影响,其积累量可改善土壤养分、团聚性能、温度调节等条件[29-30]. 根据代谢模型可以推断,环境温度升高会加速生物化学反应,微生物的碳分解速率会有所增加,其中细菌在溶解性有机物降解过程中比真菌发挥着更强的作用[31-32].
土壤微生物多样性/生物量比值通常在低碳干旱环境中较高,在富碳寒冷环境中较低[33]. 土壤微生物生物量均与其碳代谢强度、碳源丰富度呈显著的正相关关系,高土壤微生物生物量能提高土壤碳代谢速率[34]. 微土壤微生物群落碳代谢功能既受土壤有机质水平的影响,也与土壤氮素密切相关,氮含量较低的土壤会限制微生物活性而影响碳代谢功能[35].
-
MCP(microbial carbon pump)概念与合成有机物在矿物表面和土壤结构内稳定的能力结合起来,如图1显示了微生物在驱动土壤碳循环方面的关键作用[35]. 微生物对碳通量的控制有两个关键且截然不同的作用:通过分解代谢活动促进碳向大气的释放;将碳稳定为不易分解的形式来防止碳的释放.
土壤生物能够将腐殖质等复杂有机化合物质高效分解而为养分转化奠定基础,其分解效率受生物活性影响[36]. 通常富碳土壤比贫碳土壤含有更多的抗性细菌群落和更敏感的真菌群落,因此富碳土壤中的群落在应对移位增温时具有更强的碳代谢能力[37]. 土壤理化性质及其微生物群落活动主要受有机碳库的影响,是因为有机碳库的积累和矿化影响了土壤水-气间的碳平衡,微生物代谢需求和现有碳资源状况变化对细胞外酶活性产生了巨大影响[38].
植物根际部分是土壤微生物群落最活跃的部分,含有的大量生物活性分子以及各种次生代谢产物极大地改善了微生物群落结构和多样性[39]. 其中酸细菌是土壤碳循环起关键作用的第二大细菌类型,具有降解纤维素和木质素的能力;放线菌能抑制疾病、增加根结瘤、促进植物生长并改善土壤性能;异养菌通过吸收溶解有机碳增加生物量并转化为无机碳,是碳泵的关键部分[40]. 真菌和细菌的贡献作用取决于土地利用、土壤深度、降水量、温度、pH值、可用养分、细胞外酶活性等土壤理化特性、群落特性以及微生物固碳能力成为微生物残留物积累的主要控制因素[41-42].
-
土壤中磷的主要形态为无机磷,占土壤总磷的60%—80%. 有机磷主要以可溶性磷的形式存在,可溶性有机磷和微生物磷的强相关性表明它们大部分来源于微生物细胞[43]. 土壤微生物在自然磷循环中起着核心作用. 植物根际和土壤微生物通过分泌弱酸来溶解土壤中的磷,并合成磷酸酶促进含磷有机化合物的释放来获取磷资源[44].
土壤磷循环过程主要涉及磷化合物的氧化和还原反应,主要是有机磷和磷酸盐的转化[45]. 土壤中碳和氮的积累会导致营养成分中磷含量的变化从而限制微生物的磷代谢活动,但也可能通过负反馈调节增加微生物磷获取相关的酶活性[33]. 细菌、真菌和藻类中的磷以聚合物形式储存,植物中的磷主要以植酸的形式有机结合存在于种子和谷物中,而磷在动物组织、骨骼和鳞片广泛存在. 磷除了在细胞中储存外,还通过生物溶解聚合形式或生物降解来实现磷的生物循环. 溶磷菌释放的低分子量有机酸通过羟基和羧基螯合与磷酸盐结合的阳离子,增大了可溶性磷含量[46-47]. 然而,磷溶解与释放涉及复杂生物化学过程取决土壤微生物营养、生理及其它环境条件[48].
-
固氮细菌(重氮营养细菌)包括自生固氮菌、共生固氮菌、联合固氮细菌3种,是获得生物可利用氮的重要参与者,能提高土壤肥力[8]. 影响土壤微生氮循环效率的因素有很多,如硝酸盐异化还原成铵是降低系统NO3− 淋溶与流失的重要过程,该过程与降水、温度、pH、土壤全碳和土壤全氮呈正相关关系,其中降水是土壤氮循环的主要驱动因子[49]. 外源氮素的添加能影响土壤有效氮含量进而影响微生物的氮代谢能力,这也是影响土壤微生物活性的一大因素[50]. 土壤碳和pH值对土壤微生物氮循环的影响因生态系统类型而异. 营养碳能加快土壤中的微生物氮循环速率,而pH能促进NO3-N 和 NO2-N周转. 此外,根际环境富集了与有机化合物转化、固氮和反硝化作用相关的微生物,这样的环境严重削弱了硝化作用[51]. 如图1中氮循环可知,除了土壤内部氮周转外,生物固氮对促进系统间氮交流与缓解土壤氮素流失有重要意义. 生物固氮可以催化大气中的氮气还原为生物可利用的铵,能缓解受联合氮源限制的陆地和水生生境的营养压力,有研究发现矿渣肥力的提高可以刺激氮循环[52].
降低土壤氨挥发是农田生态系统中减少土壤氮素损失、提高氮肥利用率的关键途径之一[53]. 提高土壤pH值和透气性、增强土壤有机氮矿化微生物活性促进了土壤氨挥发[54],由此土壤NH4+和NH3吸附的作用机制及土壤硝化作用调控是氨挥发减排的两个主要机制,其受pH、土壤温度、降水等环境因素以及土壤颗粒表面特性控制[55]. 在应对未来气候变化过程中,控制土壤基质有效性和土壤pH等环境因素的交互作用对促进土壤氮素固持具有重要作用.
-
土壤系统中除了重金属污染会导致土壤质量恶化,严重影响土壤功能及其稳定性外,农药、石油烃、微塑料、氟化物等非重金属污染物随着频繁的人类活动变得愈发复杂,能杀死某些特定的微生物群从而破坏土壤生态[56].
常见农药包括有机氯、有机磷、氨基甲酸酯、甲脒、硫氰酸酯、脱硝基酚和抗生素等,其中部分能被土壤原细菌和真菌降解,但受环境基质吸附、农药自身特性以及微生物靶向性等限制,因此具有高环境相容性、靶向性、降解率强的微生物备受关注[57]. 其中抗生素是农业生产中应用最普遍的,植物根部会对抗生素有直接吸附作用,或由植物根系吸收抗生素后向地上组织运输转移,还可通过根系分泌物和土壤微生物组来降解抗生素. 四环素、磺胺甲基嗪、诺氟沙星、红霉素和氯霉素常被作为抗生素类型的代表进行研究. 如嗜热光合菌(Roseiflexus)、贪嗜菌属(Variocorax)、类诺卡氏菌属(Nocardioide)和芽孢杆菌属(Bacillus)都是磺胺类抗生素的潜在降解菌[58].
低水溶性和生物有效性的石油烃易吸附于土壤中[59] ,即使连续氧气注入能加速微生物有氧降解,但自然降解速率不高时对环境和人类健康构成了严重的威胁[60]. 多环芳烃(PAHs)持久存在的主要原因是其具有难降解性、疏水性和生态毒性,长期滞留会扰乱土壤生境,对土壤生物和人类具有很高的潜在风险[61]. 微生物可将PAHs作为唯一碳源和能源,通过产生加氧酶直接破坏PAHs的结构以达到降解目的. 如无色杆菌属(Achromobacter insolitus)、芽孢杆菌属(Bacillus)、解环烃菌属(Cycloclasticus)、黄孢原毛平革菌(Phanaerochaete chrysporium) 和假单胞菌(Pseudomonas) 在PAHs降解中发挥着重要作用[62]. 其中根际微生物通过不同的植物促生长的方式直接或间接帮助寄主植物生长,从而减少根际PAHs的胁迫. 植物还会通过释放不同的根系分泌物,如黄酮类化合物和脂肪酸有助于降解多环芳烃[63].
微塑料(MPs)是一种难降解、持久性强、传播快的新型污染物,可在植物根部被吸收和富集,并从根部迁移到地上部[64]. 土壤中MPs随着时间的推移和微生物资源的变化而增加,从而增加了MPs选择的微生物群落比例. 如放线菌和拟杆菌门在MPs表面生长良好. MPs增加了脱硫杆菌科(Desulfobacteraceae)和脱硫球茎菌科(Desulfobulbaceae)比例,含有的聚酯超细纤维(PES)还会增加盘状真菌菌丝和AMF的丰度.
磷矿的开采与浮选、农肥工业、岩土风化及火山爆发[65]是土壤中氟化物的主要来源,其迁移转化过程受土壤粘土组分、pH、有机质的影响,一般来说迁移性较低[66]. 即使土壤氟的生物有效性较低,但植物根际生态过程会致使氟解吸,并在微生物作用下得到强化,与土壤微生物的溶出-吸收等微观作用是土壤氟迁移与转化研究不可或缺的部分[67]. 氟对植物的影响具有多样性,大多数植物对土壤中的氟具有阻隔作用,但茶树能从土壤中吸收大量的氟并积累在叶片中,适量的氟还能促进茶树生长,同时茶树根际土壤的真菌数量与氟处理量呈正相关关系,而细菌则刚好相反[68].
土壤生态因素与微生物的协同作用是非金属污染物降解的重要过程. 污染物降解过程与土壤的理化特性、微生物活性和氧状态紧密相关. 同时污染物的积累会造成一系列的环境行为,从而改变土壤环境. 如微塑料可以改变土壤理化参数(容重、孔隙度、聚集度、电导率、持水能力和pH值等),进而影响微生物生长代谢[60]. 因此,土壤环境对微生物代谢及微生物对污染物降解有着至关重要的作用.
-
矿山环境恶化源头主要来自于矿山开采、尾矿堆积及工程器械作业活动,长期以来尾矿治理一直是绿色矿山的关键内容. 矿石的尾矿产生量可超60%,部分选矿甚至能达到99%以上. 2013年以来全国新增尾矿累积堆存量已超50亿t,综合利用率却不足36%,并常年处于较低水平[69]. 尾矿中不同价态和形态的As、Hg、Cd等因迁移转化差异显著而污染阻滞困难,并且受尾矿尾砂粒径、pH、含水率等理化性质影响较大. 环境条件变化易释放有毒物质,并且能通过食物链富集而威胁人类健康. 选矿过程中添加的有毒有害化学药剂也是环境污染的潜在来源[70-71].
各尾矿因其具有不同的理化特性也被广泛利用,地聚合物技术是最具创新性和适用性的方法之一,添加的粉煤灰和硅粉对于提高产品性能起重要作用,还包括有价成分回收、陶粒生产等利用途径[72]. 尾矿的土壤化利用也是常见的工程技术之一. 多数尾矿富含植物生长所需要的矿物元素而用作土壤改良剂或制备化肥[73],尾矿与有机固废以及重金属稳定剂复配成尾矿基土壤,具有一般土壤蓄水、养分、气的能力,为矿山植物提供更理想的生长环境[74]. 由于尾矿粒径分布、重金属、微生物多样性、pH等的复杂性,尾矿土壤化技术需要低成本与高效率的创新性发展.
-
矿山土壤溶液中重金属及其它有毒物质是微生物所接触的不良指标,其中有效重金属含量与土壤微生物代谢高度相关. 酸碱度低于6时可能会降低微生物对重金属的极限值,并且会增加大部分重金属的有效浓度[75]. 硫还原和有机酸释放能降低矿山土壤pH值并增加可溶性金属离子,植物根际微生物通过络合、螯合、氧化还原等反应调节植物适应性和改变土壤的理化性质来促进重金属的快速解毒或清除,根际质子(H+)和酶有助于重金属的迁移与转化[76].
矿山土壤具有较低的活性,相比一般土壤而言,其进行更多的厌氧反应. 随着矿山土壤有机质的消耗,其生态功能与结构将持续恶化,微生物及植被恢复成为矿山复垦的必由之路. 根系生物量可以增加胞外酶、铁载体、植物激素等含量,稳定尾砂和提高保水能力,同时降低重金属对植物健康的不利影响[77-78]. 腐殖酸和沸石的联合作用可减轻重金属对土壤酶活性的影响[79],其他诸多特定菌剂也可用来固定重金属. 农杆菌能快速氧化植物根部砷(Ⅲ)和锑(Ⅲ),在根际土壤中螯合铁/锰氢氧化物/羟基氧化物沉淀降低生物有效性[80]. 矿山土壤生态恢复除了对重金属和酸碱变化表现出耐受能力外,有关固氮解磷和碳循环微生物的增加在促进生态重构方面功不可没. 尾矿废弃地中常见的固氮微生物有变形菌、古细菌和蓝藻等[81],其中变形菌对矿山环境表现出快速的生长和适应能力,并且对缺碳的胁迫具有强大的反应能力,在矿山早期微生物群落恢复和提高土壤活性方面起重要作用.
-
电迁移、电泳和电化学氧化诱导等电动处理方法是去除高粘低渗透土壤中Ni、Zn、Cr、Cd等无机污染物的主要手段[82]. 但电动处理过程中土壤pH、含水量、温度等环境因子的变化会引起微生物群落结构、丰度、多样性或活性改变,对土壤生态有较大影响[83]. 土壤孔隙水电解产生的H+和OH-会改变两极土壤pH,引起微生物群落结构以及数量和丰度降低,减轻营养循环及重金属作用过程[84]. 处理过程中电极两端离子不断聚集可能导致土壤渗透势增加,造成细胞失水,减少微生物数量和降低代谢能力.
不同的电场强度会引起不同的电流效应,对微生物群落变化及其代谢水平的影响不同,弱电场(1 V·cm−1)可激活脱氢酶活性,适当的电场强度(2 V·cm−1)有利于微生物的生长代谢,但较高的电场强度(3 V·cm−1)会让土壤温度过高而对微生物活性和代谢产生负面影响[83,85-86]. 电动处理后土壤中营养物质的消耗和污染物浓度的变化改变了微生物代谢状态[87].
-
磁场可通过影响水-土界面行为来影响土壤微生物群落演替及物质循环过程,主要机制是促进水的电离和改变带电粒子的作用轨迹来影响溶液的物理化学性质,并与磁性矿物Fe3SO4关系密切[88]. 磁场还可以通过跨膜运输、基因表达和细胞酶活性等多种机制影响微生物的生长代谢如引起跨膜蛋白和可溶性蛋白构象的改变而产生显著的生物学效应[89-90]. 磁处理对废水中微生物的生长和降解能力具有明显影响,强度8.1 mT时能提高好氨氧化细菌的活性以缩短硝化时间[91-93],并且磁处理能影响特定条件下微生物的活性,富集具有特殊耐性的微生物菌群[94]. 低强度磁场能增强微生物活性促进土壤的呼吸作用,高强度的磁场甚至会对过氧化物酶和脲酶活性产生抑制作用. 磁场对微生物的影响还取决于磁场类型、细菌种类和操作条件[95-96]. 土壤磁处理后改变了细菌数量和群落结构. 该处理减少了氨化细菌的数量,但增加了与硝化反应及磷循环相关的细菌数量,并且对有机磷细菌有显著影响. 磁场还可以通过影响土壤的渗透性、膨胀性和团聚性等性质使微生物生存的微生态环境发生变化,从而影响其活性[97].
-
紫外线照射对环境是致命的,它引起的氧化损伤导致了大多数细胞类型中重要的生物分子(包括蛋白质)的损伤. 然而,有些细菌能在极端照射下生存,包括从航天器组件中分离出来的芽孢杆菌及西藏膜杆菌、嗜麦芽窄食单胞菌和葡萄球菌等耐紫外细菌[98]. 研究发现微生物在极端紫外线照射下的生存能力与它们的基因组稳定性有关,并且也在其它耐紫外线细菌中发现了紫外线防御过程[99]. 在地球自然环境中,耐紫外线辐射微生物的多样性及其代谢机制研究,可增强土壤环境功能性微生物的耐受性且将持久发挥作用[100].
-
随着土地利用模式及环境的变化,微生物研究成为解决土壤可持续利用和提高社会生产效率的重要途径. 微生物作为土壤生态系统中物质循环和能量流动的主要驱动者,在碳、氮、磷等物质分解和养分循环以及结构稳定等方面发挥着重要作用,但极易受pH、营养条件、重金属等土壤因子的影响. 再者,土壤系统中农药、石油烃、多环芳烃等非金属污染物具有难降解、毒性强和持久性强的特点,可通过生物降解的方法,分离驯化高效降解菌,从而改善土壤结构,防止生态破坏. 通过土壤环境的外场作用机制分析,表明电、磁、紫外等外场控制将有助于微生物群落与功能向可控方向演变,土壤生化过程调控有望加快退化土壤生态结构与功能重塑过程.
针对土壤微生物代谢模式的特点,未来还需要进行更深入的研究.
(1)污染与退化土壤的微生物修复或治理过程除了关注特异性降解菌株研究外,微生物与其生境的协同作用将对土壤长效自净功能保持起着关键性作用. 土壤作为一个整体的、动态的生命系统,其结构与营养条件是维持系统内物理迁移和化学转化过程有序进行的重要基础.
(2)提高各类污染物的生物可利用性,针对不同污染物特性,考虑土壤环境因素,有效结合其他技术,如添加辅助剂,以促进微生物在污染物胁迫条件下代谢,或提高微生物对某一污染物的降解速率.
(3)建立土壤健康评估体系,关注和研究微生物群落的定向代谢以及与植物根际的协同作用将极大地推动土壤高质量发展.
土壤微生物代谢模式及其环境影响研究进展
Developments in the research of soil microbial metabolic patterns and their environmental impacts
-
摘要: 随着土壤利用模式变化及矿产资源不断开发,土壤微生物活性降低及矿山土壤生态恶化已成为阻碍社会生产效率提高的主要因素之一.由于国家和社会逐渐重视土地高质量发展及微生物生态修复工程,本文综述了土壤微生物对碳、磷、氮和其它非金属污染物的代谢模式,并且基于土壤生态系统特性,讨论了微生物驱动的物质循环影响因素(pH、营养条件、重金属等土壤因子).阐述了微生物多样性和根际环境的形成在矿山生态环境修复初期所起的重要作用,并通过土壤环境的外场作用机制分析,揭露了电、磁、紫外等外场的控制将有助于微生物群落及其功能的可控方向演变,对土壤污染物阻控和理化特性改善并推动实现退化土壤生态结构与功能的重塑具有重要意义.Abstract: With the change of soil utilization patterns and the continuous exploitation of mineral resources, the decrease of soil microbial activity and the ecological deterioration of mineral soils have become one of the main factors that hinder the improvement of social productivity.As the country and society are gradually paying attention to high-quality land development and microbial ecological remediation projects, this paper reviews the metabolic patterns of carbon, phosphorus, nitrogen and other non-metallic pollutants by soil microorganisms, and discusses the microbially driven material cycling factors (pH, nutrient conditions, heavy metals and other soil factors) based on soil ecosystem characteristics.The importance of microbial diversity and the formation of the inter-root environment in the initial phase of mine ecosystem restoration is described, and through the analysis of the external field action mechanism of soil environment, revealing that the control of external fields such as electric, magnetic and ultraviolet will contribute to the controlled evolution of microbial communities and their functions, which is significant for the control of soil contaminants and improvement of physicochemical properties as well as promoting the remodeling of ecological structure and function of degraded soils.
-
Key words:
- Soil microorganisms /
- Nutrient metabolism /
- Non-metallic pollutant /
- Heavy metal /
- Outfield regulation.
-
浮游植物是生活在河流、湖泊、海洋等水体中的一类营光合作用的微型生物,含原核生物(蓝藻)和各种真核生物. 浮游植物群落结构受各种环境因素和污染物的影响,当水体中的氮、磷、硅等营养物质过量时,浮游植物会暴发性增殖形成赤潮(也称藻华)[1]. 赤潮暴发可对渔业、海洋资源、水产养殖、公共健康等造成直接或间接的危害[2]. 赤潮暴发期会造成养殖水体光照、二氧化碳等严重不足,从而破坏水体生态系统. 赤潮消亡时由于微生物分解作用也会造成水体缺氧而引发水生生物的死亡. 同时,一些赤潮种,如亚历山大藻(Alexandrium spp.)可产生毒素并通过食物链在水生生物体内富集或引起鱼类死亡[3].
裸甲藻类是我国近海常见的一类赤潮生物,其中链状裸甲藻(Gymnodinium catenatum)已经在澳大利亚、墨西哥、日本等23个国家引发赤潮[3–4]. 链状裸甲藻可产生麻痹性贝类毒素,2017年我国福建省沿海海域发生了由该藻引起的数十人中毒事件[5]. 伊姆裸甲藻(Gymnodinium impudicum)是裸甲藻属(Gymnodinium)下的另一常见赤潮肇事种,已在埃及、韩国、西班牙等多地暴发赤潮[6–8]. 该种与链状裸甲藻形态极为相近,常发生两种藻鉴定混淆的情况,如发生在帕加西蒂科斯湾(Pagassitikos Gulf)的链状裸甲藻赤潮后经鉴定肇事藻应为伊姆裸甲藻[8],因此推测伊姆裸甲藻赤潮的暴发频数可能因错误鉴定而被低估.
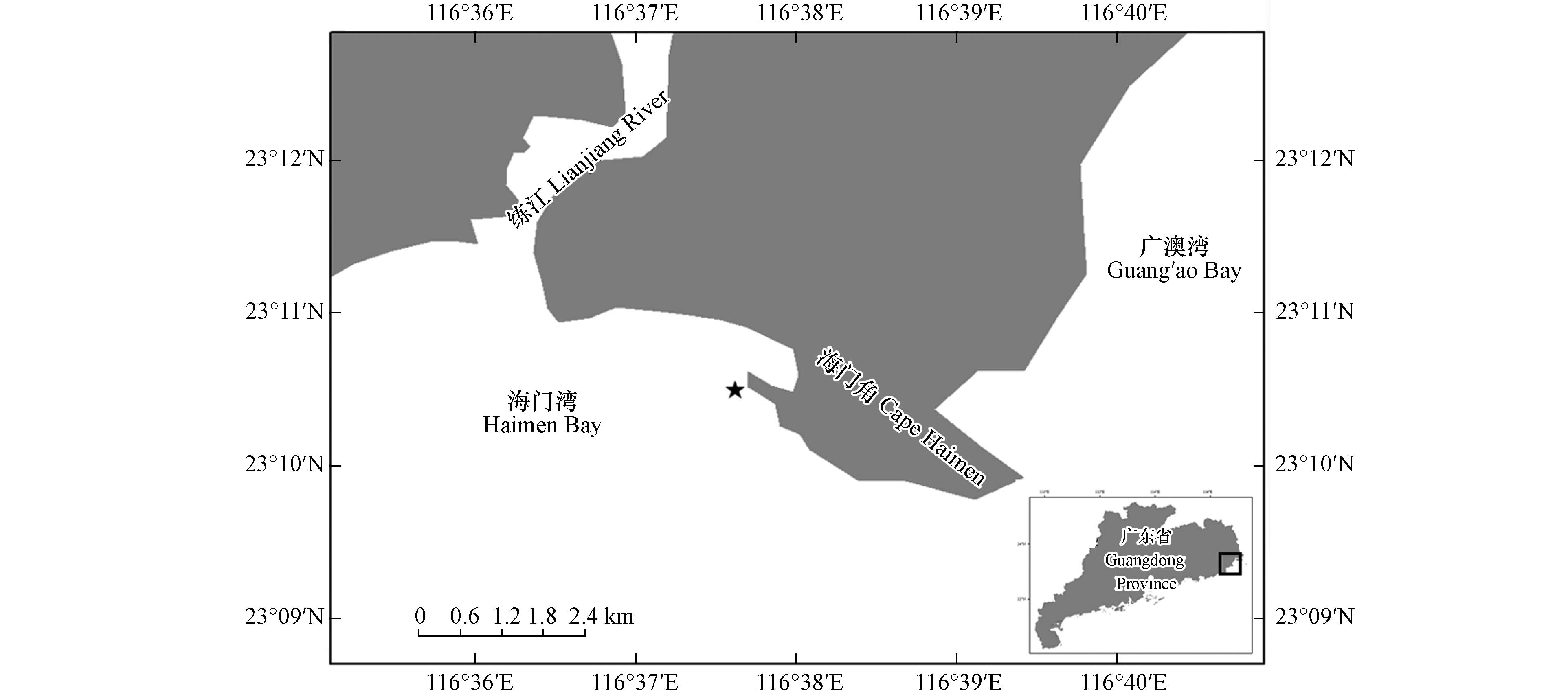
广东省海门湾位于练江流域入海口. 根据2020至2022年海门湾闸桥断面监测站点每月入海河流监测信息显示,该区域过去3年水质污染严重[9] . 2021年8月,广东省海门湾暴发了一起裸甲藻类赤潮,本文对此次赤潮进行了采样,对肇事种进行形态学鉴定与系统发育学分析,并探究了赤潮种的温度适应性、溶血活性和急性生物毒性,以期为我国近海有毒有害赤潮的监测与研究提供参考.
1. 材料与方法(Materials and methods)
1.1 样品采集
于2021年8月26日于赤潮暴发区采集海水样品(图1),使用采水器采集现场表层水样,混匀后装入1 L广口塑料瓶,保存现场活体水样和固定样品各一份. 固定样品使用Lugol’s液固定,于实验室内在显微镜下进行藻类鉴定和计数藻密度. 活体水样带回实验进行藻类分离培养及急性生物毒性研究. 使用多参数水质分析仪(YSI-professional,USA)测定采样站位(23°10′30′′N,116°37′39′′E)的现场水温、盐度、溶解氧、pH等环境因子.
1.2 赤潮藻种分离与培养
使用玻璃毛细管对赤潮肇事种进行分离,单细胞以L1培养基培养于96孔板中,培养温度为(20±1) ℃,光照强度为120 μmol·m−2·s−1,光暗周期12 h:12 h. 藻细胞生长15 d后将其转移培养在含50 mL L1培养基的玻璃试管中生长.
1.3 赤潮藻种形态鉴定
使用研究型荧光显微镜(Olympus BX61,Japan)对本次赤潮肇事种进行观察,用Image-pro Plus6.0进行图像采集,并随机挑选50个细胞测量大小. 吸取1 mL藻液加入SYBR® Safe DNA Gel Stain染料(Invitrogen,S33102)对藻细胞核染色10 min,在荧光显微镜下观察细胞核形态与位置. 使用戊二醛(终浓度为2.5%)对肇事种样品进行固定,4 °C下静置12 h,随后用不同浓度(10%、30%、50%、70%、90%、100%)酒精进行梯度脱水,使用二氧化碳超临界点干燥仪(CPD300,Leica,Wetzler,Germany)对样品进行干燥处理,使用电子溅射仪(Leica EM SCD 500,Leica,Wetzler,Germany)对干燥后的样品进行喷金处理,最后在扫描电子显微镜(Carl Zeiss Inc,Oberkochen,Germany)下观察藻细胞的电子显微结构.
1.4 DNA扩增与系统发育分析
DNA提取与扩增:取赤潮藻纯培养液50 mL,按照HP Plant DNA Kit提取试剂盒(Omega Bio-tek Inc,USA)提供的实验流程提取纯培养藻细胞DNA. 以藻细胞DNA为模板,以D1R(5'-ACCCGCTGAATTTAAGCATA-3'),D3B(5′-GCATCGCCAGTTCTGCTTACC-3′)为引物[10]对其LSU rDNA基因进行扩增. 使用ITSA (5′-CAAGCTTCTAGATCGTAACAAGGHTCCGTAGGT-3'),ITSB (5′-CTGCAGTCGACAKATGCTTAARTTCAGCRGG-3′)[11]引物对其ITS rDNA序列进行扩增. PCR反应程序:94 ℃预变性30 s,98 ℃变性10 s,56 ℃退火30 s,共34个循环;最后72 ℃延伸2 min. PCR扩增产物送往生工生物工程有限公司(上海)进行测序. 所得到的LSU rDNA和ITS序列提交至GenBank (https://www.ncbi.nlm.nih.gov/genbank/). PCR扩增获得的伊姆裸甲藻LSU rDNA(D1–D3区)和ITS rDNA片段长度分别为930 bp (Genbank收录号:OP278931)、549 bp (Genbank收录号:ON795173).
系统发育分析:将所获得的LSU rDNA和ITS rDNA序列在GenBank数据库进行BLAST同源性检测,下载近缘序列,通过MEGA6软件采用最大似然法(Maximum likelihood,ML)构建系统发育树,使用MrBayes3.2.6软件构建贝叶斯树(Bayesian inference,BI). ML分析时进行1000次随机重复取样,并通过自展分析检验分支置信度.
1.5 急性生物毒性实验
赤潮水样对海洋青鳉鱼的急性生物毒性实验:用2.5 L的白色塑料桶采集1.5 L的现场赤潮水样(藻细胞密度为3.39×103 cells·mL−1),向其中放入15尾健康、运动力强、大小一致(约30日龄)的海洋青鳉鱼幼鱼对其进行观察,于0 h、6 h、12 h、24 h、48 h记录幼鱼死亡数. 本实验每组设置3个平行,以无藻细胞的过滤海水为空白对照组.
赤潮肇事藻细胞对卤虫的急性生物毒性实验:在6孔细胞培养板中加入10 mL实验室纯培养的赤潮藻藻液(藻细胞密度为4.32×103 cells·mL−1),取20尾健康、运动力强、大小一致的卤虫加入到各孔对其进行观察,于0 h、6 h、12 h、24 h、48 h记录卤虫死亡数量,以卤虫在碰触10 s内附肢无明显摆动判定为死亡标准. 本实验每组设置3个平行,以无藻细胞的L1培养基为空白对照组.
1.6 溶血活性测定
赤潮肇事种纯培养细胞溶血毒素的提取方法参照Eschbach等[12],溶血活性测定方法参照周成旭等[13]并加以改进. 取50 mL的赤潮肇事种纯培养液(藻细胞密度为3.66×103 cells·mL−1) 5000 r·min−1离心10 min,弃上清后加入2 mL的溶血毒素缓冲液进行超声破碎,得到溶血毒素提取液. 取1 mL的EDTA抗凝兔血加入兔血缓冲液洗涤兔血2次,并配制为0.6%的兔血红细胞溶液备用. 随后取溶血毒素缓冲液、兔血缓冲液、0.6%兔血红细胞溶液、溶血毒素提取液各150 μL,按照反应体系配制在光照强度为100 μmol·m−2·s−1的环境中反应5 h,3000 r·min−1离心10 min,取上清液在414 nm波长下测得吸光值. 将所得吸光值代入溶血百分数计算公式得到赤潮肇事种的溶血活性百分数.
stringUtils.convertMath(!{formula.content}) (1) 其中,As为溶血毒素提取液加兔血红细胞溶液反应后的吸光值;Ab为溶血毒素提取液加兔血缓冲液反应后的吸光值;Aa为毒素缓冲液加兔血红细胞溶液反应后的吸光值;Ac为TritonX·100加兔血红细胞溶液反应后的吸光值.
每个实验组设置3个平行,以无溶血活性[13]的钝头原甲藻(Prorocentrum obtusidens,曾命名为东海原甲藻) (藻细胞浓度为4.89×103 cells·mL−1)为阴性对照组,以灭菌的天然海水为空白对照组.
1.7 温度适应性实验
将于温度20 ℃、盐度27条件下保种的赤潮肇事种进行扩大培养至1 L. 随后将藻细胞转接培养于4个500 mL锥形瓶中,分别置于20℃、25℃、30℃、33℃ 等温度的光照培养箱培养2代(培养箱光照周期14 h:10 h,光照强度(100—120) μmol·m−2·s−1). 随后将4个温度下藻细胞再次转接,使得藻液初始密度为5.00×102 cells·mL−1,将其置于4个温度下观察藻细胞对温度的适应性. 每隔2天取混匀藻液0.5 mL于正置显微镜(Olympus CX31,Japan)下,使用浮游植物计数框进行计数,每次计数0.1 mL,每个样品计数3次,根据所得密度计算伊姆裸甲藻不同温度下的比生长速率(specific growth rate,μ). 同时,取混匀藻液1 mL,黑暗处理15 min,使用浮游植物荧光仪(PHYTO−ED,Germany)测定不同温度组不同时间藻细胞的最大光化学效率(Fv/Fm).
stringUtils.convertMath(!{formula.content}) (2) 其中,Nt和N0分别为培养第t天和刚接种时的藻细胞密度[14].
1.8 数据分析
使用Origin2018、ArcMap10.7软件绘图,实验数据采用IBM SPSS Statistics22软件进行统计学分析,组间差异比较采用单因素方差分析(one-way ANOVA),多重比较检验采用Fisher’s least significant difference(LSD)法,当P < 0.05时为差异显著.
2. 结果与讨论(Results and discussion)
2.1 赤潮发生概况与肇事种鉴定
本次赤潮于2021年8月24日—8月29日期间暴发于我国广东省海门湾(23°10′30′′N,116°37′39′′E),现场藻细胞密度为3.39×103 cells·mL−1,已达到赤潮标准密度(赤潮生物细胞大小在10—29 μm范围内,密度超过1×103 cells·mL−1可定义为赤潮[15]). 其中,主优势种密度为2.75×103 cells·mL−1. 赤潮发生时,海域水温为26.1 ℃,盐度32.77,溶解氧为5.84 mg·L−1,pH为8.27. 本次赤潮面积为7.8 km2,赤潮期间未出现海洋生物异常死亡或人员中毒事件[16].
对赤潮优势种形态学鉴定结果表明,该种细胞长14.2—26.1 μm,平均为(20.5±2.9)μm (n=50),宽13.2—23.6 μm,平均为(18.6±2.4) μm (n=50),常见形态为2或4个细胞组成的链状结构,偶有8细胞链状结构或单细胞形态(图 2a—c). 链状群体顶端细胞上壳部呈半圆球状,下壳部扁平,链中细胞上壳部和下壳部的顶端扁平(图2c). 细胞核圆形,位于细胞中央(图 2d). 叶绿体数量多,位于细胞的外周部(图 2e). 细胞间通过细胞顶端的连接孔彼此相连成链状(图2h). 细胞的横沟始末位移约为2倍横沟宽度,横沟截距为细胞全长的1/3—1/4. 纵沟狭窄,且入侵到上壳顶部. 细胞顶沟呈“鱼钩”状(图2g). 光学显微镜下,该种具有清晰可见的红色眼点(图2a). 细胞呈快速直线游动或静止不游动两种状态,扩大培养期间发现水体中有粘液产生. 该种细胞形态(包含细胞链长、顶沟结构)、游动状态和粘液分泌等特征符合文献[8]对伊姆裸甲藻的描述.
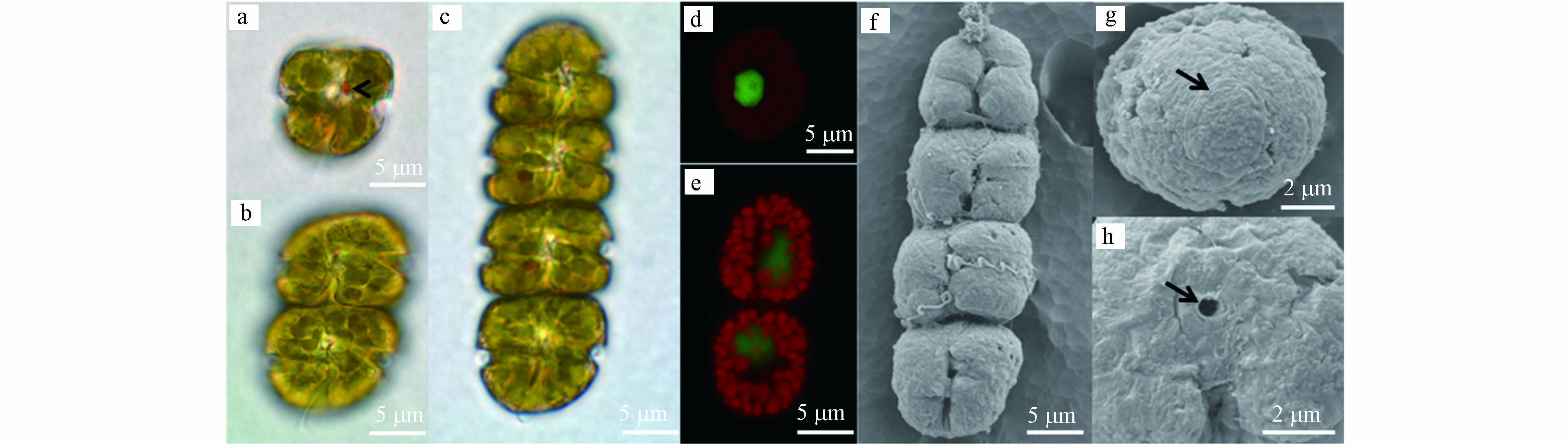 图 2 分离于海门湾的伊姆裸甲藻形态特征Figure 2. Morphology of Gymnodinium impudicum isolated from Haimen Bay(a–c光镜图,d–e核染色图,f–h扫描电镜图. a,单个细胞,箭头示红色眼点;b,2个细胞组成的链状结构;c,4个细胞组成的链状结构;d,细胞荧光染色图,重点显示细胞核(绿色);e,细胞荧光染色图,重点显示叶绿体(红色);f,4个细胞组成的链状结构;g,顶沟细节(箭头);h,细胞间的连接孔(箭头))(a–c: light microscopy photographs, d–e: fluorescence light microscopy photographs, f–h: scanning electron microscopy photographs; a, a single cell with an eyespot (arrow head); b, a chain composed of two cells; c, a chain composed of four cells; d, fluorescence light microscopy, showing the position of nucleus (in green); e, fluorescence light microscopy, showing the chloroplasts (in red); f, a chain composed of four cells; g, detail of the apical groove (arrow); h, the pore connecting cells (arrow))
图 2 分离于海门湾的伊姆裸甲藻形态特征Figure 2. Morphology of Gymnodinium impudicum isolated from Haimen Bay(a–c光镜图,d–e核染色图,f–h扫描电镜图. a,单个细胞,箭头示红色眼点;b,2个细胞组成的链状结构;c,4个细胞组成的链状结构;d,细胞荧光染色图,重点显示细胞核(绿色);e,细胞荧光染色图,重点显示叶绿体(红色);f,4个细胞组成的链状结构;g,顶沟细节(箭头);h,细胞间的连接孔(箭头))(a–c: light microscopy photographs, d–e: fluorescence light microscopy photographs, f–h: scanning electron microscopy photographs; a, a single cell with an eyespot (arrow head); b, a chain composed of two cells; c, a chain composed of four cells; d, fluorescence light microscopy, showing the position of nucleus (in green); e, fluorescence light microscopy, showing the chloroplasts (in red); f, a chain composed of four cells; g, detail of the apical groove (arrow); h, the pore connecting cells (arrow))对PCR扩增的LSU rDNA和ITS rDNA产物进行测序,于GenBank中比对并下载其近缘序列37条和33条,以甲藻纲(Dinophycene)的链状亚历山大藻(Alexandrium catenella)和定鞭藻纲(Aptophyceae)的球形棕囊藻(Phaeocystis globosa)为外类群构建系统发育树. ML树与BI树形基本一致,系统发育树显示:本研究分离的伊姆裸甲藻与法国、西班牙、墨西哥等多个国家沿海海域的伊姆裸甲藻聚在一个分支中,置信值为100/1.00. 本株系与分离自我国渤海海域的伊姆裸甲藻(Genbank收录号:MH732685、MH732677)序列一致,位于同一分支,置信值为100/1.00(图3,图4).
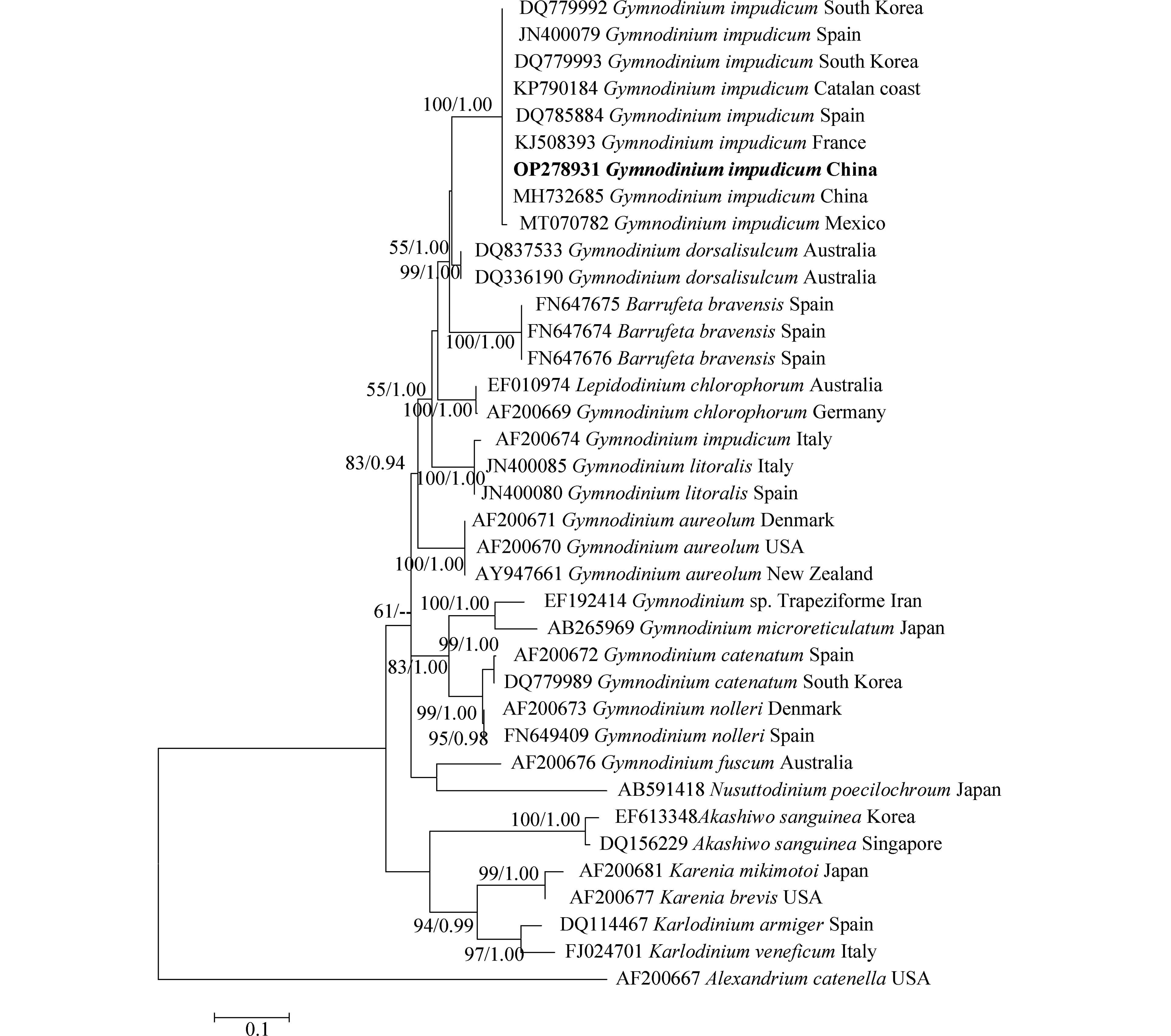 图 3 基于LSU rDNA(D1–D3)序列构建的裸甲藻属系统发育树.Figure 3. Phylogenetic tree of Gymnodinium species based on LSU rDNA (D1–D3) sequences.数字分别表示来自最大似然(左)和贝叶斯(右)分析的Bootstrap值( > 50%)和后验概率值( > 0.8). 本文获得的序列以粗体表示Numbers indicate the bootstrap values ( > 50%) and posterior probabilities ( > 0.8) inferred from Maximum-likelihood (left) and Bayesian (right). Sequence obtained in the present study was marked in bold.
图 3 基于LSU rDNA(D1–D3)序列构建的裸甲藻属系统发育树.Figure 3. Phylogenetic tree of Gymnodinium species based on LSU rDNA (D1–D3) sequences.数字分别表示来自最大似然(左)和贝叶斯(右)分析的Bootstrap值( > 50%)和后验概率值( > 0.8). 本文获得的序列以粗体表示Numbers indicate the bootstrap values ( > 50%) and posterior probabilities ( > 0.8) inferred from Maximum-likelihood (left) and Bayesian (right). Sequence obtained in the present study was marked in bold.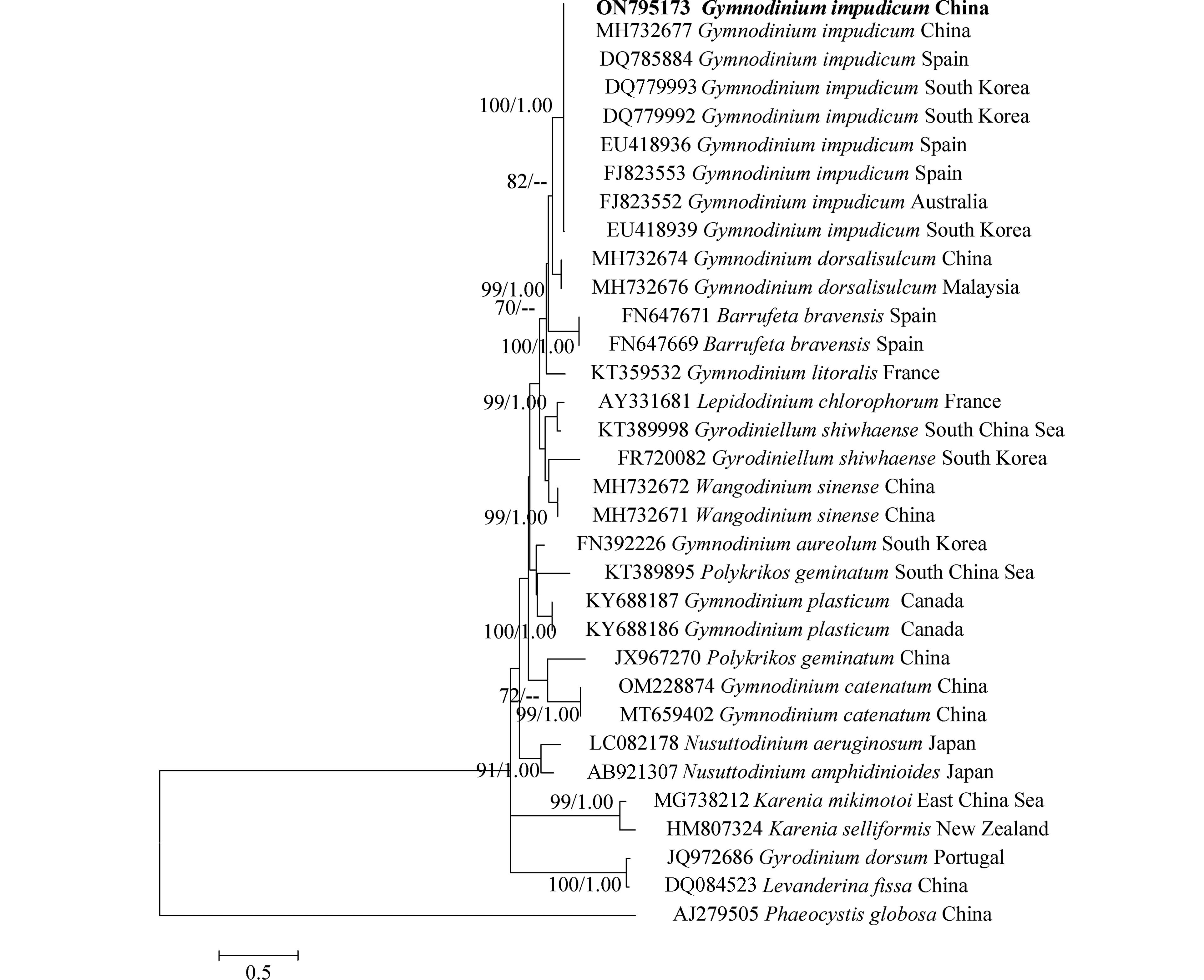 图 4 基于ITS序列构建的裸甲藻属系统发育树.Figure 4. Phylogenetic tree of Gymnodinium species based on ITS sequences.数字分别表示来自最大似然(左)和贝叶斯(右)分析的Bootstap值( > 50%)和后验概率值( > 0.8). 本研究获得的序列以粗体表示Numbers indicate the bootstrap values ( > 50%) and posterior probabilities ( > 0.8) inferred from Maximum-likelihood (left) and Bayesian (right). Sequence obtained in the present study was marked in bold.
图 4 基于ITS序列构建的裸甲藻属系统发育树.Figure 4. Phylogenetic tree of Gymnodinium species based on ITS sequences.数字分别表示来自最大似然(左)和贝叶斯(右)分析的Bootstap值( > 50%)和后验概率值( > 0.8). 本研究获得的序列以粗体表示Numbers indicate the bootstrap values ( > 50%) and posterior probabilities ( > 0.8) inferred from Maximum-likelihood (left) and Bayesian (right). Sequence obtained in the present study was marked in bold.综上,经形态学和分子特征序列分析,本次赤潮优势种为伊姆裸甲藻. 伊姆裸甲藻隶属于甲藻纲(Dinophycene),裸甲藻目(Gymnodiniales),裸甲藻科(Gymnodiniaceae),裸甲藻属(Gymnodinium). 该藻分布广泛,在澳大利亚、韩国、葡萄牙、西班牙、新西兰、意大利等全球多个国家沿海海域都有报道[17]. 伊姆裸甲藻是加泰罗尼亚海岸(Catalonia)夏季浮游植物主要优势种之一,在巴塞罗那港口(Barcelona harbor)频繁暴发赤潮[18]. 自1980s以来,韩国沿海水域每年9、10月都会暴发以伊姆裸甲藻为主要优势种的赤潮[6]. 伊姆裸甲藻在我国渤海海域也有发现[19],但南海海域并无该种暴发赤潮的有关记录. 此次报道为伊姆裸甲藻首次在我国南海海域暴发赤潮。
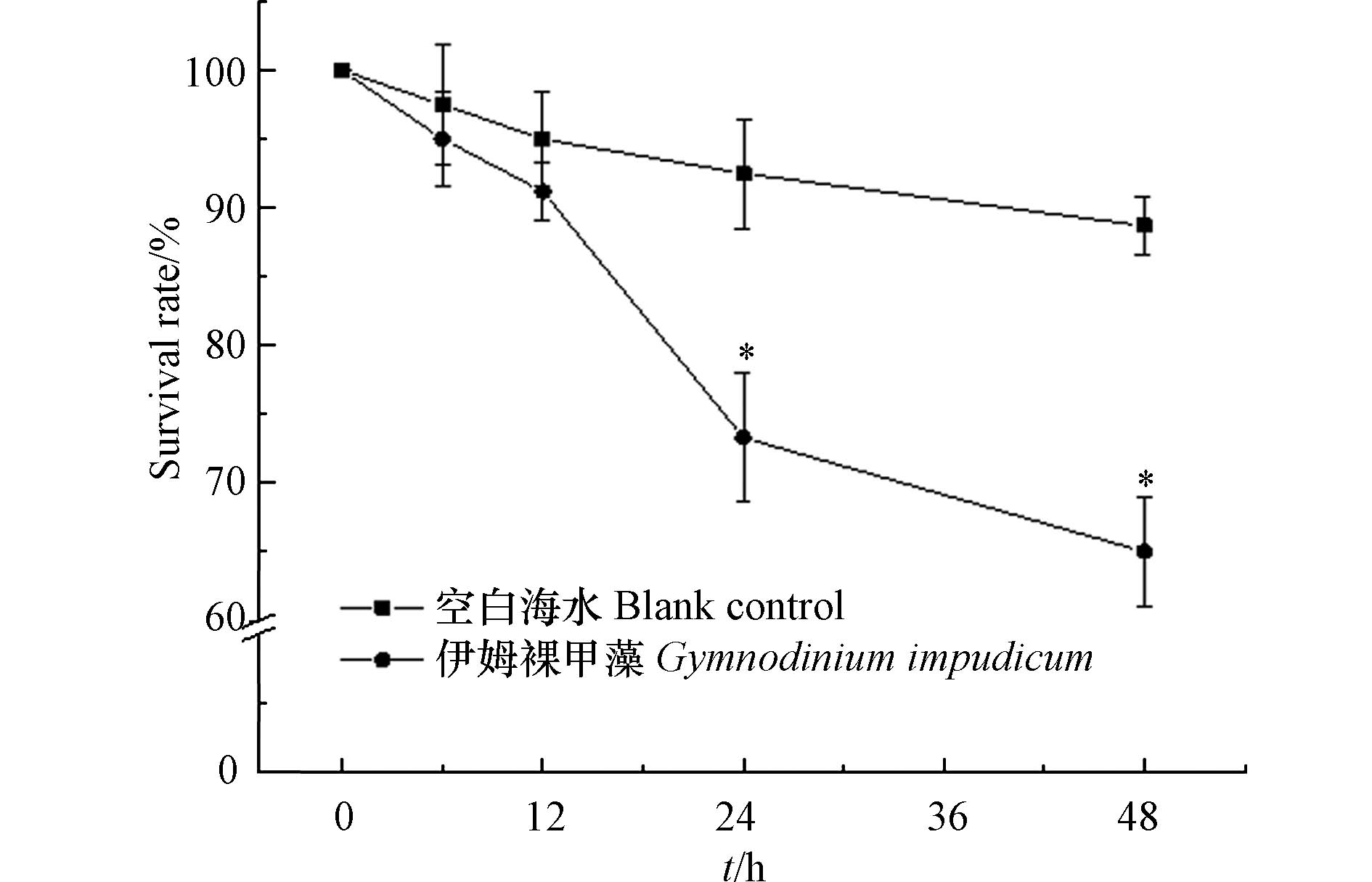
2.2 伊姆裸甲藻的急性生物毒性
伊姆裸甲藻纯培养藻液对卤虫持续48 h暴露结果显示,该藻纯培养藻液对卤虫具有毒性(藻密度为4.32×103 cells·mL−1),随着暴露时间的延长,实验组卤虫的死亡率升高:24 h时实验组卤虫存活率为73.33%±4.7%,显著低于空白对照组(92.5%±4%) (P < 0.05);48 h时,实验组卤虫存活率降低为65%±4%,显著低于空白组(88.7%±2.1%) (P < 0.05) (图5). Farga等[8]对伊姆裸甲藻纯培养藻细胞的毒性进行研究,结果表明伊姆裸甲藻对小鼠无毒害,高效液相色谱(HPLC)未检测到PSP的存在. 本文对置于伊姆裸甲藻纯培养藻液的卤虫观察发现,部分卤虫被藻细胞分泌的粘液所黏附且无法挣脱,逐渐失去自由运动能力进而死亡(图6). 推测伊姆裸甲藻可能通过分泌某种粘性物质导致海洋生物的死亡,伊姆裸甲藻赤潮暴发对养殖渔业的潜在危害不容忽视. 现场赤潮水样对海洋青鳉鱼幼鱼的急性生物毒性实验显示,海洋青鳉鱼48 h内未出现死亡现象,幼鱼游泳行为正常,表明本次赤潮水样对海洋青鳉鱼无致死效应. 有研究表明伊姆裸甲藻在增殖过程中会产生一种胞外粘性多糖,该物质可能会覆盖在鱼腮表面导致鱼类窒息死亡[20].
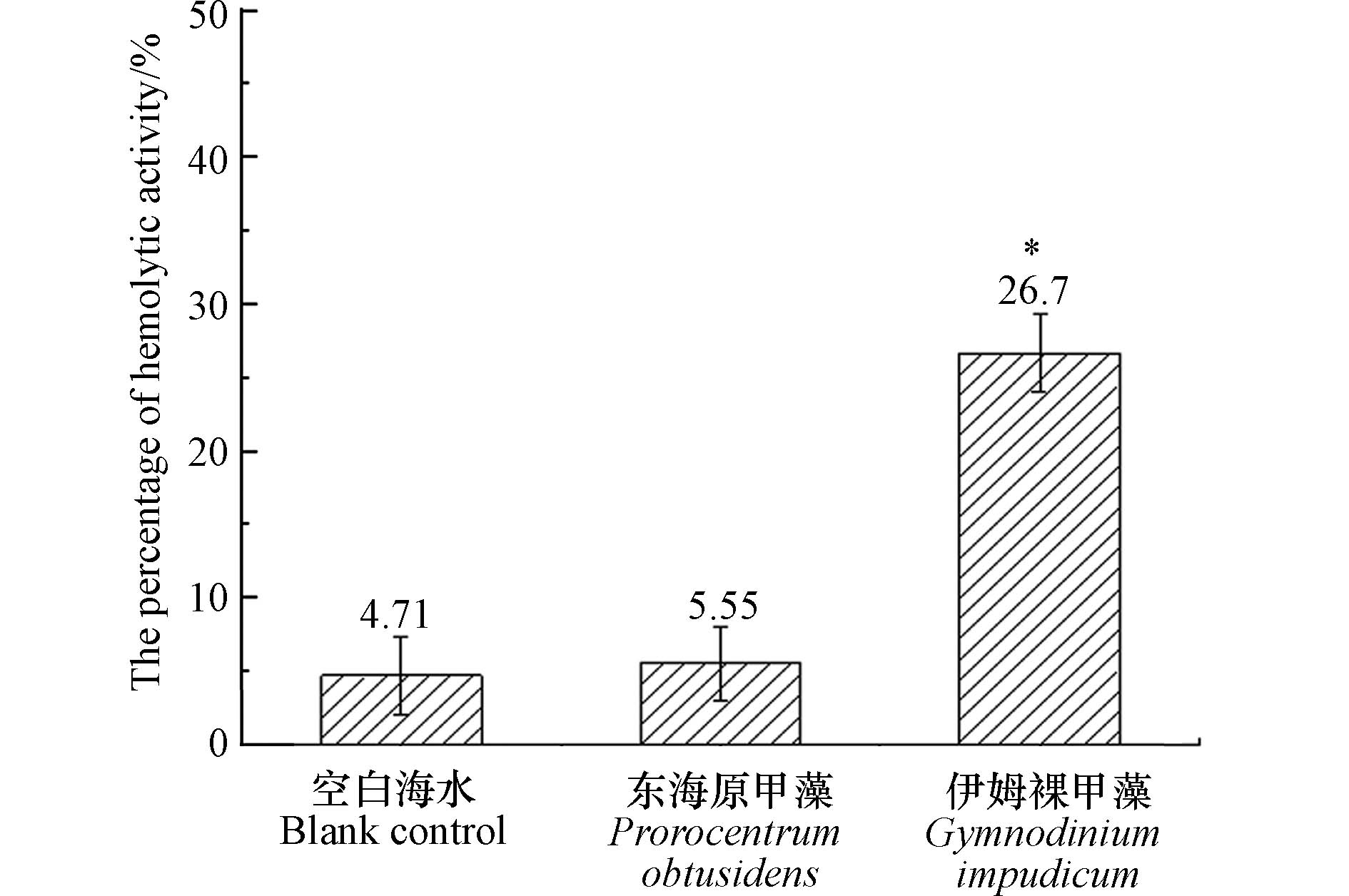
2.3 伊姆裸甲藻的溶血活性
溶血毒素是海洋微藻产生的一类次生代谢产物,可以使血红细胞破损,从而造成鱼类死亡. 目前发现剧毒卡尔藻(Karlodinium veneficum),米氏凯伦藻(Karenia mikmootoi),鞍形凯伦藻(Karenia selliformis)等多种甲藻均具有溶血活性或溶解血红细胞的能力[21]. 以本次分离的伊姆裸甲藻纯培养藻液进行兔血细胞溶血实验,伊姆裸甲藻溶血活性百分数为26.7%±2.6%,显著高于空白对照组(4.71%±2.62%)和阴性对照组(5.55%±2.51%) (P < 0.05)(图7),显示伊姆裸甲藻具有溶血活性. 这一结果也表明伊姆裸甲藻具有潜在毒性效应,伊姆裸甲藻溶血毒素的具体成分仍有待进一步研究.
2.4 伊姆裸甲藻的温度适应幅
对培养于20 ℃、25 ℃、30 ℃、33 ℃下的伊姆裸甲藻进行为期48天的连续计数,结果表明该藻在此4个温度下均可存活(图8). 其中,20 ℃、25 ℃、30 ℃实验组分别在第36、32和46天到达浓度最高值,依次为(2.54±0.05)×104 cells·mL−1、(2.35±0.02)×104 cells·mL−1和(2.46±0.05)×104 cells·mL−1. 藻细胞最大比生长速率(μmax)出现在25 ℃ (0.371、第2天),其次是30 ℃ (0.360、第4天)、20 ℃ (0.228、第4天)、33 ℃ (0.202、第6天). 值得注意的是,33 ℃实验组藻细胞以5.00×102 cells·mL−1的起始密度缓慢生长至第14天达到密度峰值(3.30±3.08)×103 cells·mL−1,随后藻细胞密度开始降低,至实验结束藻细胞浓度长期维持在(1.40—6.85)×102 cells·mL−1,说明伊姆裸甲藻可以耐受33 ℃的环境,但在此温度下细胞不能大量增殖.
对4个温度下伊姆裸甲藻的最大光化学效率(Fv/Fm)测定表明,伊姆裸甲藻在20 ℃、25 ℃、30 ℃可始终保持较高的光化学活性,Fv/Fm变化范围分别为0.44—0.64、0.46—0.62、0.42—0.61,最大光化学效率值出现时间分别为第18天、第12天和第14天. 在整个生长期,33 ℃实验组伊姆裸甲藻的Fv/Fm明显低于其它3个温度组,除在第1—16天保持了较高的Fv/Fm (0.44—0.57),此后Fv/Fm迅速下降(0.1—0.29).
伊姆裸甲藻对温度的适应范围广,在22—32.9 °C下都曾暴发过赤潮. 1992年发生在加泰罗尼亚海岸的伊姆裸甲藻赤潮水温为22—24 °C,盐度为37.7,发生在瓦伦西亚(西班牙第三大城市)的伊姆裸甲藻赤潮水温为25—28 ℃[8]. 2015年埃及水域9月份伊姆裸甲藻达到细胞峰值7.12×103 cells·mL−1,此时水温为30.4—32.9 ℃,盐度为28.6—29.3 [7]. 在本文的温度实验中,伊姆裸甲藻在20—33 ℃的条件下都可存活,20—30 ℃的培养条件下细胞密度可增长至赤潮水平,但是33 ℃下藻细胞密度较低. 本次伊姆裸甲藻赤潮区现场水温26.1 °C,盐度为32.77,是符合伊姆裸甲藻生长的温度环境.
3. 结论(Conclusion)
(1)经形态学分析和分子系统发育学分析,2021年8月发生于广东省海门湾的裸甲藻赤潮肇事种为伊姆裸甲藻,这是我国南海海域首次报道该种赤潮.
(2)生物毒性测定结果表明,本次赤潮水样对海洋青鳉鱼无毒害;纯培养的伊姆裸甲藻对兔血具有溶血活性,溶血活性百分数为26.7%;藻密度为4.32×103 cells·mL−1,48小时对卤虫致死率为35%.
(3)伊姆裸甲藻具有较为宽的温度适应幅,25 ℃下比生长速率最高. 20 —30 ℃时,藻细胞可大量繁殖,最高密度达(2.35—2.54)×104 cells·mL−1;33 ℃时,藻细胞无法大量增殖,密度维持在(1.40—6.85)×102 cells·mL−1.
-
[1] FEI X F, CHRISTAKOS G, XIAO R, et al. Improved heavy metal mapping and pollution source apportionment in Shanghai City soils using auxiliary information [J]. Science of the Total Environment, 2019, 661: 168-177. doi: 10.1016/j.scitotenv.2019.01.149 [2] CRAWFORD J W, HARRIS J A, RITZ K, et al. Towards an evolutionary ecology of life in soil [J]. Trends in Ecology & Evolution, 2005, 20(2): 81-87. [3] KHAN K, LU Y L, KHAN H, et al. Heavy metals in agricultural soils and crops and their health risks in Swat District, northern Pakistan [J]. Food and Chemical Toxicology, 2013, 58: 449-458. doi: 10.1016/j.fct.2013.05.014 [4] 郭娟, 崔荣国, 闫卫东, 等. 2019年中国矿产资源形势回顾与展望 [J]. 中国矿业, 2020, 29(1): 1-5. GUO J, CUI R G, YAN W D, et al. Outlook and overview of mineral resources situation of China in 2019 [J]. China Mining Magazine, 2020, 29(1): 1-5(in Chinese).
[5] NICOLÁS C, MARTIN-BERTELSEN T, FLOUDAS D, et al. The soil organic matter decomposition mechanisms in ectomycorrhizal fungi are tuned for liberating soil organic nitrogen [J]. The ISME Journal, 2019, 13(4): 977-988. doi: 10.1038/s41396-018-0331-6 [6] 林耀奔, 叶艳妹, 杨建辉, 等. 土地整治对土壤微生物多样性的影响分析 [J]. 环境科学学报, 2019, 39(8): 2644-2653. LIN Y B, YE Y M, YANG J H, et al. The effect of land consolidation on soil microbial diversity [J]. Acta Scientiae Circumstantiae, 2019, 39(8): 2644-2653(in Chinese).
[7] 吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望 [J]. 植物生态学报, 2014, 38(3): 298-310. doi: 10.3724/SP.J.1258.2014.00027 WU L K, LIN X M, LIN W X. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates [J]. Chinese Journal of Plant Ecology, 2014, 38(3): 298-310(in Chinese). doi: 10.3724/SP.J.1258.2014.00027
[8] ISLAM W, NOMAN A, NAVEED H, et al. Role of environmental factors in shaping the soil microbiome [J]. Environmental Science and Pollution Research, 2020, 27(33): 41225-41247. doi: 10.1007/s11356-020-10471-2 [9] WANG J W, NIU W Q, LI Y, et al. Subsurface drip irrigation enhances soil nitrogen and phosphorus metabolism in tomato root zones and promotes tomato growth [J]. Applied Soil Ecology, 2018, 124: 240-251. doi: 10.1016/j.apsoil.2017.11.014 [10] MARLEAU J N, PELLER T, GUICHARD F, et al. Converting ecological currencies: Energy, material, and information flows [J]. Trends in Ecology & Evolution, 2020, 35(12): 1068-1077. [11] DELEN D. A holistic approach to manufacturing systems modelling [J]. International Journal of Simulation and Process Modelling, 2009, 5(1): 54. doi: 10.1504/IJSPM.2009.025827 [12] KORHONEN J, WIHERSAARI M, SAVOLAINEN I. Industrial ecosystem in the Finnish forest industry: Using the material and energy flow model of a forest ecosystem in a forest industry system [J]. Ecological Economics, 2001, 39(1): 145-161. doi: 10.1016/S0921-8009(01)00204-X [13] ZHANG J. Energy flows in complex ecological systems: A review [J]. Journal of Systems Science and Complexity, 2009, 22(3): 345-359. doi: 10.1007/s11424-009-9169-3 [14] MERINO-MARTÍN L, STOKES A, GWEON H S, et al. Interacting effects of land use type, microbes and plant traits on soil aggregate stability [J]. Soil Biology and Biochemistry, 2021, 154: 108072. doi: 10.1016/j.soilbio.2020.108072 [15] XIE H T, LI J W, ZHANG B, et al. Long-term manure amendments reduced soil aggregate stability via redistribution of the glomalin-related soil protein in macroaggregates [J]. Scientific Reports, 2015, 5: 14687. doi: 10.1038/srep14687 [16] GUPTA V V S R, GERMIDA J J. Soil aggregation: Influence on microbial biomass and implications for biological processes [J]. Soil Biology and Biochemistry, 2015, 80: A3-A9. doi: 10.1016/j.soilbio.2014.09.002 [17] XIAO S S, ZHANG W, YE Y Y, et al. Soil aggregate mediates the impacts of land uses on organic carbon, total nitrogen, and microbial activity in a Karst ecosystem [J]. Scientific Reports, 2017, 7: 41402. doi: 10.1038/srep41402 [18] JING Y L, DING X L, ZHAO X C, et al. Non-additive effects of nitrogen and phosphorus fertilization on microbial biomass and residue distribution in a subtropical plantation [J]. European Journal of Soil Biology, 2022, 108: 103376. doi: 10.1016/j.ejsobi.2021.103376 [19] LALIBERTÉ E, KARDOL P, DIDHAM R K, et al. Soil fertility shapes belowground food webs across a regional climate gradient [J]. Ecology Letters, 2017, 20(10): 1273-1284. doi: 10.1111/ele.12823 [20] MURASE J, HIDA A, OGAWA K, et al. Impact of long-term fertilizer treatment on the microeukaryotic community structure of a rice field soil [J]. Soil Biology and Biochemistry, 2015, 80: 237-243. doi: 10.1016/j.soilbio.2014.10.015 [21] GEISSELER D, LINQUIST B A, LAZICKI P A. Effect of fertilization on soil microorganisms in paddy rice systems - A meta-analysis [J]. Soil Biology and Biochemistry, 2017, 115: 452-460. doi: 10.1016/j.soilbio.2017.09.018 [22] DANG P F, LI C F, LU C, et al. Effect of fertilizer management on the soil bacterial community in agroecosystems across the globe [J]. Agriculture, Ecosystems & Environment, 2022, 326: 107795. [23] YANG F, TIAN J, FANG H J, et al. Functional soil organic matter fractions, microbial community, and enzyme activities in a mollisol under 35 years manure and mineral fertilization [J]. Journal of Soil Science and Plant Nutrition, 2019, 19(2): 430-439. doi: 10.1007/s42729-019-00047-6 [24] VOLTR V, MENŠÍK L, HLISNIKOVSKÝ L, et al. The soil organic matter in connection with soil properties and soil inputs [J]. Agronomy, 2021, 11(4): 779. doi: 10.3390/agronomy11040779 [25] EVANGELOU V P, PHILLIPS R E. Cation exchange in soils[M]//SSSA Book Series. Madison, WI, USA: Soil Science Society of America, 2018: 343-410. [26] LAVALLEE J M, SOONG J L, COTRUFO M F. Conceptualizing soil organic matter into particulate and mineral-associated forms to address global change in the 21st century [J]. Global Change Biology, 2020, 26(1): 261-273. doi: 10.1111/gcb.14859 [27] WANG B R, AN S S, LIANG C, et al. Microbial necromass as the source of soil organic carbon in global ecosystems [J]. Soil Biology and Biochemistry, 2021, 162: 108422. doi: 10.1016/j.soilbio.2021.108422 [28] ZHAO R D, HE M, JIANG C L, et al. Microbial community structure in rhizosphere soil rather than that in bulk soil characterizes aggregate-associated organic carbon under long-term forest conversion in subtropical region [J]. Rhizosphere, 2021, 20: 100438. doi: 10.1016/j.rhisph.2021.100438 [29] LAL R. Digging deeper: A holistic perspective of factors affecting soil organic carbon sequestration in agroecosystems [J]. Global Change Biology, 2018, 24(8): 3285-3301. doi: 10.1111/gcb.14054 [30] GHIMIRE R, LAMICHHANE S, ACHARYA B S, et al. Tillage, crop residue, and nutrient management effects on soil organic carbon in rice-based cropping systems: A review [J]. Journal of Integrative Agriculture, 2017, 16(1): 1-15. doi: 10.1016/S2095-3119(16)61337-0 [31] CROWTHER T W, van den HOOGEN J, WAN J, et al. The global soil community and its influence on biogeochemistry [J]. Science, 2019, 365(6455): eaav0550. doi: 10.1126/science.aav0550 [32] ZHANG Y L, HEAL K V, SHI M J, et al. Decreasing molecular diversity of soil dissolved organic matter related to microbial community along an alpine elevation gradient [J]. Science of the Total Environment, 2022, 818: 151823. doi: 10.1016/j.scitotenv.2021.151823 [33] BASTIDA F, ELDRIDGE D J, GARCÍA C, et al. Soil microbial diversity–biomass relationships are driven by soil carbon content across global biomes [J]. The ISME Journal, 2021, 15(7): 2081-2091. doi: 10.1038/s41396-021-00906-0 [34] 苏丹, 张凯, 陈法霖, 等. 施氮对不同有机碳水平桉树林土壤微生物群落碳代谢的影响 [J]. 生态学报, 2015, 35(18): 5940-5947. SU D, ZHANG K, CHEN F L, et al. Effects of nitrogen application on carbon metabolism of soil microbial communities in eucalyptus plantations with different levels of soil organic carbon [J]. Acta Ecologica Sinica, 2015, 35(18): 5940-5947(in Chinese).
[35] LIANG C, SCHIMEL J P, JASTROW J D. The importance of anabolism in microbial control over soil carbon storage [J]. Nature Microbiology, 2017, 2: 17105. doi: 10.1038/nmicrobiol.2017.105 [36] 喻国军, 谢晓尧. 喀斯特地区造林对土壤团聚体稳定性及微生物碳代谢活性的影响 [J]. 水土保持研究, 2020, 27(6): 21-27,36. YU G J, XIE X Y. Effects of afforestation on soil aggregate stability and microbial carbon metabolism activity in Karst area [J]. Research of Soil and Water Conservation, 2020, 27(6): 21-27,36(in Chinese).
[37] GLASSMAN S I, WEIHE C, LI J H, et al. Decomposition responses to climate depend on microbial community composition [J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(47): 11994-11999. doi: 10.1073/pnas.1811269115 [38] WANG C Q, XUE L, DONG Y H, et al. Soil organic carbon fractions, C-cycling hydrolytic enzymes, and microbial carbon metabolism in Chinese fir plantations [J]. Science of the Total Environment, 2021, 758: 143695. doi: 10.1016/j.scitotenv.2020.143695 [39] GLICK B R. Soil microbes and sustainable agriculture [J]. Pedosphere, 2018, 28(2): 167-169. doi: 10.1016/S1002-0160(18)60020-7 [40] LI X F, XU J, SHI Z, et al. Regulation of protist grazing on bacterioplankton by hydrological conditions in coastal waters [J]. Estuarine, Coastal and Shelf Science, 2019, 218: 1-8. doi: 10.1016/j.ecss.2018.11.013 [41] 梁超, 朱雪峰. 土壤微生物碳泵储碳机制概论 [J]. 中国科学:地球科学, 2021, 51(5): 680-695. LIANG C, ZHU X]. An overview of carbon storage mechanism of soil microbial carbon pump [J]. Chinese Science:Earth Science, 2021, 51(5): 680-695(in Chinese).
[42] DENG F B, LIANG C. Revisiting the quantitative contribution of microbial necromass to soil carbon pool: Stoichiometric control by microbes and soil [J]. Soil Biology and Biochemistry, 2022, 165: 108486. doi: 10.1016/j.soilbio.2021.108486 [43] ZHAO Y, LI Y L, YANG F. Critical review on soil phosphorus migration and transformation under freezing-thawing cycles and typical regulatory measurements [J]. Science of the Total Environment, 2021, 751: 141614. doi: 10.1016/j.scitotenv.2020.141614 [44] YAO Q M, LI Z, SONG Y, et al. Community proteogenomics reveals the systemic impact of phosphorus availability on microbial functions in tropical soil [J]. Nature Ecology & Evolution, 2018, 2(3): 499-509. [45] MENDEZ M O, MAIER R M. Phytostabilization of mine tailings in arid and semiarid environments: An emerging remediation technology [J]. Environmental Health Perspectives, 2008, 116(3): 278-283. doi: 10.1289/ehp.10608 [46] VEDRAN, VUČIĆ, SUSANN, et al. New developments in biological phosphorus accessibility and recovery approaches from soil and waste streams [J]. Engineering in Life Sciences, 2021, 21(3/4): 77-86. [47] AMY C, AVICE J C, LAVAL K, et al. Are native phosphate-solubilizing bacteria a relevant alternative to mineral fertilizations for crops?Part II: PSB inoculation enables a halving of P input and improves the microbial community in the rapeseed rhizosphere [J]. Rhizosphere, 2022, 21: 100480. doi: 10.1016/j.rhisph.2022.100480 [48] ZHANG J E, FENG L F, OUYANG Y, et al. Phosphate-solubilizing bacteria and fungi in relation to phosphorus availability under different land uses for some latosols from Guangdong, China [J]. CATENA, 2020, 195: 104686. doi: 10.1016/j.catena.2020.104686 [49] CHENG Y, ELRYS A S, MERWAD A R M, et al. Global patterns and drivers of soil dissimilatory nitrate reduction to ammonium [J]. Environmental Science & Technology, 2022, 56(6): 3791-3800. [50] CHINTA Y D, UCHIDA Y, ARAKI H. Availability of nitrogen supply from cover crops during residual decomposition by soil microorganisms and its utilization by lettuce (Lactuca sativa L. ) [J]. Scientia Horticulturae, 2020, 270: 109415. doi: 10.1016/j.scienta.2020.109415 [51] LING N, WANG T T, KUZYAKOV Y. Rhizosphere bacteriome structure and functions [J]. Nature Communications, 2022, 13: 836. doi: 10.1038/s41467-022-28448-9 [52] NAVARRO-NOYA Y E, HERNÁNDEZ-MENDOZA E, MORALES-JIMÉNEZ J, et al. Isolation and characterization of nitrogen fixing heterotrophic bacteria from the rhizosphere of pioneer plants growing on mine tailings [J]. Applied Soil Ecology, 2012, 62: 52-60. doi: 10.1016/j.apsoil.2012.07.011 [53] NGUYEN T T N, XU C Y, TAHMASBIAN I, et al. Effects of biochar on soil available inorganic nitrogen: A review and meta-analysis [J]. Geoderma, 2017, 288: 79-96. doi: 10.1016/j.geoderma.2016.11.004 [54] 许云翔, 何莉莉, 陈金媛, 等. 生物炭对农田土壤氨挥发的影响机制研究进展 [J]. 应用生态学报, 2020, 31(12): 4312-4320. XU Y X, HE L L, CHEN J Y, et al. Effects of biochar on ammonia volatilization from farmland soil: A review [J]. Chinese Journal of Applied Ecology, 2020, 31(12): 4312-4320(in Chinese).
[55] STARKE R, MONDÉJAR R L, HUMAN Z R, et al. Niche differentiation of bacteria and fungi in carbon and nitrogen cycling of different habitats in a temperate coniferous forest: A metaproteomic approach [J]. Soil Biology and Biochemistry, 2021, 155: 108170. doi: 10.1016/j.soilbio.2021.108170 [56] ARAÚJO A S F, MONTEIRO R T R, ABARKELI R B. Effect of glyphosate on the microbial activity of two Brazilian soils [J]. Chemosphere, 2003, 52(5): 799-804. doi: 10.1016/S0045-6535(03)00266-2 [57] AL-ANI M A M, HMOSHI R M, KANAAN I A, et al. Effect of pesticides on soil microorganisms [J]. Journal of Physics:Conference Series, 2019, 1294(7): 072007. doi: 10.1088/1742-6596/1294/7/072007 [58] 田其凡, 何玘霜, 陆安祥, 等. 农田土壤抗生素抗性基因与微生物群落的关系 [J]. 环境化学, 2020, 39(5): 1346-1355. doi: 10.7524/j.issn.0254-6108.2019060602 TIAN Q F, HE Q S, LU A X, et al. Relationship between antibiotic resistance genes and microbial communities in farmland soil [J]. Environmental Chemistry, 2020, 39(5): 1346-1355(in Chinese). doi: 10.7524/j.issn.0254-6108.2019060602
[59] ZHANG W, LIU Y G, TAN X F, et al. Enhancement of detoxification of petroleum hydrocarbons and heavy metals in oil-contaminated soil by using Glycine-β-cyclodextrin [J]. International Journal of Environmental Research and Public Health, 2019, 16(7): 1155. doi: 10.3390/ijerph16071155 [60] NISHIWAKI J, KAWABE Y, KOMAI T, et al. Decomposition of gasoline hydrocarbons by natural microorganisms in Japanese soils [J]. Geosciences, 2018, 8(2): 35. doi: 10.3390/geosciences8020035 [61] KOŠNÁŘ Z, MERCL F, TLUSTOŠ P. Ability of natural attenuation and phytoremediation using maize (Zea mays L. ) to decrease soil contents of polycyclic aromatic hydrocarbons (PAHs) derived from biomass fly ash in comparison with PAHs-spiked soil [J]. Ecotoxicology and Environmental Safety, 2018, 153: 16-22. doi: 10.1016/j.ecoenv.2018.01.049 [62] LI X N, QU C S, BIAN Y R, et al. New insights into the responses of soil microorganisms to polycyclic aromatic hydrocarbon stress by combining enzyme activity and sequencing analysis with metabolomics [J]. Environmental Pollution, 2019, 255: 113312. doi: 10.1016/j.envpol.2019.113312 [63] KOTOKY R, RAJKUMARI J, PANDEY P. The rhizosphere microbiome: Significance in rhizoremediation of polyaromatic hydrocarbon contaminated soil [J]. Journal of Environmental Management, 2018, 217: 858-870. doi: 10.1016/j.jenvman.2018.04.022 [64] 郝爱红, 赵保卫, 张建, 等. 土壤中微塑料污染现状及其生态风险研究进展 [J]. 环境化学, 2021, 40(4): 1100-1111. doi: 10.7524/j.issn.0254-6108.2020083102 HAO A H, ZHAO B W, ZHANG J, et al. Research progress on pollution status and ecological risk of microplastics in soil [J]. Environmental Chemistry, 2021, 40(4): 1100-1111(in Chinese). doi: 10.7524/j.issn.0254-6108.2020083102
[65] GAN C D, GAN Z W, CUI S F, et al. Agricultural activities impact on soil and sediment fluorine and perfluorinated compounds in an endemic fluorosis area [J]. Science of the Total Environment, 2021, 771: 144809. doi: 10.1016/j.scitotenv.2020.144809 [66] CUI S F, FU Y Z, ZHOU B Q, et al. Transfer characteristic of fluorine from atmospheric dry deposition, fertilizers, pesticides, and phosphogypsum into soil [J]. Chemosphere, 2021, 278: 130432. doi: 10.1016/j.chemosphere.2021.130432 [67] 傅绍光, 刘鹏, 罗虹, 等. 铝和氟对茶树根际土壤微生物交互作用的研究 [J]. 浙江师范大学学报(自然科学版), 2009, 32(3): 332-337. FU S G, LIU P, LUO H, et al. Interaction of aluminum and fluorine stress on soil microbes of tea rhizosphere [J]. Journal of Zhejiang Normal University (Natural Sciences), 2009, 32(3): 332-337(in Chinese).
[68] 2020年城市固体废物污染环境防治年报发布[J]. 再生资源与循环经济, 2021, 14(2): 14. 2020 annual report on prevention and control of environmental pollution by urban solid waste released[J]. Recyclable Resources and Circular Economy, 2021, 14(2): 14(in Chinese).
[69] 中华人民共和国环境保护部. 2014年全国大、中城市固体废物污染环境防治年报(节选) [J]. 再生资源与循环经济, 2015, 8(1): 4-8. doi: 10.3969/j.issn.1674-0912.2015.01.003 Ministry of Environmental Protection of the People's Republic of China. 2014 national annual report on prevention and control of environmental pollution by solid waste in large and medium cities (excerpt) [J]. Recyclable Resources and Circular Economy, 2015, 8(1): 4-8(in Chinese). doi: 10.3969/j.issn.1674-0912.2015.01.003
[70] ZHOU Y Y, REN B Z, HURSTHOUSE A, et al. Antimony ore tailings: Heavy metals, ChemicalSpeciation, and leaching characteristics [J]. Polish Journal of Environmental Studies, 2018, 28(1): 485-495. doi: 10.15244/pjoes/85006 [71] HU X Y, HE M C, LI S S, et al. The leaching characteristics and changes in the leached layer of antimony-bearing ores from China [J]. Journal of Geochemical Exploration, 2017, 176: 76-84. doi: 10.1016/j.gexplo.2016.01.009 [72] CUI X W, GENG Y, LI T, et al. Field application and effect evaluation of different iron tailings soil utilization technologies [J]. Resources, Conservation and Recycling, 2021, 173: 105746. doi: 10.1016/j.resconrec.2021.105746 [73] WANG L, JI B, HU Y H, et al. A review on in situ phytoremediation of mine tailings [J]. Chemosphere, 2017, 184: 594-600. doi: 10.1016/j.chemosphere.2017.06.025 [74] YI Z J, ZHAO C H. Desert “soilization”: An eco-mechanical solution to desertification [J]. Engineering, 2016, 2(3): 270-273. doi: 10.1016/J.ENG.2016.03.002 [75] KAUR R, SHARMA S, KAUR H. Heavy metals toxicity and the environment [J]. Journal of Pharmacognosy and Phytochemistry, 2019: 247-249. [76] MA Y, OLIVEIRA R S, FREITAS H, et al. Biochemical and molecular mechanisms of plant-microbe-metal interactions: Relevance for phytoremediation [J]. Frontiers in Plant Science, 2016, 7: 918. [77] MISHRA J, SINGH R, ARORA N K. Alleviation of heavy metal stress in plants and remediation of soil by rhizosphere microorganisms [J]. Frontiers in Microbiology, 2017, 8: 1706. doi: 10.3389/fmicb.2017.01706 [78] TRIPPE K M, MANNING V A, REARDON C L, et al. Phytostabilization of acidic mine tailings with biochar, biosolids, lime, and locally-sourced microbial inoculum: Do amendment mixtures influence plant growth, tailing chemistry, and microbial composition? [J]. Applied Soil Ecology, 2021, 165: 103962. doi: 10.1016/j.apsoil.2021.103962 [79] XING L, WEN J, YAN C Y, et al. Improving the microenvironment of Cd-contaminated River sediments through humic substances washing and zeolite immobilization [J]. Process Safety and Environmental Protection, 2021, 146: 779-788. doi: 10.1016/j.psep.2020.12.024 [80] XIAO E Z, NING Z P, XIAO T F, et al. Variation in rhizosphere microbiota correlates with edaphic factor in an abandoned antimony tailing dump [J]. Environmental Pollution, 2019, 253: 141-151. doi: 10.1016/j.envpol.2019.06.097 [81] ZHAN J, SUN Q Y. Diversity of free-living nitrogen-fixing microorganisms in wastelands of copper mine tailings during the process of natural ecological restoration [J]. Journal of Environmental Sciences, 2011, 23(3): 476-487. doi: 10.1016/S1001-0742(10)60433-0 [82] 刘广容, 叶春松, 钱勤, 等. 电动生物修复底泥中电场对微生物活性的影响 [J]. 武汉大学学报(理学版), 2011, 57(1): 47-51. LIU G R, YE C S, QIAN Q, et al. Effects of electrokinetic bioremediation of electric field on sediment microbial activity [J]. Journal of Wuhan University (Natural Science Edition), 2011, 57(1): 47-51(in Chinese).
[83] LI F M, GUO S H, WANG S, et al. Changes of microbial community and activity under different electric fields during electro-bioremediation of PAH-contaminated soil [J]. Chemosphere, 2020, 254: 126880. doi: 10.1016/j.chemosphere.2020.126880 [84] HARTL M, BEDOYA-RÍOS D F, FERNÁNDEZ-GATELL M, et al. Contaminants removal and bacterial activity enhancement along the flow path of constructed wetland microbial fuel cells [J]. Science of the Total Environment, 2019, 652: 1195-1208. doi: 10.1016/j.scitotenv.2018.10.234 [85] 范瑞娟, 马艳, 张琇, 等. 芘污染盐碱土壤微生物-电动修复效率影响因素 [J]. 中国环境科学, 2021, 41(2): 801-812. doi: 10.3969/j.issn.1000-6923.2021.02.035 FAN R J, MA Y, ZHANG X, et al. Factors affecting bio-electrokinetic remediation efficiency of pyrene contaminated saline-alkali soil [J]. China Environmental Science, 2021, 41(2): 801-812(in Chinese). doi: 10.3969/j.issn.1000-6923.2021.02.035
[86] ALSHAWABKEH A N, MAILLACHERUVU K. Electrochemical and biogeochemical interactions under dc electric fields[M]//Physicochemical Groundwater Remediation. Boston: Kluwer Academic Publishers, 2005: 73-90. [87] 范瑞娟, 郭书海, 李凤梅, 等. 二维电场中微生物群落动态及混合有机物降解特征 [J]. 环境科学学报, 2017, 37(9): 3543-3552. FAN R J, GUO S H, LI F M, et al. Dynamics of microbial community and degradation characteristics of mixed organics in a 2-dimensional electric field [J]. Acta Scientiae Circumstantiae, 2017, 37(9): 3543-3552(in Chinese).
[88] ZAIDI N S, SOHAILI J, MUDA K, et al. Magnetic field application and its potential in water and wastewater treatment systems [J]. Separation & Purification Reviews, 2014, 43(3): 206-240. [89] QU M M, CHEN J M, HUANG Q Q, et al. Bioremediation of hexavalent chromium contaminated soil by a bioleaching system with weak magnetic fields [J]. International Biodeterioration & Biodegradation, 2018, 128: 41-47. [90] MCLEAN M, ENGSTRÖM S, HOLCOMB R. Static magnetic fields for the treatment of pain [J]. Epilepsy & Behavior, 2001, 2(3): S74-S80. [91] LYU W L, SONG Q, SHI J, et al. Weak magnetic field affected microbial communities and function in the A/O/a sequencing batch reactors for enhanced aerobic granulation [J]. Separation and Purification Technology, 2021, 266: 118537. doi: 10.1016/j.seppur.2021.118537 [92] LI M Q, ZHANG J, LIANG S, et al. Novel magnetic coupling constructed wetland for nitrogen removal: Enhancing performance and responses of plants and microbial communities [J]. Science of the Total Environment, 2022, 819: 152040. doi: 10.1016/j.scitotenv.2021.152040 [93] XU D, JI H M, REN H Q, et al. Inhibition effect of magnetic field on nitrous oxide emission from sequencing batch reactor treating domestic wastewater at low temperature [J]. Journal of Environmental Sciences (China), 2020, 87: 205-212. doi: 10.1016/j.jes.2019.05.014 [94] NIU C, LIANG W H, REN H Q, et al. Enhancement of activated sludge activity by 10-50 mT static magnetic field intensity at low temperature [J]. Bioresource Technology, 2014, 159: 48-54. doi: 10.1016/j.biortech.2014.01.131 [95] 张吉先, 俞劲炎. 磁场对土壤微生物和酶活性的影响 [J]. 土壤通报, 1999, 30(1): 26-28. doi: 10.3321/j.issn:0564-3945.1999.01.008 ZHANG J X, YU J Y. Effect of magnetic field on soil microorganism and enzyme activity [J]. Chinese Journal of Soil Science, 1999, 30(1): 26-28(in Chinese). doi: 10.3321/j.issn:0564-3945.1999.01.008
[96] XU Y B, HOU M Y, RUAN J J, et al. Effect of magnetic field on surface properties of Bacillus cereus CrA and its Extracellular Polymeric Substances (EPS) [J]. Journal of Adhesion Science and Technology, 2014, 28(21): 2196-2208. doi: 10.1080/01694243.2014.951303 [97] 栗杰, 依艳丽, 贺忠科, 等. 磁处理棕壤对土壤中几种细菌的影响 [J]. 土壤通报, 2009, 40(6): 1262-1265. LI J, YI Y L, HE Z K, et al. Effects of magnetic treatment on some soil microbial activities in brown earth [J]. Chinese Journal of Soil Science, 2009, 40(6): 1262-1265(in Chinese).
[98] FLORES M R, ORDOÑEZ O F, MALDONADO M J, et al. Isolation of UV-B resistant bacteria from two high altitude Andean Lakes (4, 400 m) with saline and non saline conditions [J]. The Journal of General and Applied Microbiology, 2009, 55(6): 447-458. doi: 10.2323/jgam.55.447 [99] SINGH O V, GABANI P. Extremophiles: Radiation resistance microbial reserves and therapeutic implications [J]. Journal of Applied Microbiology, 2011, 110(4): 851-861. doi: 10.1111/j.1365-2672.2011.04971.x [100] GABANI P, PRAKASH D, SINGH O V. Bio-signature of ultraviolet-radiation-resistant extremophiles from elevated land [J]. American Journal of Microbiological Research, 2014, 2(3): 94-104. doi: 10.12691/ajmr-2-3-3 期刊类型引用(4)
1. 杨莹攀,尹娟,朱银浩,李升. 水氮调控对宁夏中部旱区马铃薯产量与土壤质量的影响. 农业机械学报. 2024(09): 358-370+458 .  百度学术
百度学术
2. 郝胜杰,霍嘉兴,李玉叶,杜雨欣,李金跃,康俊宇. 干旱胁迫下硅和丛枝菌根对甘草根的影响. 北方园艺. 2024(20): 99-109 .  百度学术
百度学术
3. 高国宏,阮梦颖,郝英豪,吴访,周新河,刘荣灿,李媛. 矿区深层地下水微生物群落特征. 煤炭工程. 2024(S1): 163-170 .  百度学术
百度学术
4. 陈维峰,王思凡,马林,袁宗胜,刘芳. 微生物菌剂组合施用对艾草生长的影响. 亚热带农业研究. 2023(04): 273-281 .  百度学术
百度学术
其他类型引用(3)
-






 下载:
下载: