-
对羟基苯甲酸酯(parabens,PBs)是由对羟基苯甲酸和醇类发生酯化反应产生的一类物质,微溶于水,易溶于有机溶剂,为提高水溶性,可进一步与氢氧化物反应制成对羟基苯甲酸酯的盐类. PBs对抑制各种霉菌、酵母菌和细菌十分有效,具有无色、无味、用量小、成本低廉和安全性较好等特点,作为防腐剂使用已有超过50年的历史,被美国食品和药品管理局(Food and Drug Administration,FDA)列为“公认为安全的”(generally recognized as safe,GRAS)化合物[1].
目前,包括我国在内的多个国家或地区均允许在食品、药品和个人护理品的生产中添加PBs,各领域使用较多的PBs主要包括对羟基苯甲酸甲酯(methyl paraben,MeP)、对羟基苯甲酸乙酯(ethyl paraben,EtP)、对羟基苯甲酸丙酯(propyl paraben,PrP)、对羟基苯甲酸丁酯(butyl paraben,BuP),以及它们的盐类. PBs作为防腐剂的安全性很高,毒理试验表明其半数致死量(median lethal dose,LD50)为5000—8000 mg·kg−1,其它常用防腐剂,如苯甲酸及其盐类的LD50为500—2000 mg·kg−1,山梨酸及其盐类的LD50为6—10 g·kg−1,苯氧乙醇的LD50为5000 mg·kg-1[2]. 同时,由于PBs具有酚羟基结构使其抗细菌性能较强,相同条件下其添加量更低,因而其使用相对更安全,风险更低[3]. 遗憾的是,虽然毒性试验显示PBs相对无刺激性且毒性较低,但随着人们对PBs认识的不断深入,该类物质被证明具有潜在的内分泌干扰作用[4],而PBs在多个领域的广泛应用,已使人们处于较为复杂的PBs暴露态势中. 识别PBs的暴露来源和途经,确定人体浓度分布特征及水平,对于阐明PBs的环境及健康风险至关重要. 本文重点梳理近十年发表的PBs环境污染及人体暴露类研究论文,为后续开展PBs人体暴露和健康风险评估研究提供基础数据和思路.
-
PBs在食品行业的应用已有数十年的历史,主要用于酒精饮料、谷物制品和调味料等食品的防腐. 2006年,美国FDA允许将MeP和PrP作为直接食品添加剂;加拿大卫生部颁布的食品药品条例(2016)批准了MeP和PrP的使用. 我国在《食品安全国家标准食品添加剂使用标准》(GB2760-2014)中规定,不同类型食品中对羟基苯甲酸甲酯钠和EtP及其钠盐的最大使用量(以对羟基苯甲酸计)为0.012—0.5 g·kg−1.
基于此,多数研究表明食品中可检出PBs,如Liao等[5]调查我国9个城市13种品类的282份食品样本中PBs的水平,结果显示所有类别的食品样本中均可检出至少1种PBs,其中MeP、EtP和PrP的检出率分别为99%、84%和79%,美国[6]、西班牙[7]和沙特阿拉伯[8]等不同国家的同类研究中PBs也呈现出相同的分布特征. 对比检出浓度发现,我国食品中总PBs浓度范围(<LOQ—2.53 µg·g−1)略高于美国(<LOQ—0.409 µg·g−1)和西班牙(<LOQ—0.28 µg·g−1),而沙特阿拉伯(<LOQ—1113 µg·g−1)比其他国家高约3个数量级,其中检出浓度最高的是谷物和调味品中的MeP(<LOQ—495.7 µg·g−1). 此外,研究显示[6]不同类型食品,如鱼类、海产品等未加工食品和饼干、调味品等加工食品中均可不同程度检出PBs,虽然检出浓度有很大的差异,但统计学分析显示各食物类别间没有显著差异. 结果提示环境中残留的PBs不仅可以通过环境介质进入人体,还可进一步通过生物累积效应对人体产生间接危害.
-
个人护理品中添加了大量营养物质,极易为微生物的繁殖创造条件,加入一定剂量的防腐剂,可有效防止微生物繁殖造成的产品腐败和变质. 我国《化妆品安全技术规范》(2015年版)对个人护理品中PBs的使用进行了严格限定,如对羟基苯甲酸异丙酯(iPrP)、对羟基苯甲酸异丁酯(iBuP)、对羟基苯甲酸苄酯(BzP)等禁用于化妆品,MeP、EtP、PrP、BuP等的使用限值(以对羟基苯甲酸计)为单一酯0.4%和混合酯0.8%,且PrP、BuP及其盐类之和不得超过0.14%. 通过调研个人护理品中PBs使用情况的文献,如杨艳伟等[9]对702件各类化妆品中防腐剂的使用情况、种类和频率等进行调查,结果显示73.7%的化妆品加入两种或两种以上防腐剂,其中PBs的使用率最高,可达65.33%. 程文静等[10]通过调查1205份护肤品,结果显示不同国家(中国、韩国、日本、美国和欧盟)护肤品中防腐剂的使用情况和种类分布基本一致,PBs 是除苯氧乙醇外个人护理品中使用最多的防腐剂.
生产过程中大量添加的PBs可经过皮肤吸收进入人体,动物实验[11]证实高达60%的MeP和40%的EtP能够完全通过兔子的皮肤进入其体内,因此我们可以得到个人护理品是PBs最为重要的外暴露来源之一,尤其对于使用个人护理品频率较高的青年女性. 添加PBs的个人护理品主要包括美容用品、身体护理、口腔用品和日化用品等,可大致分为清洗型和涂抹型产品. 对于沐浴露等清洗型产品,中国Cheng等[12]研究结果显示,该类产品中仍是MeP、PrP和EtP的检出率较高,其中位浓度分别为7.23、1.48、9.99 µg·g−1. 分析西班牙[13]和美国[14]市售的清洗型个人护理品中PBs的浓度,西班牙检出水平与我国接近,其中MeP、EtP和PrP的中位浓度分别为13.28、9.29、7.04 µg·g−1,而美国研究显示,MeP(757 µg·g−1)、EtP(95.5 µg·g−1)和PrP(47.2 µg·g−1)的检出浓度显著高于其他国家. 对于面霜等涂抹式个人护理品,研究表明由于其脂质含量更高,因此需要添加更多的防腐剂以保证产品的质量. Guo等[15]分别对美国和中国市售身体乳和面霜中PBs进行检测,结果显示中国MeP、EtP和PrP检出浓度分别为1200、39.1、746 µg·g−1,美国分别为885、246、221 µg·g−1,可见两国该类产品中MeP和PrP浓度处于相同数量级,美国EtP的浓度含量高于中国. 此外近年来已有研究表明BuP在某些个人护理品中被广泛使用,在口红、面霜和洗面奶等中BuP的检出浓度水平在每克数十微克,与EtP和PrP水平相当[12],这一结果需引起我们重点关注.
-
药品因其使用淀粉等有机物作为辅助用料,存在变质的风险,生产过程中需要添加一定量的防腐剂以延长保质期. 上世纪90年代,美国FDA批准MeP和PrP应用于注射用剂(包括皮下、肌肉和静脉等注射),鼻内制剂和眼内制剂(如药膏、溶液和悬浮液)等药品. 《中华人民共和国药典》(2020年版)规定,中药糖浆剂、合剂中对羟基苯甲酸酯的含量不得超过0.05%. 研究显示药品中检出率最高的物质仍是MeP和PrP,这与食品和个人护理品中的检测结果基本一致,如Ma等[16]对常用的药物中6种PBs进行测定,结果显示几乎所有的药物样本中都含有至少1种PBs,且总PBs中位浓度为119 ng·g−1.
-
随着经济的快速发展和人们生活水平的显著提高,我国PBs的生产量也在逐年上升. PBs的大量生产和广泛使用无疑加剧了PBs的环境暴露风险. 目前在与人们生活息息相关的多种环境介质(如水、空气、土壤、灰尘等)中均可检出PBs.
-
工业生产和日常生活中使用的PBs不断地通过工业废水和生活污水排放到环境中. 虽然PBs容易被生物降解,但由于人类大量频繁地使用,导致目前世界范围内的污水、地表水、地下水、饮用水中均可检测到PBs的残留.
城市污水处理厂(WWTPs)是向环境释放PBs的主要途径之一,通过监测WWTPs进出水和污水污泥中PBs的浓度能够了解PBs的排放情况. 通过分析近年来关于WWTPs中PBs浓度的文献数据,发现MeP和PrP是WWTPs进水中最主要的PBs,其次是EtP和BuP. 如Molins等[17]和Kapelewska等[18]分别测定了WWTPs中的PBs浓度水平,结果显示西班牙进水中MeP和PrP的最高浓度分别为2466 ng·L−1和5700 ng·L−1,而波兰进水中MeP、EtP和PrP的最高浓度分别为5030、4150、2730 ng·L−1. 对比数据发现早期欧美国家WWTPs进水中PBs浓度水平显著高于亚洲国家,但近些年来亚洲地区国家的浓度水平呈现快速上升特点. 现阶段,世界各国WWTPs进水中的PBs浓度水平,特别是MeP和PrP的水平仍呈上升趋势. 分析我国的同类研究发现,不同地区WWTPs进水中PBs的水平差异也较大,如哈尔滨的MeP浓度大于1000 ng·L−1[19],但长沙和厦门的PBs浓度[20]明显较低. WWTPs出水中PBs的浓度结果显示,WWTPs对PBs的去除率虽然能够达到96.1%—99.9%[21],但未被完全去除的PBs从污水处理厂排出后仍会进一步进入其他水环境,如地表水、地下水,甚至是饮用水水源.
PBs的持续使用以及污水处理过程的不完全去除,导致其广泛存在于地表水中. 本文总结了近年来国内的研究结果,分析我国北京城市河流[22]、湘江[23]、长江[24]、九龙江[25]、黄河和淮河[26]以及台湾垦丁等[27]几大地表水体系中PBs的浓度水平,主要PBs的检测结果如表1所示. 结果显示,地表水中的主要污染物是MeP和PrP,且两类物质在大部分水系中的检出率均为100%. 湘江中检出的PBs最高浓度水平(MeP为1.4—3173.9 ng·L−1、PrP为<LOD—1040.4 ng·L−1)远高于其他河流,其次是北京城市河流. 值得注意的是,除了MeP、EtP、PrP等主要PBs,长江中BzP的检出率高达85.3%,湘江中iPrP的检出率高达93%,黄河则检出对羟基苯甲酸庚酯(HepP)(检出率32%),提示我们应对地表水中的PBs引起足够重视且有必要研究其来源. 世界范围内波兰[28]、斯洛文尼亚[29]、巴基斯坦[30]等国家发表过同类研究结果,显示MeP和PrP为检出率最高的两类PBs. 结果提示目前PBs特别是MeP和PrP已成为全世界水生系统中无处不在的污染物,其暴露水平呈现逐步上升趋势.
污水处理过程中未完全去除的PBs有可能通过污水灌溉等途径进一步污染地下水甚至是饮用水水源. Serra-Roig等[31]研究发现,西班牙巴塞罗那地下水中MeP和PrP的最大浓度分别为194 ng·L−1和61.9 ng·L−1. 赵雪等[32]在2021年对我国雄安地区地下水开展调查,结果表明MeP(3.02 ng·L−1)、EtP(2.66 ng·L−1)和PrP(1.00 ng·L−1)是检出的主要PBs,但含量水平较低. Caldas[33]对巴西48个自来水样本进行分析,结果显示MeP浓度为234 ng·L−1,西班牙Valcarcel等[34]也开展同类研究,检出MeP和EtP,浓度范围分别为120.82—182.71 ng·L−1和4.23—11.97 ng·L−1. 上述结果表明,虽然地下水、自来水中PBs的检出浓度整体较低,但饮水中的低浓度赋存水平提示饮水是PBs的潜在暴露途径,需要予以关注.
-
PBs的空气污染尚未引起足够重视,仅有个别学者关注PBs在空气环境中的赋存水平. 与水环境相比,空气中PBs的残留相对较低. Chen等[35]开展的室外空气中8种主要PBs的环境评估研究结果表明,哈尔滨市的室外空气样本中除HepP外均有检出,其中MeP和EtP在气相和颗粒相空气样品中的检出率均为100%. 8种PBs的总浓度为0.253—1.540 ng·m−3,平均浓度0.701 ng·m−3;气相和颗粒相中PBs的浓度范围分别为0.149—1.150 ng·m−3和0.083—0.391 ng·m−3,即PBs主要存在于气相中. 此外,伊朗[36]和美国[37]均开展过室内外空气中PBs的浓度及其相关性研究,结果表明室内空气中PBs的浓度明显高于室外空气,提示空气中PBs的污染主要来源于生活环境中PBs的使用,目前我国暂未开展有关室内空气中PBs的暴露评估研究.
此外,研究证明室内环境灰尘中也能够检测到PBs的残留,其主要来源可能是人们接触个人护理品的过程中释放并附着在室内灰尘上的. 研究发现,不同国家和地区室内灰尘中PBs呈现不同特征. Zhu[38]等在2020年比较了中国6个不同地区(北部、西部、东北、西北、中南和西南地区)的289份室内灰尘样本中PBs的浓度水平. 结果显示6种PBs均有不同程度的检出,总PBs检出浓度范围为8.66—21500 ng·g−1,不同类型PBs浓度中位数水平由高到低分别是:MeP(184 ng·g−1)> PrP(53.4 ng·g−1)> EtP(11.0 ng·g−1)>BuP(1.36 ng·g−1)>BzP(0.289 ng·g−1)>HepP(<LOD). Wang[39]等2021年测定129份北京和湖北随州室内灰尘中PBs浓度,结果显示北京地区PBs的浓度中位数(1050 ng·g−1)明显高于随州地区(314 ng·g−1). 根据所查阅的文献,不同国家PBs的检出率基本一致(MeP > PrP > EtP > BzP>HepP),但浓度水平存在一定差异,如美国[40](140—39090 ng·g−1)、韩国[41](427—11900 ng·g−1)、日本[41](273—19900 ng·g−1)和加拿大[42](99—14450 ng·g−1)室内灰尘中PBs的检出浓度比较接近,且普遍高于越南[43](<LOD—1650 ng·g−1). 室内灰尘中PBs的检出率和检出水平与个人护理品的使用习惯及消费量是否具有相关性有待进一步研究.
-
室外大气环境中普遍存在的PBs通过沉降的方式进入土壤环境,土壤是其主要的储存介质,不过对于以使用为主要暴露来源的PBs,土壤并非直接的暴露途径,因此国内外均未大量开展相关研究. 印度[44]的一项研究结果显示,在农业土壤中可检出MeP(0.233 ng·g−1)、PrP(0.916 ng·g−1)和BuP(0.192 ng·g−1),而西班牙[45]农业土壤中MeP(6.35 ng·g−1)和PrP(4.03 ng·g−1)检出浓度与印度相比处于较高水平. 于浡等[46]于2019年采集48份哈尔滨市表层土壤进行检测,结果显示MeP和PrP的检出率最高,均为96%,其次是EtP、iPrP和BuP,分别为67%、60%和56%,BzP、iBuP和HepP的检出率相对较低,分别为23%、23%和2%,8种PBs的总平均浓度为2.879 ng·g−1.
-
PBs的主要暴露途径包括呼吸道暴露(空气和灰尘)、皮肤暴露(个人护理品和灰尘等)和消化道暴露(食品、药品和饮水等). PBs进入人体后可通过体液循环到达肝脏和肾脏,在非专一性酯酶的作用下水解,并与体内的硫酸盐和葡萄糖醛酸等物质结合,大部分以结合态的形式随尿液排出体外,其余以胆汁和粪便形式代谢或进入血液和脂肪等组织中[47]. 虽然,PBs代谢迅速,很少在体内蓄积,但由于个人、工农业和畜牧业大量而频繁的使用,导致PBs对人体暴露呈现“假性持续性现象”[48]. 目前已有研究表明包括人体尿液、血液、脂肪组织、母乳、头发、指甲、唾液、羊水和胎盘组织等多种介质中均存在PBs残留.
-
研究证实,在人体暴露PBs后的24 h内大约有86%的PBs以4-HB及葡萄糖醛酸结合物形式经尿液排出体外[47],其中4-HB并非是PBs专一的代谢产物,仅通过检测尿中4-HB来评价人体PBs的暴露并不全面,因此目前多数研究通常将尿中游离态和结合态的PBs浓度作为评估其人体内暴露的依据. 此外,也有部分研究关注OH-MeP、OH-EtP等特异性代谢物,但相对较少.
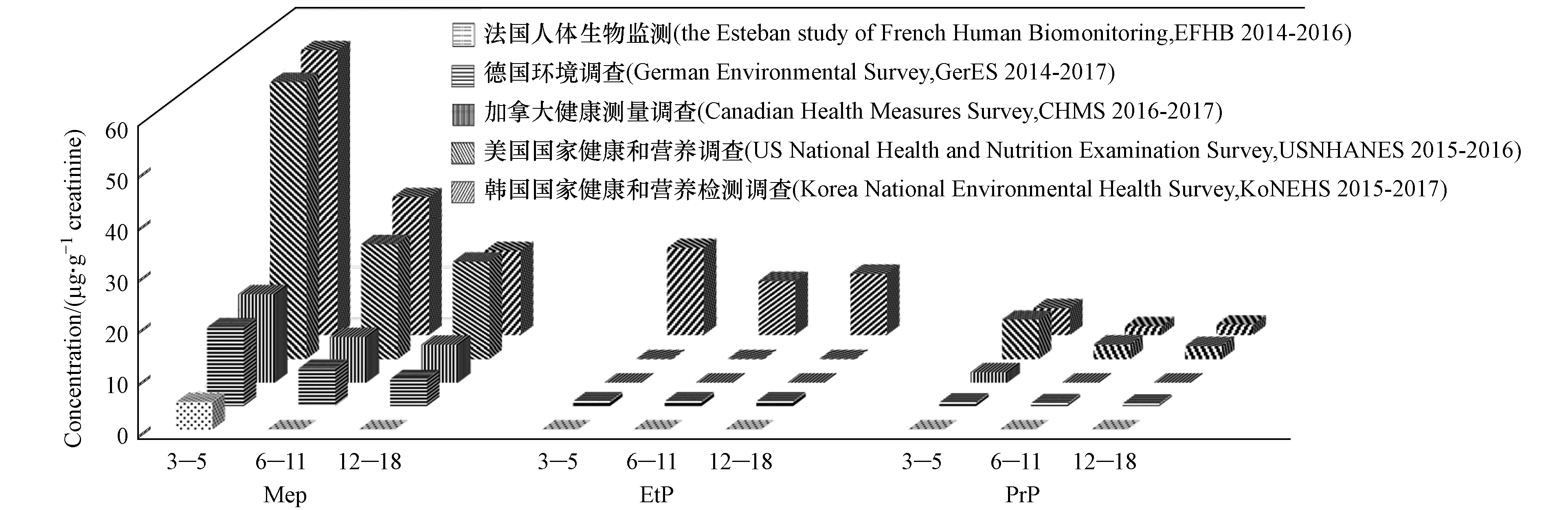
目前,美国、德国、韩国和加拿大等国家[49–52]均对本国居民开展了该类物质的生物监测工作. 一般人群尿液中PBs的检测结果显示呈现一定的地区和人群差异,其中美国人群尿液中PBs的检出浓度显著高于其他国家. 此外,比较不同性别人群浓度水平发现,女性尿液PBs浓度显著高于男性. 分析我国一般人群内暴露调查数据也得到类似结果,如Wang等[39]测定来自湖北随州和北京的203份一般人群尿样中PBs的水平,结果显示北京PBs浓度水平显著高于随州,且两地区目标人群中女性显著高于男性和儿童.
儿童和青少年相比成年人对PBs更敏感,但目前关于该类人群的研究十分有限,仅有部分已开展生物监测工作的国家数据可供参考(如图1). 结果显示,不同国家该人群尿液中PBs的浓度也存在较大差异,如韩国MeP、EtP和PrP的检出率(94.6%—100%)和检出浓度(1.7—55.1 µg·g−1)最高,其中MeP(24.5 µg·g−1)和PrP(2.2 µg·g−1)的检出浓度与美国水平相当,但高暴露组(95百分位)显示出更高的浓度水平;与加拿大、德国和法国儿童相比,韩国MeP平均浓度水平高出3—10倍,PrP平均浓度水平高出2倍,值得注意的是,其他国家均检出较低浓度的EtP,韩国亦表现出较高的检出水平. 此外,3—5岁儿童的检出率和检出浓度均高于其他年龄段,提示儿童和青少年对PBs可能存在特定的暴露来源,后续研究中需要引起重视. 我国针对PBs的生物监测工作仍处于起步阶段,但Lu等[53]开展小样本儿童暴露调查研究发现,MeP、EtP和PrP的检出率均在90%以上,但中位浓度远低于韩国、美国和德国,有待通过大样本调查予以证实.
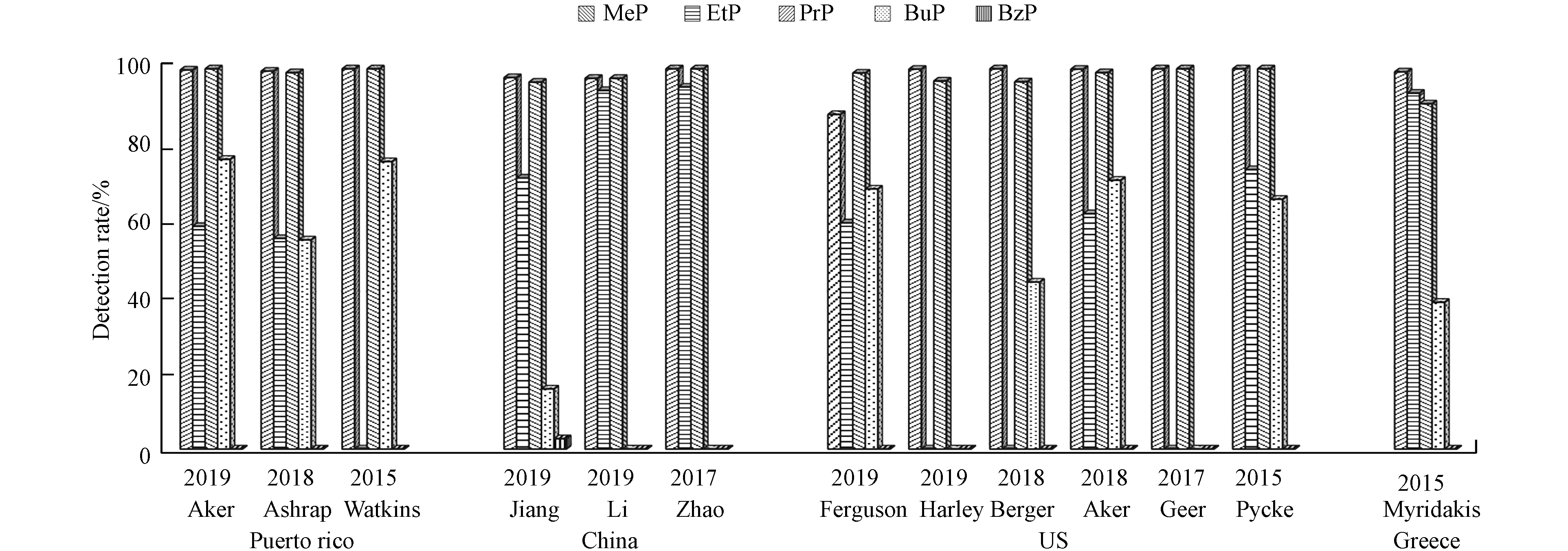
妊娠期妇女作为一类特殊人群极易受到内分泌紊乱的影响,因此不同国家相继开展该类人群的研究. 通过总结近年新发表的孕妇尿中PBs暴露研究发现(如图2),包括美国在内的十多个国家孕妇尿液中测得的PBs中,MeP和PrP的检出率均接近100%,其中位浓度超过100 ng·mL−1和20 ng·mL-1[54–58]. 对比不同国家后发现,美国人群中PBs的浓度水平最高,MeP和PrP的最高浓度分别为12598 ng·mL−1和2028 ng·mL–1[57],而我国孕妇尿液中该类物质的浓度远低于美国,如Jiang等[58]2019年测得MeP和PrP的最高浓度分别为50.58 ng·mL−1和3.08 ng·mL−1. 大多数孕妇的尿液样本中普遍检测到EtP和BuP,但其含量低于MeP和PrP. 总体而言,MeP和PrP是孕妇尿液中的主要PBs,占PBs总浓度的90%,且PrP与MeP暴露水平相关,提示上述两类PBs对孕妇具有相似的暴露来源.
-
血液是机体转运和分布化学物质的主要载体,PBs经过不同途径进入人体后,部分可进入血液而输送到机体的各个部分. 与尿液不同,血液很少受组成变化的影响,具有足够的稳定性和准确性,因此有越来越多的研究关注血液样本(全血、血清和血浆等)尤其是特定人群血液样本中PBs的浓度水平(如表2所示).
Assens等[63]在2019年对丹麦502名孕妇血清中的PBs进行分析,结果显示与尿液中一致,MeP和PrP检出率最高,分别为69.9%和59.2%,其中MeP检出浓度中位数为0.85 ng·mL−1,此外iPrP和iBuP也有个别检出,检出率为1.6%和0.9%. 越来越多的研究开始关注孕妇血液、尿液和羊水等配对样本,以探寻母体PBs暴露对胎儿生长发育的影响. 如Shekhar等[64]和Brauner等[65]分别于2016和2020年开展此类研究,结果显示母体对PBs的暴露与胎儿在发育过程中的宫内暴露呈正相关且血清和羊水配对样本间的PBs浓度存在统计学上的明显正相关. Song等[66]在2020年对95份孕妇血清和脐带血清中PBs的浓度水平进行分析,结果表明两种基质中各类PBs呈现高度相关. Jiménez-Díaz等[67]于2016年首次探究女性月经血中的PBs暴露与月经紊乱间的关系,研究表明月经血中PBs的浓度为ng·mL−1水平,与其他生物样本中的水平一致,MeP和PrP检出率最高. 另有研究证实[68],PBs暴露可能与子宫内膜异位症有关,月经血作为一种与子宫内膜密切接触的非损伤性生物样本,积极开展此类研究有助于进一步揭示PBs对女性生殖健康的影响.
-
早在2004年Darbre等[69]就在对20份人乳房肿瘤组织的分析中首次发现PBs的存在,并提示其可能与乳房肿瘤的形成有关. 随后Sajid[70]和Alampanos[71]等开展过卵巢和乳腺癌组织中PBs的暴露分析,结果显示MeP和PrP检出浓度最高,且肿瘤组织中PBs的浓度至少是良性组织中的两倍. 值得注意的是,我国Shen等[72]研究的乳腺组织中HepP的检出浓度(1.5—5931.1 ng·g−1,中位数为727.2 ng·g−1)远远高于其他类型的PBs,需要引起我们的进一步关注.
胎盘组织是一种能够直接反映PBs对生命早期发育影响的重要人体生物样本. Overmeire等[73]分析了71份比利时胎盘样本中PBs的浓度水平,研究证实MeP、EtP和PrP的中位数分别为4.4 ng·g−1、0.7 ng·g−1和1.0 ng·g−1,未检出BuP. Vela-Soria等[74]研究显示,在15份样本中MeP(87%)和EtP(67%)的检出浓度范围分别为0.5—1.5 ng·g−1和0.5—2.2 ng·g−1. Jennifer Valle-Sistac等[75]则在2016年首次在西班牙胎盘样本中检出BzP.
鉴于人体组织的特殊性,目前仅有少数针对脂肪等人体组织的PBs暴露研究. Wang等[76]收集20份来自美国医疗中心的脂肪,分析其中MeP、EtP、PrP、BuP、BzP、HepP和4-HB的浓度水平,结果显示4-HB检出率和检出浓度(95%,<LOD—17400 ng·g−1)最高,其次为EtP(60%,<LOD—306 ng·g−1). Artacho-Cordón[77]在2018年对144份来自西班牙非癌症病人的脂肪组织进行分析,结果显示MeP、EtP、PrP、BuP和iBuP的检出率分别为100%、20%、54.2%、5.6%和2.1%,检出浓度均低于美国.
-
尽管针对母乳、头发、指甲、唾液、羊水等生物样本中PBs的暴露研究十分有限,但仍有部分国内外研究已证实PBs可以在该类生物样本中检出. 值得注意的是,不同生物样本具有其特定的暴露特征和研究优势,如母乳中的PBs水平可以间接反映哺乳期婴幼儿摄入PBs的浓度水平,头发采集容易、适用人群广泛且能反映过去某一段时间的暴露水平,羊水可以通过分析女性孕期PBs的水平而进一步研究人类生命早期的暴露等.
Dualde等[78]对西班牙120份母乳样本中PBs进行分析,结果显示MeP的检出率(89%)和检出浓度(中位数为0.19 ng·mL−1)最高. Park等[79]和Kim等[80]分别在2019年和2020年对200份以上的母乳样本进行检测分析,结果显示MeP、EtP、PrP和BuP均有不同程度检出,其中检出率最高的是EtP(66%),且其随母亲年龄的增长而显著增加. 此外该研究还得出,随着哺乳期时间的推移,母乳中MeP、EtP和BuP水平显著降低,其中使用化妆品的母亲母乳中PrP水平显著高于未使用的母亲.
Martín等[81]收集来自西班牙的42份头发样本,检测结果显示MeP(68.3—14187.3 ng·g−1,中位数为822.1 ng·g−1)和PrP(12.5—9009.0 ng·g−1,中位数为256.3 ng·g−1)的检出率为100%,EtP(2.9—6565.9 ng·g−1,中位数为84.8 ng·g−1)的检出率为95%,成人头发中PBs的浓度高于儿童,女性头发中PBs浓度总和(5725 ng·g−1)高于男性头发(4296 ng·g−1). Li等[82]收集来自中国南京的50份指甲样本,结果显示,MeP、EtP、PrP、BuP、BzP、HepP、4-HB、OH-EtP和OH-MeP的中位数分别为2070、785、136、17.9、1.48、0.02、0.12、0.09、18.2 ng·g−1,且女性指甲中PBs及其代谢物的含量比男性指甲中高,这与血尿样本中的检测结果一致.
Song等[66]收集的我国95份孕妇羊水样本中MeP(92%)、PrP(85%)及其代谢物OH-MeP(100%)和4-HB(100%)检出率较高,但检出浓度低于印度[67]、丹麦[68]和希腊[83]等国家的同类研究. 尽管多数研究均显示胎盘转移率较低,但仍有几种PBs可穿过胎盘屏障并存在于羊水中. 在羊水中,它们可能与宫内环境发生作用,因此我们需要进一步研究这些物质的毒代动力学和潜在的内分泌干扰特性,以更好地评估其对发育中胎儿的健康风险.
总体而言,已有越来越多的研究集中在一些除尿液外的非破坏性样本(如头发、指甲、唾液等)和胎盘、脐带血及羊水等与生命早期发育相关的样本,但目前该类数据仍十分有限,限制了PBs的有效生物标志物和疾病相关研究.
-
本文通过综述国内外最新的PBs环境外和人体内暴露研究结果发现,相比于林忠洋等[84]的同类研究,各类环境介质及人体生物样本中PBs,仍以检出MeP和PrP为主,其次是EtP和BuP. 然而PBs的浓度水平发生了明显变化,具体表现在多数国家人群PBs的检出浓度呈现进一步升高的趋势,此外之前欧洲、美国和韩国的水平显著高于其他国家,但近些年中国和其他亚洲地区的浓度水平显著增加,这需要引起我们的足够重视.
随着科学研究的逐步深入,以前被认为是无毒、安全的PBs,现在很多都被证明是潜在的内分泌干扰物,会对生殖系统[85-87]、免疫系统[88]和血糖水平[87]以及甲状腺功能[89]产生干扰,并可以对隔代效应的表观遗传发挥调节作用[90]. 动物体内外实验结果表明PBs具有雌激素活性,如长期暴露于PBs的大鼠表现出荷尔蒙分泌降低的趋势,并会造成内分泌系统紊乱,影响生殖器官的正常发育[91]. 啮齿类动物口服 PBs 会诱导其氧化应激,250 mg·(kg·d)−1的MeP暴露导致大鼠发生脂质过氧化反应[92]. 此外,人体流行病学研究证实PBs可能与过敏[93]、哮喘[94]、糖尿病[89]以及乳腺癌[95]等疾病相关,如PBs在乳腺肿瘤组织中可被高浓度检出、尿液中PBs的总水平(特别是BuP)与女性月经周期长度之间存在着明显的负相关关系[96]、女性体内高水平的MeP和EtP与生育能力下降有关[97]、糖尿病与PBs的浓度水平呈现明显的剂量反应关系[98]等. 大量PBs的健康风险评估数据提示我们确定PBs的来源并监测其暴露特征是至关重要的. 我国正逐步成为世界上最大的PCPs市场之一,我国人群PBs的浓度水平呈现出逐年上升的趋势. 然而国内针对PBs开展的暴露评估工作相对缓慢,仅有个别基于小规模样本量的暴露研究可供参考,亟需开展基于大样本量的人群暴露监测及评估工作,以获取具有代表性的基线数据.
对于环境外暴露研究,通过分析最新国内外相关研究表明水环境和室内灰尘中PBs检出率和检出浓度远高于其他环境介质,因此提示此后的研究重点应聚焦于这两类环境介质的暴露评估. 其次,水环境特别是地下水和WWTPs中PBs的污染特征呈现出一定的地域特点,应结合研究地区的人口分布特征、社会发展水平等因素进一步分析可能的暴露来源.
针对人体内暴露评估,应在做好人体尿液中PBs浓度水平监测工作的基础上,积极开展其他生物样本的暴露评估工作,根据不同生物样本具有的特定暴露特征和研究优势有针对性地开展该类研究,以便全面了解PBs的人群健康风险及相关的疾病负担状况,为环境质量标准制定和健康政策的实施提供科学依据,切实保障人民健康.
对羟基苯甲酸酯类防腐剂的环境和人体暴露研究进展
Research progress in the study of environmental and human exposure to paraben preservatives
-
摘要: 对羟基苯甲酸酯(parabens,PBs)作为一类防腐剂,因其具有独特的理化性质而被广泛应用于食品、药品和个人护理品中. 但随着科学技术的发展和研究的不断深入,PBs被证明在一定程度上具有与持久性有机污染物相类似的“持久性、生物富集性和生物毒性”,是潜在的内分泌干扰物. 近年来此类防腐剂已经在世界范围内的环境介质和人体样本中被广泛检出,且检出浓度呈逐年上升趋势,引发国内外高度关注. 本文分别从环境外暴露和人体内暴露两个方面,对国内外最新的PBs暴露相关研究成果进行归纳和总结,为开展PBs人体暴露和健康风险评估研究提供参考及思路.Abstract: Parabens (PBs) are widely used as preservatives in food, pharmaceuticals and personal care products because of their unique physicochemical properties. However, with the advancement of research and technology, PBs have been proved to be “persist, bioaccumulative and biotoxic”, which is similar to persistent organic pollutants (POPs), as well as been identified as potential endocrine disrupting chemicals. In recent years, PBs have been widely detected in environmental matrices and human samples worldwide. The detection of PBs has been increasing over the years, which has aroused great concern both domestically and internationally. This review therefore focuses on the latest global research findings in the assessment of human exposure to PBs, both externally and internally to provide ideas for further research on human exposure and health risk assessment of PBs.
-
Key words:
- parabens /
- preservatives /
- environmental exposure /
- human exposure.
-
工业时代以来,大气污染就成为全球最为关注的环境问题之一[1]。大气污染不仅阻碍区域经济的发展,而且对生态环境和居民健康产生各种负面影响[2]。高浓度的大气污染物对人体各类器官产生不良影响[3],导致呼吸道、心血管等病症[1],甚至引发癌症等重型疾病[4],每年全球都会有大量人员因此死亡[5]。尽管近年来空气质量有明显改善的趋势,但短期内空气迅速恶化的事件却时有发生,其中,以传统节日期间燃放烟花爆竹所引起的大气污染物浓度骤升现象最为频繁,且影响范围广大。相较于工业和交通等污染源的持续性与稳定性[1,4,6],燃放烟花爆竹所造成的污染具有短时效性、间断性和集中性[7]。实际上,用烟花爆竹庆祝大型节日活动在世界范围内普遍存在,如:印度的迪帕瓦里节[8]、伊朗的察哈尔—山贝苏里文化节[2]、荷兰的新年之夜[5,9-11]、美国的独立日庆典[12-14]、马尔他群岛[15]和意大利[16]的节日庆祝活动等。因此,学术界对其关注度也越来越高[7,17-20]。
烟花爆竹作为中国庆祝春节的传统习俗已经延续了一千多年[21-23],河南作为中华民族起源与繁荣发展的核心区域,烟花爆竹的燃放历史更是悠久绵长,也是目前典型的烟花爆竹燃放区。爆竹的主要成分是黑火药[30],包含硫磺粉(S)、硝酸钾(KNO3)、木炭粉(C),有的还包含氯酸钾(KClO3),制作烟花时还要加入无机盐和镁粉(Mg)等[13, 30-32]。因此,烟花爆竹的大量燃放会导致SO2等气态污染物和PM等颗粒污染物[33]、重金属[18]及有毒物质[34]等的浓度在短期内迅速上升。近些年来,为了解决春节期间的大气污染问题,政府接连出台了一系列禁燃、禁放、禁售政策,也逐渐得到了居民的认可[21]。关于节日期间烟花爆竹燃放引起的短期大气污染事件,学术界同样进行了深入研究。就国外而言,印度排灯节期间[24-25]大规模烟花活动导致空气质量在短期内迅速恶化,PM颗粒污染物和SO2、NO等气态污染物浓度骤升;荷兰新年期间[9-11],颗粒物和气溶胶的浓度显著升高,还发现烟花事件、PM10浓度和每日死亡率之间存在一定的正相关关系;美国圣诞节[13]和独立日[14]烟花燃放量的升高致使PM2.5和PM10浓度显著高于节日前。我国关于烟花爆竹燃放与空气污染的研究,主要集中在北京[7,26]、南京[6,27]、上海[28]、武汉[29]、成都[30]、广州[31]、海口[32]、石家庄和郑州[21]等省会城市[33],研究内容主要涉及烟花爆竹燃放引起的人体健康和居民安全问题、大气颗粒污染物和主要化学成分的浓度变化、春节前中后不同时期的空气质量变化、烟花燃放是否受到监管的城市之间空气质量的对比分析等。
综上可见,已有研究主要集中在两个方面:在没有禁燃的背景下,探究燃放烟花爆竹对某一孤立城市整体的大气环境质量、污染物浓度及居民健康的影响;在有明确或较为模糊的烟花管控措施下,针对不同城市之间政策的差异性而进行的污染物浓度对比研究。关于传统烟花燃放区,尤其是同一城市或城市群内部,禁燃政策实施前后的对比分析及其实施成效是否显著进行定量化剖析的研究相对较少;另外,已有研究几乎没有考虑由于城市地理位置不同导致的气象条件差异,从而忽视了由此引起的城市空气质量和污染物浓度的差异性。这些不足之处导致了部分公众对政府禁燃政策的适用性看法不一,目前的研究结果也尚不足以彻底打消公众的疑虑,从上而下的政策监管转变为自下而上自觉拥护仍需要一定的时间。
本研究以典型烟花燃放区河南省18个地市2016—2019年逐小时的空气质量指数(AQI)、污染物浓度和气象因子监测数据为基础,分析河南省禁燃政策实施前后春节前、中、后期的空气质量变化特征,并将烟花爆竹对大气污染物的贡献定量化,对实施禁燃政策的成效进行探析,以期为是否有必要在春节期间实施禁燃政策或更进一步加强禁燃力度、扩大禁燃范围的科学决策提供依据。
1. 材料与方法(Materials and methods)
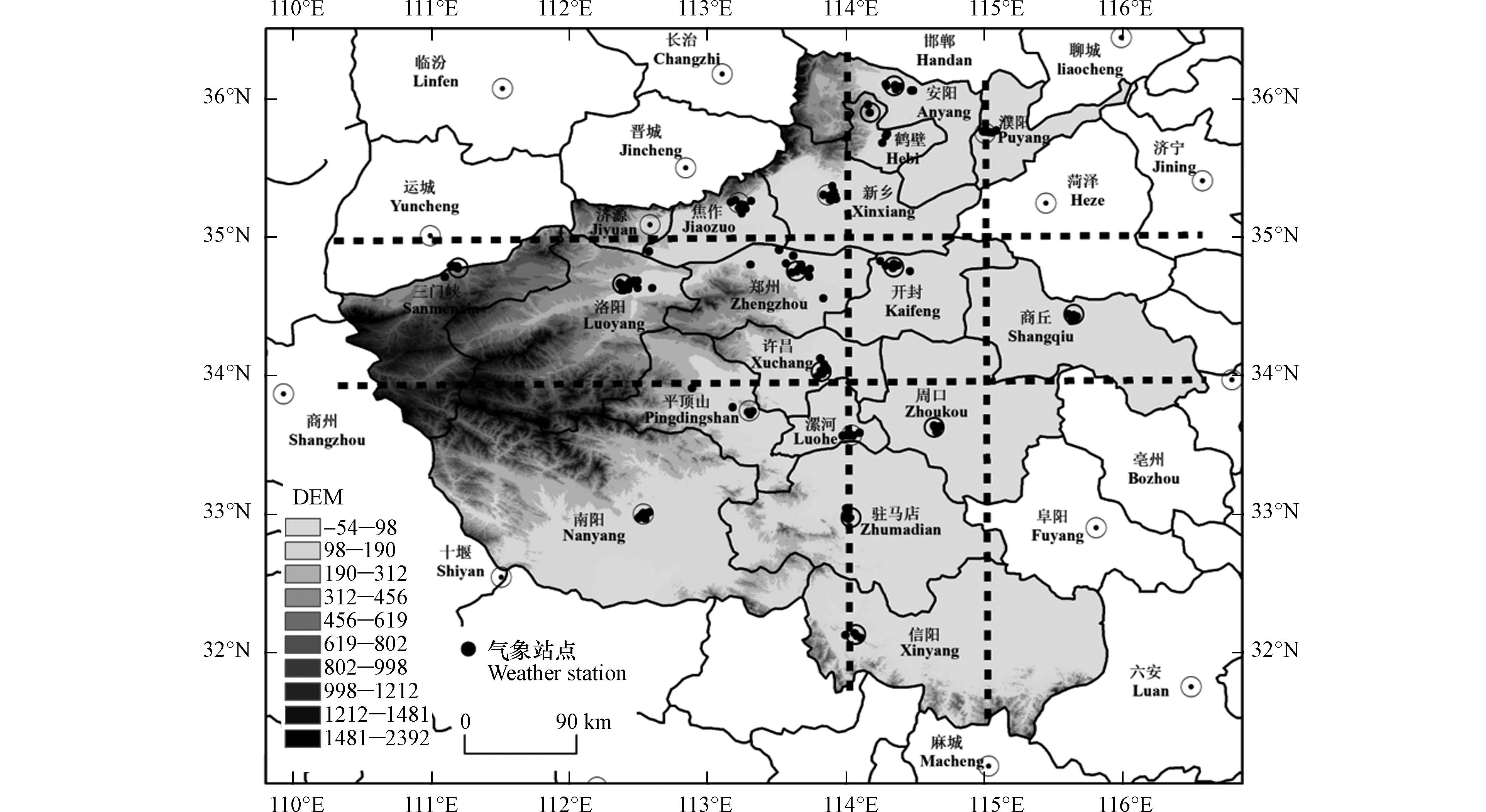
河南省界于110°21'E—116°39'E,31°23N—36°22'N之间(图1),地势自西向东逐渐下降,太行山、伏牛山、桐柏山和大别山沿河南省边界于北、西、南三面呈半环形分布,大气扩散条件较差,易出现静风和逆温现象,不利于污染物的迁移、扩散。河南省18个地市不仅是中原城市群的主体城市,还是京津冀及周边“2+26”城市中的重要交通枢纽,与中部崛起、黄河流域生态保护和高质量发展、“一带一路”建设等重大国家战略的有效实施密切相关。
1.1 数据来源
空气质量指数和污染物(PM2.5、PM10、NO2、SO2、O3、CO)质量浓度数据来源于2016—2019年河南省各地市环境监测中心自动监测站,为全年24 h连续监测数据。气象因子数据来自河南省18个地市地面气象观测站,为全年逐时观测数据,包括温度、气压、相对湿度、风速和降水。AQI是用于定量描述空气质量状况的无量纲指数[34],根据其值范围分为6个等级:0—50(优)、51—100(良)、101—150(轻度污染)、151—200(中度污染)、201—300(重度污染)以及>300(严重污染)。
数据的计算方法参照《环境空气质量标准》(GB3095—2012)和《环境空气质量指数(AQI)技术规定》[34-35]。根据前人研究[8,18,36-37]和中国传统习俗所处的特殊日期[27,30],如小年(腊月二十三)、除夕[29]、正月初一、元宵节[38](正月十五)将春节分为前、中、后期[39]。春节前期为腊月二十二至腊月二十九(8 d)、春节中期为除夕至正月初七(8 d)、春节后期为正月初八至正月十六(9 d)。
1.2 研究方法
1.2.1 距离倒数权重插值法
距离倒数权重(inverse distance weight , IDW)插值法是将散点数据面状化最常用的方法之一。其公式为:
Zi=s∑1Zi×(1√(xi+xj)2−(yi+yj)2)ks∑1(1√(xi+xj)2−(yi+yj)2)k (1) 式中,Zi为已知点I的Z值;Zj为未知点J的估计值;xi、yi为已知点I的坐标;xj、yj为未知点J的坐标;s是已知点的数量;k是确定的幂值,控制局部影响的程度。
1.2.2 空间自相关分析
空间自相关能直观地反映空间邻近单元的相似度,揭示污染物变化的时空分布格局。全局Moran's I用于分析在整个研究区内空气质量指数是否存在集聚或离散特征的分布模式。局部Moran's I可以度量区域内是否存在高值或低值的局域空间集聚。表达式为:
I=n×n∑i=1n∑j=1Wij(xi−¯x)(xj−¯x)n∑i=1n∑j=1Wijn∑i=1(xj−¯x)2 (2) Ii=(xi−¯x)×n∑j=1Wij(xj−¯x)1nn∑i=1(xj−¯x)2 (3) 式中,n为城市站点的总数;xi、xj为分别为i站点和j站点的AQI。
−x 1.2.3 相似性指数法
欧氏距离是衡量多维空间中各个点之间的绝对距离,在计算相似度的场景下,是比较直观、常见的相似度算法。结合前人研究[18,40],采用欧氏距离原理,将算法进一步改进, 并赋予相应权重,得到相似性指数S。表达式为:
S=√Wi(TEMX−TEMy)2+Wj(WDX−WDy)2+Wk(PRSX−PRSy)2+Wl(RHVX−RHVy)2 (4) 式中,Wi、Wj、Wk和Wl分别为气温、风速、气压和相对湿度的权重。TEMx和TEMy分别为某一年的温度值;WDx和WDy分别为某一年的风速值;PRSx和PRSy分别为某一年的气压值;RHVx和RHVy分别为某一年的相对湿度。
2. 结果与讨论(Results and discussion)
2.1 河南省春节空气质量的时空变化特征
2.1.1 空气质量的空间分布特征
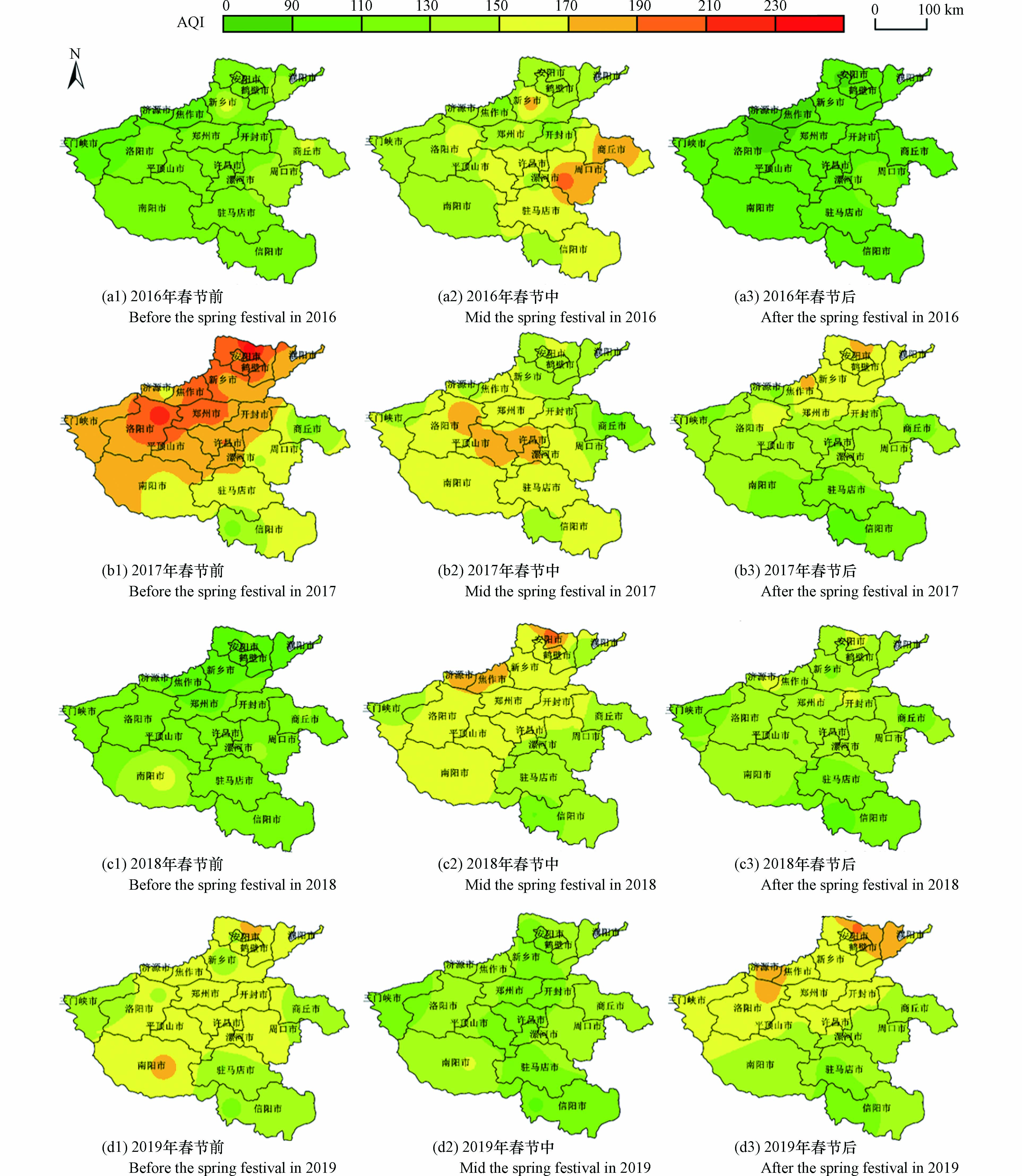
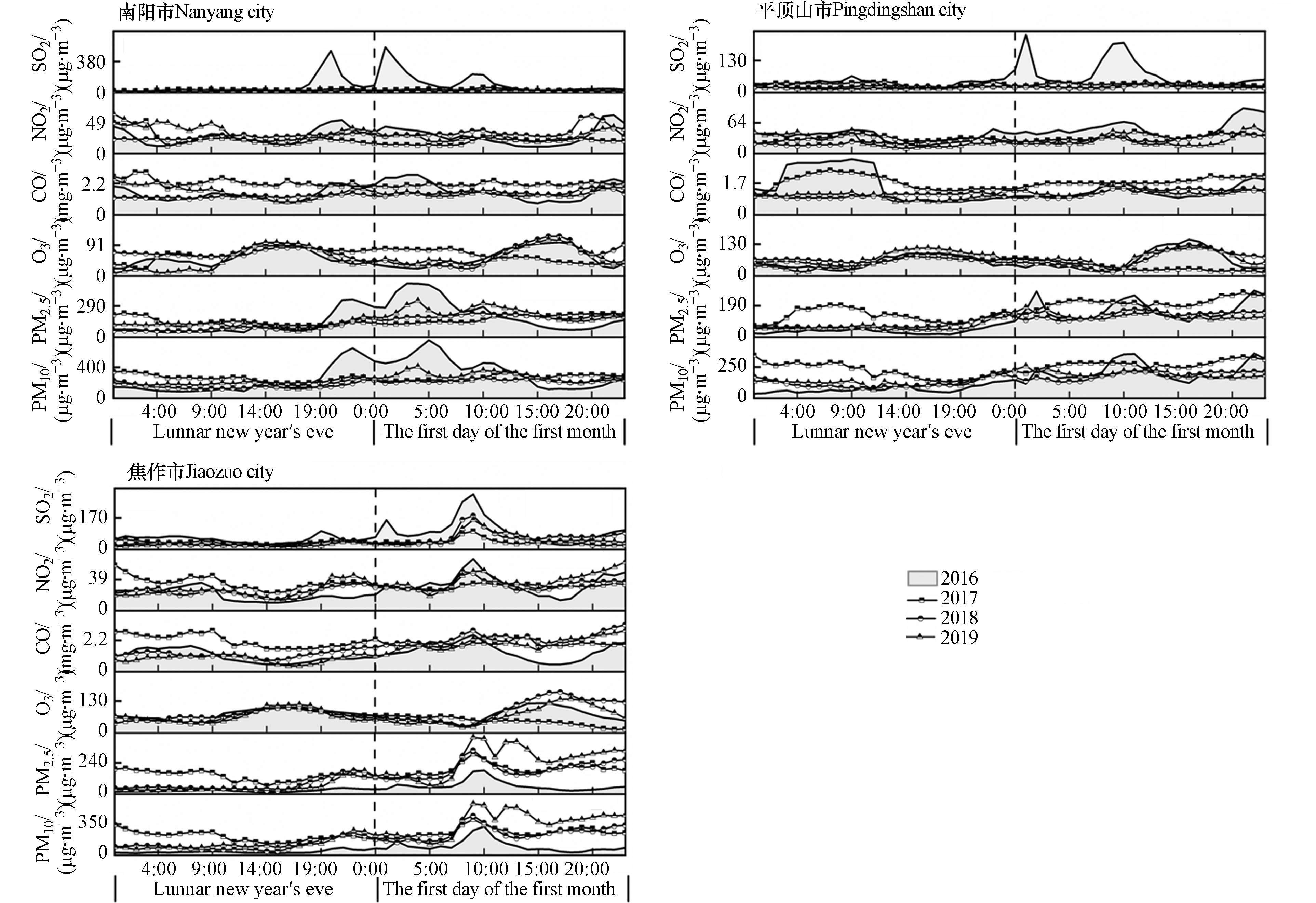
总体来看,2016—2019年河南省春节中期AQI呈逐渐降低的趋势(图2)。其中,2016年春节中期平均AQI明显高于春节前期和后期,且在周口、商丘等东部地区呈现出明显的高值区;春节前期AQI高值区主要位于新乡、商丘和周口等地,随着春节庆典活动到来,烟花爆竹燃放量逐渐攀升,到了春节中期这些地区的AQI率先成为高值区;到了春节后期,随着烟花爆竹燃放量的减少,各地AQI均明显降低。2017年河南省整体空气质量较2016年污染严重。AQI变化呈春节前期到春节后期逐渐下降的趋势,春节前期高值区主要位于安阳、洛阳、焦作等传统重工业区及经济活动密集区;春节中期上述高污染地区的AQI大幅降低,到春节后期全省AQI继续下降。2018年春节前、中、后期的空气质量较2017年均得到了明显的改善。春节前期基本上不存在AQI污染区,春节中期AQI高值区出现在安阳、济源、焦作等北部地区,到春节后期,空气质量整体转好。2019年春节中期AQI明显低于春节前期和后期,是近4年来同期的最低值,但春节前期和后期的AQI较2018年有所增加。
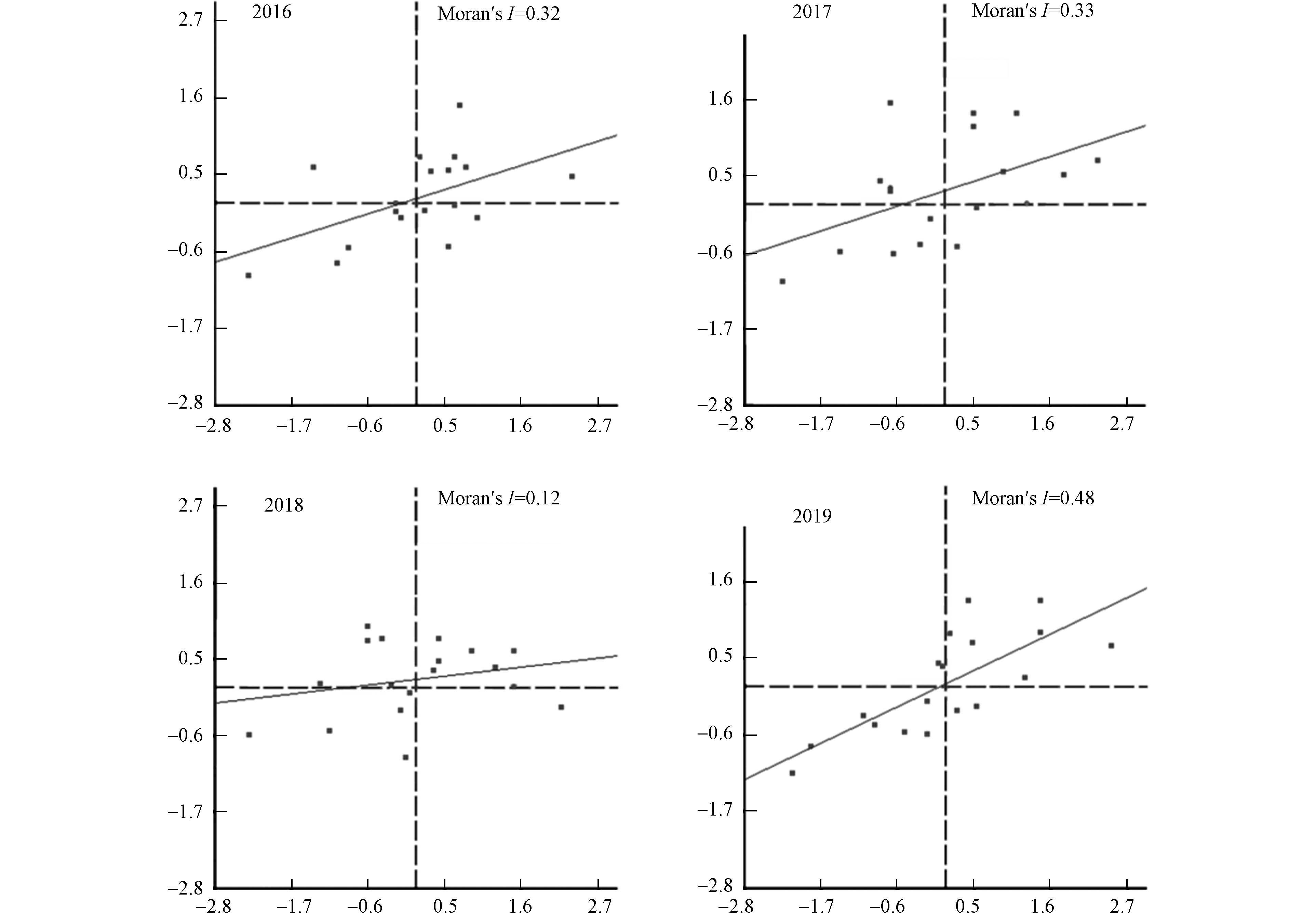
为了揭示河南省各城市之间的AQI空间分布是否存在集聚特征,利用空间自相关方法进行了逐年分析,分别得出全局和局部Moran's I(表1)。从表1可以看出,2017年春节后期、2018年前期和2019年后期P值均小于显著水平0.01,Z得分超过了临界值2.58,达到了99%的置信度,表明河南省各地级市的AQI在空间上呈现出一定的集聚特征。
表 1 2016—2019年河南省春节不同时期AQI空间自相关分析Table 1. Spatial autocorrelation analysis of AQI during different periods of the Spring Festival in Henan Province from 2016 to 20192016 2017 2018 2019 前期Early 中期Mid 后期Late 前期Early 中期Mid 后期Late 前期Early 中期Mid 后期Late 前期Early 中期Mid 后期Late Moran's I −0.15 −0.12 0.12 0.16 0.13 0.34 0.30 0.02 0.04 −0.15 −0.12 0.33 Z −0.63 −0.45 1.28 1.57 1.35 2.84 2.62 0.58 0.73 −0.63 −0.45 2.76 P 0.53 0.65 0.20 0.12 0.18 0.00 0.01 0.56 0.47 0.53 0.65 0.01 根据2016—2019年春节期间空气质量浓度的局部Moran's I散点图(图3)可以看出,4个年份HH区(重污染区与重污染区集聚)的数量都为7,并没有发生数量变化,说明4年间河南省重污染区分布相对较为集中,并没有新增离散地区;LH区(轻度污染区环绕重污染区)呈先增后减的趋势,由2016年的1个增至2017的4个和2018年的5个,2019年又降至1个;HL区(重污染区包围轻度污染区)呈下降趋势,由2016年的6个降至2019年的2个;LL区(轻度污染区与轻度污染区集聚)的数量逐年增加,由2016年的4个升至2019年的7个。污染物高值区逐渐向低值区转换及HL区的减少和LL区的增多,间接体现了不同城市之间的污染物通道传输作用,表明了河南省18个城市之间空气质量的相互作用机制。
2.1.2 空气质量的时间变化特征
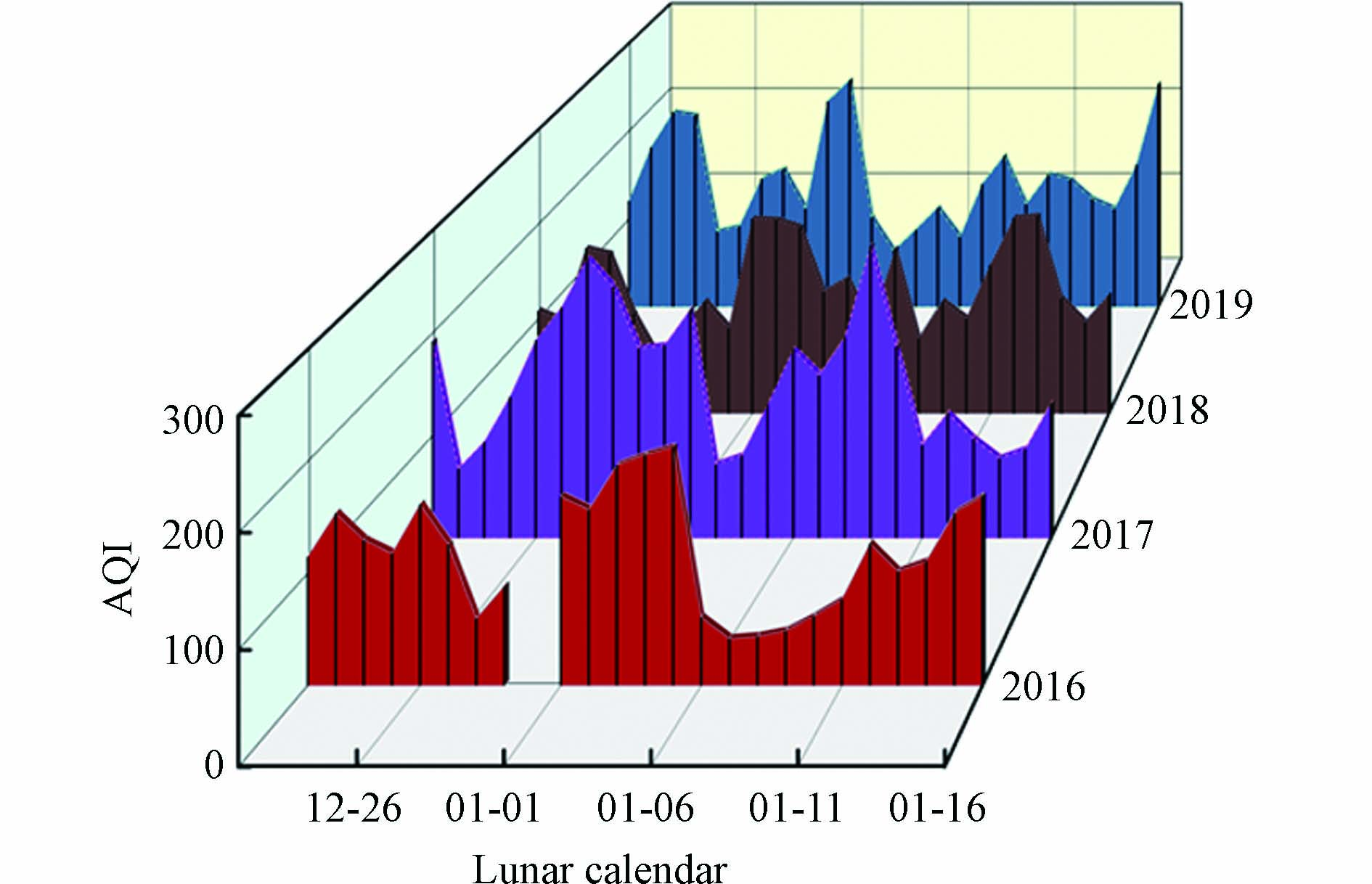
从2016—2019年河南省春节时期的AQI日均值(图4)可以看出,AQI高值区出现的时间稍有提前。2016年AQI高值主要集中在正月初一至初五,达到中度污染水平;春节后期AQI持续降低,至正月初七达到最小值,为42;接着于正月十六达到第二峰值,为169。2017年春节前、中、后期AQI呈逐级递减的趋势,高值期稍有提前,出现在腊月二十六至二十九,腊月二十八达到峰值(273);正月初三至正月初五传统高峰期空气质量严峻形势呈弱化趋势,AQI值于正月初三降低至最小值(72),继而升高,于正月初九达到高值(285),正月十六再次降低至131。2018年春节中期的AQI达到4年来同期的最高水平(155),而在传统高值时期较低,除夕和正月十六分别为91和125。2019年春节中期的AQI在4年同期中处于最低值,且明显优于春节前期和后期。这与伊朗德黑兰地区在庆祝活动后的AQI变化趋势是一致的,该地区的AQI在庆祝活动之后的夜间上升到200以上[2]。同时对春节前、中、后期的AQI与各气象因子之间的相关关系进行分析,发现春节前期相对湿度与AQI的相关性最强,春节中期和后期则分别是气温和降水与AQI关系密切。但气象因子与AQI的相关系数在年际间的变幅并不明显。可见,气象因子并不是同时期春节空气质量显著变化的主要原因,而春节期间的烟花活动可能是造成短期AQI变化的主要原因。
2.2 禁燃政策的实施成效分析
2.2.1 河南省烟花爆竹禁燃政策
为打赢大气污染攻坚战,河南省于2017年开始实施一系列措施[41],要求县级及以上城市建成区全时段禁止销售、燃放烟花爆竹,以防出现春节期间污染物浓度骤升、大面积爆表的现象(表2)。2018年,该政策通过扩大范围和增大强度得到了进一步加强,全省各地级市主城区均全时段禁燃。2019年8月,河南省再次加强禁燃力度,相继出台全域全时段烟花爆竹禁售禁放的政策规定[21]。
表 2 2016—2019年春季期间河南省烟花爆竹禁燃政策变化Table 2. Changes in the ban on fireworks and firecrackers during the Spring Festival in Henan Province from 2016 to 20192016 2017 2018 2019 安阳 无 市主城区及龙安腊梅园示范区 维持 扩大 濮阳 无 市主城区 扩大 维持 鹤壁 无 市主城区 扩大 维持 新乡 无 市建成区 扩大 扩大 焦作 无 市建成区 维持 维持 济源 无 市区1环路内 扩大 维持 郑州 无 市5区、4个开发区 扩大 维持 开封 无 市主城区 维持 扩大 商丘 无 市主城区 扩大 扩大 洛阳 无 市建成区限放 扩大、升级 维持 三门峡 无 市主城区 维持 扩大 平顶山 无 市4个开发区 扩大 维持 许昌 无 市主城区 维持 扩大 漯河 无 市主城区 维持 扩大 周口 无 市主城区 维持 扩大 驻马店 无 市主城区 维持 扩大 南阳 无 市主城区 维持 扩大 信阳 无 市主城区 维持 扩大 注:“无”表示未施行禁燃政策;“维持”表示禁燃政策所规定的禁燃范围保持不变;“扩大”表示禁燃政策所规定的禁燃范围扩大至市主城区及县(区)建成区;“升级”表示禁燃政策由限放升级为禁放. Note: “None”: the burning ban policy has not been implemented. “Maintain”: the range of ban on burning under the burning ban policy remains unchanged; “Expanded”: the burning ban range stipulated by the burning ban policy is extended to the main urban areas and counties of the city (Area) built-up area; “upgrade”: the burning ban policy has been upgraded from restricted discharge to no discharge. 2.2.2 禁燃对相同纬度城市的影响效果分析
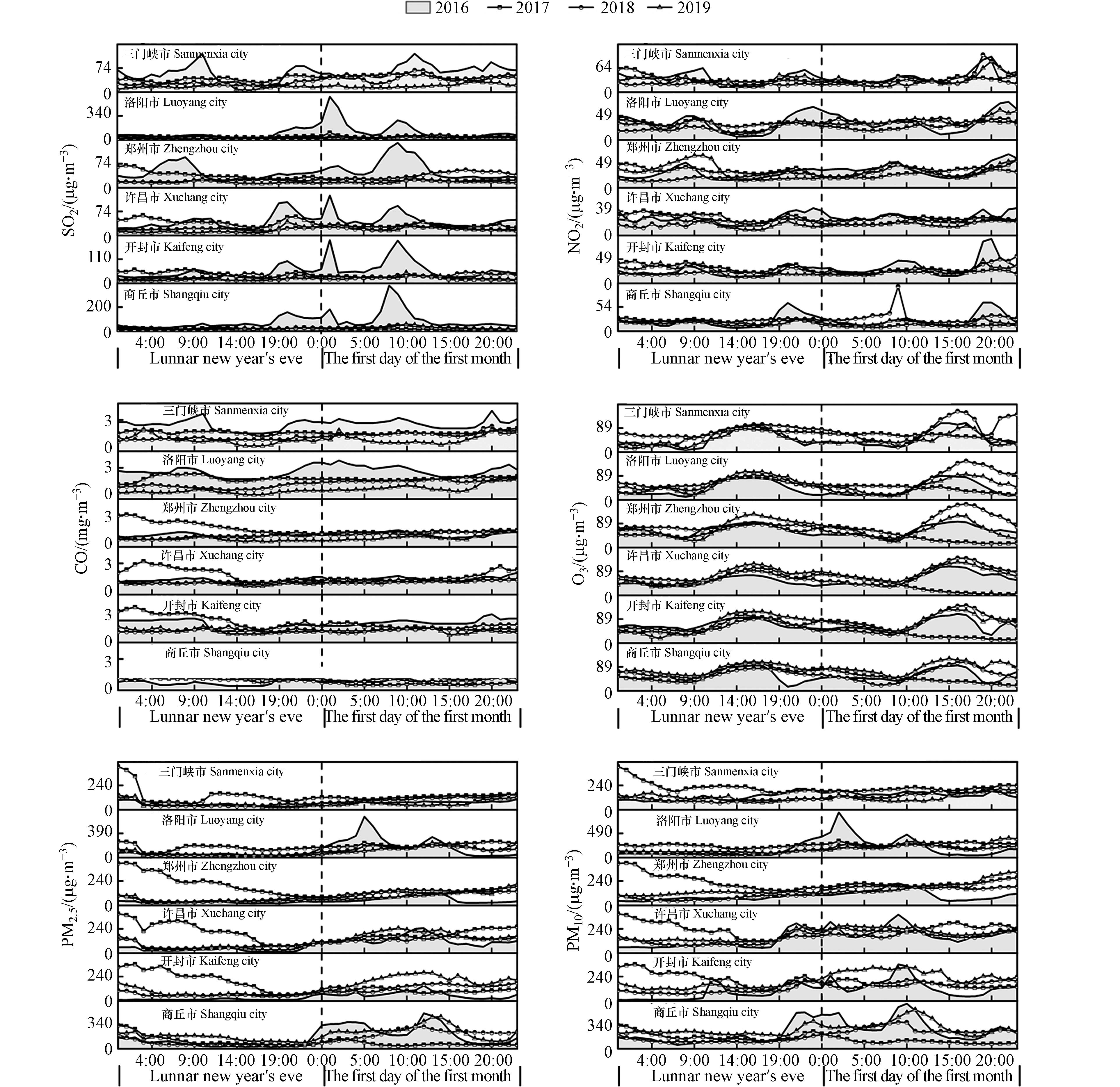
纬度差异会造成城市内部太阳辐射和气象条件的差异,进而对污染物的产生、扩散及迁移产生影响。为了减弱上述影响,选择同属于暖温带大陆性季风气候,且位于同一纬度带(34°N—35°N之间)的城市,包括三门峡、洛阳、郑州、开封、商丘和许昌(图1)。通过对该6个城市2016—2019年除夕至正月初一逐小时污染物浓度变化趋势进行分析(图5),评估禁燃政策的实施成效。
在年际尺度上,6个城市连续4年间SO2浓度均呈波动变化,且2016年高于其他年份,禁燃政策实施后的3年间SO2浓度年际差异较小,呈逐年下降的趋势,可见禁燃政策的实施对SO2浓度有“削峰”作用。在年间尺度上,从2016年除夕19:00烟花爆竹大量燃放开始,6个城市SO2浓度均呈波动上升趋势,于正月初一的2:00达到峰值(烟花燃放基本停滞),5:00逐渐降低至谷值;第二峰值则出现在正月初一的7:00—11:00,12:00之后逐渐降低。这一特征与印度艾哈迈达巴德市排灯节晚上至次日凌晨SO2浓度的变化趋势一致[18]。
除夕至正月初一期间6个城市4年间NO2的变化趋势接近,且变化幅度较小,可见同时期的烟花燃放可能不是其主要污染源。这一结果与Garg等[36]的研究相一致。6个城市NO2的峰值和高值区集中出现在9:00和20:00,这主要受到居民出行早、晚高峰的影响,再加上春节期间人流量及车流量剧增,使得NO2排放量在短时间内达到峰值[42]。CO的高值区主要在除夕0:00—9:00和初一20:00之后。其中,三门峡和洛阳禁燃政策实施后CO浓度较2016年降低;而郑州、开封和商丘在2017年除夕凌晨,CO浓度高于2016年同时期,在其他时间相差不大,且变化幅度和变化速率均较小。O3浓度没有明显的年际变化,均呈现午后上升、夜间下降的趋势。在年间尺度上,O3浓度变化呈“双峰”趋势,即9:00开始上升,14:00—15:00达到峰值,接着开始下降,6:00—7:00达到最小值。这与安阳[43]和郑州[44]的O3日变化分析结果相似。O3浓度变化主要与光化学反应有关,与烟花爆竹燃放的关系不密切。
烟花爆竹燃放是春节期间颗粒污染物PM2.5和PM10的重要来源[37],其突变上升值大多位于集中燃放时间。禁燃对洛阳和商丘颗粒污染物浓度降低的成效尤为明显,尤其在除夕19:00至初一的2:00这个烟花爆竹集中燃放的时段,2017—2019年期间的峰值较2016年明显降低,且高峰期持续时间也明显缩短。
综上可见,禁燃对SO2、PM2.5和PM10的影响最为明显,这与伊朗德黑兰地区的研究结果相一致[2]。对NO2和O3来说,禁燃成效并不明显,这与意大利米兰的研究结果相近[16],4年间其浓度变化趋势没有明显的突变值,且变化幅度和浓度范围也均大致相近。禁燃对CO浓度的降低有一定的成效,但对于部分城市效果并不明显,可能与当地禁燃政策实施的强度和禁燃范围、禁燃时间有一定的关系,尚需进一步研究。
2.2.3 禁燃对相同经度城市的影响效果分析
经度不同也会引起城市内部污染物传输、扩散及迁移,为减弱这种影响,选择河南省同一经度地带(114°E—115°E之间)的6个城市,分别为安阳、鹤壁、开封、周口、驻马店和信阳(图1),开展禁燃政策实施成效分析(图6)。
由图6可见,安阳和鹤壁污染物浓度变化趋势及峰值出现的时刻相近,2017—2019年SO2浓度明显低于2016年,且除夕24:00后出现的两个峰值于正月初一均未出现,表明禁燃对两市SO2浓度降低效果明显。除夕至正月初一期间安阳和鹤壁的NO2、O3和CO浓度并未出现2016年原有峰值的消失,可见禁燃对其影响不明显。禁燃对两市的颗粒污染物有一定的影响,2016年正月初一1:00的PM2.5和PM10峰值及3:00的PM10峰值在2017—2019年均未出现,但正月初一8:00附近的峰值连续4年均未消失,其原因有待进一步探究。
开封、周口、驻马店和信阳4市污染物浓度变化特征较为相似。开封和周口2016年除夕至初一SO2浓度变化呈三峰趋势,驻马店和信阳呈双峰趋势,而到了2017—2019年这些峰值均不再凸显。除夕至初一禁燃对周口和信阳NO2浓度有一定的“削峰”作用,尤其是对两市2016年除夕21:00出现的NO2峰值削减更为明显。禁燃对4市O3和CO浓度的影响不明显,2017—2019年浓度与2016年基本持平。禁燃对PM2.5和PM10影响较为明显,表现最为突出的是除夕19:00至正月初一10:00,该时间段2016年出现的峰值被削低,2017—2019年变化特征趋于平缓,达到浓度高值区的时间明显延缓。
2.2.4 禁燃对相似气象要素城市的影响效果分析
对河南省各地市同时期气象因子的相似程度进行分析(表3),取相似程度最高的6个城市(南阳、信阳、洛阳、平顶山、鹤壁和焦作),探究在相似气象要素条件下禁燃对污染物浓度的影响(图7)。其中,信阳、洛阳和鹤壁前文已述,因此该部分不再赘述。
表 3 2016—2019年河南省各气象因子相似系数分布表Table 3. Correlation coefficients of various meteorological factors in Henan Province from 2016 to 2019排名 Rank 城市 City 相似系数 Similarity coefficient 排名 Rank 城市 City 相似系数 Similarity coefficient 1 南阳市 0.680 10 周口市 0.728 2 信阳市 0.708 11 郑州市 0.732 3 洛阳市 0.709 12 开封市 0.736 4 平顶山市 0.717 13 漯河市 0.743 5 鹤壁市 0.720 14 商丘市 0.745 6 焦作市 0.721 15 许昌市 0.750 7 驻马店市 0.722 16 三门峡市 0.758 8 新乡市 0.724 17 安阳市 0.765 9 濮阳市 0.726 18 济源市 0.774 从图7可见,南阳、焦作和平顶山3市污染物浓度变化特征基本接近,峰值出现的时间和频率大致吻合,SO2、PM2.5和PM10的变化趋势与禁燃的响应最好,尤其是在烟花爆竹大量燃放期,即除夕19:00至正月初一凌晨1:00。NO2浓度的变化与禁燃呈弱相关或不相关,2017—2019年的浓度变化趋势与2016年相比差异较小,变化幅度也较小。O3和CO浓度变化与禁燃之间的关系也不显著,4年间的变化特征并没有随着禁燃政策的实施、禁燃力度的加强和禁燃范围的扩大而发生明显变化。
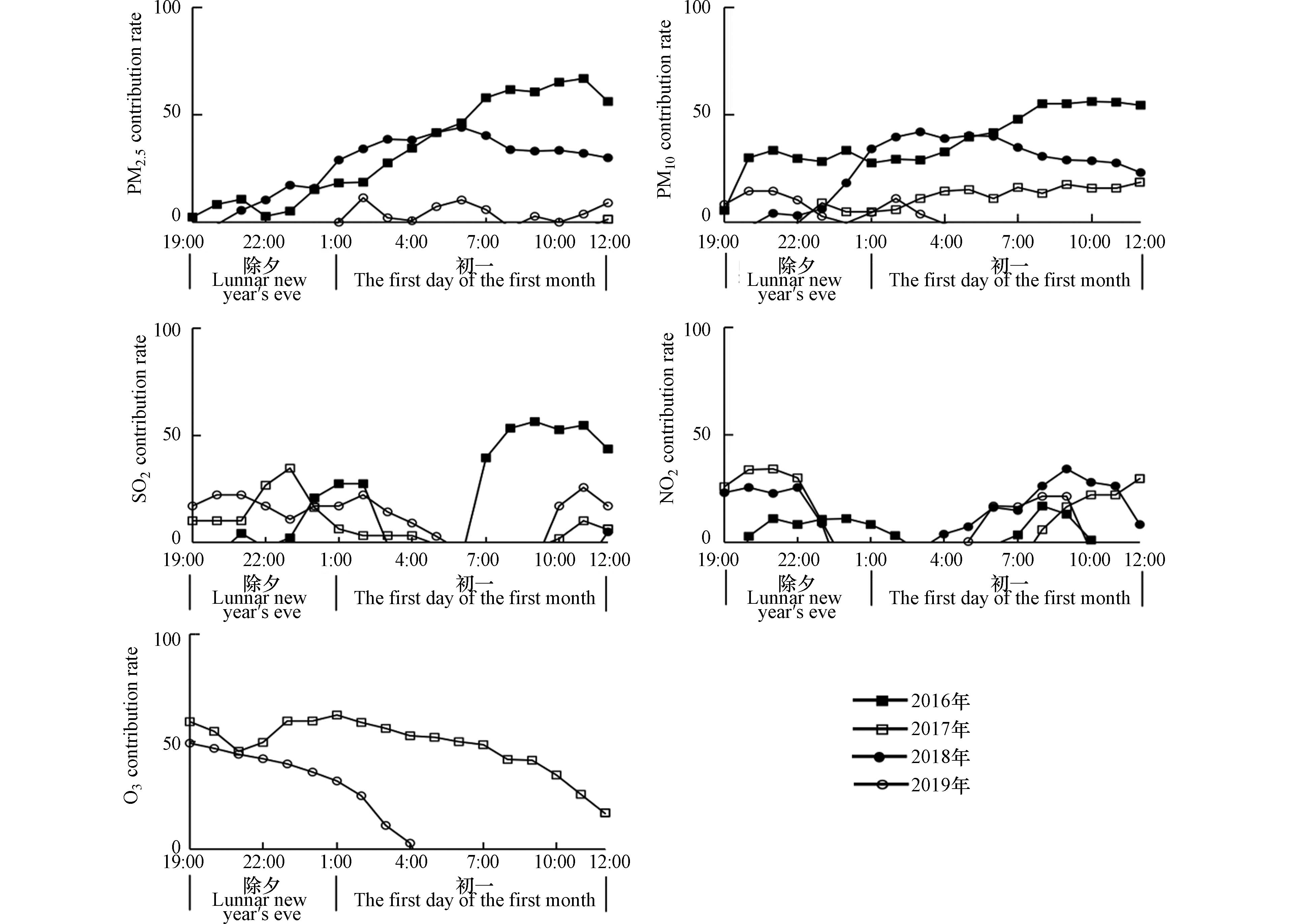
2.2.5 烟花对污染物贡献的定量化测度
为了定量评估河南省禁燃政策的实施成效,参考前人研究[31,41,45],结合河南省大气污染特征,将烟花爆竹燃放对污染物浓度的贡献进行定量化。采用相对比值法,从与烟花燃放关系并不显著的NO2、O3和CO中选取参考指标。由于NO2易受春节车流量和过境量增加等人为因素影响,O3易受到太阳辐射和温度等自然因素的影响,在光照条件下由NO2等前体物质转变而成,故不能作为参考指标。CO与烟花燃放响应既不显著,又不易受自然和人为因素影响,故可以作为参考指标来定量评估烟花燃放对污染物浓度的贡献,方法如下[21,28]:
Mfw=M−Mnfw=M−CO×MnfwCOnfw (6) 式中,Mfw为燃放烟花爆竹对污染物的贡献量,M为实测浓度,Mnfw为污染物估算浓度,CO为实测浓度,(M/CO)nfw为非燃放时段污染物M与CO平均浓度的比值。根据燃放习俗,规定除夕19:00至正月初一11:00为集中燃放时段,除夕0:00至19:00,正月初一11:00至24:00为非燃放时段。
利用2016—2019年河南省18个地市除夕至正月初一全时段、集中燃放时段和非集中燃放时段污染物浓度进行变异系数测算(表4),结果显示,3个时段中CO的标准差最小,且其在集中燃放时段最小,说明CO的浓度变化在集中燃放期波动较小,进一步验证了烟花爆竹对CO浓度贡献较小,采用其作为参考指标来估算污染物浓度具有参考价值;NO2、O3和CO的变异系数较小且较为接近,说明其在传统春节期间变化幅度较小,变化趋势稳定,烟花爆竹对其浓度变化影响不显著。
表 4 2016—2019年河南省春节期间不同时段污染物变异系数分析Table 4. Analysis for the coefficient of variation of pollutants during different periods of the Spring Festival in Henan Province from 2016 to 2019SO2/(μg·m−3) NO2/(μg·m−3) CO/(mg·m−3) O3/(μg·m−3) PM2.5/(μg·m−3) PM10/(μg·m−3) 全时段平均值 41.38 28.29 1.53 63.06 120.97 182.77 集中燃放时段平均值 58.03 28.58 1.52 54.58 148.92 220.89 非集中燃放时段平均值 32.25 28.12 1.54 67.71 105.65 161.86 全时段标准差 46.66 12.31 0.70 29.12 87.05 103.09 集中燃放时段标准差 69.35 11.22 0.65 19.20 91.10 108.98 非集中燃放时段标准差 22.33 12.86 0.72 32.40 80.75 93.34 全时段变异系数 1.13 0.44 0.45 0.46 0.72 0.56 集中燃放时段变异系数 1.20 0.39 0.42 0.35 0.61 0.49 非集中燃放时段变异系数 0.69 0.46 0.47 0.48 0.76 0.58 选取交通密集型、传统庆典活动盛大区郑州市来定量探究烟花爆竹燃放对污染物浓度的贡献率和持续贡献时间(图8)。从图8可以看出,2016年是烟花爆竹对PM2.5、PM10和SO2贡献率和贡献时间最大的一年,贡献率分别在初一的11:00、10:00和9:00达到峰值,分别为66.98%、56.32%和56.49%,贡献持续时间分别为18 h、18 h和11 h。2017年禁燃政策初步实施即取得了一定的成效,较2016年集中燃放时段烟花对污染物浓度的贡献量明显降低,对PM2.5、PM10和SO2贡献率分别为26.55%、6.64%和6.85%。随着禁燃力度的加强和禁燃范围进一步扩大,2018年和2019年烟花对上述3类污染物浓度的贡献量进一步降低,到2019年烟花对PM2.5、PM10和SO2最大贡献率分别降至11.54%、14.52%和25.71%,分别位于初一2:00、除夕21:00和初一10:00,平均贡献率分别为−0.63%、−0.23%和9.05%,持续贡献时间分别为11 h、8 h和14 h。烟花对NO2和O3的贡献率变化幅度并不明显,表明烟花并不是春节期间NO2和O3的主要来源,这也与烟花爆竹的成分燃烧所产生的污染物类型有关。
3. 结论(Conclusion)
基于河南省18个地市2016—2019年逐小时空气质量、污染物浓度和气象因子数据,在分析区域内整体的空气质量时空变化的基础上,探讨禁燃政策的实施成效,并将烟花爆竹对各污染物的贡献率和贡献时间进行定量化。
(1)2016—2019年河南省春节中期的空气质量呈现逐渐改良的趋势,且高值区出现的时间稍有提前,省内城市间表现为污染物高值区逐渐向低值区转换及高低集聚区减少和低低集聚区增多的特点,说明邻近城市的污染物传输通道作用在一定程度上也影响着空气质量。
(2)禁燃政策的实施对SO2、PM2.5和PM10的影响最为明显,在除夕至正月初一的污染物浓度短期骤升现象减少,呈现出 “削峰”作用;对NO2、O3、CO的影响较小,即烟花爆竹燃放不是引起春节期间其污染的主要原因,而是由燃放产生的污染物类型决定的。
(3)2016年是烟花爆竹对污染物浓度贡献量最大、贡献持续时间最长的一年,对SO2、PM2.5和PM10贡献率分别于初一11:00、10:00和9:00达到峰值,分别为66.98%、56.32%和56.49%,持续时间分别为18 h、18 h和11 h。到2019年,烟花爆竹对PM2.5、PM10和SO2最大贡献率分别降至11.54%、14.52%和25.71%,分别在初一2:00、除夕21:00和初一10:00。
-
表 1 国内外地表水体系中PBs的浓度水平分布
Table 1. Exposure levels of PBs in surface water in various regions
MeP EtP PrP BuP ∑PBs 年份Year 参考文献Reference 中国北京城市河流(n=350) 浓度范围/(ng·L−1)中位浓度/(ng·L−1)检出率/% 0.81—9206.45100 <LOD—2940.5474.4 <LOD—5650.7770.8 <LOD—41.5<LOD35 0.82—16549.44100 2016 [22] 中国湘江(n=86) 浓度范围/(ng·L−1)中位浓度/(ng·L−1)检出率/% 1.4—3173.96.4100 <LOD—87.01.383.7 <LOD—1040.41.897.7 <LOD—9.5<LOD4.7 — 2018 [23] 中国长江(n=120) 浓度范围/(ng·L−1)中位浓度/(ng·L−1)检出率/% 0.23—42.12.86100 <LOD—5.660.2295 <LOD—18.80.9997.5 — — 2018 [24] 中国九龙江 浓度范围/(ng·L−1)检出率/% 1.41—68.8100 — 0.44—69.9100 — — 2015 [25] 中国黄河(n=74) 浓度范围/(ng·L−1)中位浓度/(ng·L−1)检出率/% 1.92—32.65.7100 0.15—1.110.32288 1.00—21.84.31100 0.04—0.990.143100 3.31—55.211.8100 2019 [27] 中国淮河(n=48) 浓度范围/(ng·L−1)中位浓度/(ng·L−1)检出率/% 11.0—15439.5100 0.23—0.690.33390 2.66—12.76.69100 <LOD—0.640.0464 15.0—16447.5100 2019 [26] 中国台湾垦丁(n=24) 浓度范围/(ng·L−1)中位浓度/(ng·L−1)检出率/% 4.9—64.934.9100 <LOD—1.560.5440 <LOD—36.417.8100 <LOD—0.80.260 — 2018 [27] — 文献中并未开展该目标物的研究. LOD, limit of detection 检出限. 表 2 国内外血液中PBs的浓度水平分布
Table 2. Exposure levels of PBs in blood samples in various countries
MeP EtP PrP BuP 年份Year 参考文献Reference 中国大学生(n=196) 浓度范围/(ng·mL−1)中位浓度/(ng·mL−1)检出率/% <LOD—31.80.8482 <LOD—73.70.1757 <LOD—12.10.7077 <LOD—19.4<LOD41 2020 [59] 中国孕妇(n=162) 浓度范围/(ng·mL−1)中位浓度/(ng·mL−1)检出率/% 0.13—14.83.0888.3 0.02—9.230.3368.5 — 0.01—0.050.010.6 2019 [60] 西班牙女性月经血(n=57) 浓度范围/(ng·mL−1)中位浓度/(ng·mL−1)检出率/% 0.2—45.541.4198.2 0.2—16.00.4059.6 0.2—16.00.6359.6 0.2—16.00.4059.6 2020 [61] 捷克男性(n=57) 浓度范围/(ng·mL−1)中位浓度/(ng·mL−1)检出率/% <LOD—16.00.5240 <LOD—0.360.365 <LOD—0.750.5628 <LOD<LOD0 2017 [62] 丹麦孕妇(n=502) 浓度范围/(ng·mL−1)中位浓度/(ng·mL−1)检出率/% <LOD—420.50.8569.9 <LOD—15.1<LOD35.5 <LOD—19.510.1059.2 <LOD—7.67<LOD20.5 2019 [63] 印度孕妇(n=53) 浓度范围/(ng·mL−1)中位浓度/(ng·mL−1)检出率/% 0.89—55.2420.92100 <LOD—11.241.9720 1.08—63.5819.2288 0.47—10.221.1123 2016 [64] 丹麦孕妇(n=75) 浓度范围/(ng·mL−1)中位浓度/(ng·mL−1)检出率/% <LOD—1.080.3847.7 <LOD—0.240.1046.6 100% <LOD<LOD1.4 2021 [65] 中国孕妇(n=95) 血浆 浓度范围/(ng·mL−1)中位浓度/(ng·mL−1)检出率/% <LOD—100.2159 <LOD—6.5<LOD7 <LOD—1.8<LOD46 <LOD—0.47<LOD16 2020 [66] 脐带血清 浓度范围/(ng·mL−1)中位浓度/(ng·mL−1)检出率/% <LOD—9.50.1858 <LOD—6.4<LOD12 <LOD—2.6<LOD40 <LOD—0.52<LOD12 2020 [66] 西班牙女性月经血(n=25) 浓度范围/(ng·mL−1)检出率/% 0.9—45.596 0.8—16.060 0.4—9.092 0.4—1.056 2016 [53] — 文献中并未开展该目标物的研究. LOD 方法检出限. -
[1] GARCÍA-GARCÍA R, SEARLE S S. Preservatives: food use[M]//Encyclopedia of Food and Health. Amsterdam: Elsevier, 2016: 505-509. [2] SUREKHA M, REDDY S M. Preservatives. classification and properties[M]// Encyclopedia of Food Microbiology, 2014: 69-75 [3] 侯辉. 我国主要食品防腐剂安全性分析 [J]. 品牌与标准化, 2018(4): 86-88. doi: 10.3969/j.issn.1674-4977.2018.04.019 HOU H. Analysis on the safety of main food preservatives in China [J]. Brand & Standardization, 2018(4): 86-88(in Chinese). doi: 10.3969/j.issn.1674-4977.2018.04.019
[4] GAO C J, KANNAN K. Phthalates, bisphenols, parabens, and triclocarban in feminine hygiene products from the United States and their implications for human exposure [J]. Environment International, 2020, 136: 105465. doi: 10.1016/j.envint.2020.105465 [5] LIAO C Y, CHEN L X, KANNAN K. Occurrence of parabens in foodstuffs from China and its implications for human dietary exposure [J]. Environment International, 2013, 57/58: 68-74. doi: 10.1016/j.envint.2013.04.001 [6] LIAO C Y, LIU F, KANNAN K. Occurrence of and dietary exposure to parabens in foodstuffs from the United States [J]. Environmental Science & Technology, 2013, 47(8): 3918-3925. [7] GÁLVEZ-ONTIVEROS Y, MOSCOSO-RUIZ I, RODRIGO L, et al. Presence of parabens and bisphenols in food commonly consumed in Spain [J]. Foods (Basel, Switzerland), 2021, 10(1): 92. [8] MAHER H M, ALZOMAN N Z, ALMESHAL M A, et al. Quantitative screening of parabens in Ready-to-eat foodstuffs available in the Saudi market using high performance liquid chromatography with photodiode array detection [J]. Arabian Journal of Chemistry, 2020, 13(1): 2897-2911. doi: 10.1016/j.arabjc.2018.07.019 [9] 杨艳伟, 刘思然, 罗嵩, 等. 化妆品中防腐剂使用情况调查 [J]. 环境卫生学杂志, 2012, 2(2): 56-59. doi: 10.13421/j.cnki.hjwsxzz.2012.02.009 YANG Y W, LIU S R, LUO S, et al. Investigation on the use of preservatives in cosmetics [J]. Journal of Environmental Hygiene, 2012, 2(2): 56-59(in Chinese). doi: 10.13421/j.cnki.hjwsxzz.2012.02.009
[10] 程文静, 张佳婵, 杨依林, 等. 市售护肤品防腐剂使用情况调查及未来发展趋势探究 [J]. 日用化学工业, 2021, 51(7): 679-685. doi: 10.3969/j.issn.1001-1803.2021.07.014 CHENG W J, ZHANG J C, YANG Y L, et al. Investigation on the use of preservatives in skin care products and exploration on the future development trend [J]. China Surfactant Detergent & Cosmetics, 2021, 51(7): 679-685(in Chinese). doi: 10.3969/j.issn.1001-1803.2021.07.014
[11] PEDERSEN S, MARRA F, NICOLI S, et al. In vitro skin permeation and retention of parabens from cosmetic formulations [J]. International Journal of Cosmetic Science, 2007, 29(5): 361-367. doi: 10.1111/j.1468-2494.2007.00388.x [12] CHENG L, HUANG K, CUI H R, et al. Coiled molecularly imprinted polymer layer open-tubular capillary tube for detection of parabens in personal care and cosmetic products [J]. Science of the Total Environment, 2020, 706: 135961. doi: 10.1016/j.scitotenv.2019.135961 [13] ESTEVE C, HERRERO L, GÓMARA B, et al. Fast and simultaneous determination of endocrine disrupting compounds by ultra-high performance liquid chromatography-tandem mass spectrometry [J]. Talanta, 2016, 146: 326-334. doi: 10.1016/j.talanta.2015.08.064 [14] GUO Y, KANNAN K. A survey of phthalates and parabens in personal care products from the United States and its implications for human exposure [J]. Environmental Science & Technology, 2013, 47(24): 14442-14449. [15] GUO Y, WANG L, KANNAN K. Phthalates and parabens in personal care products from China: Concentrations and human exposure [J]. Archives of Environmental Contamination and Toxicology, 2014, 66(1): 113-119. doi: 10.1007/s00244-013-9937-x [16] MA W L, ZHAO X, LIN Z Y, et al. A survey of parabens in commercial pharmaceuticals from China and its implications for human exposure [J]. Environment International, 2016, 95: 30-35. doi: 10.1016/j.envint.2016.07.013 [17] MOLINS-DELGADO D, DÍAZ-CRUZ M S, BARCELÓ D. Ecological risk assessment associated to the removal of endocrine-disrupting parabens and benzophenone-4 in wastewater treatment [J]. Journal of Hazardous Materials, 2016, 310: 143-151. doi: 10.1016/j.jhazmat.2016.02.030 [18] KAPELEWSKA J, KOTOWSKA U, KARPIŃSKA J, et al. Occurrence, removal, mass loading and environmental risk assessment of emerging organic contaminants in leachates, groundwaters and wastewaters [J]. Microchemical Journal, 2018, 137: 292-301. doi: 10.1016/j.microc.2017.11.008 [19] MA W L, ZHAO X, ZHANG Z F, et al. Concentrations and fate of parabens and their metabolites in two typical wastewater treatment plants in northeastern China [J]. Science of the Total Environment, 2018, 644: 754-761. doi: 10.1016/j.scitotenv.2018.06.358 [20] MAO H Y, LI H P, LI Y, et al. Four typical personal care products in a municipal wastewater treatment plant in China: Occurrence, removal efficiency, mass loading and emission [J]. Ecotoxicology and Environmental Safety, 2020, 188: 109818. doi: 10.1016/j.ecoenv.2019.109818 [21] GONZÁLEZ-MARIÑO I, QUINTANA J B, RODRÍGUEZ I, et al. Evaluation of the occurrence and biodegradation of parabens and halogenated by-products in wastewater by accurate-mass liquid chromatography-quadrupole-time-of-flight-mass spectrometry (LC-QTOF-MS) [J]. Water Research, 2011, 45(20): 6770-6780. doi: 10.1016/j.watres.2011.10.027 [22] LI W H, GAO L H, SHI Y L, et al. Spatial distribution, temporal variation and risks of parabens and their chlorinated derivatives in urban surface water in Beijing, China [J]. Science of the Total Environment, 2016, 539: 262-270. doi: 10.1016/j.scitotenv.2015.08.150 [23] LU J, LI H P, LUO Z F, et al. Occurrence, distribution, and environmental risk of four categories of personal care products in the Xiangjiang River, China [J]. Environmental Science and Pollution Research, 2018, 25(27): 27524-27534. doi: 10.1007/s11356-018-2686-7 [24] MA X Q, WAN Y J, WU M Y, et al. Occurrence of benzophenones, parabens and triclosan in the Yangtze River of China, and the implications for human exposure [J]. Chemosphere, 2018, 213: 517-525. doi: 10.1016/j.chemosphere.2018.09.084 [25] SUN Q, LI Y, LI M Y, et al. PPCPs in Jiulong River Estuary (China): Spatiotemporal distributions, fate, and their use as chemical markers of wastewater [J]. Chemosphere, 2016, 150: 596-604. doi: 10.1016/j.chemosphere.2016.02.036 [26] FENG J L, ZHAO J H, XI N N, et al. Parabens and their metabolite in surface water and sediment from the Yellow River and the Huai River in Henan Province: Spatial distribution, seasonal variation and risk assessment [J]. Ecotoxicology and Environmental Safety, 2019, 172: 480-487. doi: 10.1016/j.ecoenv.2019.01.102 [27] KUNG T A, LEE S H, YANG T C, et al. Survey of selected personal care products in surface water of coral reefs in Kenting National Park, Taiwan, China [J]. Science of the Total Environment, 2018, 635: 1302-1307. doi: 10.1016/j.scitotenv.2018.04.115 [28] CZARCZYŃSKA-GOŚLIŃSKA B, ZGOŁA-GRZEŚKOWIAK A, JESZKA-SKOWRON M, et al. Detection of bisphenol A, cumylphenol and parabens in surface waters of Greater Poland Voivodeship [J]. Journal of Environmental Management, 2017, 204: 50-60. [29] ČESEN M, AHEL M, TERZIĆ S, et al. The occurrence of contaminants of emerging concern in Slovenian and Croatian wastewaters and receiving Sava River [J]. Science of the Total Environment, 2019, 650: 2446-2453. doi: 10.1016/j.scitotenv.2018.09.238 [30] ASHFAQ M, LI Y, REHMAN M S U, et al. Occurrence, spatial variation and risk assessment of pharmaceuticals and personal care products in urban wastewater, canal surface water, and their sediments: A case study of Lahore, Pakistan [J]. Science of the Total Environment, 2019, 688: 653-663. doi: 10.1016/j.scitotenv.2019.06.285 [31] SERRA-ROIG M P, JURADO A, DÍAZ-CRUZ M S, et al. Occurrence, fate and risk assessment of personal care products in river-groundwater interface [J]. Science of the Total Environment, 2016, 568: 829-837. doi: 10.1016/j.scitotenv.2016.06.006 [32] 赵雪, 郑一, 付彩霞, 等. 雄安新区水环境中对羟基苯甲酸酯含量及风险 [J]. 中国环境科学, 2021, 41(4): 1893-1899. doi: 10.3969/j.issn.1000-6923.2021.04.044 ZHAO X, ZHENG Y, FU C X, et al. Occurrence and ecological risk of parabens in water environment in Xiongan New Area [J]. China Environmental Science, 2021, 41(4): 1893-1899(in Chinese). doi: 10.3969/j.issn.1000-6923.2021.04.044
[33] CALDAS S, ARIAS J, ROMBALDI C, et al. Occurrence of pesticides and PPCPs in surface and drinking water in southern Brazil: Data on 4-year monitoring [J]. Journal of the Brazilian Chemical Society, 2019, 30: 71-80. [34] VALCÁRCEL Y, VALDEHÍTA A, BECERRA E, et al. Determining the presence of chemicals with suspected endocrine activity in drinking water from the Madrid region (Spain) and assessment of their estrogenic, androgenic and thyroidal activities [J]. Chemosphere, 2018, 201: 388-398. doi: 10.1016/j.chemosphere.2018.02.099 [35] CHEN M H, YU B, ZHANG Z F, et al. Occurrence of parabens in outdoor environments: Implications for human exposure assessment [J]. Environmental Pollution, 2021, 282: 117058. doi: 10.1016/j.envpol.2021.117058 [36] HAJIZADEH Y, POURZAMANI H, EBRAHIMPOUR K, et al. Monitoring of paraben compounds in indoor and outdoor air of a populated city [J]. Atmospheric Pollution Research, 2021, 12(4): 43-49. doi: 10.1016/j.apr.2021.02.012 [37] RUDEL R A, DODSON R E, PEROVICH L J, et al. Semivolatile endocrine-disrupting compounds in paired indoor and outdoor air in two northern California communities [J]. Environmental Science & Technology, 2010, 44(17): 6583-6590. [38] ZHU Q Q, WANG M, JIA J B, et al. Occurrence, distribution, and human exposure of several endocrine-disrupting chemicals in indoor dust: A nationwide study [J]. Environmental Science & Technology, 2020, 54(18): 11333-11343. [39] WANG Y, LI G L, ZHU Q Q, et al. Occurrence of parabens, triclosan and triclocarban in paired human urine and indoor dust from two typical cities in China and its implications for human exposure [J]. Science of the Total Environment, 2021, 786: 147485. doi: 10.1016/j.scitotenv.2021.147485 [40] CHEN J, HARTMANN E M, KLINE J, et al. Assessment of human exposure to triclocarban, triclosan and five parabens in US indoor dust using dispersive solid phase extraction followed by liquid chromatography tandem mass spectrometry [J]. Journal of Hazardous Materials, 2018, 360: 623-630. doi: 10.1016/j.jhazmat.2018.08.014 [41] WANG L, LIAO C Y, LIU F, et al. Occurrence and human exposure of p-hydroxybenzoic acid esters (parabens), bisphenol A diglycidyl ether (BADGE), and their hydrolysis products in indoor dust from the United States and three East Asian countries [J]. Environmental Science & Technology, 2012, 46(21): 11584-11593. [42] FAN X H, KUBWABO C, RASMUSSEN P, et al. Simultaneous quantitation of parabens, triclosan, and methyl triclosan in indoor house dust using solid phase extraction and gas chromatography-mass spectrometry [J]. Journal of Environmental Monitoring, 2010, 12(10): 1891-1897. doi: 10.1039/c0em00189a [43] TRAN T M, TRAN-LAM T T, MAI H H T, et al. Parabens in personal care products and indoor dust from Hanoi, Vietnam: Temporal trends, emission sources, and non-dietary exposure through dust ingestion [J]. Science of the Total Environment, 2021, 761: 143274. doi: 10.1016/j.scitotenv.2020.143274 [44] SAHA S, NARAYANAN N, SINGH N, et al. Occurrence of endocrine disrupting chemicals (EDCs) in river water, ground water and agricultural soils of India [J]. International Journal of Environmental Science and Technology, 2022: 1-16. [45] PÉREZ R A, ALBERO B, MIGUEL E, et al. Determination of parabens and endocrine-disrupting alkylphenols in soil by gas chromatography-mass spectrometry following matrix solid-phase dispersion or in-column microwave-assisted extraction: A comparative study [J]. Analytical and Bioanalytical Chemistry, 2012, 402(7): 2347-2357. doi: 10.1007/s00216-011-5248-0 [46] 于浡. 哈尔滨大气环境和土壤中对羟基苯甲酸酯的污染特征和健康风险研究[D]. 哈尔滨: 哈尔滨工业大学, 2020. YU B. Study on the pollution characteristics and health risk of parabens in atmospheric environment and soil of Harbin[D]. Harbin: Harbin Institute of Technology, 2020(in Chinese).
[47] TSUKAMOTO H, TERADA S. Metabolism of drugs. xlvii. metabolic fate of rho-hydroxybenzoic acid and its derivatives in rabbit [J]. Chemical & Pharmaceutical Bulletin, 1964, 12: 765-769. [48] TERNES T A, MEISENHEIMER M, MCDOWELL D, et al. Removal of pharmaceuticals during drinking water treatment [J]. Environmental Science & Technology, 2002, 36(17): 3855-3863. [49] MURAWSKI A, TSCHERSICH C, RUCIC E, et al. Parabens in urine of children and adolescents in Germany - human biomonitoring results of the German environmental survey 2014-2017 (GerES V) [J]. Environmental Research, 2021, 194: 110502. doi: 10.1016/j.envres.2020.110502 [50] CHOI W, KIM S, BAEK Y W, et al. Exposure to environmental chemicals among Korean adults-updates from the second Korean National Environmental Health Survey (2012-2014) [J]. International Journal of Hygiene and Environmental Health, 2017, 220(2): 29-35. doi: 10.1016/j.ijheh.2016.10.002 [51] FILLOL C, OLEKO A, SAOUDI A, et al. Exposure of the French population to bisphenols, phthalates, parabens, glycol ethers, brominated flame retardants, and perfluorinated compounds in 2014-2016: Results from the Esteban study [J]. Environment International, 2021, 147: 106340. doi: 10.1016/j.envint.2020.106340 [52] POLLOCK T, KARTHIKEYAN S, WALKER M, et al. Trends in environmental chemical concentrations in the Canadian population: Biomonitoring data from the Canadian Health Measures Survey 2007-2017 [J]. Environment International, 2021, 155: 106678. doi: 10.1016/j.envint.2021.106678 [53] LU S Y, REN L, LIU Y L, et al. Urinary parabens in children from South China: Implications for human exposure and health risks [J]. Environmental Pollution, 2019, 254: 113007. doi: 10.1016/j.envpol.2019.113007 [54] BERGER K, GUNIER R B, CHEVRIER J, et al. Associations of maternal exposure to triclosan, parabens, and other phenols with prenatal maternal and neonatal thyroid hormone levels [J]. Environmental Research, 2018, 165: 379-386. doi: 10.1016/j.envres.2018.05.005 [55] FERGUSON K K, LAN Z, YU Y F, et al. Urinary concentrations of phenols in association with biomarkers of oxidative stress in pregnancy: Assessment of effects independent of phthalates [J]. Environment International, 2019, 131: 104903. doi: 10.1016/j.envint.2019.104903 [56] AKER A M, FERGUSON K K, ROSARIO Z Y, et al. A repeated measures study of phenol, paraben and Triclocarban urinary biomarkers and circulating maternal hormones during gestation in the Puerto Rico PROTECT cohort [J]. Environmental Health, 2019, 18(1): 28. doi: 10.1186/s12940-019-0459-5 [57] GEER L A, PYCKE B F G, WAXENBAUM J, et al. Association of birth outcomes with fetal exposure to parabens, triclosan and triclocarban in an immigrant population in Brooklyn, New York [J]. Journal of Hazardous Materials, 2017, 323: 177-183. doi: 10.1016/j.jhazmat.2016.03.028 [58] JIANG Y Q, ZHAO H Z, XIA W, et al. Prenatal exposure to benzophenones, parabens and triclosan and neurocognitive development at 2 years [J]. Environment International, 2019, 126: 413-421. doi: 10.1016/j.envint.2019.01.023 [59] ZHANG H, QUAN Q, LI X W, et al. Occurrence of parabens and their metabolites in the paired urine and blood samples from Chinese university students: Implications on human exposure [J]. Environmental Research, 2020, 183: 109288. doi: 10.1016/j.envres.2020.109288 [60] LI A J, ZHUANG T F, ZHU Q Q, et al. Concentration and distribution of parabens, triclosan, and triclocarban in pregnant woman serum in China [J]. Science of the Total Environment, 2020, 710: 136390. doi: 10.1016/j.scitotenv.2019.136390 [61] IRIBARNE-DURÁN L M, DOMINGO-PIÑAR S, PEINADO F, et al. Menstrual blood concentrations of parabens and benzophenones and related factors in a sample of Spanish women: An exploratory study [J]. Environmental Research, 2020, 183: 109228. doi: 10.1016/j.envres.2020.109228 [62] KOLATOROVA SOSVOROVA L, CHLUPACOVA T, VITKU J, et al. Determination of selected bisphenols, parabens and estrogens in human plasma using LC-MS/MS [J]. Talanta, 2017, 174: 21-28. doi: 10.1016/j.talanta.2017.05.070 [63] ASSENS M, FREDERIKSEN H, PETERSEN J H, et al. Variations in repeated serum concentrations of UV filters, phthalates, phenols and parabens during pregnancy [J]. Environment International, 2019, 123: 318-324. doi: 10.1016/j.envint.2018.11.047 [64] SHEKHAR S, SOOD S, SHOWKAT S, et al. Detection of phenolic endocrine disrupting chemicals (EDCs) from maternal blood plasma and amniotic fluid in Indian population [J]. General and Comparative Endocrinology, 2017, 241: 100-107. doi: 10.1016/j.ygcen.2016.05.025 [65] BRÄUNER E V, ULDBJERG C S, LIM Y H, et al. Presence of parabens, phenols and phthalates in paired maternal serum, urine and amniotic fluid [J]. Environment International, 2022, 158: 106987. doi: 10.1016/j.envint.2021.106987 [66] SONG S M, HE Y, ZHANG T, et al. Profiles of parabens and their metabolites in paired maternal-fetal serum, urine and amniotic fluid and their implications for placental transfer [J]. Ecotoxicology and Environmental Safety, 2020, 191: 110235. doi: 10.1016/j.ecoenv.2020.110235 [67] JIMÉNEZ-DÍAZ I, IRIBARNE-DURÁN L M, OCÓN O, et al. Determination of personal care products -benzophenones and parabens- in human menstrual blood [J]. Journal of Chromatography B, 2016, 1035: 57-66. doi: 10.1016/j.jchromb.2016.09.035 [68] PEINADO F M, OCÓN-HERNÁNDEZ O, IRIBARNE-DURÁN L M, et al. Cosmetic and personal care product use, urinary levels of parabens and benzophenones, and risk of endometriosis: Results from the EndEA study [J]. Environmental Research, 2021, 196: 110342. doi: 10.1016/j.envres.2020.110342 [69] DARBRE P D, ALJARRAH A, MILLER W R, et al. Concentrations of parabens in human breast tumours [J]. Journal of Applied Toxicology:JAT, 2004, 24(1): 5-13. doi: 10.1002/jat.958 [70] SAJID M, BASHEER C, NARASIMHAN K, et al. Application of microwave-assisted micro-solid-phase extraction for determination of parabens in human ovarian cancer tissues [J]. Journal of Chromatography B, 2015, 1000: 192-198. doi: 10.1016/j.jchromb.2015.07.020 [71] ALAMPANOS V, KABIR A, FURTON K G, et al. Fabric phase sorptive extraction combined with high-performance-liquid chromatography-photodiode array analysis for the determination of seven parabens in human breast tissues: Application to cancerous and non-cancerous samples [J]. Journal of Chromatography A, 2020, 1630: 461530. doi: 10.1016/j.chroma.2020.461530 [72] SHEN X, LIANG J, ZHENG L X, et al. Ultrasound-assisted dispersive liquid-liquid microextraction followed by gas chromatography-mass spectrometry for determination of parabens in human breast tumor and peripheral adipose tissue [J]. Journal of Chromatography B, 2018, 1096: 48-55. doi: 10.1016/j.jchromb.2018.08.004 [73] van OVERMEIRE I, VRIJENS K, NAWROT T, et al. Simultaneous determination of parabens, bisphenols and alkylphenols in human placenta by ultra-high performance liquid chromatography-tandem mass spectrometry [J]. Journal of Chromatography B, 2019, 1121: 96-102. doi: 10.1016/j.jchromb.2019.05.012 [74] VELA-SORIA F, GALLARDO-TORRES M E, BALLESTEROS O, et al. Assessment of parabens and ultraviolet filters in human placenta tissue by ultrasound-assisted extraction and ultra-high performance liquid chromatography-tandem mass spectrometry [J]. Journal of Chromatography A, 2017, 1487: 153-161. doi: 10.1016/j.chroma.2017.01.041 [75] VALLE-SISTAC J, MOLINS-DELGADO D, DÍAZ M, et al. Determination of parabens and benzophenone-type UV filters in human placenta. First description of the existence of benzyl paraben and benzophenone-4 [J]. Environment International, 2016, 88: 243-249. doi: 10.1016/j.envint.2015.12.034 [76] WANG L, ASIMAKOPOULOS A G, KANNAN K. Accumulation of 19 environmental phenolic and xenobiotic heterocyclic aromatic compounds in human adipose tissue [J]. Environment International, 2015, 78: 45-50. doi: 10.1016/j.envint.2015.02.015 [77] ARTACHO-CORDÓN F, FERNÁNDEZ M F, FREDERIKSEN H, et al. Environmental phenols and parabens in adipose tissue from hospitalized adults in Southern Spain [J]. Environment International, 2018, 119: 203-211. doi: 10.1016/j.envint.2018.05.052 [78] DUALDE P, PARDO O, CORPAS-BURGOS F, et al. Biomonitoring of parabens in human milk and estimated daily intake for breastfed infants [J]. Chemosphere, 2020, 240: 124829. doi: 10.1016/j.chemosphere.2019.124829 [79] PARK N Y, CHO Y H, CHOI K, et al. Parabens in breast milk and possible sources of exposure among lactating women in Korea [J]. Environmental Pollution, 2019, 255: 113142. doi: 10.1016/j.envpol.2019.113142 [80] KIM J H, KIM D, MOON S M, et al. Associations of lifestyle factors with phthalate metabolites, bisphenol A, parabens, and triclosan concentrations in breast milk of Korean mothers [J]. Chemosphere, 2020, 249: 126149. doi: 10.1016/j.chemosphere.2020.126149 [81] MARTÍN J, SANTOS J L, APARICIO I, et al. Exposure assessment to parabens, bisphenol A and perfluoroalkyl compounds in children, women and men by hair analysis [J]. Science of the Total Environment, 2019, 695: 133864. doi: 10.1016/j.scitotenv.2019.133864 [82] LI C, CUI X Y, CHEN Y, et al. Paraben concentrations in human fingernail and its association with personal care product use [J]. Ecotoxicology and Environmental Safety, 2020, 202: 110933. doi: 10.1016/j.ecoenv.2020.110933 [83] KARZI V, TZATZARAKIS M N, HATZIDAKI E, et al. Determination of prenatal exposure to parabens and triclosan and estimation of maternal and fetal burden [J]. Toxicology Reports, 2021, 8: 808-815. doi: 10.1016/j.toxrep.2021.03.030 [84] 林忠洋, 马万里, 齐迹, 等. 对羟基苯甲酸酯类防腐剂的人体暴露 [J]. 化学进展, 2015, 27(5): 614-622. LIN Z Y, MA W L, QI J, et al. Human exposure to parabens [J]. Progress in Chemistry, 2015, 27(5): 614-622(in Chinese).
[85] LAWS M J, NEFF A M, BREHM E, et al. Endocrine disrupting chemicals and reproductive disorders in women, men, and animal models [J]. Advances in Pharmacology, 2021, 92(4): 151-190. [86] LI X J, ZHONG Y, HE W Y, et al. Co-exposure and health risks of parabens, bisphenols, triclosan, phthalate metabolites and hydroxyl polycyclic aromatic hydrocarbons based on simultaneous detection in urine samples from Guangzhou, South China [J]. Environmental Pollution, 2021, 272: 115990. doi: 10.1016/j.envpol.2020.115990 [87] TYAGI P, JAMES-TODD T, MÍNGUEZ-ALARCÓN L, et al. Identifying windows of susceptibility to endocrine disrupting chemicals in relation to gestational weight gain among pregnant women attending a fertility clinic [J]. Environmental Research, 2021, 194: 110638. doi: 10.1016/j.envres.2020.110638 [88] ASSAF VANDECASTEELE H, GAUTIER F, TOURNEIX F, et al. Next generation risk assessment for skin sensitisation: A case study with propyl paraben [J]. Regulatory Toxicology and Pharmacology, 2021, 123: 104936. doi: 10.1016/j.yrtph.2021.104936 [89] LIANG J F, YANG X X, LIU Q S, et al. Assessment of thyroid endocrine disruption effects of parabens using In vivo, In vitro, and In silico approaches [J]. Environmental Science & Technology, 2022, 56(1): 460-469. [90] KOLATOROVA L, VITKU J, HAMPL R, et al. Exposure to bisphenols and parabens during pregnancy and relations to steroid changes [J]. Environmental Research, 2018, 163: 115-122. doi: 10.1016/j.envres.2018.01.031 [91] VO T T B, YOO Y M, CHOI K C, et al. Potential estrogenic effect(s) of parabens at the prepubertal stage of a postnatal female rat model [J]. Reproductive Toxicology, 2010, 29(3): 306-316. doi: 10.1016/j.reprotox.2010.01.013 [92] BŁĘDZKA D, GROMADZIŃSKA J, WĄSOWICZ W. Parabens. From environmental studies to human health [J]. Environment International, 2014, 67: 27-42. doi: 10.1016/j.envint.2014.02.007 [93] HAFEEZ F, MAIBACH H. An overview of parabens and allergic contact dermatitis [J]. Skin Therapy Letter, 2013, 18(5): 5-7. [94] JUNGE K M, BUCHENAUER L, STRUNZ S, et al. Effects of exposure to single and multiple parabens on asthma development in an experimental mouse model and a prospective cohort study [J]. Science of the Total Environment, 2022, 814: 152676. doi: 10.1016/j.scitotenv.2021.152676 [95] 刘慧, 徐诚, 刘倩, 等. 对羟基苯甲酸酯类内分泌干扰效应的研究进展 [J]. 卫生研究, 2016, 45(1): 155-158,172. doi: 10.19813/j.cnki.weishengyanjiu.2016.01.031 LIU H, XU C, LIU Q, et al. Research progress on endocrine disrupting effects of parabens [J]. Journal of Hygiene Research, 2016, 45(1): 155-158,172(in Chinese). doi: 10.19813/j.cnki.weishengyanjiu.2016.01.031
[96] NISHIHAMA Y, YOSHINAGA J, IIDA A, et al. Association between paraben exposure and menstrual cycle in female university students in Japan [J]. Reproductive Toxicology, 2016, 63: 107-113. doi: 10.1016/j.reprotox.2016.05.010 [97] SMARR M M, SUNDARAM R, HONDA M, et al. Urinary concentrations of parabens and other antimicrobial chemicals and their association with couples' fecundity [J]. Environmental Health Perspectives, 2017, 125(4): 730-736. doi: 10.1289/EHP189 [98] LI A J, XUE J C, LIN S, et al. Urinary concentrations of environmental phenols and their association with type 2 diabetes in a population in Jeddah, Saudi Arabia [J]. Environmental Research, 2018, 166: 544-552. doi: 10.1016/j.envres.2018.06.040 期刊类型引用(4)
1. 尉文霞,裴社强,杨宝. 盐酸特比萘芬乳膏抑菌效力考察及抑菌剂使用评价. 科技创新与应用. 2025(06): 56-60 .  百度学术
百度学术
2. 廖秋月,李鑫,孔伟蒙,于鹏霞,黄娇龙,段鹏,廉凯,邓杰. 对羟基苯甲酸乙酯暴露于雌性斑马鱼对子代胚胎发育的毒性效应. 湖北医药学院学报. 2024(03): 227-234+246 .  百度学术
百度学术
3. 宁晓盼,马晶晶,刘宇,王梦茹,滕颖,楼芸,殷耀,柳菡,张晓燕,丁涛. 超高效液相色谱-串联质谱法测定热凝固蛋制品中7种对羟基苯甲酸酯类防腐剂. 食品安全质量检测学报. 2024(21): 32-40 .  百度学术
百度学术
4. 徐阳纯,王志强,许泽群,谭维嘉,蔡杏宜. 基于自动电位分析尼泊金酯钠盐含量不确定度及其控制值. 中国测试. 2024(S2): 241-249 .  百度学术
百度学术
其他类型引用(2)
-






 下载:
下载: