-
氮素是农作物生长发育过程中必不可少的营养元素,近年来由于过量施用化肥一方面加剧了硝酸盐淋失,另一方面氮素通过反硝化作用生成N2O、N2释放到大气中,导致氮素利用率下降[1]. 氮素形态转换的本质是氮素在相关微生物功能基因调控下的转化过程,刻画氮循环功能基因与农田氮素利用率间耦合关系,明确主导氮素利用率提升的关键基因种类有利于为进一步开展土壤健康管理和促进农业增产提供科学依据. 现有研究表明,过量施加氮肥会导致土壤中积累的氨通过硝化作用在氨氧化细菌(AOB)的作用下将环境中的氨转化为亚硝酸,而亚硝酸盐氧化细菌(NOB)通过亚硝酸盐氧化还原酶(NXR)将亚硝酸盐氧化为硝酸盐,加剧了土壤酸化[2]. 同时,施肥可以改变土壤nosZ型反硝化细菌基因丰度,并且提高土壤反硝化速率[3-4]. 陈娜等[5]研究发现,增施氮肥可以提升(narG、nosZ)型反硝化功能基因丰度,从而使NO3−、NO2−被还原为N2O、N2释放到大气中,导致农田氮素损失. 研究表明抑制硝化作用功能基因丰度不仅可以缓解氮素以硝酸盐形式流失,还可以促进植株对氮素吸收,从而提升氮素利用率[6]. 综上,研究土壤中氮素的生物化学转化,明确施入土壤的氮素去向进而刻画氮循环功能基因丰度与氮素利用率间的耦合关系可以为减缓农田氮素流失,促进氮素增效提供理论基础.
红黄壤主要分布在我国南方地区,土壤pH为5.25—5.44、降雨量充沛、土壤质地较黏、容重较高. 由于红黄壤本身的性质和当地气候的作用使施入土壤中的氮素通过挥发、淋失、反硝化等进入大气环境以及湖泊河流中[7]. 因此,减少氮素流失,提高农田氮素利用率已成为提高农作物增产增收的的关键所在. 生物质炭和沼液作为典型的土壤改良剂,通过增加土壤有机碳含量为氮循环微生物提供碳源,直接或间接调控氮循环过程相关功能基因丰度和关键环节,从而提高土壤氮素利用效率以及作物产量. 生物质炭是农作物秸秆或动物粪便残渣在厌氧的条件下经过高温热解所产生,具有巨大的比表面积,可以吸附土壤中的营养物质,而且作为肥料的载体,它们还影响着土壤持水性能,可以提高农作物对养分的吸收、改良土壤结构、促使土壤微生物繁殖[8-9]. 沼液作为改善土壤质量的有机物料对氮循环功能基因同样具有显著的调控作用. 由于单独施用沼液易产生氨挥发、硝酸盐淋失和N2O排放等主要环境问题,因此采用生物质炭-沼液联合施用的方式,利用生物质炭吸附和负载氮素,在降低硝酸盐淋失的同时减少N2O排放,提高土壤养分保蓄能力[10-11]. 现有研究发现生物质炭施加到土壤中可以影响硝化作用的限速步骤,促进氨氧化作用的进行,提高氨氧化菌的基因丰度,从而达到促进硝化作用的发生[12]. 而Dempster等[13]的研究则得出生物质炭的施加会对土壤氨氧化作用产生抑制的影响,这可能是由于生物质炭能释放硝化抑制剂,阻碍土壤中铵根离子向硝酸根离子的转化. 而生物质炭对土壤反硝化作用的影响至今仍有不同的观点,刘杰云等[14]研究表明,生物质炭作为土壤改良剂可以显著提高narG、nirK、nosZ基因相对丰度. 王伟等[15]研究发现,通过施加生物质炭可以改善土壤孔隙度,增加了土壤的透气状况,阻碍了厌氧条件下反硝化作用的进行. 施加沼液可以增加土壤微生物的数量,并且沼液的施加也放大了反硝化(nirK、narG)功能基因信号强度、氨化作用(ureC)功能基因信号强度[11].
综上,前人在探讨氮循环功能基因对氮素形态调控以及影响土壤氮素循环过程做了大量研究,为明确氮循环功能基因对农田氮素利用率的影响奠定了基础. 然而,现有研究主要集中在研究功能基因丰度对氮素活化的影响,氮素增效与功能基因间的内在联系仍有待探索[16],其次,目前的研究多采用生物质炭/无机肥料或沼液/无机肥料配施的方式改良土壤,而生物质炭-沼液协同施用的研究手段仍较为少见. 因此,本研究聚焦农田氮素增效的关键问题,从氮循环功能基因角度入手,以浙江省杭州市红黄壤为试验对象,采用生物质炭-沼液联合施用的方式研究了其对土壤肥力因子、氮循环功能基因和氮素利用率的响应特征,刻画氮循环功能基因与氮素利用率间耦合关系,为改善土壤性质,提高氮素利用率以及为缓解因过量施肥而造成的农业污染问题提供理论依据.
-
该试验地点位于浙江省杭州市浙江科技学院(30°13′N,120°1′E). 该试验土壤为红黄壤,属于亚热带季风气候,年平均气温17.8 ℃、年平均日照数1970 h、年平均降雨量为1573 mm. 基本理化性质为:土壤容重1.45 g·cm-3,pH为5.44,硝态氮含量3.54 mg·kg−1,铵态氮含量0.79 mg·kg −1,全氮含量0.6 g·kg−1.
-
供试生物质炭原材料来自浙江省开化县顺康牧业猪粪,由浙江金华市金锅公司厌氧炭化制成猪粪生物质炭,理化性质为:硝态氮含量11.37 mg·kg−1、铵态氮含量15 mg·kg−1、全氮含量18.95 g·kg−1、有机碳含量605 g·kg−1、pH 8.5. 沼液为浙江省开化县顺康牧业猪场废水厌氧发酵制备的沼液,试验站建有专门蓄水调节池,可对沼液进行标准化处理,经标准化处理的沼液符合农田灌溉水质标准(GB5084-2005). 沼液理化性质为:硝态氮含量10 mg·L−1、铵态氮含量220 mg·L−1、全氮含量2.95 g·L−1、pH 8.5.
-
2021年4月开始试验,采用生物质炭和沼液完全交互试验设计:生物质炭设置4个水平,分别为0%、0.5%、1%、2%,沼液设置3个水平分别为0%、50%、100%(详见表1),其中0%沼液处理采用等体积超纯水代替. 按照当地栽培方式最佳施肥量为:尿素(折合纯氮90 kg·hm−2)、氯化钾(195 kg·hm−2)、钙镁磷肥(375 kg·hm−2). 每个处理3个重复,同时设置对照(CK)处理,共计39个小区. 各小区面积3 m2(2 m×1.5 m). 试验基地种植农作物为包菜,种植采取育苗方式,再移栽至每个试验小区. 行距为40 cm,株距为20 cm. 于试验开始前两周将猪粪生物质炭一次性均匀的施于土壤表面,人工翻至15—30 cm土层,后期不再施加生物质炭. 对照组(CK)处理不施生物质炭和沼液,但仍需人工翻耕. 农作物的种植方式与当地保持一致,沼液和化肥于农作物种植一周前均匀施入其对应试验小区,并且后期每季作物种植前均需再次施用沼液和化肥,各小区每隔一个月施1次沼液,共施加3次.
-
供试土壤于包菜成熟前两周采集,用S形采样方法采样,每个小区采集5个样本并混合均匀冷藏于带有冰块的泡沫箱内运回实验室. 2 d内除去样品中沙粒、枯叶等,把样品均匀分成3份. 一份风干,用于测土壤基本理化性质,参照《土壤农业化学分析方法》鲁如坤[17]. 一份冷藏于4 ℃冰箱测定土壤硝态氮、铵态氮,另一份储存于-80 ℃冰箱中用于提取土壤DNA. 土壤容重采用环刀法测定,土壤pH采用pH计电位法测定(水土比5:1),土壤硝态氮、铵态氮采用氯化钾浸提-流动分析仪测定,土壤全氮的测定采取浓硫酸消煮-流动分析仪测定. 每季包菜收获期各小区按照包菜颗数进行收获计产,再换算得至每公顷包菜产量. 所有植株样品经105 ℃杀青烘干,烘干样品粉碎过100目筛,经H2SO4-H2O2消解后测定全氮含量,计算氮素利用率. 氮素利用率测算公式参照Yang所述方法[18].
包菜氮素农学利用率(ANUE,kg·kg -1) = (施氮区包菜产量-不施氮区包菜产量)/施氮量
-
取所需土壤鲜样0.5 g,每个处理取3个平行. 使用中国Tian-Gen公司的土壤基因组DNA快速提取试剂盒TIANNAMP Soil DNA Kit提取土壤微生物总DNA,提取完成后分别利用TBS-380、NanoDrop200对土壤样品DNA进行浓度及纯度检测.
-
采用BIO-RAD T100TM扩增仪进行,扩增反应体系为:5 μL 10×Ex Taq buffer (Mg2+ Plus),4 μL dNTP(2.5 mmol·L−1),0.5 μL上游和下游引物(20 μmol·L−1),0.25 μL Ex Taq DNA聚合酶(5 U·L−1),1 μL DNA模板,无菌去离子水补足至50 μL. 采用质粒试剂盒(Plasmid Miniprep Kit,Biomiga) 进行质粒提取,质粒DNA提取液经2%琼脂糖凝胶电泳检测、纯化后测定质粒浓度,由质粒浓度换算出质粒拷贝数. 标准曲线用无菌去离子水稀释10倍后的质粒DNA作为模板,在Bio-Rad miniopticon扩增仪上进行扩增,功能基因PCR扩增引物序列见表2[19].
-
采用Microsoft Excel 2016、Origin 2021及SPSS 20.0软件对试验数据进行方差分析、均值的多重比较和相关性分析,显著性水平设为P=0.05,采用CANOCO 5软件 (CANOCO, Microcomputer PowerInc, Ithaca, NY, USA) 进行土壤环境因子与氮循环功能基因间的冗余分析 (redundancy analysis, RDA),采用Amos刻画功能基因与氮素利用率间的结构方程模型.
-
本研究结果表明施加生物质炭、沼液以及生物质炭-沼液配施均可降低土壤容重,提升土壤氮素含量(表3). 单施化肥(C0B0)处理的土壤容重、pH、硝态氮、全氮、总有机碳含量与空白处理(CK)相比差异性不显著(P>0.05). 单独施用生物质炭可以显著提升土壤pH,本研究中C3B0处理土壤pH值较C0B0提升了45.43%,同时,生物质炭-沼液配施(C3B2)处理土壤pH提升幅度较大,比单施化肥处理(C0B0)提升了44.85%,其原因是由于生物质炭本身所具有的含氧官能团在土壤中发生了质子化作用导致土壤pH增加[20]. 施加生物质炭、沼液可降低土壤容重,其中C1B0、C1B1、C1B2处理土壤容重均比单施化肥(C0B0)处理显著降低了13.79%、11.72%、11.03%. 生物质炭施加量为0.5%、沼液0%替代化肥(C1B0)处理中土壤容重较单施化肥(C0B0)处理降幅最为显著(P<0.05),下降了13.79%. 由于生物质炭具有巨大的比表面积和孔隙度,施入土壤后其稀释效应增加了微生物与土壤颗粒物间的相互作用, 促进了土壤微团粒向大团粒的聚合,降低了土壤容重[21]. 土壤有机碳和氮素含量以生物质炭-沼液配施(C3B2)处理效果最佳,均较单施化肥(C0B0)处理有显著提升,并且均高于单独施生物质炭(C3B0)处理,其中C3B2处理土壤硝态氮含量较C3B0处理增加了86%,铵态氮较C3B0处理增加了23.79%. 因为生物质炭对于施入土壤中的养分具有吸附作用,沼液则富含有机质并且其主要氮素含量以无机氮为主,因此生物质炭和沼液联合施用可以提高土壤硝态氮、有机碳含量. 沼液中富含腐殖酸,其中的官能团与土壤中含氮物质形成络合物减少了土壤铵态氮的流失,并且沼液作为有机碳库,施入土壤中提升了土壤微生物的活性,从而增加了土壤速效养分含量[22].
-
试验发现单施化肥处理可以显著提高硝化作用功能基因丰度,而施加生物质炭则能显著提高反硝化作用功能基因丰度,土壤氮循环相关基因丰度变化如图1所示.
图1A中单施化肥(C0B0)处理较对照组(CK)硝化作用基因(amoA-1、amoA-2、amoB和nrxA)丰度提升显著,差异达显著水平(P<0.05). 而单独施加生物质炭(C3B0)处理较单施加化肥(C0B0)处理硝化作用功能基因(amoA-1、amoA-2、amoB和nrxA)显著降低,分别下降了93%、35%和16%. 说明施加生物质炭对土壤硝化作用起到了抑制作用,进而可缓解土壤中硝酸盐淋失的问题. 这与Clough的研究得到了一致的结果,其认为生物质炭可释放一种硝化抑制剂α-松萜从而抑制了土壤硝化作用[23]. 而在本试验中单施化肥处理(C0B0)与空白处理(CK)相比硝化作用功能基因丰度有显著提升,但随着生物质炭与沼液的施加导致其功能基因丰度增长率逐渐降低. 由于亚硝酸细菌的适宜生长环境为偏酸性,而生物质炭与沼液的施加提升了土壤pH,因此pH的提高抑制了硝化作用功能基因丰度的提升. 单施生物质炭(C3B0)处理较单施化肥(C0B0)处理反硝化作用基因(narG、napA、nirS-1、nirS-2和nirK-1)丰度则提升了33%、182%、189%、131%和102%(图1B). 同时,生物质炭-沼液配施(C3B2)处理与单施化肥(C0B0)处理相比,反硝化作用基因丰度提升较为显著(P<0.05). 可能是由于生物质炭、沼液的投入增加了土壤中的氮源以及土壤有机碳的含量,补充了土壤反硝化细菌所需的的底物. 也有研究发现,有机肥部分替代化肥增加了反硝化功能微生物(narG、nirK、nirS和norZ)数量与丰度,甚至形成一些较为特殊的反硝化微生物群落结构[24]. 单施化肥(C0B0)处理、单施沼液(C0B2)处理均较(CK)处理显著提升了土壤厌氧氨氧化功能基因丰度,单施生物质炭(C3B0)处理、生物质炭-沼液配施显(C3B2)处理与单施沼液(C0B0)处理相比,著降低了土壤氨氧化作用功能基因丰度(P<0.05)(图1D). 研究表明,厌氧氨氧化菌的数量与土壤尿素呈正相关,但与土壤铵态氮、硝态氮含量呈负相关趋势. 因此施肥改变了土壤肥力,提升了土壤氨氧化细菌的数量,而随着生物质炭、沼液的施加增加了土壤硝态氮与铵态氮的含量,进而阻碍了土壤厌氧氨氧化作用[25-26]. 单施加生物质炭(C3B0)处理、生物质炭-沼液配施(C3B2)处理与单施化肥(C0B0)处理相比氨化作用功能基因(ureC)均有显著增加,分别提升了36.5%、62.5%,差异均达到显著水平(P<0.05)(图1C),由于有机物料施入到土壤中后,需经过土壤中的微生物将有机氮肥转化为无机氮才能被植株所吸收,所以有机物料的施加提升了土壤氨化作用功能基因丰度[27].
-
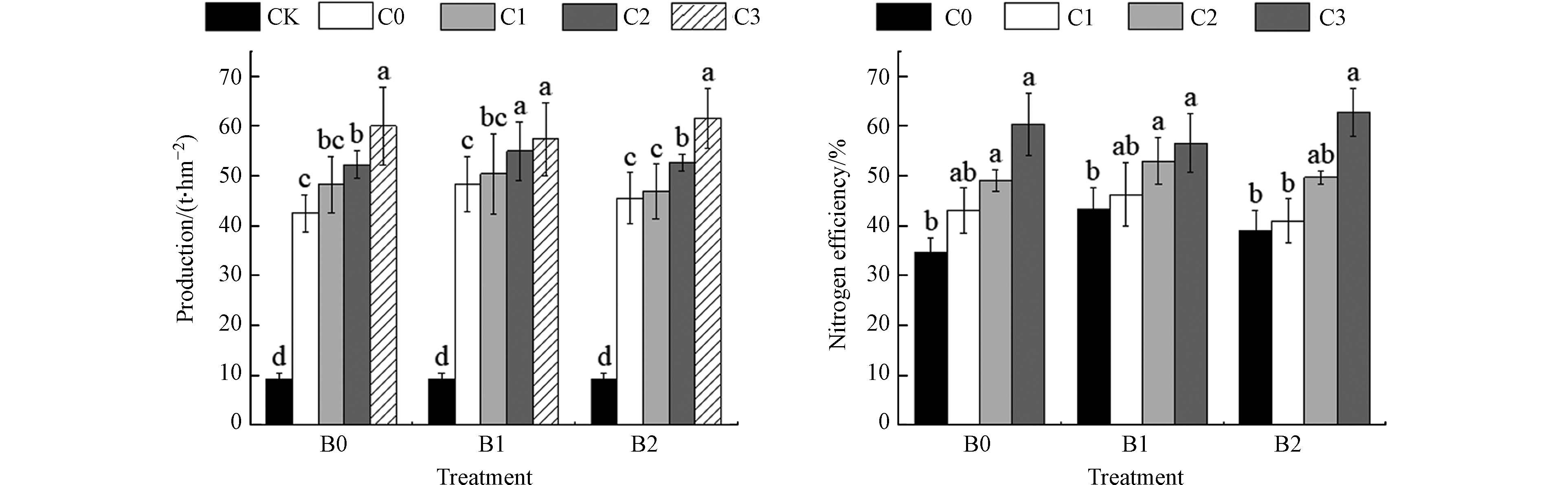
不同处理包菜产量与氮素利用率如图2所示,单施化肥(C0B0)处理的包菜产量较对照组(CK)提高了33.31 t·hm−2,差异达显著水平(P<0.05). 单施用生物质炭可以显著提高包菜产量,其中(C3B0)处理包菜产量为59.93 t·hm−2,较单施化肥(C0B0)处理提高了41.08%. 生物质炭-沼液配施(C3B2)处理包菜产量最高,与单施化肥(C0B0)处理相比差异显著(P<0.05),增幅为44.13%. 单独施用生物质炭可以显著提升包菜氮素利用率,其中C3B0处理包菜氮素利用率最高,较单施肥(C0B0)处理提升42.80%,差异达显著水平(P<0.05). 生物质炭-沼液配施(C3B2)处理较单施化肥(C0B0)处理包菜氮素利用率有显著提升(P<0.05)且升高了44.99%. 由于生物质炭、有机物料的投入与替代化肥提升了土壤肥力,可为作物的生长发育提供适宜的生存环境与充足的氮源,因此可对包菜的氮素利用率起到提升作用.
-
利用氮循环功能基因与所选取的6个环境因子(pH、SBD、NH4+-N、NO3−-N、TN、SOC)做冗余分析. 氮循环功能基因分别选取amoA、amoB、napA、ureC、nirK、nosZ、nirS,由图3可知,第一排序轴和第二排序轴分别解释了94.63%、4.6%. 影响土壤硝化作用功能基因丰度amoA的环境因子依次是NO3−-N>NH4+-N>TN,amoB功能基因丰度与NO3−-N、NH4+-N、TN呈正相关,amoA功能基因丰度与pH、NO3−-N、NH4+-N、SOC呈负相关,与土壤TN含量呈正相关. 对反硝化作用功能基因nosZ、nirK丰度影响作用较为显著的环境因子是NO3−-N、NH4+-N、SOC、pH、nirK、nirS功能基因丰度分别与pH、NO3−-N、NH4+-N、SOC呈显著正相关关系. 在六种环境因子(pH、SBD、NH4+-N、NO3−-N、TN、SOC)当中,NH4+-N(P=0.02)、NO3−-N(P=0.002)、SOC(P=0.04)对土壤氮循环功能基因影响较为显著. 其分别解释了土壤中氮循环功能基因丰度变异的21.5%、66.5%、13.7%.
-
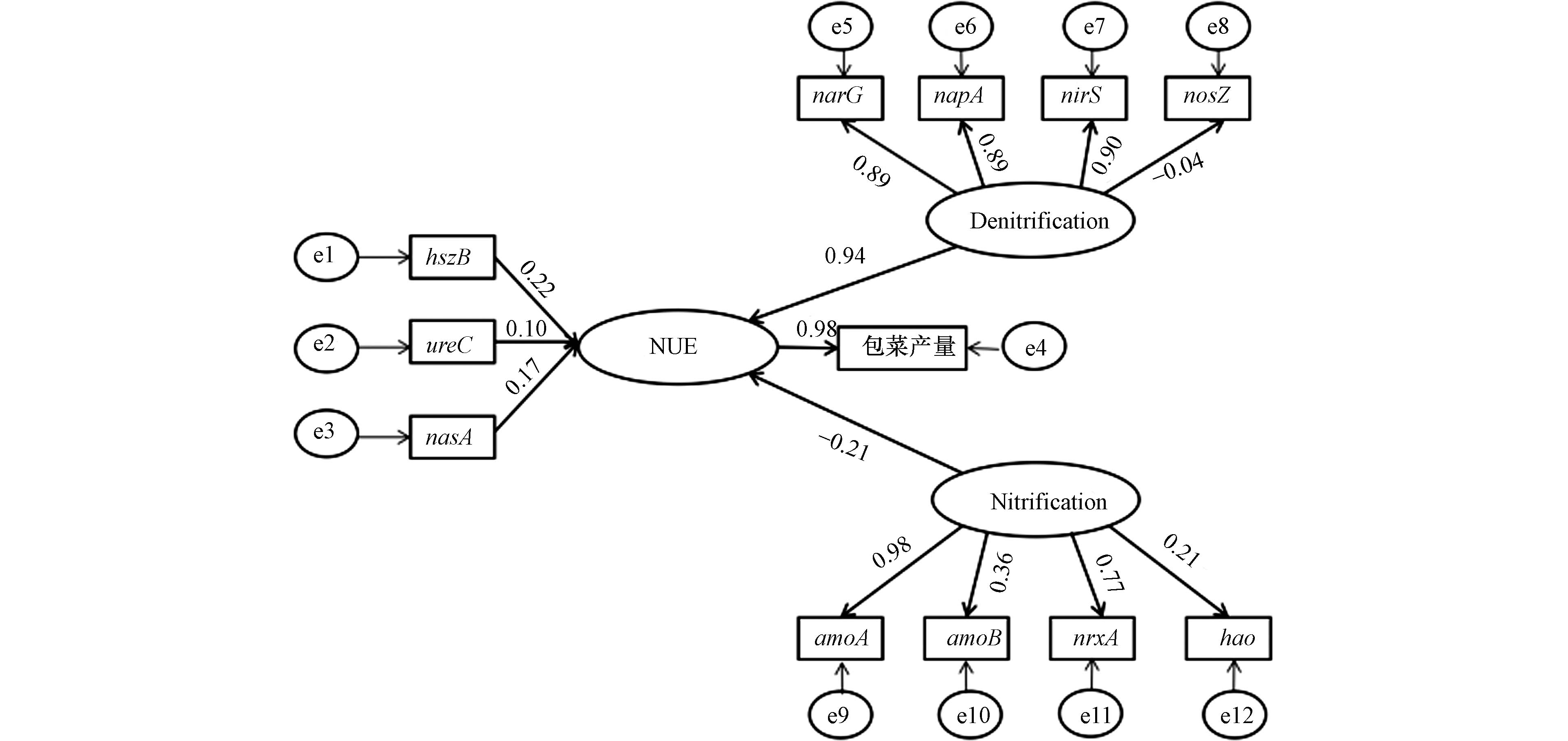
氮循环作为土壤养分循环的重要组成部分之一,而作为硝化、反硝化又是氮循环的重要组成部分,其组成细菌的丰度和群落结构直接影响施入土壤中氮素的转化,并影响农作物对氮素的吸收利用[28]. 以氮循环功能基因和作物产量为观测变量,农田氮素利用率为潜变量构建一阶SEM(图4),模型的拟合度指数良好(CMIN/DF = 3.286<5,RMSAE = 0.078<0.08,AGFI、GFI、CFI、NFI>0.8). 由图4可以看出,土壤反硝化作用可以由narG、napA、nirS和nosZ这4个观测变量来测量,其中narG、napA、nirS,对反硝化作用影响较为显著且为正相关效应,相关系数分别为0.89、0.89、0.90,土壤硝化作用可以由amoA、amoB、nrxA和hao的4个观测变量来测量,amoA、nrxA对硝化作用的影响显著,路径系数分别为0.98、0.77. 结构方程模型结果表明,反硝化功能基因丰度的提升有利于包菜农学氮素利用率的提升(路径系数0.94),而硝化作用功能基因(amoB、hao)丰度的提升对包菜氮素农学利用率呈现负相关趋势(路径系数-0.21). 产生这一趋势的原因可能是由于施入土壤的氮肥在氨氧化细菌的参与下将氮素转化为硝态氮,导致了土壤中氮素淋失,也可能是因为铵态氮被土壤胶体吸附不易被作物吸收[29]. 同时,氨化作用、同化氮还原和厌氧氨氧化功能基因也是农田氮素利用率的正向影响因素(路径系数分别为0.10、0.17和0.22). 另外,农田氮素利用率的提升显著促进了包菜的增产(路径系数0.98).
-
生物质炭的输入可以缓解土壤酸化问题、降低土壤容重,施加沼液可以增加土壤氮素含量提高土壤肥力. 单独施加化肥增加了土壤硝化作用(amoA、amoB)功能基因丰度,但随着施生物炭和沼液的施加会使其增长率逐渐降低. 生物质炭与沼液配施提升了土壤反硝化作用(narG、nirS、nirK)功能基因丰度. 因此,可以根据包菜在不同生理期对硝态氮和铵态氮吸收比例的不同适当减少化肥的供应量以减少因硝化作用而产生的硝酸盐淋失. 生物质炭与沼液配施提升了土壤肥力,丰富了土壤氮循环微生物群落结构,促使包菜增产并提高了包菜氮素农学利用率. 因此结合当地种植背景,生物质炭与沼液部分替代化肥模式为绿色、可持续发展的施肥管理模式.
生物质炭-沼液联合施用对调控氮循环功能基因促进氮素增效的影响
Effects of combined application of biochar and biogas slurry on regulating nitrogen cycle function genes and promoting nitrogen efficiency
-
摘要: 为探讨生物质炭-沼液配施条件下氮循环功能基因调控农田土壤氮素转化并影响农作物氮素吸收利用机制. 本试验以浙江省杭州市红黄壤作为研究对象,设置生物质炭和沼液两个因素,探究生物质炭-沼液配施条件下土壤基本理化性质和氮循环功能基因丰度变化情况,刻画功能基因与农田氮素利用率间的耦合关系. 结果表明,生物质炭-沼液配施可以显著降低土壤容重,提升土壤pH和土壤氮素含量,其中,高剂量生物质炭-沼液配施(C3B2)处理较单施化肥(C0B0)处理铵态氮、硝态氮、全氮含量增幅均达到显著水平(P<0.05). 与空白处理(CK)相比,生物质炭-沼液配施(C3B2)处理则显著提高了反硝化功能基因丰度,较单施化肥(C0B0)处理增幅30.98%和44.99%. 冗余分析结果显示,铵态氮、硝态氮和有机碳含量对土壤氮循环功能基因影响较为显著,结构方程模型则表明硝化作用功能基因丰度的提升对包菜氮素农学利用率呈现负相关趋势. 研究结果表明,在相同养分施用量的条件下,生物质炭-沼液配施可显著提高土壤肥力. 氮素和有机碳含量是影响功能基因丰度的关键因素,硝化作用功能基因丰度的降低可以提高农田氮素利用率. 本研究结果可以为促进农业废弃物资源化利用,提升农田土壤氮素活性提供理论依据.Abstract: The objective of this study was to investigate the mechanism of nitrogen cycling function genes regulating soil nitrogen transformation and affecting crop nitrogen uptake and utilization under combined application of biochar and biogas slurry. In this study, red yellow soil was used as the research subject in Hangzhou, Zhejiang Province. The changes of soil basic physicochemical properties and nitrogen cycling gene abundance as well as the correlation between functional genes and nitrogen use efficiency were explored under the combined application of biogas slurry and biochar. The results were as follow: the combined application of biochar and biogas slurry could significantly reduce soil bulk density, increase soil pH and soil nitrogen content, among which, the contents of ammonium nitrogen, nitrate nitrogen and total nitrogen in the combined application of biochar and biogas slurry (C3B2) increased significantly compared with that in the single application of chemical fertilizer (C0B0) (P<0.05). The C3B2 treatment significantly increased the abundance of denitrifying functional genes by 30.98% and 44.99%, respectively, compared with (CK) and (C0B0) treatments. The results of redundancy analysis showed that the contents of NH4+-N, NO3−-N and organic carbon had significant effects on soil nitrogen cycling functional genes, while the structural equation model showed that the increase of the abundance of nitrification functional genes had a negative correlation with the nitrogen agronomic efficiency of cabbage. The results showed that under the same nutrient application rate, the combined application of biochar and biogas slurry could significantly improve soil fertility. The nitrogen and organic carbon contents were the key factors affecting the abundance of functional genes, the decrease of nitrification gene abundance could improve nitrogen use efficiency. The results of this study can provide a theoretical basis for promoting the resource utilization of agricultural waste and improving the activity of nitrogen in farmland soil.
-
Key words:
- biocher /
- biogas slurry /
- nitrogen cycling function gene /
- nitrogen use efficiency.
-
新型有机污染物(emerging organic contaminants, EOCs)指环境中新出现或最近引起关注,可能对生态系统和人体健康产生风险,管理措施不足或尚未纳入管理的有机污染物[1-4]. 主要包括药品和个人护理品(pharmaceuticals and personal care products, PPCP)、阻燃剂(flame retardant)、塑化剂(plasticizers)、杀虫剂,激素、表面活性剂等[3,5]. 这些EOCs在日常生活和工业生产中被频繁使用并广泛存在,如多溴联苯醚(polybrominated diphenyl ethers, PBDEs)是一种典型的溴代阻燃剂,具有阻燃效果好、生产成本低等特点,曾是应用最广泛的阻燃剂[6]. 近些年研究发现其具有环境持久性、生物累积性和生物毒性,目前已在全球范围内被禁用,并逐渐被有机磷酸酯阻燃剂(organophosphate flame retardants, OPFRs)取代[6—7]. 邻苯二甲酸酯(phthalic acid esters, PAEs)具有可塑性、耐久性,能够提高材料强度和透明度等优点[7—8],是一种常用的塑料添加剂,进入人体后经代谢转化可形成单酯或单酯的氧化产物即邻苯二甲酸酯代谢物(phthalate metabolites,mPAEs). 全氟及多氟烷基化合物(per-fluorinatedand polyfluoroalkyl compounds,PFASs)具有化学及热稳定性[9]、高表面活性及疏水疏油性[10]等特点,结构中含有极其稳定的C—F键,不易发生热解、光解、水解和生物降解,具有较强的生物蓄积性[11]. 上述化合物常以非化学键或直接添加的形式在塑料、建材、食品包装材料、电子设备、玩具、化妆品、农药、纸张、地毯、纺织品、家具等产品中被广泛使用[9,12—15],因而容易在产品生产、使用及回收处理过程经磨损、挥发等途径释放到环境中[16]. 目前已在土壤[17]、水体[18]、室内灰尘[19]等环境介质以及鱼[20]、蛋[21]等日常食品中被广泛检出,并可通过食物摄入、呼吸吸入和皮肤接触等途径进入人体,如血液、尿液、母乳、指甲等人体样品中已有关于PBDEs、PFASs、OPFRs、PAEs以及mPAEs检出的报道[22—26]. 同时研究发现这些EOCs能够导致人体内分泌紊乱,具有神经毒性、生殖毒性、内分泌毒性和致癌性等[27—28].
相较于血液、尿液、母乳等传统生物基质,头发具有采集方便、易储存、非侵入性采样、易被采集对象接纳等优点,常做为生物监测材料用于法医、毒品、重金属及有机污染物等研究,反映人体长期暴露情况. 尽管目前已有多篇文献报道了关于头发中EOCs检测方法[11, 29—31],但能够同时分析头发中多种EOCs的研究较为缺乏. 现有文献多采用硝酸消解的方法检测头发中的PBDEs、OPFRs和PAEs等污染物[6, 32—34],PFASs则多使用碱消解[35]. 两种消解方式存在费时、耗费溶剂、缺乏安全性等缺点. 此外有研究显示,酸/碱消解破坏头发结构的同时释放的一些内源性物质可能会影响头发中目标污染物如PFASs[11]的检测,具有一定局限性;相比之下,头发研磨后经有机溶剂萃取,能够更准确的反映头发中PFASs的污染水平[11, 36-37],然而该方法是否同样适用于其他种类的EOCs目前还缺少相关的文献报道.
因此,本研究在以往研究的基础上,通过优化有机萃取溶剂和分散固相萃取剂种类,建立了仅用少量头发样品(0.1 g)和有机溶剂即可同时检测头发中15种PAEs、12种PFASs、11种OPFRs、8种mPAEs及8种PBDEs共5大类54种EOCs的前处理方法,该方法节约溶剂且更为安全快速,同时采用本研究建立的前处理方法,分析了广州市10例普通男性头发中5类有机污染物的浓度水平.
1. 材料与方法(Materials and methods)
1.1 材料、试剂与仪器
材料与试剂:离心管(目盛付,日本),色谱级乙酸铵(CH3COONH4)、甲酸(HCOOH)、乙腈(ACN)、乙酸乙酯(EtAC)、甲基叔丁基醚(MTBE)、异辛烷(ISO)、正己烷(HEX)、二氯甲烷(DCM)和丙酮(ACE),无水硫酸镁(MgSO4)、无水硫酸钠(Na2SO4)、N-丙基乙二胺(PSA)、十八烷基硅烷键合硅胶(C18)和石墨化炭黑(GCB)(上海安谱实验科技股份有限公司,中国),甲醇(MEOH)(默克,德国).
仪器:AB SCIEX API 4000三重四极杆质谱仪(AB SCIEX, 美国);Agilent 7890B气相色谱仪、Agilent 1260液相色谱仪、Agilent 5977A质谱仪、Agilent 5975C质谱仪、DB-5HT毛细管柱(15 m×0.25 mm i.d., 0.10 μm)、DB-5MS毛细管柱(30 m×0.25 mm i.d., 0.25 μm)、Poroshell 120EC-C18(2.1 mm×100 mm, 2.7 μm)(安捷伦,美国);Kinetex EVO-C18100 A色谱柱(2.1 mm×100 mm, 5 μm),Kinetex×2.6 μm Bipheny l00 A(2.1 mm×100 mm)(Phenomenex,美国). 分析天平(上海安亭电子仪器厂,中国),氮吹仪(柏林河西路,美国),Milli-Q超纯水系统(默克,德国),涡旋振荡器(特朗纳,美国),冷冻干燥机(SP Scientific,美国),Eppendorf 5810低速冷冻离心机(Eppendorf,比利时). KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司,中国),行星式球磨仪(弗卡斯实验仪器有限公司,中国).
1.2 标准品
PBDEs、PAEs、mPAEs化合物标准品(AccuStandard,美国),PFASs化合物标准品(wellington,加拿大),OPFRs化合物标准品(CIL(Cambridge Isotope Laboratorie),美国)及对应内标标准品信息见表1.
表 1 目标化合物及内标标准品信息Table 1. The information of target chemicals and internal standards目标化合物Target chemicals 内标Internal standards 目标化合物Target chemicals 内标Internal standards 目标化合物Target chemicals 内标Internal standards 目标化合物Target chemicals 内标Internal standards 目标化合物Target chemicals 内标Internal standards PAEs PFASs OPFRs mPAEs PBDEs 邻苯二甲酸二甲酯(DMP) d4-邻苯二甲酸二丁酯(d4-DNBP) 全氟庚酸(PFHpA) 13C12-全氟辛酸(MPFOA) 磷酸三苯酯(TPHP) d15-磷酸三苯酯(d15-TPHP) 邻苯二甲酸单(2-乙基-5-羟基己基)酯(5OH-MEHP) 13C4-邻苯二甲酸单2-乙基-5-羟基己基酯(13C4-5OH-mEHP) 2,4,4-三溴联苯醚(BDE28) 2,3',4,4',5-五溴联苯醚(BDE118) 邻苯二甲酸二乙酯(DEP) 全氟辛酸(PFOA) 磷酸三异丙酯(TIPRP) d18-三(2-氯丙基)磷酸酯(d18-TCIPP) 邻苯二甲酸单(2-乙氧-5-氧己基)酯(5Oxo-MEHP) 邻苯二甲酸单(2-乙氧-5-氧己基)酯-13C4,(5Oxo-MEHP-13C4) 2,2',4,4'-四溴联苯醚(BDE47) 邻苯二甲酸二异丁酯(DIBP) 全氟壬酸(PFNA) 磷酸三乙酯(TEP) d12-三(2-氯乙基)磷酸酯(d12-TCEP) 邻苯二甲酸单(2-乙基己基)酯(mEHP) 邻苯二甲酸单(2-乙基己基)酯-13C4(mEHP-13C4) 2,2',4,4',5-五溴联苯醚(BDE99) 邻苯二甲酸二丁酯(DNBP) 全氟癸酸(PFDA) 磷酸三丁酯(TNBP) d15-磷酸三苯酯(d15-TPHP) 邻苯二甲酸单乙酯(mEP) 13C4-邻苯二甲酸单乙酯(13C4-mEP) 2,2',4,4',6-五溴联苯醚(BDE100) 邻苯二甲酸二甲氧乙酯(DMEP) 全氟十一烷酸(PFUdA) 13C12-全氟辛烷磺酸(MPFOS) 磷酸三(2-丁氧乙基)酯(TBOEP) 邻苯二甲酸单辛基乙酯(mnOP) d4-邻苯二甲酸单辛酯(d4-mnOP) 2,2',4,4',5,5'-六溴联苯醚(BDE153) 2,2',3,3',4,4'-六溴联苯醚(BDE128) 邻苯二甲酸二-4-甲基-2-戊基酯(DMPP) 全氟十二烷酸(PFDoA) 磷酸三2-乙基己基酯(TEHP) 邻苯二甲酸单苄基酯(mBzP) 13C4-邻苯二甲酸单苄基酯(13C4-mBzP) 2,2',4,4',5,6'-六溴联苯醚(BDE154) 邻苯二甲酸双-2-乙氧基乙酯(DEEP) 全氟十三烷酸(PFTrDA) 13C12-全氟辛酸(MPFOA) 2-乙基己基二苯基磷酸酯(EHDPP) 邻苯二甲酸单异壬酯(minP) d4-邻苯二甲酸单辛酯(d4-mnOP) 2,2',3,4,4',5',6-七溴联苯醚(BDE183) 邻苯二甲酸二戊酯(DPP) 全氟十四烷酸(PFTeDA) 磷酸三(2-氯乙基)酯(TCEP) d12-三(2-氯乙基)磷酸酯(d12-TCEP) 邻苯二甲酸单异丁酯(miBP) 13C4-邻苯二甲酸单正丁酯(13C4-mnBP) 十溴联苯醚(BDE209) 13C12-十溴联苯醚(13C12-BDE209) 邻苯二甲酸二己酯(DHP) 全氟丁烷磺酸盐(PFBS) 13C12-全氟辛烷磺酸(MPFOS) 磷酸三(2-氯丙基)酯(TCIPP) d18-三(2-氯丙基)磷酸酯(d18-TCIPP) 邻苯二甲酸丁苄酯(BBP) 全氟己烷磺酸盐(PFHxS) 三(1,3-二氯-2-丙基)磷酸酯(TDCIPP) d15-三(1,3-二氯-2-丙基)磷酸酯(d15-TDCIPP) 邻苯二甲酸二(2-丁氧基)乙酯(BBEP) 全氟辛烷磺酸(PFOS) 磷酸三甲苯酯(TCP) 邻苯二甲酸二(2-乙基)己酯(DEHP) 全氟癸烷磺酸盐(PFDS) 邻苯二甲酸二苯酯(DPHP) 邻苯二甲酸二正辛酯(DOP) 邻苯二甲酸二壬酯(DNP) 1.3 样本采集与前处理
以广州市年龄在18—40岁,且近期无烫染发行为的男性作为研究对象,志愿者在了解本次研究目的并签署知情同意书后,贴近头皮采集全部头发样品,铝箔纸包裹编号后放入密实袋,干燥阴凉处保存,每份样品大于5 g. 采集后的头发置于锥形瓶, Milli-Q水振荡清洗两遍,去除头发表面附着的灰尘等外部污染物,进行冷冻干燥. 实验前用HEX洗过的不锈钢剪刀将其剪短至0.5—1 cm. 采用行星式球磨仪将头发样品充分研磨成粉/絮状. 取0.1 g研磨头发于离心管加入1mL EtAC及20 μL各类目标物的同位素内标(OPFRs、PFASs、mPAEs的内标及13C12-BDE 209的质量浓度为100 ng·mL−1,BDE 118、BDE 128的质量浓度为200 ng·mL−1,PAEs 内标的质量浓度为500 ng·mL−1),通风橱静置过夜使溶剂挥发. 然后加入HEX、ACE、ACN及EtAC(1:1:1:1, V/V/V/V)的混合溶液4 mL,2000 r·min−1涡旋4 min, 20 ℃ 超声20 min,4000 r·min−1离心15 min取上清,重复3次. 上清液氮吹浓缩至1 mL后加入 20 mg 无水Na2SO4和100 mg C18进行净化. 1200 r·min−1涡旋7 min、3500 r·min−1离心15 min,转移上清液至干净的玻璃管中,氮吹近干后200 μL MEOH复溶,-20 ℃下静置4—6 h冷冻沉淀除杂,上清液待GC-MS、GC-MS/MS和LC-MS/MS检测分析.
1.4 仪器分析
PBDEs和PAEs分别采用气相色谱-质谱联用仪(GC-MS)和三重四极杆气相色谱质谱联用仪(GC-MS/MS)进行分析. PBDEs:负化学离子源(NCI),DB-5HT色谱柱(15 m×0.25 mm i.d., 0.10 μm)分离. 起始温度110 °C,保留5 min,20 °C·min−1升至200 °C,保持4.5 min,10 °C·min−1升至310 °C,保持15 min. PAEs:DB-5MS毛细管柱(30 m × 0.25 mm i.d., 0.25 μm),进样口温度290℃,传输线温度150 ℃;载气为氦气,流速1 mL·min−1;起始温度90 ℃,15 °C·min−1的速率升至310 ℃,保持5 min. 溶剂延迟5 min,EI源,电子轰击能量70 eV,多重反应监测模式(MRM);离子源温度230 ℃,四极杆温度150 ℃. 不分流进样且进样量均为1 μL.
OPFRs、PFASs、mPAEs使用Agilent 1260液相色谱仪、AB SCIEX API 4000+ MS/MS三重四极杆串联质谱仪分析(LC-MS/MS),色谱柱分别为:Kinetex 2.6 μm Biphenyl 100 A(2.1 mm×100 mm)、Poroshell 120 EC-C18(4.6 mm× 100 mm, 2.7 μm)、Kinetex EVO-C18 100 A(2.1 mm × 100 mm,5 μm),均采用电喷雾电离源(ESI)及多反应监测模式(MRM),进样量5 μL,其余仪器分析条件见表2.
表 2 OPFRs、PFASs及mPAEs的液相色谱和质谱参数Table 2. Liquid chromatography and mass spectrometry parameters of OPFRs, PFASs and mPAEs分析条件Analytical Conditions OPFRs PFASs mPAEs 色谱条件(流动相、洗脱梯度) Chromatographic conditions(Mobile phase, elution gradient) A:甲醇,B:0.01 mol·L−1乙酸铵溶液;0—0.1 min:65% B0.1—9 min:65%—5% B9—13 min:5%—0% B13—14 min:0% B14—15.1 min:0%—65% B15.1—20 min:65% B柱温40 ℃,流速250 μL·min−1 A:乙腈,B:0.01 mol·L−1乙酸铵溶液;0—1 min:20% A1—8 min:20%—100% A8—12.5 min:100% A12.5—13 min:100%—20% A13—18 min:20% A柱温50 ℃,流速300 μL·min−1 A:乙腈,B:0.1%甲酸水溶液,0—12 min:15%—45% A12—15 min:45% A15—19 min:45%—98% A19-21 min:98% A21—21.1 min:98%—15% A21.1-25 min:15% A柱温40 ℃,流速300 μL·min−1 质谱条件Mass spectrometry conditions 正离子扫描方式;毛细管电压:4000 V;气体(N2)温度:550 ℃ 负离子扫描方式,离子喷雾电压为-4500 V,离子源温度为450℃ 负离子扫描方式,离子喷雾电压4000 V,气体(N2)温度350℃ 1.5 质量保证与质量控制(QAQC)
所有玻璃器材使用前均采用碱液(pH>11)浸泡4 h以上,经自来水及超纯水冲洗并用烘箱烘干,再在400 ℃的马弗炉中焙烧4 h,使用前经DCM和HEX淋洗吹干. 方法定量限(limit of quantification,LOQ)和方法检出限(limit of detection,LOD)为空白样品中目标化合物浓度的均值加10倍或者3倍标准差,空白未检出时定义为10倍或者3倍信噪比. 实验采用内标法定量,设置空白、基质、空白加标和基质加标等4组实验且每组3个重复,用空白加标和基质加标浓度减去空白和基质的平均浓度计算回收率和相对标准差.
2. 结果与讨论(Results and discussion)
2.1 前处理条件优化
2.1.1 分散固相萃取剂的选择
现有研究中,EtAC、HEX、ACE、MTBE常用作OPFRs、PAEs、PAFSs和PBDEs的提取剂或洗脱剂[38—42] ,本研究在以往研究基础上首先采用ACE、HEX和MTBE对头发中污染物进行提取[16]. 分散固相萃取剂参考Zafeiraki [21]和熊仕茂[43]对OPFRs和PFASs的净化条件,具体如表3中方案1所示. 另有文献指出,研磨处理可提高头发样品中污染物的提取效率[11,37,44],故本研究在进行EOCs提取前将所有头发充分研磨成粉/絮状.
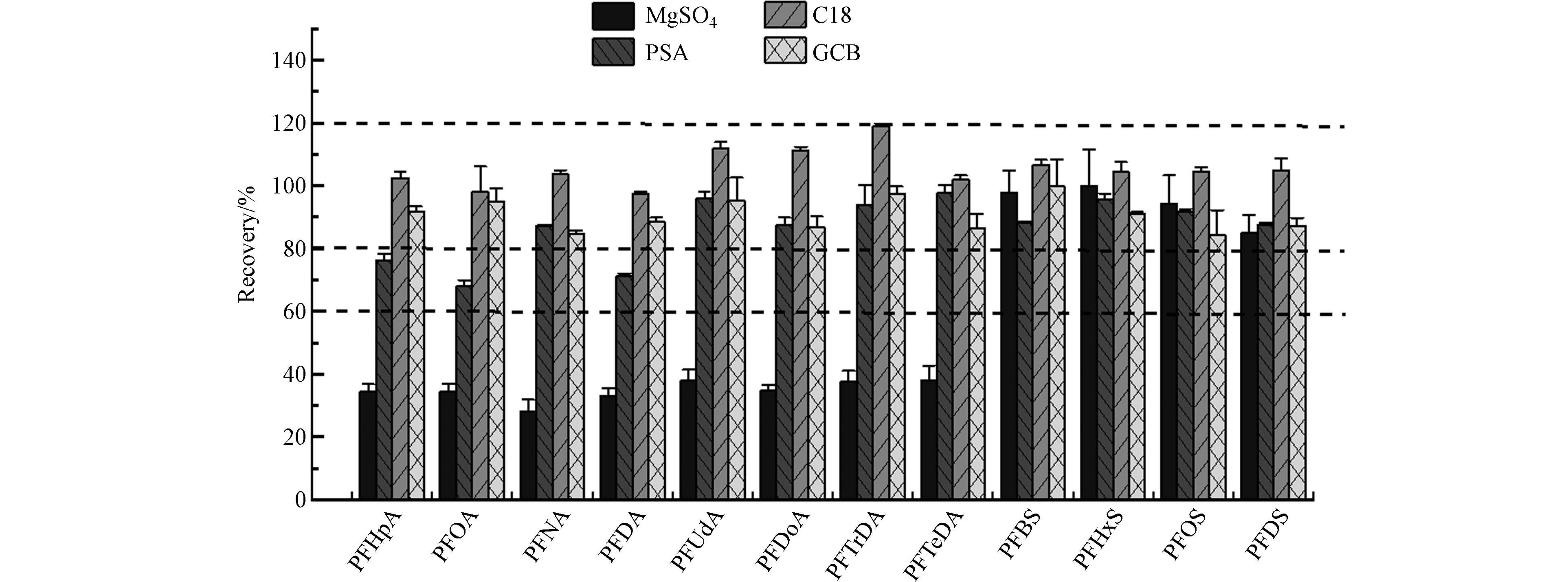
表 3 有机提取溶剂和分散固相萃取填料的4种前处理方案Table 3. Four pretreatment schemes of organic extraction solvent and dispersed solid phase extraction filler方案Scheme 有机提取溶剂Organic extraction solvent 分散固相萃取剂Disperse solid phase extractant 1 ACE,HEX,MTBE 无水MgSO4,PSA,C18 2 ACE,HEX,MTBE 无水Na2SO4,C18 3 EtAC,HEX,MTBE 4 EtAC,HEX,ACN,ACE 头发样品经方案1处理后,PBDEs、OPFRs和PAEs三类污染物均有较好效果,回收率和相对标准偏差分别介于40%—129%和0.1%—21.4%之间. 而PFASs中仅PFHxS、PFOS和PFDS的回收率在60%以上,其余几种化合物空白和基质加标的回收率小于7%,损失较为严重. 为进一步探究分散固相萃取填料对PFASs的影响,溶剂加标后分别采用MgSO4、PSA、C18和GCB净化,结果如图1所示. PFASs的回收率整体呈现C18>GCB>PSA>MgSO4的趋势. 其中经MgSO4处理后,8种全氟烷酸的回收率均低于50%,推测MgSO4可能对PFASs类污染物具有较强的吸附效应,因此回收率相对差. MgSO4作为干燥剂可吸收溶液中的微量水分[38, 45],考虑到可能存在的吸附作用,后续实验改用无水Na2SO4. C18一般用于去除脂肪等非极性杂质[38],研究结果显示其对大多数化合物的影响最小[46],因此实验选用无水Na2SO4和C18作为净化填料.
2.1.2 有机萃取溶剂的优化
确定净化填料后,进一步对有机萃取溶剂展开优化. Alves等[22]分别比较了乙酸乙酯、异丙醇、四氢呋喃/异丙醇的(50:50, V/V)对PFASs的提取效果,发现乙酸乙酯效果最好(回收率69.0%—141%之间). 此外乙酸乙酯常作为OPFRs优良的提取剂或洗脱剂,能够获得较好的回收效果[41],故本研究分别对比了ACE+HEX+MTBE(方案2)和EtAC+HEX+MTBE(方案3)对5类污染物的提取效率. 结果显示,经方案2处理后,EHDPP、PFHpA和PFOA的回收率较差,回收率在29.6%—42.8%之间;而方案3处理后EHDPP、PFBS的回收率在21.4%—48.2%之间,两种方案均存在一定的缺陷.
综合以上实验结果,考虑到mPAEs属于亲水性化合物,因此进一步采用EtAC+HEX+ACE+ ACN(方案4)作为提取剂,无水Na2SO4和C18作为净化剂对头发进行前处理,结果如图2所示. PBDEs、PFASs、OPFRs、PAEs和mPAEs基质加标回收率在53.6%—138%之间,RSD:0.01%—18.9%,化合物整体回收率较之前有大幅提升. 值得注意的是,PFASs和OPFRs中回收率一直低于40%的PFDA、EHDPP、TCP等化合物,经过方案4处理后效果得到明显改善,回收率和相对标准偏差分别为53.6%—138%和0.01%—16.0%.
2.2 方法学验证
2.2.1 标准曲线和检出限
本研究采用内标法定量,使用甲醇和异辛烷将“1.2”中标准品进行稀释,分别配制mPAEs、PFASs、OPFRs及PBDEs混合溶液,然后依次稀释成9个系列浓度(2.0、5.0、10.0、20.0、50.0、100.0、200.0、500.0、1000.0 ng·mL−1). 考虑到样品中较高的检出浓度,PAEs标曲浓度为5.0、10.0、20.0、50.0、100.0、200.0、500.0、1000.0、2000.0、3000.0、4000.0、5000.0 ng·mL−1. 所配标准曲线在仪器最佳条件下检测,以待测物与对应内标峰面积比值Y对其质量浓度比值X进行分析,各目标化合物在相应浓度范围有良好线性关系,相关系数(correlation coefficient, R)均大于0.995. 按照“1.5”中方法计算每种化合物的方法定量限和检出限. PBDEs、OPFRs、PAEs、mPAEs和PFASs的检出限在0.042—364.7 ng·g−1之间,详见表4.
表 4 目标化合物相关系数(R)、定量限(LOQ)及检出限(LOD)(ng·g−1)Table 4. Correlation coefficient (R), Limit of Quantification (LOQ) and Limit of Detection (LOD) of target chemicals目标物Target chemicals 相关系数(R) 定量限(LOQ) 检出限(LOD) 目标物Target chemicals 相关系数(R) 定量限(LOQ) 检出限(LOD) PAEs PFASs DMP 0.999 20.98 6.294 PFHpA 0.997 2.429 0.729 DEP 0.999 32.35 9.705 PFOA 0.998 1.788 0.537 DIBP 0.995 1215 364.7 PFNA 0.997 1.208 0.362 DNBP 0.998 856.0 256.8 PFDA 0.997 0.816 0.245 DMEP 0.998 15.11 4.533 PFUdA 0.996 0.668 0.200 DMPP 0.999 1.996 0.599 PFDoA 0.999 0.344 0.103 DEEP 0.997 17.29 5.186 PFTrDA 0.997 1.098 0.329 DPP 0.997 0.581 0.174 PFTeDA 0.997 1.457 0.437 DHP 0.999 0.297 0.089 PFBS 0.999 0.152 0.045 BBP 0.999 0.690 0.207 PFHxS 0.998 0.140 0.042 BBEP 0.999 1.129 0.339 PFOS 0.999 0.377 0.113 DEHP 0.997 1074 322.2 PFDS 0.997 0.457 0.137 DPHP 0.999 0.159 0.048 DOP 0.999 0.629 0.189 DNP 0.996 12.89 3.866 OPFRs mPAEs TPHP 0.995 1.044 0.313 5OH-MEHP 0.998 3.249 0.975 TIPRP 0.998 0.187 0.056 5Oxo-MEHP 0.998 0.146 0.044 TEP 0.999 0.574 0.172 mEHP 0.998 48.16 14.45 TNBP 0.995 17.12 5.135 mEP 0.999 2.874 0.862 TBOEP 0.997 1.280 0.384 mnOP 0.998 0.574 0.172 TEHP 0.999 4.726 1.575 mBzP 0.998 0.315 0.095 EHDPP 0.996 3.822 1.147 miNP 0.998 0.465 0.139 TCEP 0.999 12.44 3.731 miBP 0.997 21.79 6.538 TCIPP 0.998 6.327 1.898 TDCIPP 0.999 32.51 9.752 TCP 0.998 22.59 6.776 PBDEs PBDEs BDE 28 0.997 1.546 0.464 BDE 153 0.999 0.513 0.154 BDE 47 0.996 7.813 2.344 BDE 154 0.999 4.673 1.402 BDE 99 0.999 2.179 0.654 BDE 183 0.999 3.419 1.026 BDE 100 0.999 1.783 0.535 BDE 209 0.999 1.506 0.452 2.2.2 准确度和精密度
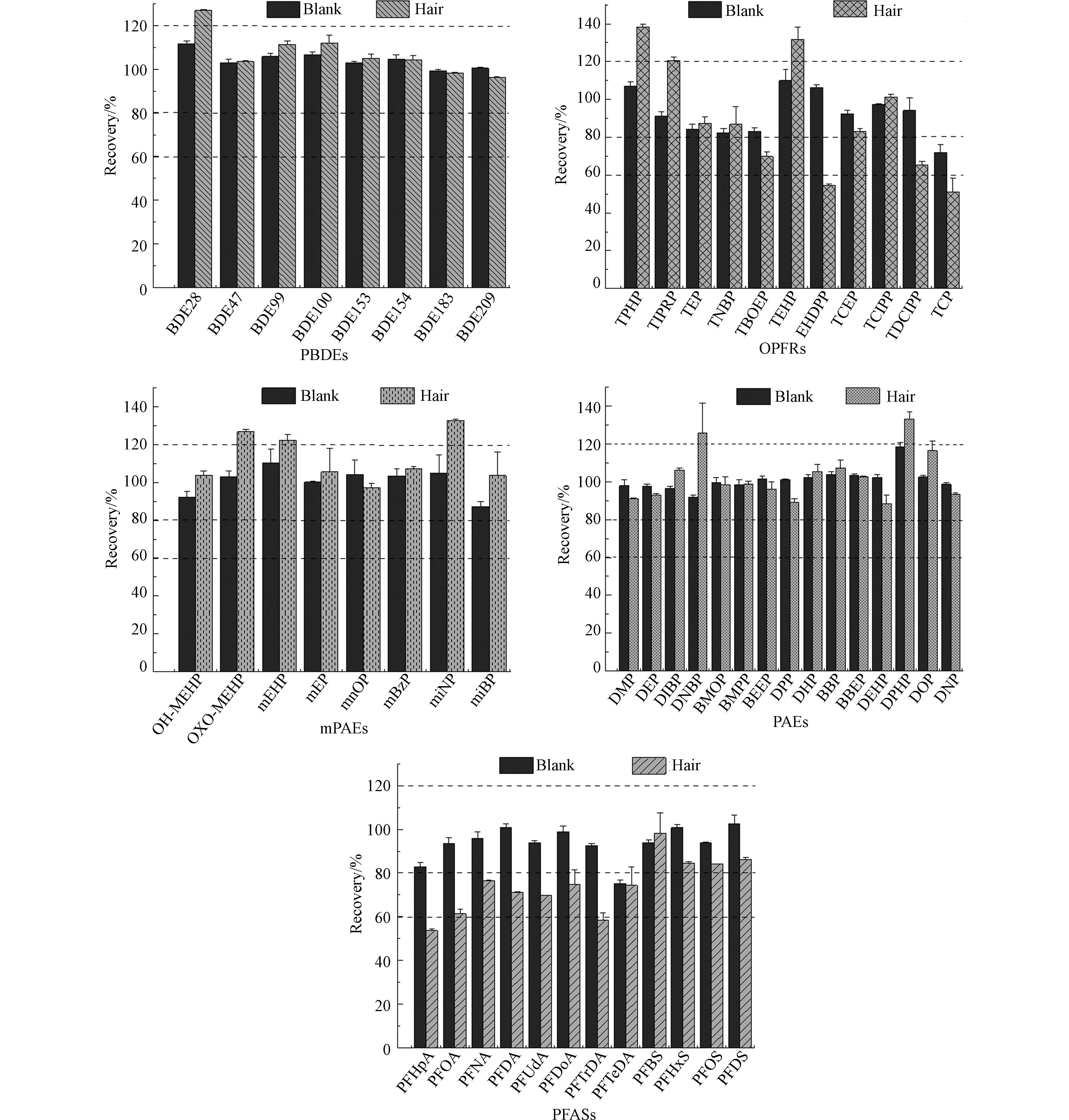
准确度采用目标化合物在头发样品中的加标回收率确定,精密度用平行样品之间的相对标准偏差(RSD)表示,使用同一标曲点每日重复测定3次且连续测定3 d获得的日内/间精密度评价方法的稳定性. 头发样品中5类化合物的基质加标回收率、相对标准差结果及样品基质加标色谱图如表5及图3所示. 经方案4处理后,5类化合物回收率及相对标准偏差均在可接受范围. 其中PBDEs回收率范围为:96. 4%—127%(RSD<4%);OPFRs:54. 7%—138%(RSD<7%);PFASs:53.6%—98.2%(RSD<10%);PAEs:88.3%—126%(RSD<16%);mPAEs:97.2%—133%(RSD<15%),所有化合物日内/间精密度均<20%,结果表明该前处理方法和操作过程适合用于头发中此5类污染物的分析.
表 5 目标化合物的基质加标回收率±相对标准差及精密度(%)Table 5. Matrix spiked recoveries, relative standard deviations and precisions of target chemicals目标物Target chemicals 回收率/%(Rec.±RSD)Recoveries 日内精密度/%Intraday precisions 日间精密度/%Interday precisions 目标物Target chemicals 回收率/%(Rec.±RSD)Recoveries 日内精密度/%Intraday precisions 日间精密度/%Interday precisions PAEs PFASs DMP 91.0±0.47 2.19 3.86 PFHpA 53.6±0.94 10.4 11.1 DEP 93.1±0.50 1.99 2.63 PFOA 61.4±2.19 9.75 11.5 DIBP 106±1.11 2.58 9.14 PFNA 76.6±0.08 4.90 5.51 DNBP 126±16.0 1.87 2.41 PFDA 71.1±0.30 3.55 11.7 DMEP 98.5±4.04 3.43 9.66 PFUdA 69.8±0.01 1.95 2.98 DMPP 98.9±1.45 2.11 15.5 PFDoA 74.7±6.78 1.47 3.09 DEEP 96.2±3.85 5.09 13.7 PFTrDA 58.6±3.37 2.02 3.01 DPP 89.1±1.99 4.12 13.3 PFTeDA 74.4±8.36 2.69 2.47 DHP 105±3.70 7.89 14.3 PFBS 98.2±9.26 2.93 3.58 BBP 107±4.10 5.72 13.9 PFHxS 84.7±0.51 4.38 4.23 BBEP 102±0.45 3.34 10.1 PFOS 84.1±0.12 3.11 2.86 DEHP 88.3±4.70 4.01 3.91 PFDS 86.3±1.00 3.96 3.75 DPHP 133±3.67 7.12 14.1 DOP 116±5.20 17.1 14.6 DNP 93.5±0.44 17.7 16.7 mPAEs OPFRs 5OH-MEHP 104±2.47 2.77 7.42 TPHP 138±1.71 3.53 6.07 5Oxo-MEHP 127±1.30 3.08 11.2 TIPRP 120±1.93 2.59 1.31 mEHP 122±3.21 4.84 7.23 TEP 87.4±3.52 5.88 3.16 mEP 106±12.4 8.24 9.32 TNBP 86.8±9.29 6.24 4.64 mnOP 97.2±2.20 5.07 8.89 TBOEP 69.8±2.41 3.42 4.23 mBzP 107±0.81 3.72 8.37 TEHP 132±6.31 3.25 5.90 miNP 133±0.72 2.44 2.00 EHDPP 54.7±0.42 5.40 10.4 miBP 104±12.6 6.22 6.88 TCEP 83.3±1.18 3.27 5.85 TCIPP 101±1.60 2.22 0.66 TDCIPP 65.2±2.04 1.53 1.20 TCP 67.7±8.31 2.16 0.64 PBDEs PBDEs BDE 28 127±0.47 2.07 5.76 BDE 153 105±1.85 5.91 10.2 BDE 47 104±0.45 0.66 5.66 BDE 154 104±1.97 4.28 9.02 BDE 99 111±1.68 0.89 4.94 BDE 183 98.4±0.38 5.41 8.02 BDE 100 112±3.82 4.58 6.26 BDE 209 96.4±0.36 0.18 0.12 2.3 头发样品分析及验证
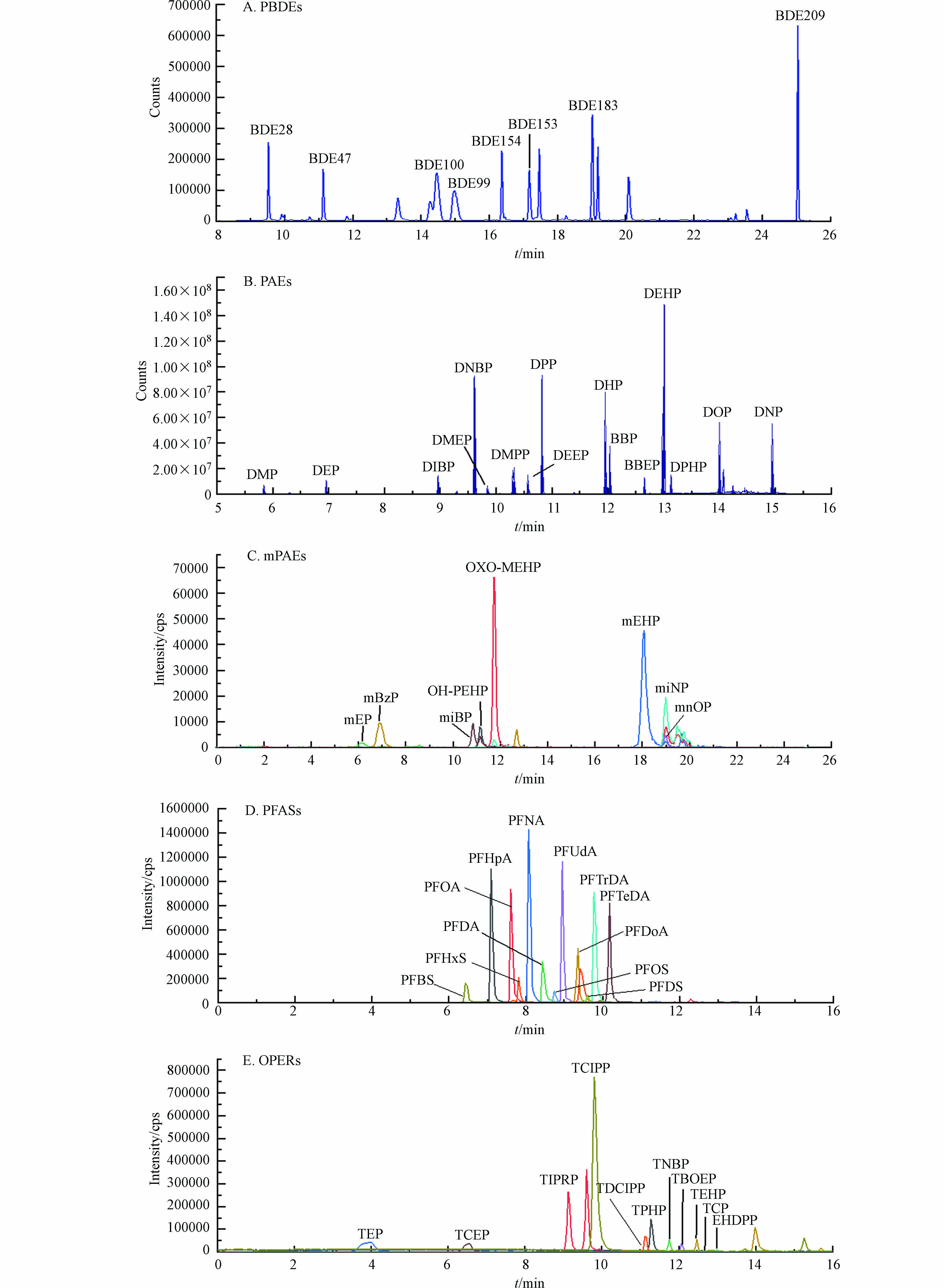
将本研究建立的前处理方法用于检测广州市10例普通男性头发样品,结果显示5类EOCs在头发中均有检出(表6). PBDEs中主要检出污染物为BDE 209,检出率为100%,浓度在1.09 —36.6 ng·g−1 之间. OPFRs和PAEs检出污染物种类最多,其中TPHP、TEHP、EHDPP、TCEP、TCIPP、 DMP、DEP、DIBP、DNBP、DEHP在所有样品中均有检出,检出率为100%,含量介于2.69 —4951 ng·g−1之间. mEHP和miBP是mPAEs中最主要检出的两种化合物,检出率为100%,浓度分别为27.0—298 ng·g−1和15.0—38.6 ng·g−1. PFASs中主要检出的是PFOS和PFUdA,检出率分别为100%和90%,含量范围分别为1.40—17.9 ng·g−1和nd—0.58 ng·g−1. 头发主要检出污染物种类与之前报道相一致,其中 PBDEs和OPFRs检出浓度水平与广州居民头发的检出含量类似(2.61—56.86 ng·g−1、nd—287 ng·g−1)[47— 48];PAEs和mPAEs的浓度与重庆城市居民及希腊孕妇的报道相似(9.22—5890 ng·g−1、1.10—412.9 ng·g−1)[34, 49],而 PFASs检出浓度水平明显高于深圳居民(<0.03—1.60 ng·g−1)[24]. 值得注意的是,包括DMPP、DHP、TIPRP、PFBS和mnOP在内的24种目标物在所有样品中均未检出,表明这些污染物受试者日常生活中的暴露程度可能相对较低.
表 6 经研磨和消解处理后测得的头发样品中EOCs的检出率和浓度范围Table 6. Detection frequency and concentration range of EOCs detected by hair samples after grinding and digestion化合物Chemicals 研磨Grind 消解Digestion 检出率/%Detection frequency 浓度范围/(ng·g−1)Concentration range 检出率/%Detection frequency 浓度范围/(ng·g−1)Concentration range OPFRs TPHP 100 6.32—332 100 20.9—476 TIPRP 0 nd 0 nd TEP 0 nd 0 nd TNBP 30 nd—7.85 55 nd—7.37 TBOEP 60 nd—33.5 33 nd—2.54 TEHP 100 2.69—30.3 100 3.63—30.2 EHDPP 100 8.14—176 100 16.2—174 TCEP 100 6.38—36.6 100 4.04—44.7 TCIPP 100 14.9—132 100 1.38—48.0 TDCIPP 80 nd—390 66 nd—177 TCP 0 nd 0 nd PBDEs BDE 28 0 nd 0 nd BDE 47 0 nd 0 nd BDE 99 0 nd 0 nd BDE 100 0 nd 0 nd BDE 153 0 nd 0 nd BDE 154 0 nd 0 nd BDE 183 0 nd 0 nd BDE 209 100 1.09—36.6 100 0.57—41.4 PFASs PFHpA 30 nd—2.04 0 nd PFOA 70 nd—2.47 0 nd PFNA 60 nd—1.05 0 nd PFDA 30 nd—0.36 0 nd PFUdA 90 nd—0.58 0 nd PFDoA 70 nd—0.24 0 nd PFTrDA 10 nd—0.47 0 nd PFTeDA 30 nd—0.08 0 nd PFBS 0 nd 0 nd PFHxS 0 nd 0 nd PFOS 100 1.40—17.9 0 nd PFDS 0 nd 0 nd PAEs DMP 100 63.9—181 na na DEP 100 127—2593 na na DIBP 100 804—4823 na na DNBP 100 1074—4402 na na DMEP 0 nd na na DMPP 0 nd na na DEEP 0 nd na na DPP 20 nd—334 na na DHP 0 nd na na BBP 0 nd na na BBEP 0 nd na na DEHP 100 326—4951 na na DPHP 20 nd—1.50 na na DOP 0 nd na na DNP 0 nd na na mPAEs 5OH-MEHP 60 nd—4.53 0 nd 5Oxo-MEHP 0 nd 0 nd mEHP 100 27.0—298 0 nd mEP 30 nd—260 0 nd mnOP 0 nd 0 nd mBzP 0 nd 0 nd miNP 0 nd 0 nd miBP 100 15.0—38.6 0 nd 注:nd 未检出;na 未获得. Note: nd, not detected, na, not available. 此外,为进一步验证研磨处理能否使头发中的污染物完全释放,本研究参考Tang[50]等的研究方法,将上述10例样品采用硝酸消解处理,液液提取后过弗罗里硅土小柱净化,上机后分析. 结果显示PFASs的回收率非常差,13C12-PFOA同位素内标回收率不足30%,而mPAEs同位素内标几乎全部损失. 同时发现PBDEs和OPFRs浓度与采用研磨处理后的水平相当(表6),进一步表明采用该方法对头发样品进行前处理能够准确反映人体中5类EOCs的暴露水平.
3. 结论(Conclusion)
本文在现有研究基础上对头发样品前处理条件进行优化,建立了EtAC : HEX : ACE : ACN(1 : 1 : 1 : 1, V/V/V/V)混合溶液超声提取、C18和无水Na2SO4分散固相萃取填料净化分析头发中5类新型有机污染物的方法,结果显示15种PAEs、12种PFASs、11种OPFRs、8种mPAEs及8种PBDEs共54种EOCs的回收率在53.6%—138%之间. 采用该方法对广州10例普通男性头发样本进行分析,结果显示5类污染物在头发中均有检出,其中PFOS、DMP、DEP、DINP、DNBP、DEHP、miBP、mEHP、TPHP、TEHP、EHDPP、TCEP、TCIPP及BDE 209是最主要的污染物,检出率为100%,浓度范围在1.09— 4951 ng·g−1之间. 另外还将此结果与头发硝酸消解处理后的浓度水平进行了对比,表明该前处理方法可用于分析头发中的PBDEs、OPFRs、PFASs、PAEs和mPAEs类污染物. 本文建立的前处理方法仅需0.1 g样品和少量有机溶剂即可获得良好回收率和精密度,灵敏度高且简单快速,能同时有效检测头发中多种痕量新型有机污染物,可为人体多种有机污染物长期暴露研究提供技术参考.
-
表 1 试验设计方案
Table 1. Test design scheme
处理Treatment 生物质炭a/%Biocher 沼液b/%Biogas slurry 处理Treatment 生物质炭/%Biocher 沼液/%Biogas slurry 处理Treatment 生物质炭/%Biocher 沼液/%Biogas slurry C0B0 0 0 C0B1 0 50 C0B2 0 100 C1B0 0.5 0 C1B1 0.5 50 C1B2 0.5 100 C2B0 1 0 C2B1 1 50 C2B2 1 100 C3B0 2 0 C3B1 2 50 C3B2 2 100 a代表生物质炭占小区耕层土壤总重比,b代表所施沼液全氮量占施氮总量比. 根据本项目小区面积和沼液全氮含量,0%生物质炭施用量为0 kg,0.5%生物质炭施用量为13.5 kg,1%生物质炭施用量为27 kg,2%生物质炭施用量为54 kg,0%沼液施用量为0 L,50%沼液施用量为22.7 L,100%沼液施用量为45.4 L. The percentage of biocher application represents the percentage of the total weight of residential tillage soil; the percentage of biogas slurry application represents the percentage of total biogas slurry applied for the total nitrogen applied. According to the residential area and total nitrogen content of biogas slurry, The application amount of 0% biochar was 0 kg, The application amount of 0.5% biochar was 13.5 kg, The application amount of 1% biochar was 27 kg, The application amount of 2% biochar was 54 kg, 0% biogas slurry application amount was 0 L, 50% biogas slurry application amount was 22.7 L and 100% biogas slurry application amount was 45.4 L. 表 2 功能基因PCR扩增引物
Table 2. Primers for PCR amplification of functional genes
目标基因 Target gene 引物 Primer 引物序列(5'-3') Primer sequences amoA-A Arch-amoAFArch-amoAR STAATGGTCTGGCTTAGACGGCGGCCATCCATCTGTATGT amoA-B amoA-1FamoA-2R GGGGTTTCTACTGGTGGTCCCCTCKGSAAAGCCTTCTTC nxrA F1370FF2843R CAGACCGACGTGTGCGAAAGTCCACAAGGAACGGAAGGTC narG narG 1960FnarG 2650R TAYGTSGGCCARGARAATTYTCRTACCABGTBGC nirS Cd3AfR3cd GTSAACGTSAAGGARACSGGGASTTCGGRTGSGTCTTGA nirK F1aCuR3Cu ATCATGGTSCTGCCGCGGCCTCGATCAGRTTGTGGTT nosZ nosZFnosZ1662R CGYTGTTCMTCGACAGCCAGCGSACCTTSTTGCCSTYGCG napA napAV67FnapAV67R TAYTTYYTNHSNAARATHATGTAYGGDATNGGRTGCATYTCNGCCATRTT 表 3 不同生物质炭和沼液处理下土壤理化性质
Table 3. The physicochemical properties of the soil under different biocher and biogas slurry treatments
处理Trentment pH 容重/(g·cm-3)SBD 硝态氮/(mg·kg−1)NO3--N 铵态氮/(mg·kg−1)NH4+-N 全氮/(g·kg−1)Total N 有机碳/(g·kg−1)Organic Carbon B0 CK 5.31±0.16c 1.45±0.01a 3.54±0.74c 0.79±0.10d 0.6±0.01c 4.82±0.97d C0 5.15±0.17c 1.43±0.01ab 4.13±1.37c 2.37±0.52c 0.5±0.01c 4.33±0.64d C1 6.28±2.8b 1.25±0.01c 8.68±1.33b 3.40±0.58c 1.4±0.03b 11.48±1.18c C2 7.15±0.34b 1.41±0.02ab 14.78±2.07a 7.44±0.97b 1.9±0.06b 15.87±2.08b C3 7.49±0.1a 1.36±0.01b 15.02±1.25a 15.72±1.13a 4.5±0.04a 22.44±0.90a B1 CK 5.31±0.09c 1.45±0.01a 3.54±0.23c 0.79±0.10d 0.6±0.02c 4.82±0.97d C0 5.31±0.07c 1.49±0.01a 4.58±0.07c 3.39±0.10c 0.5±0.01c 4.34±0.33d C1 7.14±0.20b 1.28±0.02b 3.51±0.02c 4.11±0.24c 1.3±0.00b 11.92±1.15c C2 7.35±0.06ab 1.43±0.06b 16.24±5.75b 11.16±1.46b 2.3±0.006a 17.78±1.05a C3 7.39±0.23a 1.42±0.06b 28.34±1.19a 18.66±0.61a 2.2±0.016a 14.22±0.59b B2 CK 5.31±0.09b 1.45±0.01ab 3.54±0.72d 0.79±0.10d 0.6±0.02d 4.82±0.97d C0 5.17±0.09b 1.47±0.02a 4.37±0.93d 4.04±0.81c 0.9±0.06cd 4.16±0.19d C1 7.38±0.04a 1.29±0.01c 8.02±0.86c 4.88±0.46c 1.7±0.05bc 10.03±1.77c C2 7.37±0.16a 1.45±0.04ab 15±0.51b 13.54±1.22b 2.7±0.04b 13.71±1.20b C3 7.46±0.05a 1.36±0.02bc 27.9±1.8a 19.46±1.00a 5.2±0.09a 23.05±0.28a 表中不同处理同列数据后不同小写字母表示各处理间差异显著(P<0.05) Different lowercase letters after different processing of the same column in the table indicate significant differences between treatments (P<0.05) -
[1] 董达, 王宇婕, 姜培坤, 等. 炭基肥和竹炭对土壤氮素淋失和微生物的影响 [J]. 水土保持学报, 2021, 35(2): 144-151. doi: 10.13870/j.cnki.stbcxb.2021.02.020 DONG D, WANG Y J, JIANG P K, et al. Effects of carbon based fertilizer and bamboo charcoal on soil nitrogen loss and microorganism [J]. Journal of Soil and Water Conservation, 2021, 35(2): 144-151(in Chinese). doi: 10.13870/j.cnki.stbcxb.2021.02.020
[2] 虞璐. 生物质炭对酸化土壤的改良效应及其对土壤硝化作用的影响[D]. 杭州: 浙江大学, 2019. YU L. The effect of biochar on acidic soil amelioration and soil nitrification[D]. Hangzhou: Zhejiang University, 2019(in Chinese).
[3] 孟阳阳, 刘冰, 康建军. 不同水肥措施对甜高粱农田土壤呼吸和硝化-反硝化作用的影响 [J]. 甘肃农业大学学报, 2020, 55(6): 67-76. doi: 10.13432/j.cnki.jgsau.2020.06.009 MENG Y Y, LIU B, KANG J J. Effects of different irrigation and fertilizer application on soil respiration and nitrification-denitrification in sweet Sorghum farmland [J]. Journal of Gansu Agricultural University, 2020, 55(6): 67-76(in Chinese). doi: 10.13432/j.cnki.jgsau.2020.06.009
[4] 赵永鹏. 耕作和施肥对水稻土厌氧氨氧化和反硝化速率的影响[D]. 重庆: 西南大学, 2017. ZHAO Y P. Effects of tillage and fertilization on anammox and denitrification rates in paddy soils[D]. Chongqing: Southwest University, 2017(in Chinese).
[5] 陈娜, 刘毅, 黎娟, 等. 长期施肥对稻田不同土层反硝化细菌丰度的影响 [J]. 中国环境科学, 2019, 39(5): 2154-2160. doi: 10.3969/j.issn.1000-6923.2019.05.044 CHEN N, LIU Y, LI J, et al. Effects of long-term fertilization on the abundance of the key denitrifiers in profile of paddy soil profiles [J]. China Environmental Science, 2019, 39(5): 2154-2160(in Chinese). doi: 10.3969/j.issn.1000-6923.2019.05.044
[6] 刘发波, 马笑, 张芬, 等. 硝化抑制剂对我国蔬菜生产产量、氮肥利用率和氧化亚氮减排效应的影响: Meta分析 [J]. 环境科学, 2022, 43(2): 5140-5148. LIU F B, MA X, ZHANG F, et al. Impact of nitrification inhibitors on vegetable production yield nitrogen fertilizer use efficiency and nitrous oxide emission reduction in China: Meta Analysis [J]. Environmental Science, 2022, 43(2): 5140-5148(in Chinese).
[7] 王利民, 林新坚, 黄东风, 等. 红黄壤茶园不同培肥模式的土壤理化效应 [J]. 东北林业大学学报, 2012, 40(1): 54-57,65. doi: 10.3969/j.issn.1000-5382.2012.01.013 WANG L M, LIN X J, HUANG D F, et al. Effect of different fertilization patterns on physicochemical properties of red-yellow soil in tea garden [J]. Journal of Northeast Forestry University, 2012, 40(1): 54-57,65(in Chinese). doi: 10.3969/j.issn.1000-5382.2012.01.013
[8] 李力, 刘娅, 陆宇超, 等. 生物炭的环境效应及其应用的研究进展 [J]. 环境化学, 2011, 30(8): 1411-1421. LI L, LIU Y, LU Y C, et al. Review on environmental effects and applications of biochar [J]. Environmental Chemistry, 2011, 30(8): 1411-1421(in Chinese).
[9] 简秀梅, 陈学濡, 刘富豪, 等. 不同灰分生物质炭对红壤理化特性与微生物特性的影响 [J]. 农业机械学报, 2020, 51(6): 282-291. doi: 10.6041/j.issn.1000-1298.2020.06.030 JIAN X M, CHEN X R, LIU F H, et al. Effects of biochars with various ash contents on physiochemical properties and microbial community quantity and activity in red soils [J]. Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(6): 282-291(in Chinese). doi: 10.6041/j.issn.1000-1298.2020.06.030
[10] 杨润. 沼液对水稻产量、氮素利用、氨挥发的影响及氨挥发减缓措施探讨[D]. 南京: 南京农业大学, 2017. YANG R. Effects of biogas slurry on rice yield, nitrogen use efficiency and ammonia volatilization, and the discussion on measures for ammonia volatilization reduction[D]. Nanjing: Nanjing Agricultural University, 2017(in Chinese).
[11] REN T T, YU X Y, LIAO J H, et al. Application of biogas slurry rather than biochar increases soil microbial functional gene signal intensity and diversity in a poplar plantation [J]. Soil Biology and Biochemistry, 2020, 146: 107825. doi: 10.1016/j.soilbio.2020.107825 [12] 潘逸凡. 生物质炭对稻田土壤氨氧化微生物的影响研究[D]. 杭州: 浙江大学, 2014. PAN Y F. Influence of biochar on ammonia oxidation microbial community in paddy soil[D]. Hangzhou: Zhejiang University, 2014(in Chinese).
[13] DEMPSTER D N, GLEESON D B, SOLAIMAN Z M, et al. Decreased soil microbial biomass and nitrogen mineralisation with Eucalyptus biochar addition to a coarse textured soil [J]. Plant and Soil, 2012, 354(1/2): 311-324. [14] 刘杰云, 邱虎森, 王聪, 等. 生物质炭对双季稻田土壤反硝化功能微生物的影响 [J]. 环境科学, 2019, 40(5): 2394-2403. doi: 10.13227/j.hjkx.201810182 LIU J Y, QIU H S, WANG C, et al. Influence of biochar amendment on soil denitrifying microorganisms in double rice cropping system [J]. Environmental Science, 2019, 40(5): 2394-2403(in Chinese). doi: 10.13227/j.hjkx.201810182
[15] 王伟, 白军红, 张玲, 等. 基于Cite Space的生物质炭对土壤氮循环影响的文献计量分析 [J]. 北京师范大学学报(自然科学版), 2021, 57(1): 76-85. WANG W, BAI J H, ZHANG L, et al. Biochar modulation of the soil nitrogen cycle: A Cite Space-based bibliometric study [J]. Journal of Beijing Normal University (Natural Science), 2021, 57(1): 76-85(in Chinese).
[16] 潘逸凡, 杨敏, 董达, 等. 生物质炭对土壤氮素循环的影响及其机理研究进展 [J]. 应用生态学报, 2013, 24(9): 2666-2673. doi: 10.13287/j.1001-9332.2013.0518 PAN Y F, YANG M, DONG D, et al. Effects of biochar on soil nitrogen cycle and related mechanisms: a review [J]. Chinese Journal of Applied Ecology, 2013, 24(9): 2666-2673(in Chinese). doi: 10.13287/j.1001-9332.2013.0518
[17] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU R K. Methods for soil agrochemical analysis [M]. Beijing: China Agricultural Science and Technology Press, 2000(in Chinese).
[18] YANG X L, LU Y L, DING Y, et al. Optimising nitrogen fertilisation: A key to improving nitrogen-use efficiency and minimising nitrate leaching losses in an intensive wheat/maize rotation (2008-2014) [J]. Field Crops Research, 2017, 206: 1-10. doi: 10.1016/j.fcr.2017.02.016 [19] 储成, 吴赵越, 黄欠如, 等. 有机质提升对酸性红壤氮循环功能基因及功能微生物的影响 [J]. 环境科学, 2020, 41(5): 2468-2475. doi: 10.13227/j.hjkx.201911013 CHU C, WU Z Y, HUANG Q R, et al. Effect of organic matter promotion on nitrogen-cycling genes and functional microorganisms in acidic red soils [J]. Environmental Science, 2020, 41(5): 2468-2475(in Chinese). doi: 10.13227/j.hjkx.201911013
[20] 董心亮, 林启美. 生物质炭对土壤物理性质影响的研究进展 [J]. 中国生态农业学报, 2018, 26(12): 1846-1854. doi: 10.13930/j.cnki.cjea.180277 DONG X L, LIN Q M. Biochar effect on soil physical properties: A review [J]. Chinese Journal of Eco-Agriculture, 2018, 26(12): 1846-1854(in Chinese). doi: 10.13930/j.cnki.cjea.180277
[21] ESMAEELNEJAD L, SHORAFA M, GORJI M, et al. Impacts of woody biochar particle size on porosity and hydraulic conductivity of biochar-soil mixtures: An incubation study [J]. Communications in Soil Science and Plant Analysis, 2017, 48(14): 1710-1718. doi: 10.1080/00103624.2017.1383414 [22] 万辰, 马瑛骏, 张克强, 等. 洱海流域不同有机肥替代对土壤理化性质及油菜产量的影响 [J]. 农业环境科学学报, 2021, 40(11): 2494-2502. doi: 10.11654/jaes.2021-1026 WAN C, MA Y J, ZHANG K Q, et al. Effects of different organic fertilizer substitutions on soil physical and chemical properties and rapeseed yield in erhai lake basin, China [J]. Journal of Agro-Environment Science, 2021, 40(11): 2494-2502(in Chinese). doi: 10.11654/jaes.2021-1026
[23] CLOUGH T J, BERTRAM J E, RAY J L, et al. Unweathered wood biochar impact on nitrous oxide emissions from a bovine-urine-amended pasture soil [J]. Soil Science Society of America Journal, 2010, 74(3): 852-860. doi: 10.2136/sssaj2009.0185 [24] JIN Z J, LI L Q, LIU X Y, et al. Impact of long-term fertilization on community structure of ammonia oxidizing and denitrifying bacteria based on amoa and nirk genes in a rice paddy from tai lake region, China [J]. Journal of Integrative Agriculture, 2014, 13(10): 2286-2298. doi: 10.1016/S2095-3119(14)60784-X [25] 周慧芳. 农田土壤厌氧氨氧化及其在氮循环中影响的研究[D]. 杭州: 浙江大学, 2018. ZHOU H F. Study on anammox of farmland soil and its effects on nitrogen cycling[D]. Hangzhou: Zhejiang University, 2018(In Chinese).
[26] MURASE J, HIDA A, OGAWA K, et al. Impact of long-term fertilizer treatment on the microeukaryotic community structure of a rice field soil [J]. Soil Biology and Biochemistry, 2015, 80: 237-243. doi: 10.1016/j.soilbio.2014.10.015 [27] 赵伟, 王宏燕, 王大庆, 等. 农肥和化肥对东北黑土土壤氮素转化作用的研究 [J]. 水土保持学报, 2009, 23(2): 99-102,108. doi: 10.3321/j.issn:1009-2242.2009.02.022 ZHAO W, WANG H Y, WANG D Q, et al. Effects of manure and chemical fertilizers application on nitrogen transfer in black soil [J]. Journal of Soil and Water Conservation, 2009, 23(2): 99-102,108(in Chinese). doi: 10.3321/j.issn:1009-2242.2009.02.022
[28] 马龙, 高伟, 栾好安, 等. 有机肥/秸秆替代化肥模式对设施菜田土壤氮循环功能基因丰度的影响 [J]. 植物营养与肥料学报, 2021, 27(10): 1767-1778. doi: 10.11674/zwyf.2021136 MA L, GAO W, LUAN H A, et al. Effects of partial substitution of chemical fertilizer with manure and/or straw on the abundance of functional genes related to soil N-cycling [J]. Journal of Plant Nutrition and Fertilizers, 2021, 27(10): 1767-1778(in Chinese). doi: 10.11674/zwyf.2021136
[29] 郭俊杰, 朱晨, 刘文波, 等. 不同施肥模式对土壤氮循环功能微生物的影响 [J]. 植物营养与肥料学报, 2021, 27(5): 751-759. doi: 10.11674/zwyf.20504 GUO J J, ZHU C, LIU W B, et al. Effects of different fertilization managements on functional microorganisms involved in nitrogen cycle [J]. Journal of Plant Nutrition and Fertilizers, 2021, 27(5): 751-759(in Chinese). doi: 10.11674/zwyf.20504
期刊类型引用(2)
1. 蒋鹏,李磊,解昊郡,徐得甲,王锐,虎强,孙权. 净化沼液滴灌对砂壤土质量、青贮玉米生产力的影响及安全消纳容量分析. 草业学报. 2025(04): 64-81 .  百度学术
百度学术
2. 郑一玲,范栩妙,钟哲伦,姚光伟,林晨,顾佳艳,靳泽文,平立凤,单胜道. 生物质炭-沼液配施条件下旱地红壤碳氮循环功能基因丰度主控因子与耦合关系. 农业资源与环境学报. 2024(04): 835-845 .  百度学术
百度学术
其他类型引用(4)
-





 DownLoad:
DownLoad: