-
作为预防和治疗细菌与真菌性疾病应用最广泛的药物之一[1-2], 抗生素在我国生产和使用量巨大且滥用现象严重。多数抗生素难以被人和动物完全吸收代谢,约60%—80%以原形或代谢产物的形式排除体外进入环境水体,从而潜在影响饮用水源地水质安全[3-5]。近年来,水环境中的喹诺酮类、四环素类、磺胺类和大环内酯类等4类抗生素被频繁检出[6-8]。因此,建立快速同时测定饮用水源水中多种抗生素残留的方法对保障供水安全具有重要意义。
目前,国内外针对抗生素的主要检测方法有酶联免疫法[9-10]、高效液相色谱法[11-12]和高效液相色谱串联质谱法 [13-14]等。但酶联免疫法的特异性不够高,无法准确定量且存在假阳性的可能;高效液相色谱法存在检测抗生素种类有限、检出限高,容易受到复杂基质的干扰等缺点。而固相萃取-高效液相色谱串联质谱法(SPE-HPLC-MS/MS)因其灵敏度高、分析速度快、选择性强的优点,已成为环境中抗生素检测的首选分析方法[15-18]。然而,由于抗生素的种类繁多、化学结构复杂、性质差异较大,不同种类抗生素的前处理方法的差异化,方法合并后回收结果参差不齐[19],测定方法虽可以满足地表水中抗生素残留的分析需求[20],但难以达到饮用水源中超痕量残留浓度的检出要求。因此,为了满足不同种类抗生素的灵敏、快速检测的需要,亟需建立一种适用于多种抗生素同时测定的痕量检测方法。
本文通过优化固相萃取前处理条件、液相色谱和质谱参数等条件,考察方法的线性回归方程、相关系数、方法的检出限和回收率等指标,建立了一种目标污染物的固相萃取-高效液相色谱串联质谱的测定方法。最后,应用该方法对厦门市饮用水源地源水中4类13种抗生素残留情况进行了初步分析,为饮用水源地源水中抗生素残留研究提供了分析方法支撑。
-
仪器:pH 计(中国,pH2100),固相萃取仪(USA,Supelco公司),恒温水浴氮吹仪(USA,Organomation公司),真空干燥箱(中国,DZF-6050),Kinetex®C18 色谱柱(2.6 μm ,100 mm×4.6 mm,Phenomenex),高效液相色谱-质谱联用仪(USA,Agilent,ABI 3200 Q TRAP LC-MS/MS System)。
试剂及耗材:13种抗生素标准品购自生工生物工程(上海)股份有限公司,纯度均高于95%。甲醇购自美国Fisher公司(色谱纯,纯度高于99.0%),甲酸购自国药集团(纯度88.0%),乙二胺四乙酸二钠(Na2EDTA)购自阿拉丁集团(色谱纯,纯度高于99.0%),实验中的用水均为 Millipore 超纯水,OASIS® HLB 固相萃取小柱(USA,Waters公司,6 mL ,500 mg)。
标准储备溶液:称取13种抗生素各50 mg,分别充分溶解于甲醇中配制成浓度为500 mg·L−1的储备溶液,于–20 ℃下密闭保存,使用时稀释至一定浓度。
-
2019年4月—5月,对厦门市饮用水源地的九龙江引水的江东泵站(117°45′39.86″ E,24°33′13.34″ N)和北溪水闸(118°0′53.27″ E,24°41′6.61″ N)共2个采样点进行连续采样,用GPS进行采样点定位,间隔7 d采集1次。采集水面以下0.5 m处的水样,保存于棕色玻璃采样瓶中;每个点采集平行样品3份。样品运回实验室于 4 ℃密封避光保存,在48 h之内完成样品的前处理工作,以保证测试结果的准确度。
-
量取水样500 mL,用0.45 μm的玻璃纤维膜过滤,加入0.5 g Na2EDTA;用5 mol·L−1甲酸调节pH约等于3。依次用6 mL甲醇和6 mL的0.5%甲酸水溶液活化小柱(甲醇和0.5%甲酸水溶液各取3次,每次2 mL),水样以3—5 mL·min−1的流速过萃取小柱进行富集。用6 mL的0.5%甲酸水溶液清洗小柱,然后真空干燥30 min以去除柱体残留的水分。小柱使用6 mL甲醇分3次缓慢洗脱,用棕色玻璃试管收集洗脱液,经温和氮吹后用甲醇定容至1.0 mL,最后用0.22 μm针式滤器转入进样瓶中待上机分析测定。
-
色谱条件:流动相分为水相A和有机相B,分别为5 mmol·L−1乙酸铵的0.5%甲酸水溶液和甲醇;流动相的流速为0.5 mL·min−1,柱温为40 ℃,样品进样量为10 μL。具体梯度洗脱程序如下:0—0.01 min,10%B;0.01—6.50 min,10%—20% B;6.50—8.00 min,20% B;8.00—8.01 min,20%—10%B;8.01—12 min,10%B。
质谱条件:质谱采用电喷雾离子源(ESI)在正离子模式下对分离后的抗生素化合物进行检测。离子喷射电压为5500 V,离子源气体Ⅰ(GS1)气流量为50 mL·min−1,离子源气体Ⅱ(GS2)气流量为60 mL·min−1,去溶剂化气体温度为550 ℃。通过质谱进样调谐,在多反应监测模式(MRM)下进行扫描,选择相应强度最高的子离子进行定量,对母离子、子离子、碰撞能、去簇电压等各项质谱参数进行优化,优化后的质谱参数详见表1。
-
方法优化:为实现每种化合物的定性和定量分析,并有效缩短分析时间,减少离子峰的相互干扰,优化了色谱柱型号、柱温和流动相等色谱条件;在样品前处理阶段,对比了2种不同的固相萃取小柱对萃取效率的影响,优化了水样pH值、上样水样的体积和洗脱液体积等影响因素,以求达到方法回收率和相对平均偏差在最优范围。
数据处理:HPLC-MS/MS的仪器控制、数据采集和定量分析均使用Analyst software (Version 1.6.3) (AB SCIEX, 美国),使用Excel 2016 (Microsoft, 美国)进行数据计算和编辑,使用Origin 2021 (OriginLab, 美国)完成MRM色谱图的绘制。
-
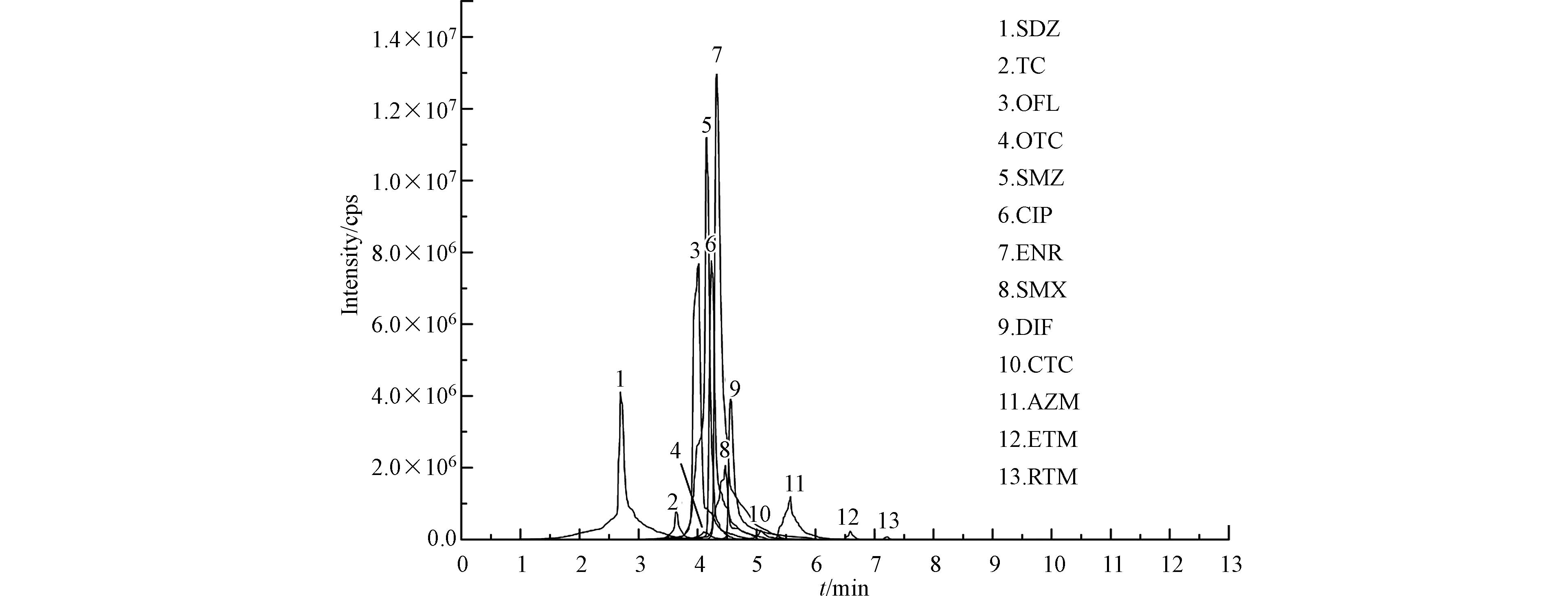
良好的色谱分离程度和响应强度是对目标化合物定性和定量的保证[21],实验对比了Kinetex®C18 色谱柱(100 mm×4.6 mm,2.6 μm,Phenomenex)和Kromasil 100-5 C18 色谱柱(150 mm×4.6 mm,3.5 μm,Akzo Nobel)对13种目标化合物的分离效果。结果表明,虽然两种色谱柱的填料规格相同,但长度较短的100 mm的Kinetex®C18 色谱柱,大大缩短了分析时间,并在一定程度上实现13种目标化合物的定性和定量离子峰的互不干扰,且分离后的峰形良好。
柱温可以很大程度上影响待测组分的分离效果,实验研究了不同柱温(30 ℃、40 ℃和50 ℃)对色谱分离的影响,结果表明,在柱温为40 ℃时,可以达到最大程度的基线分离,从而使得峰形和组分的分离效果最好,这是因为适宜的柱温可以降低流动相的黏度,缩短平衡时间。
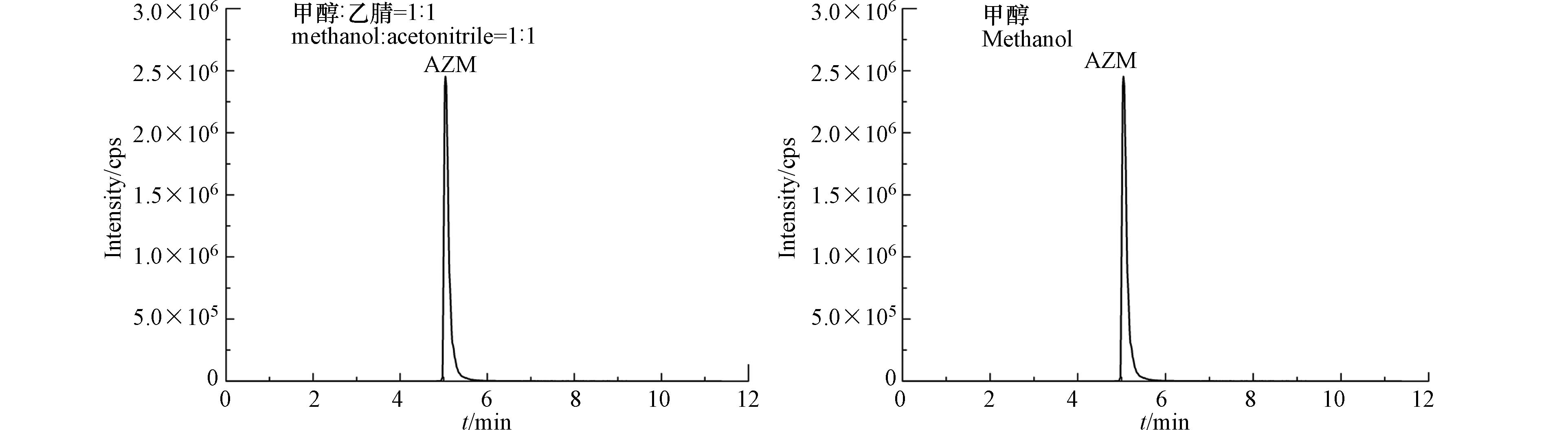
色谱流动相的组成除影响保留时间和峰形外,还会影响离子化效率,进而影响目标物的检测灵敏度[22-23]。实验对比了甲醇/乙腈(V/V,1/1)和甲醇作为有机流动相对目标化合物灵敏度和分离度的影响,结果表明,2种有机流动相都能得到尖锐对称的峰形,但用甲醇作为有机流动相时,可以有效改善拖尾(以喹诺酮类抗生素AZM为例,见图1);同时,在水相中加入0.5%的甲酸(含5 mmol·L−1乙酸铵)有利于目标化合物的离子化效率,得到更高的检测灵敏度和响应强度。这是因为甲酸和乙酸铵在正离子模式下可以增强目标化学物质离子化程度,有效改善峰形,使峰形更加尖锐和对称[24-25]。条件优化后各目标物的MRM色谱图见图2.
-
分别选择Oasis® HLB和C18固相萃取小柱,考察不同类型萃取柱对萃取回收率的影响。结果表明,磺胺类抗生素在C18小柱上的保留较弱,萃取效率低于50%;而Oasis® HLB小柱可以有效地富集抗生素,对4类抗生素的萃取效率均高于C18小柱,萃取效率为65%—120%。这是由于Oasis® HLB和C18固相萃取小柱的吸附填料的差异。Oasis® HLB小柱是由二乙烯苯和N-乙烯基吡咯烷酮按一定比例聚合而成,具有亲水亲脂平衡、水可浸润的特性,对极性和非极性化合物具有均衡的吸附作用;而C18小柱填充的是硅胶上接十八烷基的反相键合硅胶,主要对极性偏弱的化合物保留较好[26]。除此之外,在比表面积上HLB小柱也大于C18小柱,对化合物有较高的萃取效率[27]。因此,选择HLB小柱进行萃取。
样品溶液的pH值也是固相萃取过程的重要参数,会影响目标化合物的化学形态、稳定性以及在固相萃取小柱上的保留情况。实验采用甲酸和氨水调节pH值,考察了不同的pH值(pH=3.0、5.0、7.0)对萃取效率的影响。结果表明,四环素类和磺胺类抗生素在pH= 7.0回收率较低,分别为40%—62.1%和58.5%—75%,但在pH=3.0和pH=5.0,这2类抗生素均有较好的回收率;氟喹诺酮类抗生素在pH=3.0时回收率较高,为75.4%—85.3%,大环内酯类抗生素在pH=3.0和pH=5.0时回收率均高于65%。综合考虑,选择调节水样pH=3.0,保证4类抗生素均取得较高的萃取效率。
实验设置2个体积(500 mL和1000 mL)来优化水样的上样体积。采用加标100 ng·L−1来探究目标物在各个体积下的回收率,结果见表2。当上样体积为500 mL和1000 mL,13种抗生素的回收率范围分别为67.5%—124.8%和40.1%—87.4%,这可能是由于上样体积过大导致固相萃取小柱过载,从而影响回收率[28],同时考虑到更少的上样体积可以减少前处理的时间。因此,选取500 mL作为水样的上样体积。
实验对比分析了4、6、8、10 mL甲醇等4种洗脱液体积的洗脱效果(表2)。当洗脱液体积为4 mL时,各目标化合物回收率为39.1%—86.1%;洗脱液体积为6 mL时,回收率为71.4%—114.1%;洗脱液体积为8 mL时,回收率为70.4%—117.8%;洗脱液体积为10 mL时,回收率为71.4%—115.0%。由此可见,当溶剂量少时,洗脱液与填料接触时间短解吸不充分,体积增加到6 mL以后回收率变化不大。因此,采用6 mL甲醇洗脱,既可以保证目标化合物的较高回收率,又可以减少溶剂使用量,有利于提高固相萃取的效率。
-
采用外标法定量,配制浓度分别为10、20、50、100、200、250 μg·L−1的标准系列溶液,绘制标准曲线。以相应面积和对应浓度进行线性回归分析,13种抗生素在0.02—0.5 ng·L−1范围内线性关系良好,相关系数R2均大于0.993。以3倍信噪比(S/N)对应的浓度为检出限,以10倍信噪比对应的浓度为定量限,该方法检出限为0.05—1.66 ng·L−1,定量限为0.17—5.52 ng·L−1。抗生素的线性方程、相关系数、检出限和定量限等参数见表3。
-
在超纯水和水源水中分别添加低、中、高的3个水平浓度(2、20、100 ng·L−1)的13种抗生素混合标准溶液,按照上述的优化固相萃取-高效液相色谱串联质谱分析方法进行加标实验,以3次平行测得值计算回收率和相对标准偏差(RSD),结果见表4。3种不同加标浓度下的回收率为70.2%—121.5%,RSD为1.1%—13.5%。
-
对本研究建立的测定方法与其他研究的测定方法进行了比较,详细数据见表5。本方法选择的抗生素共4类,一定程度上保证了抗生素种类的全面性,同时在检出限和回收率上明显优于其他方法,且检出限低至0.05 ng·L−1,可以满足痕量检测的要求。
-
采用上述优化的固相萃取-高效液相色谱串联质谱法对江东泵站和北溪水闸水样中4类13种抗生素残留含量进行测定。测定时每10个样品后加测1组质量控制样品(方法空白、加标回收和重复样品),以检查干扰和交叉污染。
结果表明,13种抗生素均有不同程度的检出。在江东泵站有6 种被检出,检出率46.2%,检出浓度为ND—12.5 ng·L−1,主要抗生素残留为RTM、SMZ和SMX,检出浓度分别为12.5、10.2、6.12 ng·L−1;在北溪水闸有7 种被检出,检出率53.8%,检出浓度为ND—32.6 ng·L−1,主要抗生素残留为AZM、SMX和SMZ,检出浓度分别为32.6、26.5、12.0 ng·L−1。由此可见,在厦门市饮用水源地源水中主要抗生素污染类型为大环内酯类和磺胺类抗生素。
-
本文建立了同时测定环境水体中4类13种抗生素固相萃取-高效液相色谱串联质谱分析方法,各目标物的检出限为0.05—1.66 ng·L−1,定量限为0.17—5.52 ng·L−1,回收率为70.2%—121.5%,RSD为1.1%—13.5%。该方法高效准确、灵敏度高、选择性好、回收率高,适用于饮用水源水体中痕量抗生素残留的分析。利用该方法对厦门市饮用水源地源水中13种抗生素污染状况进行了初步分析,共有7 种抗生素被检出,其中检出浓度最高的抗生素为AZM。该方法可进一步拓展用于检测河流、湖泊、水库等地表水中多种抗生素的同时快速测定,为水环境中抗生素残留的分析检测及风险防控工作提供技术支持。
测定13种抗生素的固相萃取-高效液相色谱串联质谱法优化与应用
Optimization and application of solid phase extraction-high performance liquid chromatography-tandem mass spectrometry for determination of 13 antibiotics
-
摘要: 大量用于预防和治疗细菌和真菌性等疾病的抗生素药物未经完全代谢后最终进入自然水体,对饮用水源水质安全构成潜在威胁。为快速测定饮用水源水体中的抗生素残留,保障饮水安全,本论文建立一种固相萃取-高效液相色谱串联质谱法测定13种抗生素的分析方法。采用OASIS® HLB小柱对水样进行固相萃取富集和净化,以甲醇和0.5%的甲酸(含5 mmol·L−1乙酸铵)水溶液为流动相,经Kinetex®C18 色谱柱分离后采用三重四极杆串联质谱多反应监测模式分析。该方法检出限为0.05—1.66 ng·L−1,定量限为0.17—5.52 ng·L−1,回收率为70.2%—121.5%,相对标准偏差为1.1%—13.5%。该方法准确度高,灵敏度高,适用于饮用水源源水中痕量抗生素残留的测定。方法成功应用于厦门市饮用水源源水中抗生素残留分析,共检出7种抗生素,浓度范围为ND—32.6 ng·L−1。
-
关键词:
- 高效液相色谱串联质谱法 /
- 抗生素 /
- 固相萃取 /
- 饮用水源
Abstract: Antibiotics are used for the prevention and treatment of bacterial and fungal diseases. The residual antibiotics end up in natural water bodies, leading to safe drinking water quality. In order to rapid determination antibiotic residues in drinking water and ensure the safety of drinking water, an analytical method was developed for the simultaneous determination of 13 antibiotics residues in 4 classes in waters of drinking water source by solid phase extraction-high performance liquid chromatography-tandem mass spectrometry. The samples were concentrated and purified with OASIS® HLB cartridge. Gradient elution was performed using methanol as mobile phase B and 0.5% formic acid water containing 5 mmol·L−1 ammonium acetate as mobile phase A. Samples were analyzed by means of multiple reaction monitoring (MRM) through the mass separation by Kinetex®C18 column. The detection limits and quantization limits for the 13 antibiotics were 0.05—1.66 ng·L−1 and 0.17—5.52 ng·L−1, respectively. The recoveries ranged from 70.2% to 121.5% with relative standard deviations of 1.1%—13.5%. The method has high sensitivity, high efficiency which can be used for simultaneous determination of antibiotics residues in source water of drinking water sources at trace level. The method was successfully applied to analysis of antibiotics residue in source water in Xiamen. 7 antibiotics were detected, and the concentrations ranged from not detected to 32.6 ng·L−1. -

-
表 1 MRM 模式下13种抗生素的质谱参数
Table 1. MS parameters in multiple reaction monitoring model for 13 antibiotics
化合物
Compound母离子
Parent
ion子离子
Daughter
ion保留时间/min
Retention
time去簇电压/V
Declustering
potential入口电压/V
Entrance
voltage碰撞能/eV
Collision
energy出口电压/V
Export
voltageOxytetracycline 461 426 4.10 45 8 25 17 (土霉素,OTC) 444* 45 8 25 17 Tetracycline 445 427 3.64 85 8 25 13 (四环素,TC) 410* 85 8 25 13 Chlortetracycline 479 444 5.06 51 9 26 20 (金霉素,CTC) 462* 51 9 26 20 Roxithromycin 837 679* 7.21 60 4.05 40 14.2 (罗红霉素,RTM) 158 60 4.05 40 14.2 Azithromycin 749.3 158 5.75 85 9 45 7 (阿奇霉素,AZM) 591* 85 9 45 7 Erythromycin 734 576* 6.59 50 7 35 14.2 (红霉素,ETM) 158 50 7 35 14.2 Sulfadiazine 251 156.1* 2.69 46 5.5 23 2 (磺胺嘧啶,SDZ) 91.9 46 5.5 35 2 Sulfamethazine 279 186.1* 4.15 46 6 23 2 (磺胺二甲嘧啶,SMZ) 124 72 10 23 10 Sulfamethoxazole 253.9 92.1 4.47 41 5.5 37 2 (磺胺甲噁唑,SMX) 155.9* 77 10 23 29 Ofloxacin 362.2 302* 4.02 59 5.8 26 16 (氧氟沙星,OFL) 233.1 59 5.8 33 11 Ciprofloxacin 332.2 314* 4.23 65 7 35 2 (环丙沙星,CIP) 245 65 7 35 2 Enrofloxacin 360.1 342.2* 4.32 64 7 37 4 (恩诺沙星,ENR) 245.1 64 7 37 4 Difloxacin 400 356* 4.56 43 12 27 5 (二氟沙星,DIF) 299 43 12 27 5 注:*为定量离子. The characterisitic ions asterisk are used for quantification. 表 2 上样体积和洗脱液体积对回收率的影响(%)
Table 2. Recoveries of 13 antibiotics with different sample volumes and eluent volumes(%)
化合物
Compound上样体积Sample volumes 洗脱液体积Eluent volumes 500 mL 1000 mL 4 mL 6 mL 8 mL 10 mL OTC 122.5 87.4 72.4 106.0 108.2 115.0 TC 91.1 64.0 73.0 86.0 97.4 95.3 CTC 74.1 80.9 78.5 74.8 70.4 71.8 RTM 105.5 65.6 68.5 110.8 117.8 84.0 AZM 67.5 68.5 65.4 94.2 114.0 108.6 ETM 68.2 40.1 39.1 71.4 76.5 71.2 SDZ 86.5 71.4 49.6 92.8 84.4 107.2 SMZ 92.0 85.2 77.8 86.3 85.1 97.0 SMX 101.2 60.2 68.2 81.3 78.2 71.4 OFL 90.4 69.2 54.7 94.2 84.9 76.4 CIP 124.8 87.2 46.0 103.9 71.3 75.4 ENR 75.4 64.6 86.1 114.1 102.1 114.4 DIF 94.5 82.7 72.3 94.0 104.6 95.4 表 3 13种抗生素的线性方程、检出限和定量限
Table 3. Linear equations, limits of detections and limits of quantifications of 13 kinds of antibiotics
化合物
Compound线性方程
Linear equation相关系数
Correlation coefficient(R2)检出限/(ng·L−1)
LOD定量限/(ng·L−1)
LOQOTC y=139.71x+67.06 0.9997 1.21 4.02 TC y=206.19x−596.31 0.9996 1.48 5.52 CTC y=162.24x−186.94 0.9997 1.54 5.13 RTM y=205.2x+467.26 0.9969 0.87 2.91 AZM y=464.29x+1292 0.9981 0.05 0.17 ETM y=714.98x+1052.29 0.9991 1.66 5.52 SDZ y=1093.24x+2342.46 0.9965 0.10 0.32 SMZ y=749.91x+1435.55 0.9962 0.08 0.25 SMX y=714.98x+1052.29 0.9991 0.16 0.52 OFL y=921.17x+1229.69 0.9969 0.76 2.52 CIP y=188.34x+197.56 0.9933 1.14 3.81 ENR y=1093.24x+2342.46 0.9965 0.26 0.86 DIF y=835.13x+1290.17 0.9972 1.43 4.76 表 4 13种抗生素在3个加标水平下的加标回收率和相对标准偏差(n=3)
Table 4. Recoveries and relative standard deviations at three spiked levels of 13 antibiotics(n=3)
化合物
Compound加标浓度/(ng·L−1)
Spiked concentration超纯水 Pure water 水源水Source water 回收率/%Recovery RSD/% 回收率/%Recovery RSD/% OTC 2 110.4 1.1 87.4 2.3 20 94.3 9.9 86.1 6.5 100 76.3 8.6 72.5 10.7 TC 2 88.1 4.3 75.6 2.6 20 116.6 6.8 92.8 10.8 100 73.0 9.7 111.5 13.3 CTC 2 89.5 11.4 78.6 9.8 20 117.2 3.2 80.9 5.1 100 79.2 4.9 120.1 5.5 RTM 2 94.8 8.6 73.1 9.9 20 98.3 7.3 75.6 4.4 100 70.5 13.1 101.9 13.5 AZM 2 96.2 7.5 78.5 7.1 20 114.5 9.2 102.9 1.4 100 84.3 12.1 77.0 8.4 ETM 2 75.4 1.2 73.2 3.7 20 94.9 4.8 76.9 8.5 100 97.6 10.3 81.5 12.1 SDZ 2 75.1 12.1 73.1 9.2 20 84.4 11.7 79.6 5.4 100 71.4 12.5 83.9 12.9 SMZ 2 75.3 11.1 79.6 4.2 20 85.2 9.5 70.2 3.4 100 71.5 12.5 77.8 13.1 SMX 2 116.8 0.9 77.5 7.8 20 74.2 12.9 72.2 2.7 100 73.5 10.3 78.2 3.9 OFL 2 105.7 7.9 114.1 12.3 20 84.9 5.7 80.8 5.1 100 77.4 9.8 74.5 9.7 CIP 2 79.2 5.8 84.7 10.9 20 121.5 2.2 89.1 5.9 100 103.9 10.4 71.3 5.6 ENR 2 74.6 11.3 72.9 11.8 20 116.2 7.9 82.6 1.5 100 75.4 3.3 102.6 7.8 DIF 2 73.7 9.3 78.7 10.8 20 88.7 8.9 71.3 2.1 100 107.3 11.5 112.6 12.3 表 5 与其他方法的比较
Table 5. Comparison with other methods
化合物(组分)
Compound( component)检出限/( ng·L-1)
LOD回收率/%
RecoveryRSD/% 参考文献
ReferencesSD、TC、NOF等(三类14种) 0.09—12.3 40.6—127.5 无 [29] AMC、ERY、SMX(五类9种) 0.4—0.8 60.1—104.6 0.7—5.5 [30] TMP、CIP、CTC等(五类10种) 3.0—16.0 71—105 <15 [31] CFX、LIN、RTM等(五类15种) 0.19—1.09 87—170 无 [32] CLR、ROX、AZM等(六类18种) 0.8—45.0 51.0—94.0 3.9—10.6 [33] OTC、ENR、DIF等(四类13种) 0.05—1.66 70.2—121.5 1.1—13.5 本研究 -
[1] BENOTTI M J, TRENHOLM R A, VANDERFORD B J, et al. Pharmaceuticals and endocrine disrupting compounds in US drinking water [J]. Environmental Science & Technology, 2009, 43(3): 597-603. [2] NAGESWARA RAO R, VENKATESWARLU N, NARSIMHA R. Determination of antibiotics in aquatic environment by solid-phase extraction followed by liquid chromatography-electrospray ionization mass spectrometry [J]. Journal of Chromatography. A, 2008, 1187(1/2): 151-164. [3] 殷强, 付峥嵘. 我国水环境中抗生素污染的研究进展 [J]. 安徽农业科学, 2017, 45(31): 50-51,55. YIN Q, FU Z R. Research progress of antibiotic pollution in water invironment in China [J]. Journal of Anhui Agricultural Sciences, 2017, 45(31): 50-51,55(in Chinese).
[4] 闭凤丽, 李志广, 刘波, 等. 南方某地区水体抗生素含量及风险评估 [J]. 环境化学, 2018, 37(3): 621-624. BI F L, LI Z G, LIU B, et al. Assessments of ecological and health risk induce by antibiotics in the water of a southern city [J]. Environmental Chemistry, 2018, 37(3): 621-624(in Chinese).
[5] PADHYE L P, YAO H, KUNG'U F T, et al. Year-long evaluation on the occurrence and fate of pharmaceuticals, personal care products, and endocrine disrupting chemicals in an urban drinking water treatment plant [J]. Water Research, 2014, 51: 266-276. doi: 10.1016/j.watres.2013.10.070 [6] LI S, SHI W, LIU W, et al. A duodecennial national synthesis of antibiotics in China's major rivers and seas (2005-2016) [J]. Science of the Total Environment, 2018, 615: 906-917. doi: 10.1016/j.scitotenv.2017.09.328 [7] 丁惠君, 钟家有, 吴亦潇, 等. 鄱阳湖流域南昌市城市湖泊水体抗生素污染特征及生态风险分析 [J]. 湖泊科学, 2017, 29(4): 848-858. doi: 10.18307/2017.0408 DING H J, ZHONG J Y, WU Y X, et al. Characteristics and ecological risk assessment of antibiotics in five city lakes in Nanchang City, Lake Poyang Catchment [J]. Journal of Lake Sciences, 2017, 29(4): 848-858(in Chinese). doi: 10.18307/2017.0408
[8] 封丽, 程艳茹, 封雷, 等. 三峡库区主要水域典型抗生素分布及生态风险评估 [J]. 环境科学研究, 2017, 30(7): 1031-1040. FENG L, CHENG Y R, FENG L, et al. Distribution of typical antibiotics and ecological risk assessment in main waters of Three Gorges reservoir area [J]. Research of Environmental Sciences, 2017, 30(7): 1031-1040(in Chinese).
[9] WEN K, NÖLKE G, SCHILLBERG S, et al. Improved fluoroquinolone detection in ELISA through engineering of a broad-specific single-chain variable fragment binding simultaneously to 20 fluoroquinolones [J]. Analytical and Bioanalytical Chemistry, 2012, 403(9): 2771-2783. doi: 10.1007/s00216-012-6062-z [10] FAN G Y, YANG R S, JIANG J Q, et al. Development of a class-specific polyclonal antibody-based indirect competitive ELISA for detecting fluoroquinolone residues in milk [J]. Journal of Zhejiang University. Science. B, 2012, 13(7): 545-554. doi: 10.1631/jzus.B1200001 [11] DAI X H, XUE Y G, LIU H J, et al. Development of determination method of fluoroquinolone antibiotics in sludge based on solid phase extraction and HPLC-fluorescence detection analysis [J]. Environmental Science, 2016, 37(4): 1553-1561. [12] 曾国龙, 马晓国, 樊银明. 多模板分子印迹聚合物磁性固相萃取-高效液相色谱法测定环境水样中四环素类抗生素 [J]. 分析测试学报, 2020, 39(6): 749-755. ZENG G L, MA X G, FAN Y M. Determination of tetracyclines in environmental water samples by high performance liquid chromatography with multi-template molecularly imprinted polymer magnetic solid phase extraction [J]. Journal of Instrumental Analysis, 2020, 39(6): 749-755(in Chinese).
[13] 陈书鑫, 王静, 何士冲, 等. 超高效液相色谱串联质谱法测定水体中17种抗生素 [J]. 中国环境监测, 2020, 36(6): 119-126. CHEN S X, WANG J, HE S C, et al. Determination of 17 antibiotics in drinking water sources in Zhejiang Province by ultra-high performance liquid chromatography-tandem mass spectrometry [J]. Environmental Monitoring in China, 2020, 36(6): 119-126(in Chinese).
[14] 赵娜, 梁嘉诚, 时丽艳, 等. QuEChERS-高效液相色谱-串联质谱法同时测定有机肥料中10种氟喹诺酮类药物残留 [J]. 色谱, 2019, 37(3): 313-318. doi: 10.3724/SP.J.1123.2018.11002 ZHAO N, LIANG J C, SHI L Y, et al. Simultaneous determination of ten fluoroquinolone residues in organic fertilizers by QuEChERS and high performance liquid chromatography-tandem mass spectrometry [J]. Chinese Journal of Chromatography, 2019, 37(3): 313-318(in Chinese). doi: 10.3724/SP.J.1123.2018.11002
[15] 杨路平, 焦燕妮, 邵立君, 等. 超高效液相色谱-质谱法测定饮用水中14种氟喹诺酮类抗生素的残留量 [J]. 理化检验-化学分册, 2016, 52(4): 397-401. YANG L P, JIAO Y N, SHAO L J, et al. UPLC-MS determination of residual amounts of 14 fluoroquinolone antibiotics in drinking water [J]. Physical Testing and Chemical Analysis Part B (Chemical Analysis), 2016, 52(4): 397-401(in Chinese).
[16] 王娅南, 彭洁, 谢双, 等. 固相萃取-高效液相色谱-串联质谱法测定地表水中40种抗生素 [J]. 环境化学, 2020, 39(1): 188-196. WANG Y N, PENG J, XIE S, et al. Determination of 40 antibiotics in surface water by solid phase extraction-high performance liquid chromatography-tandem mass spectrometry [J]. Environmental Chemistry, 2020, 39(1): 188-196(in Chinese).
[17] 秦宏兵, 顾海东. 超高效液相色谱-串联质谱法测定饮用水源水中磺胺类抗生素 [J]. 中国环境监测, 2013, 29(1): 98-102. QIN H B, GU H D. Determination of sulfonamide antibiotics in drinking source water using ultra performance liquid chromatography tandem mass spectrometry [J]. Environmental Monitoring in China, 2013, 29(1): 98-102(in Chinese).
[18] 卢诚, 张俊, 王钊, 等. 河北潘家口水库氯霉素类抗生素检测及风险评估 [J]. 中国环境科学, 2016, 36(6): 1843-1849. LU C, ZHANG J, WANG Z, et al. Determination and risk assessment of chloramphenicols in Panjiakou Reservoir, Hebei Province [J]. China Environmental Science, 2016, 36(6): 1843-1849(in Chinese).
[19] 高立红, 史亚利, 厉文辉, 等. 高效液相色谱-电喷雾串联质谱法检测环境水样中22种抗生素类药物 [J]. 色谱, 2010, 28(5): 491-497. doi: 10.3724/SP.J.1123.2010.00491 GAO L H, SHI Y L, LI W H, et al. Determination of 22 antibiotics in environmental water samples using high performance liquid chromatography-electrospray ionization tandem mass spectrometry [J]. Chinese Journal of Chromatography, 2010, 28(5): 491-497(in Chinese). doi: 10.3724/SP.J.1123.2010.00491
[20] 龚润强, 赵华珒, 高占啟, 等. 骆马湖及主要入湖河流表层水体中抗生素的赋存特征及风险评价 [J]. 环境科学, 2022, 43(4): 1384-1393. doi: 10.13227/j.hjkx.202106087 GONG R Q, ZHAO H J, GAO Z Q, et al. Occurrence characteristics and risk assessment of antibiotics in the surface water of Luoma Lake and its main inflow rivers [J]. Environmental Science, 2022, 43(4): 1384-1393(in Chinese). doi: 10.13227/j.hjkx.202106087
[21] 沈颖, 魏源送, 郭睿, 等. 超高效液相色谱串联质谱检测猪粪中残留的四环素类抗生素 [J]. 环境化学, 2009, 28(5): 747-752. SHEN Y, WEI Y S, GUO R, et al. Determination of tetracyclines residues in swine manure by UPLC/MS [J]. Environmental Chemistry, 2009, 28(5): 747-752(in Chinese).
[22] WU H, LI G, LIU S, et al. Monitoring the contents of six steroidal and phenolic endocrine disrupting chemicals in chicken, fish and aquaculture pond water samples using pre-column derivatization and dispersive liquid-liquid microextraction with the aid of experimental design methodology [J]. Food Chemistry, 2016, 192: 98-106. doi: 10.1016/j.foodchem.2015.06.059 [23] STRECK G. Chemical and biological analysis of estrogenic, progestagenic and androgenic steroids in the environment [J]. Trace, Trends Analysis Chemistry, 2009, 28(6): 635-652. doi: 10.1016/j.trac.2009.03.006 [24] 杨松, 邹楠, 高云, 等. 固相萃取-超高效液相色谱-串联质谱法检测环境水体中18 种农药残留 [J]. 色谱, 2020, 38(7): 826-832. YANG S, ZOU N, GAO Y, et al. Determination of 18 pesticide residues in environmental water by solid phase extraction-ultra performance liquid chromatography-tandem mass spectrometry [J]. Chinese Journal of Chromatography, 2020, 38(7): 826-832(in Chinese).
[25] 陆静, 陈练, 付善良, 等. 高效液相色谱-三重四极杆串联质谱测定环境水样中19种个人护理品 [J]. 环境化学, 2019, 38(8): 1930-1940. LU J, CHEN L, FU S L, et al. Determination of 19 personal care products in environmental water samples by high performance liquid chromatography mass spectrometry [J]. Environmental Chemistry, 2019, 38(8): 1930-1940(in Chinese).
[26] 洪蕾洁, 石璐, 张亚雷, 等. 固相萃取-高效液相色谱法同时测定水体中的10种磺胺类抗生素 [J]. 环境科学, 2012, 33(2): 652-657. HONG L J, SHI L, ZHAND Y L, et al. Simultaneous determination of 10 sulfonamide antibiotics in water by solid-phase extraction and high performance liquid chromatography [J]. Environmental Science, 2012, 33(2): 652-657(in Chinese).
[27] 杨金泉, 贺小敏, 施敏芳, 等. 固相萃取-超高效液相色谱-串联质谱法同时测定地表水中9种性激素 [J]. 中国环境监测, 2019, 35(3): 19-27. YANG J Q, HE X M, SHI M F, et al. Simultaneous determination of 9 hormones in surface water by ultra performance liquid chromatography-tandem mass spectrometry with solid-phase extraction [J]. Environmental Monitoring in China, 2019, 35(3): 19-27(in Chinese).
[28] 张律, 岳亚军, 赖少阳, 等. 高效液相色谱-串联质谱法测定生活饮用水中11种抗生素 [J]. 食品安全质量检测学报, 2017, 8(6): 2204-2210. doi: 10.3969/j.issn.2095-0381.2017.06.042 ZHANG L, YUE Y J, LAI S Y, et al. Determination of 11 kinds of antibiotics in drinking water by high performance liquid chromatography-tendem mass spectrometry [J]. Journal of Food Safety and Quality, 2017, 8(6): 2204-2210(in Chinese). doi: 10.3969/j.issn.2095-0381.2017.06.042
[29] ZHANG X, ZHANG D D, ZHANG H, et al. Occurrence, distribution, and seasonal variation of estrogenic compounds and antibiotic residues in Jiulongjiang River, South China [J]. Environmental Science and Pollution Research, 2012, 19(5): 1392-1404. doi: 10.1007/s11356-012-0818-z [30] 朱婷婷, 段标标, 宋战锋, 等. 深圳铁岗水库水体中抗生素污染特征分析及生态风险评价 [J]. 生态环境学报, 2014, 23(7): 1175-1180. ZHU T T, DUAN B B, SONG Z F, et al. Pollution characteristics and ecological risk assessment of antibiotics in tiegang reservoir in Shenzhen [J]. Ecology and Environment Sciences, 2014, 23(7): 1175-1180(in Chinese).
[31] 秦延文, 张雷, 时瑶, 等. 大辽河表层水体典型抗生素污染特征与生态风险评价 [J]. 环境科学研究, 2015, 28(3): 361-368. QIN Y W, ZHANG L, SHI Y, et al. Contamination characteristics and ecological risk assessment of typical antibiotics in surface water of the daliao river, China [J]. Research of Environmental Sciences, 2015, 28(3): 361-368(in Chinese).
[32] 魏红, 王嘉玮, 杨小雨, 等. 渭河关中段表层水中抗生素污染特征与风险 [J]. 中国环境科学, 2017, 37(6): 2255-2262. WEI H, WANG J W, YANG X Y, et al. Contamination characteristic and ecological risk of antibiotics in surface water of the Weihe Guanzhong section [J]. China Environmental Science, 2017, 37(6): 2255-2262(in Chinese).
[33] ROSSMANN J, SCHUBERT S, GURKE R, et al. Simultaneous determination of most prescribed antibiotics in multiple urban wastewater by SPE-LC-MS/MS [J]. Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences, 2014, 969: 162-170. doi: 10.1016/j.jchromb.2014.08.008 -



 下载:
下载: