-
锑是元素周期表第五周期中的一种类金属元素,其在环境中广泛存在。锑及其化合物会引起肝脏、皮肤、呼吸系统和心血管系统疾病[1-2],已被美国环境保护署(USEPA)[3]及欧盟[4]列为优先控制污染物。此外,国际癌症研究机构(IARC)认为三氧化二锑可能对人类有致癌作用[5]。随着锑开采和应用相关的人为活动(例如采矿、冶炼矿石、燃烧煤炭、废弹药以及各类产品(如阻燃剂、合金、半导体、塑料)的生产使用)干扰加剧,锑污染日益严重[6-10]。中国拥有丰富的锑资源,是世界上最大的锑生产国,约占全球锑总产量的90%[11],在全球锑排放中也扮演着重要角色。近些年来,锑污染事件在中国时有发生,对人们的健康安全造成了极大的威胁[12]。
受锑污染的水体中锑浓度可高达几千到几万微克每升[13]。水环境中的锑可被动植物富集,继而通过食物链在人体内积累,危害人类健康[14]。水产品是居民,尤其沿海城市居民日常膳食的重要组成部分,现阶段有关中国水产品中的锑研究仍十分有限,仅对烟台海产品和湖南水产品中锑有报道[15-19]。
为更全面地了解中国沿海城市水产品中锑的赋存特征及其食用风险,本研究对中国8个典型沿海城市(盐城市、杭州市、舟山市、宁波市、台州市、温州市、福州市、深圳市)市售水产品中锑含量进行了检测,基于每日摄入评估量(EDI)及目标危害系数(THQ)对通过食用水产品摄入锑引起的潜在健康风险进行了评估,并根据各类水产品对THQ的贡献为中国沿海城市居民提供了水产品消费建议。
-
2019年2月至2020年5月,从中国8个典型沿海城市的当地菜市场共采集了124个水产品样品(盐城市:鱼类10个,贝类10个,虾1个;杭州市:鱼类16个,贝类7个,虾1个;舟山市:鱼类4个,贝类10个,虾1个;宁波市:鱼类4个,贝类7个,虾1个;台州市:鱼类2个,贝类4个,虾1个;温州市:鱼类4个,贝类8个,虾1个;福州市:鱼类6个,贝类12个,虾1个;深圳市:鱼类4个,贝类8个,虾1个)。针对每一个鱼类或贝类及虾类样品,采购1—3条或1.5 kg左右的量。采集的水产品运送至实验室后,测量样品长度,对于每个采样点的每一种虾类及贝类样品,随机各取8个进行长度测量,取平均值。用纯水清洗去除水产品表面泥沙等杂质,沥干后取贝类的可食用部分、鱼肉或虾肉,经冷冻干燥后,用研磨机研磨混匀,储存于−20℃冰箱。冷冻干燥前后称量样品重量以计算样品水分。样品脂肪含量根据中国食品安全国家标准(GB5009.6—2016)食品中脂肪的测定方法[20]进行测定。对部分鱼类的其他部位(肝脏、鱼鳃、鱼皮、鱼籽)进行同样处理,用于锑在鱼体内的累积分布特征研究。
-
根据中国食品安全国家标准(GB5009.137—2016)食品中锑的测定方法[21]进行水产品中锑的测定。具体步骤:称取0.2—0.5 g冷干样品于微波消解罐中,加入5 mL硝酸、1 mL过氧化氢后进行微波消解。冷却后,加入20 mL水,加热赶酸至0.5—1 mL,将消化液转移至10 mL容量瓶中,用纯水定容至刻度。随后,取5 mL消化液,加入1 mL盐酸(30%,V/V)和1 mL预还原剂(10% (M/V)硫脲+10% (M/V)抗坏血酸),稀释定容至10 mL。静置30 min后使用原子荧光光谱仪(AFS-9750,北京海光仪器有限公司)检测。
-
国家标准物质,扇贝成分分析标准物质(GBW10024),购于中国计量科学研究院,用于确保检测方法的准确性。通过上述分析方法测定的扇贝标准物质中锑含量为(16.1±1.32)ng·g−1,接近其参考值14 ng·g−1。另外对样品进行加标回收实验,100—200 ng·g−1加标水平下,锑的加标回收率在85%—98%范围内。水产品中锑的检出限(以3倍信噪比计)为0.13 ng·g−1。在每批样品分析过程中,均增设了国家标准物质、平行样、加标回收及对照空白分析。所有数据均扣除空白。所有样品测定值的相对标准偏差值(RSDn = 3)均小于10%。
-
为评估通过食用水产品摄入锑对人体健康产生的潜在风险,对每日摄入评估量(Estimated daily intake EDI, μg·kg−1·d−1)进行了计算,计算公式如式(1):
式中,C表示水产品中的锑含量(ng·g−1),IR表示水产品的每日摄入量(g·d−1),BW表示人体平均体重(kg),以60 kg作为成人平均体重。不同人群的水产品摄入量差异较大,本文综合2020年中国统计年鉴[22]、中国膳食指南[23]以及Gulkowska等的研究[24],将IR分为一般摄入量(47.7—75.6 g·d−1)、推荐摄入量(75 g·d−1)、高摄入量(235 g·d−1),并将Gulkowska等研究[24]中不同类型水产摄入量占比(鱼类、贝类和虾的占比分别为44.7%、32.3%、23.0%)应用于上述3种摄入量,以进行更准确的评估。
采用目标危害系数(Target hazard quotient, THQ)评估锑暴露的非致癌风险。如果THQ<1,表明评估项目对居民没有明显的健康风险。如果THQ≥1,则评估项目对人体存在有潜在的健康风险,应采取防护措施。THQ越高意味着经历长期非致癌性危害的可能性越高。THQ计算公式如式(2)。
式中,EF为暴露频率(365 d·a−1),ED为总暴露时间(70 a),RfD为口服参考剂量,TA为非致癌物的平均接触时间(ED×365 d·a−1)。美国环境保护署(USEPA)规定锑的口服参考剂量为0.4 μg·kg−1·d−1[25]。
-
采用SPSS 18.0软件对实验数据进行统计分析。Kolmogorov–Smirnov检验表明,目标数据不符合正态分布。因此,采用Kruskal–Wallis H检验来评估锑含量在城市或物种间的显著差异性。当锑含量存在显著差异时,使用Mann-Whitney U检验来确定组间的差异。使用Spearman相关性分析探讨锑含量与个体身体特征(长度、重量、水分和脂肪含量)的关系,当P<0.05时,差异具有统计学意义。本文中样品的锑含量均以湿重计。样品中目标物含量低于检出限时,以0代替,便于数据统计分析。
-
采自国内8个典型沿海城市的124份市售水产品样品中锑的检出率为64.5%,其含量范围为<0.13—37.8 ng·g−1(平均值5.70 ng·g−1,中位值2.89 ng·g−1),远低于中国香港食物掺杂(金属杂质含量)规例标准(锑的最高限量值为1000 ng·g−1)[26],表明中国沿海城市水产品污染程度低。山东烟台市水产品锑的检测结果同样也表明该沿海城市海产品中未出现锑污染[15]。现阶段国内外对于水产品中锑污染情况的其他研究主要集中在矿区[6-7, 27-30],这些地区锑污染严重,例如湖南锡矿山,作为世界上储量最大的锑矿,当地鱼体中锑平均含量则达15 ng·g−1(59.8 ng·g−1干重,以75%含水率换算)[6],受采矿污染的南非Olifants河中鱼体内锑的最高含量更是高达28600 ng·g−1 [29],远远高于本次研究鱼体中锑的最高含量(7.40 ng·g−1)。
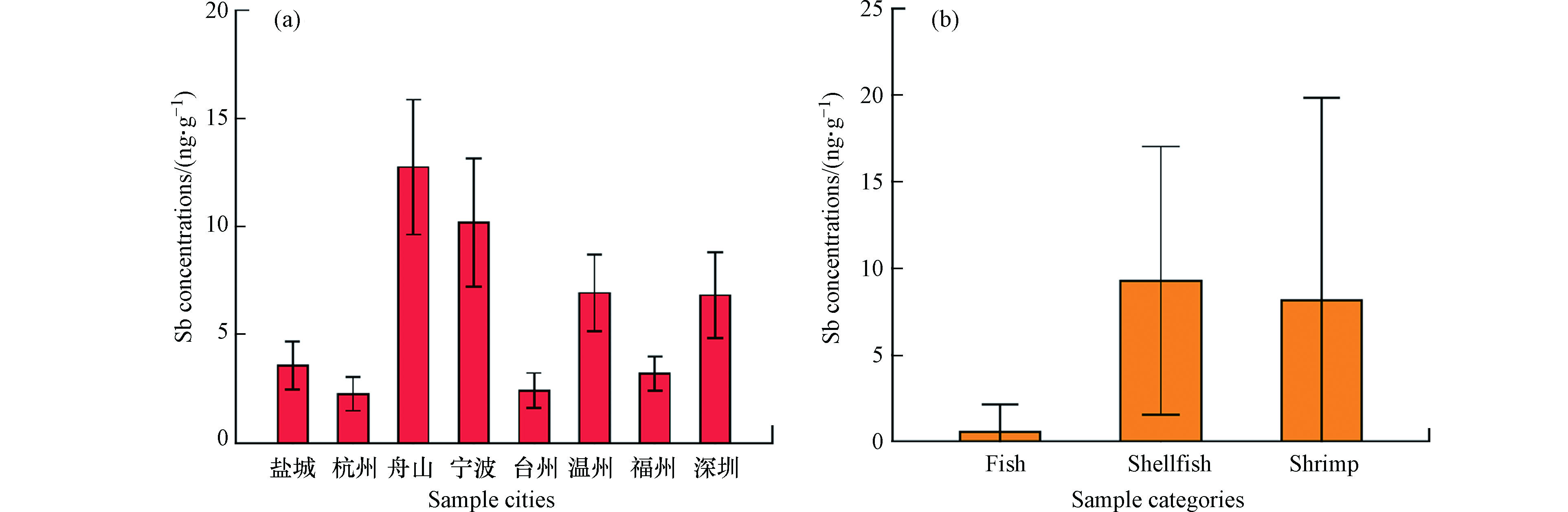
不同城市市售水产品中锑含量分布如图1a所示,其平均含量由高到低排序为舟山市(12.7 ng·g−1)、宁波市(10.2 ng·g−1)、温州市(6.94 ng·g−1)、深圳市(6.84 ng·g−1)、盐城市(3.59 ng·g−1)、福州市(3.21 ng·g−1)、台州市(2.42 ng·g−1)、杭州市(2.27 ng·g−1)。经Kruskal–Wallis H检验发现各个城市之间水产品中的锑含量并无显著差异(P<0.05),这与之前关于这些地区水产品中汞和硒的研究结论一致[31],这一现象可归因于多种因素,包括:(1)研究中的采样城市主要集中在中国东部;(2)市场所售的水产品多为人工养殖产品,其生长时间较短,对于污染物的累积时间较少;(3)沿海海洋系统中的锑含量被海流均匀化;(4)一些水生生物对锑的积累能力较弱,即使采样地点受到人为污染,生物体中的锑浓度也可能很低[14]。
不同类别水产品中锑的赋存具有明显差异。锑在贝类和虾中的检出率分别达98.5%和87.5%,而鱼中检出率仅为16.0%。鱼肉中锑的含量(平均0.57 ng·g−1)明显低于贝类(9.40 ng·g−1)和虾(7.30 ng·g−1)(图1b),这可能与不同生物的锑积累转化能力、生活习性及栖息环境有关。现阶段对此研究较少,有研究指出锑的毒理作用及生物行为与砷相似[6, 32]。贝类对于砷的同化吸收能力要比鱼类强[33-34],推测贝类对于锑的同化吸收能力也可能比鱼类强。底栖生物对锑的累积能力比浮游生物强[18],贝类大多栖息于水底沉积物中,沉积物通常沉积了大量重金属和类金属,贝类更容易通过接触沉积物富集锑。在贝类中,腹足类的锑含量(平均值13.5 ng·g−1)高于双壳类(8.57 ng·g−1),可能是由于腹足类通常以藻类及双壳类为食。
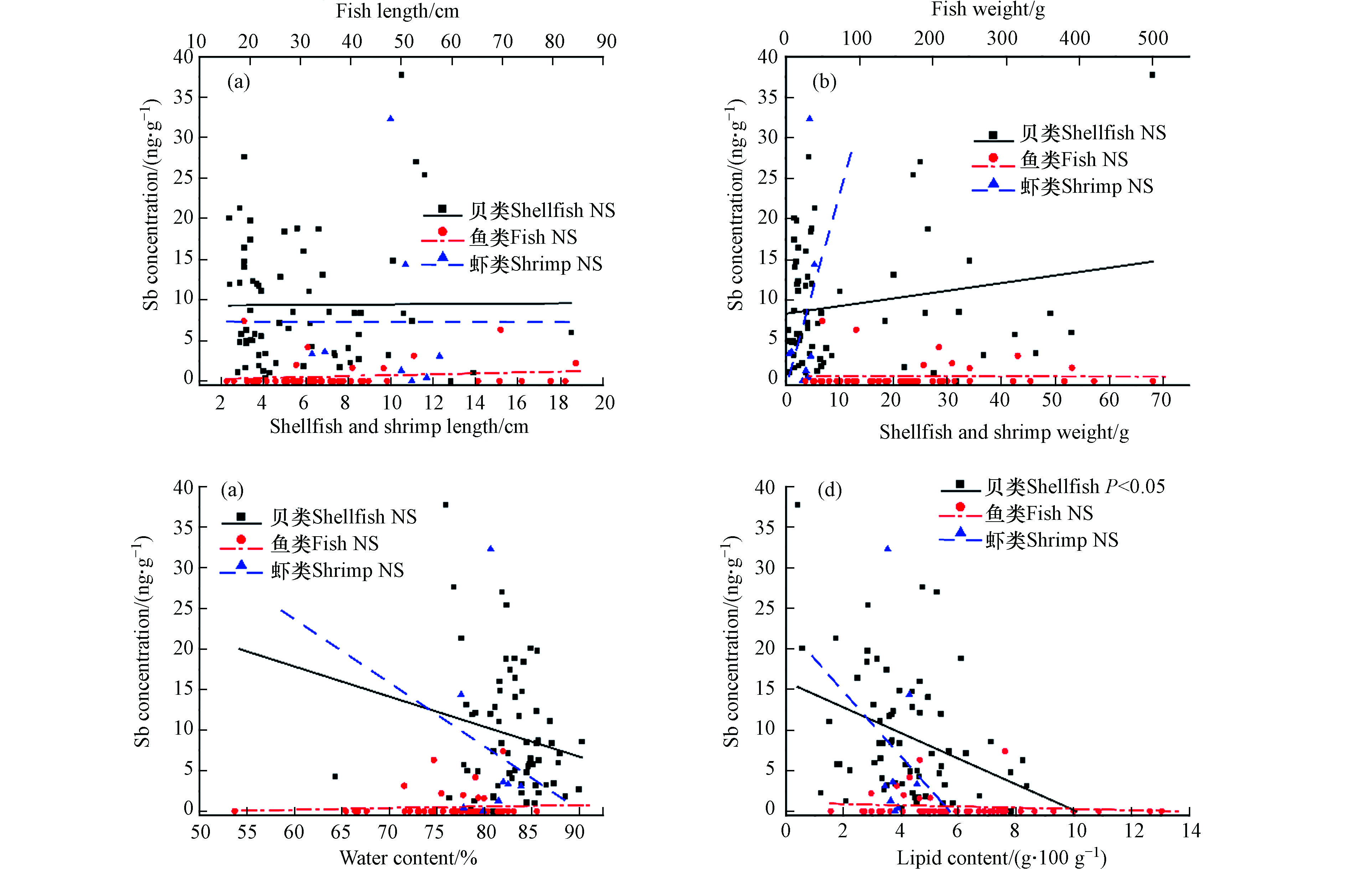
为揭示个体对水产品中锑累积的影响,本研究对锑含量与个体身体特征(长度、重量、水分和脂肪含量)进行了Spearman相关性分析。如图2所示,仅在贝类脂含量与锑含量之间存在有明显的负相关性(y=−1.5856x+15.9793, N=66, R2=0.12, P<0.05),并未发现锑含量和其他身体特征之间存在显著相关性,说明个体身体特征对水产品中锑积累的影响较小。
-
由于生物体不同部位对金属的吸收、调节、储存、生物转化和排泄作用不同,锑在鱼体不同器官或组织中的分布具有差异性。如表1所示,在大多数样品中,鱼鳃中锑的检出率和含量较高,其后是肝脏和肌肉,鱼皮和鱼籽中锑均无检出。这一结果与先前的研究结果一致[6, 19]。鱼鳃中的锑含量高于其他器官,这可能与鱼鳃的离子调节作用有关。由于鱼鳃组织表面积大,含有大量的主动运输泵,可从外部水环境运输离子进来,同时鳃组织可以分泌黏液,是捕获金属的结合点。此外,鱼鳃具有排泄作用,会导致更多的锑被转运至鱼鳃中[19]。关于砷、铜等金属的研究发现,当经由食物暴露途径时,鱼鳃中的金属浓度通常低于其他器官[35-36]。在本研究中,鱼鳃中的锑浓度较高,而包括肝脏在内的其他器官中的锑含量很低(大多低于检出限),暗示着所研究鱼摄入锑的主要途径并非食物暴露途径,鱼体中锑主要来源于水体中锑。
-
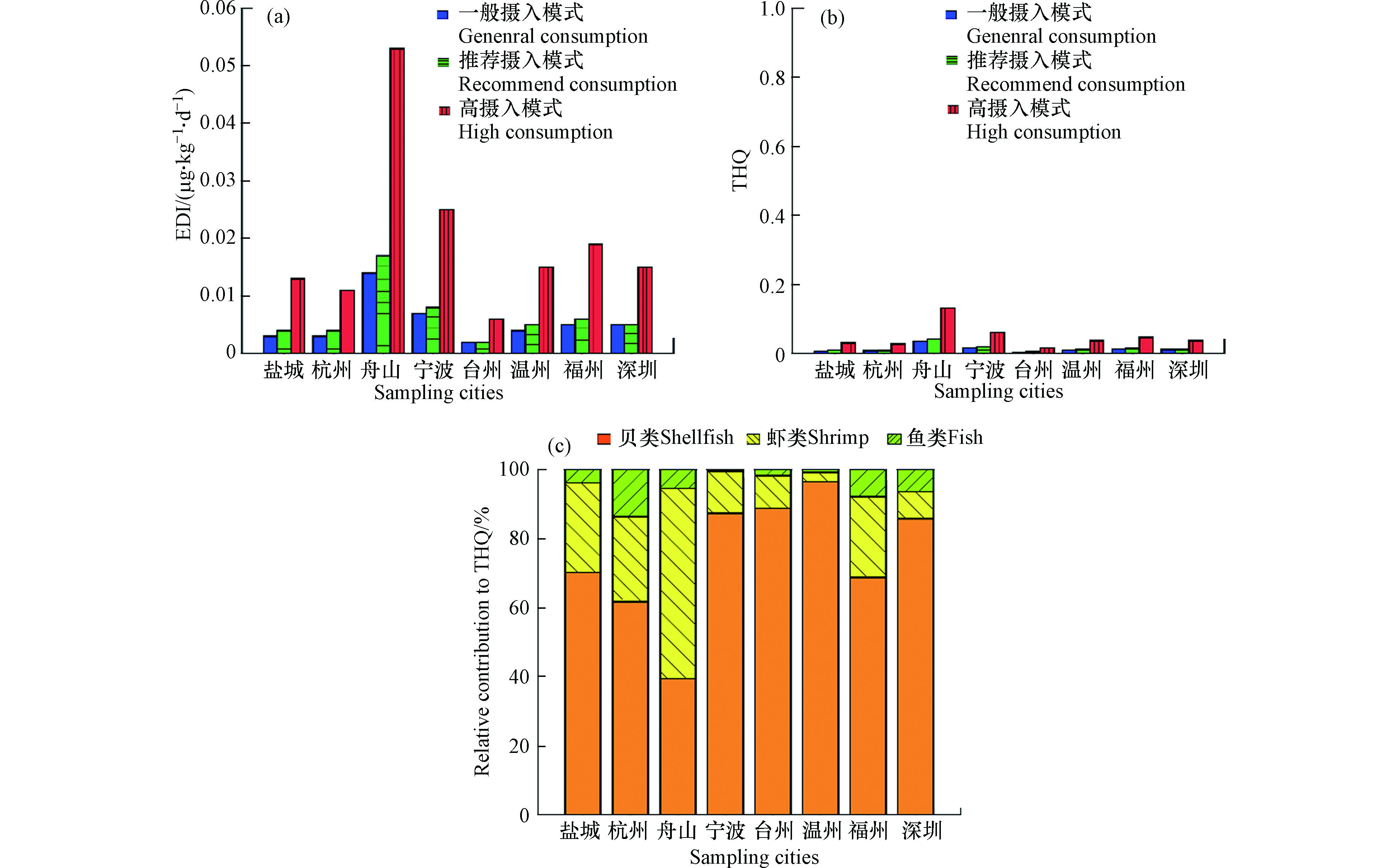
中国8个沿海城市居民锑的平均EDI、 THQ、及鱼类、贝类和虾对THQ的相对贡献占比见图3。3种水产品食用水平下采样城市居民锑的平均EDI分别为0.002—0.014、0.002—0.017、0.006—0.053 μg·kg−1·d−1,远低于由美国环境保护署规定的锑口服参考剂量(0.4 μg·kg−1·d−1)。同时,各个城市居民在3种消费模式下的THQ均小于1。该结果表明,即使是水产品高摄入人群,例如渔民,通过水产品消费所产生的锑暴露风险也可以忽略不计,人体健康不会受到危害。在绝大多数采样城市中,贝类食用是通过水产品摄入锑的THQ主要贡献来源,占比达到39.4%—88.4%,鱼和虾的占比分别在0.4%—13.7%和2.71%—55.2%范围内。因此,在考虑减少通过食用水产品摄入的锑时,可优先减少贝类的食用量。总体而言,对于中国沿海城市居民来说,水产品中锑污染水平处于安全限值以内,可以放心食用,不必担心水产品中的锑暴露风险。
-
本研究分析了中国8个典型沿海城市市售水产品中锑的分布特征及其食用风险。虽然在大多数市售水产品中能够检测到锑,但锑含量普遍较低。与空间区域因素及个体体征相比,物种、生活习性及栖息环境对水产品锑的积累起着更重要的作用。鱼鳃中锑含量较高,说明鱼鳃是鱼类累积锑的主要器官,同时暗示食物暴露并非鱼体摄入锑的主要途径。健康风险评估结果表明,所采样地区居民食用水产品所导致的锑暴露风险可以忽略不计。尽管如此,考虑到锑被广泛应用于各种工业行业,所造成的环境污染越来越严重,仍需要持续关注水产品中锑含量变化以防控相关健康风险。
中国典型沿海城市水产品中锑的分布特征及食用风险
Distribution characteristics and consumption risk of antimony in aquatic products in typically coastal cities of China
-
摘要: 锑具有毒性和潜在的致癌性,近年来受到越来越多的关注。水产品中锑的数据十分有限。本文分析了中国8个典型沿海城市(盐城市、杭州市、舟山市、宁波市、台州市、温州市、福州市、深圳市)124个市售水产品中锑的分布特征和食用风险。结果显示,水产品中锑的污染水平较低,含量范围为<0.13—37.8 ng·g−1湿重,平均含量5.70 ng·g−1湿重。锑含量在各个城市样品间无显著差异,但不同物种间存在明显差异。贝类和虾类中锑含量相对鱼类较高。鱼体中,鱼鳃的锑含量较高。水产品中锑含量受个体体征影响较小,仅贝类中锑含量与其脂肪含量存在负相关性。在一般、推荐、高的水产品食用水平(47.7—235 g·d−1)下,采样区居民每日食用水产品摄入锑的平均量约在0.002—0.053 μg·kg−1·d−1,目标危害系数均小于1,表明中国沿海城市居民通过食用水产品暴露锑的风险可忽略不计。Abstract: Antimony (Sb) has received increasing attention in recent years due to its toxicity and potential carcinogenicity. However, available data on Sb in aquatic products are extremely limited. This study analyzed the distribution characteristics and consumption risk of Sb in 124 marketed aquatic products from eight typically coastal cities of China (Yancheng City, Hangzhou City, Zhoushan City, Ningbo City, Taizhou City, Wenzhou City, Fuzhou City, and Shenzhen City). Results show that the Sb pollution in aquatic products was relatively low. The content of Sb in the samples ranged from <0.13 to 37.8 ng·g−1 wet weight (ww) with an average value of 5.70 ng·g−1 ww. Significant differences in Sb contents were not observed among the samples from different cities but existed among species. The contents of Sb in shellfish and shrimp were higher than those in fish. Fish gills contained higher Sb contents than other organs. The Sb content in aquatic products was less affected by individual characteristics, and only the Sb content in shellfish was negatively correlated with the lipid content. The average estimated daily intakes of Sb under the general, recommended and high aquatic products consumption scenarios (47.7—235 g·d−1) were in the range of 0.002—0.053 μg·kg−1·d−1 for the residents in the sampled sites. The values of correspondingly target hazard quotients were less than 1, indicating the negligible risk of Sb exposure for residents through aquatic products consumption in coastal cities in China.
-
Key words:
- antimony /
- aquatic products /
- distribution characteristics /
- consumption risk
-
图 3 一般、推荐、高的水产品食用水平下,中国八个沿海城市居民锑的(a)平均每日摄入评估量(EDI)、(b)目标危害系数(THQ)、及(c)鱼类、贝类和虾的THQ贡献比例
Figure 3. (a) Mean estimated daily intake (EDI), (b)target hazard quotient (THQ) of Sb from aquatic product consumption for residents in sampling cities in China under general, recommend and high intake consumption scenarios, and (b) relative contributions of fish, shellfish and shrimp to the THQ
表 1 中国市售鱼体不同部位中的锑含量
Table 1. Concentrations of Sb in different parts of the marketed aquatic products in China
品种Species 部位Parts 锑含量/(ng·g−1)Sb concentrations 品种Species 部位Parts 锑含量/(ng·g−1)Sb concentrations 罗非鱼 肌肉 ND. a 昂刺鱼 肌肉 ND. 肝脏 2.47 肝脏 ND. 鱼皮 ND. 鱼皮 ND. 鱼鳃 14.7 鱼鳃 35.3 珍珠斑 肌肉 ND. 鮰鱼 肌肉 1.60 肝脏 ND. 肝脏 ND. 鱼皮 ND. 鱼皮 ND. 鱼鳃 3.77 鱼鳃 14.3 桂鱼 肌肉 ND. 龙头鱼 肌肉 ND. 肝脏 1.84 肝脏 2.37 鱼皮 ND. 鲫鱼 肌肉 ND. 鱼鳃 25.9 鱼皮 ND. 鳊鱼 肌肉 ND. 鱼籽 ND. 肝脏 7.32 黄鱼 肌肉 ND. 鱼皮 ND. 鱼皮 ND. 鱼籽 ND. 鱼籽 ND. a ND (not detected) 表示未检出. -
[1] SCHNORR T M, STEENLAND K, THUN M J, et al. Mortality in a cohort of antimony smelter workers [J]. American Journal of Industrial Medicine, 1995, 27(5): 759-770. doi: 10.1002/ajim.4700270510 [2] KURODA K, ENDO G, OKAMOTO A, et al. Genotoxicity of beryllium, gallium and antimony in short-term assays [J]. Mutation Research Letters, 1991, 264(4): 163-170. doi: 10.1016/0165-7992(91)90072-C [3] U. S. Environmental Protection Agency (USEPA). Water-related environmental fate of 129 priority pollutants. Volume I: introduction and technical background, metals and inorganics, pesticides and PCBs[M]. Washington: United States Environmental Protection Agency, 1979. [4] The Council of the European Union (CEU). Council Directive 98/83/EC of 3 November 1998 on the quality of water intended for human consumption[EB/OL]. [2015-10-27].https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:01998L0083-20151027&from=EN. [5] International Agency for Research on Cancer (IARC). Antimony trioxide and antimony trisulfide. IARC monographs on the evaluation of carcinogenic risks to humans[EB/OL]. [1989].https://monographs.iarc.who.int/agents-classified-by-the-iarc/. [6] FU Z Y, WU F C, MO C L, et al. Comparison of arsenic and antimony biogeochemical behavior in water, soil and tailings from Xikuangshan, China [J]. Science of the Total Environment, 2016, 539: 97-104. doi: 10.1016/j.scitotenv.2015.08.146 [7] GUO W J, ZHANG Z Y, WANG H, et al. Exposure characteristics of antimony and coexisting arsenic from multi-path exposure in typical antimony mine area [J]. Journal of Environmental Management, 2021, 289: 112493. doi: 10.1016/j.jenvman.2021.112493 [8] OKKENHAUG G, GRASSHORN GEBHARDT K A, AMSTAETTER K, et al. Antimony (Sb) and lead (Pb) in contaminated shooting range soils: Sb and Pb mobility and immobilization by iron based sorbents, a field study [J]. Journal of Hazardous Materials, 2016, 307: 336-343. doi: 10.1016/j.jhazmat.2016.01.005 [9] HALDAR A K, SEN P, ROY S. Use of antimony in the treatment of leishmaniasis: Current status and future directions [J]. Molecular Biology International, 2011, 2011: 571242. [10] SHOTYK W, KRACHLER M. Contamination of bottled waters with antimony leaching from polyethylene terephthalate (PET) increases upon storage [J]. Environmental Science & Technology, 2007, 41(5): 1560-1563. [11] TIAN H Z, ZHAO D, CHENG K, et al. Anthropogenic atmospheric emissions of antimony and its spatial distribution characteristics in China [J]. Environmental Science & Technology, 2012, 46(7): 3973-3980. [12] HE M C, WANG X Q, WU F C, et al. Antimony pollution in China [J]. Science of the Total Environment, 2012, 421/422: 41-50. doi: 10.1016/j.scitotenv.2011.06.009 [13] 朱静, 吴丰昌, 邓秋静, 等. 湖南锡矿山周边水体的环境特征 [J]. 环境科学学报, 2009, 29(3): 655-661. doi: 10.3321/j.issn:0253-2468.2009.03.029 ZHU J, WU F C, DENG Q J, et al. Environmental characteristics of water near the Xikuangshan antimony mine, Hunan Province [J]. Acta Scientiae Circumstantiae, 2009, 29(3): 655-661(in Chinese). doi: 10.3321/j.issn:0253-2468.2009.03.029
[14] OBIAKOR M O, TIGHE M, PEREG L, et al. Bioaccumulation, trophodynamics and ecotoxicity of antimony in environmental freshwater food webs [J]. Critical Reviews in Environmental Science and Technology, 2017, 47(22): 2208-2258. doi: 10.1080/10643389.2017.1419790 [15] 刘海韵, 王茂波, 刘正毅, 等. 烟台市部分海域常见水产品锑含量水平及污染评价 [J]. 预防医学论坛, 2012, 18(3): 217-218. LIU H Y, WANG M B, LIU Z Y, et al. Evaluation on the content and pollution of Sb in marine products from some sea areas in Yantai city [J]. Preventive Medicine Tribune, 2012, 18(3): 217-218(in Chinese).
[16] 谭湘武, 马金辉, 萧福元, 等. 湖南居民主要食品中锑的污染及暴露评估 [J]. 中国食品卫生杂志, 2016, 28(4): 528-532. TAN X W, MA J H, XIAO F Y, et al. Dietary exposure assessment of antimony in hunan [J]. Chinese Journal of Food Hygiene, 2016, 28(4): 528-532(in Chinese).
[17] WU F C, FU Z Y, LIU B J, et al. Health risk associated with dietary co-exposure to high levels of antimony and arsenic in the world's largest antimony mine area [J]. Science of the Total Environment, 2011, 409(18): 3344-3351. doi: 10.1016/j.scitotenv.2011.05.033 [18] FU Z Y, WU F C, MO C L, et al. Bioaccumulation of antimony, arsenic, and mercury in the vicinities of a large antimony mine, China [J]. Microchemical Journal, 2011, 97(1): 12-19. doi: 10.1016/j.microc.2010.06.004 [19] FU Z Y, WU F C, AMARASIRIWARDENA D, et al. Antimony, arsenic and mercury in the aquatic environment and fish in a large antimony mining area in Hunan, China [J]. Science of the Total Environment, 2010, 408(16): 3403-3410. doi: 10.1016/j.scitotenv.2010.04.031 [20] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 中华人民共和国国家标准: 食品安全国家标准 食品中脂肪的测定 GB 5009.6—2016[S]. 北京: 中国标准出版社, 2017. National Health Commission of the People's Republic of China, China Food and Drug Administration. . National Standard (Mandatory) of the People's Republic of China: GB 5009.6—2016[S]. Beijing: Standards Press of China, 2017(in Chinese).
[21] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 中华人民共和国国家标准: 食品安全国家标准 食品中锑的测定 GB 5009.137—2016[S]. 北京: 中国标准出版社, 2017. National Health Commission of the People's Republic of China, China Food and Drug Administration. . National Standard (Mandatory) of the People's Republic of China: GB 5009.137—2016[S]. Beijing: Standards Press of China, 2017(in Chinese).
[22] 国家统计局. 中国统计年鉴2020[M]. 北京: 中国统计出版社, 2020. National Bureau of Statistics of China. China Statistical Yearbook 2020[M]. Beijing: China Statistics Press, 2020.
[23] 中国营养学会. 中国居民膳食指南: 2016 科普版[M]. 北京: 人民卫生出版社, 2016. Chinese Nutrition Society. The Chinese Dietary Guidelines 2016 [M]. Beijing: People's Medical Publishing House, 2016(in Chinese).
[24] GULKOWSKA A, JIANG Q T, SO M K, et al. Persistent perfluorinated acids in seafood collected from two cities of China [J]. Environmental Science & Technology, 2006, 40(12): 3736-3741. [25] U. S. Environmental Protection Agency (USEPA). Antimony; CASRN 7440-36-0[EB/OL]. [1987-1-31].https://iris.epa.gov/ChemicalLanding/&substance_nmbr=6. [26] 香港特别行政区政府食品安全中心. 食物掺杂(金属杂质含量)规例[S].https://www.cfs.gov.hk/tc_chi/whatsnew/whatsnew_fstr/whatsnew_fstr_PA_Food_Adulteration_Metallic_Contamination.html#1. Hong Kong Special Administrative Region Centre for Food Safety. Guideline Food Adulteration-Metallic Contamination[S].https://www.cfs.gov.hk/tc_chi/whatsnew/whatsnew_fstr/whatsnew_fstr_PA_Food_Adulteration_Metallic_Contamination.html#1.
[27] UJAH I I, DO O, VE O. Determination of heavy metals in fish tissues, water and sediment from the onitsha segment of the river Niger anambra state Nigeria [J]. Journal of Environmental & Analytical Toxicology, 2017, 7(5): 1000507. doi: 10.4172/2161-0525.1000507 [28] DOVICK M A, KULP T R, ARKLE R S, et al. Bioaccumulation trends of arsenic and antimony in a freshwater ecosystem affected by mine drainage [J]. Environmental Chemistry, 2016, 13(1): 149. doi: 10.1071/EN15046 [29] LEBEPE J, MARR S, LUUS-POWELL W. Metal contamination and human health risk associated with the consumption of Labeo rosae from the Olifants River system, South Africa [J]. African Journal of Aquatic Science, 2016, 41(2): 161-170. doi: 10.2989/16085914.2016.1138100 [30] CHÉTELAT J, COTT P A, ROSABAL M, et al. Arsenic bioaccumulation in subarctic fishes of a mine-impacted bay on Great Slave Lake, Northwest Territories, Canada [J]. PLoS One, 2019, 14(8): e0221361. doi: 10.1371/journal.pone.0221361 [31] ZHANG H Y, GUO C Q, FENG H R, et al. Total mercury, methylmercury, and selenium in aquatic products from coastal cities of China: Distribution characteristics and risk assessment [J]. Science of the Total Environment, 2020, 739: 140034. doi: 10.1016/j.scitotenv.2020.140034 [32] OKKENHAUG G, ZHU Y G, HE J W, et al. Antimony (Sb) and arsenic (As) in Sb mining impacted paddy soil from Xikuangshan, China: Differences in mechanisms controlling soil sequestration and uptake in rice [J]. Environmental Science & Technology, 2012, 46(6): 3155-3162. [33] ZHANG W, WANG W X. Arsenic biokinetics and bioavailability in deposit-feeding clams and polychaetes [J]. Science of the Total Environment, 2018, 616/617: 594-601. doi: 10.1016/j.scitotenv.2017.10.292 [34] ZHANG W, HUANG L M, WANG W X. Arsenic bioaccumulation in a marine juvenile fish Terapon jarbua [J]. Aquatic Toxicology, 2011, 105(3/4): 582-588. [35] AMLUND H, INGEBRIGTSEN K, HYLLAND K, et al. Disposition of arsenobetaine in two marine fish species following administration of a single oral dose of [14C]arsenobetaine [J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2006, 143(2): 171-178. [36] CLEARWATER S J, FARAG A M, MEYER J S. Bioavailability and toxicity of dietborne copper and zinc to fish [J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2002, 132(3): 269-313. -




 下载:
下载: