-
河口为陆地-海洋相互作用的重要界面和陆源物质进入海洋的主要过渡区,对于地球表面物质循环具有重要意义。天然和人为源的重金属从陆地到近海水域是以河口为主要运输路径。河口的复杂流体动力学在悬浮物的运输,沉积和再悬浮中起着关键作用[1-2],影响河口邻近海域的重金属的空间分布、转化和生物富集。重金属具有生物毒性、持久性、不可降解性以及广泛的来源性,是对海洋环境的最大威胁之一[3-5]。在2009年黄河口表层海水中溶解态重金属(Cu、Pb、Zn、Cd、Hg和As)的平均浓度分别为2.65、0.51、37.7、0.68、0.013、0.92 µg·L−1。溶解态重金属的含量从黄河口以及其近岸海域到远海逐渐减少说明溶解态重金属的浓度受人类活动、黄河流域污染的影响。据估计黄河能承受的重金属污染物总负荷预估为687 t至1110 t[6-7]。对比过去的研究,黄河三角洲的重金属污染有所增加[8-9]。与1980年代相对比,2001年的黄河河口及其邻近海域的重金属汞的含量高出6倍到8倍[10]。研究认为农业、工业和大气沉降可能是黄河口溶解态重金属的来源,近岸海流、沿海上升流和各理化参数可能是溶解态重金属空间和季节分布的主要影响因素[11]。
黄河是中国第二长河,是世界上悬浮泥沙含量最高的河流,每年向河口输送大量的泥沙对黄河口湿地及其附近海域环境产生影响,过去研究认为黄河口附近海域的重金属含量主要受自然过程影响[12]。近年来黄河流域生态环境逐渐改善,黄河向河口输沙量减少,同时随着黄河流域经济的快速发展,向黄河排放的污染物也在增加。但近些年对黄河口重金属的研究较少,本研究通过研究黄河口邻近海域重金属形态的变化特征,分析重金属来源的变化,弥补这方面的不足,并可为黄河流域的保护和高质量发展提供一定的科学依据。
-
随鲁昌渔60003分别对黄河口邻近海域进行布点采样。2020年8月和10月分别布设了37个和40个采样点(图1)。用有机玻璃采水器分别取表、底层水样及10%平行样质量控制样品。用混合纤维滤膜过滤收集海水中的悬浮颗粒物,置于膜盒内密封-20℃保存带回实验室,用于测定颗粒态重金属的含量;过滤后水样倒入聚四氟乙烯瓶,加硝酸酸化固定,用于测定水中金属元素。同时记录风速风向、水色、透明度和气温等参数。水温、水深、pH、溶解氧、盐度等海水参数由多参数水质仪实时测定;根据海洋监测规范(GB 17378)采集样品测定叶绿素 a、营养盐(硝酸盐、亚硝酸盐等)、COD 等。
-
颗粒态重金属,将过滤后的混合纤维滤膜置于消解罐中(海洋监测技术规程HY/T147.2—2013),加入浓硝酸微波消解,定容于50 mL的比色管中,由ICP-MS(Agilent 7900)测定Cu、Pb、Zn、Cr、Cd、Fe、Al等元素,用PCu、PPb、PZn、PCr、PCd、PFe、PAl表示。
溶解态重金属,按照海洋监测技术规程(HY/T147.1—2013),取 1 mL 过滤后的水样加9 mL1%的硝酸溶液稀释10倍,由ICP-MS(Agilent 7900)测定Cu、Pb、Zn、Cr、Cd、Fe、Al等元素。用DCu、DPb、DZn、DCr、DCd、DFe、DAl表示。Cu、Pb、Zn、Cd、Cr、As的检出限分别为0.12、0.07、0.10、0.03、0.05、0.05 µg·L−1。水中总重金属浓度为溶解态和颗粒态重金属之和。玻璃和塑料器皿均用3 mol·L−1硝酸浸泡 24 h。每隔10个样品设置1组平行,相对标准偏差均<5%。
叶绿素采用分光光度法测定,COD采用碱性高锰酸钾法测定,详见海洋监测规范(GB17378.4—2007);营养盐采用流动分析法测定,详见海洋监测技术规程(HY/T147.1—2013)。
-
表1列出了黄河口夏秋两个季节的理化参数值。水温在夏季明显高于秋季。秋季表层悬浮颗粒物高于夏季表层,夏秋两季表层盐度和COD相差不大。秋季pH、DO、叶绿素a均高于夏季。
-
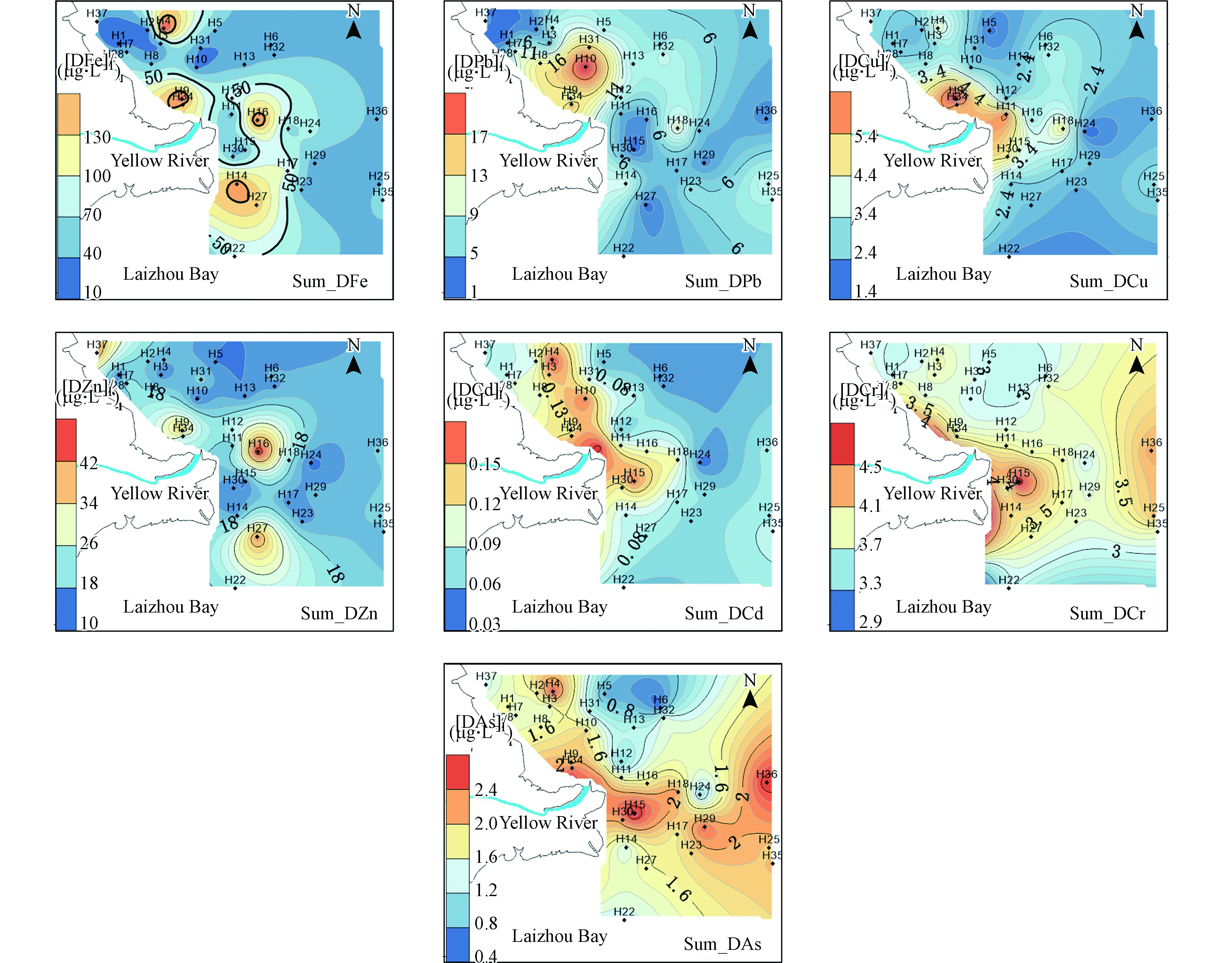
夏季DFe、DPb、DCu、DZn、DCd、DCr、DAs的浓度平均值分别为45.2、7.33、2.87、18.0、0.0979、3.24、1.65 µg·L−1,浓度变化范围分别为12.9—154、1.05—26.5、1.41—6.83、10.5—45.9、0.03—0.18、2.54—4.71、0.426—2.65 µg·L−1。溶解态重金属浓度整体呈现自河口至远海逐渐降低的分布趋势。DFe、DCd和DAs在河口西北部出现高浓度(图2),是由于站位受东营港的人为活动输入以及轮船排污等影响;DFe、DZn和DCd在河口东南部出现高浓度可能是由于旧黄河口地下径流输入影响,以及此区域水流变缓、各种离子的剧烈变化引起的水化学反应导致;DAs在黄河口东部远海内部出现高浓度可能是由于近些年近海养殖区夏季投饵造成。
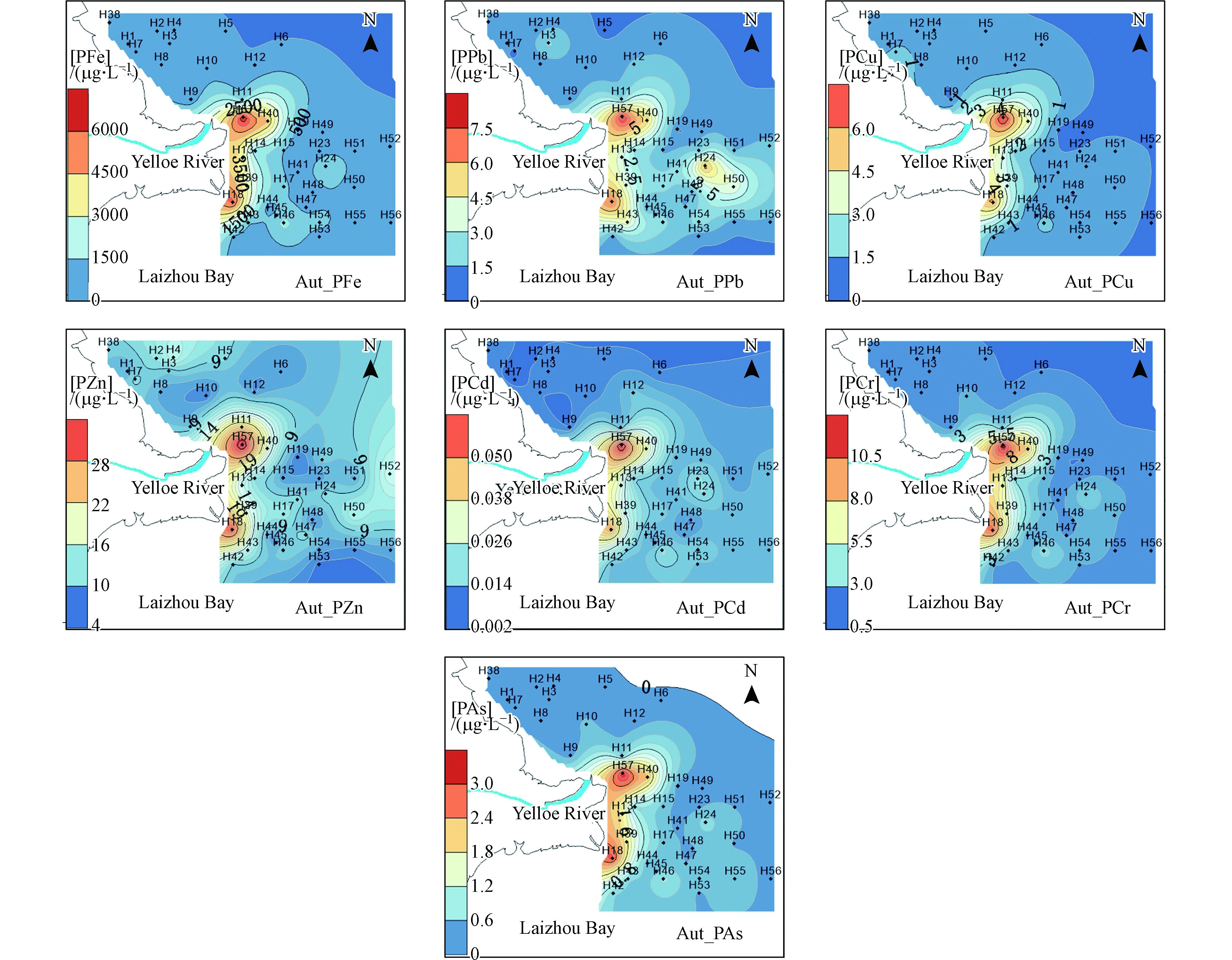
夏季PFe、PPb、PCu、PZn、PCd、PCr、PAs的浓度变化范围为167—9832、0.6—21.6、0.4—10.6、4.2—29.7、0.004—0.107、0.66—17.3、0.12—6.13 µg·L−1。颗粒态重金属均呈现出在三角洲东部出现高浓度区域(图3),但PPb的含量在黄河入海口附近要大于三角洲东部区域,整体上向东部和北部海域逐渐递减。这种分布特点主要是由于黄河携带大量的悬浮颗粒物注入渤海,在河口出现了高值区;同时在黄河冲淡水与沿渤海沿岸流、潮汐作用下,在三角洲东部出现颗粒态重金属的最大值,颗粒态金属的分布基本上与悬浮颗粒物的分布特点一致。
-
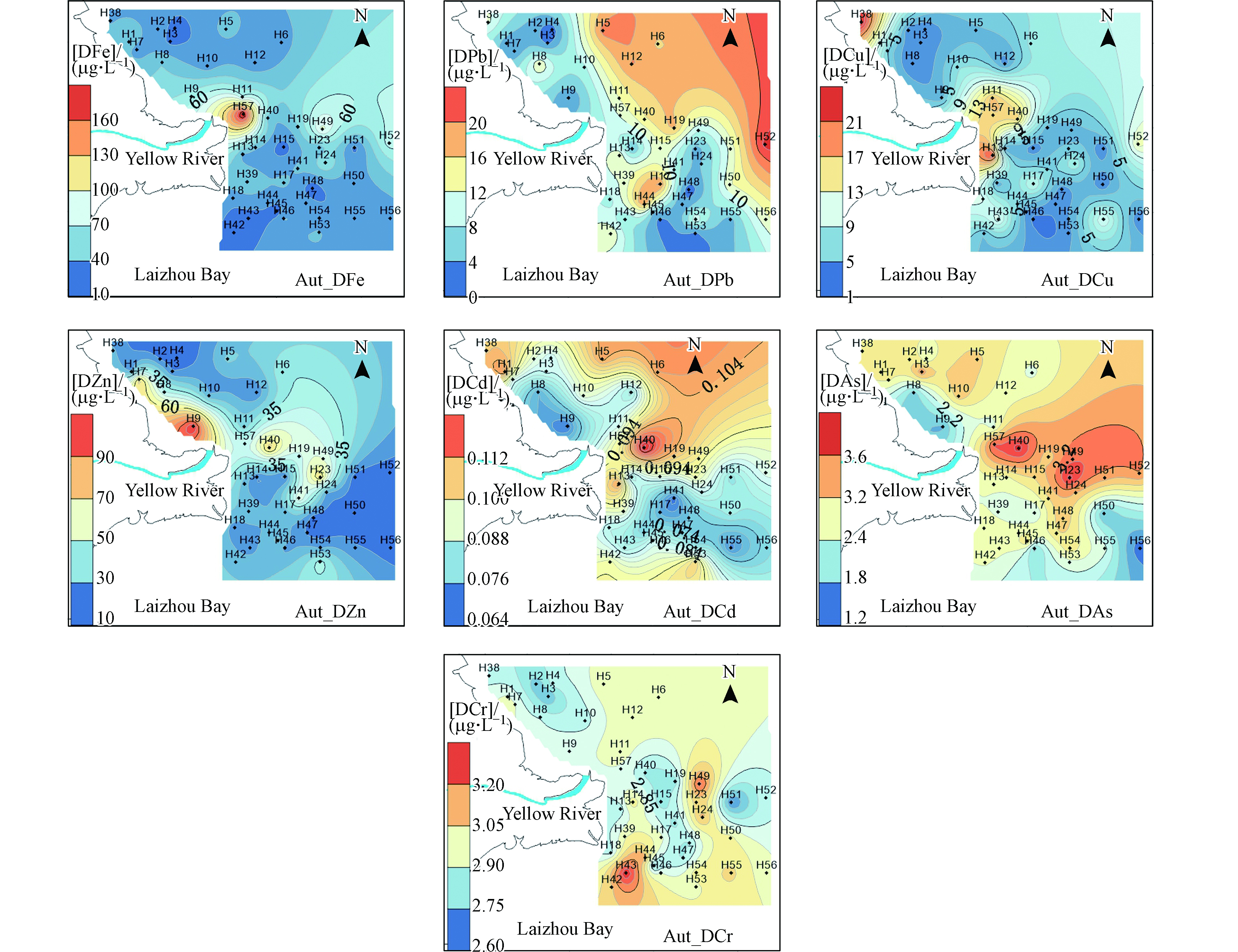
秋季DFe、DPb、DCu、DZn、DCd、DCr、DAs的浓度为12.1—178.6、0.52—22.8、1.69—50.0、10.5—96.0、0.04—0.12、2.63—3.67、1.25—3.72 µg·L−1。秋季的DFe、DCu、DZn、DCr的浓度在黄河入海口处出现高浓度但分布范围较小(图4),DPb、DCd、DAs在东部偏北的渤海海域偏高,可能由于秋季进入海洋养殖的成熟期,大量的养殖船作业以及渔船作业排污所致。
秋季PFe、PPb、PCu、PZn、PCd、PCr、PAs的浓度变化范围为47.0—5988、0.387—7.47、0.386—6.95、4.61—32.0、0.0036—0.059、1.00—11.1、0.05—3.07 µg·L−1。秋季颗粒态重金属在黄河入海口以及其南部出现高浓度,依次向周边海域递减(图5)。
-
将黄河口海域Fe、Cu、Zn、Cd、Cr、As的浓度与其它河口浓度进行比较(表2)。由于缺乏其他海域的颗粒态重金属的相关数据,本文用溶解态重金属与其他海域进行对比。黄河口邻近海域DFe的浓度低于印度东南沿海[13]。DPb、DCu和DZn的浓度高于中国其他河口。DCr的浓度略高于长江口海域[14],但低于国内的其他河口。DCd的浓度高于山东半岛的东部沿海海域[15]。DAs的浓度与之前此海域研究以及珠江口海域相当[16],但低于辽东湾北部海域[17]。
-
黄河口海域夏季表层的DFe、DPb、DCu、DZn、DCd、DCr、DAs占其总量的比例分别为8%、56%、60%、64%、86%、59%、70%,底层为7%、50%、69%、64%、86%、64%、76%;秋季表层DFe、DPb、DCu、DZn、DCd、DCr、DAs占其总量的的比例分别为12%、79%、81%、71%、90%、62%、88%。除铁外,颗粒态重金属的浓度明显低于溶解态(表3),颗粒态重金属高浓度均出现在黄河口附近,表明颗粒态重金属来自黄河的输入 [18]。高浓度颗粒态重金属出现在河口,并沿入海的方向出现由高浓度向低浓度的迅速转化。由于入海流速变缓、悬浮颗粒物的沉降以及盐度、各种离子的剧烈变化引起的水化学反应导致此现象的产生。溶解态重金属分布趋势没有颗粒态重金属明显,但高浓度主要出现在沿岸附近以及东营港附近。
夏季表层的DFe、DCd和DCr浓度高于秋季,DCu、DZn、DAs、DPb浓度秋季高于夏季。夏季溶解态重金属的高浓度主要集中在近岸、河口以及东营港口附近。秋季溶解态重金属高浓度出现在莱州湾内部,可能是由于秋季禁渔期结束以及水产养殖产品收获引起的,湾内大量的养殖船、渔船作业排污导致了高浓度溶解态重金属的出现。夏季颗粒态重金属浓度高于秋季,颗粒态高浓度点出现的位置比秋季距离黄河入海口的位置更远。秋季黄河径流量减少导致颗粒物高浓度区域相比夏季向东部海域偏移,黄河水量的大小决定了河口重金属混合区的位置和范围。秋季颗粒态重金属在东营港港口同样出现高浓度,也反映大量渔船进出东营港引起的颗粒物的再悬浮以及渔船排污的影响。
表层溶解态重金属主要出现在河口位置,高浓度DCu、DZn出现在东营港附近,与人类活动有关。DAs高浓度出现在莱州湾内部,由于铜和砷的是一些杀菌剂和藻类杀菌剂的成分[19-21],莱州湾以水产养殖为主,说明了砷主要来源为养殖业。可能受周边工业区的排放导致附近海域有较高的镉浓度。
-
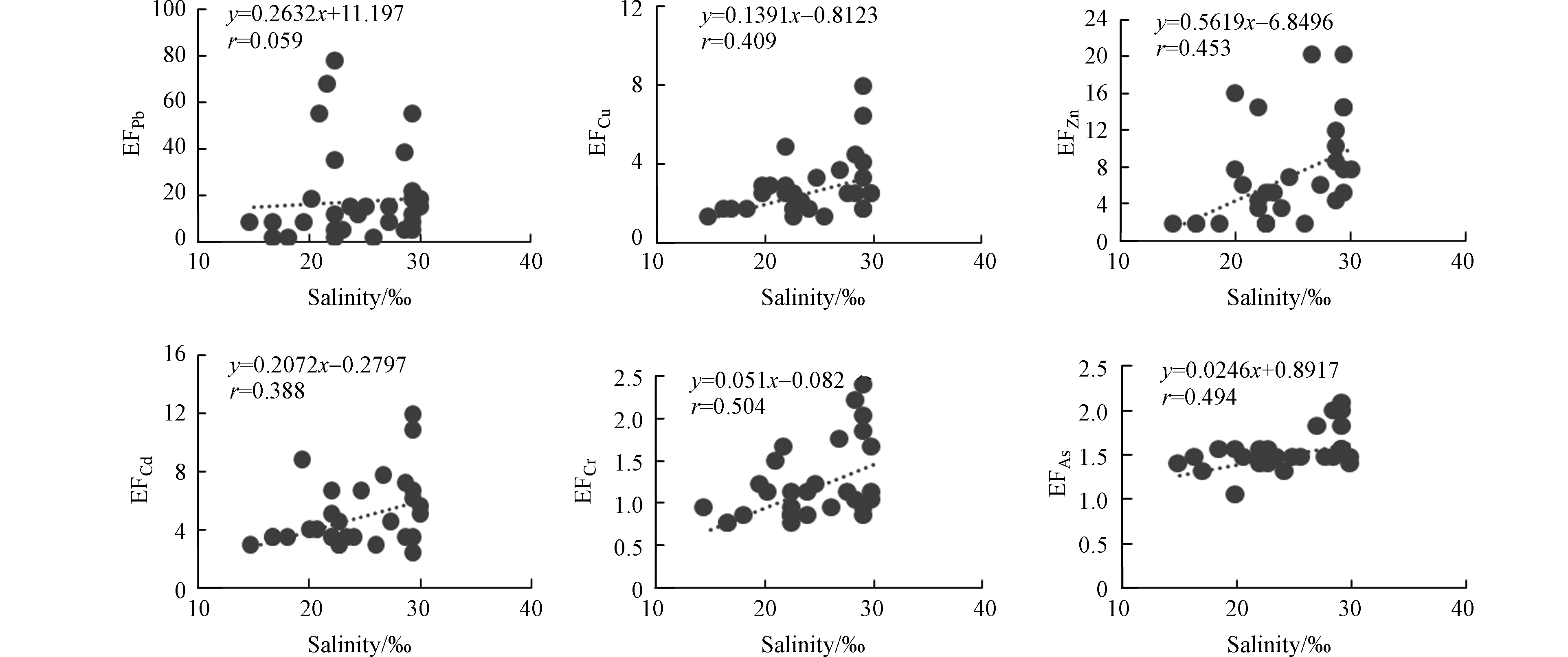
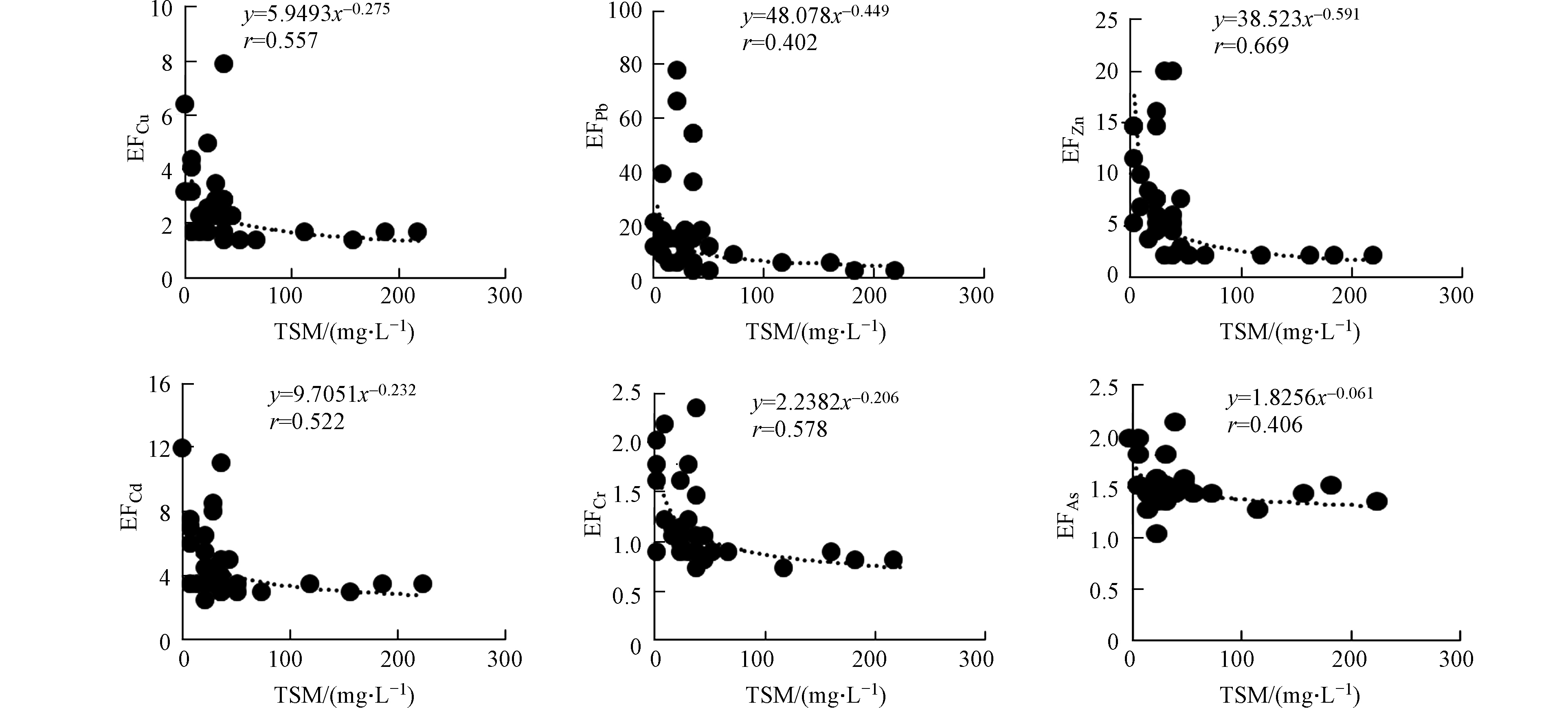
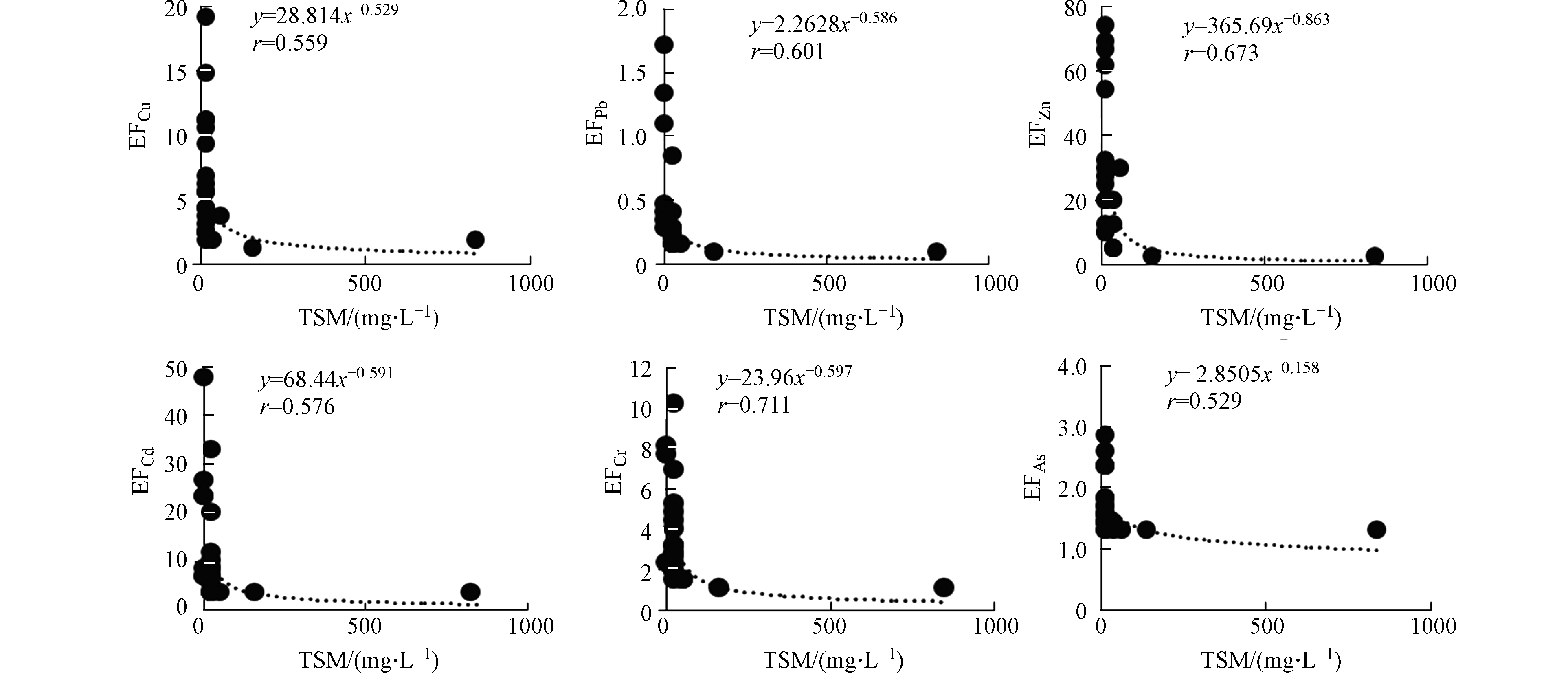
夏季黄河口邻近海域PPb、PCu、PZn、PCd、PCr、PAs的富集因子EF的平均值分别为10.4、2.88、6.21、4.42、1.13、1.49,变化范围分别为0.11—76.3、1.29—12.7、1.40—28.5、2.40—11.7、0.69—2.32、0.99—2.08。PPb、PCu、PZn、PCd污染程度为中度污染,PCr、PAs的污染程度为无污染或轻微污染。夏季PPb、PCu、PZn、PCd、PCr、PAs的富集因子EF均呈现出随TSM浓度的增大而减小、随盐度的增大而增大的趋势(图6、7)。
秋季黄河口邻近海域PPb、PCu、PZn、PCd、PCr、PAs的富集因子EF的平均值分别为0.35、4.28、19.5、11.1、2.78、1.66,变化范围分别为0.07—1.69、1.14—18.8、1.85—74.1、2.24—47.6、0.82—10.0、1.20—2.97。PCu、PZn、PCd、PCr污染程度为中度污染,PPb、PAs的污染程度为无污染或最小污染。夏季PPb、PCu、PZn、PCd、PCr、PAs的富集因子EF均呈现出随TSM浓度的增大而减小、随盐度的增大而增大的趋势(图8、9)。
夏秋两季海水中悬浮颗粒物的浓度在黄河入海口较高,向远海方向逐渐减少,盐度、悬浮颗粒物含量等变化较大。由表4发现颗粒态重金属与悬浮颗粒物呈显著相关性(r值均在0.6到1.0之间, P<0.01),表明颗粒态重金属的浓度受颗粒物浓度的影响明显。海水中的重金属主要赋存在悬浮颗粒物表面,并随其迁移,悬浮颗粒物的增减, 将会直接导致颗粒态重金属含量的变化。底层悬浮颗粒物的浓度受沉积物再悬浮和河流输送表层悬浮颗粒物因重力下沉的影响,导致底层悬浮颗粒物的浓度高于表层,进而使底层颗粒态重金属的浓度高于表层。夏秋两季表层海水中颗粒态重金属浓度均与盐度呈显著负相关(r值均在-0.3到-0.6之间, P<0.01),但底层海水中的颗粒态重金属以及海水中溶解态重金属浓度与盐度相关关系不显著,底层海水盐度变化较小。但以往研究表明盐度为5—20 psu时,溶解态的Fe、Cu、Ni、Pb和Mn的浓度增加[22-23]。盐度可能会影响重金属的吸附-解吸反应和海水中的离子反应, 进而影响水中重金属在溶解态与颗粒态之间的转化, 但对重金属总浓度影响不大。因而悬浮颗粒物浓度的变化是影响海水中重金属变化的主要原因。
-
秋季海水中颗粒态重金属的浓度与氨氮的呈显著正相关关系(r值范围为0.38—0.61, P<0.01)。秋季颗粒态重金属与叶绿素a也有显著的相关性(r值为0.6—0.88, P<0.01)(表4)。氨氮是藻类生长的重要营养物质,叶绿素a的浓度反映了藻类在海水中的生长情况和生物量。在入海口淡水与海水混合区域为氮盐、叶绿素a的高浓度点,大量营养物质的输入为藻类生长提供了营养物质,导致藻类生长旺盛,使颗粒态重金属浓度升高。
-
用固-液分配系数(Kd)表征海水中颗粒态重金属与溶解态重金属之间的配分关系,计算分配系数(Kd),有助于我们更好的认识重金属在海水中的迁移和转化。
式中, CP 是黄河口海域颗粒态重金属浓度(µg·L−1);CD 是黄河口海域溶解态重金属的浓度(µg·L−1);Kd是分配系数,单位是L·mg−1。
由表5发现,夏季各重金属的分配系数均高于秋季。这可能是因为夏季黄河径流量增大,并且常在此时期进行调水调沙,再加上大的径流量有利于河道淤积的泥沙输送到海洋,使河水和河口中颗粒态金属含量相对升高。而秋季径流量减少,流速下降,输沙能力下降,到达河口的颗粒物减少。
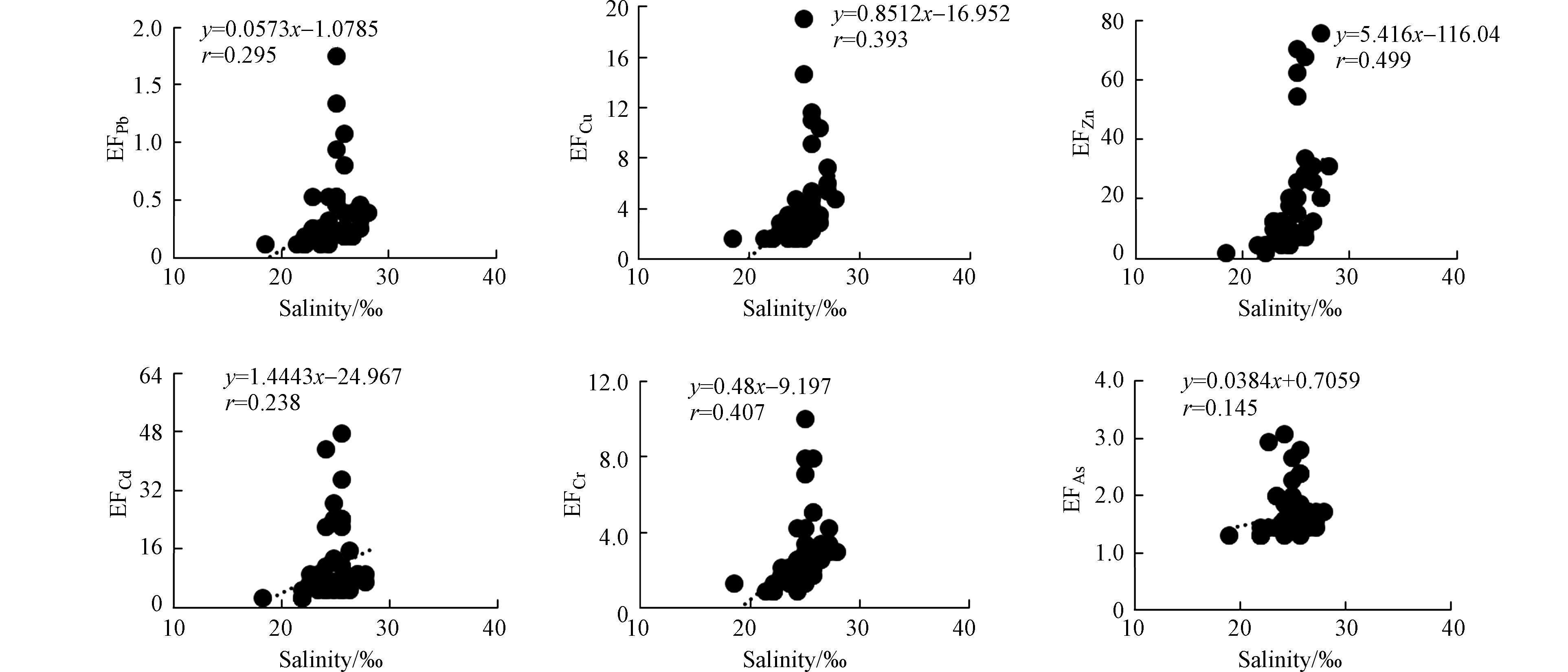
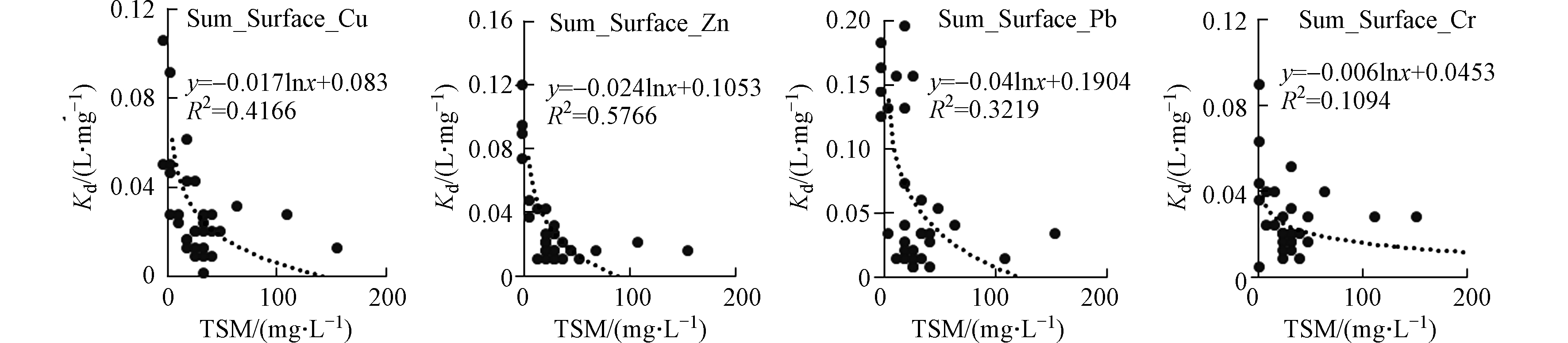
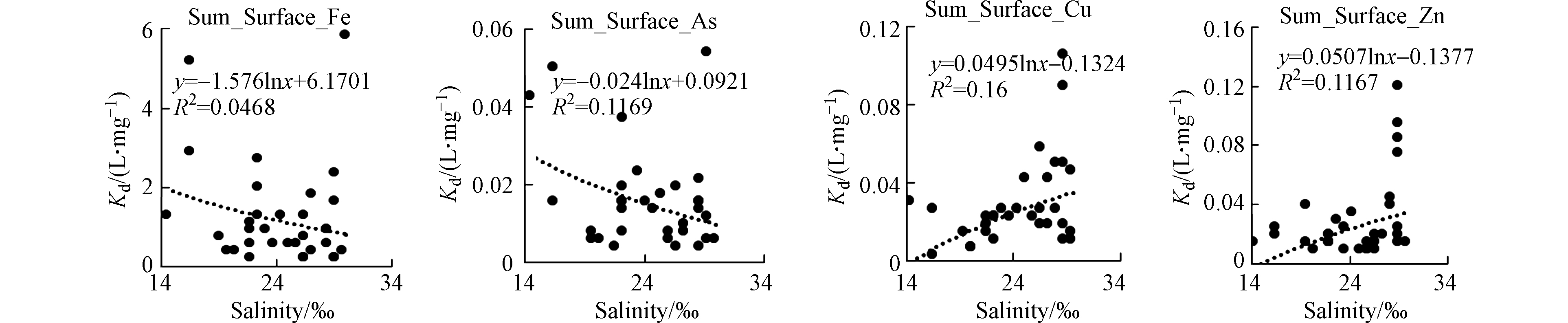
海水的悬浮颗粒物的浓度、盐度均会对金属在悬浮颗粒物上的吸附-解吸行为有重要的影响。夏季表层海水的铜、锌、铅和铬的分配系数具有显著的颗粒物浓度效应,即铜、锌、铅和铬的分配系数随着悬浮颗粒物浓度的增大而减小(图10),类似变化规律在其他河口的重金属研究中也有发现[24]。夏季表层海水铁、砷的分配系数随着盐度的增加而减小,铜、锌的分配系数随着盐度的增加而增加(图11),这种不同的变化趋势可能与不同金属的来源有关,在盐度较高的东部海域的养殖区存在铁、砷的高值区,进而影响了分配系数随盐度的变化。
-
(1) 黄河口邻近海域,DFe、DPb、DCu、DZn、DCd、DCr和DAs的浓度平均值分别为45.2、7.33、2.87、18.0、0.0979、3.24、1.65 µg·L−1,颗粒态金属PFe、PPb、PCu、PZn、PCd、PCr和PAs的浓度平均值分别为1018、6.76、2.38、10.0、0.0195、3.38、1.01 µg·L−1。夏季表底层、秋季表层各颗粒态重金属浓度变化趋势相似, 呈现出由河口高浓度向周围递减的趋势。溶解态重金属高浓度点主要出现在东营港、黄河入海口以及莱州湾内部。
(2)颗粒态重金属与悬浮颗粒物呈显著相关性(P<0.01),夏秋两季表层海水中颗粒态重金属浓度均与盐度呈显著负相关关系(r值均在-0.3到-0.6之间, P<0.01),但底层海水中的颗粒态重金属以及海水中溶解态重金属浓度与盐度相关关系较弱。说明悬浮颗粒物浓度的变化是影响海水中重金属变化的主要和重要原因,盐度、氨氮与叶绿素a的浓度也对颗粒态重金属浓度的变化起到一定的影响。
(3)溶解态重金属分布趋势没有颗粒态重金属明显,高浓度出现在河口、东营港附近以及莱州湾内部和北部,主要为人为输入,莱州湾养殖业以及拖网渔船的捕捞、排污,对重金属的输入也有一定的贡献。颗粒态重金属高浓度点出现在黄河入海口位置附近,表现为黄河输入。
(4) 各重金属的富集因子EF均呈现出随TSM浓度的增大而减小、随盐度的增大而增大的趋势,海水中PCu、PZn、PCd污染程度为中度污染。夏季分配系数均高于秋季,铜、锌、铅和铬的分配系数随着悬浮颗粒物浓度的增大而减小,铁、砷的分配系数随着盐度的增加而减小,铜、锌的分配系数随着盐度的增加而增加的趋势。这种不同的变化趋势与不同金属的来源有关,在盐度较高的东部海域的养殖区存在铁、砷的高值区,进而影响了分配系数随盐度的变化。
夏秋季黄河口邻近海域水体中重金属变化特征
Changes of heavy metals in the waters adjacent to the Yellow River estuary in summer and autumn
-
摘要: 2020年夏季和秋季观测了黄河口邻近海域海水中溶解态的重金属(DFe、DPb、DCu、DZn、DCd、DCr、DAs)和颗粒态金属(PFe、PPb、PCu、PZn、PCd、PCr和PAs),以探讨各重金属形态的空间和季节变化及其影响因素,研究重金属的分配系数及其来源差异。结果表明,黄河口邻近海域DFe、DPb、DCu、DZn、DCd、DCr和DAs的浓度平均值分别为45.2、7.33、2.87、18.0、0.0979、3.24、1.65 µg·L−1,溶解态重金属高浓度点主要出现在东营港、黄河入海口以及莱州湾内部。颗粒态金属PFe、PPb、PCu、PZn、PCd、PCr和PAs的浓度平均值分别为1018、6.76、2.38、10.0、0.0195、3.38、1.01 µg·L−1,浓度由河口附近高浓度向周围递减。颗粒态重金属与悬浮颗粒物呈显著正相关性,夏秋两季表层海水中颗粒态重金属浓度均与盐度呈负相关关系。各重金属的富集因子随悬浮颗粒物浓度的增大而减小、随盐度的增大而增大。各金属的分配系数夏季高于秋季。Cu、Zn、Pb和Cr的分配系数随着悬浮颗粒物浓度的增大而减小,Fe、As的分配系数随着盐度的增加而减小,Cu、Zn的分配系数随着盐度的增加而增加。Abstract: In summer and autumn of 2020, dissolved metals (DFe, DPb, DCu, DZn, DCd, DCr, DAs), and particulate metals (PFe, PPb, PCu, PZn, PCd, PCr, PAs) in seawater of the Yellow River estuary were determined to study the spatial and seasonal changes of heavy metals forms, and their influencing factors. The distribution coefficient and sources difference of heavy metals in two seasons were analyzed. The results showed that the average concentrations of DFe, DPb, DCu, DZn, DCd, DCr and DAs in the Yellow River estuary were 45.2, 7.33, 2.87, 18.0, 0.0979, 3.24, 1.65 µg·L−1 respectively. The high concentrations of dissolved heavy metals mainly appeared in Dongying Port, the Yellow River estuary and the interior of Laizhou Bay. The average concentrations of PFe, PPb, PCu, PZn, PCd, PCr and PAs were 018, 6.76, 2.38, 10.0, 0.0195, 3.38, 1.01 µg·L−1 respectively, and the concentration decreased from the high concentrations near the estuary to the surrounding sea areas. There was a significant positive correlation between particulate heavy metals and suspended particulate matter. The concentration of particulate heavy metals in surface seawater in summer and autumn had a significant negative correlation with salinity. The distribution coefficient (Kd) of each heavy metal in summer was higher than that in autumn. Kd of copper, zinc, lead, and chromium decreased with the increase of the concentration of suspended particulate matter. Kd of iron and arsenic decreased with the increase of salinity, and Kd of copper and zinc increased with the increase of salinity.
-
苯扎氯铵(benzalkonium chlorides, BACs)主要由3种正烷烃基(n-C12H25、n-C14H29和n-C16H33)取代二甲基苄基氯化铵组成的同系物混合物[1],因其具有较强的杀菌作用,常被作为洗涤剂、纺织物软化剂、界面转化活性剂、矿物浮选剂、杀菌剂以及个人护理品中的防护和抗静电成分[2]。由于杀菌剂生产及使用量的逐年递增,BACs被美国和加拿大列为高产量化学品[3]。BACs的大量生产和消耗,将不可避免地随着时空迁移进入环境中。近年来,BACs陆续在多种环境介质中被检出,如污水处理厂进水[4-5]、医院废水[6]、洗衣店出水[6](如表1所示)、天然水体[7-8]、污水厂污泥[9]、河口沉积物[10-11]以及土壤[12]中。其中,河水中BAC-12和BAC-14的含量分别达到2.7~5.8 μg·L−1和6.3~36.6 μg·L−1[7];地表水中BAC-12、BAC-14和BAC-16的总量达到(3.24±14)~(72.5±14)μg·L−1[8];RUAN等[9]在中国52个污水处理厂污泥中检测出BACs的含量为0.09~191 μg·g−1;LI等[10]在中国珠江口的沉积物中发现BACs的含量为49.3~1 050 ng·g−1;FERRER等[11]曾报道BAC同系物在美国的河水沉积物中的浓度为22~206 μg·kg−1。KANG等[12]在韩国土壤中检测到BACs的含量为0.001~8.5 mg·kg−1。
表 1 环境中BACs含量Table 1. Concentrations of BACs in the environmentμg·L−1 环境中BACs的存在对生物具有潜在的毒性风险。毒理学研究表明,BACs对哺乳动物和水生动物均有急性和慢性毒性。BACs对大鼠的半数致死量(LD50)为234~525 mg·kg−1[13-14]。MELIN等[15]发现,BACs能够干扰雌性小鼠的排卵系统和发情周期,并降低雄性小鼠的精子浓度和活动能力,从而降低小鼠的繁殖率。BACs对水生生物(如藻类、水蚤、轮虫和原生动物)均具有急性毒性,半数效应浓度(EC50)为21~2 940 μg·L−1[16-18]。在欧盟修订的(EC)No.1272/2008条例中,将BACs归类为“对水生生物毒性极大”的物质,并认为对与其共存污染物的迁移性和生物有效性具有显著影响[19]。
在水环境中发现的BACs主要来自城市污水处理厂[4]。季铵盐化合物的存在可能会引起活性污泥潜在的急性反应,影响污泥的微生物活性和生存能力,从而影响其去除污染物的能力[20-21]。迄今为止,有关BACs对活性污泥微生物活性影响的研究鲜有报道。本研究在序批式反应器(SBR)处理模拟废水的基础上,以BACs的主要成分十二烷基二甲基苄基氯化铵(dodecylbenzyldimethylammonium chloride, DDBAC)为研究对象,通过污泥的微生物活性指标、氧化还原酶活性以及DDBAC浓度变化的测定,探究在DDBAC暴露下活性污泥的急性反应及微生物活性变化,以期为评估BACs在污水处理厂中的行为及影响提供参考。
1. 材料和方法
1.1 接种污泥和进水水质
实验室所用的接种污泥取自某城市污水处理厂的回流污泥。母反应器SBR的工作体积为36 L,温度控制在(22±1)℃,污泥浓度(MLSS)控制在3 000~3 500 mg·L−1,每天包含2个周期的循环,每个周期运行方式为:进水阶段(15 min)、好氧曝气阶段(180 min)、缺氧搅拌阶段(300 min)、沉降阶段(90 min)、排水阶段(15 min)和闲置阶段(120 min)。好氧阶段使用曝气设备进行曝气,溶解氧控制在2 mg·L−1左右;搅拌阶段使用搅拌器进行搅拌,溶解氧控制在0.5 mg·L−1左右,使用1.0 mol·L−1 NaHCO3和1.0 mol·L−1HCl调节系统pH,使初始pH维持在7.0±0.2。运行3个月后,系统对氮的去除率达到99%左右,表明SBR运行状态稳定。
本研究采用模拟废水,水质特性为:化学需氧量(COD)为400 mg·L−1左右,氨氮(
NH+4 -N)为40 mg·L−1左右,溶解性磷(SOP)为5 mg·L−1左右。模拟废水主要由葡萄糖、NH4Cl、KH2PO4、MgSO4、CaCl2和微量元素组成,其中微量元素包括0.03 g·L−1CuSO4·5H2O、0.06 g·L−1 Na2MoO4·2H2O、0.12 g·L−1 ZnSO4·7H2O、0.12 g·L−1 MnCl2·4H2O、0.15 g·L−1H3BO3、0.15 g·L−1 CoCl2·6H2O、0.18 g·L−1 KI、1.5 g·L−1 FeCl3·6H2O、10 g·L−1EDTA。微量元素投加量为0.5 mL·L−1。1.2 实验方法
在进行DDBAC在SBR系统中的短期暴露实验时,从稳定运行的母反应器里取出适量污泥混合均匀,平均分配在7个完全相同的SBR子反应器中,每个反应器有效容积为3 L,7个反应器运行方式和母反应器相同。污泥浓度(MLSS)控制在3 000~3 500 mg·L−1,污泥负荷(以COD计)大约为0.3 kg·(kg·d)−1(以MLSS计),污泥停留时间(SRT)大约为15 d,水力停留时间(HRT)为20 h。反应器中DDBAC浓度分别为0、0.1、1、2、5、10和20 mg·L−1,运行一个周期后,取上清液测定DDBAC在水相中的残余量,取底泥进行TCC-脱氢酶活性、CAT活性的测定,然后弃去上清液,重新换入模拟废水,然后进行污泥耗氧速率OUR的测定。
在进行DDBAC对硝化过程的影响实验时,取母反应器活性污泥静置倒掉上清液,用自来水重复清洗3遍,再用不含C、N、P的配水清洗3遍,以充分去除原水样中C、N、P的含量。污泥浓度控制在3 000~3 500 mg·L−1,平行操作2组实验,实验期间需要曝气,曝气量控制在2 mg·L−1。温度调整至(20±1)℃,通过1.0 mol·L−1NaHCO3和1.0 mol·L−1HCl,调节pH至7.0±0.2。起始基质(
NH+4 -N和NO−2 -N)浓度均为30 mg·L−1,其中DDBAC投加浓度与SBR子反应器中一致,每隔10 min取样分析NH+4 -N和NO−2 -N浓度变化,直到出水各指标稳定,实验结束。1.3 分析方法
本研究中的常规项目如混合液悬浮固体浓度(MLSS)、
NH+4 -N、NO−2 -N、NO−3 -N指标参照文献中的方法[22]测定,溶解氧采用便携式溶氧仪监测。污泥耗氧速率(OUR)采用有氧厌氧呼吸仪(美国RSA公司)测定。比氨氧化率(SAOR)、亚硝酸盐氧化率(SNOR)和硝酸盐还原率(SNRR)的测定方法参照文献中的方法[23]。
TCC-脱氢酶采用常温萃取法[22-24]测定,过氧化氢酶(CAT)活性采用紫外分光光度法[25]测定。
低于0.2 mg·L−1的DDBAC浓度采用Agilent 1260 Infinity液相色谱/6410三重四极杆液质联用系统测定,色谱柱为ZORBAX RRHD Eclipse Plus C18 2.1 mm×50 mm, 1.8 μm,流动相为2种溶液的混合液,溶液A为20 mmol·L−1乙酸铵水溶液(含0.2%甲酸),溶液B为甲醇和乙腈的混合液(甲醇∶乙腈=3∶7),流动相为A∶B=20∶80(体积比),流速为0.3 mL·min−1,温度为25 ℃,进样体积为2 μL,雾化气压力为310 kPa,干燥器温度为350 ℃,干燥器流速为10 L·min−1,采用正离子扫描方式,根据峰面积计算出其含量。高于0.2 mg·L−1的DDBAC浓度采用改进的二硫蓝离子对提取方法[26]进行测定。
2. 结果与讨论
2.1 DDBAC浓度变化对污泥OUR的影响
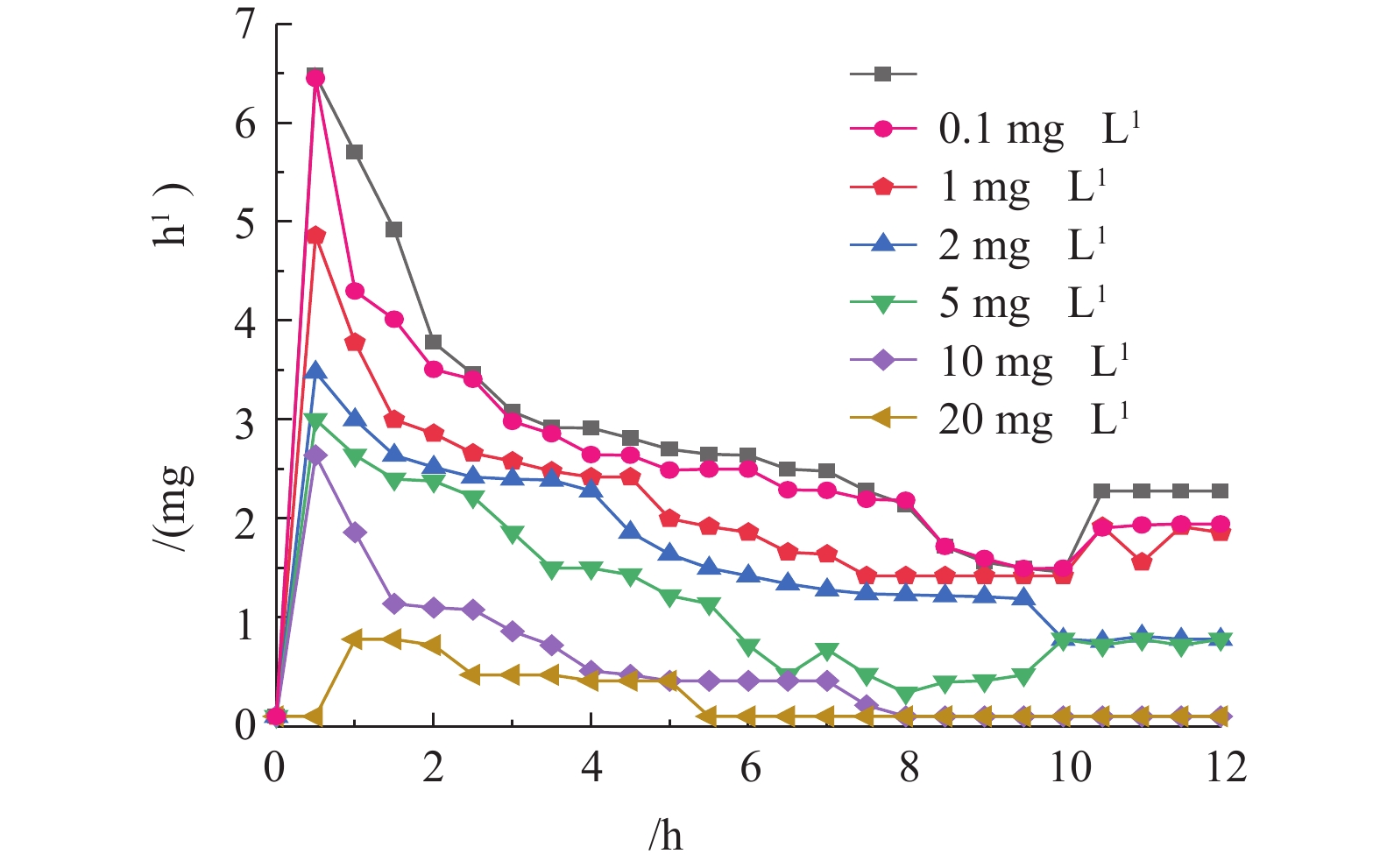
OUR是指活性污泥在单位时间内所利用氧的量,是评价污泥微生物代谢活性的一个重要指标。根据不同系统运行12 h后测定相同体积活性污泥OUR的变化,可以判断不同浓度DDBAC暴露下污泥性质的变化,结果如图1所示。前1 h,OUR呈明显的上升趋势,不含DDBAC的系统中污泥OUR最高达6.48 mg·h−1。随着DDBAC浓度的增加,最高OUR呈下降趋势。在1 mg·L−1 DDBAC的系统中,OUR最大为4.86 mg·h−1。当DDBAC浓度达到20 mg·h−1时,污泥OUR上升缓慢,1 h时最高OUR为0.78 mg·h−1;1 h后,7组反应器中污泥的OUR均逐渐降低,且DDBAC浓度越高,OUR的降低趋势越明显。当DDBAC浓度达到20 mg·L−1时,经过5.5 h后,污泥的呼吸速率降为0。结果表明,随着DDBAC浓度的增加,活性污泥中呼吸酶活性越低,氧的吸收和利用率越低。DDBAC作为有机抗菌剂,与细胞膜具有较好的相容性,可损伤细胞膜,造成细胞裂解;或与细胞膜融合,损坏细胞中的酶、蛋白质,使氧化磷酸化过程和电子传递系统受到影响,导致呼吸作用受到抑制。ZHANG等[27]和CROSS等[28]亦认为呼吸酶活性的下降是由DDBAC引起细胞裂解所致。
2.2 DDBAC对硝化过程的影响
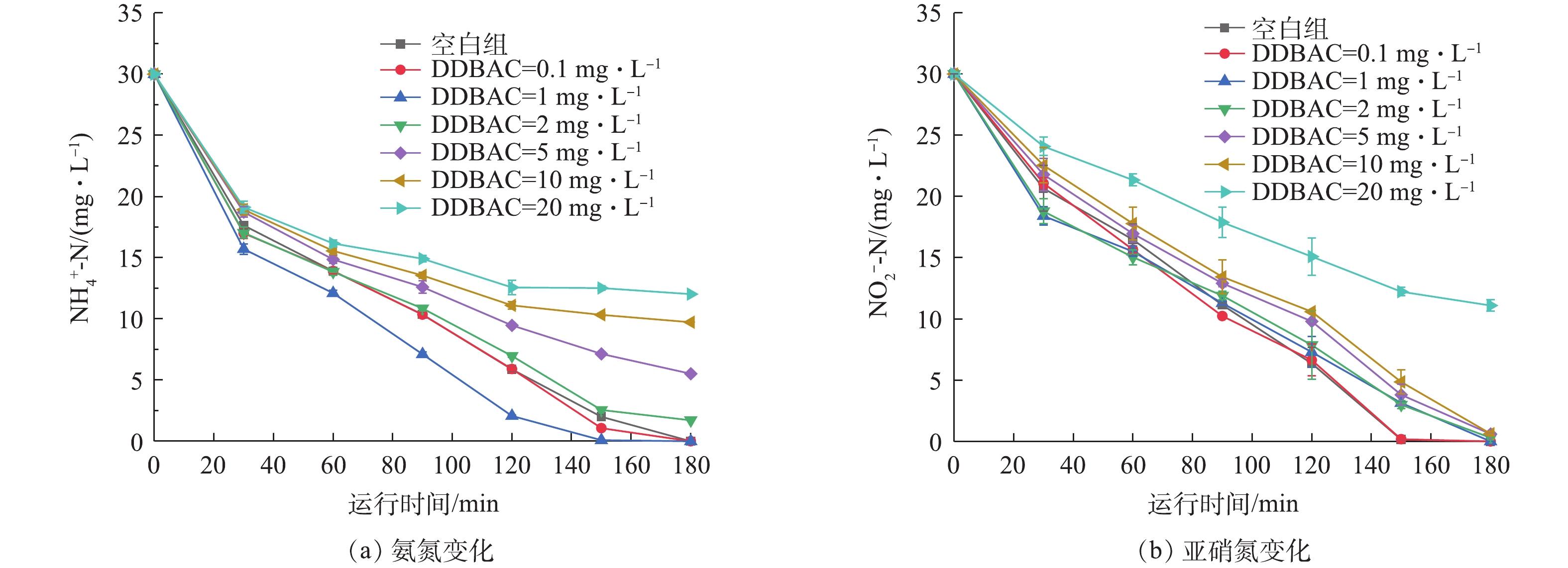
DDBAC对硝化反应中的氨氮的降解过程影响如图2(a)所示,对亚硝氮的降解过程影响如图2(b)所示。从图2(a)中可以看出,当DDBAC浓度为0.1 mg·L−1和1.0 mg·L−1时,氨氮的转化速率大于空白对照组,即DDBAC的存在能够促进氨氮的氧化过程。当DDBAC浓度为2、5、10和20 mg·L−1时,氨氮的氧化速率随着DDBAC浓度的升高而逐渐下降,氨氮去除率分别为94.28%、81.61%、67.59%和59.92%。这表明,DDBAC的过量存在(≥2.0 mg·L−1)抑制了氨氧化菌的活性,影响好氧条件下氨氮的转化过程,且浓度越高,抑制效果越明显。此结果与SÜTTERLIN等[29]研究结果一致。从图2(b)中可以看出,低浓度DDBAC对亚硝酸盐氧化菌几乎无影响,20 mg·L−1的DDBAC短期暴露在系统中,使得亚硝氮降解率从100%降到(62.98±0.02)%,亚硝酸盐氧化菌受到一定抑制。此现象可能与微生物群落中氨氧化菌AOB与亚硝酸盐氧化菌NOB的相对丰度有关。与亚硝酸盐氧化菌相比,氨氧化菌的产率低、比增长速率小,更容易受到外界环境的影响[30]。
2.3 DDBAC对污泥SAOR、SNOR、SNNR的影响
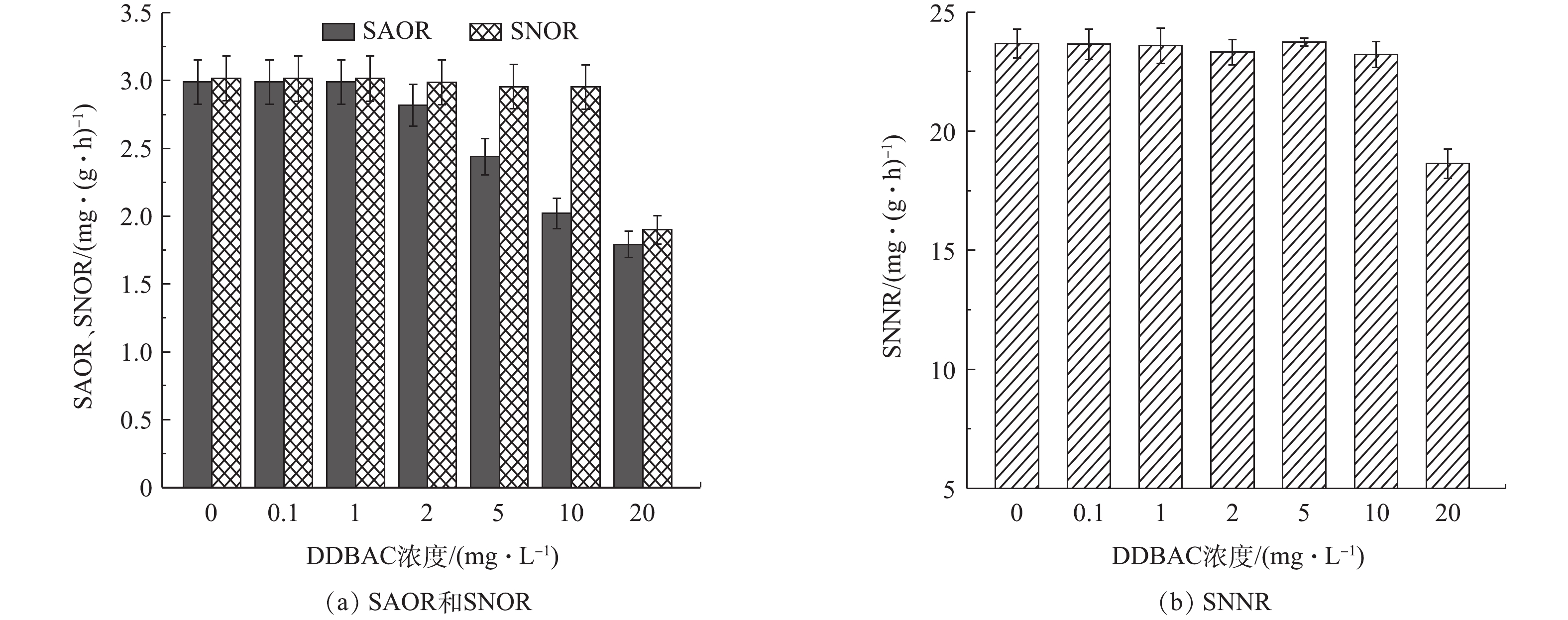
图3展示了不同浓度DDBAC对系统内SAOR、SNOR和SNNR的影响。当DDBAC浓度为0.1 mg·L−1和1.0 mg·L−1时,对系统内SAOR、SNOR和SNNR基本无影响。当DDBAC浓度为2 mg·L−1时,SAOR(以
NH+4 -N计)由(2.99±0.16) mg·(g·h)−1(以MLSS计)降至(2.82±0.15) mg·(g·h)−1,降低了5.72%;当DDBAC浓度为20 mg·L−1时,SAOR降至(1.79±0.09) mg·(g·h)−1,降低40.08%。DDBAC对SNOR的影响较小,当DDBAC浓度≤10 mg·L−1时,SNOR基本不受影响;当DDBAC浓度达到20 mg·L−1时,系统内SNOR受到较大影响,与对照组相比,下降了37.02%。当进水DDBAC浓度高于2 mg·L−1时,SAOR低于SNOR,此现象表明,氨氧化过程更易受到DDBAC的影响,与2.2节中的研究结果相呼应。由图3(b)可看出,当DDBAC浓度达到20 mg·L−1时,SNNR(以NO−3 -N计)由(23.69±0.61) mg·(g·h)−1(以MLSS计)降到(18.64±0.62) mg·(g·h)−1,下降了(21.32±0.59)%。此研究结果表明,与硝酸盐还原过程相比,DDBAC对硝化过程,尤其是氨氧化菌主导的氨氧化过程的抑制作用更加显著。这是由于与异养型微生物相比,主导硝化过程的硝化细菌世代时间长,增长速率低,一般只占活性污泥微生物总量的5%左右,对环境条件要求较为苛刻。因此,DDBAC对硝化过程的抑制性更强。2.4 DDBAC对氧化还原酶活性的影响
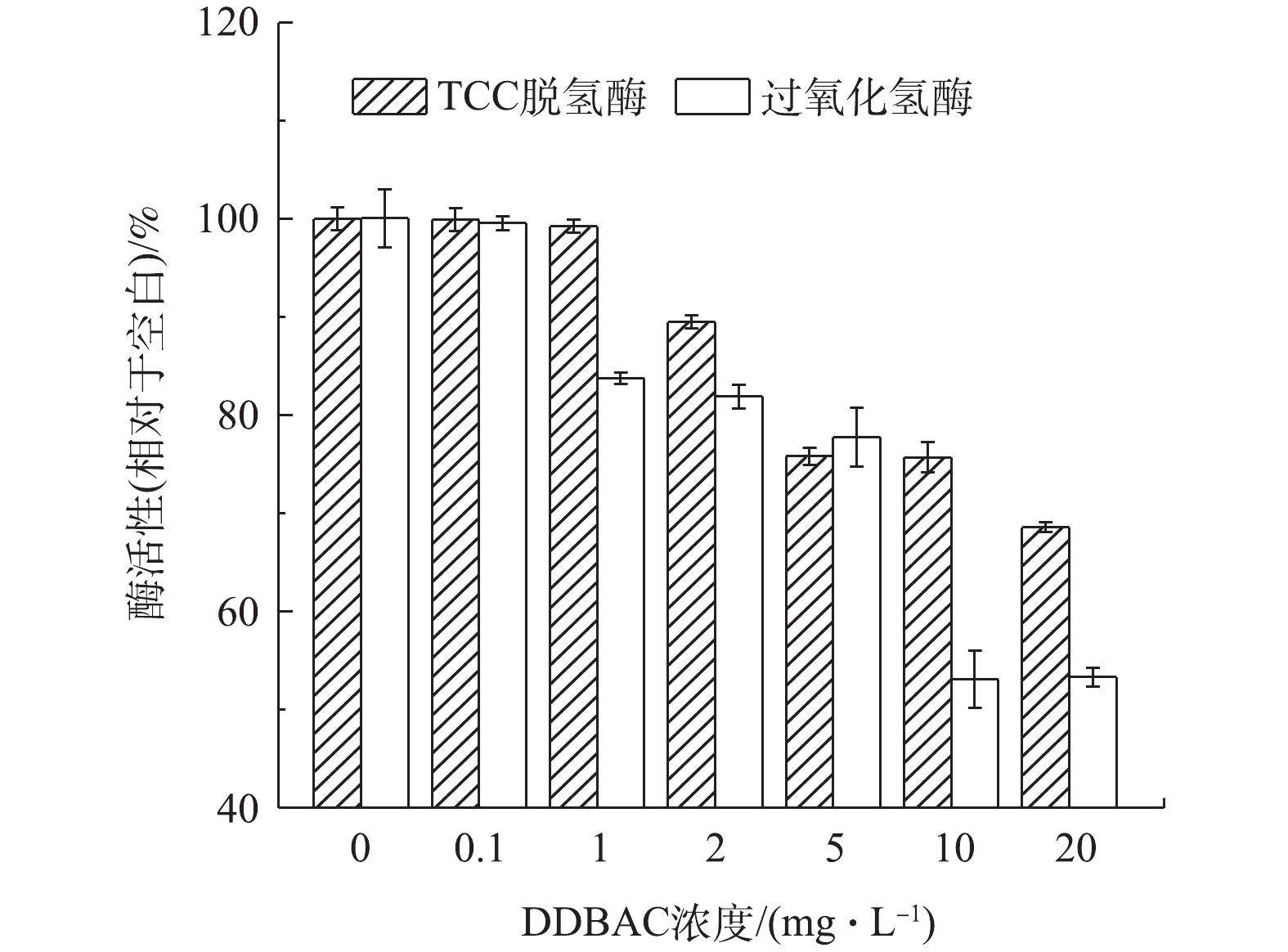
在有机化合物的好氧生物降解过程中,TCA循环是主要的代谢过程[31]。TCC-脱氢酶参与了TCA循环,能较好地反映微生物异养代谢行为。因此,在本研究中,脱氢酶活性可以作为有机化合物生物降解能力的指标之一,来评价DDBAC造成的急性效应[32]。TCC-脱氢酶活性的抑制率5%~25%属轻度抑制,25%~60%属中度抑制,大于60%属重度抑制[33-34]。DDBAC对污泥样品中TCC-脱氢酶活性的影响如图4所示。当DDBAC浓度低于2 mg·L−1时,DDBAC对TCC-脱氢酶活性的影响几乎可以忽略不计。当DDBAC浓度为2、5和10 mg·L−1时,TCC-脱氢酶活性与空白组对比,分别降低了(10.50±1.70)%、(24.20±0.01)%和(24.31±0.68)%。此时为轻度抑制;当DDBAC浓度增加到20 mg·L−1时,抑制率增加到(31.42±0.29)%,为中度抑制。根据以往的研究,季铵盐类化合物在活性污泥中的行为一般为3个过程:吸附、抑制和生物转化[35]。也有报道[26]认为,95%的季铵盐都会吸附于颗粒物,季铵盐浓度越高,对微生物的吸附量越大,对活性污泥活性的抑制作用越强。脱氢是微生物氧化分解有机物过程中的关键步骤,TCC-脱氢酶活性降低,降低了微生物对有机物的氧化分解速率,也反映了DDBAC对微生物种群的毒害作用。
CAT是生物呼吸和代谢过程中的末端还原酶,它能将对细胞有毒害作用的H2O2分解为水和氧气[36]。图4显示了DDBAC对TCCC-脱氢酶活性、过氧化氢酶活性的影响。当DDBAC浓度为1.0 mg·L−1和2.0 mg·L−1时,对CAT的影响几乎相同,抑制率在18%左右;DDBAC浓度达到5 mg·L−1时,抑制率为22.4%;DDBAC浓度为10 mg·L−1和20 mg·L−1时,抑制率均为47%左右。此研究结果表明,含DDBAC废水的输入对污泥中的微生物的呼吸和代谢过程产生了负面影响,破坏了污泥的抗氧化机制。腾跃等[37]曾观察过苯扎溴铵与过氧化氢酶之间的微观作用机理,发现苯扎溴铵能够通过改变部分的氨基酸残基和蛋白质的二级结构,使过氧化氢酶的骨架结构变松散,进而抑制了过氧化氢酶的活性。
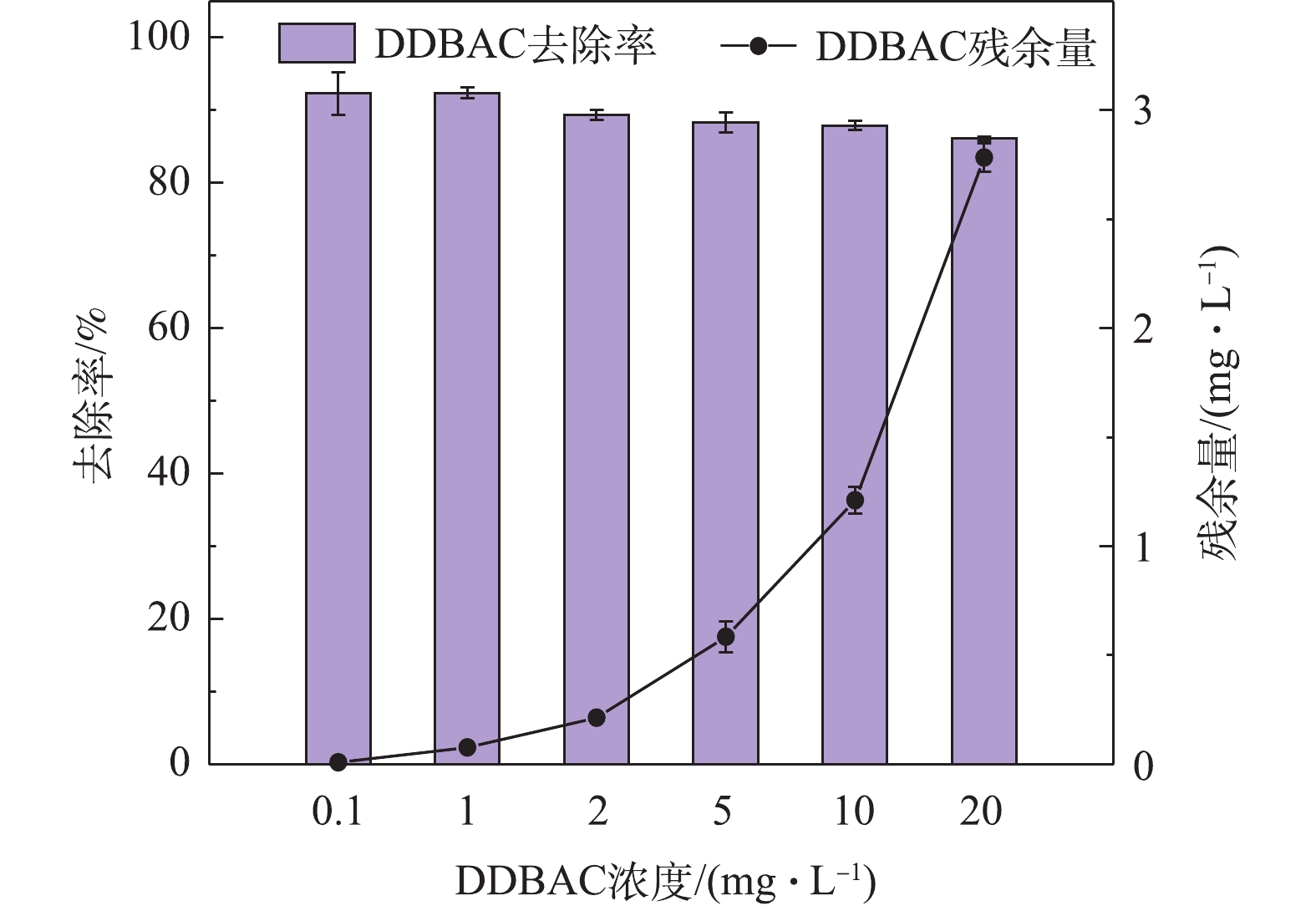
2.5 微生物对DDBAC的去除潜力
图5展示了微生物对不同浓度DDBAC的去除情况。当DDBAC的进水浓度为0.1 mg·L−1时,系统对DDBAC的去除率达到(92.30±2.97)%;当DDBAC初始浓度≥1 mg·L−1时,活性污泥微生物对DDBAC的去除潜力随着其浓度的增加而逐渐减弱,去除率由92.3%(初始浓度1 mg·L−1)降至(86.09±0.32)%(初始浓度20 mg·L−1),出水中的DDBAC浓度由(0.008±0.003)mg·L−1增加到(2.78±0.06)mg·L−1。造成此结果可能的原因是,活性污泥处理系统具有一定的容纳、消化和去除DDBAC的潜力,但是能力尚有限,当DDBAC浓度逐渐增大时,系统中的微生物不能够在有限的处理时间内将DDBAC完全去除,因此导致了出水中DDBAC的残留。当DDBAC浓度较大时,水相中残留的DDBAC将随着出水排至流域水环境中,造成河流、湖泊等地表水以及沉积物中DDBAC的积累,且DDBAC具有生物毒性,将增加水环境健康管理负担和安全用水的风险。
3. 结论
1) DDBAC能够影响污泥的耗氧率,对污泥的呼吸产生抑制作用,且其浓度越高,抑制作用越强。
2)相对于反硝化过程,DDBAC对硝化过程,尤其是氨氧化菌主导的氨氧化过程的抑制作用更加显著。当DDBAC浓度≥2.0 mg·L−1时,即能够抑制氨氮的转化过程,且浓度越高,抑制效果越明显。
3)当2 mg·L−1≤DDBAC≤10 mg·L−1时,DDBAC对脱氢酶活性为轻度抑制;DDBAC浓度为20 mg·L−1时,对脱氢酶活性为中度抑制,严重影响污泥代谢过程。
4) DDBAC对过氧化氢酶活性的抑制作用随其浓度的升高而加强,可影响微生物的呼吸和代谢过程,破坏污泥的抗氧化机制。
5)活性污泥微生物对DDBAC具有一定的去除潜力,但处理能力尚有限,出水中残留的DDBAC将增加水环境健康管理负担,提高安全用水的风险。
-
表 1 黄河口海水中各理化参数汇总
Table 1. Spatial variations of physicochemical parameters in the seawater of the Yellow River Estuary.
T/℃ pH 盐度/‰Salinity TSM/(mg·L−1) COD/(mg·L−1) DO/(mg·L−1) chl a/(µg·L−1) 夏季 表层 范围 23.9—29.6 7.82—8.07 15.0—30.2 6.5—1868 0.90—2.61 4.60—7.96 0.55—5.39 平均值±标准差 26.7 ±1.4 8±0.12 25.1±4.2 93.3±306.8 1.79±0.34 5.99±0.786 2.57±1.21 底层 范围 22.7—29.1 7.80—8.29 19.0—31.9 14.8—1868 1.14—2.61 3.02—7.96 0.51—5.39 平均值±标准差 25.7±1.8 8.00±0.14 27.8±3.4 118±343 1.70±0.35 4.95±1.38 2.74±1.32 秋季 表层 范围 17.4—19.9 8.03—8.38 18.9—28.1 17.7—850 0.67—3.36 5.04—9.52 1.76—8.16 平均值±标准差 18.9±0.62 8.17±0.07 24.9±1. 8 73.8±171.8 1.68±0.61 7.54±0.805 3.88±1.45 表 2 黄河口及世界其它海域Fe、Cu、Zn、Cd、Cr、As的含量
Table 2. The concentrations of Fe、Cu、Zn、Cd、Cr、As in waters from Yellow River Estuary and various world regions
海区 Region Fe/(µg·L−1) Pb/(µg·L−1) Cu /(µg·L−1) Zn/(µg·L−1) Cd/(µg·L−1) Cr/(µg·L−1) As/(µg·L−1) 黄河口溶解态 12.1—188(42.4) 1.05—21.6(7.29) 1.41—21.6(4.40) 10.5—96.0(21.8) 0.0333—0.177(0.0907) 2.54—6.71(3.27) 0.426—3.72(2.03) 黄河口 — 0.42—13.3(5.61) 0.04—31.0(11.6) 1.97—42.2(14.9) 0.10—1.90(0.66) — 0.16—5.89(2.59) 长江口 — 2.28—2.43(2.36) 2.89—3.66(3.30) — 0.08—0.09(0.08) — — 珠江口 — 0.19—4.58(1.61) 0.34—3.26(1.64) 13.54 0.0015—0.30(0.12) — 0.16—8.18(2.55) 山东半岛东部海域 — 0.52—3.60(1.51) 0.83—5.38(2.46) 2.22—40.7(17.20) 0.08—0.73(0.17) 0.84—3.56(2.01) ND—1.86(0.98) 辽东湾北部 — 0.60—17.20(3.98) 0.70—6.20(2.86) 1.20—82.80(17.76) 0.10—1.40(0.66) — 1.92—10.10(5.46) 印度东南沿海 79.60±21.57 0.36±0.06 5.19±2.00 9.31±1.33 0.11±0.05 0.31±0.57 — 表 3 黄河口海水中各重金属浓度汇总
Table 3. Statistics of heavy metals concentrate in the seawater of the Yellow River Estuary.
Fe/(µg·L−1) Pb/(µg·L−1) Cu/(µg·L−1) Zn/(µg·L−1) Cd/(µg·L−1) Cr/(µg·L−1) As/(µg·L−1) 夏季 表层 溶解态 范围 12.9—154 1.05—26.5 1.41—6.83 10.5—45.9 0.03—0.18 2.54—4.71 0.43—2.65 平均值+标准差 45.2±35.0 7.33±5.33 2.87±1.23 18.0±8.37 0.10±0.04 3.24±0.35 1.65±0.54 颗粒态 范围 167—9832 0.58—21.6 0.43—10.6 4.2—29.7 0.004—0.107 0.66—17.3 0.12—6.13 平均值+标准差 1018±1781 6.76±6.15 2.38±2.49 10.0±6.38 0.020±0.025 3.38±4.30 1.01±1.48 底层 溶解态 范围 15.0—188 0.88—19.2 1.68—20.2 11.0—78.1 0.06—0.14 2.91—6.71 1.20—2.46 平均值+标准差 50.8±44.8 5.77±4.38 4.52±4.49 19.9±15.7 0.09±0.03 3.67±0.85 1.87±0.345 颗粒态 范围 129—11323 0.58—17.9 0.57—11.4 5.321—40.1 0.004—0.120 0.61—17.3 0.11—6.68 平均值+标准差 2071±3136 6.13±4.61 2.20±2.99 11.0±9.3 0.02±0.031 3.38±4.73 1.15±1.77 秋季 表层 溶解态 范围 12.1—178.6 0.52—22.8 1.69—50.0 10.5—96.0 0.04—0.12 2.63—3.67 1.25—3.72 平均值+标准差 34.7±27.4 8.85±6.25 8.28±9.52 27.4±19.0 0.08±0.02 2.91±0.18 2.59±0.53 颗粒态 范围 47.0—5988 0.39—7.47 0.39—6.95 4.6—32.0 0.004—0.06 1.00—11.1 0.05—3.07 平均值+标准差 853±1148 1.76±1.43 1.19±0.96 9.8±4.4 0.0117±0.008 2.34±1.85 0.48±0.59 表 4 夏、秋季黄河口邻近海域PFe、PPb、PCu、PZn、PCd、PCr、PAs与环境因子的相关性分析
Table 4. The correlations between PFe, PPb, PCu, PZn, PCd, PCr, PAs and environmental factors of the Yellow River Estuary in summer and autumn
PFe PPb PCu PZn PCd PCr PAs 夏季 TSM 0.64 0.66 0.67 0.63 0.68 0.65 0.68 盐度 −0.54 −0.57 −0.55 −0.60 −0.54 −0.53 −0.53 秋季 TSM 1.00 0.98 0.98 0.62 0.99 1.00 1.00 盐度 −0.55 −0.45 −0.44 −0.31 −0.48 −0.54 −0.58 氨氮 0.50 0.38 0.61 0.41 0.45 0.51 0.48 叶绿素 0.87 0.83 0.88 0.60 0.86 0.86 0.87 表 5 黄河口海水中各重金属平均分配系数
Table 5. Coefficient of average distribution of heavy metals in the seawater of the Yellow River Estuary
Fe Pb Cu Zn Cd Cr As 夏季表层 0.882 0.047 0.027 0.025 0.006 0.024 0.015 夏季底层 1.472 0.039 0.020 0.022 0.005 0.025 0.012 秋季表层 0.403 0.015 0.007 0.013 0.002 0.017 0.002 -
[1] POURABADEHEI M, MULLIGAN C N. Effect of the resuspension technique on distribution of the heavy metals in sediment and suspended particulate matter [J]. Chemosphere, 2016, 153: 58-67. [2] WANG L, LONG X X, CHONG Y X, et al. Potential risk assessment of heavy metals in sediments during the denitrification process enhanced by calcium nitrate addition: Effect of AVS residual [J]. Ecological Engineering, 2016, 87: 333-339. [3] KIM J J, KIM Y S, KUMAR V. Heavy metal toxicity: An update of chelating therapeutic strategies [J]. Journal of Trace Elements in Medicine and Biology, 2019, 54: 226-231. [4] LAO Q B, SU Q Z, LIU G Q, et al. Spatial distribution of and historical changes in heavy metals in the surface seawater and sediments of the Beibu Gulf, China [J]. Marine Pollution Bulletin, 2019, 146: 427-434. [5] VARDHAN K H, KUMAR P S, PANDA R C. A review on heavy metal pollution, toxicity and remedial measures: Current trends and future perspectives [J]. Journal of Molecular Liquids, 2019, 290: 111197. [6] State Oceanic Administration of China. China Marine Environment Quality Bulletin [R]. 2011. [7] State Oceanic Administration of China. China Marine Environment Quality Bulletin [R]. 2013. [8] YU L S. The Huanghe (Yellow) River: A review of its development, characteristics, and future management issues [J]. Continental Shelf Research, 2002, 22(3): 389-403. [9] NIE M, XIAN N X, FU X H, et al. The interactive effects of petroleum-hydrocarbon spillage and plant rhizosphere on concentrations and distribution of heavy metals in sediments in the Yellow River Delta, China [J]. Journal of Hazardous Materials, 2010, 174(1/2/3): 156-161. [10] LIU C, et al. All around the Bohai Gulf Estuary potential ecological risk assessment [J]. Environ Sci Res, 2002, 121: 33-37. [11] WANG X Y, ZHAO L L, XU H Z, et al. Spatial and seasonal characteristics of dissolved heavy metals in the surface seawater of the Yellow River Estuary, China [J]. Marine Pollution Bulletin, 2018, 137: 465-473. [12] WANG Y, LING M, LIU R, et al. Distribution and source identification of trace metals in the sediment of Yellow River Estuary and the adjacent Laizhou Bay [J]. Physics and Chemistry of the Earth, 2017, 97: 62-70. [13] KUMAR S B, PADHI R K, MOHANTY A K, et al. Distribution and ecological- and health-risk assessment of heavy metals in the seawater of the southeast coast of India [J]. Marine Pollution Bulletin, 2020, 161: 111712. [14] AN Q, WU Y Q, WANG J H, et al. Assessment of dissolved heavy metal in the Yangtze River Estuary and its adjacent sea, China [J]. Environmental Monitoring and Assessment, 2010, 164(1/2/3/4): 173-187. [15] LIU R, JIANG W W, LI F J, et al. Occurrence, partition, and risk of seven heavy metals in sediments, seawater, and organisms from the eastern sea area of Shandong Peninsula, Yellow Sea, China [J]. Journal of Environmental Management, 2021, 279: 111771. [16] ZHANG D W, ZHANG X, TIAN L, et al. Seasonal and spatial dynamics of trace elements in water and sediment from Pearl River Estuary, South China [J]. Environmental Earth Sciences, 2013, 68(4): 1053-1063. [17] ZHANG A G, WANG L L, ZHAO S L, et al. Heavy metals in seawater and sediments from the northern Liaodong Bay of China: Levels, distribution and potential risks [J]. Regional Studies in Marine Science, 2017, 11: 32-42. [18] 刘汝海, 吴晓燕, 秦洁, 等. 黄河口河海混合过程水中重金属的变化特征 [J]. 中国海洋大学学报(自然科学版), 2008, 38(1): 157-162. doi: 10.16441/j.cnki.hdxb.2008.01.028 LIU R H, WU X Y, QIN J, et al. The variation characters of heavy metal content in Huanghe Estuary water [J]. Periodical of Ocean University of China, 2008, 38(1): 157-162(in Chinese). doi: 10.16441/j.cnki.hdxb.2008.01.028
[19] BURGOS-NÚÑEZ S, NAVARRO-FRÓMETA A, MARRUGO-NEGRETE J, et al. Polycyclic aromatic hydrocarbons and heavy metals in the Cispata Bay, Colombia: A marine tropical ecosystem [J]. Marine Pollution Bulletin, 2017, 120(1/2): 379-386. [20] HAYNES D, JOHNSON J E. Organochlorine, heavy metal and polyaromatic hydrocarbon pollutant concentrations in the great barrier reef (Australia) environment: A review [J]. Marine Pollution Bulletin, 2000, 41(7/8/9/10/11/12): 267-278. [21] NACKE H, GONÇALVES A C Jr, SCHWANTES D, et al. Availability of heavy metals (Cd, Pb, And Cr) in agriculture from commercial fertilizers [J]. Archives of Environmental Contamination and Toxicology, 2013, 64(4): 537-544. [22] WANG Z L, LIU C Q. Distribution and partition behavior of heavy metals between dissolved and acid-soluble fractions along a salinity gradient in the Changjiang Estuary, Eastern China [J]. Chemical Geology, 2003, 202(3/4): 383-396. [23] KOSHIKAWA M K, TAKAMATSU T, TAKADA J, et al. Distributions of dissolved and particulate elements in the Yangtze Estuary in 1997-2002: Background data before the closure of the Three Gorges Dam [J]. Estuarine, Coastal and Shelf Science, 2007, 71(1/2): 26-36. [24] BENOIT G, OKTAY-MARSHALL S D, CANTU A II, et al. Partitioning of Cu, Pb, Ag, Zn, Fe, Al, and Mn between filter-retained particles, colloids, and solution in six Texas estuaries [J]. Marine Chemistry, 1994, 45(4): 307-336. -




 DownLoad:
DownLoad: