-
作为一种具有神经毒性的污染物,汞可以在生物体内累积并产生毒性,且能够长距离迁移[1],因此备受人们关注。研究估算,全球每年约有2000–3000 Mg汞由人为源释放到环境中[2-3],造成汞污染问题。1956年发生在日本的水俣病事件,引发了全球对汞毒性及其生态健康风险的高度重视。随后,人们采取一系列措施限制和减少汞的人为使用和排放。但是,全球汞污染问题仍将长期存在。即使在鲜少受人为活动影响的偏远地区,生物体内仍检测到较高浓度的甲基汞[4]。
在诸多汞污染事件中,汞矿区的汞污染问题尤为突出。贵州万山汞矿是我国最大的汞矿区,其已于2001年政策性关闭。但采矿活动遗留的矿渣等污染物对生态环境造成持续性的影响[5]。已有多篇文献报道,万山汞矿区的植物存在明显的汞积累现象,多种植物组织中汞含量可达到33 mg·kg−1[6-9]。以往研究指出,植物既可以通过根系吸收土壤中的汞,又可以通过叶片累积大气汞[10]。大气汞通过干湿沉降被植物叶片截留在林冠层,使得植物叶片成为大气汞的重要受体[11-12]。大气汞被植物叶片固定后,可通过植物凋落物进入土壤,在大气汞沉降中起到重要作用[3, 13-14]。云南哀牢山、贵州雷公山和重庆铁山坪凋落物的汞沉降通量分别为1.32、0.120、0.291 mg·m−2·a−1[15-16]。作为生态系统中的初级生产者,植物体内累积的汞还可通过食物链进入到其他生物和人体。
因此,研究废弃汞矿区周围不同类型植物和不同植物组织中汞的蓄积能力和分布特征将有助于了解当地汞污染现状、迁移规律和生态风险。本研究对贵州万山废弃汞矿区采集的土壤和植物样品中汞的赋存特征进行研究,探究了不同种类植物对汞的累积能力,并比较了汞在不同植物组织中的分布特征.
-
贵州省铜仁市万山汞矿区属于亚热带季风性湿润气候,该区为喀斯特地形地貌,以山地为主,地势呈西北高东南低,土壤类型包括黄壤、红壤和石灰土等。本研究选择万山汞矿区的两个采样点开展研究,分别为采样点A(东经:109°11'38'',北纬:27°33'59'',海拔:460 m)和采样点B(东经:109°12'17'',北纬:27°36'42'',海拔:840 m),其中采样点A为废弃汞冶炼作坊附近,采样点B为废弃汞矿。另外,选取远离汞矿区的贵阳市高坡村作为对照采样点C(东经:106°36'21'',北纬:26°39'33'',海拔:1278 m)。本研究各采样点的采样范围为直径100 m,采样点位置如图1所示。
-
本研究于采样点A、B和C采集植物和土壤样品,其中植物样品分别于2017年5月和2018年10月两次采集,土壤样品仅在2017年5月采集。土壤样品采集使用工兵铲取表层土壤(0–5 cm);植物样品采集时,尽量采集采样范围内所有种类植物,但由于采样时间和地域差异,植物种类存在差异。木本植物等较大植株只取叶片部分,小型草本植物采集整株。土壤和植物样品采集后用自封袋盛装,置于冷藏采样箱运输到实验室。土壤样品冷冻干燥后研磨粉碎,过筛(80目)后保存。植物样品先用自来水冲洗以去除尘土和泥沙,再用去离子水冲洗3次,将整株采集的草本植物分为茎叶部分(不含花和果实)和根部,分别冷冻干燥后研磨粉碎。本研究共采集土壤样品17个,植物种类77种,植物茎叶部分和根部样品共计185个。其中,2017年5月采集植物样品84个,2018年10月采集植物样品101个。不同采样点采集的植物样品的详细信息见表1。
-
称取约10–50 mg土壤和植物样品,采用DMA 80直接测汞仪(Milestone,意大利)对样品中的总汞(THg)进行测定。仪器检出限为0.0003 ng,标准曲线线性良好(0–1000 ng:R2 ≥ 0.9997)。柑橘叶标准参考物质GBW10020(GSB-11)和水系沉积物标准参考物质GBW07307a(GSD-7a)的回收率为93%–118%。针对THg浓度较高的土壤样品,采用干稀释法进行测定,每个样品重复测定3次。植物样品测定过程中,每隔15个样品,对同一个样品进行多次测量。同一样品重复测定结果的相对标准差为1.6%–11%。不同样品测定之间无汞残留。
-
本研究采用SPSS Statistics 26和Origin 2018对土壤和植物样品的THg浓度数据进行统计分析。双样本T检验、成对T检验和ANOVA方差分析分别用于两组独立样本、两组成对样本和三组及以上独立样本的均值差异性检验,采用Spearsman秩相关系数法和Kendall秩相关系数法对植物茎叶部分和根部THg浓度进行相关性分析。
-
万山汞矿区采样点和对照采样点土壤样品THg含量见表2。
贵阳市对照点采集土壤THg浓度(0.14–0.26 mg·kg−1)与文献报道的贵阳市土壤THg背景值(0.20 mg·kg−1)[17]一致。万山汞矿区采集的土壤样品THg浓度(采样点A:1.8–21 mg·kg−1,采样点B:7.9–224 mg·kg−1)比对照点土壤THg浓度高出1–3个数量级。本研究中万山的废弃汞矿和汞冶炼作坊土壤中THg浓度与以往文献报道的万山汞矿区土壤THg浓度(0.21–207 mg·kg−1)[18-20]相当。其中,采样点A的土壤THg浓度(中位数:3.4 mg·kg−1;几何平均数:4.0 mg·kg−1)与2019年报道的万山汞矿区的稻田土THg浓度(几何平均数:4.26 mg·kg−1)[18]接近,采样点B的土壤THg浓度(中位数:93 mg·kg−1;几何平均数:51 mg·kg−1)明显偏高,这可能与周围的汞矿残渣有关[21-22]。本研究采集的万山汞矿区土壤样品中,近半数样品THg浓度高于国家农用土地汞污染最大风险管制值(6.0 mg·kg−1)(GB15618-2018),17%的土壤样品THg浓度高于国家建筑第二类用地汞污染最大风险管制值(82 mg·kg−1)(GB36600-2018)。
-
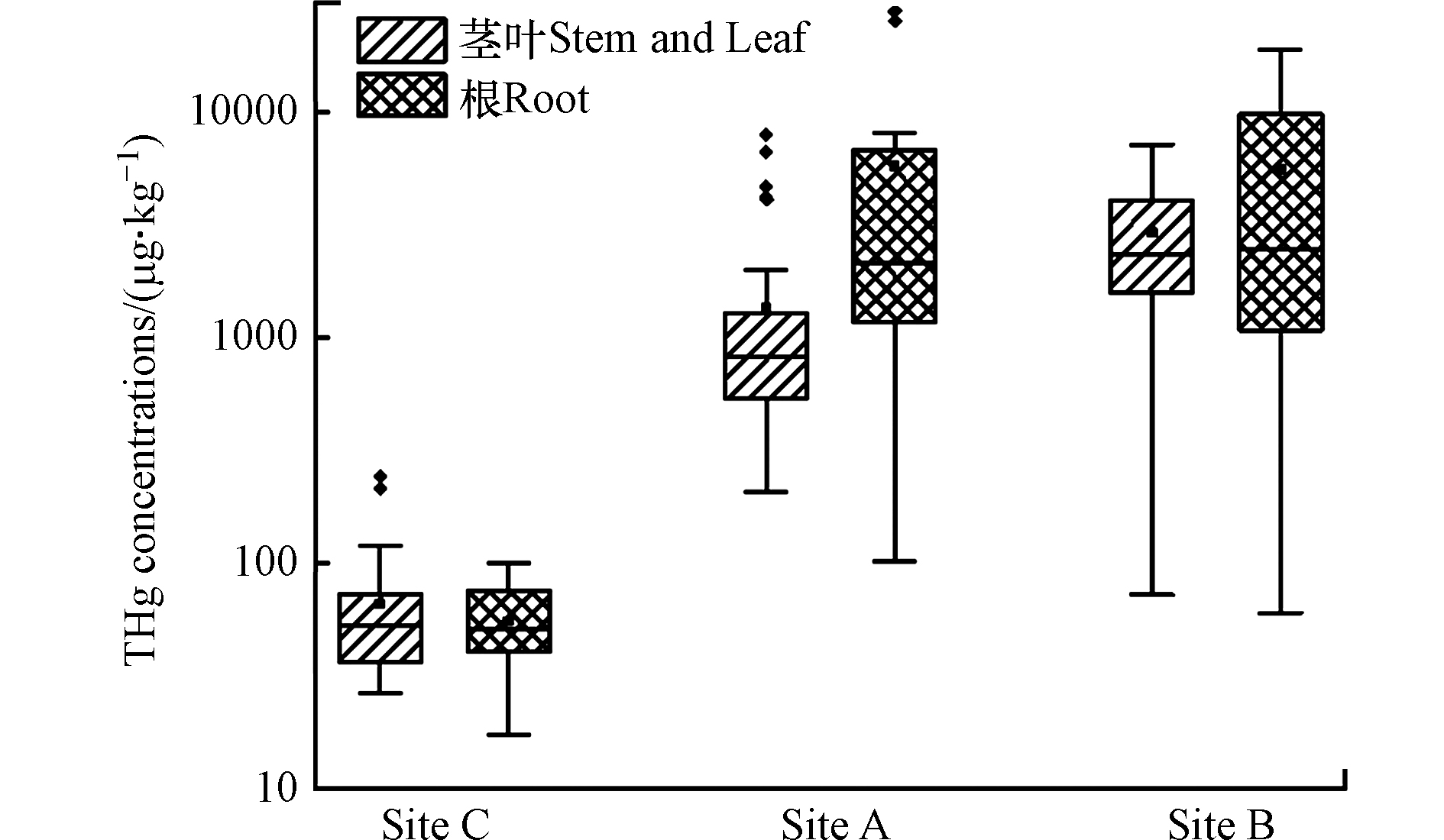
万山汞矿区和对照采样点的植物样品中THg含量见图2。采样点A的植物茎叶部分和根部THg浓度范围分别为0.21–7.9 mg·kg−1和0.10–28 mg·kg−1,茎叶部分和根部THg浓度最高的植物分别是禾本科荩草和鸢尾科鸢尾。采样点B的植物茎叶部分和根部THg含量分别为0.07–7.1 mg·kg−1和0.06–19 mg·kg−1,茎叶部分和根部THg最高的分别是菊科菊芋和伞形科水芹。贵阳对照点植物茎叶部分和根部THg浓度水平分别为0.03–0.24 mg·kg−1和0.02–0.08 mg·kg−1。通过比较万山汞矿区和对照点同种植物样品,万山汞矿区采集的植物样品中THg浓度水平显著较高(P < 0.001,成对T检验),而采样点A和B同种植物样品的THg浓度无显著差异(P > 0.05,成对T检验)。另外,2017年5月和2018年10月两次采集的汞矿区植物样品中THg浓度无显著差异(P > 0.05,成对T检验)。本研究测定的万山汞矿区植物样品THg浓度水平与以往报道的万山汞矿废弃地植物中无机汞浓度(根部:0.59–33 mg·kg−1;地上部分:0.27–12 mg·kg−1)[7]相当,但是显著高于三峡水库消落带的植物样品(1.62–49.42 μg·kg−1)[23]以及青藏高原地区木本植物叶片(< 20 μg·kg−1)[24]。这些结果表明万山汞矿区植物体内汞累积显著,周围环境中汞的污染状况直接影响植物体内汞的累积程度。
-
将同株植物的茎叶部分和根部THg含量进行相关性分析,结果表明植物茎叶部分与根部的THg含量显著相关(Spearsman秩相关系数法:R = 0.79,P<0.001;Kendall秩相关系数法:R = 0.58,P<0.001;n = 58)。由于植物根部不仅具有凯氏带等生物屏障限制根部汞的向上传输[25-27],并且根部的汞可能与富含半胱氨酸的多肽结合转移至液泡中[26,28-29],因此植物根部吸收和累积的汞难以向地上部分传输。近些年研究证实植物根部和地上部分的汞分别主要来自土壤和大气[30-33]。由于汞矿区矿石残渣和土壤可以持续释放无机汞,土壤和大气汞浓度通过不断的汞交换达到平衡[21-22],汞矿区大气汞浓度水平也比较高[34],因此汞矿区植物根部和茎叶部分的汞浓度具有相关性。
对整株采集植物的茎叶部分和根部样品进行分析,发现不同植物组织对汞的累积存在一定差异。2017年5月采集的植物根部THg浓度(中位数:1.5 mg·kg−1;几何平均值:1.8 mg·kg−1)显著高于茎叶部分(中位数:1.2 mg·kg−1;几何平均值:1.1 mg·kg−1)(n = 20,P < 0.05,成对T检验)。2018年10月采集的整株植物样品中,采样点A的植物根部THg浓度(中位数:6.15 mg·kg−1;几何平均值:4.9 mg·kg−1)显著高于茎叶部分(中位数:1.0 mg·kg−1;几何平均值:1.2 mg·kg−1)(n = 10,P < 0.05,成对T检验),表明该采样点植物根部对汞的累积更多。然而,采样点B的植物根部(中位数:2.3 mg·kg−1;几何平均值:2.6 mg·kg−1)和茎叶部分(中位数:4.7 mg·kg−1;几何平均值:4.6 mg·kg−1)中THg浓度无显著性差异(n = 8,P > 0.05,成对T检验)。该结果表明不同植物组织对汞的累积能力存在差异,多数情况下植物根部汞累积水平更高。由于植物叶片和根部中汞分别主要来自大气和土壤[10, 30-33],2018年10月不同采样点的植物组织汞累积能力的差异,推测与不同采样点的土壤和大气汞浓度差异有关,也可能与植物生长阶段和种类等有关。
-
植物体内高浓度汞的累积会对植物产生毒害效应,如叶片发黄、枯萎,甚至植株死亡[35],而对汞耐受性高的植物在汞矿区更易存活并可能具有更大的生物量[36]。本研究在废弃汞冶炼作坊与汞矿周边采集的77种植物中菊科植物有17种(如青蒿、艾、菊花、野茼蒿和苣荬菜等),超过全部植物种类的1/5,说明菊科植物可能较好地适应高汞环境。这可能与菊科植物的强繁殖能力和抗逆性有关,使其在很多尾矿中存活[37]。
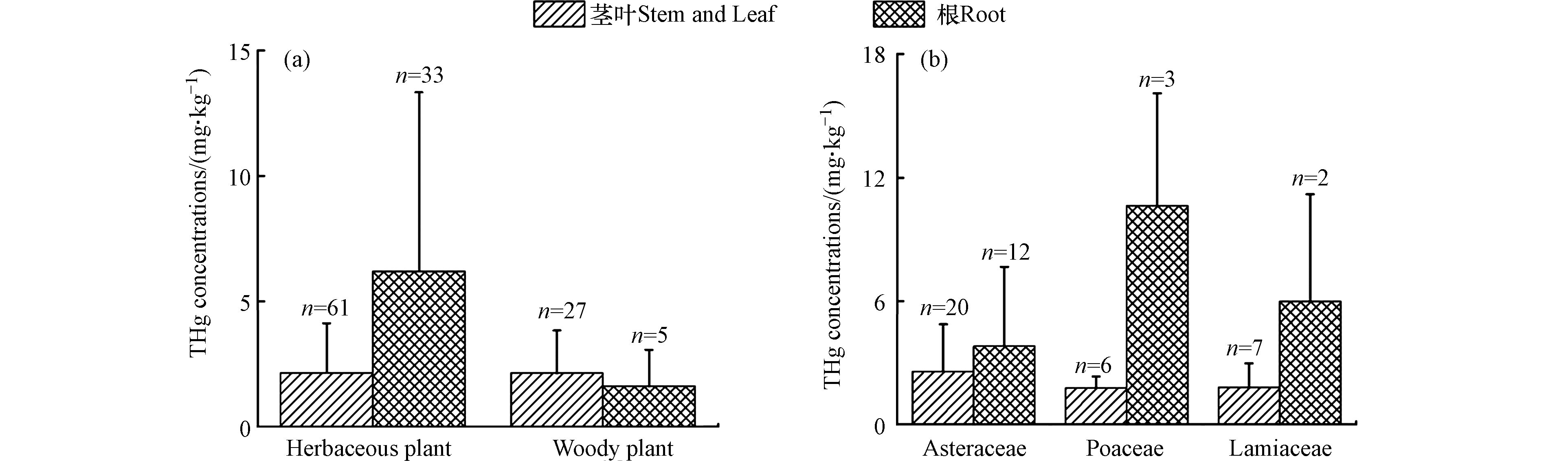
本研究比较了不同种类植物的汞累积能力。荩草的茎叶部分THg浓度(7.9 mg·kg−1)最高,鸢尾的根部THg浓度(28 mg·kg−1)最高,该结果与先前报道的万山汞矿区耐汞野生植物中的最高汞浓度(根部:15.6 mg·kg−1 ,地上部分:6.1 mg·kg−1)[8]相近。本研究进一步比较了木本植物和草本植物,以及菊科、禾本科和唇形科植物对汞的累积能力。如图3(a)所示,草本植物(茎叶部分:(2.2 ± 2.0) mg·kg−1;根部:(6.2 ± 7.1) mg·kg−1)和木本植物(茎叶部分:(2.1 ± 1.7) mg·kg−1;根部:(1.6 ± 1.5) mg·kg−1)对汞的累积能力没有明显差异(P > 0.05,双样本T检验)。菊科、禾本科和唇形科植物体内汞浓度如图3(b)所示,茎叶部分THg浓度均值分别为2.6、1.8和1.8 mg·kg−1,无显著差异(P > 0.05,ANOVA检验);这三类植物的根部THg浓度均值分别为3.8、10.6、6.0 mg·kg−1,由于样品数量较少,未做方差分析。因此,本研究中不同种类植物对汞的累积能力未表现出明显差异。
-
万山废弃汞冶炼作坊和废弃汞矿附近土壤THg浓度为1.8–224 mg·kg−1,植物样品中THg浓度为0.06–28 mg·kg−1,表明这些采样点周围存在汞污染问题。植物茎叶部分和根部中THg浓度显著相关,但不同植物组织中汞累积能力存在差异。由于不同植物组织中汞来源不同,因而不同组织中汞的累积特征与当地大气和土壤汞浓度特征有关。另外,万山汞矿区植物样品中THg浓度显著高于贵阳市对照采样点植物样品,表明植物体内汞的赋存水平主要与当地的汞污染状况有关。尽管这些汞矿和汞冶炼作坊已经废弃,但仍存在一定的汞污染问题,具有潜在的生态风险。
贵州万山汞矿区植物中汞的累积特征
Bioaccumulation of mercury in plants collected from Wanshan mercury mining areas in Guizhou province
-
摘要: 本研究对采集自贵州万山废弃汞冶炼作坊与废弃汞矿附近的土壤和植物样品进行总汞分析,旨在探究不同种类植物和植物组织中汞的蓄积能力和分布特征。本研究共采集菊科、禾本科和唇形科等植物77种,植物茎叶部分和根部样品共185个。结果表明,废弃汞冶炼作坊与废弃汞矿周围土壤汞浓度(1.8–224 mg·kg−1)显著高于贵阳市对照点(0.14–0.26 mg·kg−1);万山汞矿区采集的植物茎叶部分和根部总汞浓度范围分别为0.07–7.9 mg·kg−1和0.06–28 mg·kg−1,显著高于对照点的同种植物茎叶部分和根部样品中总汞浓度(P < 0.001)。另外,草本植物和木本植物,以及菊科、禾本科和唇形科植物对汞的累积水平无明显差异(P > 0.05)。通过对同株植物的不同组织进行分析,发现植物茎叶部分和根部累积汞的能力存在差异,二者总汞浓度水平显著相关(R ≥ 0.58,P < 0.001),推测其与不同组织中汞的来源不同及植物体内汞转运有关。这些结果表明废弃汞冶炼作坊和废弃汞矿对周边植物的汞累积能力有显著影响,需重视废弃汞矿区的潜在生态风险。Abstract: This study analyzed mercury (Hg) concentrations in soil and plant samples collected from one abandoned Hg smelting workshop and one abandoned Hg mine in Wanshan Hg mining areas, Guizhou province, aiming to investigate the Hg accumulation characteristics of different plants and the Hg distribution in plant tissues. A total of 185 plant samples (including shoots and roots) of 77 plant species were collected, such as Asteraceae, Poaceae, and Lamiaceae. Results showed that total Hg (THg) concentrations in soil collected from Wanshan Hg mining areas (1.8–224 mg·kg−1) were significantly higher than those in soil collected from the control site in Guiyang (0.14–0.26 mg·kg−1). THg concentrations in plant shoots and roots from Wanshan Hg mining areas were 0.07–7.9 mg·kg−1and 0.06–28 mg·kg−1, respectively, which were higher than those from the control site (P < 0.001). No significant THg concentration differences were observed between herbaceous and woody plants (P > 0.05), nor did among Asteraceae, Poaceae, and Lamiaceae species (P > 0.05). THg concentrations varied in the root and shoot for the same plant, and THg concentrations in these plant tissues were significantly correlated (R ≥ 0.58, P < 0.001), which may be due to the different origins for Hg in different tissues and Hg transport within plants. These results suggested that the abandoned Hg smelting workshop and abandoned Hg mine have a substantial influence on Hg accumulation in plants, and the potential ecological risks posed by abandoned Hg mining areas deserve further attention.
-
Key words:
- mercury /
- mercury mining areas /
- soil /
- plant /
- bioaccumulation
-
表 1 不同采样点植物样品名称、分类和采样时间
Table 1. Names, classification and sampling time of plant samples collected from different sampling sites
中文名Chinese name 拉丁名Latin name 属Genus 科Family 采样时间Sampling time 采样点A(废弃汞冶炼作坊) Site A (an abandoned mercury smelting workshop) 鼠李 Rhamnus davurica 鼠李属 鼠李科 2017-5 木贼 Equisetum hyemale 木贼属 木贼科 2017-5 车前 Plantago asiatica 车前属 车前科 2018-10 马桑 Coriaria nepalensis 马桑属 马桑科 2017-5 野百合 Lilium brownii 百合属 百合科 2018-10 十大功劳 Mahonia fortunei 十大功劳属 小檗科 2018-10 香椿 Toona sinensis 香椿属 楝科 2018-10 棕榈 Trachycarpus fortunei 棕榈属 棕榈科 2018-10 紫茉莉 Mirabilis jalapa 紫茉莉属 紫茉莉科 2018-10 樟 Cinnamomum camphora 樟属 樟科 2017-5 博落回 Macleaya cordata 博落回属 罂粟科 2017-5 鸢尾 Iris tectorum 鸢尾属 鸢尾科 2018-10 雾水葛 Pouzolzia zeylanica 雾水葛属 荨麻科 2018-10 紫麻 Oreocnide frutescens 紫麻属 荨麻科 2017-5、2018-10 打碗花 Calystegia hederacea 打碗花属 旋花科 2018-10 蜈蚣草 Pteris vittata L. 凤尾蕨属 凤尾蕨科 2017-5、2018-10 窃衣 Torilis scabra 窃衣属 伞形科 2017-5 野蔷薇 Rosa multiflora 蔷薇属 蔷薇科 2018-10 长鬃蓼 Polygonum longisetum 萹蓄属 蓼科 2018-10 酸模 Rumex acetosa 酸模属 蓼科 2017-5 臭牡丹 Clerodendrum bungei 大青属 唇形科 2017-5 小鱼仙草 Mosla dianthera 石荠苎属 唇形科 2018-10 薄荷 Mentha canadensis 薄荷属 唇形科 2017-5 雀稗 Paspalum thunbergii 雀稗属 禾本科 2018-10 荩草 Arthraxon hispidus 荩草属 禾本科 2017-5、2018-10 狼尾草 Pennisetum alopecuroides 狼尾草属 禾本科 2018-10 青蒿 Artemisia caruifolia 蒿属 菊科 2017-5 艾 Artemisia argyi 蒿属 菊科 2017-5、2018-10 一年蓬 Erigeron annuus 飞蓬属 菊科 2017-5 小蓬草 Erigeron canadensis 飞蓬属 菊科 2017-5 菊花 Chrysanthemum morifolium 菊属 菊科 2018-10 马兰 Aster indicus 紫菀属 菊科 2018-10 苍耳 Xanthium strumarium 苍耳属 菊科 2018-10 腺梗豨莶 Sigesbeckia pubescens 豨莶属 菊科 2018-10 野茼蒿 Crassocephalum crepidioides 野茼蒿属 菊科 2018-10 采样点B(废弃汞矿) Site B (an abandoned mercury mine) 木贼 Equisetum hyemale 木贼属 木贼科 2017-5 马桑 Coriaria nepalensis 马桑属 马桑科 2017-5、2018-10 蕨 Pteridium aquilinum var. latiusculum 蕨属 碗蕨科 2017-5 樟 Cinnamomum camphora 樟属 樟科 2017-5 博落回 Macleaya cordata 博落回属 罂粟科 2017-5 醉鱼草 Buddleja lindleyana 醉鱼草属 玄参科 2017-5、2018-10 猪毛菜 Salsola collina 猪毛菜属 藜科 2017-5 腺柳 Salix chaenomeloides 柳属 杨柳科 2018-10 云南木犀榄 Olea tsoongii 木樨榄属 木犀科 2018-10 盐肤木 Rhus chinensis 盐肤木属 漆树科 2018-10 梵天花 Urena procumbens 梵天花属 锦葵科 2018-10 土荆芥 Dysphania ambrosioides 腺毛藜属 苋科 2018-10 齿牙毛蕨 Cyclosorus dentatus 毛蕨属 金星蕨科 2017-5 渐尖毛蕨 Cyclosorus acuminatus 毛蕨属 金星蕨科 2018-10 忍冬 Lonicera japonica 忍冬属 忍冬科 2017-5 川续断 Dipsacus asper 川续断属 忍冬科 2018-10 败酱 Patrinia scabiosifolia 败酱属 忍冬科 2018-10 水芹 Oenanthe javanica 水芹属 伞形科 2017-5 窃衣 Torilis scabra 窃衣属 伞形科 2018-10 野蔷薇 Rosa multiflora 蔷薇属 蔷薇科 2017-5、2018-10 灰白毛莓 Rubus tephrodes 悬钩子属 蔷薇科 2017-5、2018-10 火棘 Pyracantha fortuneana 火棘属 蔷薇科 2018-10 何首乌 Fallopia multiflora 何首乌属 蓼科 2018-10 愉悦蓼 Polygonum jucundum 萹蓄属 蓼科 2018-10 小鱼仙草 Mosla dianthera 石荠苎属 唇形科 2018-10 薄荷 Mentha canadensis 薄荷属 唇形科 2017-5 紫苏 Perilla frutescens 紫苏属 唇形科 2018-10 荩草 Arthraxon hispidus 荩草属 禾本科 2017-5 狼尾草 Pennisetum alopecuroides 狼尾草属 禾本科 2018-10 野古草 Arundinella anomala 野古草属 禾本科 2017-5 芒 Miscanthus sinensis 芒属 禾本科 2018-10 艾 Artemisia argyi 蒿属 菊科 2017-5 一年蓬 Erigeron annuus 飞蓬属 菊科 2017-5 小蓬草 Erigeron canadensis 飞蓬属 菊科 2018-10 马兰 Aster indicus 紫菀属 菊科 2017-5、2018-10 蒌蒿 Artemisia selengensis 蒿属 菊科 2017-5 菊芋 Helianthus tuberosus 向日葵属 菊科 2018-10 千里光 Senecio scandens 千里光属 菊科 2018-10 蒙古蒿 Artemisia mongolica 蒿属 菊科 2018-10 风毛菊 Saussurea japonica 风毛菊属 菊科 2018-10 对照采样点C Site C (the control sampling site) 马桑 Coriaria nepalensis 马桑属 马桑科 2018-10 蕨 Pteridium aquilinum var. latiusculum 蕨属 碗蕨科 2017-5、2018-10 醉鱼草 Buddleja lindleyana 醉鱼草属 玄参科 2017-5、2018-10 灰莉 Fagraea ceilanica 灰莉属 马钱科 2017-5 紫薇 Lagerstroemia indica L. 紫薇属 千屈菜科 2017-5 构树 Broussonetia papyrifera 构属 桑科 2018-10 匙羹藤 Gymnema sylvestre 匙羹藤属 夹竹桃科 2018-10 龙葵 Solanum nigrum 茄属 茄科 2018-10 菊叶香藜 Dysphania schraderiana 腺毛藜属 苋科 2018-10 庭菖蒲 Sisyrinchium rosulatum 庭菖蒲属 鸢尾科 2018-10 欧旋花 Calystegia sepium subsp. Spectabilis 打碗花属 旋花科 2018-10 蜈蚣草 Pteris vittata L. 凤尾蕨属 凤尾蕨科 2017-5 狭叶凤尾 Pteris henryi 凤尾蕨属 凤尾蕨科 2017-5 扁豆 Lablab purpureus 扁豆属 豆科 2018-10 刺槐 Robinia pseudoacacia 刺槐属 豆科 2018-10 葛 Pueraria montana 葛属 豆科 2018-10 窃衣 Torilis scabra 窃衣属 伞形科 2017-5 胡萝卜 Daucus carota var. sativa 胡萝卜属 伞形科 2018-10 野蔷薇 Rosa multiflora 蔷薇属 蔷薇科 2017-5 火棘 Pyracantha fortuneana 火棘属 蔷薇科 2018-10 酸模 Rumex acetosa 酸模属 蓼科 2017-5 何首乌 Fallopia multiflora 何首乌属 蓼科 2017-5 紫苏 Perilla frutescens 紫苏属 唇形科 2017-5 荩草 Arthraxon hispidus 荩草属 禾本科 2018-10 竹叶草 Oplismenus compositus 求米草属 禾本科 2017-5 芒 Miscanthus sinensis 芒属 禾本科 2017-5 艾 Artemisia argyi 蒿属 菊科 2017-5、2018-10 小蓬草 Erigeron canadensis 飞蓬属 菊科 2017-5 马兰 Aster indicus 紫菀属 菊科 2017-5 腺梗豨莶 Sigesbeckia pubescens 豨莶属 菊科 2018-10 千里光 Senecio scandens 千里光属 菊科 2018-10 蒙古蒿 Artemisia mongolica 蒿属 菊科 2018-10 苣荬菜 Sonchus arvensis L. 苦苣菜属 菊科 2017-5、2018-10 香丝草 Erigeron bonariensis 飞蓬属 菊科 2018-10 牛膝菊 Galinsoga parviflora 牛膝菊属 菊科 2018-10 表 2 万山汞矿区和对照采样点土壤THg浓度
Table 2. THg concentrations in soil samples collected from Wanshan mercury mining areas and the control site
采样地点Sampling location THg 含量/(mg·kg−1)THg concentrations 范围Range 中位数Median 几何平均数Geometric mean 四分位距Interquartile range 采样点A 1.8—21 3.4 4.0 3.4 采样点B 7.9—224 93 51 197 采样点C 0.14—0.26 0.17 0.18 0.81 -
[1] 冯新斌, 陈玖斌, 付学吾, 等. 汞的环境地球化学研究进展 [J]. 矿物岩石地球化学通报, 2013, 32(5): 504-530. FENG X B, CHEN J B, FU X W, et al. Progresses on environmental geochemistry of mercury [J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2013, 32(5): 504-530(in Chinese).
[2] HOLMES C D, JACOB D J, CORBITT E S, et al. Global atmospheric model for mercury including oxidation by bromine atoms [J]. Atmospheric Chemistry and Physics, 2010, 10(24): 12037-12057. doi: 10.5194/acp-10-12037-2010 [3] UNEP. Global mercury assessment [R], 2018. [4] MEILI M. The coupling of mercury and organic matter in the biogeochemical cycle-Towards a mechanistic model for the boreal forest zone [J]. Water, Air, and Soil Pollution, 1991, 56: 333-347. doi: 10.1007/BF00342281 [5] SUN Z H, XIE X D, WANG P, et al. Heavy metal pollution caused by small-scale metal ore mining activities: A case study from a polymetallic mine in South China [J]. Science of the Total Environment, 2018, 639: 217-227. doi: 10.1016/j.scitotenv.2018.05.176 [6] 刘雅妮, 张习敏, 徐小蓉, 等. 贵州主要汞矿废弃地带的植物及其对汞的富集能力 [J]. 贵州农业科学, 2014, 42(11): 248-250. doi: 10.3969/j.issn.1001-3601.2014.11.061 LIU Y N, ZHANG X M, XU X R, et al. Plant species in main abandoned mercury mines and their enrichment capacity of mercury in Guizhou [J]. Guizhou Agricultural Sciences, 2014, 42(11): 248-250(in Chinese). doi: 10.3969/j.issn.1001-3601.2014.11.061
[7] 钱晓莉, 徐晓航, 吴永贵, 等. 贵州万山汞矿废弃地自然定居植物对汞与甲基汞的吸收与累积 [J]. 生态学杂志, 2019, 38(2): 558-566. doi: 10.13292/j.1000-4890.201902.001 QIAN X L, XU X H, WU Y G, et al. Distribution of inorganic mercury and methylmercury in wild plants inhabited on abandoned lands of Wanshan Hg mining region, Guizhou Province [J]. Chinese Journal of Ecology, 2019, 38(2): 558-566(in Chinese). doi: 10.13292/j.1000-4890.201902.001
[8] 赵甲亭, 李云云, 高愈希, 等. 贵州万山汞矿地区耐汞野生植物研究 [J]. 生态毒理学报, 2014, 9(5): 881-887. ZHANG J T, LI Y Y, GAO Y X, et al. Study of mercury resistant wild plants growing in the mercury mine area of Wanshan district, Guizhou Province [J]. Asian Journal of Ecotoxicology, 2014, 9(5): 881-887(in Chinese).
[9] QIAN X L, WU Y G, ZHOU H Y, et al. Total mercury and methylmercury accumulation in wild plants grown at wastelands composed of mine tailings: Insights into potential candidates for phytoremediation [J]. Environmental Pollution, 2018, 239: 757-767. doi: 10.1016/j.envpol.2018.04.105 [10] MENG B, LI Y, CUI W, et al. Tracing the uptake, transport, and fate of mercury in sawgrass (Cladium jamaicense) in the Florida Everglades using a multi-isotope technique [J]. Environmental Science & Technology, 2018, 52(6): 3384-3391. [11] LOUIS V L. ST, RUDD J W. M, J, KELLY C A, et al. Importance of the forest canopy to fluxes of methyl mercury and total mercury to boreal ecosystems [J]. Environmental Science & Technology, 2001, 35(15): 3089-3098. [12] STAMENKOVIC J, GUSTIN M S. Nonstomatal versus stomatal uptake of atmospheric mercury [J]. Environmental Science & Technology, 2009, 43(5): 1367-1372. [13] FU X B, ZHU W, ZHANG H, et al. Depletion of atmospheric gaseous elemental mercury by plant uptake at Mt. Changbai, Northeast China [J]. Atmospheric Chemistry and Physics, 2016, 16(20): 12861-12873. doi: 10.5194/acp-16-12861-2016 [14] WANG X, BAO Z D, LIN C J, et al. Assessment of global mercury deposition through litterfall [J]. Environmental Science & Technology, 2016, 50(16): 8548-8557. [15] ZHOU J, FENG X B, LIU H Y, et al. Examination of total mercury inputs by precipitation and litterfall in a remote upland forest of Southwestern China [J]. Atmospheric Environment, 2013, 81: 364-372. doi: 10.1016/j.atmosenv.2013.09.010 [16] WANG Z W, ZHANG X S, XIAO J S, et al. Mercury fluxes and pools in three subtropical forested catchments, Southwest China [J]. Environmental Pollution, 2009, 157(3): 801-808. doi: 10.1016/j.envpol.2008.11.018 [17] 成杭新, 李括, 李敏, 等. 中国城市土壤化学元素的背景值与基准值 [J]. 地学前缘, 2014, 21(3): 265-306. doi: 10.13745/j.esf.2014.03.028 CHENG H X, LI K, LI M, et al. Geochemical background and baseline value of chemical elements in urban soil in China [J]. Earth Science Frontiers, 2014, 21(3): 265-306(in Chinese). doi: 10.13745/j.esf.2014.03.028
[18] 高令健, 毛康, 张伟, 等. 贵州万山汞矿区稻田土壤汞的分布及污染特征 [J]. 矿物岩石地球化学通报, 2021, 40(1): 148-154. doi: 10.19658/j.issn.1007-2802.2020.39.087 GAO L J, MAO K, ZHANG W, et al. Temporal and spatial distribution and pollution characteristics of mercury in paddy soils of the Wanshan mercury mining area, Guizhou Province [J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2021, 40(1): 148-154(in Chinese). doi: 10.19658/j.issn.1007-2802.2020.39.087
[19] 尹德良, 何天容, 安艳玲, 等. 万山稻米汞含量分布特征及影响因素研究 [J]. 农业环境科学学报, 2014, 33(6): 1082-1088. doi: 10.11654/jaes.2014.06.004 YIN D L, HE T R, AN Y L, et al. Distribution and influencing factors of mercury in rice grains in Wanshan [J]. Journal of Agro-Environment Science, 2014, 33(6): 1082-1088(in Chinese). doi: 10.11654/jaes.2014.06.004
[20] 朱宗强. 喀斯特地区汞污染土壤生物有效态分析方法及修复技术研究 [D]. 北京: 中国科学院大学, 2018. ZHU Z Q. Study on bioavailability analysis method and remediation technology of mercury contaminated soil in Karst area [D]. Beijing: University of Chinese Academy of Sciences, 2018 (in Chinese).
[21] BIESTER H, GOSAR M, COVELI S. Mercury speciation in sediments affected by dumped mining residues in the drainage area of the Idrija mercury mine, Slovenia [J]. Environmental Science & Technology, 2000, 34(16): 3330-3336. [22] BIESTER H, GOSAR M, Müller G. Mercury speciation in tailings of the Idrija mercury mine [J]. Journal of Geochemical Exploration, 1999, 65: 195-204. doi: 10.1016/S0375-6742(99)00027-8 [23] 梁丽, 王永敏, 李先源, 等. 三峡水库消落带植物汞的分布特征 [J]. 环境科学, 2015, 36(11): 4103-4111. doi: 10.13227/j.hjkx.2015.11.021 LIANG L, WANG Y M, LI X Y, et al. Distribution of mercury in plants at water-level-fluctuating zone in the Three Gorges Reservoir [J]. Environment Science, 2015, 36(11): 4103-4111(in Chinese). doi: 10.13227/j.hjkx.2015.11.021
[24] 吴飞, 王训, 罗辑, 等. 青藏高原林线森林汞的空间分布格局及对大气环境汞污染的指示 [J]. 环境化学, 2019, 38(7): 1619-1627. doi: 10.7524/j.issn.0254-6108.2018092302 WU F, WANG X, LUO J, et al. Spatial distribution of total mercury in timberline forest of Tibetan plateau regions and its implications of atmospheric mercury pollution [J]. Environment Chemistry, 2019, 38(7): 1619-1627(in Chinese). doi: 10.7524/j.issn.0254-6108.2018092302
[25] BISHOP K H, LI Y H, MUNTHE J, et al. Xylem sap as a pathway for total mercury and methylmercury transport from soils to tree canopy in the boreal forest [J]. Biogeochemistry, 1998, 40: 101-113. doi: 10.1023/A:1005983932240 [26] CANáRIO J, POISSANT L, PILOTE M, et al. Salt-marsh plants as potential sources of Hg0 into the atmosphere [J]. Atmospheric Environment, 2017: 458-464. [27] ROTHENBERG S E, FENG X B, DONG B, et al. Characterization of mercury species in brown and white rice (Oryza sativa L. ) grown in water-saving paddies [J]. Environmental Pollution, 2011, 159: 1283-1289. doi: 10.1016/j.envpol.2011.01.027 [28] ZENK M H. Heavy metal detoxification in higher plants [J]. Gene, 1996, 179: 21-30. doi: 10.1016/S0378-1119(96)00422-2 [29] WEIS J S, WEIS P. Metal uptake, transport and release by wetland plants: implications for phytoremediation and restoration [J]. Environment International, 2004, 30: 685-700. doi: 10.1016/j.envint.2003.11.002 [30] YIN R S, FENG X B, MENG B. Stable mercury isotope variation in rice plants (Oryza sativa L. ) from the Wanshan mercury mining district, SW China [J]. Environmental Science & Technology, 2013, 47(5): 2238-2245. [31] MAO Y X, LI Y B, RICHARDS J, et al. Investigating uptake and translocation of mercury species by sawgrass (Cladium jamaicense) using a stable isotope tracer technique [J]. Environmental Science & Technology, 2013, 47(17): 9678-9684. [32] LAACOURI A, NATER E A, KOLKA R K. Distribution and uptake dynamics of mercury in leaves of common deciduous tree species in Minnesota, USA [J]. Environmental Science & Technology, 2013, 47(18): 10462-10470. [33] POISSANT L, PILOTE M, YUMVIHOZE E, et al. Mercury concentrations and foliage/atmosphere fluxes in a maple forest ecosystem in Quebec, Canada [J]. Journal of Geophysical Research-Atmospheres, 2008, 113(D10307). [34] 王少锋, 冯新斌, 仇广乐, 等. 万山汞矿区地表与大气界面间汞交换通量研究 [J]. 环境科学, 2006, 27(8): 1478-1494. doi: 10.3321/j.issn:0250-3301.2006.08.003 WANG S F, FENG X B, QIU G L, et al. Mercury exchange fluxes between air and soil interface over different type of land in Wanshan Hg mine area [J]. Environment Science, 2006, 27(8): 1478-1494(in Chinese). doi: 10.3321/j.issn:0250-3301.2006.08.003
[35] 黄银晓, 林舜华, 姚依群, 等. 植物对汞的吸收和反应 [J]. 植物学通报, 1983, 1: 47-52. HUANG X Y, LIN S H, YAO Y Q, et al. Plant uptake and response to mercury [J]. Chinese Bulletin of Botany, 1983, 1: 47-52(in Chinese).
[36] 徐小蓉. 万山汞矿区耐汞植物筛选及耐性机理研究 [D]. 贵阳: 贵州师范大学, 2008. XU X R. The selection of Hg-tolerance plants and the study of the tolerance mechanisms in the Wanshan mine [D]. Guiyang: Guizhou Normal University, 2008 (in Chinese).
[37] 杨世勇, 谢建春, 刘登义. 铜陵铜尾矿复垦现状及植物在铜尾矿上的定居 [J]. 长江流域资源与环境, 2004, 13(5): 488-493. doi: 10.3969/j.issn.1004-8227.2004.05.017 YANG S Y, XIE J C, LIU D Y. Reclamation status of copper tailings in Tongling and the settlement of plants on copper tailings [J]. Resources and Environment in the Yangtze Basin, 2004, 13(5): 488-493(in Chinese). doi: 10.3969/j.issn.1004-8227.2004.05.017
-






 下载:
下载: