-
日益严格的环境管理政策及污染物排放标准的实施,持续推动我国污水处理从常规二级处理向污水深度处理(尤其是总氮)的转变。反硝化生物滤池作为生物法深度脱氮的主流工艺,在污水处理厂的提标改造中应用较广[1]。然而,目前在我国,污水处理厂二级生化尾水等污水的一大特征是低碳氮比,反硝化将被抑制,造成亚硝酸盐的累积以及反硝化效率低等问题,导致出水难以达标[2-3]。目前,为实现对低碳氮废水的深度脱氮,反硝化滤池主要通过进水处直接添加甲醇、乙酸钠、乙醇等外加碳源作为电子供体,但会造成运行成本高和出水COD超标的问题[4]。因此,采用缓释碳源材料作为滤池滤料成为反硝化脱氮的研究热点之一,其主要特点是无需持续投加碳源且可提供微生物附着位点。
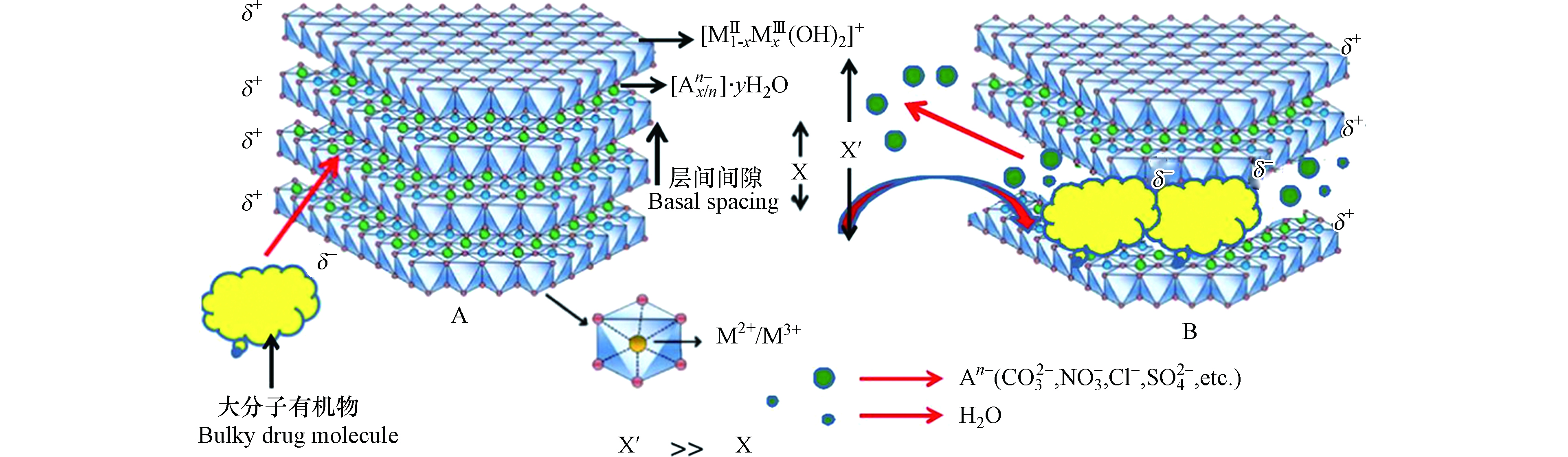
释碳材料包括天然释碳材料(秸秆、稻壳、木屑等[5-7])和可生物降解的聚合物(聚乳酸、聚乙烯醇、聚丁二酸丁二醇酯等[8-11])。使用天然释碳材料虽然价格低廉,但其脱氮效果不佳,反硝化负荷较低,用聚合物作为碳源可实现较理想的脱氮效果,但是其成本相对较高。层状双金属化合物(LDHs)结构示意图如图1,LDHs具有双金属(三价金属离子和二价金属离子)层状结构,层间结合负电离子,层间存在氢键,紧密结合,结构稳定,具有良好的机械性能和缓释性能[12]。若将LDHs用于制备释碳材料的骨架、并将其与较为廉价的有机碳源混合制备反硝化滤料,既可实现缓释碳效果,又能适当降低运行成本。如Islam等[13]合成Zn-Al-Cl-LDH碳源,使用0.3 g的碳源置于100 mL初始浓度为10 mg·L−1的硝酸盐溶液中,硝酸盐去除率为85.5%。Fang等[14]制备Bio-ceramic/Zn-LDHs,将其用于去除模拟废水的氨氮,最高去除率可达50%。Jiang等[15]针对微量金属(铁、锰、铜、锌、钼)对反硝化活性的影响研究,发现铁可显著提高生物反硝化速率。Chen等[16]将含金属镍的层状双金属纳米颗粒用于反硝化以改善微生物脱氮性能。Mg2+和Al3+是合成LDHs最常用的二价和三价金属离子,Ni2+和Fe3+可以赋予LDHs更好的释放性能,并能促进反硝化活性和反硝化速率[17]。同时,有机物羟甲基纤维素钠(CMC)具有黏合性且较为廉价。故使用CMC作为LDHs缓释碳源的有机碳源和包埋法制备滤料中的黏合剂,选用Fe3+、Ni2+等金属离子制备LDHs缓释碳源的方法具有潜在有效性,且此方案在国内外鲜见报道。
因此,本研究选择Fe3+、Al3+、Ni2+、Mg2+等4种金属离子,率先选用CMC为负电离子用于制备基于层状双金属化合物的缓释碳源材料,并初步筛选出碳源FeNi-LDH-CMC用于LDHs基滤料的制备。对制得的LDHs基滤料进行系统研究,确定了各组成物质最优质量分数及释碳性能。选用最优LDHs基滤料,构建反硝化滤池反应器,以低碳氮比模拟废水作为处理对象,综合分析不同水力停留时间下反硝化滤池对废水的处理效果并探究其机理,结果表明,新型LDHs基缓释碳源滤料可提高反硝化滤池对低碳氮比废水的深度脱氮效果,具有较强的推广应用前景。
-
实验试剂:氢氧化钠、六水三氯化铁、六水三氯化铝、六水氯化镍、六水氯化镁、羧甲基纤维素钠(CMC)、聚乙烯醇(PVA)、硼酸、无水氯化钙、乙酸钠、硝酸钾、磷酸二氢钾、碳酸氢钠、高纯氮气等,所用试剂纯度均在98%及以上。
实验仪器:总有机碳测定仪(Multi+N/C 3000)、电子分析天平(AL104)、紫外可见分光光度计(UV-2700)、电热恒温鼓风干燥箱(DHG-9070A)、恒温加热搅拌器(DF-101S)、低温冷冻离心机(Centrifuge5810R)、pH仪(SG7型)、COD快速消解仪(DRB2000)、傅里叶变换红外光谱仪(NEXUS870)、X射线光电子能谱仪(ESCALAB 250)、超纯水系统(Milli-Q)、荧光定量PCR仪(ABI 7500)、Nanodrop分光光度计(ND-100)等。
-
LDHs基缓释碳源材料采用共沉淀法制备而成[18],具体步骤如下:称量一定的FeCl3·6H2O和NiCl2·6H2O,使二者的物质的量之比为2:3,溶于一定体积的去离子水中,将含有Fe3+、Ni2+的溶液置于1 L的三口瓶中。三口瓶置于恒温搅拌器中,在氮气保护环境下持续搅拌,然后滴加羟甲基纤维素钠溶液,用2 mol·L−1的NaOH溶液调节溶液的pH值为9.0左右。加热三口瓶使温度维持在75 ℃左右,搅拌12 h,需添加冷凝装置。对得到的混合液进行冷却、离心,并用去离子水洗涤至少3次,在65 ℃的烘箱中烘干48 h。再经研磨,不同目数的筛网过筛,得到3种粒径的FeNi-LDH-CMC碳源。实验中所用的去离子水需提前氮吹30 min,除去其中的氧气。以此方法也可得到FeMg-LDH-CMC、AlNi-LDH-CMC和AlMg-LDH-CMC等 3种碳源材料,此3种碳源材料在制备过程中三价与二价金属离子的物质的量之比为2:3。
基滤料采用包埋法制备而成[19],具体步骤如下:称量一定量的PVA,在90 ℃条件下溶解于去离子水中,然后下调温度至60 ℃。称量一定量的CMC完全溶解其中,再称量本研究中已制备好的LDHs-CMC缓释碳源材料,加入到混合液中。充分混合之后,待混合液冷却至40 ℃左右,将混合液以100—300 μL·s−1的速度滴加到质量分数为4%的CaCl2饱和硼酸溶液中,交联24 h,得到粒径为3—5 mm的颗粒,在65 ℃条件下干燥48 h,即得LDHs基滤料。
-
取不同粒径的4种碳源材料FeNi-LDH-CMC、FeMg-LDH-CMC、AlNi-LDH-CMC和AlMg-LDH-CMC各0.5 g,溶于250 mL超纯水中,进行快速静态释碳实验[20]。在1、2、4、6、8、10、12、24、48、72、96、120、144、168 h取样,经过0.45 μm醋酸纤维素滤膜过滤后置于4 ℃冰箱内保存至测定COD。
-
使用Cu-Kα辐射(λ=0.15418 nm)以4 min−1的扫描速度重新采集5°—80°之间的粉末X射线衍射(XRD)数据。仪器在40 kV和40 mA下运行,用于确定低密度脂蛋白样品的相结构。使用PHI5000 VersaProbe使用带有AlKa射线源的X射线光电子能谱(XPS,Thermo Scientific K-Alpha+)分析释碳材料的不同价态元素所占比例。
-
根据单因素实验分析,已初步判断了PVA、CMC、FeNi-LDH-CMC的较佳配比,为响应面实验提供范围依据。响应面实验采用Design-Expert.V8.0.6.1软件设计,共17组相关设计见表1。
LDHs基滤料用于投加至反硝化生物滤池中为缓慢释放碳源,需要绘制LDHs基滤料的释碳曲线,操作步骤为:称量不同配比的LDHs基滤料、PVA、CMC各2 g,溶于1 L超纯水中,在1、2、4、6、8、10、12、24、48、72、96、120、144、168 h取样,经过0.45 μm醋酸纤维素滤膜过滤后,置于4 ℃冰箱内保存至测定COD。相关评价的方程为:K=cm/t1/2,其中,K为释碳系数,表示碳源释放过程受到的阻力,K值越低,缓释碳源滤料释碳性能越好,cm为单位缓释碳源滤料在溶液中释放的饱和COD值,t1/2为单位缓释碳源滤料在溶液中释放的COD达饱和浓度一半时所用时间[21]。
-
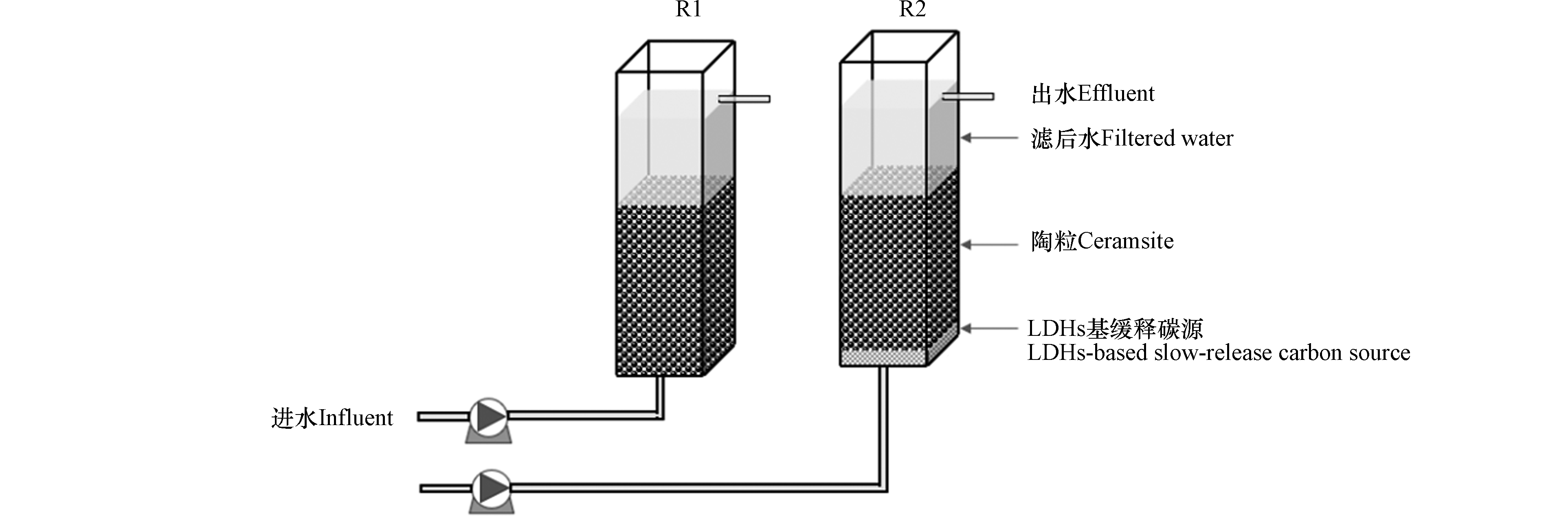
本研究共设置2个实验室规模的反硝化滤池,装置示意图如图2 所示。
反应器由有机玻璃制成,总有效容积为3 L,长和宽均为10 cm,总高度35 cm,滤料填充层的高度为20 cm,水位高度为10 cm左右。其中陶粒滤料购买自安徽华祺环保,直径为3—5 mm,有效比表面积为500—600 m2·m−3,密度为1.5—1.6 g·cm−3。反应器温度为25 ℃,基于反硝化滤池实际运行时间和脱氮负荷,水力停留时间设置为6 h和3 h。R1-1、R2-1代表HRT为6 h时的反应器,R1-2、R2-2代表HRT为3 h时的反应器。R2反应器中FeNi-LDH-CMC碳源滤料投加的位置在反应器的最下端(反应器的进口处),用纱布包裹,便于更换。
LDHs基滤料的投加量可根据模拟进水组分及TN低于5 mg·L−1的处理目标确定。根据前期调研相关数据,反硝化生物滤池进水中的碳氮比为5:1时,可实现处理目标,故本实验需投加LDHs基滤料补充COD值为100 mg·L−1。经过实际测算,此反硝化生物滤池静态运行过程中,废水的容积约为1.6 L,日处理量约为6.4 L,则LDHs基滤料投加补充的有机碳值为0.64 g,本研究中滤料的最大释碳量为320.96 mg·g−1,则每天需要的LDHs基滤料质量约为2 g,LDHs基滤料的密度为0.83 g·cm−3,则每天所需LDHs基滤料的体积为2.4 cm3,为满足预期的脱氮效果,拟运行60 d需要投加的LDHs滤料的理论体积为144 cm3,其与陶粒的体积比约为1:12.9。但实际操作中,考虑碳源流失等情况,适当增加LDHs基滤料与陶粒的体积比至1:10。
本研究使用人工合成低碳氮比废水作为进水,进水中COD为150 mg·L−1,硝态氮为50 mg·L−1,碳氮比为3:1,pH值在8.10±0.15。模拟废水详细组分见表2。
本研究反硝化滤池的挂膜方式采用接种挂膜法,接种污泥取自南京市某市政污水处理厂氧化沟工艺缺氧段,混合液悬浮固体浓度(mixed liquor suspended solids, MLSS)在3000 mg·L−1左右,活性污泥倒入反硝化滤池内至淹没滤料,闷曝24 h后将接种活性污泥全部排出并开始连续通入模拟废水,反硝化滤池采用上流式连续运行2个月。实验进水溶解氧浓度为0.29—0.41 mg·L−1,低于0.5 mg·L−1。
在反应器运行期间,每2—3 d采集反应器出水1次并测定水质指标:NO3–-N、NO2–-N、TFe,测定方法参考国家环保总局颁布的水和废水监测和分析方法,TOC和TN采用总有机碳测定仪进行测定。
-
在反应器连续运行的第30天和第60天,对反应器内滤料表面生物膜进行取样,在8000 r·min−1下离心5 min,使用Fast DNA Soil Kit(MP Biomedicals,CA,USA)将离心后的生物质用于DNA提取。对提取得到DNA产物采用Nanodrop分光光度计进行纯度和浓度的测定,符合要求后送至上海美吉生物医药科技有限公司进行琼脂凝胶电泳检测、PCR扩增、扩增纯化和测序,其中PCR扩增区域为16S rRNA基因V3-V4区域,所用的正向引物序列为341F (CCCTACACGACGCTCTTCCGATCTG),反向引物序列为805R(GACTGGAGTTCCTTGGCACCCGAGAATTCCA)。
-
对1.7节中提取得到的DNA样品进行实时荧光定量PCR(qPCR)扩增,选取微生物反硝化脱氮过程中氮素转化的重要基因:硝酸盐还原酶(nitrate reductase, narG)、周质硝酸盐还原酶(pericytic nitrate reductase, napA)、亚硝酸盐还原酶(nitrite reductase, nirK和nirS)和一氧化二氮还原酶(nitrous oxide reductase, nosZ)。在NCBI数据库中搜索并确定各基因片段序列,并委托上海捷瑞生物工程有限公司进行质粒标准品及正反引物的构建,根据质粒标准品绘制标准曲线,并计算出各功能基因的拷贝数进行分析[22]。实验过程设计的引物序列、基因片段长度和扩增实验条件见表3.
-
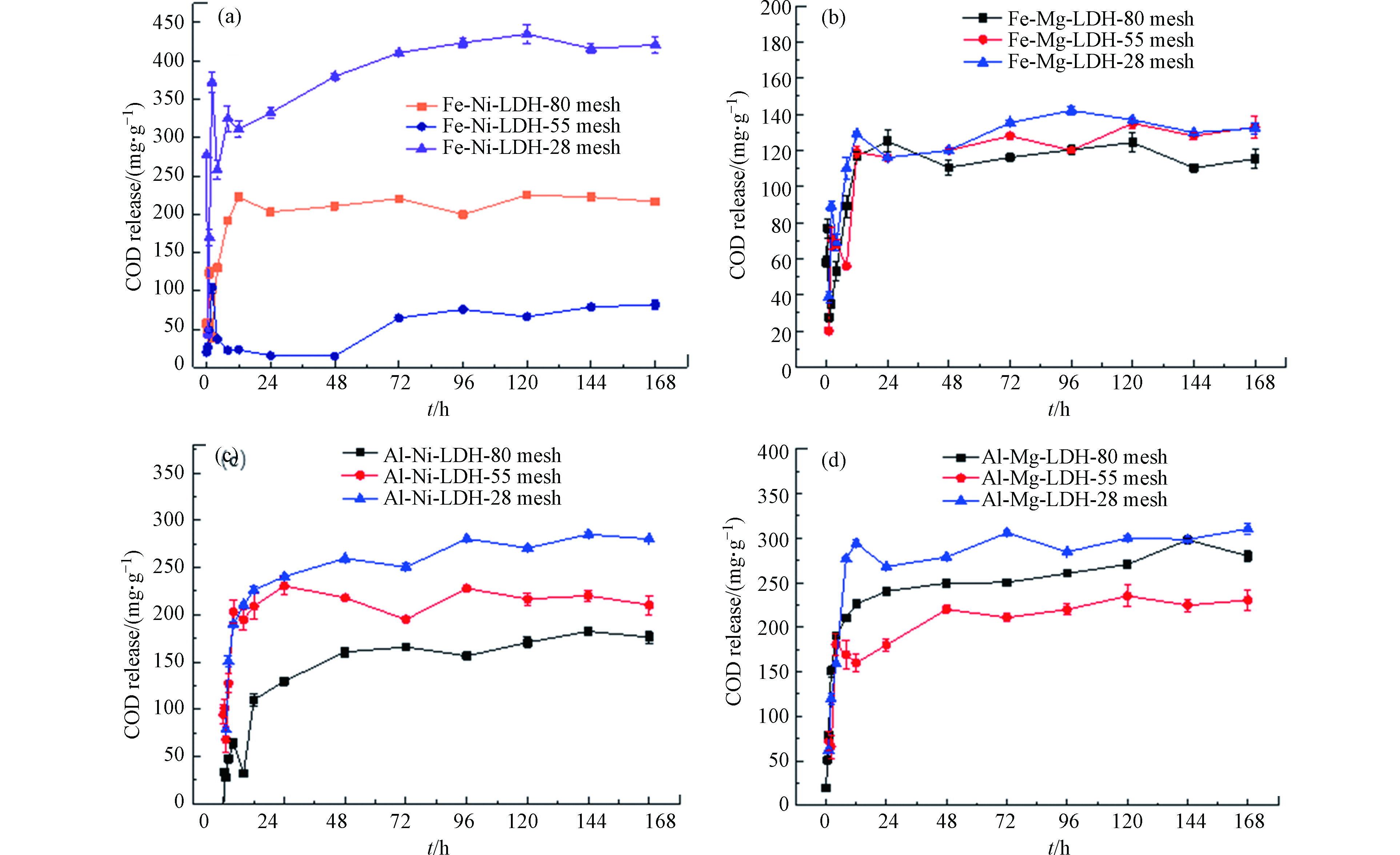
对制得的FeNi-LDH-CMC、FeMg-LDH-CMC、AlNi-LDH-CMC和AlMg-LDH-CMC等4种缓释碳源进行释碳性能研究,比较不同种类、不同粒径的缓释碳源之间的差异。结果如图3所示。从图3可知,缓释碳源的粒径对释碳性能有一定的影响,且不同金属种类合成的碳源,存在较大差异。
释碳量最大的碳源材料是28目的FeNi-LDH-CMC,其最大COD释放量为(420.36±5.36) mg·g−1;对于FeMg-LDH-CMC碳源,其释碳量随粒径的改变并不明显变化,最大COD释放量在(115.32—136.94) mg·g−1。在实验涉及到的范围内,AlNi-LDH-CMC碳源粒径越大,释碳量越大;对于FeNi-LDH-CMC、AlMg-LDH-CMC这两种碳源,释碳量均存在28目>80目>55目的规律。这与Jiang等[15]的结论不一致,可能是因为对于含铁的层状双金属碳源,Ni2+和Mg2+对其晶型结构的改变情况不同。
通过对比不同碳源的释碳量及缓释速率可知,最优碳源28目的FeNi-LDH-CMC碳源,其释碳能力最强,且释碳速率较为缓慢。这可能是因为Fe3+的电负性高于Al3+,Ni2+的电负性高于Mg2+,金属阳离子和阴离子之间的静电吸引力总是随着金属电荷密度的增加而增强,故FeNi-LDH-CMC碳源的正电荷密度高于其他离子,其中的Fe3+与Ni2+之间静电吸引力最大,结构更稳定,缓释速率也最慢[15]。
-
FeNi-LDH-CMC、AlMg-LDH-CMC、AlNi-LDH-CMC、FeMg-LDH-CMC等4种缓释碳源和CMC的XRD和XPS如图4和图5所示。
XRD研究了缓释碳源的结晶特征。CMC在20°处有峰,而4种碳源均无,说明CMC与金属离子并非简单的混合,而是进行了晶态结合。FeNi-LDH-CMC、AlMg-LDH-CMC、AlNi-LDH-CMC的 3种碳源晶态良好,FeMg-LDH-CMC碳源未观察到明显的峰,说明结晶状态不好,结构不稳定,这也解释了在实验周期内其释碳速率较快,且释碳量随粒径变化不大。碳源材料AlNi-LDH-CMC与AlMg-LDH-CMC的图谱类似,峰数一致,而峰值有所差异,说明在同一种金属阳离子存在时,阴离子对晶体的结构仅表现在峰值,而不影响特征峰。
表4所示为根据XPS数据计算出的4种碳源材料中主要元素含量,AlNi-LDH-CMC、AlMg-LDH-CMC、FeNi-LDH-CMC、FeMg-LDH-CMC的4种碳源由于掺杂了金属元素,其含碳量(25.1%、21.18%、33.14%、33.33%)均低于CMC(53.39%),FeMg-LDH-CMC碳源的碳元素相对含量最高,FeNi-LDH-CMC碳源略低。值得关注的是,根据实验设计,投加的三价与二价金属物质的量之比为2:3,而FeNi-LDH-CMC碳源中,元素Fe与Ni的物质的量之比约为0.38:1,其余碳源三价与二价金属元素比例均小于1:10,仅FeNi-LDH-CMC碳源中三价与二价金属的物质的量之比最接近实验设计投加的比例,说明FeNi-LDH-CMC碳源中金属离子利用率更高,结合更紧密,结构更稳定,也进一步证明了其良好的缓释性能。故本实验采用FeNi-LDH-CMC碳源材料制备LDHs基缓释碳源,用于反硝化滤池处理低碳氮比废水。另外,4种碳源的氧含量均大于CMC,可能是由于层状双金属结构之间存在大量羟基[12]。
-
响应面实验结果见表5,软件拟合的方程式为:K=30.51950−1.58888×PVA−4.59338×LDH−9.92300×CMC−0.076875×PVA×LDH−0.98500×PVA×CMC+0.32000×LDH×CMC+0.39681×PVA2+0.29431×LDH2+5.57900×CMC2。其中,K代表释碳系数;PVA、LDH、CMC分别代表PVA、FeNi-LDH-CMC、CMC的质量分数。
由图6可知,在某个因素不变的情况下,其它两个因素的交互作用对释碳系数K的影响。
图6(a)中,当CMC质量分数为1%时,随着FeNi-LDH-CMC碳源质量分数和PVA的升高,K值先减小后增大,存在最佳的含量值;图6(b)中,随着CMC质量分数的增加,释碳系数K呈现先降低后升高的规律,说明CMC也存在一个最佳浓度;由图6(c)可知,释碳系数K随FeNi-LDH-CMC碳源的质量分数变化不大。因为PVA的用量影响着载体本身的强度和牢固程度,超过最佳浓度后由于PVA本身密度增大,导致孔隙变小,固定CMC的量减少,释放变快。同时,由于CMC与交联剂溶液中的氯化钙发生交联反应,能够增强材料的强度,对材料的牢固程度有影响,最佳浓度时材料的释碳阻力较大,释碳过程更缓慢[23]。
由响应面软件模拟结果可知,当PVA、CMC和FeNi-LDH-CMC碳源的质量分数分别为4.02%、1.02%、7.77%时,K值最小,为4.40,由实际实验验证,此时LDHs基缓释碳源最大COD释放量为320.96 mg·g−1,接近FeNi-LDH-CMC碳源材料的最大COD释放量。
-
各反应器对有机物(以TOC计)、总氮(TN)、NO3–-N、NO2–-N的去除效果如图7所示。由于LDHs基滤料的投加,R2反应器的TOC值(>40 mg·L−1)明显大于R1(<20 mg·L−1)。且R2中出水TN明显低于R1(P<0.05),说明LDHs基滤料投加后,促进了异养反硝化菌的反硝化作用[24]。LDHs基滤料的投加使TN去除率提高了35.32%—38.46%(P<0.05),一方面,LDHs基滤料投加使得反应器中的有机碳含量升高,促进反硝化作用,另一方面,LDHs基滤料中的碳源中含有少量的Fe3+,对反硝化也起到了一定的促进作用。在HRT为6 h时,投加LDHs基滤料之后,出水TN可达中国污水排放一级A标准(≤15 mg·L−1)。在HRT为3 h时,R2中反应器出水的TN并未随HRT的改变而产生很大波动,说明投加LDHs基滤料之后,异养反应器的受冲击能力更强。在HRT为3 h时,由图7(c)和(d)可知,出水的NO3−-N与TN的波动较为同步,同时说明普通异养反应器TN去除率较低,关键在于NO3−-N并未去除。所有反应器的NO2−-N基本在10 mg·L−1以内波动,且在R1中最高,这是因为废水中碳源较低容易导致反硝化不完全,进而造成亚硝酸盐的累积[25]。在HRT变为3 h后,R1出水中NO2−-N进一步提高,而投加缓释碳源的R2反应器NO2−-N并没有明显变化,反硝化效果较为稳定。
反硝化生物滤池稳定阶段的出水水质及氮负荷如表6所示,在HRT为3 h时,LDHs基滤料的投加使反硝化滤池氮负荷提高了(0.118±0.0092)kg·m−3·d−1 N,氮负荷最大为(0.2140±0.001) kg·m−3·d−1 N,通过对比各反应器不同HRT时的氮负荷可知,HRT的缩短引起氮负荷的升高,但氮负荷并非计算公式中的成倍增加,说明HRT的缩短对反应器具有一定的冲击,一定程度上限制了反硝化效率[26]。在反硝化生物滤池中,投加LDHs基滤料可明显提高氮负荷,可能是由于LDHs基滤料缓释出的有机碳被异养反硝化菌利用,促进了异养反硝化菌的活性,提高了系统反硝化性能[27]。
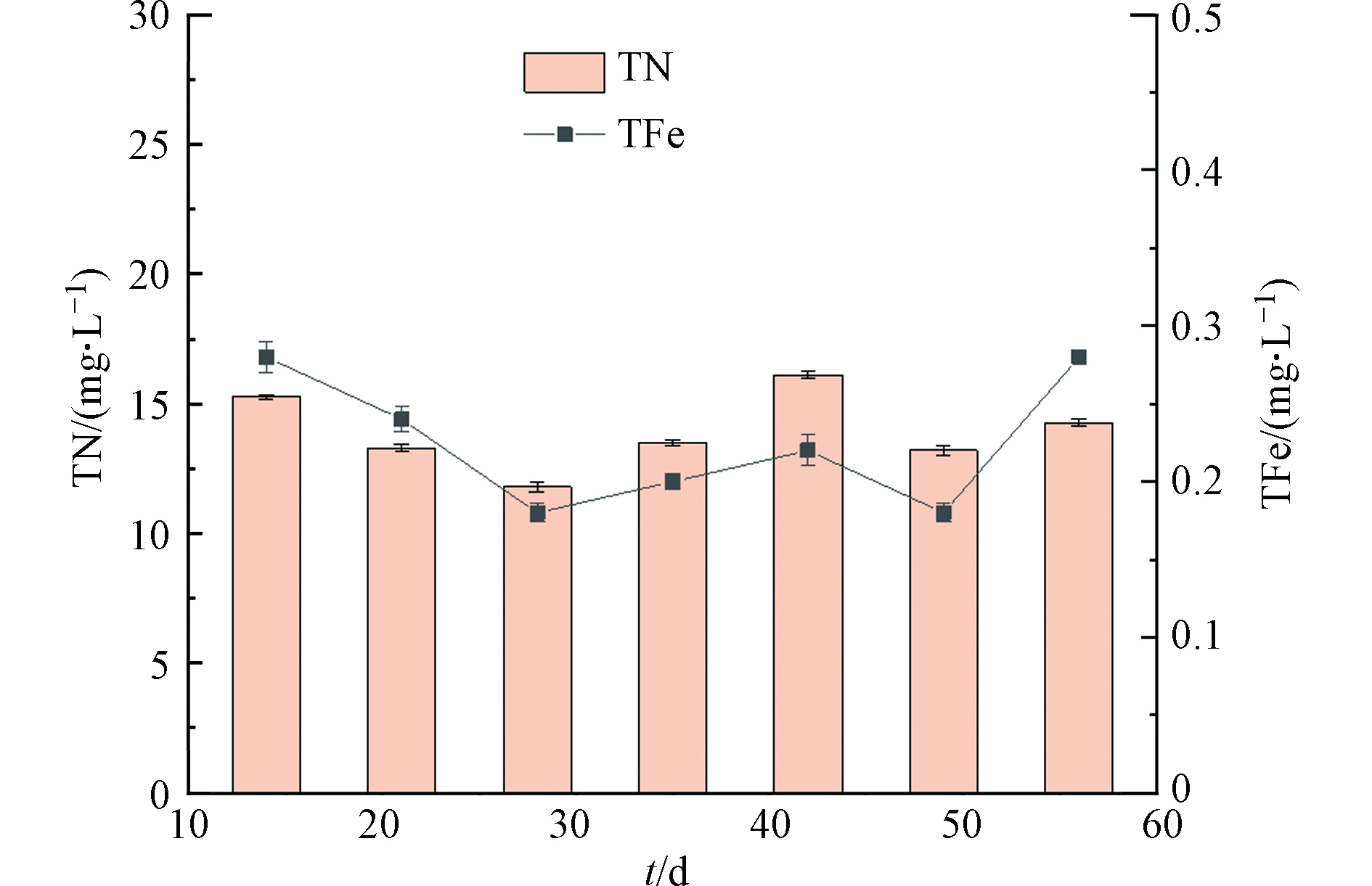
对各反应器出水的总铁(TFe)和TN进行了显著性差异分析,结果如图8所示。TFe与TN的Pearson相关系数为0.575,P=0.177>0.05,说明在LDHs滤料投加的反硝化滤池中,TFe的释放促进反硝化作用,提高TN的去除率,但是影响不显著。各反应器的出水中TFe浓度均低于0.3 mg·L−1,满足城市污水再生利用标准(GB/T 18920—2020,GB/T 19923—2005)。
-
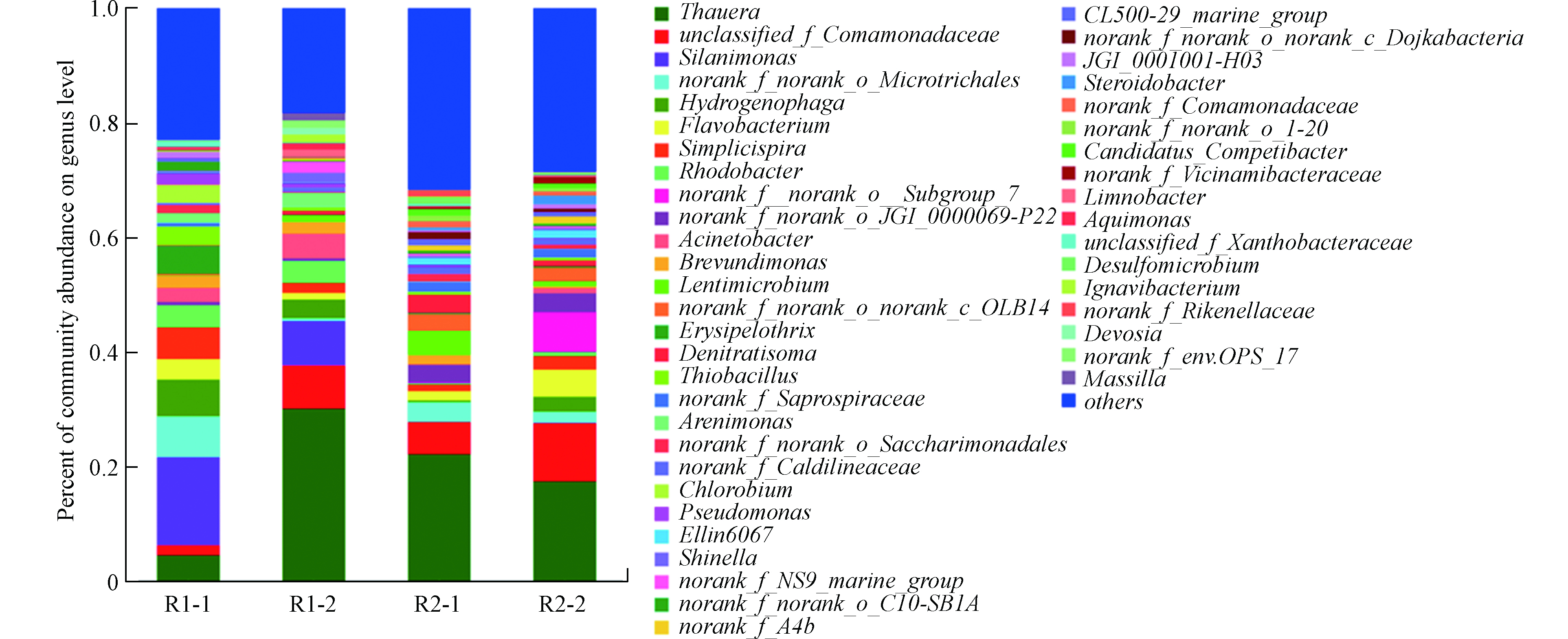
采用16S rRNA基因测序分析了生物膜的微生物结构,结果表明在反应器之间存在明显差异。其结果如图9所示。
在属水平上,Thauera和unclassified_f_Comamondacea是异养反硝化滤池中的主要菌属,但Silanimonas仅存在于R1,且丰度范围在8%—15.3%。其中Thauera属于Betoproteobacteria门,是能在有氧条件和厌氧条件生存并进行反硝化的菌属[28]。R2中的Simplicispira最高可达5.5%,Rhodocyclaceae丰度为11.8%。其中Simplicispira为一种固相反硝化菌,很容易使用生物聚合物作为碳源[29]。Rhodocyclaceae是一种异养反硝化菌,且被发现在聚己内酯固相反硝化滤池中[30]。两者均受投加的LDHs基滤料相关。因此,两者可能为降解LDHs基滤料中PVA的功能菌。Silanimonas和Hydrogenophaga的丰度均明显受HRT的影响,随着HRT的缩短,其丰度明显下降(P < 0.05),可能是因为其易受冲击负荷的影响。
-
为了进一步探究LDHs基滤料对反硝化作用的影响,对主要的反硝化功能基因napA、narG、nirS、nirK和nosZ进行测定,结果如图10所示。
napA和narG反硝化过程中编码硝酸盐还原酶的主要基因[31]。结果表明,随着HRT的缩短,两种基因的丰度有所降低。但当HRT为6 h时,LDHs基滤料的投加明显提高了两种基因的丰度(P<0.05),且napA基因的丰度超过对照组的2倍。当HRT为3 h时,LDHs基滤料的投加明显提高了narG基因的丰度(P<0.05),而napA基因的丰度变化不明显。且通过Pearson相关性分析,出水的TFe与基因narG的丰度呈显著正相关(P<0.05),说明LDHs基滤料溶出的TFe有利于硝酸盐的还原,进一步促进反硝化作用。
亚硝酸盐还原酶编码基因nirS和nirK基因都被认为是反硝化过程中亚硝酸盐还原的标志物[32],在反硝化生物滤池中,LDHs基滤料的投加明显提高了这两种基因的丰度(P<0.05)。nirK基因丰度在105—106 copies·µg−1 DNA水平,而nirS的基因丰度在104—105 copies·µg−1 DNA水平,这表明nirK基因的表达可能在亚硝酸盐还原中起更加关键的作用,并且能更有效地促进反硝化的另一关键过程——NO气体的产生[33]。已有的研究表明,废水处理工艺中微生物的nirS基因一般比nirK基因更加丰富[32, 34],但nirK型反硝化细菌对环境的剧烈波动具有更好的耐受性,例如受氧和pH的波动影响不大[35].
一氧化二氮还原酶编码基因(nosZ)是气态氮还原过程中的主要功能基因[36],在反硝化滤池中,其丰度均保持在105 copies·µg−1 DNA。作为整个反硝化过程的最后一步,nosZ基因在反硝化途径中起着重要作用。综合考虑以上5种基因丰度的变化,在投加LDHs基滤料后,这五种基因的拷贝数均有明显增加(P<0.05),说明滤料的投加在一定程度上有利于反硝化功能基因的富集,从反硝化的各个阶段提高脱氮效率。
为了综合分析LDHs基滤料添加的反硝化生物滤池深度脱氮机理,对反硝化滤池稳定运行期间出水水质、微生物群落结构以及运行条件进行了相关性分析,结果如图11所示。
其中“C”代表LDHs基滤料的投加。可以看出LDHs基滤料的投加与TN和Silanimonas负相关,说明LDHs基滤料添加有利于去除TN,但不利于Silanimonas的生存,HRT对TN的去除没有做出太大的贡献。为了进一步确定主要的相关细菌,去除TN和LDHs基滤料投加的关系,应用Pearson相关分析法研究了它们之间的相关性。C与norank_f_norank_o_JGI-0000069-P22和norank_f_norank_o_norank_c_OLB14呈正相关(P < 0.05),说明LDHs基滤料投加可能通过促进norank_f_norank_o_JGI-0000069-P22和norank_f_norank_o_norank_c_OLB14的生长提高对TN的去除率。
-
本研究率先选用CMC用于制备基于层状双金属化合物的缓释碳源,并通过释碳性能及化学表征筛选出最佳碳源FeNi-LDH-CMC用于LDHs基滤料的制备,确定了LDHs基滤料的最佳配比并进行实验室规模反硝化滤池深度脱氮应用和机理研究,验证了LDHs基滤料在反硝化生物滤池中的可行性,具有较强的应用推广场景。研究主要结论如下:
(1) 选用Fe3+、Al3+、Mg2+、Ni2+等金属离子为正电子来源,并率先选用CMC作为负电离子来源,通过共沉淀法制备出4种碳源,其中FeNi-LDH-CMC碳源释碳能力最强,COD释放量最大为(420.36±5.36) mg·g−1,且释碳速率较为缓慢、结构稳定、金属离子利用率高,可作为后续制备释碳滤料的碳源;
(2) 确定了FeNi-LDH-CMC碳源、PVA、CMC的最佳配比质量分数分别为7.77%、4.02%、1.02%,此时制备的LDHs基滤料的最大COD释放值为320.96 mg·g−1,缓释碳源系数K=4.40;
(3) LDHs基滤料使反硝化滤池的TN去除率提高了35.32%—38.46%,脱氮负荷最大提高到(0.2140±0.001) kg·m−3·d−1 N,表明LDHs基缓释碳源可提高反硝化滤池低碳氮比废水深度脱氮效果,具有较强的推广应用前景。
(4) 溶出的TFe与基因narG的丰度呈正相关(P<0.05),且在投加LDHs基滤料后,5种反硝化功能基因的丰度均明显增加(P<0.05),从反硝化过程的各个阶段提高脱氮效率。
新型LDHs基缓释碳源的制备及应用
Preparation and application of a novel LDHs-based slow-release carbon source
-
摘要: 以羟甲基纤维素钠(CMC)为负电离子,选用4种金属离子(Fe3+、Al3+、Ni2+、Mg2+),以共沉淀法制备4种基于层状双金属化合物(LDHs)的缓释碳源材料。采用X射线衍射(XRD)、X射线光电子能谱(XPS)和缓释性能分析,筛选出释碳量大、稳定缓释的FeNi-LDH-CMC碳源材料。通过响应面实验确定了FeNi-LDH-CMC、聚乙烯醇(PVA)、CMC的最佳质量分数为7.77%、4.02%、1.02%,此时制备的LDHs基滤料释碳系数为4.40,最大COD释放值为320.96 mg·g−1。最后构建反硝化生物滤池,对模拟低碳氮比废水进行脱氮处理。结果表明,HRT=3 h时,反硝化滤池对TN平均去除率仅为32.4%,氮负荷为(0.0960±0.0082)kg·m−3·d−1 N,而投加LDHs基滤料使滤池TN去除率提高了35.32%—38.46%,氮负荷提高了(0.118±0.0092)kg·m-3·d−1 N;在投加LDHs基滤料后,5种反硝化功能基因(napA、narG、nirS、nirK、nosZ)的丰度均有显著增加(P<0.05),提高了反硝化的各个阶段脱氮效率。研究结果表明LDHs基缓释碳源在反硝化滤池中可强化低碳氮比废水深度脱氮,是一种潜在应用于废水深度脱氮的新型材料。
-
关键词:
- 羟甲基纤维素钠(CMC) /
- 层状双金属化合物(LDHs) /
- 缓释碳源 /
- 深度脱氮
Abstract: This study took the lead in using sodium hydroxymethyl cellulose (CMC) as the negative ion and four kinds of metal ions (Fe3+, Al3+, Ni2+ and Mg2+) to prepare layered bimetallic compounds (LDHs)-based slow-release carbon source materials by coprecipitation method. FeNi-LDH-CMC with the charecteristics of large amount and stable slow-release of carbon was screened out through X-ray diffraction (XRD), X ray photoelectron spectroscopy (XPS) and slow-release performance analyses. The optimum mass fraction of FeNi-LDH-CMC, polyvinyl alcohol (PVA) and CMC was determined as 7.77%:4.02%:1.02% by response surface experiment, to achieve the carbon release coefficient of 4.40 and the maximum chemical oxygen demand (COD) release of 320.96 mg·g-1 of the prepared LDHs-based filter media. Finally, denitrification biological filter was constructed for denitrogenation of synthetic wastewater with low C/N ratio. Results showed that under HRT of 3 h, the average removal rate of total nitrogen (TN) was only 32.4% and the nitrogen load was (0.0960±0.0082) kg·m-3·d-1 N. By contrast, TN removal rate and nitrogen load were increased by 35.32%—38.46% and (0.118±0.0092) kg·m-3·d-1 N, respectively, after the addition of LDHs-based filter media. The abundances of five denitrifying functional genes (napA, narG, nirS, nirK and nosZ) were also significantly increased (P<0.05), which improved the denitrogenation efficiency at each stage of denitrification. It demonstrated that LDHs-based slow-release carbon source could strengthen the deep denitrogenation of wastewater with low C/N ratio in denitrification biological filter, and could be employed as a potentially novel material for advanced denitrogenation of wastewater. -
湿地作为陆地生态系统与水生生态系统之间过渡的独特生态系统,在维持生物多样性、降解污染物、调蓄洪水等方面发挥着重要的生态功能[1-2]。近年来,随着围湖垦殖、造塘养鱼、水资源过度耗用、建设用地开发侵占、填海造陆等掠夺性开发,湿地己成为全球受威胁最为严重的自然生态系统之一[2-5],其中最主要的原因就是将湿地垦殖成农业用地或被开发用于其他目的[6-7]。湿地退化会造成湿地生物多样性受损、环境恶化,威胁到区域生态安全与可持续发展[1,8],受损湿地的恢复,是保障区域社会经济发展和保护生物多样性的必由之路。
受损湿地生态系统的修复和恢复,既可以依靠生态系统本身的自控能力进行自然恢复,也可以依靠人工调控工程进行强化修复[9-10]。早期的湿地修复多以人工强化修复为主,近年来多采用人工重建与自然修复相结合的手段[11]。20世纪60年代,欧美国家已开展湿地恢复工作[12]。2000年,美国联邦政府通过了《大沼泽湿地恢复综合规划》[13-14],对南佛罗里达大沼泽湿地进行生物多样性保护、水质改善、沟渠河道修复。我国滨海湿地生态修复工作起步较晚,早期研究多集中在退化湿地修复的基础理论研究[9]。近年来开始关注不同恢复方式对湿地的影响。周远刚等[15]以黑河中游地区张掖国家湿地公园为研究对象,比较了自然恢复方式和人工恢复方式下植物多样性和营养盐的变化特征;杨文军等[16]基于自然恢复湿地、人工恢复湿地、人工重建湿地和自然湖泊湿地等4个对照区,对南滇湿地修复效果进行了评价。退塘还湿近年来已经成为水体滨岸带湿地生态修复的重要举措。云南省高原湖泊异龙湖在2010年即大规模退塘还湖600 hm2[17];“十三五”时期,海南出台《海南省湿地保护条例》,开展湿地保护专项行动,共退塘还湿 2 933 hm2[18]。但总体来说,我国湿地修复技术研究仍然较为薄弱,尚缺乏定量化的工程实施要求[19-20],未形成相对完善的湿地标准或规范,因而对于退塘还湿、退林还湿等具体生态修复工程实施难以进行工程化指导。
天津位于海河流域下游,历史上坑塘洼淀众多,具有丰富的湿地资源,但近几十年来受开发利用影响,湿地面积萎缩、湿地生态退化。为有效遏制湿地退化趋势,天津市2017年制定了《天津市湿地自然保护区规划》等“1+4”规划[21],拟通过污染整治、湿地恢复与修复、生态移民、土地流转、护林保湿等任务,推动全市4大湿地保护与恢复。本研究依托七里海古海岸与湿地国家级自然保护区内的湿地修复工作,选择典型腾退渔塘进行退塘还湿技术研究,通过比对人工强化修复与自然保育2种手段下退塘还湿生态修复的效果,筛选退塘还湿生态修复策略与技术方法,以期为类似生态恢复工程提供参考。
1. 材料与方法
1.1 研究区概况与修复方案
本研究选择天津市七里海湿地核心区内的腾退鱼塘作为研究区域,开展修复实验。七里海湿地地处天津市宁河区西南部,中心位置在北纬39°17′,东经117°47′,分布在表口、七里海、淮淀、潘庄、造甲城等5个乡镇,总面积95 km2,其中核心区56.5 km2。七里海土地利用类型[22]主要包括耕地、城镇建设用地、农村居民点、水库水面、养殖水面、河流水面、草地。2019年,在七里海湿地核心区选择40 000 m2腾退渔塘区域作为退塘还湿实验区,参考南滇池国家湿地公园湖滨带鱼塘湿地恢复做法[16],采用去除塘堤、连通外部水体的手段进行恢复,并对塘内部分区域进行塘泥清挖、异位堆存,将原有鱼塘进行地形重构,使其形成高低有致、适宜不同湿地动植物生存的连续地貌环境。在高程−0.5~1.5 m内,将实验区分为深水区、浅水区、湿生区3种区域,并进行人工强化恢复与自然保育修复分区(面积各约50%)。
①高程-0.5~0.5 m 区域:为深水区,水深保持在0.5~1.5 m,以恢复沉水植物为主,兼有浮水植物恢复,如菹草、黑藻、荇菜等。
②高程0.5~1.0 m 区域:为浅水区,水深保持在0~0.5 m,以恢复挺水植物为主,如芦苇、香蒲等。
③高程1.0~1.5 m 区域:为湿生区,以恢复湿生植物为主,主要种植物芦苇及湿生杂草等。
对于湿生植物恢复,人工强化恢复实验分区内设计了平行的3处(分别为P1、P2、P3),自然保育对照分区为A1;对于水生植物恢复,人工强化恢复实验分区内设计了平行的3处(分别为T1、T2、T3),自然保育对照分区为A2。退塘还湿实验区布局见图1,不同分区植物恢复方式见表1。
表 1 退渔还湿实验不同分区植物恢复方式Table 1. Plant restoration methods in different zones of the study area of returning pond to wetland湿生植物恢复实验区 水生植物恢复实验区 分区 恢复方式 分区 恢复方式 P1 芦苇,5棵∙m−2 T1 浅水区:芦苇,10棵∙m−2;深水区:菹草,10棵∙m−2 P2 芦苇,5棵∙m−2 T2 浅水区:香蒲,5棵∙m−2;深水区:黑藻,10棵∙m−2 P3 芦苇,5棵∙m−2 T3 浅水区:芦苇+香蒲,各5棵∙m−2;深水区:荇菜,1棵∙m−2 A1 自然封育对照 A2 自然封育对照 1.2 监测调查方法
2019年6月—2020年8月,对不同分区生态修复过程进行了跟踪监测,从高等植物、浮游动植物及底栖动物、土壤微生物等3方面分别在人工强化修复与自然保育修复分区进行了监测点位布设。每间隔2个月左右(冬季除外),对湿生植物、浮游动植及底栖动物和土壤微生物(真菌)的种类、密度、生物量及多样性开展周期性监测。
湿地植物恢复区以及浅水区的高等植物调查采用样方法,每个实验分区设置4~5个1 m×1 m调查样方,依据《中国植物志》[23]、《中国高等植物图鉴》[24]等进行鉴定;在湿生植物恢复区,对植物地上部分收割后现场称重,获取高等植物地上生物量。高等植物调查日期为2019年6月、8月、10月,2020年4月、5月、7月。
每个水生植物恢复实验分区设置一个浮游动植物和大型底栖动物调查样点(分别为D0、D1、D2、D3),并在实验区外的自然河沟中设置一处对比样点DR,具体位置见图1。浮游动植物和大型底栖动物样品采集、保存、处理和分析参照《淡水浮游生物研究方法》[25]和《湖泊生态调查观测与分析》[26]等提供的方法。底栖动物采用直接称量法,计算其湿生物量。浮游动植物与底栖动物调查日期为2019年5月、8月、10月,2020年5月、8月。
每个湿生植物恢复区采用梅花布点法设置5个土壤样品采集点位,在每个点位进行表层土壤(0~20 cm)样品采集并带回实验室后处理,先后经过冷冻干燥、DNA提取等流程开展分子生物学分析。土壤样品采集日期同浮游动植物与底栖动物调查日期。土壤/沉积物样品采用Power Soil® DNA Isolation Kit(Mobio,USA)试剂盒提取样品的基因组DNA,所用PCR引物如表2所示。PCR反应采用TransGen AP221-02(TransGen,China)的20 μL体系。PCR扩增程序为:95 °C预变性3 min;然后95 °C变性30 s,55 °C退火30 s,72 °C延伸45 s;最后再72 °C延伸10 min。PCR产物使用AxyPrepDNA凝胶回收试剂盒(AXYGEN,USA)纯化后,用2%琼脂糖凝胶电泳进行检测。Illumina高通量测序委托上海美吉生物医药科技有限公司(http://www.Majorbio.com)在Illumina Miseq PE300平台上完成。在高通量测序序列的OTU数据分析中,采用Mothur(version v.1.30.1)计算各个样品的alpha多样性(包括Shannon多样性、Chao1丰富度和Shannon均匀度等)。
表 2 本实验所用PCR引物及相应反应条件Table 2. PCR primers and corresponding reaction conditions used in this experiment引物名称 引物序列 微生物 退火温度/℃ 循环次数 ITS1F 5'-CTTGGTCATTTAGAGGAAGTAA-3' 真菌 55 35 ITS2R 5'-GCTGCGTTCTTCATCGATGC -3' 1.3 数据分析方法
1)湿生植物、浮游动植物和底栖生物种多样性。采用Shannon Wiener指数(H)、Simpson指数(D)、Margalef(D′)指数和Pielou指数(JSW)进行湿生植物、浮游动植物和底栖生物多样性测度[27]分析,具体计算方法见式(1)~式(4)。
H=−∑si=1PilnPi (1) D=1−∑si=1P2i (2) JSW=H/lnS (3) D′=(S−1)/lnN (4) 式中:Pi=Ni/N,Ni为样方中第i物种的物种个数;N为样方中全部物种的物种个数;S为物种种类数。
2)数据处理。实验数据运用Excel和SPSS 19.0处理,采用单因素方差分析和多重比较检验各指标在不同时间段以及不同植被类型生境中的差异情况。
2. 修复结果与分析
2.1 植物恢复结果
退塘还湿实验结束时,强化恢复区与自然保育区内的高等植物均恢复效果良好,植被覆盖度很高。实验期间强化恢复区与自然保育区共计调查到高等植物81种,其中自然保育区48种、强化恢复区77种。湿生植物恢复实验区内高等植物植物物种数与地上生物量的历次调查结果见表3。由表3可以看出,自实验开始至结束,强化恢复区物种数量均明显高于自然保育区;但无论自然保育区还是强化恢复区,湿生植物恢复实验区内的物种数量都较为稳定,不同时间调查结果差异主要是因为调查样方内的植物物种差异。强化恢复区内湿生植物地上生物量在2019年3次调查数据分别为7.95~61.5 g∙m−2(平均16.6 g∙m−2)、53.2~513.1 g∙m−2(平均133.2 g∙m−2)、26.5~690.0 g∙m−2(平均134.1 g∙m−2);2020年3次调查数据分别为12.7~168.0 g∙m−2(平均55.5 g∙m−2)、76.8~1 600.0 g∙m−2(平均410.4 g∙m−2)、141.5~1 667.5 g∙m−2(平均585.3 g∙m−2)。自然恢复区湿生植物地上生物量与强化恢复区无显著差异。无论是自然恢复区还是强化恢复区,湿生植物地上生物量高的样方均有红蓼生长,该物种植株高大,导致较高的湿生植物地上生物量。
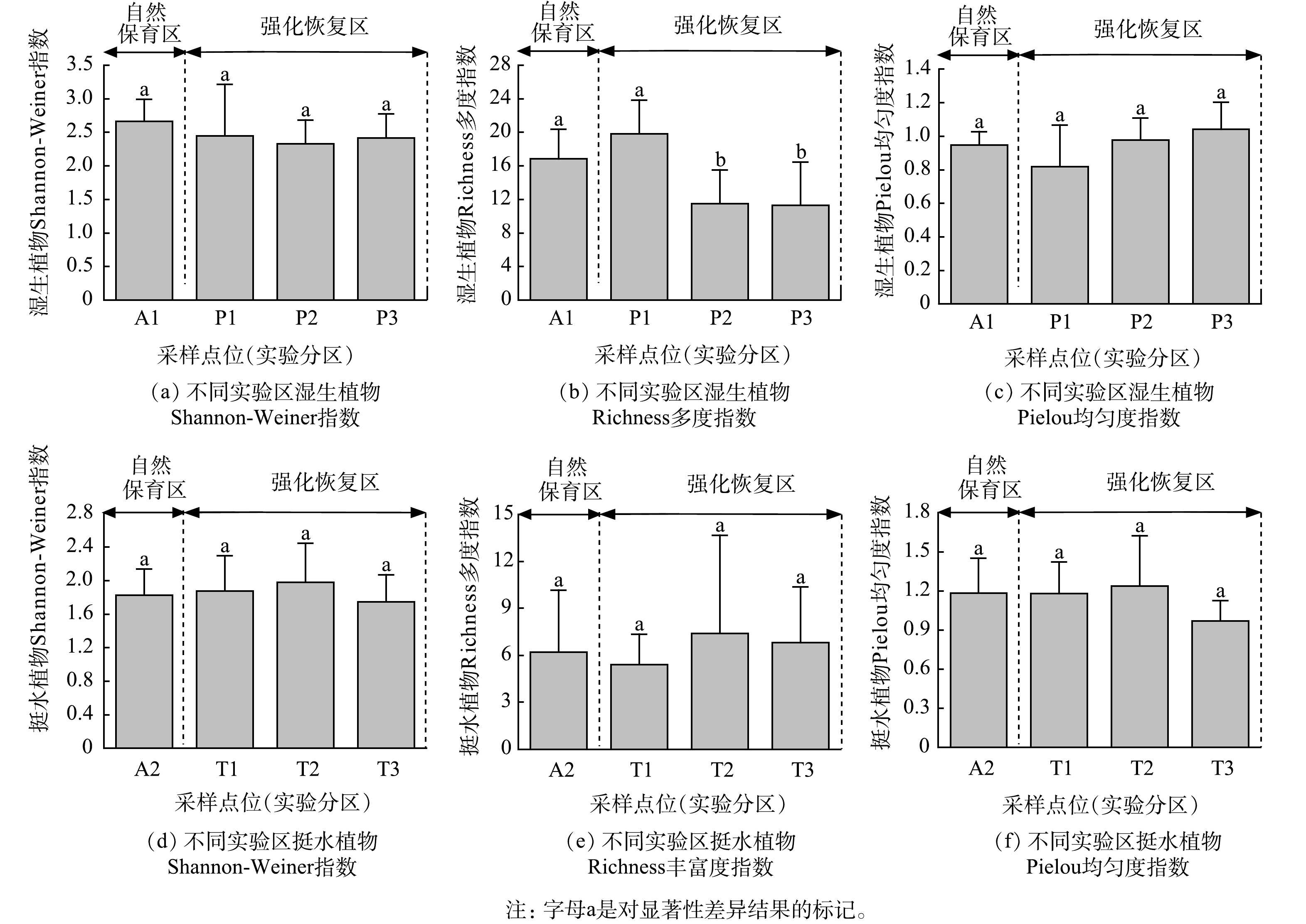
表 3 湿生植物恢复实验区高等植物物种数及生物量时间变化Table 3. Temporal changes of plant species and biomass in wet plant restoration experimental area日期 高等植物物种数 高等植物地上生物量/(g∙m−2) 自然保育区 强化恢复区 自然保育区 强化恢复区 2019-06-04 12 22 7.3 16.6 2019-08-22 22 42 354.9 133.2 2019-10-19 19 28 234.0 134.1 2020-04-27 14 18 51.3 55.5 2020-05-30 17 27 558.6 410.4 2020-07-15 17 26 398.1 585.3 湿生植物和挺水植物在自然保育区与强化恢复区的生物多样性指数方差分析结果见图2。由图2可以看出,自然保育区A1与强化恢复区P1、P2、P3的湿生植物Richness多度指数差异显著(P<0.05)、Shannon-Weiner指数和Pielou均匀度指数差异不显著(P>0.05)。挺水植物自然保育区A2与强化恢复区T1、T2、T3的Shannon-Weiner指数、Richness多度指数及Pielou均匀度指数差异不显著(P>0.05)。
2.2 浮游动植物及底栖动物恢复结果
由2019—2020年调查数据可以看出,浮游植物8门、42属、120种,浮游动物4门、18属、27种,底栖动物3门、6属、13种,浮游动植物及底栖动物的最大物种数量均出现在2020年8月。
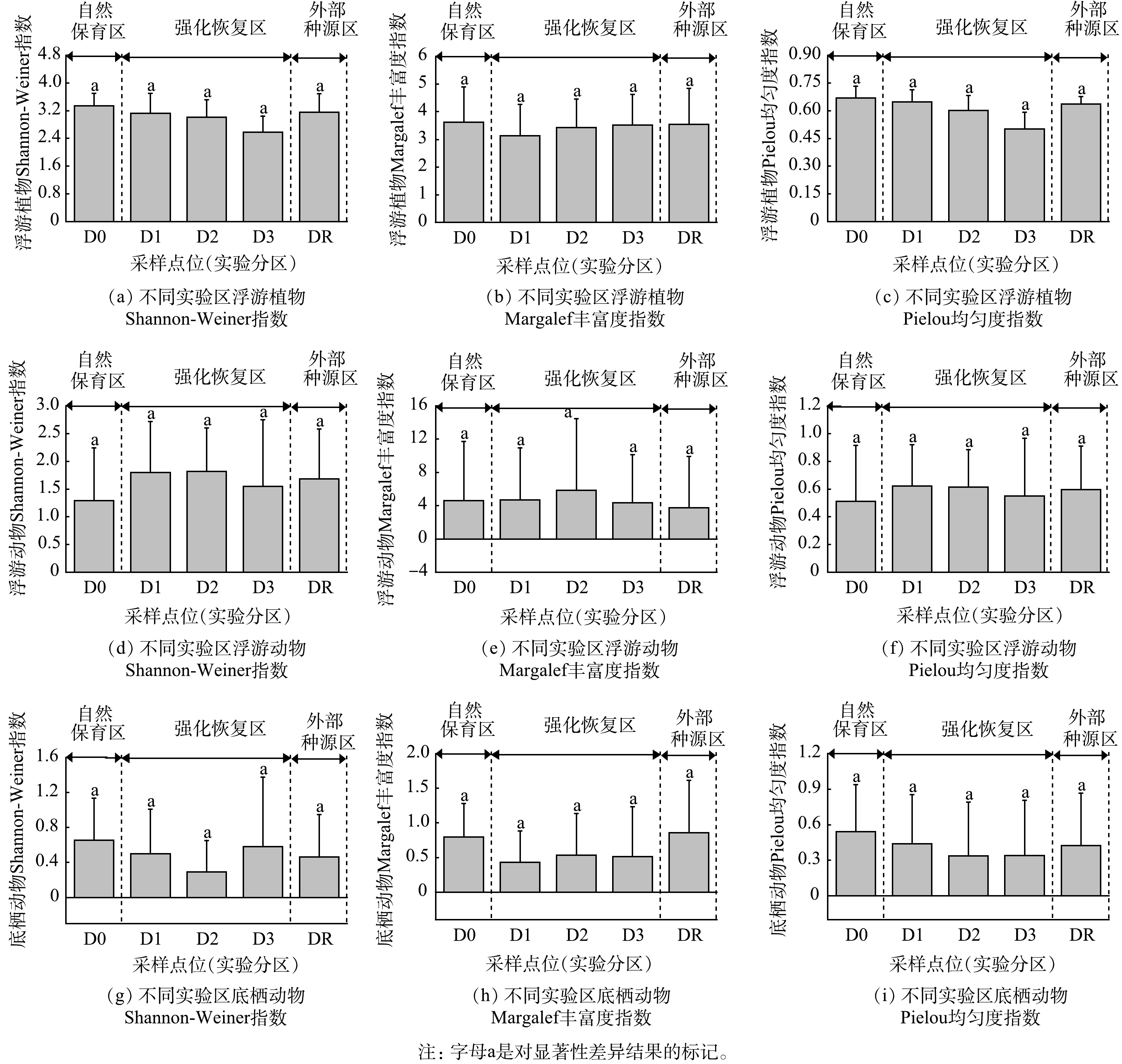
调查期内自然保育区与强化恢复区的浮游动植物及底栖动物的生物密度及生物量调查结果(多点监测均值)见表4、表5。由表4、表5可以看出,自然保育区与强化恢复区的浮游植物、浮游动物在实验期间均未呈现明显变化,但底栖动物则呈现出显著增长。如自然保育区的底栖动物生物密度,2019年5月1日为550 个·m−2,2020年5月1日则增至2 000 个·m−2。
表 4 自然保育区与强化恢复区浮游动植物及底栖动物生物密度时间变化Table 4. Temporal changes in the density of phytoplankton and benthic animals in natural conservation zone and enhanced restoration zone日期 浮游植物/(104 个·L−1) 浮游动物/(个·L−1) 底栖动物/(个·m−2) 自然保育区 强化恢复区 自然保育区 强化恢复区 自然保育区 强化恢复区 2019-05-01 430.00 410.47 7 431.50 29 131.67 550.00 934.00 2019-08-01 450.00 416.58 20 585.00 8 480.00 75.00 31.67 2019-10-01 2 400.00 7 733.33 35 000.00 18 483.67 208.00 53.00 2020-05-01 700.00 1 093.48 38 000.00 29 561.67 2 000.00 2 460.67 2020-08-01 2 242.04 3 497.24 1 200.00 1 757.00 240.00 618.00 表 5 自然保育区与强化恢复区浮游动植物及底栖动物生物量时间变化Table 5. Temporal changes in the biomass of phytoplankton and benthic animals in natural conservation zone and enhanced restoration zone日期 浮游植物/(mg·L−1) 浮游动物/(mg·L−1) 底栖动物/(g·m−2) 自然保育区 强化恢复区 自然保育区 强化恢复区 自然保育区 强化恢复区 2019-05-01 7.19 7.37 53.14 109.90 0.53 5.87 2019-08-01 37.03 22.88 73.25 23.61 1.17 6.04 2019-10-01 7.36 44.63 3.69 9.42 0.15 4.51 2020-05-01 3.53 4.53 6.35 6.75 29.18 26.20 2020-08-01 153.21 80.45 6.77 14.72 13.88 4.22 退塘还湿实验期间,强化恢复区浮游植物、浮游动物及底栖动物的生物多样性指数较为稳定,浮游植物Shannon-Weiner指数、Margalef丰富度指数、Pielou均匀度指数分别为2.58~3.13、3.13~3.53、0.50~0.65;浮游动物Shannon-Weiner指数、Margalef丰富度指数、Pielou均匀度指数分别为1.55~1.82、4.33~5.83、0.55~0.62;底栖动物Shannon-Weiner指数、Margalef丰富度指数、Pielou均匀度指数分别为0.29~0.58、0.43~0.53、0.34~0.44。浮游植物、浮游动物及底栖动物在自然保育区与强化恢复区的生物多样性指数方差分析结果见图3。由图3可以看出,自然保育区与强化恢复区浮游动植物和底栖动物的Shannon-Weiner指数、Margalef丰富度指数、Pielou均匀度指数无显著差异(P>0.05)。
2.3 土壤真菌恢复结果
在时间维度上,真菌群落的alpha多样性表现出较大差异。Sobs丰富度指数和Chao1丰富度指数的第1次(2019年5月分别为1 660和1 870)和第3次(2019年10月分别为1 116和1 359)样品的多样性水平显著高于其他3次,表明土壤真菌群落的丰富度随时间的推移表现出明显的下降趋势。第1次样品的Shannon丰富度指数和Shannon均匀度指数(分别为5.4和0.73)高于其他4次样品多样性水平,其他采样时间未呈现明显变化趋势。
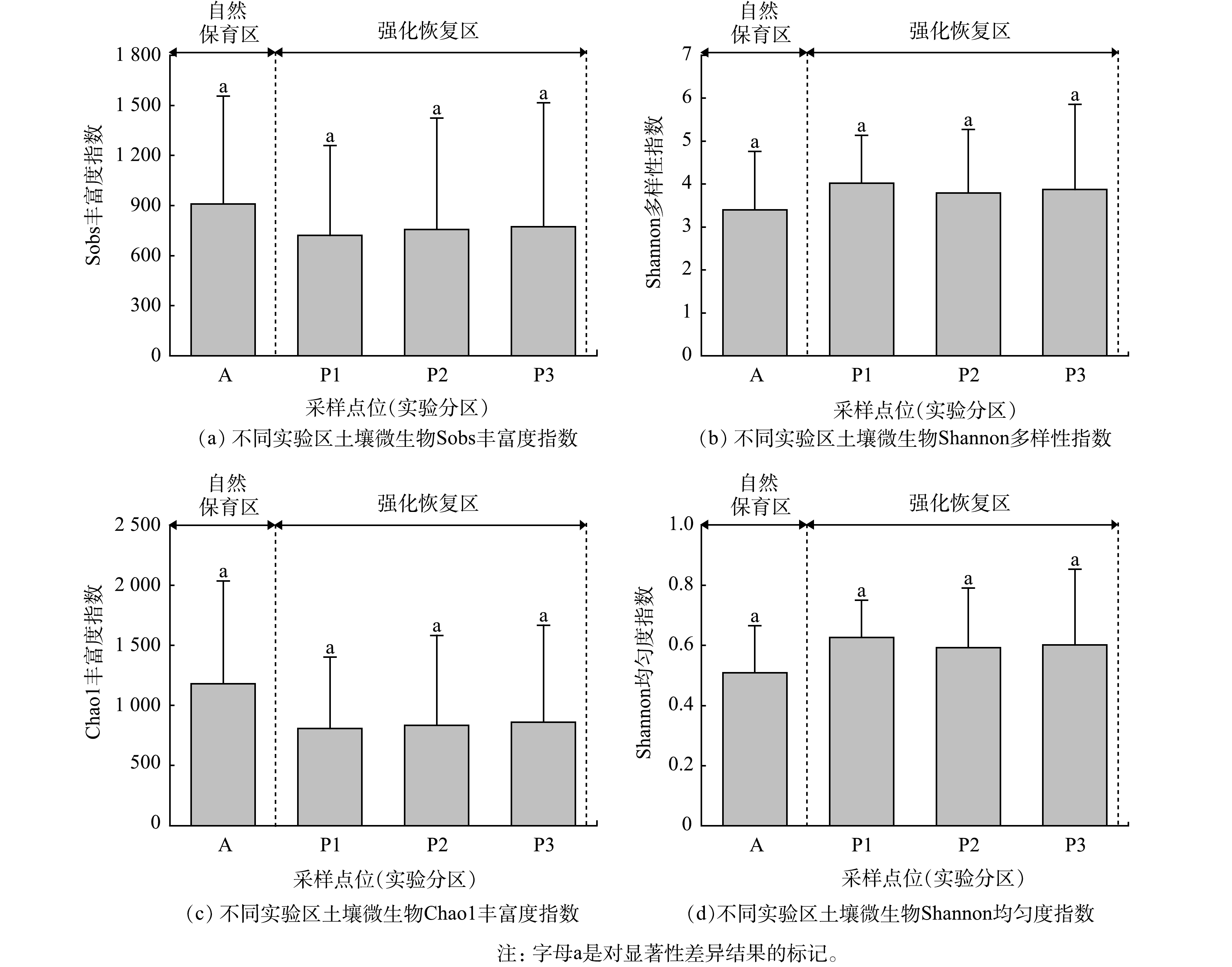
虽然在时间维度上,真菌群落的alpha多样性表现出较大差异;但在空间维度上,4个alpha多样性指数均未表现出显著差异(图4)。A区的Sobs指数为910,P1~P3的Sobs指数为720~774;而A区的Shannon多样性指数为3.4,P1~P3的Shannon多样性指数为3.9~4.0;A区的Chao1丰富度指数为1 180,P1~P3的Chao1丰富度指数为806~860;A区的Shannon均匀度指数为0.51,P1~P3的Shannon均匀度指数为0.59~0.63。这表明不同实验区域土壤真菌的alpha多样性水平相对稳定。
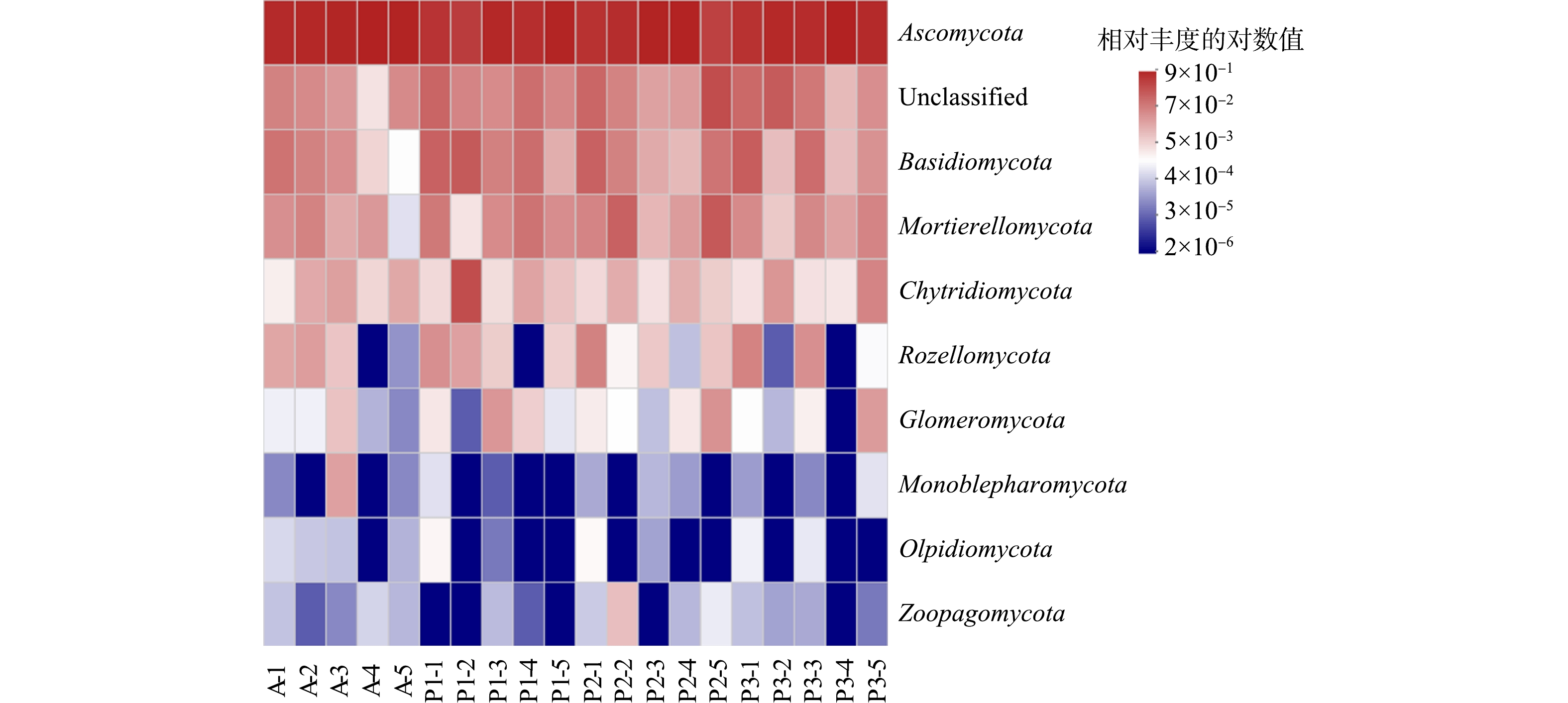
土壤样品中真菌在门水平的组成相对简单,子囊菌门类(Ascomycota)真菌在本研究采集的土壤样品中占据主导地位,其相对丰度达到了39.1%~95.1%。同时有相当部分的真菌属于未分类(unclassified)的真菌门类,其相对丰度达到了0.4%~27.4%。此外,担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)以及壶菌门(Chytridiomycota)真菌门类也在土壤真菌群落中占有一定比例,其相对丰度分别为0.1%~18.8%、0.1%~19.5%以及0.1%~27.5%(图5)。
由不同恢复区土壤真菌群落组成的对比结果可以看出,占绝对优势的真菌门Ascomycota在自然保育区(A区)的相对丰度(85.9%±7.9%)要高于强化恢复区(P1~P3区)(分别为67.8%±16.8%、70.7%±22.7%和76.1%±12.9%),但自然保育区与强化恢复区之间没有显著差别(P>0.05,图6)。
3. 讨论
3.1 植物物种数量及生物量
对于自然生态系统来说,人为干扰通常作为一种负干扰,往往会对生态系统产生负面影响,降低其生物多样性水平。梁炜[28]在物种多样性的研究中发现,不同土地利用类型中人为干扰方式的不同和强度的高低可以造成植物多样性差异。祝林等[29]在南四湖区湿地公园水生植物多样性的研究中发现,人为干扰强度及面积都会对多样性指数产生影响,人为干扰强度小且面积大的区域多样性指数高,人为干扰强度大且面积小的区域多样性指数低。但是对于退化或受损生态系统,人工强化恢复措施则可以是一种正干扰,对生态系统产生正面影响,提高其生物多样性水平。吴迪[30]在上海大莲湖湖滨带湿地修复研究中发现,通过水系沟通、植被配置等方式将养鱼塘恢复成湿地水域,人工修复与自然修复区相比,其植被多样性、景观丰富度、生物多样性乃至水质的恢复效果均较为明显。
但本研究中自然保育区与强化恢复区的湿生植物多样性指数差异均不显著。这可能是因为:该实验区(含强化恢复区与自然保育区)原有鱼塘在进行退塘还湿地形改造前,生长有大量的芦苇及杂草,即使地形重构施工后,土壤中仍保留了大量的芦苇及杂草根茎与种子;同时,该实验区离七里海其他天然湿地距离较近(约200 m),受风媒、虫媒、鸟媒等影响,即使未进行先锋植物种植,自然保育区内依然可以发育多样性较强的植物群落。本实验采取的少数几种先锋植物种植物的恢复方式,不足以令人工强化恢复区在湿地恢复过程中植物多样性与自然保育区产生显著差异。虽然生态系统的修复直至达到平衡是一个缓慢的过程,具有一定的时滞效应[31],短期监测得出的结论还需要进一步跟踪研究[32],但实验前1年半(18个月)的初始阶段未表现出差异,后期显示出差异的可能性就更小。
因此,虽然植物种植通常被作为一种退化湿地的强化恢复手段,如贡湖北岸退渔还湖[33]、滇池湖滨带退塘还湿[16],但从本研究结果来看,对于塘堤原本就有芦苇及杂草生长且距离天然湿地较近的鱼塘退塘还湿,采用自然保育方式生态修复,与进行人工干预的强化恢复相比,在湿生植物、挺水植物、浮游动植物及底栖动物生物多样性等方面差异并不显著,性价比更高。只有当难以实现自然恢复时,再考虑采取人工强化的方式促进生态修复[19]。
3.2 浮游动植物及底栖动物
浮游动植物及底栖生物是生态系统中的重要功能群[34],对湿地生态系统中的环境胁迫具有敏感响应[9,35-36]。王雅雯等[37]在浮游动植物群落结构的研究中发现,种植沉水植物的生态修复区与未修复区相比,浮游动植物多样性差异显著,生态修复区浮游动植物生物量更低、物种数更高。这可能是由于驳岸类型、地形、水深和水生植物覆盖度等因素的不同而造成生境异质性,从而引起浮游生物群落结构的差异性。任葳[9]在退化滨海湿地修复模式研究中发现,底栖动物的物种数及丰富度指数在植被强化恢复区和无植被区差异显著,且均表现为植被恢复区显著高于无植被区。
在本研究中,自然保育区与强化恢复区的浮游动植物及底栖生物的密度及生物量等各项指标,其Shannon-Weiner指数、Margalef丰富度指数、Pielou均匀度指数等均未无显著差异。这主要是因为,本实验区的实验水面北侧均通过狭小沟渠与实验区外河道相连,河道内的鱼类、浮游动植物、底栖动物等均是人工强化恢复与自然保育区同等一致的生物种源;即使在人工强化恢复区进行了浮水、沉水植物种植,但实际上并未产生显著的生境改变。人工强化恢复与自然保育区底栖动物在实验期间均呈现出显著增长,这可能是因为这2个分区都形成了较好的、利于底栖动物生存的栖息地环境。
综上所述,对浅水湿地的修复,可以通过与自然水体联通(构建沟渠)的方式,以自然保育的方式进行修复。
3.3 土壤真菌
土壤真菌是重要的土壤微生物,是土壤中众多生态过程的参与者。本研究中土壤真菌的多样性在不同土壤恢复区间未呈现显著差异。这一结果说明,不同植被类型与恢复方式并不会对土壤真菌产生显著的分异作用[34,38]。而这一结果与以往研究有所不同,例如潘傲等[39]研究了4种植物条件下表面流人工湿地的氮磷平衡以及微生物群落结构,相较于未种植植物的人工湿地,种植植物的表流人工湿地显示出更高的微生物丰富度、多样性。本研究由于是野外实验,野外环境中不同恢复区植物的生长过程不受控制,其对土壤微生物的分异作用进一步被减弱,最终可能导致土壤微生物未呈现出显著差异。这也与真菌群落组成在空间上的变化趋势较为相似,即最占优势的真菌子囊菌门类(Ascomycota)在不同恢复区均未呈现显著差异。而相比之下,恢复过程中土壤真菌的多样性水平更易随恢复时间发生变化。
4. 结论
1)强化恢复区与自然保育区内的高等植物均恢复效果良好,共计调查到高等植物81种,但两区湿生植物与挺水植物的生物量及Shannon-Weiner指数差异均不显著。
2)自然保育区与强化恢复区的浮游植物、浮游动物在实验期间均未呈现明显变化,但底栖动物均呈现出显著增长。两区共计调查到浮游植物8门、42属、120种,浮游动物4门、18属、27种,底栖动物3门、6属、13种,但两区之间浮游动植物和底栖动物的Shannon-Weiner指数、Margalef丰富度指数、Pielou均匀度指数无显著差异。
3)对于塘堤原本就有芦苇及杂草生长且距离天然湿地较近的鱼塘退塘还湿,采用自然保育方式生态修复,与进行人工干预的强化恢复相比,在湿生植物、挺水植物、浮游动植物及底栖动物生物多样性等方面差异并不显著,性价比更高。
-
表 1 响应面实验设计
Table 1. The experimental design of Response Surface Experiment
实验组别Experimental group PVA质量分数/%PVA mass fraction CMC质量分数/%CMC mass fraction FeNi-LDH-CMC质量分数/%FeNi-LDH-CMC mass fraction 1 4.0 1.5 6.0 2 4.0 1.0 8.0 3 4.0 0.5 10.0 4 4.0 1.0 8.0 5 2.0 0.5 8.0 6 6.0 1.0 6.0 7 6.0 0.5 8.0 8 6.0 1.5 8.0 9 4.0 0.5 6.0 10 4.0 1.0 8.0 11 2.0 1.5 8.0 12 4.0 1.5 10.0 13 2.0 1.0 8.0 14 2.0 1.0 6.0 15 6.0 1.0 10.0 16 4.0 1.0 8.0 17 4.0 1.0 8.0 表 2 人工合成废水组分
Table 2. Components of synthetic wastewater
主要组分Essential components 浓度/(mg·L−1)Concentration 微量元素组分Trace element components 浓度/(mg·L−1)Concentration COD 150.0 MgCl2·6H2O 24.0 NO3−-N 50.0 CaCl2·2H2O 24.0 KH2PO4 25.0 ZnSO4 0.4 NaHCO3 250.0 CoCl2·6H2O 0.5 (NH4)6Mo7O24·4H2O 0.5 MnCl2·4H2O 0.3 EDTA-2Na 5.0 表 3 功能基因的引物序列及实验条件
Table 3. Primers of functional genes and corresponding experiment conditions
功能基因Functional gene 引物名称Primer name 引物序列Primer sequence (5′-3′) 退火温度/℃Annealing temperature 基因长度/bpAmplification size nirS nirS-F ATGCAGGAAGCGGGAGGT 54 410 nirS-R TGAAGGAAACGGGCAAGGT nirK nirK583F TCATGGTGCTGCCGCGKGACGG 60 350 nirK909R GAACTTGCCGGTKGCCCAGAC napA napA-F AGCGAGAATGGGCTGTTG 52 152 napA-R TGGACGATGGGCTTCAAC narG narGF TCGCCSATYCCGGCSATGTC 61 173 narGR GAGTTGTACCAGTCRGCSGAYTCSG nosZ nosZ-F TGTCCTTGCCGTCCTTGC 55 392 nosZ-R CGACTGGGTGGTGGTGTTC 表 4 CMC和4种碳源的元素组成
Table 4. Element composition of CMC and four carbon sources
碳源 Carbon sources 元素 Elements 含量/% Percentage composition CMC C1s 53.39 O1s 38.69 Na1s 7.92 AlNi-LDH-CMC C1s 25.10 O1s 48.27 Al2p 18.20 Ni2p 4.35 Cl2p 4.05 AlMg-LDH-CMC C1s 21.18 O1s 51.31 Al2p 11.18 Mg1s 12.18 Cl2p 4.16 FeNi-LDH-CMC C1s 33.14 O1s 55.92 Fe2p 1.96 Ni2p 5.35 Cl2p 3.63 FeMg-LDH-CMC C1s 33.33 O1s 49.50 Fe2p 2.23 Mg1s 11.76 Cl2p 3.17 表 5 各组分含量对K值的影响
Table 5. Effect of each component content on K value
实验组别Experimental group PVA质量分数/%PVA mass fraction CMC质量分数/%CMC mass fraction FeNi-LDH-CMC质量分数/%FeNi-LDH-CMC mass fraction 释碳系数KCarbon release coefficient K 1 4.0 1.5 6.0 5.69 2 4.0 1.0 8.0 4.26 3 4.0 0.5 10.0 7.65 4 4.0 1.0 8.0 4.66 5 2.0 0.5 8.0 5.98 6 6.0 1.0 6.0 7.32 7 6.0 0.5 8.0 8.11 8 6.0 1.5 8.0 6.85 9 4.0 0.5 6.0 7.39 10 4.0 1.0 8.0 4.68 11 2.0 1.5 8.0 8.64 12 4.0 1.5 10.0 7.29 13 2.0 1.0 8.0 7.66 14 2.0 1.0 6.0 6.98 15 6.0 1.0 10.0 6.77 16 4.0 1.0 8.0 4.16 17 4.0 1.0 8.0 4.33 表 6 反硝化生物滤池稳定阶段出水污染物浓度
Table 6. Concentration of effluent contaminants in stable stage of denitrification biofilters
实验组别Experimental group TOC/(mg·L−1) TN/(mg·L−1) NO3−N/(mg·L−1) NO2−N/(mg·L−1) 反硝化负荷/(kg·m−3·d−1 N)Denitrification load R1-1 17.94±0.11 29.82±1.17 16.23±1.76 8.10±3.04 0.0630±0.0030 R1-2 12.73±0.92 33.98±3.84 23.2±2.97 11.03±0.40 0.0960±0.0082 R2-1 38.10±2.96 12.16±1.2 8.50±0.56 2.60±0.31 0.1130±0.0016 R2-2 42.16±1.6 14.26±0.66 9.90±4.30 3.60±1.10 0.2140±0.001 -
[1] HU H D, LIAO K W, SHI Y J, et al. Effect of solids retention time on effluent dissolved organic nitrogen in the activated sludge process: Studies on bioavailability, fluorescent components, and molecular characteristics [J]. Environmental Science & Technology, 2018, 52(6): 3449-3455. [2] CAO S B, DU R, LI B K, et al. Nitrite production from partial-denitrification process fed with low carbon/nitrogen (C/N) domestic wastewater: Performance, kinetics and microbial community [J]. Chemical Engineering Journal, 2017, 326: 1186-1196. doi: 10.1016/j.cej.2017.06.066 [3] 张蕊, 韩志英, 陈重军, 等. 生物膜型污水脱氮系统中膜结构及微生物生态研究进展 [J]. 生态学杂志, 2011, 30(11): 2628-2636. doi: 10.13292/j.1000-4890.2011.0381 ZHANG R, HAN Z Y, CHEN C J, et al. Microstructure and microbial ecology of biofilm in the bioreactor for nitrogen removing from wastewater: A review [J]. Chinese Journal of Ecology, 2011, 30(11): 2628-2636(in Chinese). doi: 10.13292/j.1000-4890.2011.0381
[4] HAN F, WEI D, NGO H H, et al. Performance, microbial community and fluorescent characteristic of microbial products in a solid-phase denitrification biofilm reactor for WWTP effluent treatment [J]. Journal of Environmental Management, 2018, 227: 375-385. [5] HER J J, HUANG J S. Influences of carbon source and C/N ratio on nitrate/nitrite denitrification and carbon breakthrough [J]. Bioresource Technology, 1995, 54(1): 45-51. doi: 10.1016/0960-8524(95)00113-1 [6] COSTA D D, GOMES A A, FERNANDES M, et al. Using natural biomass microorganisms for drinking water denitrification [J]. Journal of Environmental Management, 2018, 217: 520-530. [7] LIANG X Q, LIN L M, YE Y S, et al. Nutrient removal efficiency in a rice-straw denitrifying bioreactor [J]. Bioresource Technology, 2015, 198: 746-754. doi: 10.1016/j.biortech.2015.09.083 [8] MARTÍNEZ N B, TEJEDA A, del TORO A, et al. Nitrogen removal in pilot-scale partially saturated vertical wetlands with and without an internal source of carbon [J]. The Science of the Total Environment, 2018, 645: 524-532. doi: 10.1016/j.scitotenv.2018.07.147 [9] ALI M, SHAW D R, ZHANG L, et al. Aggregation ability of three phylogenetically distant anammox bacterial species [J]. Water Research, 2018, 143: 10-18. doi: 10.1016/j.watres.2018.06.007 [10] LI P, ZUO J E, WANG Y J, et al. Tertiary nitrogen removal for municipal wastewater using a solid-phase denitrifying biofilter with polycaprolactone as the carbon source and filtration medium [J]. Water Research, 2016, 93: 74-83. doi: 10.1016/j.watres.2016.02.009 [11] HUANG G X, FALLOWFIELD H, GUAN H D, et al. Remediation of nitrate-nitrogen contaminated groundwater by a heterotrophic-autotrophic denitrification approach in an aerobic environment [J]. Water, Air, & Soil Pollution, 2012, 223(7): 4029-4038. [12] SAHA S M, RAY S, ACHARYA R, et al. Magnesium, zinc and calcium aluminium layered double hydroxide-drug nanohybrids: A comprehensive study [J]. Applied Clay Science, 2017, 135: 493-509. doi: 10.1016/j.clay.2016.09.030 [13] ISLAM M, PATEL R. Synthesis and physicochemical characterization of Zn/Al chloride layered double hydroxide and evaluation of its nitrate removal efficiency [J]. Desalination, 2010, 256(1/2/3): 120-128. [14] FANG C J, ZHANG X L, LEI Y, et al. Nitrogen removal via core-shell bio-ceramic/Zn-layer double hydroxides synthesized with different composites for domestic wastewater treatment [J]. Journal of Cleaner Production, 2018, 181: 618-630. doi: 10.1016/j.jclepro.2018.01.249 [15] JIANG L, LIU J Y, ZUO K, et al. Performance of layered double hydroxides intercalated with acetate as biodenitrification carbon source: The effects of metal ions and particle size [J]. Bioresource Technology, 2018, 259: 99-103. doi: 10.1016/j.biortech.2018.03.032 [16] CHEN M, BI R, ZHANG R, et al. Tunable surface charge and hydrophilicity of sodium polyacrylate intercalated layered double hydroxide for efficient removal of dyes and heavy metal ions [J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2021, 617: 126384. doi: 10.1016/j.colsurfa.2021.126384 [17] LABBÉ N, PARENT S, VILLEMUR R. Addition of trace metals increases denitrification rate in closed marine systems [J]. Water Research, 2003, 37(4): 914-920. doi: 10.1016/S0043-1354(02)00383-4 [18] JIANG L, LIU J Y, ZHANG C, et al. Synthesis of layered double hydroxides with fermentation liquid of organic waste to extract short-chain fatty acids as a biodenitrification carbon source [J]. ACS Sustainable Chemistry & Engineering, 2017, 5(10): 9095-9101. [19] NARAYAN K D, SABAT S C, DAS S K. Mechanism of electron transport during thiosulfate oxidation in an obligately mixotrophic bacterium Thiomonas bhubaneswarensis strain S10 (DSM 18181^T) [J]. Applied Microbiology and Biotechnology, 2017, 101(3): 1239-1252. doi: 10.1007/s00253-016-7958-x [20] XU Z X, LIU S H, YING H L, et al. Biological denitrification using corncobs as a carbon source and biofilm carrier [J]. Water Environment Research, 2009, 81: 242-247. [21] 邵留, 徐祖信, 王晟, 等. 新型反硝化固体碳源释碳性能研究 [J]. 环境科学, 2011, 32(8): 2323-2327. doi: 10.13227/j.hjkx.2011.08.048 SHAO L, XU Z X, WANG S, et al. Performance of new solid carbon source materials for denitrification [J]. Environmental Science, 2011, 32(8): 2323-2327(in Chinese). doi: 10.13227/j.hjkx.2011.08.048
[22] PENG C, HUANG H, GAO Y L, et al. A novel start-up strategy for mixotrophic denitrification biofilters by rhamnolipid and its performance on denitrification of low C/N wastewater [J]. Chemosphere, 2020, 239: 124726. doi: 10.1016/j.chemosphere.2019.124726 [23] 闫续, 许柯, 耿金菊, 等. 两种释碳材料的制备及其性能研究 [J]. 中国环境科学, 2012, 32(11): 1984-1990. doi: 10.3969/j.issn.1000-6923.2012.11.009 YAN X, XU K, GENG J J, et al. Preparation and properties of two kinds of carbon releasing material [J]. China Environmental Science, 2012, 32(11): 1984-1990(in Chinese). doi: 10.3969/j.issn.1000-6923.2012.11.009
[24] XIONG R, YU X X, YU L J, et al. Biological denitrification using polycaprolactone-peanut shell as slow-release carbon source treating drainage of municipal WWTP [J]. Chemosphere, 2019, 235: 434-439. doi: 10.1016/j.chemosphere.2019.06.198 [25] XU Z S, DAI X H, CHAI X L. Effect of different carbon sources on denitrification performance, microbial community structure and denitrification genes [J]. Science of the Total Environment, 2018, 634: 195-204. doi: 10.1016/j.scitotenv.2018.03.348 [26] WU H, ZHANG Q, CHEN X, et al. Effect of HRT and BDPs types on nitrogen removal and microbial community of solid carbon source SND process treating low carbon/nitrogen domestic wastewater [J]. Journal of Water Process Engineering, 2021, 40: 101854. doi: 10.1016/j.jwpe.2020.101854 [27] YANG M, WANG X N, LIU S, et al. Carbon release behaviour of polylactic acid/starch-based solid carbon and its influence on biodenitrification [J]. Biochemical Engineering Journal, 2020, 155: 107468. doi: 10.1016/j.bej.2019.107468 [28] YANG N, ZHAN G Q, LI D P, et al. Complete nitrogen removal and electricity production in Thauera-dominated air-cathode single chambered microbial fuel cell [J]. Chemical Engineering Journal, 2019, 356: 506-515. doi: 10.1016/j.cej.2018.08.161 [29] ZHANG Y S, JIANG J Q, ZHAO Q L, et al. Accelerating anodic biofilms formation and electron transfer in microbial fuel cells: Role of anionic biosurfactants and mechanism [J]. Bioelectrochemistry, 2017, 117: 48-56. doi: 10.1016/j.bioelechem.2017.06.002 [30] PENG P C, HUANG H, REN H Q. Effect of adding low-concentration of rhamnolipid on reactor performances and microbial community evolution in MBBRs for low C/N ratio and antibiotic wastewater treatment [J]. Bioresource Technology, 2018, 256: 557-561. doi: 10.1016/j.biortech.2018.02.035 [31] van DOAN T, LEE T K, SHUKLA S K, et al. Increased nitrous oxide accumulation by bioelectrochemical denitrification under autotrophic conditions: Kinetics and expression of denitrification pathway genes [J]. Water Research, 2013, 47(19): 7087-7097. doi: 10.1016/j.watres.2013.08.041 [32] ZHI W, JI G D. Quantitative response relationships between nitrogen transformation rates and nitrogen functional genes in a tidal flow constructed wetland under C/N ratio constraints [J]. Water Research, 2014, 64: 32-41. doi: 10.1016/j.watres.2014.06.035 [33] XU H, LIN C S, CHEN W, et al. Effects of pipe material on nitrogen transformation, microbial communities and functional genes in raw water transportation [J]. Water Research, 2018, 143: 188-197. doi: 10.1016/j.watres.2018.06.040 [34] XING W, LI J L, CONG Y, et al. Identification of the autotrophic denitrifying community in nitrate removal reactors by DNA-stable isotope probing [J]. Bioresource Technology, 2017, 229: 134-142. doi: 10.1016/j.biortech.2017.01.010 [35] DESNUES C, MICHOTEY V D, WIELAND A, et al. Seasonal and diel distributions of denitrifying and bacterial communities in a hypersaline microbial mat (Camargue, France) [J]. Water Research, 2007, 41(15): 3407-3419. doi: 10.1016/j.watres.2007.04.018 [36] LI M Y, REN L H, ZHANG J C, et al. Population characteristics and influential factors of nitrogen cycling functional genes in heavy metal contaminated soil remediated by biochar and compost [J]. Science of the Total Environment, 2019, 651: 2166-2174. doi: 10.1016/j.scitotenv.2018.10.152 -





 下载:
下载: