-
土壤是地球生态系统的重要组成部分,它不仅为各种生物提供栖息的环境和必要的食物来源,而且在维持生态平衡方面也起着重要作用。然而,随着城市化和工业化的不断推进,各种人类活动如燃煤、采矿、电镀、施用化肥农药等,导致大量的污染物进入环境中,而土壤是主要的受体[1-4]。全球有1000多万个土壤污染位点,其中大部分污染是由人类活动造成的[5]。土壤污染物主要包括Cd、Hg、As、Cu、Pb、Cr、Zn、Ni等重金属和多环芳烃、有机农药、石油烃等有机污染物[6-8]。土壤污染物的种类越来越复杂,场地污染的类型也日趋多样化,根据土壤污染物的种类,土壤污染可分为重金属污染、有机污染以及重金属-有机复合污染。土壤污染具有富集性、长期性和隐蔽性的特点,许多污染物本身的化学结构稳定或者与土壤组分形成了稳定的配合物,因而难以自然降解,导致土壤生态环境随着时间的推移而逐渐恶化[9-10],一些土壤污染物还可以通过食物链危害食品安全和人类健康[6]。为了降低土壤污染对生态环境、人类健康和社会发展的负面影响,有必要采取一定的土壤修复措施。
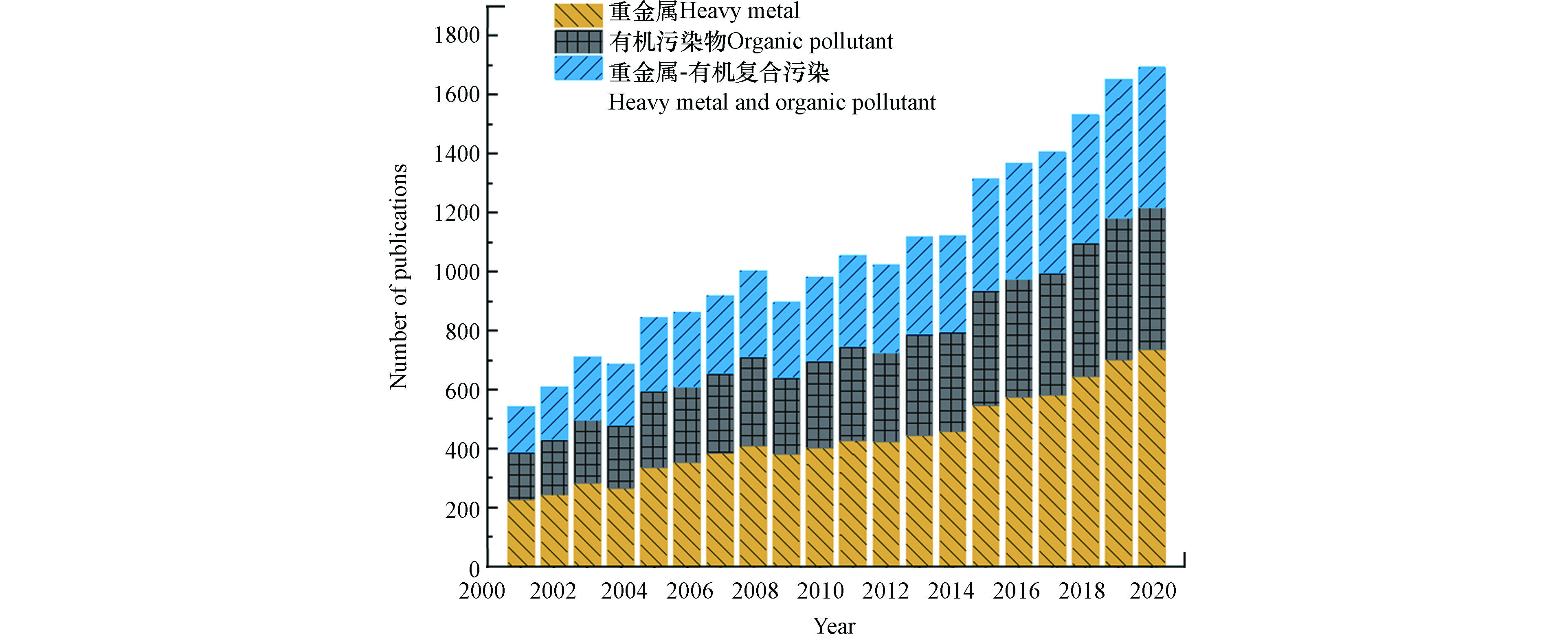
土壤修复技术可分为物理修复、化学修复和生物修复(表1)。随着土壤修复行业朝着污染物减量化和经济、环境效益最大化方向发展的趋势,修复效果好、速度快、操作灵活的土壤淋洗技术受到越来越多的关注。土壤淋洗是化学修复中的一种,通过淋洗剂与土壤的混合,将污染物从固相转移到液相,从而减少土壤污染物总量[11-12]。土壤淋洗修复效果稳定,通过选取不同的淋洗剂和淋洗方式,淋洗技术可以应用于不同类型的污染土壤[13]。近20年来,关于土壤淋洗法去除重金属或有机污染物的文献数量不断增加。其中,重金属污染相关文献数量最多,占比超过40%;有机和重金属-有机复合污染相关文献增速较快(图1)。
本文介绍了不同种类淋洗剂的特性、污染物去除机理和适用的土壤污染类型,阐述了土壤淋洗技术的实施方式,综述了影响土壤淋洗的因素,并结合土壤淋洗技术的优缺点,对其在土壤修复领域的应用前景进行了展望,以期为相关研究提供参考。
-
土壤淋洗是对土壤污染物进行提取的过程,核心部分是淋洗剂与土壤之间的相互作用,因此淋洗剂的选择是土壤淋洗技术的关键。不同种类的淋洗剂具有不同的性质和适用范围,去除污染物的机理也不同。对于淋洗剂的选择,需要综合分析其去除特定污染物的能力、土壤吸附行为、淋洗剂毒性和经济成本等因素。土壤淋洗剂按来源可分为人工合成淋洗剂和天然组分淋洗剂,将不同的淋洗剂进行混合还可得到复配淋洗剂。随着土壤修复标准的提高和对环境效益最大化的追求,天然淋洗剂和复配淋洗剂近年来受到越来越多的关注。
-
常见的无机淋洗剂包括酸、碱、盐等无机化合物。无机淋洗剂是相对传统的淋洗剂,可用于重金属污染土壤的修复,成本较低。其中,无机酸的作用是破坏土壤与重金属的结合位点,将重金属以离子的形式释放到淋洗剂中,以达到去除重金属的目的[31];碱和无机盐主要是通过沉淀、离子交换和络合的方式结合土壤重金属。强酸和强碱环境会对土壤的有机质含量和酶活性等方面造成较大不利影响,目前有关盐溶液淋洗土壤重金属的研究相对较多。低浓度的硫代硫酸钠能够在去除与土壤有机质的含硫官能团结合的重金属汞方面发挥重要作用,通过淋洗能够去除土壤样品中约50%的总汞[32]。不同于阳离子型重金属,As通常以含氧阴离子的形式存在于土壤中,磷酸盐和砷酸盐具有类似的结构,因此可以从土壤中提取As,NH4H2PO4对土壤As的总去除率可以达到24.5%,但淋洗过程提高了As的生物可利用性,使重金属毒性增加[33]。鉴于单纯的酸碱盐淋洗对土壤的负面影响,传统的无机淋洗剂可能不会发挥主要作用,但可以作为淋洗助剂使用。
-
有机螯合剂是常用于土壤重金属污染修复的药剂,可以在较宽的pH范围内通过强螯合作用与土壤重金属形成具有较高稳定性的环状结构,从而增加土壤重金属的溶解性[34-35]。与酸洗相比,螯合剂对重金属的去除效率更高,其中乙二胺四乙酸(EDTA)和二乙烯三胺五乙酸(DTPA)等是常用的螯合剂[7, 36-37]。
许多人工螯合剂对于污染物的选择结合性较低,生物降解性较差,残留在土壤中的螯合剂可能会对土壤的生态功能造成不利影响。EDTA在高效洗脱土壤Pb和Cd的同时也会去除土壤微生物所需的一些微量元素,并导致土壤酶活性显著降低[38]。因此,在选择螯合剂进行土壤淋洗时,应结合淋洗过程可能对土壤性质和结构造成的影响以及污染场地的后续用途进行评估。对试剂原有结构的一些改变可以增强对目标污染物的选择性去除效果。Zhang等合成的丙二胺四乙酸 ( PDTA, EDTA的一种衍生物)在土壤中主要阳离子如Ca2+、 Mg2+、Fe3+、Mn2+和Al3+存在的情况下对Cu的去除仍具有较高的选择性,因此可以避免淋洗过程对土壤矿物质的破坏[39]。此外,谷氨酸N,N-二乙酸(GLDA)作为一种新型的可生物降解螯合剂,有潜力作为传统螯合剂的理想替代品[40],新型螯合剂的开发也应该朝着环境友好的方向发展。
-
表面活性剂是同时具有亲水基团和亲脂基团的大分子有机物,根据极性基团的解离性质,表面活性剂还可分为阳离子型、阴离子型、两性离子型和非离子型[41]。表面活性剂的加入可以改变体系的界面状态,当体系中的表面活性剂达到临界胶束浓度后就会形成胶束[42], 使整个体系具有增溶和乳化的特性[43]。表面活性剂可以通过离子交换和络合作用去除土壤中的重金属[44],还可通过疏水性基团与有机污染物结合,增加有机污染物与土壤颗粒之间的排斥力[45]。表面活性剂还能够分散土壤污染物,增加与污染物的接触面积,形成的胶束可以提高污染物在洗脱液中的稳定性。表面活性剂的两亲性能够实现对土壤中重金属和有机污染物的同步去除,最佳条件下,螯合型表面活性剂N-酰基乙二胺三乙酸对复合污染土壤中的Cd和石油去除率分别达到了56.4%和50.8%[46]。另一方面,相较于有机溶剂应用于污染土壤淋洗修复具有对土壤性质破坏大、操作风险高的弊端,采用表面活性剂进行替代也是较为理想的选择。Zhang等的研究结果表明,浓度为5%的曲拉通X-100对土壤中氯丹、滴滴涕及灭蚁灵的淋洗效果均明显优于50%乙醇溶液[47]。阴离子和非离子表面活性剂对土壤中的多环芳烃和石油烃也有较好的溶解作用[48-49],但一些合成表面活性剂的生物降解性较低,淋洗后的少量残留也可能对土壤的性质产生不利影响[44, 50]。
-
小分子有机酸在自然界中广泛存在,可以从植物或微生物中提取[51-52]。常见的小分子有机酸包括柠檬酸、酒石酸和草酸等。研究表明,羧基可以有效地结合重金属,这些小分子有机酸可以作为土壤中重金属的配体,通过络合或螯合的方式与重金属形成配合物[53], 而且小分子有机酸在自然环境中容易降解,是环境友好型的淋洗剂。Ke等采用批实验和柱实验两种方式验证了柠檬酸对于土壤中Cd、Pb、Cu和 Zn的去除效果[54]。Moon等研究发现,酒石酸可实现对重金属和总石油烃(TPH)的同步高效去除,其中TPH去除率可达82%,其原理可能是酒石酸分子与含有少量水合分子的TPH形成氢键,从而增加了TPH的溶解度[55]。有机酸对土壤有机污染物的去除机理和应用效果仍有待进一步研究。小分子有机酸作为一种可生物降解、成本效益高的淋洗剂,在土壤修复中的应用越来越广泛,但如何避免其酸性给土壤带来的负面影响也需要进一步研究。
-
生物表面活性剂是由微生物、植物或动物产生的天然有机物。与合成表面活性剂相比,其分子结构更加复杂,生物降解性和环境相容性更高,因此生物表面活性剂在土壤污染修复方面具有独特的优势 [50, 56-57]。Gusiatin等证明,生物表面活性剂皂苷对土壤中重金属的淋洗去除率可达90%以上[56]。除了能够有效淋洗土壤重金属,一些生物表面活性剂对有机污染物也有着较好的去除效果。有研究表明,表面活性素和鼠李糖脂对土壤TPH的去除效果均优于吐温−80和曲拉通X-100 [58]。一些生物表面活性剂在较高的pH和含盐环境中对疏水有机污染物也具有良好的乳化效果,因此具有很高的应用价值[59]。此外,环糊精是一种环状低聚糖,是淀粉酶解的产物,也是具有亲水性外层和疏水性内部结构的物质,可以将有机物捕获并将其固定在内部腔体中,形成包合体系[60-61]。环糊精作为一种比合成表面活性剂更环保、更具有成本竞争力的物质,近年来也在土壤修复中得到了越来越多的应用[61],研究表明,采用甲基β环糊精为淋洗剂,在辅助加热及超声条件下连续进行五次土壤淋洗,可去除土壤中90%以上的总多环芳烃[62]。绿色环保型的表面活性剂是目前土壤淋洗研究的热点,但一些天然表面活性剂如皂苷和鼠李糖脂等价格昂贵,在未来的研究中,可以从原料的选择和提取过程中寻找降低成本的方法。
-
在农业和工业生产的过程中,会伴随着一些生物质副产品的产生,它们含有木质素、纤维素、果胶、黄酮和色素等物质[63],其中含有大量可与重金属结合的官能团,如羧基、氨基、羟基等。这些材料廉价易得,且其提取物大多性质温和,对土壤原有性质不会产生较大的负面影响。随着废弃物的资源化利用成为热点,生物质淋洗剂的开发也将是未来的重要研究方向[64]。
木质素磺酸钾是造纸工业的副产物,具有产量高,成本低的特点,在pH=5.24的弱酸性环境中,其水溶液能有效去除土壤中的Pb和Cu,淋洗后土壤有机质、氨态氮、速效磷及速效钾含量也有所增加[65]。Feng 等以菠萝皮、大豆秸秆、蚕豆秸秆和茶叶渣为原料,采用水浸提法制备淋洗剂,发现菠萝皮浸提液是较为理想的淋洗剂,离子交换和络合是其去除重金属的主要机理[66]。该文章中并未提及经过浸提后的固体残渣如何处理,如果将其制备成生物炭,用于固定淋洗后土壤中的残余重金属,也是一种可行的方法。还有研究表明,从城市污水污泥中提取的各种有机成分如溶解性有机质和腐殖质类物质能够有效地降低土壤中重金属的总量和迁移性,并且有助于土壤养分的保持[67]。
土壤淋洗并不仅仅可以是用现成的试剂作为淋洗剂,也可以采用常见的生物质为原料进行淋洗剂的制备,这些材料廉价易得,应用的最大优点是能够降低成本,同时还能够改善土壤性质。目前此方面的研究多是针对重金属污染土壤,对有机污染土壤的相关报道较少。在废弃物资源化利用中,值得注意的问题是这些材料本身可能带有其他的污染物。另外,如果原料是难溶于水的固体,也可以在传统水浸提的基础上采用一些辅助方法来提高有效成分的提取效率,如微波或超声波辅助,以及试剂辅助等。
-
复配淋洗剂即将不同的淋洗剂按比例进行混合得到的淋洗剂。一些复配淋洗剂能够强化土壤污染物的去除效果,研究发现,柠檬酸和氯化铁复配对土壤中Cd的去除效果较二者单独淋洗明显增加[68]。此外,将EDTA与生物可降解螯合剂乙二胺二琥珀酸联合使用,可以减少EDTA的用量,进而降低淋洗过程对土壤性质的不利影响,但重金属去除效果较EDTA单独淋洗不会发生明显变化[69]。复配淋洗也为重金属-有机物复合污染土壤的修复提供了有效的解决途径。土壤污染物的去除效果与淋洗剂对目标物质的选择性结合有关,针对重金属和有机污染物各自的去除机理,选择EDTA作为螯合剂,吐温−80作为增溶剂,采用二者的混合溶液对铜-菲复合污染的土壤进行淋洗,去除率分别达到了73.5%和68.1%[70]。将羧甲基β环糊精(CMCD)和羧甲基壳聚糖(CMC)进行复配,CMCD的存在还可提高CMC在水相中的溶解度,增加了可与污染物结合的基团数量,复配淋洗剂能够实现土壤中重金属和多环芳烃的高效去除,而且淋洗后土壤中剩余污染物也能够以较为稳定的形态存在[71]。但复配淋洗剂对污染物去除率的提高并非绝对[72],不同的淋洗剂之间也可能存在拮抗作用,因此复配淋洗过程中需要考虑更多的因素,比如淋洗剂的种类、性质、配比以及去除污染物的机理和适宜的环境条件等。
-
土壤淋洗技术作为客土法、热处理等传统土壤修复技术的有效替代,显示出了巨大的发展潜力。 经过淋洗处理后,土壤可在一定程度上恢复其生态功能,回填后可作为农业用地或工业用地[15],具有显著的社会效益和经济效益。其原理是将淋洗剂按一定比例注入被污染的土壤中,使淋洗剂与土壤充分接触和混合,土壤中的污染物可以在物理和化学作用下进入淋洗液当中,在短时间内实现土壤污染物的减量化[11]。淋洗剂的作用机理一般包括溶解、络合、吸附、静电作用、离子交换和氧化还原等[73-74]。近年来,土壤淋洗已有许多成功的应用案例。根据实施方式,土壤淋洗可分为原位淋洗和异位淋洗,土壤淋洗还可以与其他修复技术相结合,更高效地实现修复目标。
-
在原位土壤淋洗中,污染土壤本身不会被移动,通过注射井或喷淋头等加压装置将淋洗剂注入污染土层,然后液体在自身重力作用下进入土壤的缝隙,渗入土壤内部结构与污染物发生反应,将污染物带离土壤,然后通过地面上的抽提装置收集洗脱液,随后进行集中处理(图2a)。以上过程应建立在水力研究的基础上,以保证淋洗剂与土壤颗粒的充分接触以及注射和抽提装置的可靠性。当场地的土壤和地下水同时被污染时,采用原位淋洗技术可以充分发挥同步处理的优势。原位淋洗避免了土壤的开挖、运输和回填步骤,降低了修复成本,减少了对土壤原有结构的破坏[75]。原位淋洗技术对污染土壤的地质、水文和气候条件有一定的要求,通常适用于具有较高的水力传导性的砂质土和均质土[76], 黏粒含量高的土壤不适合采用该方法,常年冻土地区的土壤传质效率低,也不适合采用该技术。此外,由于原位淋洗涉及到对土壤及地下水等各种生态系统的影响,因此需要对淋洗后的土壤及地下水的性质变化进行评估,可采用土柱淋洗法在实验室条件下进行模拟。为降低对土壤及地下水的二次污染,应尽量采用环境友好型淋洗剂,建立洗脱液的回收和处理方法,并做好防渗措施,必要时可采用清水进行二次淋洗。出于便捷性和经济性的角度,如果当地环境符合原位淋洗的条件,尤其是大型的污染场地,则原位淋洗是首选。
原位淋洗已经在实验室模拟实验和实际污染场地的修复中取得了良好的效果。Makino 等对116 m2受Cd污染的稻田土壤进行现场原位淋洗,先用食品级CaCl2淋洗,再用水淋洗以减少残留的氯含量,去除了55%可交换态的Cd[77]。原位淋洗的效率除了与淋洗剂有关,也与操作条件有很大关系,改良注射井装置或增加搅拌、曝气等装置促进淋洗剂的扩散[78],对淋洗剂进行加热也能够提高淋洗剂与土壤污染物之间的传质效率。
-
异位淋洗相对原位淋洗的操作过程更为复杂,通常需要经过以下几个步骤:1)挖掘污染土壤并运送至修复地点;2)将土壤进行筛分,去除体积较大的杂物和石块;3)进行污染土壤的淋洗修复处理;4)固液分离;5)洁净土壤的回填和洗脱液的处理(图2b)。筛分中也涉及到物理分离方法,比如机械筛分,水力分级,静电分选,磁力分选等[7]。合理的筛分能够减轻后续土壤淋洗过程的负担,因为细颗粒拥有更大的比表面积,因此更容易吸附污染物[31],如果能够实现细颗粒的高效淋洗,也会减少淋洗剂的用量进而降低成本。
异位淋洗相对于原位淋洗操作更加灵活,经过筛分后污染土壤体积减少,且淋洗过程在专门的封闭装置中进行,土壤与淋洗剂的充分混合使得淋洗效率得到提升,能够有效缩短淋洗时间。但是异位淋洗不适用于大型的污染场地修复,因为这可能需要在挖掘、运输和淋洗设备中投入大量的资金。该方法在发达国家起步较早,已经有了比较成熟的应用案例,我国的土壤淋洗行业起步较晚,面对土壤污染的严峻形势,仍需要对异位淋洗进行进一步的探索。
-
由于土壤的复杂性质和污染类型的多样化,目前还没有一种土壤修复技术可以完美地应用于所有类型的污染土壤。对于一些难降解、持久性污染物的去除,单独使用化学淋洗技术有一定的局限性,将土壤淋洗与其他技术或方法进行联用(图2c),能够强化土壤的修复效果。
土壤淋洗与物理方法相结合,可以扩大应用范围,增强淋洗技术的优势。对于一些污染场地部分土壤不适合土壤淋洗的情况,可以采用客土法进行弥补。电化学技术与土壤淋洗相结合可以强化对污染物的去除,利用电化学方法处理淋洗废水和回收重金属也是近年来的研究热点[79]。采用物理方法辅助土壤淋洗也可以实现淋洗过程的优化,比如超声波辅助土壤淋洗主要是利用超声波能量提高土壤与淋洗剂之间的传质效率,将超声波技术与常规机械搅拌相结合可以显著提高土壤污染物的去除效果[80-81]。
淋洗技术与稳定化技术的联合使用也较为常见,淋洗后土壤中重金属和有机污染物的形态可能会发生变化,因此将稳定化技术应用于淋洗之后更有利于土壤污染物环境风险的降低[82]。这两者的结合既弥补了稳定化技术并未降低土壤污染物总量的弊端,还可巩固土壤淋洗的效果。石灰、生物炭和粉煤灰等物质都能起到固定土壤重金属的作用,一些改良剂在此基础之上还能够增加土壤养分含量,碱性稳定剂还能调节土壤的pH值[21, 83]。
土壤淋洗与植物修复相结合,可以大大缩短单独进行植物修复所需的时间[84],也能够减少土壤污染物对植物的毒性危害,植物根系的分泌物和掉落的植物成分还可以增加土壤有机质含量,改善土壤的理化性质[27],但也要注意淋洗剂在土壤中的残留对植物生长的影响以及植物的后续处理问题。微生物修复是一个环境友好、可持续发展的过程,可以与土壤淋洗技术相结合,充分发挥其优势。首先,淋洗过程对土壤有机污染物的富集能够大大提高其生物利用性,高效的污染物降解菌能够实现降解过程的绿色环保[85]。微生物对于淋洗剂中有效成分的降解程度也需要关注,如果能够实现选择性的降解,即分解污染物而不分解或少分解淋洗剂成分,则可以实现淋洗剂的循环使用。
纳米技术是一种在土壤修复领域中具有广阔应用前景的新兴技术。纳米材料具有比表面积大、反应活性高的特点,可以强化各种界面反应,促进土壤污染物的解吸,部分纳米材料还具有选择性降解污染物的能力[86-87]。纳米技术在土壤和地下水原位修复方面显示出了巨大的发展潜力,纳米零价铁因其氧化、还原、离子交换和络合等属性而备受关注[86]。Yin 等发现,纳米纤维素淋洗剂可以通过破坏土壤有机质与重金属或矿物的键合、竞争吸附和增溶作用实现对土壤中菲的去除[88],而且纳米纤维素可以从农业和工业废弃物中提取,是一种有发展前景的绿色材料[89]。
多种修复技术的组合是相辅相成的,采用的方法应具有协同效应。此外,操作步骤的增加可能也会提高修复成本,因此,是否要选择技术组合以及如何选择合适的、成本效益高的土壤修复技术组合,则应根据土壤条件、修复技术的适用范围、修复目标和成本预算等方面综合评估分析决定。
-
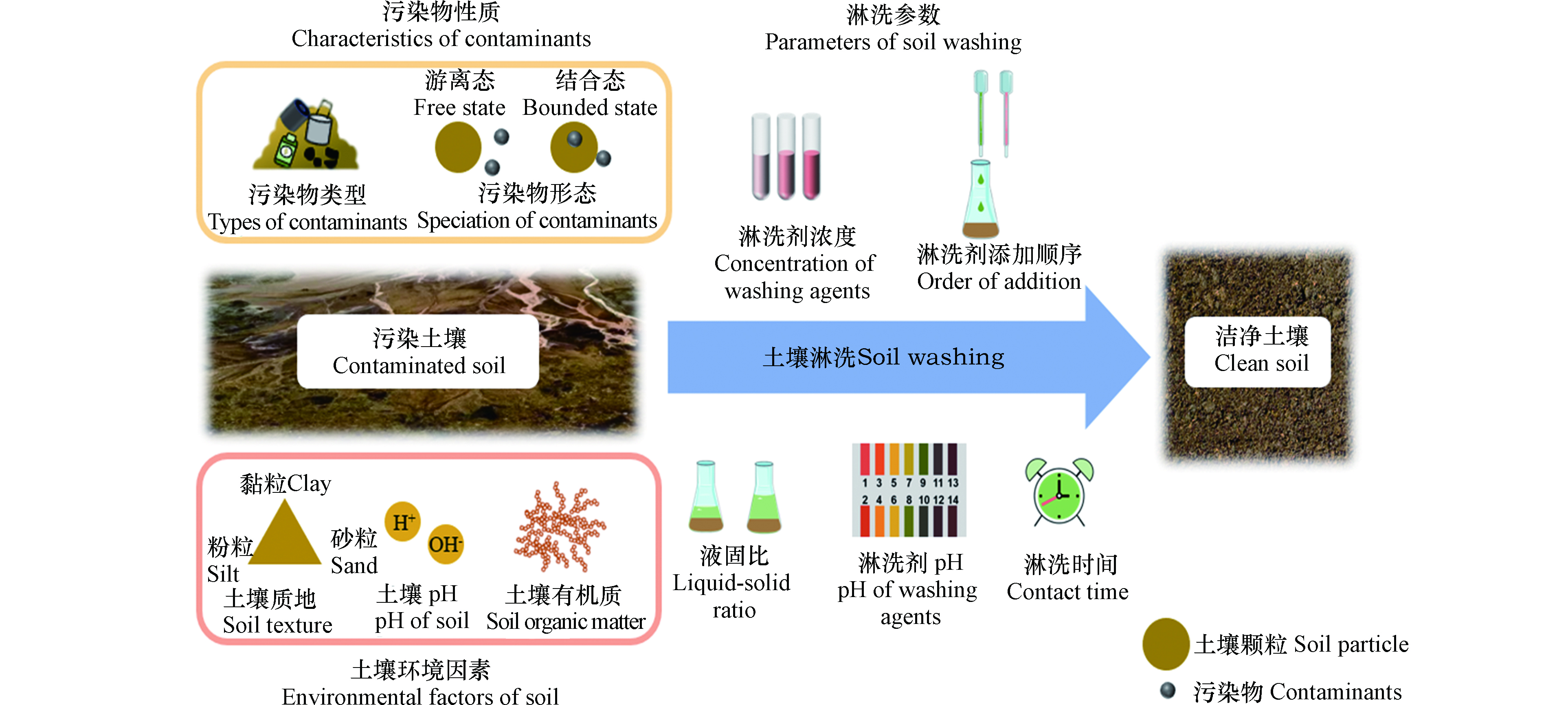
土壤本身是一个复杂的体系。从物质状态来看,它包含固体、液体和气体。从物质构成上看,它还包括水分、矿物质和有机质等。土壤污染是一个长期的动态累积过程,外部的污染物通过不同的方式以不同的形态进入土壤,然后在土壤自身和外部环境条件下进行一系列的转化。污染物性质、土壤环境因素和淋洗参数都会对土壤淋洗产生影响(图3)。
-
在各种污染源的作用下,单纯被特定的某一种重金属或有机物污染的土壤较少,大多污染土壤呈现复合污染的状态。在重金属或有机复合污染土壤中,重金属的种类和价态以及有机污染物的分子量和疏水性等性质不同,也会造成其与土壤有机质和矿物质等组分之间的物理化学作用和结合紧密程度等方面的差异性,从而影响淋洗剂对污染物的提取效果[90]。与重金属或有机复合污染相比,重金属-有机复合污染土壤具有更复杂的理化性质、更强的环境毒性以及更高的淋洗修复难度,土壤中重金属与有机污染物在赋存形态、与土壤颗粒的结合方式和去除机制等方面存在诸多差异[86, 91],覆盖在土壤表面的游离相有机污染物还能够通过物理隔离的方式减少淋洗剂与内部重金属之间的接触[92]。淋洗法处理中,在淋洗剂的选择方面,可采用表面活性剂类淋洗剂实现二者的同步去除,或针对两类污染物的不同性质选择合适的淋洗剂进行复配;在实施方面,提高淋洗剂与土壤之间的接触与混合效率也是改善淋洗效果的途径之一,还可将淋洗法与化学氧化法进行联用以强化对有机污染物的去除效果。
-
通过自然源和人为源产生的污染物通过大气沉降、污水灌溉、危险废弃物扩散等途径进入土壤后,可被土壤胶体吸附,与土壤中含有的有机物或无机物结合,或者被微生物或植物吸收,转化成不同的组分[93]。根据污染物与土壤颗粒的结合状态不同可分为游离态与结合态。目前世界上广泛采用的Tessier法将土壤重金属分为可交换态(F1)、碳酸盐结合态(F2)、铁锰氧化物结合态(F3)、有机质结合态(F4)和残渣态(F5)[94]。F1 是通过静电作用吸附在土壤颗粒上的重金属组分,F1、F2和F3组分迁移性相对较高,土壤淋洗过程对此部分的去除率较高。F4是与土壤有机质通过螯合或络合作用结合的重金属组分,F5主要以硅酸盐的形式存在,F4和F5与土壤颗粒结合紧密,稳定性高,在常规条件下很难将其完全去除。因此,土壤重金属的形态是影响土壤淋洗效果的重要因素。目前还没有对于有机污染物的确切形态分析方法。大部分有机污染物是疏水性的,进入土壤后以非水相液体的方式存在,有的通过界面相互作用,如静电作用、络合作用等与土壤颗粒结合[95],随着老化时间的增加,污染物与土壤组分之间的结合呈现更为稳定的状态,也会使淋洗的效率降低。
-
土壤颗粒按其粒径大小可分为砂粒、粉粒和黏粒。淋洗技术不适用于黏粒含量大于30%的土壤,因为黏质土的渗透性差、水力传导效率低,会影响淋洗剂在土壤孔隙中的扩散,不能使淋洗过程充分发挥作用,这也是限制土壤淋洗技术发展的原因之一。有研究表明,冻融过程能够使土壤固相物质的构成发生改变,使土壤的透水性提高[96],且这种现象在四季分明的地区是常见的,这为土壤淋洗与自然冻融的结合在实际场地的应用提供了理论支持。
-
土壤pH是影响矿物表面电荷和吸附位点的关键因素,对土壤中重金属的形态分布和迁移行为有很大影响。不同土壤pH条件下,土壤对重金属的吸附机理也不同[97]。在酸性条件下,碳酸盐结合态重金属更容易转化为可交换态重金属,而在碱性条件下,有效态重金属含量降低,碳酸盐的存在增强了土壤的缓冲能力。因此,酸性土壤中重金属的迁移性和环境风险较高[98],适宜采用具有离子交换、络合、沉淀等功能的淋洗剂,而酸性环境下进行洗脱可以提高碱性土壤中重金属的提取效率。
-
土壤有机质包括腐殖酸、微生物和植物残体等。研究表明,土壤有机质中的羧基和酚类官能团可与重金属络合[99]。一般情况下,通过范德华力和静电相互作用吸附在有机物上的重金属稳定性较低,而通过化学键与有机物结合的重金属稳定性较高,因而前者更容易被洗脱。土壤有机质与非极性有机污染物的相互作用导致土壤表面特定位置的吸附,这种相互作用更多地取决于土壤有机质的化学结构[100],有机污染物与有机质的结合力强弱也会直接影响土壤淋洗的效果。当重金属与有机污染物同时存在时,有可能在土壤有机质结合位点上形成竞争关系[101]。酸性和氧化性较强的淋洗剂能够有效去除有机结合态重金属,但也可能会对土壤结构、养分和微生物群落造成不可逆的破坏。
-
浓度、pH、液固比、淋洗时间以及淋洗剂的添加顺序都会对土壤淋洗的效果产生影响,这也是实验室中经常采用的淋洗变量。淋洗剂的浓度直接决定了与污染物相互作用的有效物质的含量,在一定范围内,污染物的去除效果应与淋洗剂浓度呈正相关;淋洗剂的pH会影响重金属的解吸和吸附行为,酸性淋洗剂可以有效地去除土壤重金属的F1, F2和F3组分,但适宜的pH应根据土壤和淋洗剂的性质来确定;液固比主要影响淋洗剂与土壤的接触和混合,液固比过低,土壤与淋洗剂不能充分混合,而液固比过高,则会产生大量废水,这增加了后续处理的成本和难度;随着淋洗时间的延长,污染物通过充分接触逐渐转移到洗脱液中,经过一段时间的淋洗,去除率会达到平衡,污染物甚至会重新吸附到土壤中,因此,确定最佳淋洗时间对确定修复周期和实现最大效益也具有重要意义;如果使用不同类型的淋洗剂进行连续淋洗,则需要评估不同的试剂与土壤中目标污染物之间的相互作用是否会影响最终的结果[92]。因此,有必要在进行淋洗修复前对土壤及污染物的背景和性质进行全面的分析和调查,使淋洗参数更符合土壤的实际性质,尽可能提高污染物去除率并减少对土壤性质和结构的破坏。
-
面对土壤污染的严峻形势,土壤淋洗技术由于修复效率高、修复周期短和操作灵活等优点而具有广阔的应用前景。目前制约淋洗技术发展的因素主要有潜在的二次污染、淋洗成本较高以及淋洗废水的处理等,针对以上问题,对淋洗技术未来的发展方向进行了展望:
(1)开发经济环保型淋洗剂,降低淋洗过程成本。将生物质废弃物资源化概念应用于土壤的淋洗修复是目前的研究热点,为实现淋洗剂的大规模生产和开发高效、可生物降解的淋洗剂提供了新的发展方向,也推动了清洁低碳能源体系的构建。对淋洗技术的研究也要着重突破传质瓶颈,并结合实际的场地修复作业,探索复配淋洗剂以及与其他土壤修复技术的联合使用的可能,降低淋洗设备的成本投入和运行维护费用等。
(2)实现淋洗废水的高效处理和重金属的资源化利用。淋洗废水中含有大量的污染物,必须经过适当的处理才能排入污水系统。目前,沉淀技术、生物吸附技术、高级氧化技术和电化学技术等已经在土壤淋洗废水的处理和重金属回收中有了初步的应用。从可持续发展的角度来看,应尽量实现淋洗剂的循环利用,从而使淋洗剂的利用率最大化,实现淋洗剂的闭路循环。同时,若对淋洗废水中分离出的重金属进行有效的回收,并进行资源化利用,如合成功能纳米材料和金属有机框架等,则能够实现淋洗废水的“零排放”,符合绿色环保的要求,创造良好的经济和社会效益,强化土壤淋洗技术的优势,促进土壤淋洗技术的更好发展。
淋洗技术在土壤污染修复中的应用与挑战
Application and challenge of washing technology in soil pollution remediation
-
摘要: 土壤污染一般包括重金属污染、有机污染以及重金属-有机复合污染,具有富集性、长期性和隐蔽性的特点,给自然环境和人类社会带来了诸多负面影响。如何快速、高效地去除土壤污染物,在一定程度上恢复土壤的生态和经济功能,是土壤修复领域的热点和难点问题。土壤淋洗作为一种能够永久去除土壤污染物的技术,具有良好的发展前景,引起了学者们的广泛关注。本文对土壤淋洗的原理,淋洗剂的分类,土壤淋洗的实施方式以及影响土壤淋洗的因素等方面进行了综述,为淋洗技术在污染土壤修复中的应用提供理论基础。Abstract: Soil contamination generally includes heavy metal contamination, organic contamination, and the co-contamination of heavy metals and organic pollutants. Soil contamination tends to be accumulative, hidden, long-lasting, and poses negative effects on natural environment and human society. How to efficiently remove soil contaminants and restore its ecological and economic functions has been the research focus of soil remediation. Soil washing is a technology that can permanently remove pollutants from soil environment, and thus has a promising development prospect and attracted widespread research attention. This review summarizes the mechanisms of soil washing processes, the classification of washing agents, the implementation and the factors affecting the efficiency of soil washing, which provides a theoretical basis for improving the application of washing technology for remediating contaminated soils.
-
Key words:
- soil contamination /
- soil washing /
- heavy metals /
- organic pollutants
-
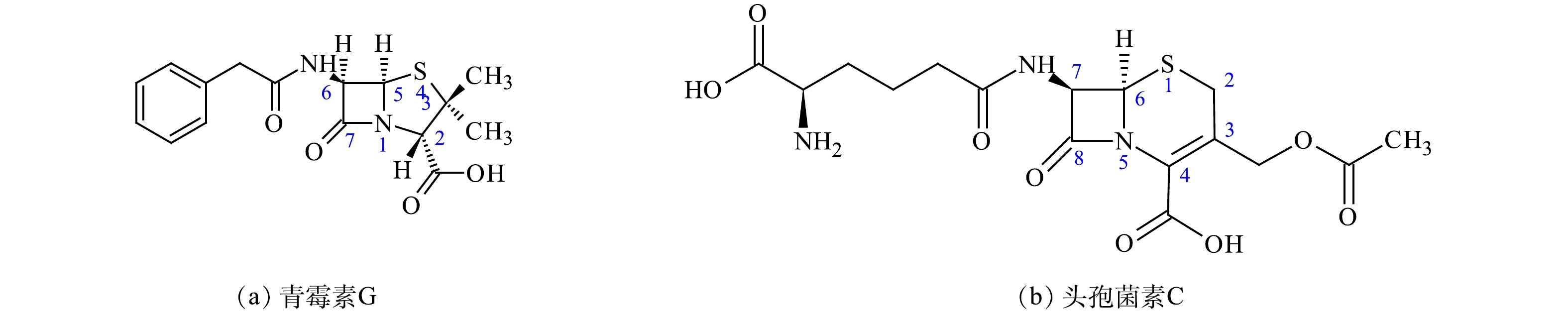
中国是抗生素生产和使用大国[1]。作为中国最常用的5类抗生素之一,β-内酰胺类抗生素生产量和销售份额在众多抗生素中名列前茅[2],在全球制药行业也具有举足轻重的地位[3-4]。青霉素和头孢菌素是使用最广泛的抗生素。2010年,青霉素和头孢菌素2种抗生素使用量占所有抗生素使用总量的近60%,与2000年相比增长了41%[5]。环境中β-内酰胺类抗生素的残留主要来自制药工业[6-9]、临床[10-12]和畜禽养殖[13-14]。抗生素生产过程产生的制药废水[8-9]及菌渣[15-16]中含有高浓度的抗生素残留[17]。LI等[18]对青霉素G生产废水(废母液)的研究表明,由于溶剂萃取过程的高温酸性环境使大部分青霉素G母体降解(残留浓度为153.0 μg·L−1),降解产物脱羧青霉噻唑酸和青霉醛的浓度可分别达到389.0 mg·L−1和75.3 mg·L−1。与青霉素G生产废水相比,青霉素生产排放菌渣中的青霉素G残留更高,可达5 000 mg·L−1[19],是β-内酰胺类抗生素排放强度最高的排放源。
尽管β-内酰胺类抗生素是生产和应用最广泛的抗生素,但由于其结构中的β-内酰胺环具有易水解和生物降解的特性,通常环境中检出浓度较低,甚至一些类型低于检测限。青霉素生产废水处理后,出水和受纳河流下游青霉素G浓度仅为1.68 μg·L−1和0.35 μg·L−1,但却发现大量对β-内酰胺类和其他各类抗生素具有多抗性的抗药细菌,这表明即使废水中抗生素母体浓度很低,其排放仍然可能导致环境细菌抗药性潜在风险[18]。头孢菌素生产废水中也出现了类似的现象[7]。制药菌渣中的青霉素G[20]、头孢菌素C[16]残留及转化产物导致在好氧堆肥过程中[17, 21]或土壤施用菌渣肥[20]后亦出现抗性基因和抗药菌升高的现象[20, 22]。因此,深入认识环境中β-内酰胺类抗生素的环境行为、抗性的产生和传播、高浓度污染源的抗生素去除等,对于该类物质的环境管理和污染控制至关重要。
本研究在对β-内酰胺类抗生素污染特征、环境行为和控制技术的研究进展进行梳理的基础上,重点关注了β-内酰胺类抗生素中最重要的“母体”抗生素原料药——青霉素G和头孢菌素C的环境行为和控制,并在构筑抗生素和抗性基因控制多级屏障技术体系和危险废弃物制药菌渣无害化处理及资源化利用等方面提出展望,以期为β-内酰胺类抗生素残留效价的削减和抗性的控制提供参考。
1. β-内酰胺类抗生素的性质和主要环境排放源
β-内酰胺类抗生素是指化学结构包含一个β-内酰胺环,具有抗菌活性的天然或经化学手段合成的有机化合物[23-25]。表1和图1列举了主要的β-内酰胺类抗生素及其分子结构。
表 1 主要的β-内酰胺类抗生素Table 1. Major β-lactam antibiotics分类 亚类 化合物名称 青霉素类 天然青霉素 青霉素G 耐酸青霉素 青霉素V、苯氧乙基青霉素 耐酶青霉素 苯唑西林、氯唑西林、双氯西林、氟氯西林 广谱青霉素 氨苄西林、阿莫西林、匹氨西林 抗绿脓杆菌青霉素 羧苄西林、磺苄西林、替卡西林等 头孢菌素类 第1代 头孢噻吩、头孢噻啶、头孢唑啉等 第2代 头孢呋辛、头孢孟多、头孢替安等 第3代 头孢哌酮、头孢噻肟、头孢克肟等 第4代 头孢吡肟、头孢匹罗等 第5代 头孢洛林、头孢托罗、头孢吡普等 非典型类 头霉素类 头孢西丁、头孢美唑、头孢替坦等 拉氧头孢类 拉氧头孢 β-内酰胺酶抑制剂 克拉维酸、舒巴坦等 单环β-内酰胺类 氨曲南、卡芦莫南 碳青霉烯类 亚胺培南,美罗培南,帕尼培南等 青霉素G和头孢菌素C是2种重要的天然抗生素和原料药。青霉素于1928年被发现。1949年,科学家通过X射线晶体学研究揭示了青霉素的完整结构,并于1959年通过全合成证实了该结构[26-27]。1945年,分离得到的头孢子菌可以产生多种成分的抗生素,1955年,分离得到头孢菌素C[28-29]。在不改变核心结构β-内酰胺环基础上,通过人工修饰侧链[30],又发展出了第4代头孢菌素、β-内酰胺抑制剂、碳青霉烯、单环菌素等多种β-内酰胺类抗生素[4, 31]。β-内酰胺类抗生素从20世纪初开始广泛使用,不仅应用于人类疾病的临床治疗,还可用于畜牧水产养殖和植物病虫害的防治[12-14, 32-33]。由于β-内酰胺类抗生素的分子结构与细胞壁黏肽结构中的D-丙氨酰-D-丙氨酸相似,可以竞争性地结合转肽酶,不可逆地抑制肽聚糖的形成,抑制细胞壁的合成,从而起到抗菌作用[34-37]。β-内酰胺环是抗菌活性基团,而侧链基团改变会引起抗菌谱或对β-内酰胺酶的敏感性等药理学特性变化[34, 38]。图2显示了青霉素G和头孢菌素C的分子结构。头孢菌素C-7位基团影响抗菌活性,而C-3和C-4位取代基主要决定药代动力学[30-31]。与青霉素相比,头孢菌素具有较低的致敏性和对β-内酰胺酶的敏感性,因此,被认为是广谱抗生素,可用于治疗革兰氏阴性和革兰氏阳性细菌的感染,并有效地阻止微生物的生长[31]。
环境中β-内酰胺类抗生素主要来自制药工业[6-9]、医用[10-12]和兽用[13-14]。抗生素原料药发酵生产过程产生的制药废水(废母液)[8-9]及菌渣[15-16]含有高浓度的抗生素残留[17],是强度最高的排放源。制药废母液中单一抗生素(如土霉素)的浓度可达1 000 mg·L−1[39]。在印度一个大型药物生产基地的污水处理厂中检出高浓度的氟喹诺酮类抗生素残留[9]。由于β-内酰胺环具有不稳定易水解的特性,与土霉素、氟喹诺酮类等结构相对稳定的抗生素相比,青霉素G残留浓度相对较低,浓度为150 μg·L−1左右。然而,其降解产物脱羧青霉噻唑酸和青霉醛的浓度可以达到389.0 mg·L−1和75.3 mg·L−1[18]。有学者[7]在中国北方一个年产头孢菌素3 000 t的制药园区排放的废水中,发现了700 μg·L−1的头孢呋辛残留。因此,尽管制药行业污水相对生活污水(含医院污水)排放量不大,但其污染物排放强度高,如果不进行有效处理,制药废水中的抗生素残留就可能直接排放到水环境或者通过管网进入城市污水处理厂。现行的污水处理技术对常规有机物处理效果良好,但是对抗生素的去除效率还较低,这也会导致抗生素从污水厂向环境中的排放[40-42]。
临床使用的抗生素可通过粪便、尿液及医疗废弃物排入环境。头孢菌素通过口服和肠胃外途径给药,排泄半衰期为0.25~9 h[43]。大多数头孢菌素以母体的形式排泄,代谢率为5%~65%,使得头孢菌素母体和在体内产生的代谢产物,以及排泄后形成的初级转化产物进入环境中[44]。医院是头孢菌素类抗生素的主要排放源[45],其中第3代和第4代头孢菌素抗生素检出较多。也有研究表明,医院废水不是城市污水中抗生素残留的主要来源。在欧洲,医院抗生素用量仅占总用量的5%~20%,而英国、美国和德国的社区使用量占比为70%~75%[46]。另外,抗生素也广泛用于畜牧水产养殖[47]:美国畜牧商每年将约11 200 t抗生素投加进牛、猪和家禽的饲料中,以促进畜禽的生长[48];兽药的使用也导致残留的抗生素随着动物排泄物进入环境中[13, 49]。排泄物中的抗生素一部分会直接渗入地下水,另一部分则通过粪便进入土壤[50],随着雨水淋洗作用迁移至河流[51]或湖泊[1, 52]。
2. 环境中β-内酰胺类抗生素的污染特征
来自制药、医用和兽用的β-内酰胺类抗生素残留,可通过在污水处理厂和土壤中的迁移进入水体被底泥吸附,或者随水体迁移进入其他水环境中。抗生素残留在医院废水[11, 46]、制药废水[6, 18]、地表水[11]、河流[24, 53]、污水厂废水[11, 54]、污泥[41]和菌渣[15, 17, 22]等不同环境基质中均有检出。β-内酰胺环不稳定,易水解开环[38, 55],同时还可以与β-内酰胺酶发生酶解反应,上述过程均使其丧失抗菌活性。因此,β-内酰胺类抗生素尽管是应用最广泛的抗生素,但通常在环境中浓度较低,甚至低于检测限。
表2列出了不同环境介质中β-内酰胺类抗生素的分布浓度。医院废水中浓度为20.0 ng·L−1~4.1 μg·L−1,与其使用量和预期排放浓度相比,检出浓度较低[56-57];青霉素G、青霉素V和头孢克洛等未检出[11]。在地表水和河水中这类抗生素的残留浓度较低,阿莫西林、头孢克洛、氯唑西林、青霉素G和青霉素V的浓度在0~250 ng·L−1[11];长江、黄河和珠江中β-内酰胺类抗生素残留浓度分别为(123.1±128.2)、(343.5±345.6)及(1 606.3±1 384.3)ng·L−1[24]。头孢菌素在不同基质中浓度在0.30~30 ng·L−1,污水厂废水中浓度最高[31]。城市污水厂中检出氨苄西林、头孢氨苄、头孢噻肟,浓度分别为77.2~383.0、65.7~525.0、38.4~93.0 ng·L−1[54]。制药废水中抗生素浓度比医院废水和污水厂浓度高。青霉素制药废水中青霉素G浓度只有0.153 mg·L−1,而水解产物青霉噻唑酸、脱羧青霉噻唑酸、青霉二酸、青霉异二酸和青霉醛的浓度分别高达8.49、389.00、23.50、1.05和75.30 mg·L−1[18]。相比之下,由于污水处理过程或水循环过程中,抗生素母体被迅速降解,使得活性污泥和河流沉积物中抗生素的浓度较低[58]。在活性污泥、剩余污泥和脱水污泥中,均未检出氨苄西林和阿莫西林[41],但其水解产物可能存在较高的浓度[18]。制药菌渣中,抗生素残留高于制药废水,例如青霉素鲜菌渣中青霉素G残留浓度为5 000 mg·L−1[15-17, 19]。作为β-内酰胺类抗生素强度最高的排放源,菌渣的无害化处理和资源化利用是抗生素残留削减的关键。
表 2 β-内酰胺类抗生素在不同环境介质中的分布浓度Table 2. Distribution concentration of β-lactam antibiotics in different environmental media环境基质 检测方法 抗生素及其转化产物名称 浓度 来源 医院废水 HPLC-MS/MS 阿莫西林、青霉素G、青霉素V、头孢克洛、氯唑西林、头孢氨苄 0~4 100 ng·L−1 [11] 制药废水 HPLC-MS/MS 青霉素G、青霉噻唑酸、脱羧青霉噻唑酸、青霉二酸、青霉异二酸、青霉醛、头孢呋辛、头孢唑啉、头孢噻肟、头孢曲松、阿莫西林、头孢菌素 0.13~703.84 mg·L−1 [7-8, 18, 59] 地表水 HPLC-MS/MS 氨苄西林、哌拉西林、阿莫西林、头孢克洛、氯唑西林、青霉素G、青霉素V 0~250 ng·L−1 [11, 56] 表层海水 HPLC-MS/MS 头孢氨苄 10~180 ng·L−1 [60] 城市污水 HPLC-MS/MS 青霉素G、头孢氨苄、头孢噻肟、阿莫西林、青霉素V、头孢克洛、氨苄西林、氯唑西林、头孢菌素、苯唑西林 0~1 400 ng·L−1 [11, 54, 57, 61-63] 河流底泥 HPLC-MS/MS 青霉素G、青霉噻唑酸、脱羧青霉噻唑酸、青霉二酸、青霉异二酸、青霉醛 0~6.56 mg·kg−1 [18, 53] 活性污泥 HPLC-MS/MS 青霉素G、青霉噻唑酸、脱羧青霉噻唑酸、青霉二酸、青霉异二酸、青霉醛 0.034~470 mg·kg−1 [18, 41] 制药菌渣 HPLC-UVHPLC-MS/MS 青霉素G、头孢菌素C 2 000~5 000 mg·L−1(鲜菌渣)70~420 mg·kg−1(干菌渣) [15-17, 19, 64] 3. β-内酰胺类抗生素的环境行为
β-内酰胺类抗生素的环境行为主要包括吸附、迁移和降解。其中,吸附和迁移是β-内酰胺类抗生素在土壤中的重要环境行为。β-内酰胺类抗生素的生物降解主要由微生物的活动驱动,受到环境条件、微生物种群、化合物结构等因素影响[65]。非生物降解指抗生素不经生物作用而自行降解的过程,通常经过光解、水解等理化作用转化为其他物质。直接光解是去除湖水中头孢曲松钠的主要过程[52],也可能是地表水中头孢菌素类抗生素最重要的消除过程[33],但是在污水处理过程中光解作用贡献较小[40]。β-内酰胺类抗生素中的β-内酰胺环不稳定,在酸、碱、热、氧化剂、紫外线以及极性试剂存在的条件下易水解开环,从而丧失抗菌活性[38, 55, 66]。水解是β-内酰胺类抗生素最主要的降解途径,通过一些强化手段还可能应用于废水中抗生素的去除。因此,下面重点讨论β-内酰胺类抗生素在环境中的吸附迁移和水解过程,并特别关注大量生产的青霉素G和头孢菌素C这2种重要母体抗生素的降解途径和降解产物。
3.1 吸附与迁移
吸附对抗生素在环境中的滞留、迁移及转化有重要影响,也会影响到抗生素在环境基质中的活性和生物转化作用。吸附作用可将抗生素暂时以非生物活性的形态储存在土壤中,降低急性毒性并延长在基质中的停留时间[67]。吸附系数(Kd)用来衡量吸附能力。吸附能力强则容易在环境中累积;而吸附能力较弱则易随雨水发生迁移,并转至其他水体中,严重时还会影响地下水质。土壤的温度、pH、阳离子交换容量(cation-exchange capacity,CEC)、黏土矿物含量和有机碳含量(organic carbon,OC)会影响抗生素的吸附[5]。温度升高会影响活性污泥对不同抗生素的吸附作用。例如,温度升高后,污泥对阿莫西林、头孢噻肟、头孢克洛和头孢唑林的吸附作用增强,对普鲁卡因和头孢曲松的吸附作用降低。与青霉素类抗生素相比,活性污泥对头孢类抗生素的吸附作用受pH的影响更大[68]。
迁移是指抗生素随水体移动到其他环境基质中,或经过土壤渗透进入土壤深层或地下水的过程[69]。青霉素制药废水中,青霉素G及水解产物在处理后会随着废水的排放向收纳河流下游迁移[18]。迁移行为的影响因素包括吸附特性、淋洗速率和降解程度等。由于β-内酰胺类抗生素在土壤中的吸附能力较弱,很可能对地表及地下水造成污染[70]。抗生素在环境中的迁移能力取决于其理化特性、土壤理化特性、有机粪肥的施用和天气条件。酸雨可使抗生素加速从动物粪便向地表土壤迁移,而长时间的降雨还会促进抗生素在土壤中向下迁移[5, 50, 65]。
3.2 水解
水解是有机化合物,特别是酯类和酰胺类化合物在环境中最重要的降解途径。β-内酰胺环不稳定易水解开环。这一特性也是这类抗生素在无大量微生物种群的系统(如河流和地下水)中的主要降解途径[71]。温度和pH是影响水解速率最重要的参数。水解速率通常随着温度的升高而增加[71-72]。氨苄青霉素、头孢洛汀和头孢西丁3种抗生素在通常环境条件(pH=7,25 ℃)下的水解半衰期为5.3~27.0 d。碱性条件下的水解速率明显快于酸性和中性条件下的水解速率。温度升高10 ℃时,水解速率增加2.5~3.9倍[71]。在对阿莫西林的水解研究中也得到了类似结论[55]。
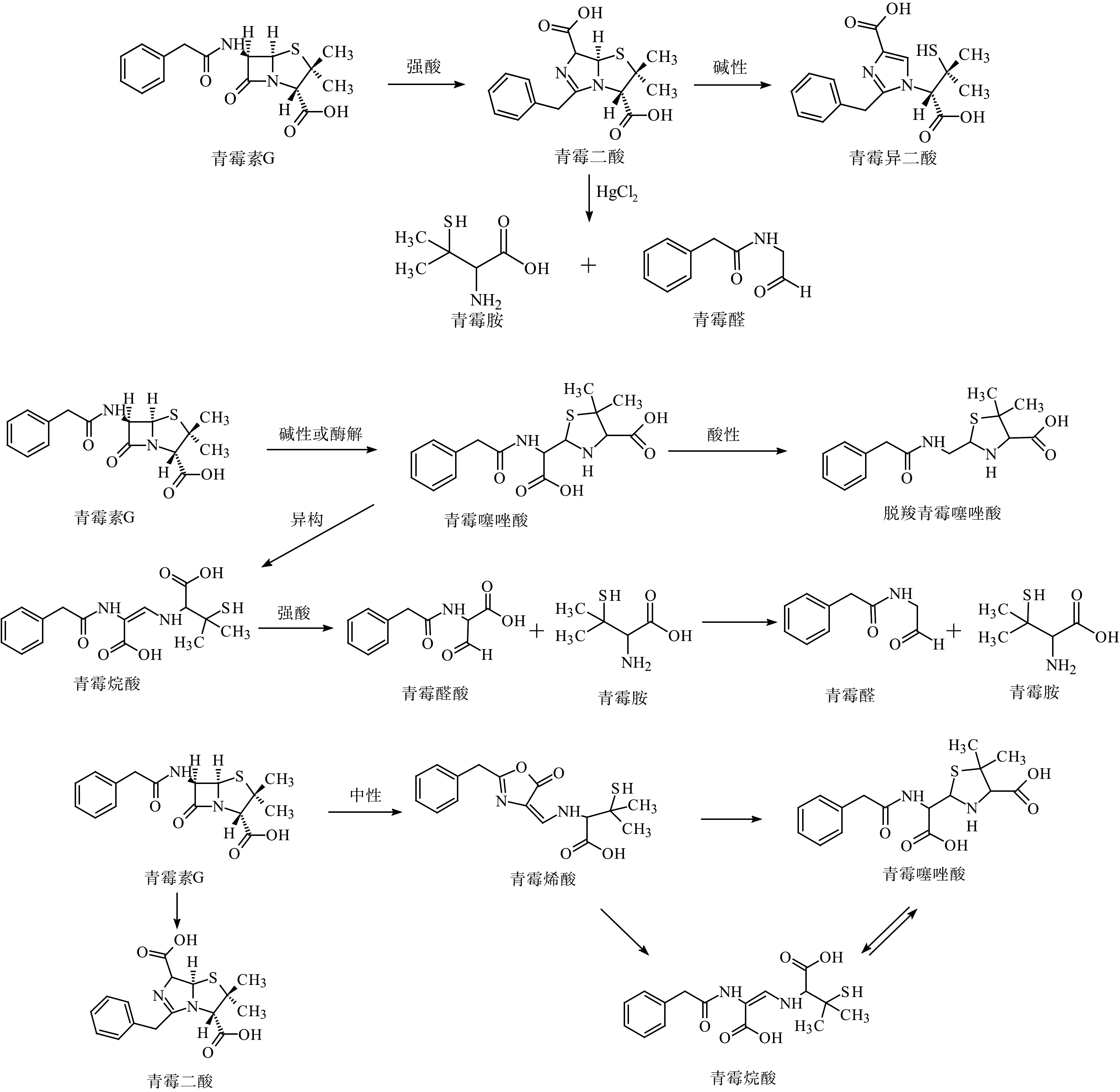
KESSLER等[73]探究了青霉素G在酸性条件下的两种降解途径,确定了青霉胺作为最终降解产物的酸性降解途径。青霉素G在酸性、碱性、中性的水解途径和酶解途径如图3所示[23,74]。在青霉素制药废水中检测到这些产物,并通过定量测定验证了产物之间的转化关系。在制药废水处理过程中,出水的青霉素G浓度为(1.68±0.48)μg·L−1,去除率为96.7%;脱羧青霉噻唑酸是青霉素的主要降解产物,浓度为(44.5±2.5)mg·L−1,摩尔浓度占总摩尔浓度的68.8%。高浓度的青霉素降解产物被排放到河流中,在污水排放的受纳河流下游,脱羧青霉噻唑酸、青霉噻唑酸和青霉二酸都具有相对的环境持久性[18]。
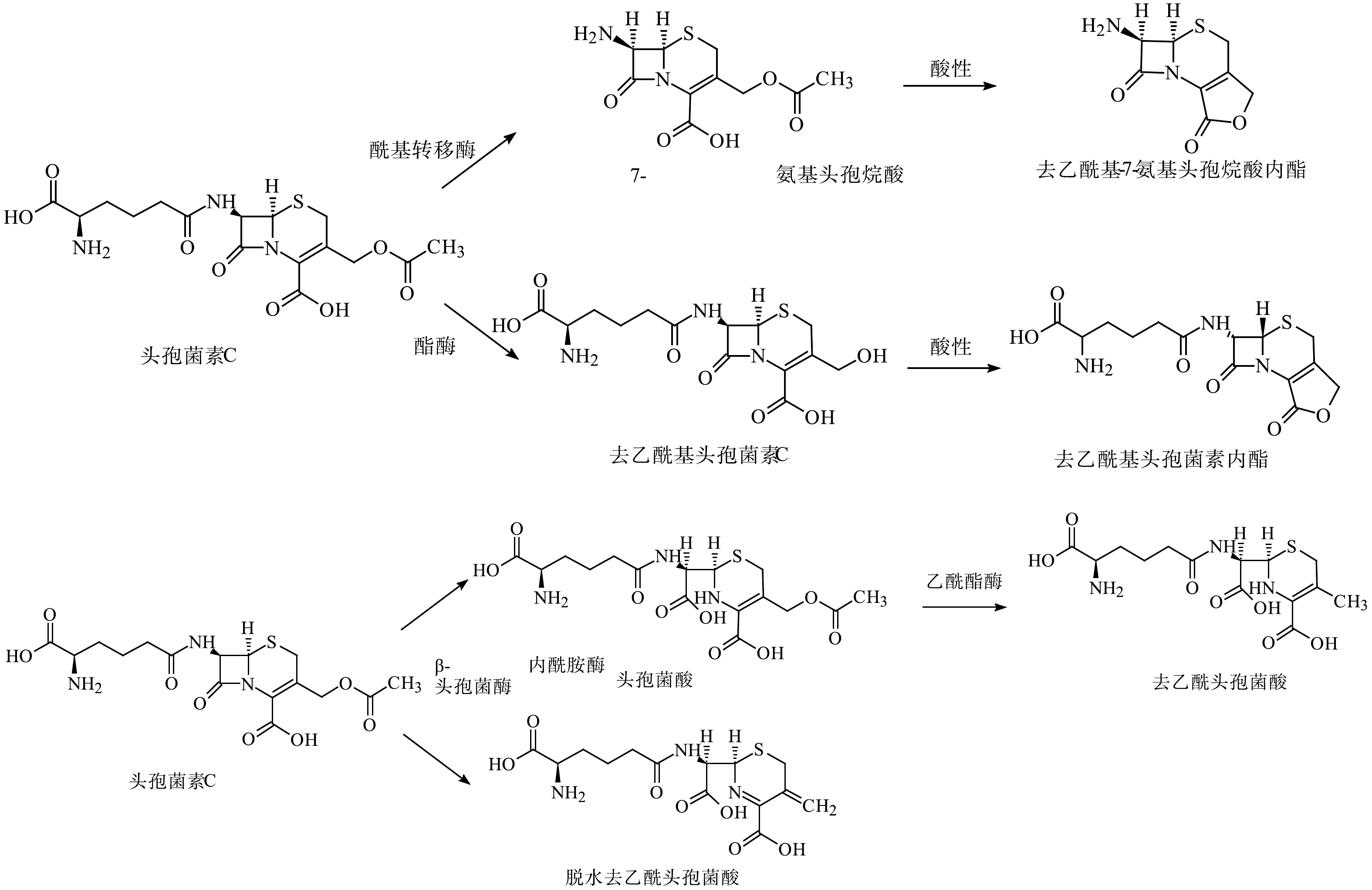
与青霉素相比,头孢菌素中四元环和六元环形成的稠合结构对水解反应更稳定,但也会发生各种化学和酶促转化。C-3位取代基、β-内酰胺环、C-4位羧基和C-7位侧链酰胺键都是头孢菌素易发生降解反应的位置(图2(b))[75]。C-3位存在离去基,使得亲核试剂或β-内酰胺酶可以水解β-内酰胺环的C—N键[23]。在酸性、碱性和中性水解中,C-3位侧链分离是头孢菌素的主要降解途径之一。头孢菌素C的水解途径[23]如图4所示。与青霉素类似,β-内酰胺环也是头孢菌素水解反应的关键位点。开环反应根据侧链结构的不同分为:中性条件的一般开环水解、侧链α-氨基参与的分子内氨解及头孢菌素环缩合成噻唑结构。另外,还存在pH依赖型的立体异构,即在中性或酸性环境下C-6位发生立体异构,而碱性环境下C-7位发生立体异构和C-7位侧链的甲氧亚胺键构型发生顺反异构[75-76]。HIRTE等[55]研究阿莫西林在酸性、碱性、中性条件下的降解过程中,识别鉴定出了45个产物,证明了阿莫西林青霉噻唑酸、阿莫西林2',5'-哌嗪二酮和阿莫西林脱羧青霉噻唑酸并非稳定产物,并首次报道了青霉胺氧化成二硫化青霉胺的过程。
4. β-内酰胺类抗生素抗性的产生和传播
抗生素的作用目标是细菌。若抗生素在环境中长期稳定存在,则会影响基质中的群落结构,导致环境中微生物菌群失调,诱导微生物抗性的产生,也会对动物、植物产生毒性作用,可能存在潜在的环境和健康风险。环境中抗生素残留对抗生素抗性细菌(ARB)及抗生素抗性基因(ARGs)的形成具有促进作用。
世界卫生组织将抗生素抗性列为一类亟需解决的全球性公共健康问题。各种抗生素第一次观察到抗性的时间序列已被系统总结[38]。19世纪40年代,临床上就出现了青霉素抗性菌。1946—1948年,青霉素抗药菌株比例从14%上升到59%。抗药菌的抗药机制[35, 37-38]主要包括4个方面:抗生素作用靶点突变、酶促反应使抗生素失活、细胞膜特性改变和外排泵机制、改变代谢途径。对于β-内酰胺类抗生素,细菌主要通过分泌β-内酰胺酶,释放到细胞外周胞质中水解药效基团β-内酰胺环,从而使其到达作用靶点前失活。此外,细菌也通过改变抗生素作用对象青霉素结合蛋白(PBPs)的结构产生抗性,但由于PBPs变异比较困难,故分泌β-内酰胺酶是β-内酰胺类抗生素最重要的抗性机制[77]。抗性基因是通常由基因突变产生的并赋予宿主细胞对抗生素有耐受性的一类基因。而抗性基因通过整合到质粒和整合子等水平转移元件上,实现了在不同菌种之间的水平转移[37]。初级抗性在微生物中天然存在,例如铜绿假单胞菌对青霉素G的抗性,相同物种生物通过细胞分裂(垂直转移)“继承”该抗性。在微生物与抗生素接触过程中会产生次级抗性,质粒介导的抗性可在微生物之间转移,染色体外遗传物质通过结合在不同细菌之间转移(水平转移)[78]。
碳青霉烯类抗生素是抗菌谱最广、抗菌活性最强的非典型β-内酰胺类抗菌药物。这类抗生素对超广谱β-内酰胺酶(ESBL)和头孢菌素酶 (AmpC酶)具有高度稳定性,是医学临床治疗中产生超广谱β-内酰胺酶类耐药肠肝菌科细菌等多重耐药革兰氏阴性菌感染的重要药物。随着这些药物广泛应用于临床,碳青霉烯类耐药肠杆菌科细菌等各种广泛耐药细菌出现并流行,碳青霉烯抗菌药物的疗效已经明显降低[79-80]。20世纪80年代,还出现铜绿假单胞菌、沙雷菌等对碳青霉烯类药物耐药的现象。KPC型碳青霉烯酶于1996年在美国发现[81]。目前,常见的碳青霉烯酶类耐药基因主要有KPC、IMP、VIM和NDM等,国内以KPC和IMP为主。碳青霉烯类抗生素抗药性产生的机理主要有3种:1)细菌通过产生碳青霉烯酶产生抗药性;2)产生质粒或染色体介导β-内酰胺酶合并外膜蛋白的缺失或数量的减少;3)药物作用靶位的特异性改变。其中,碳青霉烯酶所造成的危害最为严重[82]。由于碳青霉烯类耐药肠杆菌具有流行范围广、传播速度快、多重耐药以及引起的疾病死亡率高等特点,美国己经将碳青霉烯类耐药肠杆菌列为最为紧急的3大威胁之一[83]。目前,动物养殖、环境和临床细菌的碳青霉烯耐药菌和抗性基因及其关联性研究是一个热点。
不同环境基质中都已检出β-内酰胺类抗生素抗药菌和抗性基因。对自然水体中β-内酰胺酶基因和整合子的发生和分子多样性评估[84]发现,在77.8%的肠杆菌科和10.5%的气单胞菌中检测到β-内酰胺酶基因,最常检出基因是blaTEM。海水中超过90%的细菌菌株对1种以上的抗生素具有抗性,而20%的细菌对至少5种抗生素具有抗性。医院和集约化养殖场的废水可能是环境中抗药菌和抗性基因的主要污染源[85]。污水处理厂则被认为是环境中抗性基因传播的热点地区,因为污水处理过程为抗药菌增殖以及抗性基因在不同微生物之间的水平转移提供了便利条件[38]。目前,已有86种β-内酰胺抗性基因在11个国家的污水处理厂进水、出水和活性污泥中的分布和变化情况被报道[38]。污水处理厂中抗生素残留在抗性菌及抗性基因的维持和传播中起着重要作用,除了选择抗性表型,还可能干扰土著细菌群落。制药废水的抗生素残留进入水体后也能够改变水体的微生物系统[6, 86],通过选择性压力诱导水体中的微生物产生抗性基因,并进行传播扩散[85]。本课题组的前期研究也发现,由于可能受到废水中青霉素G及转化产物的影响,在青霉素生产废水和下游河流中发现了大量抗药菌,对β-内酰胺类抗生素具有极高的抗性,对其他各类抗生素也有广泛的抗性,具有一定的环境风险[86]。此外,携带了各种抗性基因的I型整合子(intI1)在废水和下游河流的菌株中也被检出,进一步说明了抗性基因在细菌间水平转移的可能性。制药菌渣中的青霉素G[20]、头孢菌素C[16]残留及转化产物在堆肥过程[17, 21]或施用菌渣肥[20]后,在土壤中也会诱导产生抗性基因[20, 22]和抗药菌[21]。
当考虑导致抗生素抗药菌和抗性基因出现、扩增和持续存在的因素时,传统的假设是“抗生素的使用是这些过程主要驱动力”[87]。处于亚抑制浓度的抗生素可能会影响细胞功能,并改变毒力因子基因表达或抗生素抗性转移。一些研究表明,医院废水中抗药性的增长与头孢菌素的使用呈正相关[10, 85];但也有证据表明,抗药性并不总与所用药物的量或环境中残留物的浓度有关[48]。肠胃外施用头孢噻呋对胃肠道中头孢噻呋抗药细菌的流行具有有限或短期的影响。虽然这种反应可能足以解释对头孢菌素广泛抗药的模式,但大约2/3的头孢噻呋代谢物会从尿液中排出,这增加了环境选择在扩增和维持抗生素抗药性起重要附加作用的可能性[87]。不同的基因可能具有不同的维持动力学,可能与携带它们的宿主微生物有关[85, 88]。环境中β-内酰胺类抗生素抗药菌和抗性基因发展和传播的机制还需要进一步深入探讨。
5. 废水和菌渣中β-内酰胺类抗生素的控制技术
与临床使用和动物养殖抗生素造成的环境广泛存在的污染相比,制药行业的污染源相对集中,但污染排放强度却是最高,故制药废水和菌渣是β-内酰胺类抗生素排放强度最高的排放源。若不对制药废水和菌渣进行有效控制,抗生素母体及残留效价则可能直接排放到环境中,或通过管网进入城市污水处理厂,从而导致抗生素从污水厂向环境中的排放。因此,必须在源头对抗生素残留效价进行控制,阻断抗生素和抗性基因向环境中排放。
对废水和菌渣中β-内酰胺类抗生素的去除技术,主要有生物处理和物化处理两类。通常采用厌氧、好氧和缺氧等生物处理过程去除制药废水中的COD,并实现氨氮的硝化反应和反硝化脱氮。以山西某制药厂为例,该厂青霉素生产废水生化处理后出水COD为218.0 mg·L−1,无法达到一级排放标准[89]。使用UASB反应器处理制药废水时,COD去除率为39%~85%,效果不稳定;同时6-氨基青霉烷酸和阿莫西林的去除率分别只有19%~33%和13%~47%[90]。当模拟配水中阿莫西林浓度从250 mg·L−1提高至650 mg·L−1时,活性污泥对阿莫西林的去除率从88.79%下降至完全无法去除[91]。因此,尽管β-内酰胺类抗生素容易生物降解,但因制药废水水质成分复杂,残留的抗生素和残留基质、试剂可能会影响生物处理效果[38, 61, 92]。抗生素的浓度、稳定性和对微生物的抑制作用都会造成处理效果的不稳定[31],更为严重的是可能会导致废水生物处理过程中抗性基因的产生和排放[93-95]。解决抗生素废水生物处理技术瓶颈的关键,是在废水进入生物处理之前,利用预处理技术选择性去除废水中的抗生素效价残留,降低对微生物的抑制作用,从而达到稳定的处理效果[96]。
抗生素生产过程除了产生制药废水,还会产生大量生产菌渣。制药菌渣含水率高,主要成分为菌丝体、剩余培养基、代谢中间产物、有机溶媒以及少量残留的抗生素[97]。2008年,抗生素菌渣被列入《国家危险废物名录》,如何实现抗生素菌渣合理有效利用与安全处置已成为制药企业亟待解决的难题[98]。许多研究者通过生物处理技术对菌渣进行无害化处理和资源化利用。例如,厌氧消化可以将头孢菌素C菌渣中低品位的有机质转化为高品位沼气,可实现菌渣资源化利用[99];好氧堆肥可以消除青霉素G菌渣中的抗生素残留,但堆肥过程也会导致抗药菌和抗性基因的产生[100-103],在其他青霉素菌渣好氧堆肥的研究中也得出了相似的结论[17]。最近的研究[104]发现,采用高温(70 ℃)厌氧消化对螺旋霉素菌渣进行预处理具有可行性。高温消化可大幅度降低抗生素的浓度,同时由于相应宿主的减少,抗药基因的丰度也在7 d之内减少。实际上,处理菌渣问题的关键是研发出去除抗生素效价残留的有效技术,以阻断抗性传播为目标,并在此基础上实现菌渣无害化处理及资源化利用。
氧化等一些物理化学技术通常对于水中抗生素的去除具有很好的效果。表3列出了常见的物理化学去除工艺及效果。吸附[105-106]和膜过滤[57]是常规的物理处理技术。这类技术通过分子间作用力或孔径截留作用将抗生素从一个相中分离转移至另一相,但抗生素本身没有发生降解反应。由于头孢菌素具有在相对较宽的波长范围内的光吸收作用,故光催化技术广泛用于头孢菌素类抗生素的去除技术的研究中[33, 52],但目前还难以进行实际工程应用。臭氧、芬顿等高级氧化技术在β-内酰胺类抗生素的去除研究中体现出反应速度快和去除效率高的特点,可以高效去除溶液中抗生素母体[107-108],但在氧化过程产生的降解产物的结构、毒性,特别是在复杂实际废水中的适用性还有待进一步探究[31]。在青霉素制药废水深度处理工艺探究中发现,Fenton氧化法、Cu/Fe催化还原法、臭氧氧化法均可有效降低COD残留。在Fenton氧化最优条件下,出水COD含量可降至22.5 mg·L−1 [89]。采用Fenton氧化和Fe/C微电解2种方法预处理7-氨基头孢烷酸制药废水。结果表明:2种方法均可有效提高COD去除率和废水可生化性;但Fenton氧化法存在药耗量大,处理成本高的问题;而Fe/C微电解发也存在反应时间较长的问题[109]。物理化学处理技术在制药菌渣无害化和资源化过程中也有一些初步研究。例如,青霉素菌渣经过100 ℃热水解作用,98%的抗生素残留被去除,制取的菌渣肥可以作为有机肥料应用于农业生产[15, 20]。也有研究者发现,微波加热温度可显著影响菌渣中残留抗生素的去除率,700 W辐射功率下快速升温至100 ℃条件下持续处理15 min,头孢菌素C的去除率可以达到99.9%[16]。
表 3 常见的物理化学处理工艺及处理效果Table 3. Common physical and chemical treatment process and treatment effect处理工艺 基质 处理条件 抗生素名称 浓度 去除效果 来源 吸附 制药废水 pH 为2~7 温度 30 ℃吸附剂量0.1~3.5 g 阿莫西林 317 mg·L−1 膨润土为吸附剂,去除率88.01%;活性炭为吸附剂,去除率94.67% [59] 膜处理 城市污水 MF微滤2 min,平衡罐5 min,RO反渗透 0.5 min,加氯反冲洗 阿莫西林 90 ng·L−1 头孢氨苄去除率87%~100%,其余抗生素去除率100% [57] 氯化 模拟配水 阿莫西林和头孢拉啶:ClO2和抗生素摩尔比为 0.25~2.0,pH=8.0反应时间1 min;青霉素:ClO2和抗生素摩尔比为 0.25~1.5,pH=3.5反应时间2 h 阿莫西林头孢拉啶青霉素G 1.6 mg·L−11.8 mg·L−125.0 mg·L−1 阿莫西林和头孢拉啶在1 min内全部降解,青霉素可以在2 h内全部降解 [110] 芬顿 模拟配水 pH为3,H2O2浓度25 mmol·L−1Fe3+浓度1.5 mmol·L−1 青霉素G 400 mg·L−1 配水中COD的去除率达56%,TOC的去除率达46% [111] 模拟配水 m(COD): m(H2O2): m(Fe2+)=1:3:0.3pH=3 阿莫西林氨苄青霉素氯唑西林 104 mg·L−1105 mg·L−1103 mg·L−1 2 min抗生素完全降解,10 min生物降解性提高到0.37,60 min COD和DOC降解率为81.4%和54.3% [112] 光催化 模拟配水 pH 为3.0~9.0,太阳光源,催化剂TiO2 0.1~0.7 g·L−1或不同比例铁碳混合物 阿莫西林 100 mg·L−1 最优条件下去除率可以达到85% [113] 模拟配水 pH为 3.0~11.0,紫外光源365 nm,6 W催化剂TiO2 0.5~2.0 g·L−1,H2O2 50~300 mg·L−1 阿莫西林氨苄青霉素氯唑西林 104 mg·L−1105 mg·L−1103 mg·L−1 pH=5,TiO2 1.0 g·L−1,抗生素去除率均达50%,DOC去除率81%;pH=5,TiO2为1.0 g·L−1,H2O2为100 mg·L−1,抗生素30 min内完全降解,24 h矿化率达40% [114] 臭氧 模拟配水 pH为2.5~7.2O3浓度为1.6×10−4 mol·L−1 阿莫西林 210 mg·L−1 4 min阿莫西林去除率90%,20 min阿莫西林矿化率可以达到18.2%,延长时间后,矿化率保持较低水平 [115] 模拟配水 pH为3.0~11.0,O3量为3 g·(h·L)−1H2O2浓度0~200 mmol·L−1 头孢曲松青霉素G − 60 min抗生素去除率95%,TOC去除率45%,提高废水可生化性 [110] 模拟配水 预臭氧pH 为7.0~12.0,O3量1 800 mg·(h·L)−1;H2O2 100 mmol·L−1 青霉素G 600 mg·L−1 pH=7,预臭氧工艺提高废水可生化性,但并不能完全去除生态毒性,还存在严重生物抑制作用;1 h内臭氧COD去除率为37%,而经预臭氧COD去除率达76% [116] 水热 制药菌渣 高压釜内部容积1.0 L,内径70 mm,温度100~220 ℃ 头孢菌素C − 在100~220 ℃和0~60 min内,头孢菌素C的去除率为99.0%~99.9% [66] 热水解 制药菌渣 盐酸2 mol·L−1,投加量10~60 mL,温度50~100 ℃ 青霉素G 9 g·mL−1(效价) 最优条件盐酸投加40 mL浸泡1 h,90 ℃水浴中加热机械搅拌3 h,过滤,效价去除率80.93% [64] 制药菌渣 加水倍数为3,水解温度60 ℃,水解时间30 min 青霉素G 5 000 mg·kg−1 水解后菌渣青霉素残留小于0.5 mg·kg−1,凯式氮削减率大于45%,有效降低青霉素残留及凯氏氮对厌氧消化的影响,为厌氧消化高效、稳定进行创造有利条件 [19] 热水解 制药菌渣 温度60~100 ℃ 青霉素G 2 000 mg·L−1 60 ℃时,20 min去除率为20%;100 ℃时,20 min去除率为98% [15] 微波 制药菌渣 温度100 ℃,微波功率为300、500、700 W 头孢菌素C 420 mg·kg−1 前150 s降解效率较低,此后降解速率明显提升,不同功率条件微波辐射15 min,降解率均超过99.9% [16] 综上所述,尽管生物处理过程能削减部分抗生素,但抗生素残留会导致处理效果不稳定和抗性基因产生、排放问题。高级氧化技术可以在生物处理之后进一步去除残留抗生素,阻断抗生素向环境排放。但该技术主要用于模拟废水的研究,在实际废水处理中还存在操作困难、选择性差、成本高等问题,且可能产生具有较强毒性的未知中间产物[117]。因此,如何从制药废水中高效选择性去除残留抗生素及其相关物质仍然是一个技术挑战。阻断抗性基因向环境中排放的关键,是在生物处理工序之前有效削减和控制抗生素效价残留,并根据抗生素特性,开发针对抗生素抗菌活性基团的源头预处理技术。笔者所在研究团队根据四环素类抗生素药效官能团易水解的特性,探究了四环素类抗生素的水解动力学及其效价变化,通过优化水解条件可以显著加快四环素和土霉素的水解,并有效降低抗生素对生物处理微生物的抑制[118]。在此基础上进行了现场中试实验[119],验证了强化水解预处理工艺,并与生物处理结合进行现场工程应用,实现了常规指标、抗生素及抗性基因的源头控制。该技术思路有望实现β-内酰胺类抗生素废水的无害化处理。同时,抗生素及其代谢产物残留,还有抗性基因均是菌渣资源化利用造成环境风险的重要安全隐患,在以后的研究中需要从这两个方面对菌渣资源化利用进行安全性评估,为菌渣利用安全性评估方法和控制标准的制定提供科学基础。
6. 研究展望
1)由于β-内酰胺类抗生素具有易水解和生物降解的特性,在环境中通常浓度很低或低于检测限。然而,抗生素母体的削减并不意味着环境效应的消除,各种水解、降解产物等相关物质可能会贡献残留效价,导致环境中β-内酰胺抗药菌和抗性基因的产生和传播。因此,需要对β-内酰胺类抗生素的降解产物和降解途径进行深入探究,进一步明确降解产物与细菌抗性产生和传播之间的关系。
2)对β-内酰胺类抗生素残留的去除,除了母体之外,还应关注抗生素残留效价,将具有抑菌活性的中间产物、前驱体或者生产副产物,以及经过物化或者生物降解等过程后保留抗菌活性的中间转化产物纳入β-内酰胺类抗生素污染控制评价体系。为了明确残留抗生素和效价的控制目标和标准,需要对抗生素在促进抗性基因产生和发生水平转移方面的浓度阈值进行研究。
3)针对β-内酰胺类抗生素制药废水等高浓度抗生素残留的废水,需要开发选择性地去除抗生素效价的预处理技术,从源头解决由于抗生素效价残留造成生物处理效果不稳定的问题,阻止抗性的产生;同时采用末端保障深度处理技术,阻断抗生素残留、抗性菌和抗性基因向环境的传播,保障废水的安全排放。为了构筑抗生素和抗性基因控制多级屏障技术体系,应当将源头控制预处理技术和末端保障深度处理技术联合起来。
4)包括β-内酰胺类抗生素在内的发酵类抗生素的制药菌渣已被列入《国家危险废物名录》。针对其产生量大、处理难度大等现实问题,并根据《制药工业污染防治技术政策》(征求意见稿) 中提出的“鼓励开发发酵菌渣在生产工艺中的再利用技术、无害化处理技术、综合利用技术”政策建议,如何实现抗生素菌渣合理有效利用与安全处置已成为制药企业亟待解决的难题[98]。未来的研究将以去除抗生素效价残留、阻断抗性传播为目标,开发和优化菌渣处理技术,同时围绕菌渣资源化利用过程中抗生素残留效价和抗性发展进行系统评价,为菌渣无害化处理及资源化利用提供参考。
-
图 1 2001—2020年与重金属、有机污染物和重金属-有机复合污染研究相关的土壤淋洗论文数量数据基于Web of Science—Science Citation Index Expanded
Figure 1. The number of publications on soil washing in relation to heavy metal, organic pollutant, and co-contamination of heavy metal and organic pollutant from 2001 to 2020 Data were based on the Web ofScience—Science Citation Index Expanded
表 1 常用土壤修复技术
Table 1. Commonly used soil remediation techniques
类别Category 修复方法Remediation technique 原理Principle 优势Advantage 局限性Limitation 参考文献Reference 物理修复 客土法/换土法 将洁净土壤与污染土壤混合以降低污染物浓度/将洁净土壤代替全部污染土壤。 修复周期短,操作简便。 仅适用于小型污染场地的浅层土壤,成本较高。 [14-15] 热处理法 通过热效应,土壤温度升高使污染物挥发。 对挥发性土壤污染物去除效果较好,可回收重金属。 应用范围窄,能耗较高,可能导致大气污染。 [16-17] 电化学法 通过电场中离子的定向移动和基于电化学的氧化还原反应去除重金属和有机污染物。 污染物去除效率高,修复速度快,对土壤性质扰动小。 不适合水分含量高的土壤和非均质土壤,能耗较高。 [18-20] 化学修复 固化/稳定化法 采用惰性物质包裹污染物,减少污染物与土壤的接触面积/向污染土壤中添加稳定剂降低污染物的迁移和生物有效性。 有效降低污染物的环境风险,修复成本低,操作简便,周期短。 污染物总量并未降低,修复效果不稳定,需长期监测。 [21-23] 淋洗法 淋洗剂在吸附、离子交换、配位络合等作用下提取土壤中的污染物。 能够实现对污染物的永久去除,修复周期短,对高浓度污染土壤具有良好的修复效果。 可能会带来二次污染,需考虑淋洗废水的处理问题。 [11-12] 氧化/还原法 采用氧化剂或还原剂与土壤中的污染物发生氧化或还原反应。 可降低土壤重金属环境毒性,有效去除有机污染物。 对土壤性质破坏程度较高。 [24-25] 生物修复 植物修复 通过植物的根际稳定和转运机制去除污染物。 修复成本低,操作简便,环境友好,无二次污染。 修复周期长,对光照、温度、污染物含量和土壤性质有一定要求。 [26-28] 微生物修复 通过微生物的吸附和代谢机制去除污染物。 [29-30] -
[1] CÉBRON A, BEGUIRISTAIN T, BONGOUA-DEVISME J, et al. Impact of clay mineral, wood sawdust or root organic matter on the bacterial and fungal community structures in two aged PAH-contaminated soils [J]. Environmental Science and Pollution Research, 2015, 22(18): 13724-13738. doi: 10.1007/s11356-015-4117-3 [2] KHALID S, SHAHID M, NIAZI N K, et al. A comparison of technologies for remediation of heavy metal contaminated soils [J]. Journal of Geochemical Exploration, 2017, 182: 247-268. doi: 10.1016/j.gexplo.2016.11.021 [3] LI C, SANCHEZ G M, WU Z F, et al. Spatiotemporal patterns and drivers of soil contamination with heavy metals during an intensive urbanization period (1989-2018) in Southern China [J]. Environmental Pollution, 2020, 260: 114075. doi: 10.1016/j.envpol.2020.114075 [4] SUN B, ZHAO F J, LOMBI E, et al. Leaching of heavy metals from contaminated soils using EDTA [J]. Environmental Pollution, 2001, 113(2): 111-120. doi: 10.1016/S0269-7491(00)00176-7 [5] HE Z, SHENTU J, YANG X, et al. Heavy metal contamination of soils: Sources, indicators, and assessment [J]. Journal of Environmental Indicators, 2015, 9: 17-18. [6] CAI Q Y, MO C H, WU Q T, et al. The status of soil contamination by semivolatile organic chemicals (SVOCs) in China: A review [J]. Science of the Total Environment, 2008, 389(2/3): 209-224. [7] DERMONT G, BERGERON M, MERCIER G, et al. Soil washing for metal removal: A review of physical/chemical technologies and field applications [J]. Journal of Hazardous Materials, 2008, 152(1): 1-31. doi: 10.1016/j.jhazmat.2007.10.043 [8] DALY G L, LEI Y D, TEIXEIRA C, et al. Organochlorine pesticides in the soils and atmosphere of Costa Rica [J]. Environmental Science & Technology, 2007, 41(4): 1124-1130. [9] LIU Y Z, WU T, WHITE J C, et al. A new strategy using nanoscale zero-valent iron to simultaneously promote remediation and safe crop production in contaminated soil [J]. Nature Nanotechnology, 2021, 16(2): 197-205. doi: 10.1038/s41565-020-00803-1 [10] EHLERS L J, LUTHY R G. Contaminant bioavailability in soil and sediment [J]. Environmental Science & Technology, 2003, 37(15): 295A-302A. [11] GAUTAM P, BAJAGAIN R, JEONG S W. Combined effects of soil particle size with washing time and soil-to-water ratio on removal of total petroleum hydrocarbon from fuel contaminated soil [J]. Chemosphere, 2020, 250: 126206. doi: 10.1016/j.chemosphere.2020.126206 [12] WAN X M, LEI M, CHEN T B. Review on remediation technologies for arsenic-contaminated soil [J]. Frontiers of Environmental Science & Engineering, 2019, 14(2): 1-14. [13] WANG Q W, CHEN J J, ZHENG A H, et al. Dechelation of Cd-EDTA complex and recovery of EDTA from simulated soil-washing solution with sodium sulfide [J]. Chemosphere, 2019, 220: 1200-1207. doi: 10.1016/j.chemosphere.2018.12.212 [14] DERAKHSHAN NEJAD Z, JUNG M C, KIM K H. Remediation of soils contaminated with heavy metals with an emphasis on immobilization technology [J]. Environmental Geochemistry and Health, 2018, 40(3): 927-953. doi: 10.1007/s10653-017-9964-z [15] GONG Y Y, ZHAO D Y, WANG Q L. An overview of field-scale studies on remediation of soil contaminated with heavy metals and metalloids: Technical progress over the last decade [J]. Water Research, 2018, 147: 440-460. doi: 10.1016/j.watres.2018.10.024 [16] ILYAS N, SHOUKAT U, SAEED M, et al. Comparison of plant growth and remediation potential of pyrochar and thermal desorption for crude oil-contaminated soils [J]. Scientific Reports, 2021, 11: 2817. doi: 10.1038/s41598-021-82243-y [17] PARK M O, KIM M H, HONG Y. The kinetics of mercury vaporization in soil during low-temperature thermal treatment [J]. Geoderma, 2020, 363: 114150. doi: 10.1016/j.geoderma.2019.114150 [18] LI J P, DING Y, WANG K L, et al. Comparison of humic and fulvic acid on remediation of arsenic contaminated soil by electrokinetic technology [J]. Chemosphere, 2020, 241: 125038. doi: 10.1016/j.chemosphere.2019.125038 [19] STRECHE C, COCÂRŢĂ D M, ISTRATE I A, et al. Decontamination of petroleum-contaminated soils using the electrochemical technique: Remediation degree and energy consumption [J]. Scientific Reports, 2018, 8(1): 3272. doi: 10.1038/s41598-018-21606-4 [20] HASAN S W, AHMED I, HOUSANI A A, et al. Molecular and ionic-scale chemical mechanisms behind the role of nitrocyl group in the electrochemical removal of heavy metals from sludge [J]. Scientific Reports, 2016, 6: 31828. doi: 10.1038/srep31828 [21] SHEN Z T, JIN F, O'CONNOR D, et al. Solidification/stabilization for soil remediation: An old technology with new vitality [J]. Environmental Science & Technology, 2019, 53(20): 11615-11617. [22] XIA W Y, DU Y J, LI F S, et al. In-situ solidification/stabilization of heavy metals contaminated site soil using a dry jet mixing method and new hydroxyapatite based binder [J]. Journal of Hazardous Materials, 2019, 369: 353-361. doi: 10.1016/j.jhazmat.2019.02.031 [23] ZHANG Y, WANG X M, JI H B. Co-remediation of Pb contaminated soils by heat modified sawdust and Festuca arundinacea [J]. Scientific Reports, 2020, 10: 4663. doi: 10.1038/s41598-020-61668-x [24] KAN H S, WU D, WANG T C, et al. Crystallographic manganese oxides enhanced pyrene contaminated soil remediation in microwave activated persulfate system [J]. Chemical Engineering Journal, 2021, 417: 127916. doi: 10.1016/j.cej.2020.127916 [25] BIANCO PREVOT A, GINEPRO M, PERACACIOLO E, et al. Chemical vs bio-mediated reduction of hexavalent chromium. An in-vitro study for soil and deep waters remediation [J]. Geoderma, 2018, 312: 17-23. doi: 10.1016/j.geoderma.2017.09.032 [26] YANG Y R, LIANG Y, HAN X Z, et al. The roles of arbuscular mycorrhizal fungi (AMF) in phytoremediation and tree-herb interactions in Pb contaminated soil [J]. Scientific Reports, 2016, 6(1): 1-14. doi: 10.1038/s41598-016-0001-8 [27] XU L, XING X Y, LIANG J N, et al. In situ phytoremediation of copper and cadmium in a co-contaminated soil and its biological and physical effects [J]. RSC Advances, 2019, 9(2): 993-1003. doi: 10.1039/C8RA07645F [28] BASUMATARY B, BORDOLOI S, SARMA H P. Crude oil-contaminated soil phytoremediation by using Cyperus brevifolius (rottb.) hassk [J]. Water, Air, & Soil Pollution, 2012, 223(6): 3373-3383. [29] MANGWANI N, KUMARI S, DAS S. Marine bacterial biofilms in bioremediation of polycyclic aromatic hydrocarbons (PAHs) under terrestrial condition in a soil microcosm [J]. Pedosphere, 2017, 27(3): 548-558. doi: 10.1016/S1002-0160(17)60350-3 [30] WU C, LI F, YI S W, et al. Genetically engineered microbial remediation of soils co-contaminated by heavy metals and polycyclic aromatic hydrocarbons: Advances and ecological risk assessment [J]. Journal of Environmental Management, 2021, 296: 113185. doi: 10.1016/j.jenvman.2021.113185 [31] LIAO X Y, LI Y, YAN X L. Removal of heavy metals and arsenic from a co-contaminated soil by sieving combined with washing process [J]. Journal of Environmental Sciences, 2016, 41: 202-210. doi: 10.1016/j.jes.2015.06.017 [32] ISSARO N, BESANCON S, BERMOND A. Thermodynamic and kinetic study of the single extraction of mercury from soil using sodium-thiosulfate [J]. Talanta, 2010, 82(5): 1659-1667. doi: 10.1016/j.talanta.2010.07.045 [33] JHO E H, IM J, YANG K, et al. Changes in soil toxicity by phosphate-aided soil washing: Effect of soil characteristics, chemical forms of arsenic, and cations in washing solutions [J]. Chemosphere, 2015, 119: 1399-1405. doi: 10.1016/j.chemosphere.2014.10.038 [34] KIM E J, JEON E K, BAEK K. Role of reducing agent in extraction of arsenic and heavy metals from soils by use of EDTA [J]. Chemosphere, 2016, 152: 274-283. doi: 10.1016/j.chemosphere.2016.03.005 [35] ZOU Z L, QIU R L, ZHANG W H, et al. The study of operating variables in soil washing with EDTA [J]. Environmental Pollution, 2009, 157(1): 229-236. doi: 10.1016/j.envpol.2008.07.009 [36] WANG Y, ZHANG B R, DENG T L, et al. Reclamation of EDTA by sodium tetraethylenepentamine-multi dithiocarbamate after soil washing process with EDTA [J]. Environmental Earth Sciences, 2017, 76(8): 1-10. [37] WANG A D, ZOU D S, ZENG X Y, et al. Speciation and environmental risk of heavy metals in biochars produced by pyrolysis of chicken manure and water-washed swine manure [J]. Scientific Reports, 2021, 11: 11994. doi: 10.1038/s41598-021-91440-8 [38] JELUSIC M, LESTAN D. Effect of EDTA washing of metal polluted garden soils. Part I: Toxicity hazards and impact on soil properties [J]. Science of the Total Environment, 2014, 475: 132-141. doi: 10.1016/j.scitotenv.2013.11.049 [39] ZHANG T, WEI H, YANG X H, et al. Influence of the selective EDTA derivative phenyldiaminetetraacetic acid on the speciation and extraction of heavy metals from a contaminated soil [J]. Chemosphere, 2014, 109: 1-6. doi: 10.1016/j.chemosphere.2014.02.039 [40] WANG G Y, ZHANG S R, XU X X, et al. Heavy metal removal by GLDA washing: Optimization, redistribution, recycling, and changes in soil fertility [J]. Science of the Total Environment, 2016, 569/570: 557-568. doi: 10.1016/j.scitotenv.2016.06.155 [41] FOUNTAIN J C, STARR R C, MIDDLETON T, et al. A controlled field test of surfactant-enhanced aquifer remediation [J]. Ground Water, 1996, 34(5): 910-916. doi: 10.1111/j.1745-6584.1996.tb02085.x [42] WANG M X, ZHANG B, LI G R, et al. Efficient remediation of crude oil-contaminated soil using a solvent/surfactant system [J]. RSC Advances, 2019, 9(5): 2402-2411. doi: 10.1039/C8RA09964B [43] SEO Y, BISHOP P L. Influence of nonionic surfactant on attached biofilm formation and phenanthrene bioavailability during simulated surfactant enhanced bioremediation [J]. Environmental Science & Technology, 2007, 41(20): 7107-7113. [44] OCHOA-LOZA F J, ARTIOLA J F, MAIER R M. Stability constants for the complexation of various metals with a rhamnolipid biosurfactant [J]. Journal of Environmental Quality, 2001, 30(2): 479-485. doi: 10.2134/jeq2001.302479x [45] DESHPANDE S, SHIAU B J, WADE D, et al. Surfactant selection for enhancing ex situ soil washing [J]. Water Research, 1999, 33(2): 351-360. doi: 10.1016/S0043-1354(98)00234-6 [46] 杨湘智, 周浩, 梅皓天, 等. 螯合型表面活性剂修复石油-镉复合污染土壤研究 [J]. 现代化工, 2020, 40(7): 74-78. doi: 10.16606/j.cnki.issn0253-4320.2020.07.016 YANG X Z, ZHOU H, MEI H T, et al. Study on remediation of petroleum-cadmium co-contaminated soil by chelating surfactant [J]. Modern Chemical Industry, 2020, 40(7): 74-78(in Chinese). doi: 10.16606/j.cnki.issn0253-4320.2020.07.016
[47] ZHANG S T, HE Y, WU L N, et al. Remediation of organochlorine pesticide-contaminated soils by surfactant-enhanced washing combined with activated carbon selective adsorption [J]. Pedosphere, 2019, 29(3): 400-408. doi: 10.1016/S1002-0160(17)60328-X [48] LI G, GUO S H, HU J X. The influence of clay minerals and surfactants on hydrocarbon removal during the washing of petroleum-contaminated soil [J]. Chemical Engineering Journal, 2016, 286: 191-197. doi: 10.1016/j.cej.2015.10.006 [49] SHI Z T, CHEN J J, LIU J F, et al. Anionic-nonionic mixed-surfactant-enhanced remediation of PAH-contaminated soil [J]. Environmental Science and Pollution Research, 2015, 22(16): 12769-12774. doi: 10.1007/s11356-015-4568-6 [50] SARUBBO L A, ROCHA R B, LUNA J M, et al. Some aspects of heavy metals contamination remediation and role of biosurfactants [J]. Chemistry and Ecology, 2015, 31(8): 707-723. doi: 10.1080/02757540.2015.1095293 [51] ASH C, TEJNECKÝ V, BORŮVKA L, et al. Different low-molecular-mass organic acids specifically control leaching of arsenic and lead from contaminated soil [J]. Journal of Contaminant Hydrology, 2016, 187: 18-30. doi: 10.1016/j.jconhyd.2016.01.009 [52] XIAO M, WU F C. A review of environmental characteristics and effects of low-molecular weight organic acids in the surface ecosystem [J]. Journal of Environmental Sciences, 2014, 26(5): 935-954. doi: 10.1016/S1001-0742(13)60570-7 [53] CHEN Y X, LIN Q, LUO Y M, et al. The role of citric acid on the phytoremediation of heavy metal contaminated soil [J]. Chemosphere, 2003, 50(6): 807-811. doi: 10.1016/S0045-6535(02)00223-0 [54] KE X, ZHANG F J, ZHOU Y, et al. Removal of Cd, Pb, Zn, Cu in smelter soil by citric acid leaching [J]. Chemosphere, 2020, 255: 126690. doi: 10.1016/j.chemosphere.2020.126690 [55] MOON D H, PARK J W, KOUTSOSPYROS A, et al. Assessment of soil washing for simultaneous removal of heavy metals and low-level petroleum hydrocarbons using various washing solutions [J]. Environmental Earth Sciences, 2016, 75(10): 1-8. [56] GUSIATIN Z M, KLIMIUK E. Metal (Cu, Cd and Zn) removal and stabilization during multiple soil washing by saponin [J]. Chemosphere, 2012, 86(4): 383-391. doi: 10.1016/j.chemosphere.2011.10.027 [57] JIMOH A A, LIN J. Biosurfactant: A new frontier for greener technology and environmental sustainability [J]. Ecotoxicology and Environmental Safety, 2019, 184: 109607. doi: 10.1016/j.ecoenv.2019.109607 [58] LAI C C, HUANG Y C, WEI Y H, et al. Biosurfactant-enhanced removal of total petroleum hydrocarbons from contaminated soil [J]. Journal of Hazardous Materials, 2009, 167(1/2/3): 609-614. [59] SILVA S N R L, FARIAS C B B, RUFINO R D, et al. Glycerol as substrate for the production of biosurfactant by Pseudomonas aeruginosa UCP0992 [J]. Colloids and Surfaces B:Biointerfaces, 2010, 79(1): 174-183. doi: 10.1016/j.colsurfb.2010.03.050 [60] LAU E V, GAN S Y, NG H K, et al. Extraction agents for the removal of polycyclic aromatic hydrocarbons (PAHs) from soil in soil washing technologies [J]. Environmental Pollution, 2014, 184: 640-649. doi: 10.1016/j.envpol.2013.09.010 [61] MORILLO E, MADRID F, LARA-MORENO A, et al. Soil bioremediation by cyclodextrins. A review [J]. International Journal of Pharmaceutics, 2020, 591: 119943. doi: 10.1016/j.ijpharm.2020.119943 [62] 孙明明, 滕应, 骆永明, 等. 甲基β环糊精对污染场地土壤中多环芳烃的异位增效洗脱修复研究 [J]. 环境科学, 2013, 34(6): 2428-2435. doi: 10.13227/j.hjkx.2013.06.019 SUN M M, TENG Y, LUO Y M, et al. Ex-situ remediation of PAHs contaminated site by successive methyl-β-cyclodextrin enhanced soil washing [J]. Environmental Science, 2013, 34(6): 2428-2435(in Chinese). doi: 10.13227/j.hjkx.2013.06.019
[63] BABBAR N, ROY S V, WIJNANTS M, et al. Effect of extraction conditions on the saccharide (neutral and acidic) composition of the crude pectic extract from various agro-industrial residues [J]. Journal of Agricultural and Food Chemistry, 2016, 64(1): 268-276. doi: 10.1021/acs.jafc.5b04394 [64] SALATI S, PAPA G, ADANI F. Perspective on the use of humic acids from biomass as natural surfactants for industrial applications [J]. Biotechnology Advances, 2011, 29(6): 913-922. doi: 10.1016/j.biotechadv.2011.07.012 [65] LIU Q J, DENG Y, TANG J P, et al. Potassium lignosulfonate as a washing agent for remediating lead and copper co-contaminated soils [J]. Science of the Total Environment, 2019, 658: 836-842. doi: 10.1016/j.scitotenv.2018.12.228 [66] FENG C, ZHANG S R, LI L X, et al. Feasibility of four wastes to remove heavy metals from contaminated soils [J]. Journal of Environmental Management, 2018, 212: 258-265. [67] KLIK B, GUSIATIN Z M, KULIKOWSKA D. Quality of heavy metal-contaminated soil before and after column flushing with washing agents derived from municipal sewage sludge [J]. Scientific Reports, 2021, 11: 15773. doi: 10.1038/s41598-021-95441-5 [68] 曹坤坤, 张沙沙, 胡学玉, 等. 复合淋洗条件下农用地耕作层土壤去镉效率及其功能调节 [J]. 环境科学, 2022, 43(2): 1023-1031. CAO K K, ZHANG S S, HU X Y, et al. Effect of composite leaching on cadmium removal efficiency in plow layer soil of agricultural land and its functional regulation [J]. Environmental Science, 2022, 43(2): 1023-1031(in Chinese).
[69] BEIYUAN J Z, TSANG D C W, VALIX M, et al. Combined application of EDDS and EDTA for removal of potentially toxic elements under multiple soil washing schemes [J]. Chemosphere, 2018, 205: 178-187. doi: 10.1016/j.chemosphere.2018.04.081 [70] TAO Y F, HUANG H B, ZHANG H. Remediation of Cu-phenanthrene co-contaminated soil by soil washing and subsequent photoelectrochemical process in presence of persulfate [J]. Journal of Hazardous Materials, 2020, 400: 123111. doi: 10.1016/j.jhazmat.2020.123111 [71] YE M, SUN M M, KENGARA F O, et al. Evaluation of soil washing process with carboxymethyl-β-cyclodextrin and carboxymethyl chitosan for recovery of PAHs/heavy metals/fluorine from metallurgic plant site [J]. Journal of Environmental Sciences, 2014, 26(8): 1661-1672. doi: 10.1016/j.jes.2014.06.006 [72] FONSECA B, PAZOS M, FIGUEIREDO H, et al. Desorption kinetics of phenanthrene and lead from historically contaminated soil [J]. Chemical Engineering Journal, 2011, 167(1): 84-90. doi: 10.1016/j.cej.2010.12.004 [73] MENG D L, LI J, LIU T B, et al. Effects of redox potential on soil cadmium solubility: Insight into microbial community [J]. Journal of Environmental Sciences, 2019, 75: 224-232. doi: 10.1016/j.jes.2018.03.032 [74] FERRARO A, van HULLEBUSCH E D, HUGUENOT D, et al. Application of an electrochemical treatment for EDDS soil washing solution regeneration and reuse in a multi-step soil washing process: Case of a Cu contaminated soil [J]. Journal of Environmental Management, 2015, 163: 62-69. [75] SENEVIRATHNA S T M L D, MAHINROOSTA R, LI M, et al. In situ soil flushing to remediate confined soil contaminated with PFOS-an innovative solution for emerging environmental issue [J]. Chemosphere, 2021, 262: 127606. doi: 10.1016/j.chemosphere.2020.127606 [76] LEŠTAN D, LUO C L, LI X D. The use of chelating agents in the remediation of metal-contaminated soils: A review [J]. Environmental Pollution, 2008, 153(1): 3-13. doi: 10.1016/j.envpol.2007.11.015 [77] MAKINO T, KAMIYA T, TAKANO H, et al. Remediation of cadmium-contaminated paddy soils by washing with calcium chloride: Verification of on-site washing [J]. Environmental Pollution, 2007, 147(1): 112-119. doi: 10.1016/j.envpol.2006.08.037 [78] LEE H, LEE Y, KIM J, et al. Field application of modified in situ soil flushing in combination with air sparging at a military site polluted by diesel and gasoline in Korea [J]. International Journal of Environmental Research and Public Health, 2014, 11(9): 8806-8824. doi: 10.3390/ijerph110908806 [79] LIU F Z, OTURAN N, ZHANG H, et al. Soil washing in combination with electrochemical advanced oxidation for the remediation of synthetic soil heavily contaminated with diesel [J]. Chemosphere, 2020, 249: 126176. doi: 10.1016/j.chemosphere.2020.126176 [80] CHEN F, YANG B D, MA J, et al. Decontamination of electronic waste-polluted soil by ultrasound-assisted soil washing [J]. Environmental Science and Pollution Research, 2016, 23(20): 20331-20340. doi: 10.1007/s11356-016-7271-3 [81] CHOI J, LEE D, SON Y. Ultrasound-assisted soil washing processes for the remediation of heavy metals contaminated soils: The mechanism of the ultrasonic desorption [J]. Ultrasonics Sonochemistry, 2021, 74: 105574. doi: 10.1016/j.ultsonch.2021.105574 [82] HAZRATI S, FARAHBAKHSH M, HEYDARPOOR G, et al. Mitigation in availability and toxicity of multi-metal contaminated soil by combining soil washing and organic amendments stabilization [J]. Ecotoxicology and Environmental Safety, 2020, 201: 110807. doi: 10.1016/j.ecoenv.2020.110807 [83] ZHAI X Q, LI Z W, HUANG B, et al. Remediation of multiple heavy metal-contaminated soil through the combination of soil washing and in situ immobilization [J]. Science of the Total Environment, 2018, 635: 92-99. doi: 10.1016/j.scitotenv.2018.04.119 [84] SUNG M, LEE C Y, LEE S Z. Combined mild soil washing and compost-assisted phytoremediation in treatment of silt loams contaminated with copper, nickel, and chromium [J]. Journal of Hazardous Materials, 2011, 190(1/2/3): 744-754. [85] GHARIBZADEH F, REZAEI KALANTARY R, NASSERI S, et al. Reuse of polycyclic aromatic hydrocarbons (PAHs) contaminated soil washing effluent by bioaugmentation/biostimulation process [J]. Separation and Purification Technology, 2016, 168: 248-256. doi: 10.1016/j.seppur.2016.05.022 [86] ZHANG T, LOWRY G V, CAPIRO N L, et al. In situ remediation of subsurface contamination: Opportunities and challenges for nanotechnology and advanced materials [J]. Environmental Science:Nano, 2019, 6(5): 1283-1302. doi: 10.1039/C9EN00143C [87] CAI Z Q, ZHAO X, DUAN J, et al. Remediation of soil and groundwater contaminated with organic chemicals using stabilized nanoparticles: Lessons from the past two decades [J]. Frontiers of Environmental Science & Engineering, 2020, 14(5): 1-20. [88] YIN J N, HUANG G H, AN C J, et al. Exploration of nanocellulose washing agent for the green remediation of phenanthrene-contaminated soil [J]. Journal of Hazardous Materials, 2021, 403: 123861. doi: 10.1016/j.jhazmat.2020.123861 [89] RAJINIPRIYA M, NAGALAKSHMAIAH M, ROBERT M, et al. Importance of agricultural and industrial waste in the field of nanocellulose and recent industrial developments of wood based nanocellulose: A review [J]. ACS Sustainable Chemistry & Engineering, 2018, 6(3): 2807-2828. [90] CHU W, CHAN K H. The mechanism of the surfactant-aided soil washing system for hydrophobic and partial hydrophobic organics [J]. Science of the Total Environment, 2003, 307(1/2/3): 83-92. [91] CANG L, FAN G P, ZHOU D M, et al. Enhanced-electrokinetic remediation of copper-pyrene co-contaminated soil with different oxidants and pH control [J]. Chemosphere, 2013, 90(8): 2326-2331. doi: 10.1016/j.chemosphere.2012.10.062 [92] ZHANG W H, TSANG D C W, LO I M C. Removal of Pb and MDF from contaminated soils by EDTA- and SDS-enhanced washing [J]. Chemosphere, 2007, 66(11): 2025-2034. doi: 10.1016/j.chemosphere.2006.10.017 [93] PALANSOORIYA K N, SHAHEEN S M, CHEN S S, et al. Soil amendments for immobilization of potentially toxic elements in contaminated soils: A critical review [J]. Environment International, 2020, 134: 105046. doi: 10.1016/j.envint.2019.105046 [94] TESSIER A, CAMPBELL P G C, BISSON M. Sequential extraction procedure for the speciation of particulate trace metals [J]. Analytical Chemistry, 1979, 51(7): 844-851. doi: 10.1021/ac50043a017 [95] PARIA S. Surfactant-enhanced remediation of organic contaminated soil and water [J]. Advances in Colloid and Interface Science, 2008, 138(1): 24-58. doi: 10.1016/j.cis.2007.11.001 [96] QI J L, MA W, SONG C X. Influence of freeze-thaw on engineering properties of a silty soil [J]. Cold Regions Science and Technology, 2008, 53(3): 397-404. doi: 10.1016/j.coldregions.2007.05.010 [97] ELZAHABI M, YONG R N. pH influence on sorption characteristics of heavy metal in the vadose zone [J]. Engineering Geology, 2001, 60(1/2/3/4): 61-68. [98] 刘艺芸, 陈志国, 王秀梅, 等. 蓄电池拆解区铅、镉复合污染农田土壤钝化修复 [J]. 环境化学, 2021, 40(4): 1138-1146. doi: 10.7524/j.issn.0254-6108.2020081807 LIU Y Y, CHEN Z G, WANG X M, et al. Remediation of lead and cadmium contaminated farmland soil in battery dismantling area [J]. Environmental Chemistry, 2021, 40(4): 1138-1146(in Chinese). doi: 10.7524/j.issn.0254-6108.2020081807
[99] BRADL H B. Adsorption of heavy metal ions on soils and soils constituents [J]. Journal of Colloid and Interface Science, 2004, 277(1): 1-18. doi: 10.1016/j.jcis.2004.04.005 [100] AHMED A A, THIELE-BRUHN S, AZIZ S G, et al. Interaction of polar and nonpolar organic pollutants with soil organic matter: Sorption experiments and molecular dynamics simulation [J]. Science of the Total Environment, 2015, 508: 276-287. doi: 10.1016/j.scitotenv.2014.11.087 [101] ZHANG Y, HUANG F X, WANG L, et al. Facilitating effect of heavy metals on di(2-ethylhexyl) phthalate adsorption in soil: New evidence from adsorption experiment data and quantum chemical simulation [J]. The Science of the Total Environment, 2021, 772: 144980. doi: 10.1016/j.scitotenv.2021.144980 -




 DownLoad:
DownLoad: