-
生物质在部分或完全缺氧的条件下通过高温热解产生的富碳、具有高度芳香环分子结构和多孔性副产物称之为生物炭[1]。生物炭可以通过微生物作用、氧化还原、表面沉淀、离子交换以及表面络合作用等一系列物理化学和生物作用影响土壤理化特性及重金属的形态、生物毒性、迁移和转化过程,以期实现土壤修复的目标[2-4]。采用生物炭来实施的重金属污染场地修复技术具有经济性、稳定性、环境友好等优势[5],因此,可以将生物炭用作为重要的土壤重金属修复改良剂。
水可提取的有机质(water extracted organic matter,WEOM)作为生物炭中最具活性的组分,对土壤中重金属的环境地球化学行为的影响同样不容忽视。WEOM中含有众多的荧光的有机质,诸如类蛋白物质、类富里酸和类腐殖酸等[6-10],这些荧光物质能够与土壤中的重金属发生络合作用,从而影响土壤重金属的环境化学行为。而荧光光谱方法是研究荧光有机质组分与相对含量的重要手段。荧光光谱结合荧光猝灭滴定已经广泛的用于研究这些水溶性的荧光有机物与重金属的络合作用[11-12],结合荧光猝灭络合模型能够计算出荧光组分与重金属的络合常数,以及参与络合过程中荧光物质的比例,如修正的Stern-Volmer模型[13]、非线性Ryan-Weber模型[14]。一些有机质的荧光信息经常被强的荧光基团掩盖而无法识别,而导数荧光也能够很好地用于识别有机质光谱中被掩盖的荧光组分,从而获得更多的光谱信息[7, 15]。同时,二维相关光谱方法也已经广泛用于研究WEOM与重金属络合的异质性[16-17]。
然而,不同的热解温度影响了生物炭中WEOM的含量、组分及结构特性,这些荧光组分对土壤重金属的环境化学行为起着非常重要的作用,尤其是低温热解时会产生的生物炭具有较高的WEOM含量,这些WEOM中的有机组分能够与重金属发生络合作用[18]。因此,为了进一步研究不同热解温度下生物炭中的WEOM对重金属的影响,本研究针对300℃和600℃热解下生成的生物炭提取的WEOM与重金属Cu(Ⅱ)的络合特性进行研究,采用导数荧光和二维相关光谱分析结合荧光猝灭滴定方法研究高温和低温热解条件下,生物炭WEOM中荧光组分变化及其与Cu(Ⅱ)的络合参数,解释两种温度下生物炭WEOM对Cu(Ⅱ)环境化学行为的影响,为土壤改良与重金属修复提供理论指导。
-
将某农场收集的棉杆在105°C的温度下进行烘干后,采用粉碎机进行破碎后过100目筛。过筛后的棉杆置于管式炉中进行热解,将50 g棉秆置于管式炉中,在N2气氛中由室温分别加热至300℃和600℃温度下热解30 min。
-
将上述两种热解生物炭以水炭比(V/M)为10∶1进行混合,置于水平振荡仪连续振荡24 h后,采用7000 r∙min-1转速进行离心过滤,取上清液过0.45 μm有机滤膜,滤液即为WEOM。以溶解性有机碳(DOC)作为WEOM的浓度,采用总有机碳分析仪(Multi N/C 2100,德国耶拿)测定DOC的浓度。
-
荧光猝灭滴定实验在50 mL离心管中进行。分别在一系列装有10 mL WEOM溶液的离心管中,添加Cu(Ⅱ)离子,使得WEOM溶液中Cu(Ⅱ)离子的浓度为0、20、40、60、80、120、150、200 μmol∙L−1,添加Cu(Ⅱ)离子溶液的体积未超过WEOM体积的2%。荧光猝灭滴定前将WEOM溶液pH值调至7.0±0.2,WEOM的浓度调整为10 mg∙L−1。将上述溶液置于水平振荡仪,在避光的条件下振荡24h以确保络合达到平衡,反应完成后立即进行同步荧光光谱测定(SFS)。
-
采用F-7000分子荧光光度计(日本,日立)测定不同Cu(Ⅱ)浓度下WEOM的同步荧光光谱,波长扫描范围为250—600 nm,扫描波长差为30 nm,扫描速度设置为Fast,超纯水作为空白背景被扣除。采用origin软件对同步荧光光谱数据进行二阶求导,获得WEOM同步荧光光谱的二阶导数荧光,用于识别被掩盖的荧光峰。
二维相关光谱分析能够解释因外界环境扰动而引起的光谱特征细微变化,从而提高对WEOM-Cu(Ⅱ)络合过程的解释能力。本研究将不同Cu(Ⅱ)浓度下的WEOM同步荧光光谱用于分析WEOM-Cu(Ⅱ)络合的二维相关光谱特性。采用“2D Shige”软件绘制WEOM-Cu(Ⅱ)络合过程的二维同步和异步相关光谱图。
-
WEOM-Cu(Ⅱ)的络合参数采用线性修正Stern-Volmer方程进行计算[13],该模型假定Cu(Ⅱ)离子与配位基按照1∶1进行配位作用,方程如下:
式中,F0和F分别为未添加和添加了金属Cu(Ⅱ)离子时的荧光强度;K为条件稳定常数,通常采用对数条件稳定常数lgK进行分析;CM为WEOM中金属Cu(Ⅱ)离子的浓度;f为参与配位的荧光基团的比例.
-
将同步荧光光谱分为类蛋白(250—310 nm)、类富里酸(310—380 nm)和类腐殖酸(380—600 nm)的3个区域[19],图1为3个区域积分面积。结果表明,低温热解生物炭中WEOM的荧光物质以类腐殖酸为主,占总荧光物质的51.05%,其次是类富里酸组分,占36.86%,而类蛋白荧光物质最低,仅占12.09%。高温热解生物炭中WEOM荧光物质明显要低于低温热解生物炭,表明在高温条件下大部分的荧光有机质能够被分解。高温热解生物炭WEOM中荧光组分以类富里酸为主,占总荧光物质的42.11%,其次为类腐殖酸组分,占33.93%,类蛋白荧光组分为23.96%。相比于低温热解生物炭,高温热解生物炭中的类蛋白、类富里酸和类腐殖酸分别减少了24.76%、56.62%和74.73%,表明长波方向的类腐殖酸和类富里酸荧光物质更容易被高温热解。两种生物炭中WEOM的含量分别为20172.3 mg·kg−1和5.9 mg·kg−1,高温热解后WEOM的含量极低。因此,低温热解能够增加生物炭中WEOM含量,但相对于吸附重金属,高温热解生物炭具有更高的比表面积和孔隙结构,表现出较好的吸附能力[19]。而低温生物炭WEOM中较高的类富里酸和类腐殖酸有利于改良土壤结构,提高土壤的腐殖化程度。通常用类腐殖酸与类富里酸的比值(HLR/FLR)来表征WEOM的腐殖化程度,结果表明低温热解生物炭WEOM的HLR/FLR比值为1.38,而高温热解生物炭WEOM的HLR/FLR比值仅为0.81,降低了41.74%,可知低温热解生物炭WEOM具有较高的腐殖化程度。
-
图2为两种温度下热解生物炭WEOM同步光谱经过二阶导数后的光谱。图2a显示,低温热解WEOM的同步光谱中4个荧光峰能够被识别,分别在309 nm(类蛋白荧光)、367 nm(类富里酸荧光)、409 nm(类腐殖酸荧光)和500 nm(类腐殖酸荧光)处,其中500 nm处的类腐殖酸荧光峰以肩峰的形式出现。低温热解WEOM二阶导数荧光仅能识别一个掩盖荧光峰(图2c),为270 nm处的类蛋白荧光峰,表明低温热解生物炭具有较少的荧光基团,但其荧光基团的强度较高。总类腐殖酸强度与总类富里酸强度比值(IHLR/FLR)结果表明,低温热解生物炭WEOM的IHLR/FLR值为1.32,而高温热解生物炭WEOM的IHLR/FLR值为0.94,也预示高温热解降低了生物炭WEOM的腐殖化程度。
图3b显示4个明显的荧光峰,分别在303 nm、338 nm、372 nm和500 nm处,其中303 nm处的荧光峰为类蛋白荧光峰,338 nm和372 nm处为类富里酸荧光物质所产生的荧光峰,500 nm处的荧光峰为类腐殖酸荧光物质引起的[20]。类蛋白和类富里酸荧光物质具有较高的荧光强度,而500 nm处的类腐殖酸荧光峰强度较低。图2d显示,二阶导数荧光能够显示8个明显的荧光峰,其中4个荧光峰在同步荧光光谱中未曾发现,分别在272 nm(类蛋白荧光)、290 nm(类蛋白荧光)、 418 nm(类腐殖酸荧光)和460 nm(类腐殖酸荧光),表明二阶导数荧光能够识别处更多的被掩盖的荧光峰[15]。图1也表明,高温热解导致类富里酸和类腐殖酸区域的荧光物质分解,从而产生更多的荧光组分。
-
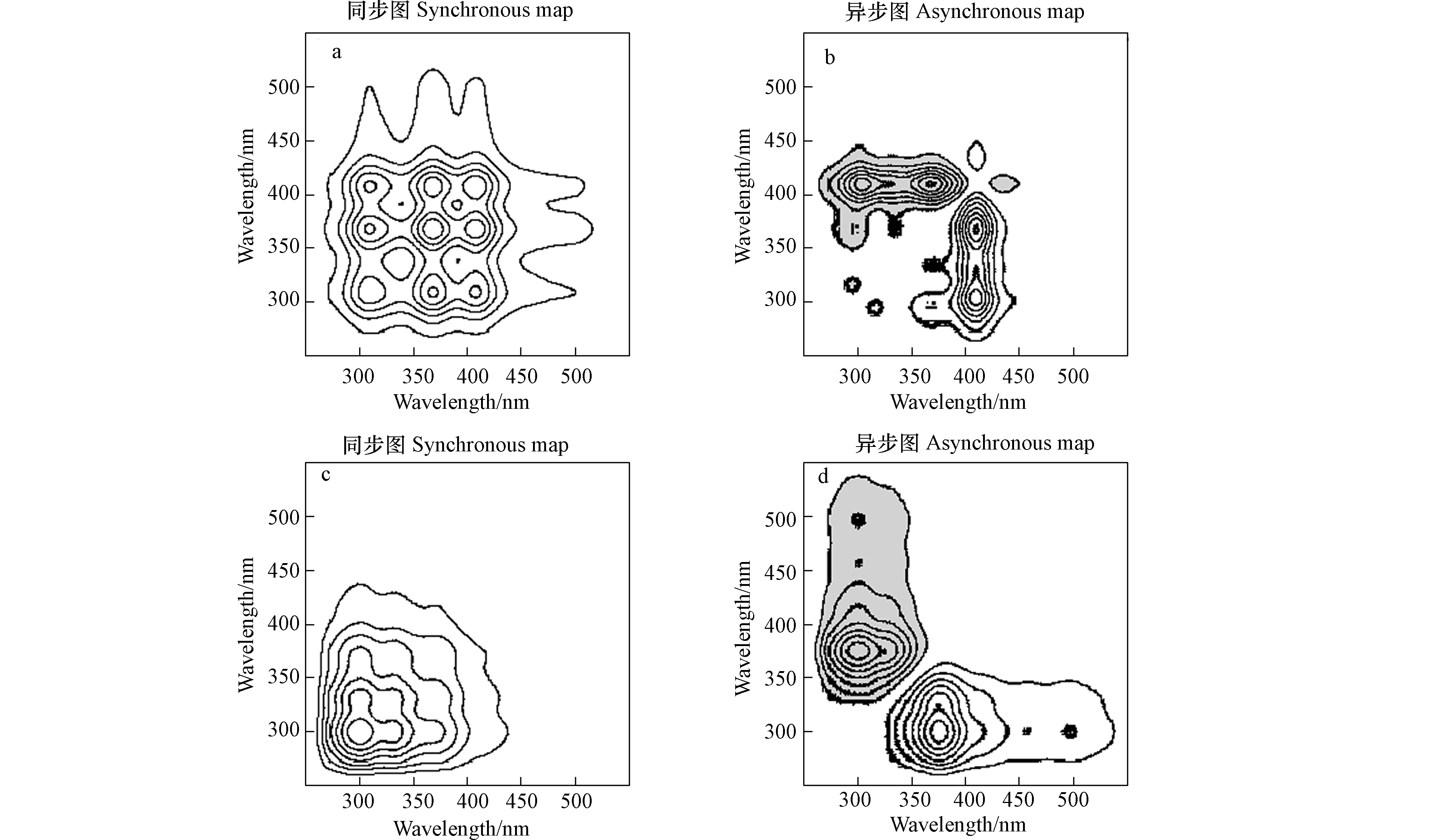
图3为生物炭WEOM-Cu(Ⅱ)络合的二维同步荧光相关光谱分析,同步光谱图关于主对角线对称,异步光谱图关于主对角线反对称[21]。结果表明,300℃热解生物炭WEOM的二维同步光谱图显示3个自动峰和3个交叉峰(图3a)。3个自动峰峰位分别在309 nm(类蛋白峰),367 nm(类富里酸)和409 nm(类腐殖酸),3个交叉峰位分别在367/309、409/309和409/367处。根据Noda规则[21],高的相关系数表明该位置的荧光峰对外界环境干扰具有较高的敏感性。因此,WEOM中荧光物质对因Cu(Ⅱ)离子的添加而导致环境扰动的敏感程度次序为:367 → 409/367 →367/309 →409 →409/309 →309,表明类富里酸荧光物质对Cu(Ⅱ)离子添加引起的环境变化具有较高的敏感性,其次是类腐殖酸荧光物质。而600℃热解生物炭WEOM二维同步光谱图显示1个明显自动峰和1个交叉峰(图3c),峰位分别在303 nm和327 nm处。根据Noda规则,303 nm处的类蛋白荧光比327 nm处的类富里酸荧光对Cu(Ⅱ)的添加引起的环境变化具有更高的敏感性。
图3b为低温热解生物炭WEOM-Cu(Ⅱ)的异步光谱图,4个正相关峰(白色)和1个负相关峰(灰色)能够被识别,分别在309 nm(类蛋白峰)、367 nm(类富里酸)、409 nm(409/290和409/367,类腐殖酸)和431 nm(类腐殖酸)。根据Noda规则,异步光谱中正的相关峰优先与Cu(Ⅱ)发生络合作用,而负的相关络合作用滞后,且高的相关系数优先发生络合作用。因此,低温热解WEOM中荧光物质与Cu(Ⅱ)络合的次序为:409→309→367→431,表明409 nm处的类腐殖酸荧光物质能够优先与Cu(Ⅱ)络合,其次是类蛋白荧光物质和类富里酸荧光物质。高温热解生物炭WEOM-Cu(Ⅱ)的异步光谱图识别出3个明显的荧光峰(图3d),分别在372 nm、460 nm和500 nm处。372 nm处的类富里酸荧光物质具有极强的相关性,表明类富里酸荧光物质优先与Cu(Ⅱ)离子发生络合作用,其次为500 nm处的类腐殖酸荧光物质。根据Noda规则,高温热解WEOM中荧光物质与Cu(Ⅱ)络合的次序为:372→500→460。
-
图4为不同温度热解生物炭WEOM中各荧光组分与Cu(Ⅱ)离子络合的荧光猝灭曲线。
由图4可知,类蛋白荧光组分并未呈现明显的猝灭趋势,随着Cu(Ⅱ)离子浓度的增加,组分的荧光强度呈现降低或增加的情况。对于这种现象先前的研究也已经给出相应的解释,如由于Cu(Ⅱ)离子浓度的增加,类蛋白分子结构三维结构变化导致蛋白荧光的量子产量变化[22]。另外,类蛋白荧光可能与无机或其他有机组分相互作用发生猝灭作用,Cu(Ⅱ)离子的加入取代了这些猝灭剂而导致荧光强度的增加[22],进而形成了更稳定的WEOM-Cu(Ⅱ)络合物。类富里酸和类腐殖酸荧光强度随着Cu(Ⅱ)离子浓度的增加呈现出逐级降低的趋势,随着Cu(Ⅱ)离子浓度的继续增加,荧光强度逐级趋于稳定。因此,本研究采用修正的Stern–Volmer方程来计算WEOM中类富里酸和类腐殖酸荧光物质与Cu(Ⅱ)的络合常数和荧光配位比。
由表1可知,类蛋白物质与Cu(Ⅱ)离子络合的Stern–Volmer方程拟合失败。而类富里酸和类腐殖酸组分能够与Cu(Ⅱ)离子的络合具有较好的拟合效果。而327 nm处的类富里酸峰因为荧光猝灭效果不明显,也不能被拟合。表1结果表明,300℃热解生物炭WEOM-Cu(Ⅱ)的lgK值在4.85—5.30之间,类富里酸物质表现出较高的lgK值,其次是500 nm处的类腐殖酸物质。WEOM中荧光物质与Cu(Ⅱ)络合的荧光配位比在26.15%—57.81%之间。尽管367 nm处的类富里酸能够与Cu(Ⅱ)形成较高化学稳定性的络合,但其参与络合的荧光物质比例较低,仅有26.15%。而生成化学稳定性较低的类腐殖酸(409 nm)表现出了较高的荧光配位比(57.81%)。图2a显示,367nm处的类富里酸和409 nm处的类腐殖酸具有较高的荧光强度,表明300℃低温热解棉杆生物炭WEOM与Cu(Ⅱ)络合过程中,367nm处的类富里酸和409 nm处的类腐殖酸扮演更为重要的作用。尽管431nm和500nm处的类腐殖酸也表现出较高的lgK值和荧光配位比,但其荧光物质的含量相对较少。然而,但低温热解生物炭用于土壤修复与改良时,随着这些荧光物质的不断积累,也能够在土壤重金属的迁移和转化过程中起到极为重要的作用。
600℃热解棉杆生物炭WEOM与Cu(Ⅱ)的lgK值在4.23—5.19之间,随着波长的增加,lgK值呈现逐级增大的趋势。长波处的类腐殖酸物质与Cu(Ⅱ)能够形成较高化学稳定性的络合物。600℃热解棉杆生物炭WEOM中372 nm左右的类富里酸与Cu(Ⅱ)的络合常数明显要低于300℃时367 nm类富里酸与Cu(Ⅱ)的络合常数,而两种温度下类腐殖酸组分与Cu(Ⅱ)的络合常数值变化不大。此外,高温热解WEOM-Cu(Ⅱ)的荧光配位比在38.18%—79.13%之间,明显要高于300℃时的荧光配位比,说明高温热解导致参与Cu(Ⅱ)络合的荧光物质比例增加。然而图1显示,高温热解生物炭WEOM中荧光物质的含量相对较低,同时生物炭WEOM的含量也非常低,因此认为WEOM与金属的络合作用对高温热解生物炭用于土壤重金属修复过程的影响相对较小,而吸附可能成为影响重金属化学行为的主要因素。
-
不同温度热解影响生物炭WEOM中荧光物质的组分及含量,生物炭热解实验结果表明,与高温生物炭相比,低温生物炭具有较高的WEOM含量,而高温热解生物炭经热解后的WEOM存在较多荧光组分。导数荧光能够更好的识别处被强的荧光基团掩盖的荧光组分,光谱分析结合荧光猝灭及二维相关分析能够很好的解释生物炭WEOM与重金属的络合特性及络合物的化学稳定性。结果表明,低温热解生物炭WEOM中367 nm处的类富里酸组分与Cu(Ⅱ)形成较高化学稳定性的络合物,而高温热解生物炭WEOM中荧光物质与Cu(Ⅱ)形成络合物的化学稳定性随着波长的增加而增加。300℃热解生物炭WEOM中,与Cu(Ⅱ)形成低化学稳定性的类腐殖酸组分(409 nm)能够优先于其他组分与Cu(Ⅱ)发生络合反应;而600℃热解生物炭WEOM中,372 nm处的类富里酸组分能够优先于其他组分与Cu(Ⅱ)形成有机络合物。高温热解与热处理生物炭增加了WEOM中参与Cu(Ⅱ)配位的荧光物质比例。不同温度热解能够改变生物炭孔隙结构、比表面积及WEOM的含量和荧光组分,这些影响生物炭土壤修复与改良效果,对WEOM与重金属的络合能够为生物炭土壤修复与改良过程中重金属的环境化学行为提供指导依据。
热解温度对棉杆生物炭中水可提取有机物与Cu(Ⅱ)络合特性的影响
Effect of pyrolysis temperature on the binding properties of Cu(Ⅱ) with WEOM extracted from cotton stem biochar
-
摘要: 本文以棉杆生物炭中水可提取的有机物(water extracted organic matter,WEOM)为研究对象,采用二阶导数荧光和二维相关光谱分析方法研究低温(300 ℃)和高温(600 ℃)热解温度下生物炭WEOM的荧光组分变化及其与Cu(Ⅱ)离子的络合特性。研究结果表明,低温和高温热解生物炭WEOM的含量分别为20172.3 mg·kg−1和5.9 mg·kg−1;低温热解生物炭WEOM以类腐殖酸为主,而高温热解生物炭WEOM以类富里酸为主。二维相关光谱(2D-COS)分析结果显示,低温热解生物炭WEOM中类腐殖酸(409 nm)能够优先与Cu(Ⅱ)离子发生络合作用,而高温热解生物炭WEOM中类富里酸组分(372 nm)优先与Cu(Ⅱ)离子结合。300℃热解生物炭WEOM-Cu(Ⅱ)的lgK值在4.85—5.30之间,类富里酸物质表现出较高的lgK值。600℃热解棉杆生物炭WEOM与Cu(Ⅱ)的lgK值在4.23—5.19之间,随着波长的增加,lgK值呈现逐级增大的趋势,且具有较高的荧光配位比,研究结果能够为生物炭用于土壤改良和修复提供指导依据。Abstract: In this study, water extracted organic matter (WEOM) were extracted from cotton stem biochar at 300 ºC and 600 ºC pyrolysis temperatures, whose fluorescent components and binding properties with Cu(Ⅱ) were investigated by using second derivative fluorescence and two-dimensional correlation spectroscopy (2D-COS). The results showed that the content of WEOM for biochar was 20172.3 mg·kg−1 and 5.9 mg·kg−1 at low and high pyrolysis, respectively. Biochar-derived WEOM was dominated by humic-like substances at low temperature pyrolysis and fulvic-like substances at high temperature pyrolysis, respectively. The result of 2D-COS indicated that humic-like substances at 409 nm combined preferentially with Cu(Ⅱ) at low temperature pyrolysis and fulvic-like substances at 372 nm preferentially complexed with Cr(Ⅲ) at high temperature pyrolysis. The lgK values were in the range of 4.85—5.30 for biochar-derived WEOM-Cu(Ⅱ) at 300 ºC, in which fulvic-like obtained a relatively high lg K value. The lgK values ranged from 4.23 to 5.19 for biochar-derived WEOM-Cu(Ⅱ) at 600 ºC, and lgK value increased with an increase of wavelength. Meanwhile, the fraction in the initial fluorescence (f) was higher for biochar-derived WEOM-Cu(Ⅱ) at 600 ºC than these at 300 ºC. The results of WEOM-Cu(Ⅱ) can provide guidance for the application of biochar in soil improvement and remediation.
-
Key words:
- biochar /
- WEOM /
- two-dimensional correlation spectroscopy /
- Cu(Ⅱ) /
- fluorescence quenching
-
生物质在部分或完全缺氧的条件下通过高温热解产生的富碳、具有高度芳香环分子结构和多孔性副产物称之为生物炭[1]。生物炭可以通过微生物作用、氧化还原、表面沉淀、离子交换以及表面络合作用等一系列物理化学和生物作用影响土壤理化特性及重金属的形态、生物毒性、迁移和转化过程,以期实现土壤修复的目标[2-4]。采用生物炭来实施的重金属污染场地修复技术具有经济性、稳定性、环境友好等优势[5],因此,可以将生物炭用作为重要的土壤重金属修复改良剂。
水可提取的有机质(water extracted organic matter,WEOM)作为生物炭中最具活性的组分,对土壤中重金属的环境地球化学行为的影响同样不容忽视。WEOM中含有众多的荧光的有机质,诸如类蛋白物质、类富里酸和类腐殖酸等[6-10],这些荧光物质能够与土壤中的重金属发生络合作用,从而影响土壤重金属的环境化学行为。而荧光光谱方法是研究荧光有机质组分与相对含量的重要手段。荧光光谱结合荧光猝灭滴定已经广泛的用于研究这些水溶性的荧光有机物与重金属的络合作用[11-12],结合荧光猝灭络合模型能够计算出荧光组分与重金属的络合常数,以及参与络合过程中荧光物质的比例,如修正的Stern-Volmer模型[13]、非线性Ryan-Weber模型[14]。一些有机质的荧光信息经常被强的荧光基团掩盖而无法识别,而导数荧光也能够很好地用于识别有机质光谱中被掩盖的荧光组分,从而获得更多的光谱信息[7, 15]。同时,二维相关光谱方法也已经广泛用于研究WEOM与重金属络合的异质性[16-17]。
然而,不同的热解温度影响了生物炭中WEOM的含量、组分及结构特性,这些荧光组分对土壤重金属的环境化学行为起着非常重要的作用,尤其是低温热解时会产生的生物炭具有较高的WEOM含量,这些WEOM中的有机组分能够与重金属发生络合作用[18]。因此,为了进一步研究不同热解温度下生物炭中的WEOM对重金属的影响,本研究针对300℃和600℃热解下生成的生物炭提取的WEOM与重金属Cu(Ⅱ)的络合特性进行研究,采用导数荧光和二维相关光谱分析结合荧光猝灭滴定方法研究高温和低温热解条件下,生物炭WEOM中荧光组分变化及其与Cu(Ⅱ)的络合参数,解释两种温度下生物炭WEOM对Cu(Ⅱ)环境化学行为的影响,为土壤改良与重金属修复提供理论指导。
1. 材料和方法(Materials and method)
1.1 棉杆生物炭制备
将某农场收集的棉杆在105°C的温度下进行烘干后,采用粉碎机进行破碎后过100目筛。过筛后的棉杆置于管式炉中进行热解,将50 g棉秆置于管式炉中,在N2气氛中由室温分别加热至300℃和600℃温度下热解30 min。
1.2 WEOM的提取
将上述两种热解生物炭以水炭比(V/M)为10∶1进行混合,置于水平振荡仪连续振荡24 h后,采用7000 r∙min-1转速进行离心过滤,取上清液过0.45 μm有机滤膜,滤液即为WEOM。以溶解性有机碳(DOC)作为WEOM的浓度,采用总有机碳分析仪(Multi N/C 2100,德国耶拿)测定DOC的浓度。
1.3 荧光猝灭滴定实验
荧光猝灭滴定实验在50 mL离心管中进行。分别在一系列装有10 mL WEOM溶液的离心管中,添加Cu(Ⅱ)离子,使得WEOM溶液中Cu(Ⅱ)离子的浓度为0、20、40、60、80、120、150、200 μmol∙L−1,添加Cu(Ⅱ)离子溶液的体积未超过WEOM体积的2%。荧光猝灭滴定前将WEOM溶液pH值调至7.0±0.2,WEOM的浓度调整为10 mg∙L−1。将上述溶液置于水平振荡仪,在避光的条件下振荡24h以确保络合达到平衡,反应完成后立即进行同步荧光光谱测定(SFS)。
1.4 光谱分析
采用F-7000分子荧光光度计(日本,日立)测定不同Cu(Ⅱ)浓度下WEOM的同步荧光光谱,波长扫描范围为250—600 nm,扫描波长差为30 nm,扫描速度设置为Fast,超纯水作为空白背景被扣除。采用origin软件对同步荧光光谱数据进行二阶求导,获得WEOM同步荧光光谱的二阶导数荧光,用于识别被掩盖的荧光峰。
二维相关光谱分析能够解释因外界环境扰动而引起的光谱特征细微变化,从而提高对WEOM-Cu(Ⅱ)络合过程的解释能力。本研究将不同Cu(Ⅱ)浓度下的WEOM同步荧光光谱用于分析WEOM-Cu(Ⅱ)络合的二维相关光谱特性。采用“2D Shige”软件绘制WEOM-Cu(Ⅱ)络合过程的二维同步和异步相关光谱图。
1.5 络合模型
WEOM-Cu(Ⅱ)的络合参数采用线性修正Stern-Volmer方程进行计算[13],该模型假定Cu(Ⅱ)离子与配位基按照1∶1进行配位作用,方程如下:
F0/(F0−F)=1/(f×K×CM)+1/f (1) 式中,F0和F分别为未添加和添加了金属Cu(Ⅱ)离子时的荧光强度;K为条件稳定常数,通常采用对数条件稳定常数lgK进行分析;CM为WEOM中金属Cu(Ⅱ)离子的浓度;f为参与配位的荧光基团的比例.
2. 结果与讨论(Results and discussion)
2.1 不同温度热解生物炭WEOM的荧光组分变化
将同步荧光光谱分为类蛋白(250—310 nm)、类富里酸(310—380 nm)和类腐殖酸(380—600 nm)的3个区域[19],图1为3个区域积分面积。结果表明,低温热解生物炭中WEOM的荧光物质以类腐殖酸为主,占总荧光物质的51.05%,其次是类富里酸组分,占36.86%,而类蛋白荧光物质最低,仅占12.09%。高温热解生物炭中WEOM荧光物质明显要低于低温热解生物炭,表明在高温条件下大部分的荧光有机质能够被分解。高温热解生物炭WEOM中荧光组分以类富里酸为主,占总荧光物质的42.11%,其次为类腐殖酸组分,占33.93%,类蛋白荧光组分为23.96%。相比于低温热解生物炭,高温热解生物炭中的类蛋白、类富里酸和类腐殖酸分别减少了24.76%、56.62%和74.73%,表明长波方向的类腐殖酸和类富里酸荧光物质更容易被高温热解。两种生物炭中WEOM的含量分别为20172.3 mg·kg−1和5.9 mg·kg−1,高温热解后WEOM的含量极低。因此,低温热解能够增加生物炭中WEOM含量,但相对于吸附重金属,高温热解生物炭具有更高的比表面积和孔隙结构,表现出较好的吸附能力[19]。而低温生物炭WEOM中较高的类富里酸和类腐殖酸有利于改良土壤结构,提高土壤的腐殖化程度。通常用类腐殖酸与类富里酸的比值(HLR/FLR)来表征WEOM的腐殖化程度,结果表明低温热解生物炭WEOM的HLR/FLR比值为1.38,而高温热解生物炭WEOM的HLR/FLR比值仅为0.81,降低了41.74%,可知低温热解生物炭WEOM具有较高的腐殖化程度。
2.2 不同温度热解生物炭WEOM的导数荧光
图2为两种温度下热解生物炭WEOM同步光谱经过二阶导数后的光谱。图2a显示,低温热解WEOM的同步光谱中4个荧光峰能够被识别,分别在309 nm(类蛋白荧光)、367 nm(类富里酸荧光)、409 nm(类腐殖酸荧光)和500 nm(类腐殖酸荧光)处,其中500 nm处的类腐殖酸荧光峰以肩峰的形式出现。低温热解WEOM二阶导数荧光仅能识别一个掩盖荧光峰(图2c),为270 nm处的类蛋白荧光峰,表明低温热解生物炭具有较少的荧光基团,但其荧光基团的强度较高。总类腐殖酸强度与总类富里酸强度比值(IHLR/FLR)结果表明,低温热解生物炭WEOM的IHLR/FLR值为1.32,而高温热解生物炭WEOM的IHLR/FLR值为0.94,也预示高温热解降低了生物炭WEOM的腐殖化程度。
图3b显示4个明显的荧光峰,分别在303 nm、338 nm、372 nm和500 nm处,其中303 nm处的荧光峰为类蛋白荧光峰,338 nm和372 nm处为类富里酸荧光物质所产生的荧光峰,500 nm处的荧光峰为类腐殖酸荧光物质引起的[20]。类蛋白和类富里酸荧光物质具有较高的荧光强度,而500 nm处的类腐殖酸荧光峰强度较低。图2d显示,二阶导数荧光能够显示8个明显的荧光峰,其中4个荧光峰在同步荧光光谱中未曾发现,分别在272 nm(类蛋白荧光)、290 nm(类蛋白荧光)、 418 nm(类腐殖酸荧光)和460 nm(类腐殖酸荧光),表明二阶导数荧光能够识别处更多的被掩盖的荧光峰[15]。图1也表明,高温热解导致类富里酸和类腐殖酸区域的荧光物质分解,从而产生更多的荧光组分。
2.3 Cu(Ⅱ)与生物炭WEOM络合2D-SFS-COS分析
图3为生物炭WEOM-Cu(Ⅱ)络合的二维同步荧光相关光谱分析,同步光谱图关于主对角线对称,异步光谱图关于主对角线反对称[21]。结果表明,300℃热解生物炭WEOM的二维同步光谱图显示3个自动峰和3个交叉峰(图3a)。3个自动峰峰位分别在309 nm(类蛋白峰),367 nm(类富里酸)和409 nm(类腐殖酸),3个交叉峰位分别在367/309、409/309和409/367处。根据Noda规则[21],高的相关系数表明该位置的荧光峰对外界环境干扰具有较高的敏感性。因此,WEOM中荧光物质对因Cu(Ⅱ)离子的添加而导致环境扰动的敏感程度次序为:367 → 409/367 →367/309 →409 →409/309 →309,表明类富里酸荧光物质对Cu(Ⅱ)离子添加引起的环境变化具有较高的敏感性,其次是类腐殖酸荧光物质。而600℃热解生物炭WEOM二维同步光谱图显示1个明显自动峰和1个交叉峰(图3c),峰位分别在303 nm和327 nm处。根据Noda规则,303 nm处的类蛋白荧光比327 nm处的类富里酸荧光对Cu(Ⅱ)的添加引起的环境变化具有更高的敏感性。
图3b为低温热解生物炭WEOM-Cu(Ⅱ)的异步光谱图,4个正相关峰(白色)和1个负相关峰(灰色)能够被识别,分别在309 nm(类蛋白峰)、367 nm(类富里酸)、409 nm(409/290和409/367,类腐殖酸)和431 nm(类腐殖酸)。根据Noda规则,异步光谱中正的相关峰优先与Cu(Ⅱ)发生络合作用,而负的相关络合作用滞后,且高的相关系数优先发生络合作用。因此,低温热解WEOM中荧光物质与Cu(Ⅱ)络合的次序为:409→309→367→431,表明409 nm处的类腐殖酸荧光物质能够优先与Cu(Ⅱ)络合,其次是类蛋白荧光物质和类富里酸荧光物质。高温热解生物炭WEOM-Cu(Ⅱ)的异步光谱图识别出3个明显的荧光峰(图3d),分别在372 nm、460 nm和500 nm处。372 nm处的类富里酸荧光物质具有极强的相关性,表明类富里酸荧光物质优先与Cu(Ⅱ)离子发生络合作用,其次为500 nm处的类腐殖酸荧光物质。根据Noda规则,高温热解WEOM中荧光物质与Cu(Ⅱ)络合的次序为:372→500→460。
2.4 络合常数
图4为不同温度热解生物炭WEOM中各荧光组分与Cu(Ⅱ)离子络合的荧光猝灭曲线。
由图4可知,类蛋白荧光组分并未呈现明显的猝灭趋势,随着Cu(Ⅱ)离子浓度的增加,组分的荧光强度呈现降低或增加的情况。对于这种现象先前的研究也已经给出相应的解释,如由于Cu(Ⅱ)离子浓度的增加,类蛋白分子结构三维结构变化导致蛋白荧光的量子产量变化[22]。另外,类蛋白荧光可能与无机或其他有机组分相互作用发生猝灭作用,Cu(Ⅱ)离子的加入取代了这些猝灭剂而导致荧光强度的增加[22],进而形成了更稳定的WEOM-Cu(Ⅱ)络合物。类富里酸和类腐殖酸荧光强度随着Cu(Ⅱ)离子浓度的增加呈现出逐级降低的趋势,随着Cu(Ⅱ)离子浓度的继续增加,荧光强度逐级趋于稳定。因此,本研究采用修正的Stern–Volmer方程来计算WEOM中类富里酸和类腐殖酸荧光物质与Cu(Ⅱ)的络合常数和荧光配位比。
由表1可知,类蛋白物质与Cu(Ⅱ)离子络合的Stern–Volmer方程拟合失败。而类富里酸和类腐殖酸组分能够与Cu(Ⅱ)离子的络合具有较好的拟合效果。而327 nm处的类富里酸峰因为荧光猝灭效果不明显,也不能被拟合。表1结果表明,300℃热解生物炭WEOM-Cu(Ⅱ)的lgK值在4.85—5.30之间,类富里酸物质表现出较高的lgK值,其次是500 nm处的类腐殖酸物质。WEOM中荧光物质与Cu(Ⅱ)络合的荧光配位比在26.15%—57.81%之间。尽管367 nm处的类富里酸能够与Cu(Ⅱ)形成较高化学稳定性的络合,但其参与络合的荧光物质比例较低,仅有26.15%。而生成化学稳定性较低的类腐殖酸(409 nm)表现出了较高的荧光配位比(57.81%)。图2a显示,367nm处的类富里酸和409 nm处的类腐殖酸具有较高的荧光强度,表明300℃低温热解棉杆生物炭WEOM与Cu(Ⅱ)络合过程中,367nm处的类富里酸和409 nm处的类腐殖酸扮演更为重要的作用。尽管431nm和500nm处的类腐殖酸也表现出较高的lgK值和荧光配位比,但其荧光物质的含量相对较少。然而,但低温热解生物炭用于土壤修复与改良时,随着这些荧光物质的不断积累,也能够在土壤重金属的迁移和转化过程中起到极为重要的作用。
表 1 不同温度热解WEOM中各组分与Cu(Ⅱ)离子的络合参数Table 1. Binding parameters of biochar-derived WEOM components with Cu(Ⅱ)生物炭Biochar 荧光峰Peak 对数稳定常数lgK 荧光配位比f/% 决定系数R2 300℃ 270c FM FM FM 309abc FM FM FM 367ab 5.30 26.15 0.80* 409abc 4.85 57.81 0.93* 431b 5.08 43.41 0.88* 500ac 5.25 44.97 0.91* 600℃ 272c FM FM FM 290c FM FM FM 303abc FM FM FM 327b FM FM FM 338ac 4.23 38.18 0.98* 372abc 4.82 71.00 0.95* 418c 4.94 74.56 0.94* 460bc 5.02 79.13 0.94* 500abc 5.19 77.76 0.91* a, b, c分别为同步荧光光谱、二维相关光谱和二阶导数光谱识别的荧光峰; * p= 0.01 level (2-tailed). FM, not modeled. 600℃热解棉杆生物炭WEOM与Cu(Ⅱ)的lgK值在4.23—5.19之间,随着波长的增加,lgK值呈现逐级增大的趋势。长波处的类腐殖酸物质与Cu(Ⅱ)能够形成较高化学稳定性的络合物。600℃热解棉杆生物炭WEOM中372 nm左右的类富里酸与Cu(Ⅱ)的络合常数明显要低于300℃时367 nm类富里酸与Cu(Ⅱ)的络合常数,而两种温度下类腐殖酸组分与Cu(Ⅱ)的络合常数值变化不大。此外,高温热解WEOM-Cu(Ⅱ)的荧光配位比在38.18%—79.13%之间,明显要高于300℃时的荧光配位比,说明高温热解导致参与Cu(Ⅱ)络合的荧光物质比例增加。然而图1显示,高温热解生物炭WEOM中荧光物质的含量相对较低,同时生物炭WEOM的含量也非常低,因此认为WEOM与金属的络合作用对高温热解生物炭用于土壤重金属修复过程的影响相对较小,而吸附可能成为影响重金属化学行为的主要因素。
3. 结论(Conclusion)
不同温度热解影响生物炭WEOM中荧光物质的组分及含量,生物炭热解实验结果表明,与高温生物炭相比,低温生物炭具有较高的WEOM含量,而高温热解生物炭经热解后的WEOM存在较多荧光组分。导数荧光能够更好的识别处被强的荧光基团掩盖的荧光组分,光谱分析结合荧光猝灭及二维相关分析能够很好的解释生物炭WEOM与重金属的络合特性及络合物的化学稳定性。结果表明,低温热解生物炭WEOM中367 nm处的类富里酸组分与Cu(Ⅱ)形成较高化学稳定性的络合物,而高温热解生物炭WEOM中荧光物质与Cu(Ⅱ)形成络合物的化学稳定性随着波长的增加而增加。300℃热解生物炭WEOM中,与Cu(Ⅱ)形成低化学稳定性的类腐殖酸组分(409 nm)能够优先于其他组分与Cu(Ⅱ)发生络合反应;而600℃热解生物炭WEOM中,372 nm处的类富里酸组分能够优先于其他组分与Cu(Ⅱ)形成有机络合物。高温热解与热处理生物炭增加了WEOM中参与Cu(Ⅱ)配位的荧光物质比例。不同温度热解能够改变生物炭孔隙结构、比表面积及WEOM的含量和荧光组分,这些影响生物炭土壤修复与改良效果,对WEOM与重金属的络合能够为生物炭土壤修复与改良过程中重金属的环境化学行为提供指导依据。
-
表 1 不同温度热解WEOM中各组分与Cu(Ⅱ)离子的络合参数
Table 1. Binding parameters of biochar-derived WEOM components with Cu(Ⅱ)
生物炭Biochar 荧光峰Peak 对数稳定常数lgK 荧光配位比f/% 决定系数R2 300℃ 270c FM FM FM 309abc FM FM FM 367ab 5.30 26.15 0.80* 409abc 4.85 57.81 0.93* 431b 5.08 43.41 0.88* 500ac 5.25 44.97 0.91* 600℃ 272c FM FM FM 290c FM FM FM 303abc FM FM FM 327b FM FM FM 338ac 4.23 38.18 0.98* 372abc 4.82 71.00 0.95* 418c 4.94 74.56 0.94* 460bc 5.02 79.13 0.94* 500abc 5.19 77.76 0.91* a, b, c分别为同步荧光光谱、二维相关光谱和二阶导数光谱识别的荧光峰; * p= 0.01 level (2-tailed). FM, not modeled. -
[1] ALLER M F. Biochar properties: Transport, fate, and impact [J]. Critical Reviews in Environmental Science and Technology, 2016, 46(14/15): 1183-1296. [2] 张雪莲, 廖洪, 李昌伟, 等. 田间条件下生物炭与化肥配施对土壤氮磷纵向迁移、结球生菜产量品质及土壤微生物数量的影响 [J]. 环境科学学报, 2021, 41(1): 21-28. ZHANG X L, LIAO H, LI C W, et al. Effects of simultaneous application of biochar and chemical fertilizer on the vertical migration of nitrogen and phosphorus, lettuce yield and quality and soil microbial quantity under field conditions [J]. Acta Scientiae Circumstantiae, 2021, 41(1): 21-28(in Chinese).
[3] 李倩倩, 许晨阳, 耿增超, 等. 生物炭对塿土土壤容重和团聚体的影响 [J]. 环境科学, 2019, 40(7): 3388-3396. LI Q Q, XU C Y, GENG Z C, et al. Impact of biochar on soil bulk density and aggregates of Lou soil [J]. Environmental Science, 2019, 40(7): 3388-3396(in Chinese).
[4] 戴静, 刘阳生. 生物炭的性质及其在土壤环境中应用的研究进展 [J]. 土壤通报, 2013, 44(6): 1520-1525. DAI J, LIU Y S. Review of research on the properties of biochar and its applications in soil [J]. Chinese Journal of Soil Science, 2013, 44(6): 1520-1525(in Chinese).
[5] ANAWAR H M, AKTER F, SOLAIMAN Z M, et al. Biochar: an emerging Panacea for remediation of soil contaminants from mining, industry and sewage wastes [J]. Pedosphere, 2015, 25(5): 654-665. doi: 10.1016/S1002-0160(15)30046-1 [6] HE X S, XI B D, WEI Z M, et al. Spectroscopic characterization of water extractable organic matter during composting of municipal solid waste [J]. Chemosphere, 2011, 82(4): 541-548. doi: 10.1016/j.chemosphere.2010.10.057 [7] GUO X J, LI C W, ZHU Q L, et al. Characterization of dissolved organic matter from biogas residue composting using spectroscopic techniques [J]. Waste Management, 2018, 78: 301-309. doi: 10.1016/j.wasman.2018.06.001 [8] FAN Q Y, SUN J X, QUAN G X, et al. Insights into the effects of long-term biochar loading on water-soluble organic matter in soil: Implications for the vertical co-migration of heavy metals [J]. Environment International, 2020, 136: 105439. doi: 10.1016/j.envint.2019.105439 [9] 杨毅, 马新培, 杨霞霞, 等. 城市污水二级出水溶解性有机物(DOM)与Cu2+作用的聚集和光谱特性 [J]. 环境化学, 2017, 36(12): 2609-2615. doi: 10.7524/j.issn.0254-6108.2017030202 ANG Y, MA X P, YANG X X, et al. Aggregation and spectral characteristics of DOM from secondary effluent of municipal wastewater in reaction with Cu2+ [J]. Environmental Chemistry, 2017, 36(12): 2609-2615(in Chinese). doi: 10.7524/j.issn.0254-6108.2017030202
[10] 杜士林, 李强, 丁婷婷, 等. 沙颍河流域水体中溶解性有机质(DOM)的荧光光谱解析[J]. 环境化学, 2019, 38(9): 2027-2037. DU S L, LI Q, DING T T, et al. Fluorescence spectra analysis of DOM in water of Shaying River basin[J].Environmental Chemistry, 2019, 38(9): 2027-2037 (in Chinese).
[11] HUANG M, LI Z W, LUO N L, et al. Application potential of biochar in environment: Insight from degradation of biochar-derived DOM and complexation of DOM with heavy metals [J]. Science of the Total Environment, 2019, 646: 220-228. doi: 10.1016/j.scitotenv.2018.07.282 [12] LI G, KHAN S, IBRAHIM M, et al. Biochars induced modification of dissolved organic matter (DOM) in soil and its impact on mobility and bioaccumulation of arsenic and cadmium [J]. Journal of Hazardous Materials, 2018, 348: 100-108. doi: 10.1016/j.jhazmat.2018.01.031 [13] LU Y F, ALLEN H E. Characterization of copper complexation with natural dissolved organic matter (DOM)—link to acidic moieties of DOM and competition by Ca and Mg [J]. Water Research, 2002, 36(20): 5083-5101. doi: 10.1016/S0043-1354(02)00240-3 [14] RYAN D K, WEBER J H. Fluorescence quenching titration for determination of complexing capacities and stability constants of fulvic acid [J]. Analytical Chemistry, 1982, 54(6): 986-990. doi: 10.1021/ac00243a033 [15] GUO X J, YU H B, YAN Z C, et al. Tracking variations of fluorescent dissolved organic matter during wastewater treatment by accumulative fluorescence emission spectroscopy combined with principal component, second derivative and canonical correlation analyses [J]. Chemosphere, 2018, 194: 463-470. doi: 10.1016/j.chemosphere.2017.12.023 [16] HUR J, LEE B M. Characterization of binding site heterogeneity for copper within dissolved organic matter fractions using two-dimensional correlation fluorescence spectroscopy [J]. Chemosphere, 2011, 83(11): 1603-1611. doi: 10.1016/j.chemosphere.2011.01.004 [17] WEI J, TU C, YUAN G D, et al. Limited Cu(II) binding to biochar DOM: Evidence from C K-edge NEXAFS and EEM-PARAFAC combined with two-dimensional correlation analysis [J]. Science of the Total Environment, 2020, 701: 134919. doi: 10.1016/j.scitotenv.2019.134919 [18] HUANG M, LI Z, LUO N, et al. Application potential of biochar in environment: Insight from degradation of biochar-derived DOM and complexation of DOM with heavy metals[J]. Science of the Total Environment, 2019,646: 220-228. [19] 丁思惠, 方升佐, 田野, 等. 不同热解温度下杨树各组分生物质炭的理化特性分析与评价 [J]. 南京林业大学学报(自然科学版), 2020, 44(6): 193-200. DING S H, FANG S Z, TIAN Y, et al. Analysis and evaluation on physicochemical properties of poplar biochar at different pyrolysis temperatures [J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2020, 44(6): 193-200(in Chinese).
[20] BARKER J D, SHARP M J, TURNER R J. Using synchronous fluorescence spectroscopy and principal components analysis to monitor dissolved organic matter dynamics in a glacier system [J]. Hydrological Processes, 2009, 23(10): 1487-1500. doi: 10.1002/hyp.7274 [21] NODA I, OZAKI Y. Two-dimensional correlation spectroscopy - applications in vibrational and optical spectroscopy[M]. Chichester, UK: John Wiley & Sons, Ltd, 2004. [22] YAMASHITA Y, JAFFÉ R. Characterizing the interactions between trace metals and dissolved organic matter using Excitation−Emission matrix and parallel factor analysis [J]. Environmental Science & Technology, 2008, 42(19): 7374-7379. -





 下载:
下载: