-
近年来,环境问题日益严峻,影响了人类健康和社会的可持续发展。如果说催化技术奠定了现代工业发展的基础,那么其也将是解决人类面临重大生存问题的关键技术。太阳光能量丰富,取之不尽,用之不竭,是理想的能量来源。光催化技术可以利用太阳能消除大气污染物,如氮氧化物、挥发性有机污染物、温室气体CO2等,进而改善我们的生存环境。
20世纪30年代,研究者发现在氧气及紫外光照射下,二氧化钛(TiO2)可以降解染料和纤维,并且反应前后TiO2无耗损[1]。但是由于当时人们对半导体理论理解不深以及测试分析水平不成熟,这种光催化降解有机污染物的现象被忽略,而被理解为紫外光的作用促使氧气在TiO2表面产生高活性物种。20世纪70年代,日本科学家Fujishima 和Honda 在Nature上发表“本多藤岛效应”的光催化现象,即TiO2在紫外光下能够光电催化分解水产生氢气[2],他们提出的太阳光催化分解水制氢的方法受到广泛的关注。1976年美国的Carey等发现光催化可以氧化多氯联苯[3];1983年Pruden和Ollis发现烷烃氯化物这种有机污染物可以被TiO2光催化降解成无污染的H2O和CO2[4];1989年Tanaka等提出在光催化反应中可以产生羟基自由基,这种活性物种将促进有机物污染物的氧化降解[5]。近几十年来,光催化已成为国内外最热门的研究领域之一,各国科研工作者都做出了不懈的努力。
半导体材料是多相光催化的核心,其中,催化剂的光吸收、光生电子-空穴分离、表面反应的性质在光催化反应性能方面起重要作用。锐钛矿TiO2因其较高的光催化性能、较好的稳定性以及低廉的价格等优点,成为应用最广泛的光催化材料。其较高的导带和较低的价带位置,可以增强光生电子、空穴的还原和氧化能力,深度还原和氧化反应物分子,避免二次污染和有毒中间物种生成。但是,TiO2作为直接利用太阳光的催化材料仍然存在一些不足,如:只能吸收紫外光,太阳能的利用率低;光催化反应的还原位点和氧化位点同时在TiO2半导体材料表面,极容易造成光生电子和空穴复合;对反应物吸附性能较差等。因此,寻求高性能的光催化材料已成为研究重点。
近年来,稀土元素以其丰富的能级结构,在光、电、磁等方面得到广泛应用。从电子结构看,5d轨道提供电子转移轨道,可作为光催化反应中光生电子的“转移站”;同时,在形成的氧化物中,正离子外层d和s电子的空态可以形成交叠导带,具有半导体性质。因此,稀土材料,尤其是铈基材料[6-8],在光催化领域具有潜在的应用前景。
-
铈(Ce)作为镧系元素,是稀土中丰度最高、最廉价的元素。由于外层特殊的电子结构(4f1、5d1、6s2),Ce元素具有可变价态。萤石结构的二氧化铈(CeO2)晶胞结构如下:阳离子按面心立方点阵排列,且每个金属阳离子被8个阴离子包围,阴离子填充全部的四面体孔隙,并与4个金属阳离子配位,进而促使氧化物中存在许多八面体空位和可迁移的氧空位[9]。因此,CeO2在较温和的条件下可以发生可逆的氧化-还原反应,具有良好的储存、释放氧性能。比如,在还原性气氛中,CeO2中Ce4+能被还原成Ce3+并释放氧,萤石型的晶胞结构保持不变,形成一种亚稳结构;而在氧化性气氛中,Ce3+又能被氧化成Ce4+储存氧,再次转变为稳定的萤石结构[10]。CeO2是常见的n型半导体,理论能带宽度是6 eV,主要由价带O2p和导带Ce5d构成;但是,由于CeO2-x中少量氧空位的存在,价带和导带分别变成O2p与4f能级,能带宽度会减小到3 eV;当在Ce2O3中,4f能级分裂为4f Empty和4f Full,价带和导带分别变成O2p和4f Full,能带宽度变为2 eV[11]。因此,相比于传统的金属氧化物TiO2光催化剂,CeO2因其特殊的电子结构,从而具有近紫外-可见光的响应,可以增强太阳光的吸收利用。同时,由于具有稳定的晶体结构、优异的氧流动性、较好的光学性质等优点,铈基催化剂被认为最具潜力的光催化材料之一,在大气污染治理领域都具有广泛的应用前景。
然而,目前CeO2光催化材料仍然存在一些不足,比如:禁带宽度为2.79 eV,只能吸收波长范围小于444 nm的光,不能充分利用太阳光;光生电子和空穴易于复合,导致量子效率较低,这严重降低了光催化性能;比表面积较小,不能有效地吸附反应物分子,影响表面反应等。针对上述问题,研究者对CeO2材料进行表面改性和优化,从而通过引入表面缺陷、形成异质结、产生更多的反应位点等方式提高光催化反应中光吸收、光生电子-空穴分离、以及表面反应这三个方面的效率,进而改善光催化反应性能。
-
研究表明通过贵金属沉积、半导体复合、碳材料修饰的方式,可以显著地提高铈基材料的光催化性能。在CeO2表面沉积适量的贵金属可以起到如下作用:
(1)贵金属沉积后,半导体的能带将弯向表面生成的损耗层,在金属-CeO2界面上形成俘获电子的浅势阱能垒,抑制光生电子-空穴的复合;
(2)光生电子快速地从CeO2表面传输到贵金属粒子上,加快电子运输到吸附氧的速率;
(3)Ag、Au负载后会产生等离子体共振效应,增强光催化剂的可见光吸收;
(4)高度分散的贵金属粒子具有特殊的电子结构,表面易吸附反应物分子,从而作为催化反应活性中心。比如:Primo等用生物聚合物模板法合成出CeO2纳米颗粒,将贵金属Au负载于CeO2纳米颗粒表面,发现相比于原来的CeO2,Au-CeO2具有优异的光催化分解水的活性,并且1% wt贵金属Au负载时性能最优[12]。Zhao等合成了CeO2@Ag@CdS复合材料,Ag的加入可以增强复合材料可见光的吸收,以及加快光生电子的迁移[13]。类似地,在Pt[14]、Pd[15]上都有所报道。另外,半导体复合也可以提高铈基催化剂的光催化性能。通过半导体的复合形成Z型、type Ⅱ型异质结,扩展CeO2光谱响应范围,同时加快光生电子-空穴的分离。常见的复合半导体有CeO2-TiO2,CeO2-CuO, CeO2-ZnO, Fe3O4/CeO2,CeO2/CdS,CeO2/g-C3N4等[16-21]。
-
离子掺杂是利用物理或化学方法,将离子引入到CeO2晶格结构内部,从而形成缺陷或改变晶格类型,影响光生电子和空穴的迁移方向、改变CeO2的能带结构,进而提高铈基材料的光催化性能。常用的掺杂离子包括非金属离子、过渡金属离子、稀土金属离子及其它离子。大量的研究表明非金属离子掺杂改性CeO2可以显著提高其光催化反应的活性。Wu等在非金属N元素掺杂过程中,发现少量CeO2的晶格氧被替换,减小CeO2禁带宽度,使得CeO2的激发波长由紫外扩展到了可见光区,提高了可见光下的催化活性,实现了直接利用太阳光能中的可见光来降解有机污染物[22]。除了N的研究[23-24],还有F[25]掺杂,以及S、N[26]共掺杂等。另外,过渡金属离子、稀土金属离子掺杂的相关报道也不少。过渡金属离子主要集中在 Fe3+、Cr3+、V4+等的掺杂[27-30],稀土金属离子主要是Eu3+、Y3+、Pr3+等[31-33]。一般来说,掺杂离子的电位要与CeO2的价带、导带相匹配,掺杂的稀土离子半径与Ce4+相近。利用离子掺杂的手段,形成捕获中心和掺杂能级,并增大载流子扩散长度,有效抑制光生电子与空穴的复合。同时。离子掺杂会引起CeO2的晶格扭曲,有利于更多氧缺陷和Ce3+物种的生成,提高可见光的吸收。
-
通常,催化剂的催化属性很大程度上依赖于其结构,因此,调控催化剂结构(特殊孔道、空心结构)是提升催化活性的重要途径。近年来,新型结构的CeO2光催化材料,如零维的量子点[34],一维的纳米棒[35]、纳米管[36],介孔结构[37],3D结构[38]等,吸引不少研究者的关注。Qi等可控合成了多层CeO2介孔材料,发现特殊的三层空心球结构有利于太阳光的充分利用,且大比表面积、高孔容、低密度的优点促进反应物分子的接触和连续碰撞,加强与活性组分的相互作用,因此相比于单层、双层空心球、纳米颗粒,CeO2三层介孔空心材料具有优异的光催化产氧性能[39]。Wang等通过前驱物MOF的晶体工程调控,得到活性位高分散的铈基材料,如图1所示,将Cu2+嵌入到Ce-MOF骨架中,以此为前驱物焙烧,促进Cu物种在CeO2中的高分散[40]。另外,关于CeO2的晶面效应在光催化反应中的作用机制也有一些报道[41-42]。Li等发现在光催化反应过程中,光生电子倾向于迁移到CeO2{111}晶面,而空穴倾向于迁移到CeO2{100}晶面[41];Zou等比较了CeO2 {110}{100}{111}晶面负载氮化碳的复合催化剂的光解水产氢性能,发现光催化性能与复合材料界面间的电子结构密切相关,CeO2 {110}与氮化碳间的电子转移作用最强,产生的内建电场有利于光生电子-空穴分离,因而具有最优的光催化反应性能[43]。
-
大气中的挥发性有机污染物(VOCs)主要来源于工业生产废气、交通运输中排放尾气以及装修房屋用到的涂料、胶合剂等[44]。在室温下VOCs易挥发,对环境和人体健康产生诸多危害。因此,VOCs的治理技术受到不少研究者的关注。近年来光催化氧化技术因为无二次污染、能耗低等优点,在去除低浓度空气污染物方面受到关注[45]。光催化氧化技术是指在光照下纳米半导体催化剂将室内空气中的挥发性有机污染物转化为无污染的H2O和CO2。其关键是高效的光生电子和空穴对分离的光催化反应,其中空穴的高氧化电位和在光生电荷存在下生成的反应活性中间体是光催化降解VOCs的主要驱动力。
稀土铈基材料由于具有较好的储-释氧能力和丰富的表面氧缺陷含量等优点,应用于甲醛、乙醛、苯、甲苯等VOCs污染物光催化消除反应中[46-53],其反应性能如表1所示。研究表明光催化消除VOCs反应性能与铈基催化剂表面的结构密切相关,特别是表面氧缺陷浓度。Eu掺杂CeO2催化剂,相比于纯CeO2,甲醛光催化降解性能显著提升,这主要由于Eu的掺入,提高了样品氧缺陷浓度,进而加快光生电子-空穴的分离;同时缺陷引入促进更多表面羟基的生成(O 1s XPS结果),样品与甲醛的接触角实验结果进一步说明了Eu掺杂CeO2催化剂有利于甲醛的吸附、活化(图2b)[46]。Muñoz-Batista等比较了CeO2-TiO2和TiO2光催化降解乙醛反应的光吸收效率和量子效率,发现催化反应性能依赖于催化剂的表面性质,在紫外光和可见光下,CeO2-TiO2都具有最优的反应活性和稳定性[49]。另外,有研究报道一些铈基材料还可以将光能转化为热能,进而提高光催化氧化性能。例如:CeMnxOy/TiO2材料可以吸收太阳光中全光谱(200—2400 nm),产生热能,提高催化体系的热量,达到光热协同高效催化消除苯污染物[50]。
对于光催化氧化VOCs多相反应,表面吸附与光催化反应间的关系值得研究。Liu等利用动力学手段,研究了Ce-TiO2光催化降解苯反应的决速步骤,他们认为光催化氧化苯的反应可以分为吸附和光催化两步反应,当吸附速率大于光催化反应速率时,光催化反应是决速步,反之则是吸附是决速步。他们比较苯分子在Ce-TiO2上吸附和光催化反应速率,发现光催化反应是决速步,且这个反应速率依赖于催化剂中Ce3+含量(图3c),反应机理如图2d所示[51]。Wu等利用叔丁醇作为捕获剂和ESR表征技术,测出在Mn-TiO2/CeO2光催化氧化甲苯反应中的活性氧物种,提出•OH氧化机制[52]。另外,研究发现光催化降解VOCs反应机制与光波长也有关系。当紫外光照射CeO2-TiO2复合材料时,光生电荷在TiO2表面激发,TiO2表面的光生空穴将甲苯氧化,而光生电子通过Ce3+/4+氧化还原电对转移到CeO2;当可见光照射时,光生电荷在CeO2表面激发,CeO2表面的光生空穴将甲苯氧化,而光生电子被CeO2中氧空位捕获[53]。
目前对于光催化降解VOCs的技术虽然得到显著地发展,但是该技术效率低、性能不稳定、反应会产生有毒中间产物等瓶颈问题仍然限制了该技术的进一步成功应用。后期研究将进一步关注功能性稀土铈基材料的可控合成:利用载体与活性组分强相互作用提高催化剂的稳定性;形成异质结和核壳结构从空间上促进光生电子-空穴分离,以及通过大比表面积有机材料,增大反应面积,提高其VOC降解能力。最终构建高效、绿色、环保的稀土铈基光催化氧化VOCs的反应体系。
-
氮氧化物(NOx)是造成大气污染的主要污染物之一,不仅能引起酸雨、雾霾、光化学烟雾、温室效应、臭氧层破坏等恶劣的环境现象,而且对人体以及动植物也会产生严重的毒害作用。随着社会经济的迅速发展,机动车辆的不断增加,人类向大气中排放的NOx越来越多。因此,大气治理刻不容缓,而解决问题的关键是控制氮氧化物的排放以及如何有效地消除NOx。如今,选择性NOx催化还原是应用最广泛的脱硝技术,主要其具有效率高、副产物少、操作简单等优点,但是存在能耗大、成本高等缺点,因此需要开发低温下高效的脱硝工艺和脱硝催化剂。
光催化消除氮氧化物因为能耗小、操作简单等优点受到不少研究者的关注。早在1984年,Courbon和Pichat就报道了TiO2在紫外光、常温下可以将少量的NO转化为N2和N2O [64]。Liu等研究了反应条件对光催化脱硝的影响,发现在8% O2,5% H2O的条件下,脱硝效率最高[65]。上述研究表明,利用光催化反应可以实现对少量氮氧化物有效消除。但是,在低温下,硝酸盐物种易形成、黏附于催化剂表面,导致催化剂中毒,削弱光催化反应活性。因此,如何防止副产物的生成是解决问题的关键。
目前,光催化消除少量NOx主要有两种反应机理:1)光催化氧化机理。NO先被光生空穴氧化成NO2,再进一步被羟基自由基、超氧自由基氧化成NO3-[66-67]。2)光催化还原机理。NO在催化剂表面氧空位吸附,进一步解离成N2和表面氧,表面氧释放出O2和电中性的氧空位,电中性的氧空位被光生空穴氧化成氧空位[68]。光催化NO还原成N2因转化率较低而研究较少,文献中主要研究的是光催化氧化NO成NO3-。稀土CeO2材料因丰富的氧空位、表面缺陷、可变的价态等优点,成为光催化氮氧化物消除反应的理想材料[54-56,69]。一方面,CeO2是碱性氧化物,可以有效地吸附、活化NO;另一方面,CeO2催化剂表面存在氧空位,可以通过掺杂、还原等方式增强表面氧空位浓度,进而增加可见光的吸收、减少光生电子-空穴的复合几率,提高光催化效率。Yu等合成了CoOx负载的N掺杂CeO2样品,用于光催化氧化NO反应。结果表明,N的掺入提高了催化剂对NO分子的吸附能力,同时Co与Ce物种间的电子作用有利于催化剂中氧空位的产生,增强O2的活化以及反应性能[69]。Cao等研究了Ce-TiO2光催化氧化NO的反应性能,发现Ce掺入到TiO2的晶胞中,改变其表面电荷密度(图3a—d),增加了激发电子数,进而有利于光催化消除NO反应效率的提高[54]。Li等发现在Au/CeO2−TiO2光催化界面处形成Au−Ce3+物种,可以锚定O2分子,进而与光生电子反应产生更多的活性自由基(图3e)[55]。另外,Ângelo等还研究了光照强度、NO停留时间、浓度、湿度这些反应因素对光催化氧化NO反应性能的影响规律。他们发现增大光照强度、延长停留时间有助于提高NO的转化率和选择性;低浓度NO有利于反应转化率的提升,但不利于选择性;适当的反应湿度可以产生更多的活性自由基,氧化NO,提高反应活性,但是过多的水汽会阻碍NO分子的吸附,不利于NO氧化[70]。因此,选择合适的反应条件对催化反应性能十分关键。
综上所述,目前光催化催化消除NO技术主要利用将NO氧化成硝酸根,此技术只适用于低浓度NO。但是,光催化消除NO方法存在转化率低、选择性差等缺点,大部分还处于实验阶段。如何有效地利用铈基催化剂提高光催化消除NO的性能以及相关的反应机制等科学问题仍需要深入研究。
-
随着工业化进程的不断推进,环境污染和能源枯竭等问题也日益突出。人类的社会活动加快了化石能源的消耗,同时化石能源的燃烧导致大气中温室气体排放量的增加,破坏自然界中碳循环平衡,引发全球气候变暖问题。积极应对能源危机和稳定控制大气中CO2总量,成为各国政府和科学家们的重大研究课题之一。利用光催化技术在太阳能驱动下将 CO2还原为甲醇、甲烷等清洁的碳氢燃料不仅能减缓全球气候变暖,更能实现工业废气的资源化利用,达到缓解石化能源危机的目的,最终实现碳的循环利用和开发清洁能源。
CO2是一种相对稳定的化合物,虽然光催化还原CO2的研究起步较早,但是太阳能转换效率最高只有1‰量级,转化效率较低。因此,光催化还原CO2极具挑战性。其中,将CO2分子还原形成•CO2-自由基的活化过程很难进行,导致光催化还原CO2反应效率至今未达到实际工业应用的要求。基于此,研发高效的绿色催化剂是实现温和条件下CO2再循环利用技术的关键。
研究表明,稀土的存在可以调节催化剂表面酸碱性。其中,CeO2材料作为稀土催化材料中最重要组成,凭借独特的4f电子、丰富的表面氧缺陷、良好的Ce3+/Ce4+切换能力等特点,在能源化工、环境保护和精细化学品生产等新兴领域展现出良好的催化性能和应用前景[57-60]。CeO2具有较强碱性可吸附活化CO2酸性分子,同时表面Ce3+/Ce4+氧化还原电对可以有效地分离光生电子和空穴。Ye等首次可控合成单金属铈层状双氢氧化物(MCe-LDHs),通过调变Ce3+/Ce4+浓度比,控制反应物CO2分子吸附活化能力[57]。Ce3+/Ce4+氧化还原电对可以改变Ce掺杂的TiO2表面电荷密度,进而影响CO2分子吸附活化位点[58]。另外,稀土铈基材料表面吸附的氧物种在光催化还原CO2反应中起到重要作用。研究表明,CeO2表面上的氧空位有助于羟基物种吸附,羟基物种可以提供电子,作为路易斯碱位与CO2分子中C空轨道作用,从而降低CO2吸附能(图4a)[60]。Wang等的研究也进一步证明,Cr掺入介孔CeO2光催化剂中,可以提高表面活性氧物种的含量,最终提升光催化还原CO2的反应性能[29]。
相比于其它传统无机材料,CeO2一个突出特征在于其具有较低的氧空位形成能,如CeO2(101)表面的氧空位形成能在2.0 eV左右,要远低于TiO2(101)表面的氧空位形成能(4.8 eV)。研究表明,表面少量缺陷相比于其体相结构和化学组成具有更重要的作用,微量缺陷的产生往往伴随着化学键的断裂与重组、晶格畸变、电子局域化等一系列的变化,进而对材料的物理化学性能甚至催化性能产生非常重要的影响。CeO2表面的氧空位可以作为路易斯酸性位,接受CO2分子中O原子的p电子,进而促进CO2分子的吸附和活化[61-63,71-73]。Wang等利用草酸和N2预处理CeO2催化剂,发现表面氧空位浓度增加,原位红外技术表明产生的氧空位可以有助于CO2分子还原成CO,但其表面强烈吸附的碳酸盐物种反而会影响催化剂的性能[61]。Rhatigan等利用理论计算也进一步证明确实存在氧空位的催化剂有助于CO2分子吸附活化和H2O分子的解离[71]。另外,Pu等提出了CeO2表面的氧空位作为路易斯酸位和其负载的Cu2O协同促进CO2分子吸附、活化、还原的反应机制,如图4b所示。类似于氧化还原机制(Mars van Krevelen),即Cu2O表面铜原子的d电子与CO2分子中的空轨道作用,同时CO2中氧原子与CeO2表面的氧空位作用,形成羧基中间物种,进一步光电子还原成CO[63]。
随着以CO2为主的温室气体排放量不断增加,寻求新型能源来构建低碳型社会的诉求越来越迫切。通过催化剂将大气中的温室气体CO2光催化还原方法是一项极具挑战性的前沿科技。其目标是合成有效的光催化材料来驱动氧化还原反应,实现其转换效率和选择性超过自然界光合作用。但是目前反应效率不高以及选择性差限制了此技术实际应用。后期可以从以下方面进行改性:(1)选择合适的半导体催剂,提高产物的选择性和产率。(2)选择合适的还原剂。目前水是光催化还原CO2反应中常见的还原剂,但是CO2在水中溶解度不高,且存在产物H2和H2O2竞争反应。因此可以选择一些有机溶剂代替水。(3)设计合适的光催化反应器,包括反应入射光强度、波长、温度、压力等。最终实现光催化还原CO2技术的大规模商业化应用。
-
稀土二氧化铈因其特殊的4f电子结构,具有近紫外-可见光的响应,同时,稳定的晶体结构、优异的氧流动性、较好的光学性质等优点,使其成为最具潜力的光催化材料之一,在光催化消除VOCs、NOx、温室气体CO2等环境领域都具有潜在的应用前景。但是目前对铈基材料的研究还处于实验阶段,主要关注其结构性质、结构与性能间的关系、以及反应机理。后期应重点开发高效铈基光催化材料,提高催化剂的量子效率和催化性能,进而推动稀土铈基光催化剂的工业化应用。
稀土铈基纳米材料在光催化消除环境污染物中的研究进展
Research progress on ceria-based nanomaterials for photocatalytic elimination of environmental pollutants
-
摘要: 当前环境污染问题已经成为影响社会可持续发展的重大问题之一,而光催化技术的迅猛发展为上述问题提供了技术支撑。稀土二氧化铈(CeO2)由于具有稳定的晶体结构、优异的氧流动性、较好的光学性质等优点,近年来在大气污染治理领域受到广泛关注。本综述总结了近年国内外研究者在稀土铈基纳米材料光催化消除环境污染物领域中所取得的主要研究进展,重点讨论了高性能铈基催化剂的设计理念,以及在光催化消除挥发性有机污染物、氮氧化物、温室气体CO2等领域中的基础应用研究,并对稀土铈基纳米材料光催化消除环境污染物的未来发展方向进行了展望。Abstract: Concerns related to air pollution and greenhouse gases emission have created great challenges for sustainable development of the society. Major attention has been given for the advance of photocatalysis to overcome these environmental crises. Recently, cerium dioxide (CeO2) received extensive attention as a promising photocatalyst, owning to its stable crystal structure, excellent oxygen mobility and good optical properties for photocatalytic elimination of environmental pollutants. This work provides a comprehensive review on recent research progress made by domestic and foreign researchers in terms of ceria-based nanomaterials. The main topics include the design of ceria-based catalysts with high-performance and their applications on the photocatalytic elimination of volatile organic compounds (VOCs), nitrogen oxides (NOx), greenhouse gas as CO2, etc. Furthermore, a perspective of future work on the development of ceria-based nanomaterials and their photocatalytic applications on pollutant removal is also presented at the end.
-
近年来,环境问题日益严峻,影响了人类健康和社会的可持续发展。如果说催化技术奠定了现代工业发展的基础,那么其也将是解决人类面临重大生存问题的关键技术。太阳光能量丰富,取之不尽,用之不竭,是理想的能量来源。光催化技术可以利用太阳能消除大气污染物,如氮氧化物、挥发性有机污染物、温室气体CO2等,进而改善我们的生存环境。
20世纪30年代,研究者发现在氧气及紫外光照射下,二氧化钛(TiO2)可以降解染料和纤维,并且反应前后TiO2无耗损[1]。但是由于当时人们对半导体理论理解不深以及测试分析水平不成熟,这种光催化降解有机污染物的现象被忽略,而被理解为紫外光的作用促使氧气在TiO2表面产生高活性物种。20世纪70年代,日本科学家Fujishima 和Honda 在Nature上发表“本多藤岛效应”的光催化现象,即TiO2在紫外光下能够光电催化分解水产生氢气[2],他们提出的太阳光催化分解水制氢的方法受到广泛的关注。1976年美国的Carey等发现光催化可以氧化多氯联苯[3];1983年Pruden和Ollis发现烷烃氯化物这种有机污染物可以被TiO2光催化降解成无污染的H2O和CO2[4];1989年Tanaka等提出在光催化反应中可以产生羟基自由基,这种活性物种将促进有机物污染物的氧化降解[5]。近几十年来,光催化已成为国内外最热门的研究领域之一,各国科研工作者都做出了不懈的努力。
半导体材料是多相光催化的核心,其中,催化剂的光吸收、光生电子-空穴分离、表面反应的性质在光催化反应性能方面起重要作用。锐钛矿TiO2因其较高的光催化性能、较好的稳定性以及低廉的价格等优点,成为应用最广泛的光催化材料。其较高的导带和较低的价带位置,可以增强光生电子、空穴的还原和氧化能力,深度还原和氧化反应物分子,避免二次污染和有毒中间物种生成。但是,TiO2作为直接利用太阳光的催化材料仍然存在一些不足,如:只能吸收紫外光,太阳能的利用率低;光催化反应的还原位点和氧化位点同时在TiO2半导体材料表面,极容易造成光生电子和空穴复合;对反应物吸附性能较差等。因此,寻求高性能的光催化材料已成为研究重点。
近年来,稀土元素以其丰富的能级结构,在光、电、磁等方面得到广泛应用。从电子结构看,5d轨道提供电子转移轨道,可作为光催化反应中光生电子的“转移站”;同时,在形成的氧化物中,正离子外层d和s电子的空态可以形成交叠导带,具有半导体性质。因此,稀土材料,尤其是铈基材料[6-8],在光催化领域具有潜在的应用前景。
1. 高性能稀土铈基光催化材料的设计 (Design for highly-efficient rare earth cerium-based photocatalysts)
铈(Ce)作为镧系元素,是稀土中丰度最高、最廉价的元素。由于外层特殊的电子结构(4f1、5d1、6s2),Ce元素具有可变价态。萤石结构的二氧化铈(CeO2)晶胞结构如下:阳离子按面心立方点阵排列,且每个金属阳离子被8个阴离子包围,阴离子填充全部的四面体孔隙,并与4个金属阳离子配位,进而促使氧化物中存在许多八面体空位和可迁移的氧空位[9]。因此,CeO2在较温和的条件下可以发生可逆的氧化-还原反应,具有良好的储存、释放氧性能。比如,在还原性气氛中,CeO2中Ce4+能被还原成Ce3+并释放氧,萤石型的晶胞结构保持不变,形成一种亚稳结构;而在氧化性气氛中,Ce3+又能被氧化成Ce4+储存氧,再次转变为稳定的萤石结构[10]。CeO2是常见的n型半导体,理论能带宽度是6 eV,主要由价带O2p和导带Ce5d构成;但是,由于CeO2-x中少量氧空位的存在,价带和导带分别变成O2p与4f能级,能带宽度会减小到3 eV;当在Ce2O3中,4f能级分裂为4f Empty和4f Full,价带和导带分别变成O2p和4f Full,能带宽度变为2 eV[11]。因此,相比于传统的金属氧化物TiO2光催化剂,CeO2因其特殊的电子结构,从而具有近紫外-可见光的响应,可以增强太阳光的吸收利用。同时,由于具有稳定的晶体结构、优异的氧流动性、较好的光学性质等优点,铈基催化剂被认为最具潜力的光催化材料之一,在大气污染治理领域都具有广泛的应用前景。
然而,目前CeO2光催化材料仍然存在一些不足,比如:禁带宽度为2.79 eV,只能吸收波长范围小于444 nm的光,不能充分利用太阳光;光生电子和空穴易于复合,导致量子效率较低,这严重降低了光催化性能;比表面积较小,不能有效地吸附反应物分子,影响表面反应等。针对上述问题,研究者对CeO2材料进行表面改性和优化,从而通过引入表面缺陷、形成异质结、产生更多的反应位点等方式提高光催化反应中光吸收、光生电子-空穴分离、以及表面反应这三个方面的效率,进而改善光催化反应性能。
1.1 表面改性
研究表明通过贵金属沉积、半导体复合、碳材料修饰的方式,可以显著地提高铈基材料的光催化性能。在CeO2表面沉积适量的贵金属可以起到如下作用:
(1)贵金属沉积后,半导体的能带将弯向表面生成的损耗层,在金属-CeO2界面上形成俘获电子的浅势阱能垒,抑制光生电子-空穴的复合;
(2)光生电子快速地从CeO2表面传输到贵金属粒子上,加快电子运输到吸附氧的速率;
(3)Ag、Au负载后会产生等离子体共振效应,增强光催化剂的可见光吸收;
(4)高度分散的贵金属粒子具有特殊的电子结构,表面易吸附反应物分子,从而作为催化反应活性中心。比如:Primo等用生物聚合物模板法合成出CeO2纳米颗粒,将贵金属Au负载于CeO2纳米颗粒表面,发现相比于原来的CeO2,Au-CeO2具有优异的光催化分解水的活性,并且1% wt贵金属Au负载时性能最优[12]。Zhao等合成了CeO2@Ag@CdS复合材料,Ag的加入可以增强复合材料可见光的吸收,以及加快光生电子的迁移[13]。类似地,在Pt[14]、Pd[15]上都有所报道。另外,半导体复合也可以提高铈基催化剂的光催化性能。通过半导体的复合形成Z型、type Ⅱ型异质结,扩展CeO2光谱响应范围,同时加快光生电子-空穴的分离。常见的复合半导体有CeO2-TiO2,CeO2-CuO, CeO2-ZnO, Fe3O4/CeO2,CeO2/CdS,CeO2/g-C3N4等[16-21]。
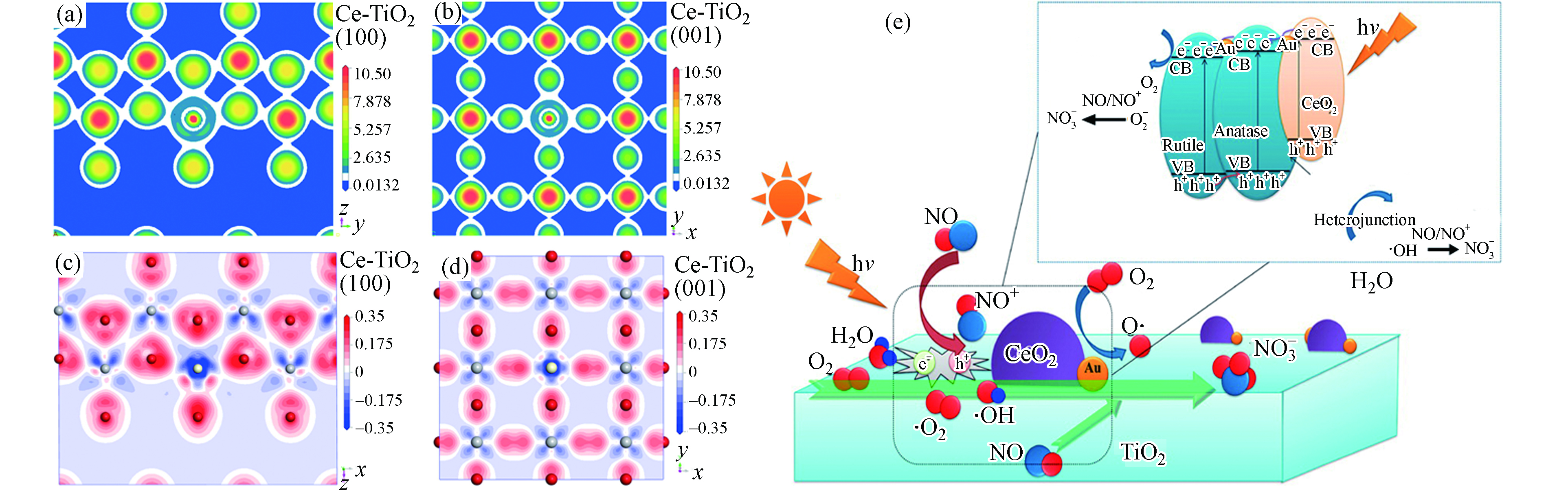
1.2 体相掺杂
离子掺杂是利用物理或化学方法,将离子引入到CeO2晶格结构内部,从而形成缺陷或改变晶格类型,影响光生电子和空穴的迁移方向、改变CeO2的能带结构,进而提高铈基材料的光催化性能。常用的掺杂离子包括非金属离子、过渡金属离子、稀土金属离子及其它离子。大量的研究表明非金属离子掺杂改性CeO2可以显著提高其光催化反应的活性。Wu等在非金属N元素掺杂过程中,发现少量CeO2的晶格氧被替换,减小CeO2禁带宽度,使得CeO2的激发波长由紫外扩展到了可见光区,提高了可见光下的催化活性,实现了直接利用太阳光能中的可见光来降解有机污染物[22]。除了N的研究[23-24],还有F[25]掺杂,以及S、N[26]共掺杂等。另外,过渡金属离子、稀土金属离子掺杂的相关报道也不少。过渡金属离子主要集中在 Fe3+、Cr3+、V4+等的掺杂[27-30],稀土金属离子主要是Eu3+、Y3+、Pr3+等[31-33]。一般来说,掺杂离子的电位要与CeO2的价带、导带相匹配,掺杂的稀土离子半径与Ce4+相近。利用离子掺杂的手段,形成捕获中心和掺杂能级,并增大载流子扩散长度,有效抑制光生电子与空穴的复合。同时。离子掺杂会引起CeO2的晶格扭曲,有利于更多氧缺陷和Ce3+物种的生成,提高可见光的吸收。
1.3 形貌调控
通常,催化剂的催化属性很大程度上依赖于其结构,因此,调控催化剂结构(特殊孔道、空心结构)是提升催化活性的重要途径。近年来,新型结构的CeO2光催化材料,如零维的量子点[34],一维的纳米棒[35]、纳米管[36],介孔结构[37],3D结构[38]等,吸引不少研究者的关注。Qi等可控合成了多层CeO2介孔材料,发现特殊的三层空心球结构有利于太阳光的充分利用,且大比表面积、高孔容、低密度的优点促进反应物分子的接触和连续碰撞,加强与活性组分的相互作用,因此相比于单层、双层空心球、纳米颗粒,CeO2三层介孔空心材料具有优异的光催化产氧性能[39]。Wang等通过前驱物MOF的晶体工程调控,得到活性位高分散的铈基材料,如图1所示,将Cu2+嵌入到Ce-MOF骨架中,以此为前驱物焙烧,促进Cu物种在CeO2中的高分散[40]。另外,关于CeO2的晶面效应在光催化反应中的作用机制也有一些报道[41-42]。Li等发现在光催化反应过程中,光生电子倾向于迁移到CeO2{111}晶面,而空穴倾向于迁移到CeO2{100}晶面[41];Zou等比较了CeO2 {110}{100}{111}晶面负载氮化碳的复合催化剂的光解水产氢性能,发现光催化性能与复合材料界面间的电子结构密切相关,CeO2 {110}与氮化碳间的电子转移作用最强,产生的内建电场有利于光生电子-空穴分离,因而具有最优的光催化反应性能[43]。
 图 1 铜铈催化剂的合成示意图Figure 1. Synthetic scheme and structure of copper–ceria catalyst.(a)MOF前驱物,(b)不同比例铜铈的MOF前驱物的晶体结构变化图,(c)Cu/Ce=0.20的催化剂的元素扫描能谱图和STEM图(标尺=2 nm)[40]。(a) metal–organic framework crystal engineering method for precursor preparation. A single-crystal-to-single-crystal-like transformation was performed in the ultrasonic-assisted conversion. Cyan and dark blue polyhedra represent Ce and Cu centers, respectively. (b) Crystal structure evolution with copper-to-cerium ratio in MOF precursors. (c) Elemental mapping and aberration-corrected STEM images of the as synthesized catalyst with Cu/Ce=0.20 (scale bar=2 nm) [40].
图 1 铜铈催化剂的合成示意图Figure 1. Synthetic scheme and structure of copper–ceria catalyst.(a)MOF前驱物,(b)不同比例铜铈的MOF前驱物的晶体结构变化图,(c)Cu/Ce=0.20的催化剂的元素扫描能谱图和STEM图(标尺=2 nm)[40]。(a) metal–organic framework crystal engineering method for precursor preparation. A single-crystal-to-single-crystal-like transformation was performed in the ultrasonic-assisted conversion. Cyan and dark blue polyhedra represent Ce and Cu centers, respectively. (b) Crystal structure evolution with copper-to-cerium ratio in MOF precursors. (c) Elemental mapping and aberration-corrected STEM images of the as synthesized catalyst with Cu/Ce=0.20 (scale bar=2 nm) [40].2. 稀土铈基材料在光催化消除大气污染物中的应用 (Application of rare earth cerium-based materials in photocatalytic elimination of air pollutants)
2.1 光催化消除挥发性有机污染物
大气中的挥发性有机污染物(VOCs)主要来源于工业生产废气、交通运输中排放尾气以及装修房屋用到的涂料、胶合剂等[44]。在室温下VOCs易挥发,对环境和人体健康产生诸多危害。因此,VOCs的治理技术受到不少研究者的关注。近年来光催化氧化技术因为无二次污染、能耗低等优点,在去除低浓度空气污染物方面受到关注[45]。光催化氧化技术是指在光照下纳米半导体催化剂将室内空气中的挥发性有机污染物转化为无污染的H2O和CO2。其关键是高效的光生电子和空穴对分离的光催化反应,其中空穴的高氧化电位和在光生电荷存在下生成的反应活性中间体是光催化降解VOCs的主要驱动力。
稀土铈基材料由于具有较好的储-释氧能力和丰富的表面氧缺陷含量等优点,应用于甲醛、乙醛、苯、甲苯等VOCs污染物光催化消除反应中[46-53],其反应性能如表1所示。研究表明光催化消除VOCs反应性能与铈基催化剂表面的结构密切相关,特别是表面氧缺陷浓度。Eu掺杂CeO2催化剂,相比于纯CeO2,甲醛光催化降解性能显著提升,这主要由于Eu的掺入,提高了样品氧缺陷浓度,进而加快光生电子-空穴的分离;同时缺陷引入促进更多表面羟基的生成(O 1s XPS结果),样品与甲醛的接触角实验结果进一步说明了Eu掺杂CeO2催化剂有利于甲醛的吸附、活化(图2b)[46]。Muñoz-Batista等比较了CeO2-TiO2和TiO2光催化降解乙醛反应的光吸收效率和量子效率,发现催化反应性能依赖于催化剂的表面性质,在紫外光和可见光下,CeO2-TiO2都具有最优的反应活性和稳定性[49]。另外,有研究报道一些铈基材料还可以将光能转化为热能,进而提高光催化氧化性能。例如:CeMnxOy/TiO2材料可以吸收太阳光中全光谱(200—2400 nm),产生热能,提高催化体系的热量,达到光热协同高效催化消除苯污染物[50]。
表 1 铈基材料在光催化消除大气污染物中的研究。Table 1. Study of ceria-based materials photocatalytic removal of atmospheric pollutants.催化剂Catalyst 大气污染物Atmospheric pollutant 污染物浓度及反应条件Pollutant concentration reaction conditions 净化效率Elimination efficiency 参考文献Reference Eu/CeO2 HCHO 500 μg·m−3,100 W100 W卤钨灯(λ>420 nm) 80% [46] Ce-GO-TiO2 HCHO 2000 μg m−3,氙灯(全光谱) 85% [47] CeO2-TiO2 乙醛 300 μg·m−3,45%湿度,紫外/可见光 70% (紫外光)5% (可见光) [48] CeO2–TiO2/g-C3N4 甲苯 700 μg·m−3,75%湿度,6 W日光灯 6.37×10−10 mol·s−1·m−1 (紫外光)3.52×10−10 mol·s−1·m−1 (可见光) [49] Pt@CeO2 苯甲醇 0.1 mmol,300 W氙灯(λ<420 nm) 40% [50] Ce3+-TiO2 苯 5.5 μg·m−3, (52%±2%)湿度,8 W汞灯 70% (紫外光)15% (可见光) [51] Mn-TiO2/CeO2 甲苯 30 μg·m−3,50%湿度4 W紫外灯 50% [52] CeO2/TiO2锐钛矿 甲苯 700 μg·m−3,90%湿度6 W灯(λ>290 nm) 1.2×10−9 mol·s−1·m−1 (紫外光)3.5×10−10 mol·s−1·m−1 (太阳光) [53] Ce-TiO2 NO 1.25 μg·m−3,50%湿度卤素灯(λ>400 nm) 27.38% [54] Au/CeO2/TiO2 0.500 μg·m−3150 W卤钨灯/4 W汞灯 80% [55] CeO2/g-C3N4 100 μg·m−3,70%湿度500 W氙灯(λ>420 nm) 55% [56] MCe-LDHs CO2 300 W氙灯,水 CO:13.5 μmol·g−1 [57] Ce-TiO2 8 W汞灯,NaOH溶液 CH4:16 μmol·g−1 [58] Fe-CeO2 300 W氙灯,水 CH4:17.5 μmol·g−1CO:75 μmol·g−1 [59] CeO2 300 W氙灯 CO:0.2 μmol·g−1 [60] CrCeO2 500 W氙灯(λ>420 nm) CH4:10.5 μmol·g−1CO:16 μmol·g−1 [29] CeO2-x 300 W氙灯,水 CO:13×10−6(V/V) [61] Pd/Ce-TiO2 氙灯,CO2/H2:1/4 CH4:225 μmol·g−1CO:28 μmol·g−1 [62] Cu2O-CeO2 300 W氙灯,水 CO:1.1 μmol·g−1 [63] 对于光催化氧化VOCs多相反应,表面吸附与光催化反应间的关系值得研究。Liu等利用动力学手段,研究了Ce-TiO2光催化降解苯反应的决速步骤,他们认为光催化氧化苯的反应可以分为吸附和光催化两步反应,当吸附速率大于光催化反应速率时,光催化反应是决速步,反之则是吸附是决速步。他们比较苯分子在Ce-TiO2上吸附和光催化反应速率,发现光催化反应是决速步,且这个反应速率依赖于催化剂中Ce3+含量(图3c),反应机理如图2d所示[51]。Wu等利用叔丁醇作为捕获剂和ESR表征技术,测出在Mn-TiO2/CeO2光催化氧化甲苯反应中的活性氧物种,提出•OH氧化机制[52]。另外,研究发现光催化降解VOCs反应机制与光波长也有关系。当紫外光照射CeO2-TiO2复合材料时,光生电荷在TiO2表面激发,TiO2表面的光生空穴将甲苯氧化,而光生电子通过Ce3+/4+氧化还原电对转移到CeO2;当可见光照射时,光生电荷在CeO2表面激发,CeO2表面的光生空穴将甲苯氧化,而光生电子被CeO2中氧空位捕获[53]。
目前对于光催化降解VOCs的技术虽然得到显著地发展,但是该技术效率低、性能不稳定、反应会产生有毒中间产物等瓶颈问题仍然限制了该技术的进一步成功应用。后期研究将进一步关注功能性稀土铈基材料的可控合成:利用载体与活性组分强相互作用提高催化剂的稳定性;形成异质结和核壳结构从空间上促进光生电子-空穴分离,以及通过大比表面积有机材料,增大反应面积,提高其VOC降解能力。最终构建高效、绿色、环保的稀土铈基光催化氧化VOCs的反应体系。
2.2 光催化消除氮氧化物
氮氧化物(NOx)是造成大气污染的主要污染物之一,不仅能引起酸雨、雾霾、光化学烟雾、温室效应、臭氧层破坏等恶劣的环境现象,而且对人体以及动植物也会产生严重的毒害作用。随着社会经济的迅速发展,机动车辆的不断增加,人类向大气中排放的NOx越来越多。因此,大气治理刻不容缓,而解决问题的关键是控制氮氧化物的排放以及如何有效地消除NOx。如今,选择性NOx催化还原是应用最广泛的脱硝技术,主要其具有效率高、副产物少、操作简单等优点,但是存在能耗大、成本高等缺点,因此需要开发低温下高效的脱硝工艺和脱硝催化剂。
光催化消除氮氧化物因为能耗小、操作简单等优点受到不少研究者的关注。早在1984年,Courbon和Pichat就报道了TiO2在紫外光、常温下可以将少量的NO转化为N2和N2O [64]。Liu等研究了反应条件对光催化脱硝的影响,发现在8% O2,5% H2O的条件下,脱硝效率最高[65]。上述研究表明,利用光催化反应可以实现对少量氮氧化物有效消除。但是,在低温下,硝酸盐物种易形成、黏附于催化剂表面,导致催化剂中毒,削弱光催化反应活性。因此,如何防止副产物的生成是解决问题的关键。
目前,光催化消除少量NOx主要有两种反应机理:1)光催化氧化机理。NO先被光生空穴氧化成NO2,再进一步被羟基自由基、超氧自由基氧化成NO3-[66-67]。2)光催化还原机理。NO在催化剂表面氧空位吸附,进一步解离成N2和表面氧,表面氧释放出O2和电中性的氧空位,电中性的氧空位被光生空穴氧化成氧空位[68]。光催化NO还原成N2因转化率较低而研究较少,文献中主要研究的是光催化氧化NO成NO3-。稀土CeO2材料因丰富的氧空位、表面缺陷、可变的价态等优点,成为光催化氮氧化物消除反应的理想材料[54-56,69]。一方面,CeO2是碱性氧化物,可以有效地吸附、活化NO;另一方面,CeO2催化剂表面存在氧空位,可以通过掺杂、还原等方式增强表面氧空位浓度,进而增加可见光的吸收、减少光生电子-空穴的复合几率,提高光催化效率。Yu等合成了CoOx负载的N掺杂CeO2样品,用于光催化氧化NO反应。结果表明,N的掺入提高了催化剂对NO分子的吸附能力,同时Co与Ce物种间的电子作用有利于催化剂中氧空位的产生,增强O2的活化以及反应性能[69]。Cao等研究了Ce-TiO2光催化氧化NO的反应性能,发现Ce掺入到TiO2的晶胞中,改变其表面电荷密度(图3a—d),增加了激发电子数,进而有利于光催化消除NO反应效率的提高[54]。Li等发现在Au/CeO2−TiO2光催化界面处形成Au−Ce3+物种,可以锚定O2分子,进而与光生电子反应产生更多的活性自由基(图3e)[55]。另外,Ângelo等还研究了光照强度、NO停留时间、浓度、湿度这些反应因素对光催化氧化NO反应性能的影响规律。他们发现增大光照强度、延长停留时间有助于提高NO的转化率和选择性;低浓度NO有利于反应转化率的提升,但不利于选择性;适当的反应湿度可以产生更多的活性自由基,氧化NO,提高反应活性,但是过多的水汽会阻碍NO分子的吸附,不利于NO氧化[70]。因此,选择合适的反应条件对催化反应性能十分关键。
综上所述,目前光催化催化消除NO技术主要利用将NO氧化成硝酸根,此技术只适用于低浓度NO。但是,光催化消除NO方法存在转化率低、选择性差等缺点,大部分还处于实验阶段。如何有效地利用铈基催化剂提高光催化消除NO的性能以及相关的反应机制等科学问题仍需要深入研究。
2.3 光催化净化温室气体CO2
随着工业化进程的不断推进,环境污染和能源枯竭等问题也日益突出。人类的社会活动加快了化石能源的消耗,同时化石能源的燃烧导致大气中温室气体排放量的增加,破坏自然界中碳循环平衡,引发全球气候变暖问题。积极应对能源危机和稳定控制大气中CO2总量,成为各国政府和科学家们的重大研究课题之一。利用光催化技术在太阳能驱动下将 CO2还原为甲醇、甲烷等清洁的碳氢燃料不仅能减缓全球气候变暖,更能实现工业废气的资源化利用,达到缓解石化能源危机的目的,最终实现碳的循环利用和开发清洁能源。
CO2是一种相对稳定的化合物,虽然光催化还原CO2的研究起步较早,但是太阳能转换效率最高只有1‰量级,转化效率较低。因此,光催化还原CO2极具挑战性。其中,将CO2分子还原形成•CO2-自由基的活化过程很难进行,导致光催化还原CO2反应效率至今未达到实际工业应用的要求。基于此,研发高效的绿色催化剂是实现温和条件下CO2再循环利用技术的关键。
研究表明,稀土的存在可以调节催化剂表面酸碱性。其中,CeO2材料作为稀土催化材料中最重要组成,凭借独特的4f电子、丰富的表面氧缺陷、良好的Ce3+/Ce4+切换能力等特点,在能源化工、环境保护和精细化学品生产等新兴领域展现出良好的催化性能和应用前景[57-60]。CeO2具有较强碱性可吸附活化CO2酸性分子,同时表面Ce3+/Ce4+氧化还原电对可以有效地分离光生电子和空穴。Ye等首次可控合成单金属铈层状双氢氧化物(MCe-LDHs),通过调变Ce3+/Ce4+浓度比,控制反应物CO2分子吸附活化能力[57]。Ce3+/Ce4+氧化还原电对可以改变Ce掺杂的TiO2表面电荷密度,进而影响CO2分子吸附活化位点[58]。另外,稀土铈基材料表面吸附的氧物种在光催化还原CO2反应中起到重要作用。研究表明,CeO2表面上的氧空位有助于羟基物种吸附,羟基物种可以提供电子,作为路易斯碱位与CO2分子中C空轨道作用,从而降低CO2吸附能(图4a)[60]。Wang等的研究也进一步证明,Cr掺入介孔CeO2光催化剂中,可以提高表面活性氧物种的含量,最终提升光催化还原CO2的反应性能[29]。
相比于其它传统无机材料,CeO2一个突出特征在于其具有较低的氧空位形成能,如CeO2(101)表面的氧空位形成能在2.0 eV左右,要远低于TiO2(101)表面的氧空位形成能(4.8 eV)。研究表明,表面少量缺陷相比于其体相结构和化学组成具有更重要的作用,微量缺陷的产生往往伴随着化学键的断裂与重组、晶格畸变、电子局域化等一系列的变化,进而对材料的物理化学性能甚至催化性能产生非常重要的影响。CeO2表面的氧空位可以作为路易斯酸性位,接受CO2分子中O原子的p电子,进而促进CO2分子的吸附和活化[61-63,71-73]。Wang等利用草酸和N2预处理CeO2催化剂,发现表面氧空位浓度增加,原位红外技术表明产生的氧空位可以有助于CO2分子还原成CO,但其表面强烈吸附的碳酸盐物种反而会影响催化剂的性能[61]。Rhatigan等利用理论计算也进一步证明确实存在氧空位的催化剂有助于CO2分子吸附活化和H2O分子的解离[71]。另外,Pu等提出了CeO2表面的氧空位作为路易斯酸位和其负载的Cu2O协同促进CO2分子吸附、活化、还原的反应机制,如图4b所示。类似于氧化还原机制(Mars van Krevelen),即Cu2O表面铜原子的d电子与CO2分子中的空轨道作用,同时CO2中氧原子与CeO2表面的氧空位作用,形成羧基中间物种,进一步光电子还原成CO[63]。
随着以CO2为主的温室气体排放量不断增加,寻求新型能源来构建低碳型社会的诉求越来越迫切。通过催化剂将大气中的温室气体CO2光催化还原方法是一项极具挑战性的前沿科技。其目标是合成有效的光催化材料来驱动氧化还原反应,实现其转换效率和选择性超过自然界光合作用。但是目前反应效率不高以及选择性差限制了此技术实际应用。后期可以从以下方面进行改性:(1)选择合适的半导体催剂,提高产物的选择性和产率。(2)选择合适的还原剂。目前水是光催化还原CO2反应中常见的还原剂,但是CO2在水中溶解度不高,且存在产物H2和H2O2竞争反应。因此可以选择一些有机溶剂代替水。(3)设计合适的光催化反应器,包括反应入射光强度、波长、温度、压力等。最终实现光催化还原CO2技术的大规模商业化应用。
3. 结论(Conclusion)
稀土二氧化铈因其特殊的4f电子结构,具有近紫外-可见光的响应,同时,稳定的晶体结构、优异的氧流动性、较好的光学性质等优点,使其成为最具潜力的光催化材料之一,在光催化消除VOCs、NOx、温室气体CO2等环境领域都具有潜在的应用前景。但是目前对铈基材料的研究还处于实验阶段,主要关注其结构性质、结构与性能间的关系、以及反应机理。后期应重点开发高效铈基光催化材料,提高催化剂的量子效率和催化性能,进而推动稀土铈基光催化剂的工业化应用。
-
图 2 Eu掺杂CeO2催化剂:(a)O 1s XPS结果,(b)与甲醛的接触角结果[46];Ce-TiO2:(c)光催化降解苯反应速率与Ce3+含量的关系,(d)光照下的反应机制[51]。
Figure 2. The results of Eu doped CeO2 catalysts: (a) XPS spectra of O 1s, (b) contact angles with formaldehyde[46]; Ce-TiO2: (c) the relationship between the degradation rates of benzene and the Ce3+ contents, and (d) reaction mechanism[51]
表 1 铈基材料在光催化消除大气污染物中的研究。
Table 1. Study of ceria-based materials photocatalytic removal of atmospheric pollutants.
催化剂Catalyst 大气污染物Atmospheric pollutant 污染物浓度及反应条件Pollutant concentration reaction conditions 净化效率Elimination efficiency 参考文献Reference Eu/CeO2 HCHO 500 μg·m−3,100 W100 W卤钨灯(λ>420 nm) 80% [46] Ce-GO-TiO2 HCHO 2000 μg m−3,氙灯(全光谱) 85% [47] CeO2-TiO2 乙醛 300 μg·m−3,45%湿度,紫外/可见光 70% (紫外光)5% (可见光) [48] CeO2–TiO2/g-C3N4 甲苯 700 μg·m−3,75%湿度,6 W日光灯 6.37×10−10 mol·s−1·m−1 (紫外光)3.52×10−10 mol·s−1·m−1 (可见光) [49] Pt@CeO2 苯甲醇 0.1 mmol,300 W氙灯(λ<420 nm) 40% [50] Ce3+-TiO2 苯 5.5 μg·m−3, (52%±2%)湿度,8 W汞灯 70% (紫外光)15% (可见光) [51] Mn-TiO2/CeO2 甲苯 30 μg·m−3,50%湿度4 W紫外灯 50% [52] CeO2/TiO2锐钛矿 甲苯 700 μg·m−3,90%湿度6 W灯(λ>290 nm) 1.2×10−9 mol·s−1·m−1 (紫外光)3.5×10−10 mol·s−1·m−1 (太阳光) [53] Ce-TiO2 NO 1.25 μg·m−3,50%湿度卤素灯(λ>400 nm) 27.38% [54] Au/CeO2/TiO2 0.500 μg·m−3150 W卤钨灯/4 W汞灯 80% [55] CeO2/g-C3N4 100 μg·m−3,70%湿度500 W氙灯(λ>420 nm) 55% [56] MCe-LDHs CO2 300 W氙灯,水 CO:13.5 μmol·g−1 [57] Ce-TiO2 8 W汞灯,NaOH溶液 CH4:16 μmol·g−1 [58] Fe-CeO2 300 W氙灯,水 CH4:17.5 μmol·g−1CO:75 μmol·g−1 [59] CeO2 300 W氙灯 CO:0.2 μmol·g−1 [60] CrCeO2 500 W氙灯(λ>420 nm) CH4:10.5 μmol·g−1CO:16 μmol·g−1 [29] CeO2-x 300 W氙灯,水 CO:13×10−6(V/V) [61] Pd/Ce-TiO2 氙灯,CO2/H2:1/4 CH4:225 μmol·g−1CO:28 μmol·g−1 [62] Cu2O-CeO2 300 W氙灯,水 CO:1.1 μmol·g−1 [63] -
[1] HASHIMOTO K, IRIE H, FUJISHIMA A. TiO2 photocatalysis: A historical overview and future prospects [J]. Japanese Journal of Applied Physics, 2005, 44(12): 8269-8285. doi: 10.1143/JJAP.44.8269 [2] FUJISHIMA A, HONDA K. Electrochemical photolysis of water at a semiconductor electrode [J]. Nature, 1972, 238(5358): 37-38. doi: 10.1038/238037a0 [3] CAREY J H, LAWRENCE J, TOSINE H M. Photodechlorination of PCB's in the presence of titanium dioxide in aqueous suspensions [J]. Bulletin of Environmental Contamination and Toxicology, 1976, 16(6): 697-701. doi: 10.1007/BF01685575 [4] PRUDEN A L, OLLIS D F. Degradation of chloroform by photoassisted heterogeneous catalysis in dilute aqueous suspensions of titanium dioxide [J]. Environmental Science & Technology, 1983, 17(10): 628-631. [5] HISANAGA T, HARADA K, TANAKA K. Photocatalytic degradation of organochlorine compounds in suspended TiO2 [J]. Journal of Photochemistry and Photobiology A:Chemistry, 1990, 54(1): 113-118. doi: 10.1016/1010-6030(90)87015-4 [6] CHEN X X, ZHAN S J, CHEN D S, et al. Grey Fe-CeO2-σ for boosting photocatalytic ozonation of refractory pollutants: Roles of surface and bulk oxygen vacancies [J]. Applied Catalysis B:Environmental, 2021, 286: 119928. doi: 10.1016/j.apcatb.2021.119928 [7] YANG C, ZHANG G H, MENG Y, et al. Direct Z-scheme CeO2@LDH core–shell heterostructure for photodegradation of Rhodamine B by synergistic persulfate activation [J]. Journal of Hazardous Materials, 2021, 408: 124908. doi: 10.1016/j.jhazmat.2020.124908 [8] HAO C C, TANG Y B, SHI W L, et al. Facile solvothermal synthesis of a Z-Scheme 0D/3D CeO2/ZnIn2S4 heterojunction with enhanced photocatalytic performance under visible light irradiation [J]. Chemical Engineering Journal, 2021, 409: 128168. doi: 10.1016/j.cej.2020.128168 [9] SHOKO E, SMITH M F, MCKENZIE R H. Charge distribution and transport properties in reduced ceria phases: A review [J]. Journal of Physics and Chemistry of Solids, 2011, 72(12): 1482-1494. doi: 10.1016/j.jpcs.2011.09.002 [10] GHOM S A, ZAMANI C, NAZARPOUR S, et al. Oxygen sensing with mesoporous ceria-zirconia solid solution [J]. Sensors and Actuators B:Chemical, 2009, 140(1): 216-221. doi: 10.1016/j.snb.2009.02.078 [11] KULLGREN J, CASTLETON C W M, MULLER C, et al. B3LYP calculations of cerium oxides [J]. The Journal of Chemical Physics, 2010, 132: 1-12. [12] PRIMO A, MARINO T, CORMA A, et al. Efficient visible-light photocatalytic water splitting by minute amounts of gold supported on nanoparticulate CeO2 obtained by a biopolymer templating method [J]. Journal of the American Chemical Society, 2012, 134(3): 1892. doi: 10.1021/ja211206v [13] ZHAO M, LI H H, SHEN X P, et al. Facile electrochemical synthesis of CeO2@Ag@CdS nanotube arrays with enhanced photoelectrochemical water splitting performance [J]. Dalton Transactions, 2015, 44(46): 19935-19941. doi: 10.1039/C5DT03661E [14] LI S X, CAI J B, WU X Q, et al. TiO2@Pt@CeO2 nanocomposite as a bifunctional catalyst for enhancing photo-reduction of Cr (VI) and photo-oxidation of benzyl alcohol [J]. Journal of Hazardous Materials, 2018, 346: 52-61. doi: 10.1016/j.jhazmat.2017.12.001 [15] SARAVANAKUMAR K, KARTHIK R, CHEN S M, et al. Construction of novel Pd/CeO2/g-C3N4 nanocomposites as efficient visible-light photocatalysts for hexavalent chromium detoxification [J]. Journal of Colloid and Interface Science, 2017, 504: 514-526. doi: 10.1016/j.jcis.2017.06.003 [16] JIANG B T, ZHANG S Y, GUO X Z, et al. Preparation and photocatalytic activity of CeO2/TiO2 interface composite film [J]. Applied Surface Science, 2009, 255: 5975-5978. doi: 10.1016/j.apsusc.2009.01.049 [17] WANG N, PAN Y, LU T, et al. A new ribbon-ignition method for fabricating p-CuO/n-CeO2 heterojunction with enhanced photocatalytic activity [J]. Applied Surface Science, 2017, 403: 699-706. doi: 10.1016/j.apsusc.2017.01.232 [18] RAJENDRAN S, KHAN M M, GRACIAL F, et al. Ce3+-ion-induced visible-light photocatalytic degradation and electrochemical activity of ZnO/CeO2 nanocomposite [J]. Scientific Reports, 2016, 6: 31641-31652. doi: 10.1038/srep31641 [19] MOHAMMADIYAN E, GHAFURI H, KAKANEJADIFARD A, Synthesis and characterization of a magnetic Fe3O4@CeO2 nanocomposite decorated with Ag nanoparticle and investigation of synergistic effects of Ag on photocatalytic activity [J]. Optik, 2018, 166: 39-48. [20] YOU D T, PAN B, JIANG F, et al. CdS nanoparticles/CeO2 nanorods composite with high-efficiency visible-light-driven photocatalytic activity [J]. Applied Surface Science, 2016, 363: 154-160. doi: 10.1016/j.apsusc.2015.12.021 [21] LI X Z, ZHU W, LU X W, et al. Integrated nanostructures of CeO2/attapulgite/g-C3N4 as efficient catalyst for photocatalytic desulfurization: Mechanism, kinetics and influencing factors [J]. Chemical Engineering Journal, 2017, 326: 87-98. doi: 10.1016/j.cej.2017.05.131 [22] WU C L, Solvothermal synthesis of N-doped CeO2 microspheres with visible light-driven photocatalytic activity [J]. Materials Letters, 2015, 139: 382-384. [23] CHEN J, SHEN S H, WU P, et al. Nitrogen-doped CeOx nanoparticles modified graphitic carbon nitride for enhanced photocatalytic hydrogen production [J]. Green Chemistry, 2015, 17: 509-517. doi: 10.1039/C4GC01683A [24] JORGE A B, FRAXEDAS J, CANTARERO A, et al. Nitrogen Doping of Ceria [J]. Chemistry of Materials, 2008, 20(5): 1682-1684. doi: 10.1021/cm7028678 [25] AHMAD S, GOPALAIAH K, CHANDRUDU S N, et al. Anion (fluoride)-doped ceria nanocrystals: Synthesis, characterization, and its catalytic application to oxidative coupling of benzylamines [J]. Inorganic Chemistry, 2014, 53: 2030-2039. doi: 10.1021/ic403166q [26] MANSINGH S, PADHI D K, PARID K M. Enhanced visible light harnessing and oxygen vacancy promoted N, S co-doped CeO2 nanoparticle: A challenging photocatalyst for Cr(Ⅵ) reduction [J]. Catalysis Science & Technology, 2017, 7: 2772-2781. [27] WANG Y G, WANG F, CHEN Y T, et al. Enhanced photocatalytic performance of ordered mesoporous Fe-doped CeO2 catalysts for the reduction of CO2 with H2O under simulated solar irradiation [J]. Applied Catalysis B:Environmental, 2014, 147: 602-609. doi: 10.1016/j.apcatb.2013.09.036 [28] PENG D Z, CHEN S Y, CHEN C L, et al. Understanding and Tuning Electronic Structure in Modified Ceria Nanocrystals by Defect Engineering [J]. Langmuir, 2014, 30(34): 10430-10439. doi: 10.1021/la501576c [29] WANG Y G, BAI X, WANG F, et al. Nanocasting synthesis of chromium doped mesoporous CeO2 with enhanced visible-light photocatalytic CO2 reduction performance [J]. Journal of Hazardous Materials, 2019, 372: 69-76. doi: 10.1016/j.jhazmat.2017.10.007 [30] CUI X, LIU Z Y, Li G S, et al. Self-generating CeVO4 as conductive channel within CeO2/CeVO4/V2O5 to induce Z-scheme-charge-transfer driven photocatalytic degradation coupled with hydrogen production [J]. International Journal of Hydrogen Energy, 2019, 44: 23921-23935. doi: 10.1016/j.ijhydene.2019.07.096 [31] XU B, YANG H, ZHANG Q T, et al. Design and synthesis of Sm, Y, La and Nd-doped CeO2 with a broom-like hierarchical structure: a photocatalyst with enhanced oxidation performance [J]. ChemCatChem, 2020, 12: 2638-2646. doi: 10.1002/cctc.201902309 [32] CODURI M, SCAYINI M, ALLIETA M, et al. Defect structure of Y-doped ceria on different length scales [J]. Chemistry of Materials, 2013, 25: 4278-4289. doi: 10.1021/cm402359d [33] HAO S Y, HOU J, APREA P, et al. Mesoporous Ce-Pr-O solid solution with efficient photocatalytic activity under weak daylight irradiation [J]. Applied Catalysis B:Environmental, 2014, 160-161: 566-573. doi: 10.1016/j.apcatb.2014.06.013 [34] SREEKANTH T V M, NAGAJYOTHI P C, DILLIP G R, et al. Determination of Band Alignment in the Synergistic Catalyst of Electronic Structure-Modified Graphitic Carbon Nitride-Integrated Ceria Quantum-Dot Heterojunctions for Rapid Degradation of Organic Pollutants [J]. The Journal of Physical Chemistry C, 2017, 121(45): 25229-25242. doi: 10.1021/acs.jpcc.7b08568 [35] ZHAO K, QI J, YIN H J, et al. Efficient water oxidation under visible light by tuning surface defects on ceria nanorods [J]. Journal of Materials Chemistry A, 2015, 3: 20465-20470. doi: 10.1039/C5TA05817A [36] WU J S, Wang J S, DU Y C, et al. Chemically controlled growth of porous CeO2 nanotubes for Cr(Ⅵ) photoreduction [J]. Applied Catalysis B:Environmental, 2015, 174-175: 435-444. doi: 10.1016/j.apcatb.2015.03.040 [37] MANWAR N R, CHILKALWAR A A, NANDA K K, et al. Ceria Supported Pt/PtO-Nanostructures: Efficient Photocatalyst for Sacrificial Donor Assisted Hydrogen Generation under Visible-NIR Light Irradiation [J]. ACS Sustainable Chemistry & Engineering, 2016, 4(4): 2323-2332. [38] WANG A Q, ZHENG Z K, WANG H, et al. 3D hierarchical H-2-reduced Mn-doped CeO2 microflowers assembled from nanotubes as a high-performance Fenton-like photocatalyst for tetracycline antibiotics degradation [J]. Applied Catalysis B:Environmental, 2020, 277: 119171. doi: 10.1016/j.apcatb.2020.119171 [39] QI J, ZHAO K, LI G D, et al. Multi-shelled CeO2 hollow microspheres as superior photocatalysts for water oxidation [J]. Nanoscale, 2014, 6(8): 4072-4077. doi: 10.1039/C3NR06822F [40] WANG F, TIAN J, LI M, et al. A photoactivated Cu-CeO2 catalyst with Cu--Ce active species designed through MOF crystal engineering [J]. Angewandte Chemie, 2020, 132: 8280-8286. doi: 10.1002/ange.201916049 [41] LI P, ZHOU Y, ZHAO Z Y, et al. Hexahedron prism-anchored octahedronal CeO2: crystal facet-based homojunction promoting efficient solar fuel synthesis [J]. Journal of the American Chemical Society, 2015, 137(30): 9547-9550. doi: 10.1021/jacs.5b05926 [42] JIANG D, WANG W Z, ZHANG L, et al. Insights into the surface-defect dependence of photoreactivity over CeO2 nanocrystals with well-defined crystal facets [J]. ACS Catalysis, 2015, 5(8): 4851-4858. doi: 10.1021/acscatal.5b01128 [43] ZOU W X, DENG B, HU X X, et al. Crystal-plane-dependent metal oxide-support interaction in CeO2/g-C3N4 for photocatalytic hydrogen evolution [J]. Applied Catalysis B:Environmental, 2018, 238: 111-118. doi: 10.1016/j.apcatb.2018.07.022 [44] XU C C, ZHANG Q, XU Q, et al. Research progress of organic-inorganic photocatalysts for degrading VOCs [J]. Environmental Engineering, 2020, 38(1): 28-36. [45] SHEN L J, CHENG R, CHEN Y H, et al. Research progress on the purification technologies of indoor volatile organic compounds [J]. Chemical Industry and Engineering Progress, 2017, 36(10): 3887-3896. [46] HUANG Y C, LONG B, TANG M N, et al. Bifunctional catalytic material: An ultrastable and high-performance surface defect CeO2 nanosheets for formaldehyde thermal oxidation and photocatalytic oxidation [J]. Applied Catalysis B:Environmental, 2016, 181: 779-787. doi: 10.1016/j.apcatb.2015.08.047 [47] LI J, ZHANG Q, LAI A C K, et al. Study on photocatalytic performance of cerium–graphene oxide–titanium dioxide composite film for formaldehyde removal [J]. Physica Status Solidi (a), 2016, 213(12): 3157-3164. doi: 10.1002/pssa.201600261 [48] MUÑOZ-BATISTA M J, DE LOS MILAGROS BALLARI M, KUBACKA A, et al. Acetaldehyde degradation under UV and visible irradiation using CeO2–TiO2 composite systems: Evaluation of the photocatalytic efficiencies [J]. Chemical Engineering Journal, 2014, 255: 297-306. doi: 10.1016/j.cej.2014.06.056 [49] MUÑOZ-BATISTA M J, FERNÁNDEZ-GARCíA M, KUBACKA A. Promotion of CeO2–TiO2 photoactivity by g-C3N4: Ultraviolet and visible light elimination of toluene [J]. Applied Catalysis B:Environmental, 2015, 164: 261-270. doi: 10.1016/j.apcatb.2014.09.037 [50] LIU H H, LI Y Z, YANG Y, et al. Highly efficient UV-Vis-infrared catalytic purification of benzene on CeMnxOy/TiO2 nanocomposite, caused by its high thermocatalytic activity and strong absorption in the full solar spectrum region [J]. Journal of Materials Chemistry A, 2016, 4: 9890-9899. doi: 10.1039/C6TA03181A [51] LIU T X, LI X Z, LI F B. Enhanced photocatalytic activity of Ce3+-TiO2 hydrosols in aqueous and gaseous phases [J]. Chemical Engineering Journal, 2010, 157: 475-482. doi: 10.1016/j.cej.2009.12.010 [52] WU M Y, LEUNG D Y C, ZHANG Y G, et al. Toluene degradation over Mn-TiO2/CeO2 composite catalyst under vacuum ultraviolet (VUV) irradiation [J]. Chemical Engineering Science, 2019, 195: 985-994. doi: 10.1016/j.ces.2018.10.044 [53] MUÑOZ-BATISTA M J, KUBACKA A, FONTELLES-CARCELLER O, et al. Surface CuO, Bi2O3, and CeO2 species supported in TiO2-anatase: study of interface effects in toluene photodegradation quantum efficiency [J]. ACS Applied Materials & Interfaces, 2016, 8(22): 13934-13945. [54] CAO X J, YANG X Y, LI H, et al. Investigation of Ce-TiO2 photocatalyst and its application in asphalt-based specimens for NO degradation [J]. Construction and Building Materials, 2017, 148: 824-832. doi: 10.1016/j.conbuildmat.2017.05.095 [55] ZHU W, XIAO S N, ZHANG D Q, et al. Highly efficient and stable Au/CeO2-TiO2 photocatalyst for nitric oxide abatement: potential application in flue gas treatment [J]. Langmuir, 2015, 31(39): 10822-10830. doi: 10.1021/acs.langmuir.5b02232 [56] TIAN N, HUANG H W, LIU C Y, et al. In situ co-pyrolysis fabrication of CeO2/g-C3N4 n–n type heterojunction for synchronously promoting photo-induced oxidation and reduction properties [J]. Journal of Materials Chemistry A, 2015, 3(33): 17120-17129. doi: 10.1039/C5TA03669K [57] YE T, HUANG W M, ZENG L M, et al. CeO2-x platelet from monometallic cerium layered double hydroxides and its photocatalytic reduction of CO2 [J]. Applied Catalysis B:Environmental, 2017, 210: 141-148. doi: 10.1016/j.apcatb.2017.03.051 [58] MATĔJOVÁ L, KOČÍ K, RELI M, et al. Preparation, characterization and photocatalytic properties of cerium doped TiO2: On the effect of Ce loading on the photocatalytic reduction of carbon dioxide [J]. Applied Catalysis B:Environmental, 2014, 152-153: 172-183. doi: 10.1016/j.apcatb.2014.01.015 [59] ZHAO Y X, CAI W, CHEN M D, et al. Turning the activity of Cr-Ce mixed oxide towards thermocatalytic NO oxidation and photocatalytic CO2 reduction via the formation of yolk shell structure hollow microspheres [J]. Journal of Alloys and Compounds, 2020, 829: 154508-154520. doi: 10.1016/j.jallcom.2020.154508 [60] ZHU C Z, WEI X Q, LI W Q, et al. Crystal-plane effects of CeO2 {110} and CeO2 {100} on photocatalytic CO2 reduction: synergistic interactions of oxygen defects and hydroxyl groups [J]. ACS Sustainable Chemistry & Engineering, 2020, 8(38): 14397-14406. [61] WANG M, SHEN M, JIN X X, et al. Mild generation of surface oxygen vacancies on CeO2 for improved CO2 photoreduction activity [J]. Nanoscale, 2020, 12: 12374-12382. doi: 10.1039/D0NR00717J [62] LI N X, ZOU X Y, LIU M, et al. Enhanced visible light photocatalytic hydrogenation of CO2 into methane over a Pd/Ce-TiO2 Nanocomposition [J]. Journal of Physical Chemistry C 2017, 121(46): 25795-25804. [63] PU Y, LUO Y D, WEI X Q, et al. Synergistic effects of Cu2O-decorated CeO2 on photocatalytic CO2 reduction: Surface Lewis acid/base and oxygen defect [J]. Applied Catalysis B:Environmental, 2019, 254: 580-586. doi: 10.1016/j.apcatb.2019.04.093 [64] COURBON H, PICHAT P. Room-temperature interaction of N18O with ultraviolet-illuminated titanium dioxide [J]. Journal of the Chemical Society, Faraday Transactions 1:Physical Chemistry in Condensed Phases, 1984, 80(11): 3175-3185. doi: 10.1039/f19848003175 [65] LIU H, ZHANG H R, YANG H M. Photocatalytic removal of nitric oxide by multi-walled carbon nanotubes‐supported TiO2 [J]. Chinese Journal of Catalysis, 2014, 35(1): 66-77. doi: 10.1016/S1872-2067(12)60705-0 [66] WANG J Y, HAN F M, RAO Y F, et al. Visible-light-driven nitrogen-doped carbon quantum dots/CaTiO3 composite catalyst with enhanced NO adsorption for NO removal [J]. Industrial & Engineering Chemistry Research, 2018, 57(31): 10226-10233. [67] DUAN Y Y, LUO J M, ZHOU S C, et al. TiO2-supported Ag nanoclusters with enhanced visible light activity for the photocatalytic removal of NO [J]. Applied Catalysis B:Environmental, 2018, 234: 206-212. doi: 10.1016/j.apcatb.2018.04.041 [68] WU Q P, van de KROL R. Selective photoreduction of nitric oxide to nitrogen by nanostructured TiO2 photocatalysts: role of oxygen vacancies and iron dopant [J]. Journal of the American Chemical Society, 2012, 134(22): 9369-9375. doi: 10.1021/ja302246b [69] YU Y, ZHONG Q, CAI W, et al. Promotional effect of N-doped CeO2 supported CoOx catalysts with enhanced catalytic activity on NO oxidation [J]. Journal of Molecular Catalysis A:Chemical, 2015, 398: 344-352. doi: 10.1016/j.molcata.2015.01.002 [70] ÂNGELO J, MAGALHÃES P, ANDRADE L, et al. Optimization of the NO photooxidation and the role of relative humidity [J]. Environmental Pollution, 2018, 240: 541-548. doi: 10.1016/j.envpol.2018.04.051 [71] RHATIGAN S, NOLAN M, CO2 and water activation on ceria nanocluster modified TiO2 rutile (110) [J]. Journal of Materials Chemistry A, 2018, 6: 9139-9152. [72] LI W Q, JIN L, GAO F, et al. Advantageous roles of phosphate decorated octahedral CeO2 {111}/g-C3N4 in boosting photocatalytic CO2 reduction: Charge transfer bridge and Lewis basic site [J]. Appl Catal B:Environ, 2021, 294: 120257. doi: 10.1016/j.apcatb.2021.120257 [73] PU Y, LI W Q, CAI Y D, et al. Effects of different treatment atmospheres on CeO2/g-C3N4 photocatalytic CO2 reduction: good or bad?[J]. Catal. Sci. Technol. , 2021, 11(8): 2827–2833. -




 下载:
下载: