-
抗生素是指用于预防或治疗人畜细菌感染产生的抗菌药物,是世界上用量最大、使用最广泛的药物之一[1]。在我国,年产抗生素原料达21万吨,使用量达18.9万吨,其中,兽用抗生素占使用量的一半以上[2]。抗生素种类众多,包括磺胺类、大环内酯类、喹诺酮类、四环素类等,其中四环素类抗生素(tetracycline antibiotics,TCs)因其价格低廉,广谱抗菌等特点,在世界各国的畜牧业中普遍使用。已有研究表明,水体[3-5]、土壤[6-7]、沉积物[8-10]等环境中均有TCs残留,且以土霉素、四环素、金霉素和强力霉素为主,残留的TCS通过食物链进入人体,从而对人体和环境产生潜在威胁[11]。
目前,土壤中抗生素的降解方法主要有理化方法和微生物降解方法两种,其中微生物降解技术因其成本低,效能高,不易产生二次污染等优势,成为众多学者的研究热点[12]。目前已筛选出的可降解四环素类抗生素降解菌属众多,但大都是降解某一种四环素类抗生素,如四环素降解菌[12-15],土霉素降解菌[16-18],金霉素降解菌[19],强力霉素降解菌[20]。翟辉[21]将筛选出的土霉素降解菌加入到污染土壤中,接入菌株的土壤中土霉素降解率比空白高30.63%;陈海宁[22]将前期筛选出的土霉素降解菌加入到污染土壤中表明,非灭菌实验组土壤中土霉素的降解率均高于空白组,土壤中菌株对土壤中土霉素的最佳降解时间为20 d。因此,研究同一菌株降解多种四环素类抗生素,修复多种四环素类抗生素污染土壤研究,减少四环素类抗生素对环境的污染和人体健康的潜在威胁,已成为研究的热点问题。
基于此,本研究从宁夏某制药厂TCS污水处理系统的活性污泥中筛选、分离出一株可同时降解土霉素、四环素、金霉素、强力霉素的高效耐药菌株TCs-2,通过形态观察、生理生化及16S rDNA分子序列分析等手段对菌株进行鉴定,研究pH、温度、降解时间对菌株TCs-2降解土霉素、四环素、金霉素、强力霉素的影响,并探究其在土壤修复过程的实际应用效果,旨在为菌株用于四环素类抗生素污染土壤环境修复提供一定的参考依据。
-
活性污泥采自宁夏某制药厂TCs污水处理系统。
-
无机盐培养基:5 g (NH4)2SO4、1 g KH2PO4、0.1 g MgSO4∙7H2O、15 mg EDTA、4.5 mg ZnSO4∙7H2O、4.5 mg CaCl2∙2H2O、3 mg FeSO4∙7H2O、 1 mg MnCl2∙4H2O、1 mg H3BO、0.4 mg Na2MoO4∙2H2O、0.3 mg CuSO4∙5H2O、0.3 mg CoCl2∙6H20和0.1 mg KI[23],1 L超纯水,于121 ℃、20 min高压灭菌后使用。
无机盐固体培养基:每L无机盐液体培养基加15—20 g琼脂,于121 ℃、20 min高压灭菌后使用。
牛肉膏蛋白胨培养基:10.0 g蛋白胨,3.0 g牛肉膏,5.0 gNaCl,1L超纯水,于121 ℃、30 min高压灭菌后使用。
牛肉膏蛋白胨固体培养基:每升牛肉膏蛋白胨液体培养基中加入15—20 g琼脂,于121 ℃、30 min高压灭菌,待冷却至50—60 ℃时,倒置平板。
-
称取1 g活性污泥加入到含土霉素、四环素、金霉素和强力霉素(以下简称TCs混合液)混合浓度为40 mg·L−1的液体培养基中,避光条件下震荡培养5 d;采用梯度压力驯化法,按 1%的接种量逐步转接至60、80、120 mg·L−1的抗生素混合液体培养基中,以5 d为1个驯化周期,持续培养。
取最终驯化的无机盐培养液以10−3—10−9的稀释倍数进行稀释,然后涂布在含TCs混合液40 mg·L−1的固体无机盐培养基中恒温培养,待长出肉眼菌落后,用平板划线法,在无菌条件下反复划线分离纯化。最后将得到的菌株斜面保存,实验备用。
-
菌悬液的制备:挑取纯化后的菌株,接种到牛肉膏蛋白胨液体培养基中,30 ℃、150 r·min−1恒温振荡避光培养24 h,取出牛肉膏蛋白胨液体培养基,将培养液分装于离心管中,室温条件下于4000 r·min−1离心10 min,收集湿菌体。然后用灭菌生理盐水(0.9%的NaCI溶液)轻轻润洗离心管3次,最后用生理盐水配制成OD600=1.0的菌悬液。
降解菌的筛选:将制备的菌悬液(OD600=1.0)接种到含四环素类抗生素浓度为60 mg·L−1的液体培养基中,避光培养5 d后,检测培养液中土霉素、四环素、金霉素、强力霉素的浓度,计算其降解率,降解能力最强的降解菌为最佳降解菌
菌株的鉴定:将筛选出的高效降解菌株交由生工生物工程(上海)股份有限公司测定菌株的16S rRNA序列,将检定结果在NCBI中进行Blast比对,获得相似性较高菌株,选取同源性高达100%的相关序列作为参考菌株序列,最后用MEGA-X软件中的Neighbor-Joining法构建系统发育树。同时,为确定筛选菌株的生理生化特性,进行菌落形态、细胞形态的观察以及生理生理生化试验(接触酶试验、甲基红试验、V-P测定试验、淀粉水解试验、反硝化试验、脲酶试验、吲哚试验等),其方法均参考《常见细菌系统鉴定手册》[24]和《伯杰氏细菌鉴定手册》[25]。
-
对1.3.2确定的最佳降解菌,研究 pH(5、 6、 7、 8、 9) 、温度(20、 25、 30、 35、 40 ℃) 、降解时间(3、7、12、15、21 d)对四环素类抗生素降解效果的影响。按接种量为5%,加入到含四环素类抗生素浓度为60 mg·L−1的液体培养基中,调节摇床转速为150 r·min−1恒温振荡避光培养5 d,测定培养液中土霉素、四环素、金霉素、强力霉素的降解率。每个处理设置3个平行样,1个空白样。
-
为研究降解菌TCs-2对土霉素、四环素、金霉素、强力霉素污染土壤修复能力,将一定浓度的TCs混合液分别加入到灭菌和未灭菌的土壤中,同时设置添加菌悬液与不添加菌悬液的空白对照组,然后将土样置于恒温培养箱中,以了解菌株TCs-2及土著微生物对污染土壤中土霉素、四环素、金霉素、强力霉素的修复效果。
(1)灭菌土与未灭菌土的制备
土壤采集宁夏某菜地0—20 cm的表层土,剔除土壤中根茎叶、碎石等杂物,于冷冻干燥机中进行干燥,然后过20目不锈钢筛,即为未灭菌土壤;将过筛后的土壤于高压灭菌锅121℃灭菌30 min,即为灭菌土壤。
(2)污染土壤制备
将四环素类抗生素溶液加入到灭菌土壤中,使土壤中土霉素、四环素、金霉素、强力霉素浓度均为50 mg·kg−1。充分搅拌土壤,使添加的抗生素在土壤中均匀分布。然后将土壤置于通风橱中,使溶剂完全挥发,即得灭菌污染土壤。未灭菌污染土壤制备方法同灭菌土壤制备方法相同。
各称取200 g灭菌污染土壤与未灭菌土壤置于500 mL灭菌烧杯中,按照菌液接种量5%(V:M)接种到灭菌烧杯中,同时均设置未接种菌液的空白对照组。加入灭菌蒸馏水,并用不同灭菌玻璃棒搅拌均匀,然后放入恒温培养箱中30℃培养,每隔12 h调节土壤含水量,使土壤含水量保持在10%—20%,分别在0、3、7、12、15、21 d取样分析土壤中土霉素、四环素、金霉素、强力霉素的降解率。以上每个处理均设置3个平行样。
-
(1)液体样品中TCs提取
准确量取200 mL无机盐溶液,过45 µm滤膜过滤,调节无机盐溶液在pH 4左右,加入Na2EDTA与氯霉素。在真空条件下,无机盐溶液通过预先用甲醇、超纯水及Mcllvaine缓冲液活化好的OasisHLB固相萃取柱(200 mg,6 mL),用6 mL超纯水淋洗小柱,在负压下抽20 min;最后用6 mL甲醇淋洗萃取柱,收集洗脱液,氮吹至近干,定容至1 mL,过0.22 μm滤膜,待测。
(2)土壤样品中TCs提取
准确称取5.00 g样品置于50 mL玻璃离心管中,加入10 mL提取液于样品中,涡旋混匀30 s。常温下超声15 min,在4500 r·min−1转速下离心15 min,收集上清液,按上述提取步骤重复3次,合并上清液,氮吹赶除有机溶剂后,用超纯水稀释上清液至200 mL。在真空条件下,将稀释后的溶液加入预先用甲醇、超纯水活化、pH=3的酸化水平衡好的SAX 柱(500 mg,6 mL)和 Oasis HLB(200 mg,6 mL)柱,接着用5%甲醇水淋洗小柱,在负压下抽20 min;最后用6 mL甲醇淋洗萃取柱,收集洗脱液,氮吹至近干,用含地美环素的流动相定容至1 mL,过有机系0.22 μm滤膜,待测。
-
采用高效液相色谱仪(AGILENT 1100),进行定性定量分析,色谱柱:Agilent C18(5 μm×4.6 mm×250 mm);色谱条件:紫外检测波长为270 nm;进样量20 μL;流速0.8 mL·min−1;柱温25 ℃;流动相甲醇:0.01 mol·L−1三氯乙酸:0.01 mol·L−1草酸:乙腈;梯度洗脱程序如表1。
-
为保证分析数据的可信度,对无机盐及土壤均做加标回收处理,样品中土霉素、四环素、金霉素、强力霉素的加标回收率为68.52%—90.64%,相对标准偏差为5.83%—12.50%,以3倍和10倍信噪比计算4种四环素类抗生素方法检出限为0.05—0.18μg·L−1。分别配置土霉素、四环素、金霉素、强力霉素标准曲线,浓度为1、10、50、100、250 μg·L−1,标准曲线R2均大于0.99,满足试验研究要求。
-
经过富集培养,分离得到6株可降解TCs的降解菌,分别命名为TCs-1、TCs-2、TCs-3、TCs-4、TCs-5、TCs-6。表2列出了6株降解菌在30 ℃、150 r·min−1恒温摇床中避光培养5d后,无机盐中土霉素、四环素、金霉素、强力霉素的降解情况。由表2可知,6株菌株对土霉素的降解率均在60%以上,降解效果明显;TCs-1、TCs-2对四环素的降解效果明显;TCs-2、TCs-3对金霉素的降解效果要高于其他菌株;TCs-2、TCs-3、TCs-4对强力霉素降解效果更好,综合6株菌株对土霉素、四环素、金霉素、强力霉素的降解效果,结果表明TCs-2对四环素类抗生素的降解效果最好,降解率为50.62%。因此,筛选出TCs-2为最佳降解菌,并对其做进一步的研究。
图1为菌株菌落形态。菌株在培养基上呈淡黄色、凸起、不透明、外缘平整、表面湿润,为革兰氏阴性菌。通过生理生化特征分析(表3),降解菌TCs-2接触酶、淀粉水解、吲哚实验为阳性,甲基红、V-P测定、反硝化和脲酶试验为阴性。
-
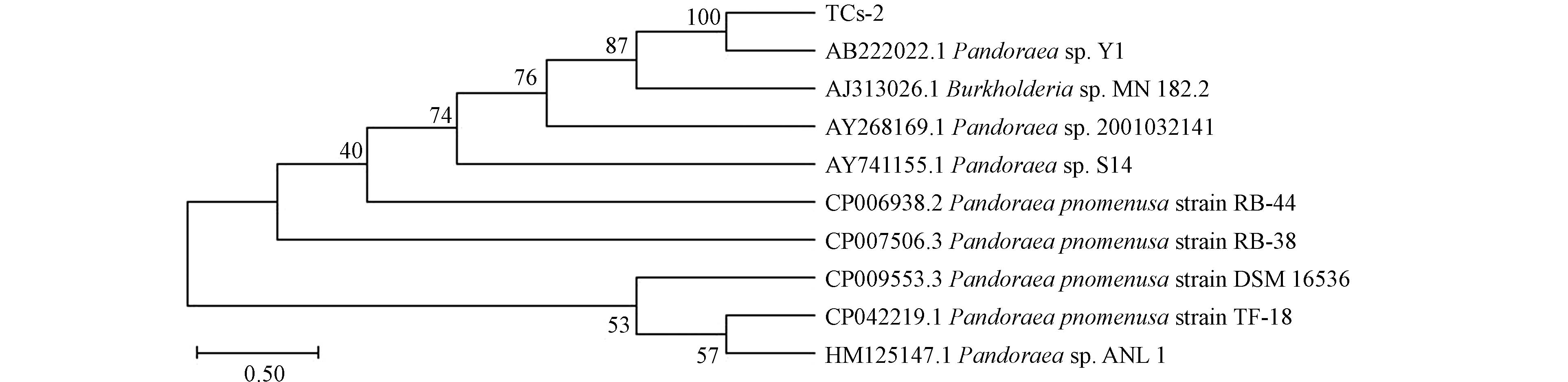
对降解菌TCs-2进行基因组DNA的提取,并完成16S rDNA基因测序,将得到的序列与GenBank中已存在的序列进行比对,并对未知降解菌TCs-2进行系统发育树的构建,结果如图2所示。16S rDNA与同源序列进行比对,降解菌TCs-2与Pandoraea sp.Y1同源性最近,序列相似性高达100%,将降解菌TCs-2所测序列结果提交到Gen Bank数据库,获得序列登录号为MT123006。
-
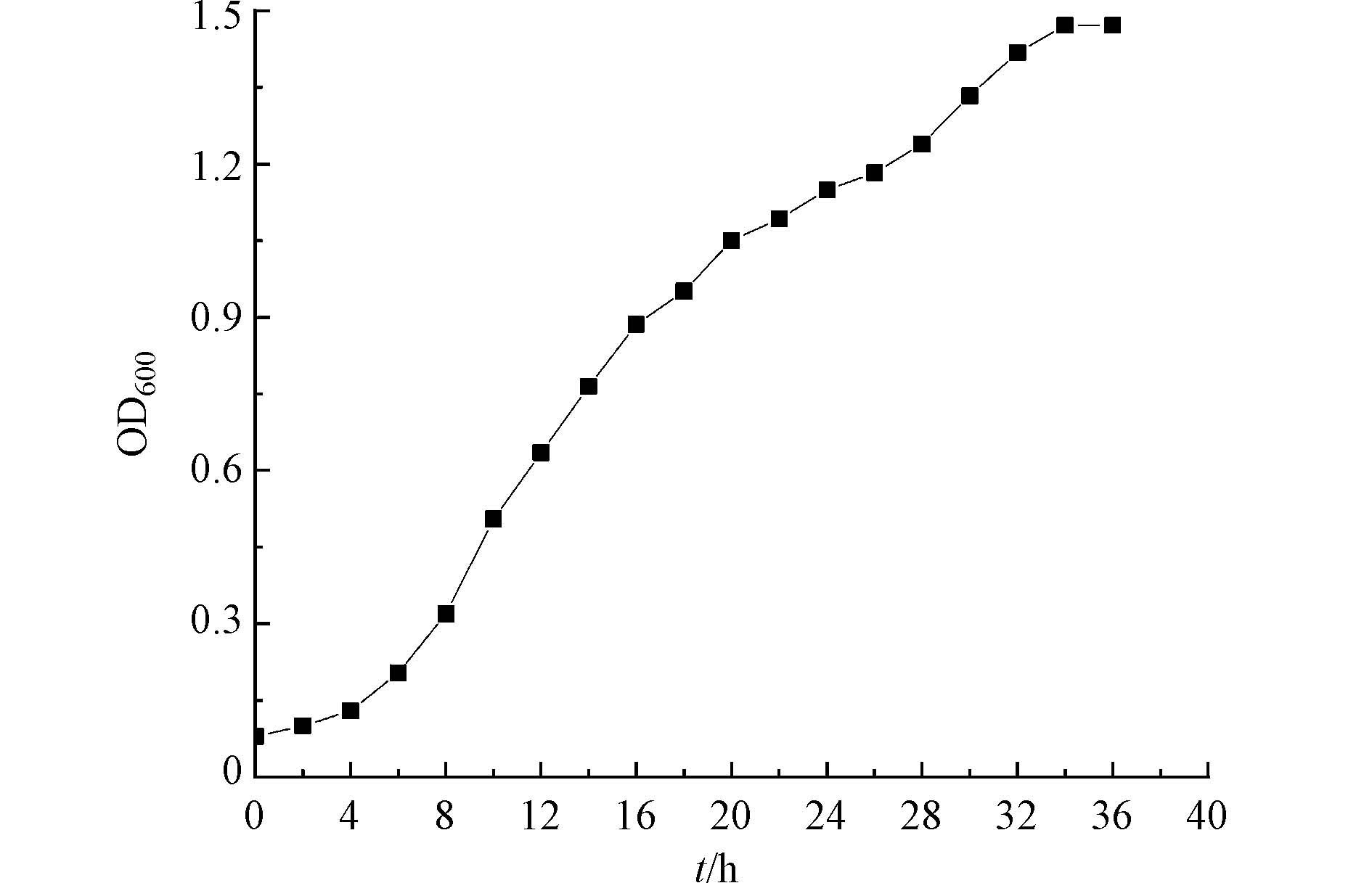
用浊度法测定菌株的生长曲线,以5%的接种量接种到牛肉膏蛋白胨培养基中,30 ℃、150 r·min−1恒温振荡避光培养,每隔2 h,在紫外分光光度计下测定OD600的值。结果如图3所示。TCs-2的OD600随时间变化呈“S”型,符合一般菌落的生长趋势。TCs-2在液体培养基中滞缓期约4 h,此期间是菌株对新环境的一个适应期,菌株生长繁殖较慢,菌液相对澄清,4—36 h为对数生长期,此时菌株适应新的环境,菌株生长繁殖较快,呈指数增长,菌液变得浑浊,经36 h达到稳定期,菌株生长繁殖达到最大值,生长曲线趋于平缓。通过菌株TCs-2的适应时间可以看出,此菌株适应时间相对较短,由此说明,菌株TCs-2的适应能力较强。
-
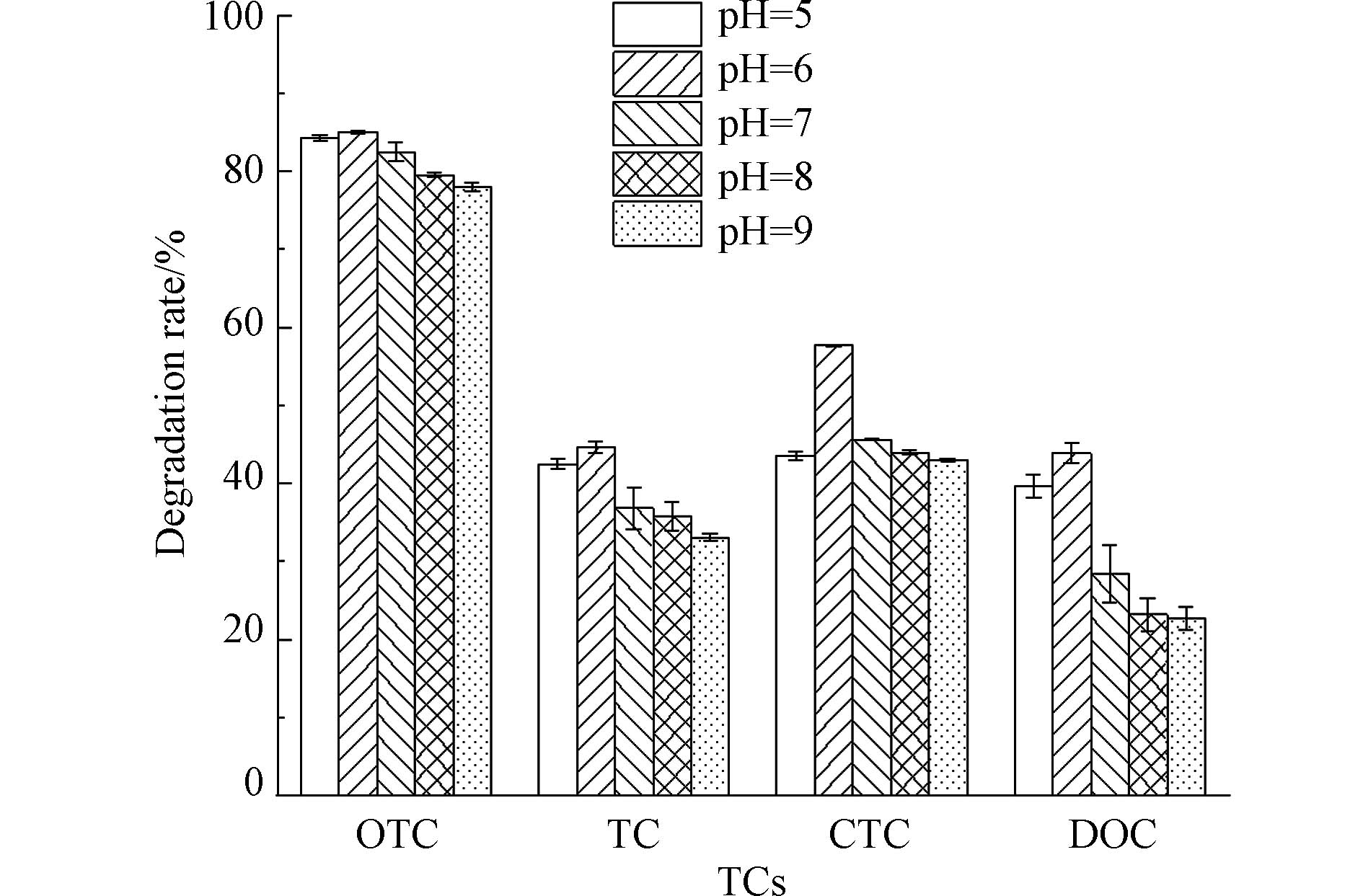
pH值通常通过影响微生物降解酶的活性,进而影响微生物对目标污染物的降解能力。图4显示了不同pH环境条件下,菌株TCs-2对土霉素、四环素、金霉素、强力霉素的降解能力的变化。由图4可知,在pH=5—9范围内,随着溶液中初始pH的增加,菌株TCs-2对土霉素、四环素、金霉素、强力霉素降解率均呈现先增加后降低的趋势,在pH=6时,降解率最高,对土霉素、四环素、金霉素、强力霉素分别为85.00%、44.58%、57.63%、43.86%。进一步分析发现,菌株TCs-2在中性偏酸性条件下(pH=5、6、7)降解率显著高于碱性条件,说明该菌株适应酸性环境四环素类抗生素的污染修复。
-
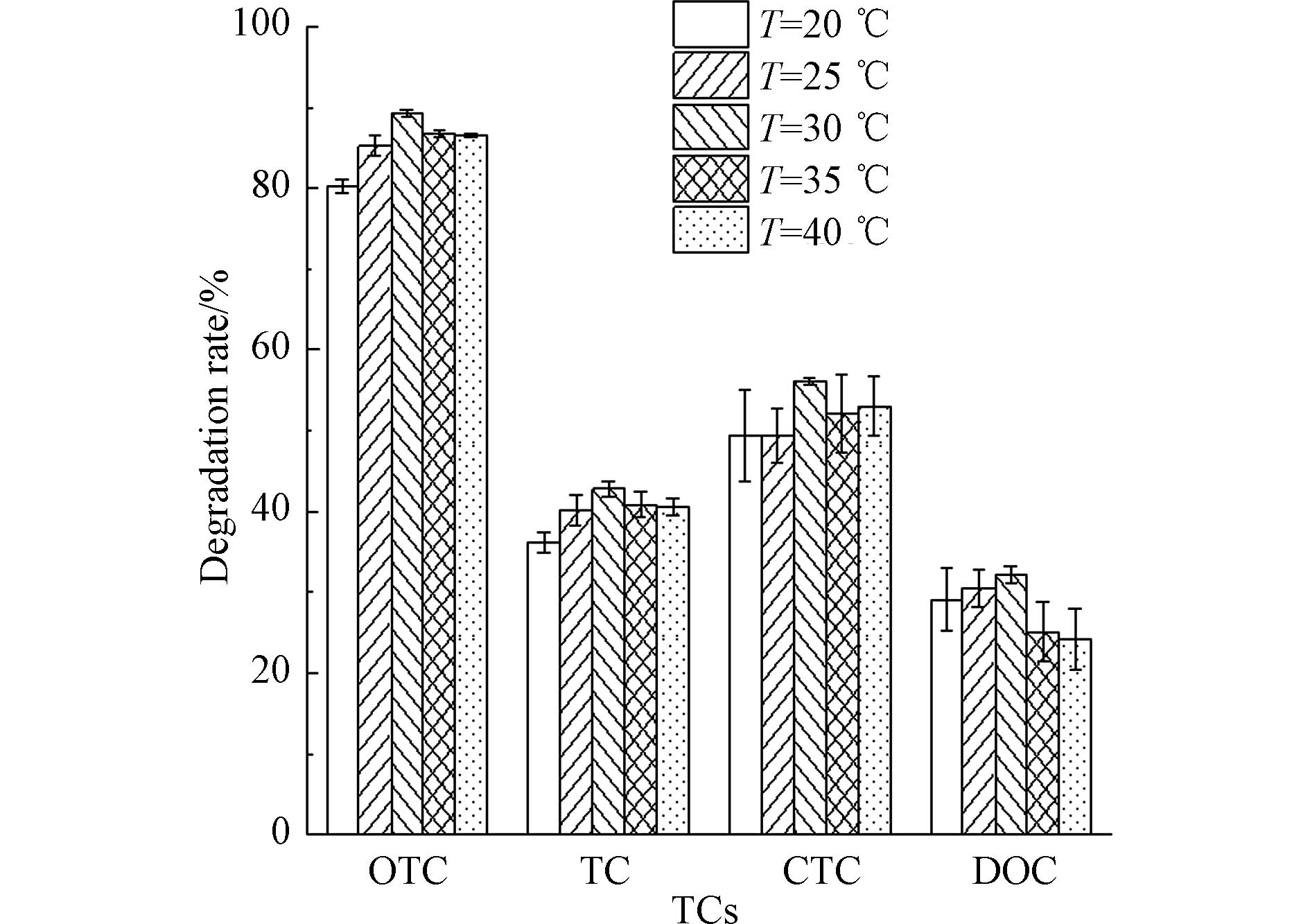
温度对菌株TCs-2降解土霉素、四环素、金霉素、强力霉素的影响如图5所示。在培养温度20—40 ℃范围内,菌株TCs-2对土霉素、四环素、金霉素、强力霉素降解率均呈现先增加后降低的趋势,最高降解率在T=30℃,对土霉素、四环素、金霉素、强力霉素降解率分别为89.39%、42.78%、56.10%、32.20%,造成这种现象的原因可能是温度过高或过低均会影响微生物降解酶的活性,继而影响其细胞生长速率和生化反应速率。
-
图6显示了降解时间对菌株TCs-2降解土霉素、四环素、金霉素、强力霉素的影响。由图6可知,随着降解时间的增加,土霉素、四环素、金霉素、强力霉素的降解率缓慢增加,降解时间对四环素类抗生素的降解效果影响并不明显,这可能是因为在3 d以前,菌株生长量已达到最大,在3 d以后,菌株处于生长的衰退期,以及四环素类抗生素的降解产物对菌株存在一定的抑制作用,导致菌株TCs-2降解四环素类抗生素效果处于稳定状态。在11 d时土霉素、四环素、金霉素、强力霉素的降解率分别可达87.62%、42.63%、47.30%、37.96%。
-
微生物降解是去除土壤中四环素类抗生素的主要方法之一,是微生物在特定的环境条件下产生的酶物质改变TCs化学结构使其失活的过程[26]。土霉素、四环素、金霉素及强力霉素在灭菌+菌悬液、未灭菌+菌悬液、灭菌+未加菌悬液及未灭菌+未加菌悬液土壤中的降解效果如图7所示。由图7可知,在其它因素一定的条件下,随着时间延长,土霉素、四环素、金霉素及强力霉素降解率均在不断增高,但不同种类的四环素类抗生素降解情况也存在一定的差异。
如图7(a)、(b)、(c)所示,当土壤中未加菌悬液时,未灭菌土壤中土霉素、四环素、金霉素的降解率高于灭菌土壤中土霉素、四环素、金霉素的降解率,这表明土壤中存在的土著微生物可降解土壤中微量的土霉素、四环素、金霉素。当土壤中加入菌悬液时,随着培养时间的增加,未灭菌与灭菌土壤中土霉素、四环素、金霉素降解率均呈现先增加后趋于平缓的趋势,21 d时未灭菌土壤中土霉素(70.50%)、四环素(56.38%)、金霉素(57.55%)的降解率高于灭菌土壤中土霉素(60.38%)、四环素(47.89%)、金霉素(55.29%)的降解率,这可能土著微生物与菌株TCs-2以协同方式加速了土壤中土霉素、四环素、金霉素的降解。但是,这均远高于未加菌悬液时未灭菌或灭菌土壤中21 d时土霉素、四环素、金霉素的降解率,由此说明,菌株TCs-2对土壤中土霉素、四环素、金霉素的污染具有较好的修复能力。
由图7(d)可以看出,土壤中强力霉素的降解情况与土霉素、四环素、金霉素存在一定的差异性。在不同时间,未加菌悬液的灭菌及未灭菌土壤中强力霉素的降解率几乎相同。除此以外,加菌悬液的灭菌土壤中强力霉素的降解率高于加菌悬液未灭菌土壤中强力霉素的降解率,这极有可能是土壤中本身存在的微生物抑制了菌株TCs-2对土壤中强力霉素的降解,21 d后,加菌悬液的灭菌土壤及未灭菌土壤中强力霉素C的降解率分别可达到31.15%及22.18%。这远远低于TCs-2对土壤中土霉素、四环素、金霉素的降解率,这是因为分离出的菌株往往对降解单一目标污染物具有良好的降解效果,而同时降解多种目标污染物时,降解能力一般会降低[27-29]。
总体来看,菌株TCs-2可有效去除土壤中残留的四环素类抗生素,菌株TCs-2可用于四环素类抗生素污染土壤中的微生物修复。
-
(1)从宁夏某生产TCs药厂的活性污泥中,筛选分离出6株可同时降解土霉素、四环素、金霉素、强力霉素的菌株,其中TCs-2的降解能力最为显著,根据TCs-2的形态、生理生化特征及16S r DNA鉴定,TCs-2属于潘多拉菌属,TCs-2对土霉素、四环素、金霉素、以及强力霉素的降解率分别为83.19%、39.96%、45.91%、33.43%。
(2)不同环境下,菌株TCs-2对四环素类抗生素的降解效果不同。TCs-2降解最佳为pH 6,对土霉素、四环素、金霉素、强力霉素分别为85.00%、44.58%、57.63%、43.86%、;最佳温度为30℃,对土霉素、四环素、金霉素、强力霉素降解率分别为89.39%、42.78%、56.10%、32.20%;在3 d以后,降解时间对菌株降解TCs影响效果并不明显,11 d时土霉素、四环素、金霉素、强力霉素的降解率分别可达87.62%、42.63%、47.30%、37.96%。
(3)TCs-2降解菌对污染土壤中四环素类抗生素具有较好的降解能力。无论是灭菌土壤还是未灭菌土壤中,加入菌悬液均可以加速土壤中TCs的降解,21 d后加入菌悬液的灭菌土壤中土霉素、四环素、金霉素、强力霉素降解率分别为60.38%、47.89%、55.29%、31.15%,加入菌悬液的未灭菌土壤中土霉素、四环素、金霉素、强力霉素降解率分别为70.50%、56.38%、57.55%、22.18%,均高于不加菌悬液土壤中土霉素、四环素、金霉素、强力霉素的降解率。
本实验研究结果对TCs污染的微生物修复具有重要意义,为同一菌株同时降解环境中的不同TCs提供了基础依据。
一株同时降解4种四环素类抗生素降解菌的筛选及降解特性
Screened and degradation characteristics of a four tetracycline antibiotics degrading bacterium
-
摘要: 选取土霉素、四环素、金霉素及强力霉素作为目标污染物,采用富集驯化法从宁夏回族自治区某药厂的活性污泥中筛选出一株可同时降解这4种四环素类抗生素的降解菌TCs-2。经形态、生理生化特征及16S rDNA分析,初步鉴定为潘多拉菌属(Pandoraea sp.),进而研究该菌株的生长曲线呈S型增长,最后通过单因素试验研究了不同环境(pH、温度、降解时间)对该菌株降解特性的影响,同时考察该菌株对人工污染土壤中四环素类抗生素的降解效果。结果表明,降解的最佳pH值为6,对土霉素、四环素、金霉素及强力霉素的降解率分别为85.00%、44.58、57.63%、43.87%;最佳温度为30℃,对土霉素、四环素、金霉素及强力霉素的降解率分别为89.39%、42.78%、56.10%、32.20%;降解时间对四环素类抗生素的降解效果影响较小,11 d时土霉素、四环素、金霉素及强力霉素的降解率分别可达87.62%、42.63%、47.30%、37.96%;人工污染土壤不投放菌株和投加菌株试验结果为,在不添加菌悬液的土壤中,21 d时未灭菌土壤中土霉素、四环素、金霉素及强力霉素的降解率高于灭菌土壤,土著微生物能降解土壤中微量的四环素类抗生素;在添加菌液的土壤中,21 d时未灭菌土壤中土霉素、四环素、金霉素及强力霉素的降解率分别为70.50%、56.38%、57.55%、22.18%,灭菌土壤中土霉素、四环素、金霉素及强力霉素的降解率分别为60.38%、47.89%、55.29%、31.15%,均高于不添加菌悬液未灭菌或灭菌土壤中土霉素、四环素、金霉素及强力霉素的降解率,菌株TCs-2对土壤中土霉素、四环素、金霉素及强力霉素的4种四环素类抗生素具有较为高效的降解能力。
-
关键词:
- 四环素类抗生素降解菌 /
- 降解特性 /
- 土壤修复
Abstract: Astrain, named TCs-2, capable of simultaneously oxytetracycline, tetracycline, chlortetracycline and doxycyclineand was isolated by culture enrichment method from activated sludge of pharmaceutical factory in Ningxia. Based on the morphology, physiological characteristic and 16S rDNA sequence analysis, TCs-2 was identified as Pandoraeasp. Furthermore, the growth curve of the strain showed an S-shaped growth. Finally, the influence of different environments (pH, temperature, degradation time) on the degradation characteristics of the strain was studied by single factor test, and the degradation effect of the strain on tetracycline antibiotics in artificially contaminated soil was also investigated. The results showed that the optimum degradation pH was 6, and the degradation rates of oxytetracycline, tetracycline, chlortetracycline and doxycycline were 85.00%, 44.58%, 57.63% and 43.87%, respectively. The optimum temperature was 30℃, and the degradation rates of oxytetracycline, tetracycline, chlortetracycline and doxycycline were 89.39%, 42.78%, 56.10% and 32.20%, respectively. The degradation rate of oxytetracycline, tetracycline, chlortetracycline and doxycycline were 87.62%, 42.63%, 47.30% and 37.96% after 11 days, respectively. The test results of artificially contaminated soil without and with strains were as follows: The degradation rate of oxytetracycline, tetracycline, chlortetracycline and doxycycline in the non-sterilized soil was higher than that of the sterilized soil at 21 d, and the indigenous microorganisms could degrade trace tetracycline antibiotics in the soil. When adding strain of soil, 21 d not sterilized soil degradation rate of oxytetracycline, tetracycline, chlortetracycline and doxycycline were 70.50%, 56.38%, 57.55%, 22.18%, sterilized soil degradation rate of oxytetracycline, tetracycline, chlortetracycline, and doxycycline were 60.38%, 47.89%, 55.29% and 31.15%, respectively, which were all higher than that of the soil without adding strains. Strains TCs-2 had high degradation of tetracycline, tetracycline, chlortetracycline and doxycycline in soil.-
Key words:
- TCs degrading bacteria /
- degradation characteristics /
- soil remediation
-
抗生素是指用于预防或治疗人畜细菌感染产生的抗菌药物,是世界上用量最大、使用最广泛的药物之一[1]。在我国,年产抗生素原料达21万吨,使用量达18.9万吨,其中,兽用抗生素占使用量的一半以上[2]。抗生素种类众多,包括磺胺类、大环内酯类、喹诺酮类、四环素类等,其中四环素类抗生素(tetracycline antibiotics,TCs)因其价格低廉,广谱抗菌等特点,在世界各国的畜牧业中普遍使用。已有研究表明,水体[3-5]、土壤[6-7]、沉积物[8-10]等环境中均有TCs残留,且以土霉素、四环素、金霉素和强力霉素为主,残留的TCS通过食物链进入人体,从而对人体和环境产生潜在威胁[11]。
目前,土壤中抗生素的降解方法主要有理化方法和微生物降解方法两种,其中微生物降解技术因其成本低,效能高,不易产生二次污染等优势,成为众多学者的研究热点[12]。目前已筛选出的可降解四环素类抗生素降解菌属众多,但大都是降解某一种四环素类抗生素,如四环素降解菌[12-15],土霉素降解菌[16-18],金霉素降解菌[19],强力霉素降解菌[20]。翟辉[21]将筛选出的土霉素降解菌加入到污染土壤中,接入菌株的土壤中土霉素降解率比空白高30.63%;陈海宁[22]将前期筛选出的土霉素降解菌加入到污染土壤中表明,非灭菌实验组土壤中土霉素的降解率均高于空白组,土壤中菌株对土壤中土霉素的最佳降解时间为20 d。因此,研究同一菌株降解多种四环素类抗生素,修复多种四环素类抗生素污染土壤研究,减少四环素类抗生素对环境的污染和人体健康的潜在威胁,已成为研究的热点问题。
基于此,本研究从宁夏某制药厂TCS污水处理系统的活性污泥中筛选、分离出一株可同时降解土霉素、四环素、金霉素、强力霉素的高效耐药菌株TCs-2,通过形态观察、生理生化及16S rDNA分子序列分析等手段对菌株进行鉴定,研究pH、温度、降解时间对菌株TCs-2降解土霉素、四环素、金霉素、强力霉素的影响,并探究其在土壤修复过程的实际应用效果,旨在为菌株用于四环素类抗生素污染土壤环境修复提供一定的参考依据。
1. 材料与方法(Materials and methods)
1.1 实验材料
活性污泥采自宁夏某制药厂TCs污水处理系统。
1.2 培养基的配置
无机盐培养基:5 g (NH4)2SO4、1 g KH2PO4、0.1 g MgSO4∙7H2O、15 mg EDTA、4.5 mg ZnSO4∙7H2O、4.5 mg CaCl2∙2H2O、3 mg FeSO4∙7H2O、 1 mg MnCl2∙4H2O、1 mg H3BO、0.4 mg Na2MoO4∙2H2O、0.3 mg CuSO4∙5H2O、0.3 mg CoCl2∙6H20和0.1 mg KI[23],1 L超纯水,于121 ℃、20 min高压灭菌后使用。
无机盐固体培养基:每L无机盐液体培养基加15—20 g琼脂,于121 ℃、20 min高压灭菌后使用。
牛肉膏蛋白胨培养基:10.0 g蛋白胨,3.0 g牛肉膏,5.0 gNaCl,1L超纯水,于121 ℃、30 min高压灭菌后使用。
牛肉膏蛋白胨固体培养基:每升牛肉膏蛋白胨液体培养基中加入15—20 g琼脂,于121 ℃、30 min高压灭菌,待冷却至50—60 ℃时,倒置平板。
1.3 实验方法
1.3.1 TCs降解菌的富集与纯化
称取1 g活性污泥加入到含土霉素、四环素、金霉素和强力霉素(以下简称TCs混合液)混合浓度为40 mg·L−1的液体培养基中,避光条件下震荡培养5 d;采用梯度压力驯化法,按 1%的接种量逐步转接至60、80、120 mg·L−1的抗生素混合液体培养基中,以5 d为1个驯化周期,持续培养。
取最终驯化的无机盐培养液以10−3—10−9的稀释倍数进行稀释,然后涂布在含TCs混合液40 mg·L−1的固体无机盐培养基中恒温培养,待长出肉眼菌落后,用平板划线法,在无菌条件下反复划线分离纯化。最后将得到的菌株斜面保存,实验备用。
1.3.2 最佳降解菌的筛选与鉴定
菌悬液的制备:挑取纯化后的菌株,接种到牛肉膏蛋白胨液体培养基中,30 ℃、150 r·min−1恒温振荡避光培养24 h,取出牛肉膏蛋白胨液体培养基,将培养液分装于离心管中,室温条件下于4000 r·min−1离心10 min,收集湿菌体。然后用灭菌生理盐水(0.9%的NaCI溶液)轻轻润洗离心管3次,最后用生理盐水配制成OD600=1.0的菌悬液。
降解菌的筛选:将制备的菌悬液(OD600=1.0)接种到含四环素类抗生素浓度为60 mg·L−1的液体培养基中,避光培养5 d后,检测培养液中土霉素、四环素、金霉素、强力霉素的浓度,计算其降解率,降解能力最强的降解菌为最佳降解菌
菌株的鉴定:将筛选出的高效降解菌株交由生工生物工程(上海)股份有限公司测定菌株的16S rRNA序列,将检定结果在NCBI中进行Blast比对,获得相似性较高菌株,选取同源性高达100%的相关序列作为参考菌株序列,最后用MEGA-X软件中的Neighbor-Joining法构建系统发育树。同时,为确定筛选菌株的生理生化特性,进行菌落形态、细胞形态的观察以及生理生理生化试验(接触酶试验、甲基红试验、V-P测定试验、淀粉水解试验、反硝化试验、脲酶试验、吲哚试验等),其方法均参考《常见细菌系统鉴定手册》[24]和《伯杰氏细菌鉴定手册》[25]。
1.3.3 环境条件对菌株TCs-2降解四环素类抗生素的影响
对1.3.2确定的最佳降解菌,研究 pH(5、 6、 7、 8、 9) 、温度(20、 25、 30、 35、 40 ℃) 、降解时间(3、7、12、15、21 d)对四环素类抗生素降解效果的影响。按接种量为5%,加入到含四环素类抗生素浓度为60 mg·L−1的液体培养基中,调节摇床转速为150 r·min−1恒温振荡避光培养5 d,测定培养液中土霉素、四环素、金霉素、强力霉素的降解率。每个处理设置3个平行样,1个空白样。
1.3.4 菌株TCs-2对四环素类抗生素污染土壤修复效果研究
为研究降解菌TCs-2对土霉素、四环素、金霉素、强力霉素污染土壤修复能力,将一定浓度的TCs混合液分别加入到灭菌和未灭菌的土壤中,同时设置添加菌悬液与不添加菌悬液的空白对照组,然后将土样置于恒温培养箱中,以了解菌株TCs-2及土著微生物对污染土壤中土霉素、四环素、金霉素、强力霉素的修复效果。
(1)灭菌土与未灭菌土的制备
土壤采集宁夏某菜地0—20 cm的表层土,剔除土壤中根茎叶、碎石等杂物,于冷冻干燥机中进行干燥,然后过20目不锈钢筛,即为未灭菌土壤;将过筛后的土壤于高压灭菌锅121℃灭菌30 min,即为灭菌土壤。
(2)污染土壤制备
将四环素类抗生素溶液加入到灭菌土壤中,使土壤中土霉素、四环素、金霉素、强力霉素浓度均为50 mg·kg−1。充分搅拌土壤,使添加的抗生素在土壤中均匀分布。然后将土壤置于通风橱中,使溶剂完全挥发,即得灭菌污染土壤。未灭菌污染土壤制备方法同灭菌土壤制备方法相同。
各称取200 g灭菌污染土壤与未灭菌土壤置于500 mL灭菌烧杯中,按照菌液接种量5%(V:M)接种到灭菌烧杯中,同时均设置未接种菌液的空白对照组。加入灭菌蒸馏水,并用不同灭菌玻璃棒搅拌均匀,然后放入恒温培养箱中30℃培养,每隔12 h调节土壤含水量,使土壤含水量保持在10%—20%,分别在0、3、7、12、15、21 d取样分析土壤中土霉素、四环素、金霉素、强力霉素的降解率。以上每个处理均设置3个平行样。
1.3.5 样品中TCs提取
(1)液体样品中TCs提取
准确量取200 mL无机盐溶液,过45 µm滤膜过滤,调节无机盐溶液在pH 4左右,加入Na2EDTA与氯霉素。在真空条件下,无机盐溶液通过预先用甲醇、超纯水及Mcllvaine缓冲液活化好的OasisHLB固相萃取柱(200 mg,6 mL),用6 mL超纯水淋洗小柱,在负压下抽20 min;最后用6 mL甲醇淋洗萃取柱,收集洗脱液,氮吹至近干,定容至1 mL,过0.22 μm滤膜,待测。
(2)土壤样品中TCs提取
准确称取5.00 g样品置于50 mL玻璃离心管中,加入10 mL提取液于样品中,涡旋混匀30 s。常温下超声15 min,在4500 r·min−1转速下离心15 min,收集上清液,按上述提取步骤重复3次,合并上清液,氮吹赶除有机溶剂后,用超纯水稀释上清液至200 mL。在真空条件下,将稀释后的溶液加入预先用甲醇、超纯水活化、pH=3的酸化水平衡好的SAX 柱(500 mg,6 mL)和 Oasis HLB(200 mg,6 mL)柱,接着用5%甲醇水淋洗小柱,在负压下抽20 min;最后用6 mL甲醇淋洗萃取柱,收集洗脱液,氮吹至近干,用含地美环素的流动相定容至1 mL,过有机系0.22 μm滤膜,待测。
1.3.6 测定条件
采用高效液相色谱仪(AGILENT 1100),进行定性定量分析,色谱柱:Agilent C18(5 μm×4.6 mm×250 mm);色谱条件:紫外检测波长为270 nm;进样量20 μL;流速0.8 mL·min−1;柱温25 ℃;流动相甲醇:0.01 mol·L−1三氯乙酸:0.01 mol·L−1草酸:乙腈;梯度洗脱程序如表1。
表 1 梯度洗脱程序Table 1. Gradient elution procedures时间/minTime 甲醇Methanol 0.01 mol·L−1三氯乙酸0.01mol·L−1 Trichloroacetic acid 0.01 mol·L−1草酸0.01mol·L−1 Oxalic acid 乙腈Acetonitrile 0 1% 20% 75% 4% 6 6% 20% 50% 24% 12 10% 20% 30% 40% 15.5 10% 20% 30% 40% 16 1% 20% 75% 4% 25 1% 20% 75% 4% 1.3.7 质量控制
为保证分析数据的可信度,对无机盐及土壤均做加标回收处理,样品中土霉素、四环素、金霉素、强力霉素的加标回收率为68.52%—90.64%,相对标准偏差为5.83%—12.50%,以3倍和10倍信噪比计算4种四环素类抗生素方法检出限为0.05—0.18μg·L−1。分别配置土霉素、四环素、金霉素、强力霉素标准曲线,浓度为1、10、50、100、250 μg·L−1,标准曲线R2均大于0.99,满足试验研究要求。
2. 结果与讨论(Results and discussion)
2.1 菌株的分离、筛选及生理生化鉴定
经过富集培养,分离得到6株可降解TCs的降解菌,分别命名为TCs-1、TCs-2、TCs-3、TCs-4、TCs-5、TCs-6。表2列出了6株降解菌在30 ℃、150 r·min−1恒温摇床中避光培养5d后,无机盐中土霉素、四环素、金霉素、强力霉素的降解情况。由表2可知,6株菌株对土霉素的降解率均在60%以上,降解效果明显;TCs-1、TCs-2对四环素的降解效果明显;TCs-2、TCs-3对金霉素的降解效果要高于其他菌株;TCs-2、TCs-3、TCs-4对强力霉素降解效果更好,综合6株菌株对土霉素、四环素、金霉素、强力霉素的降解效果,结果表明TCs-2对四环素类抗生素的降解效果最好,降解率为50.62%。因此,筛选出TCs-2为最佳降解菌,并对其做进一步的研究。
表 2 不同菌株的降解率Table 2. Degradation rate of different strains降解菌 Degradation bacteria 降解率/% Degradation rate 土霉素 Oxytetracycline 四环素 Tetracycline 金霉素 Chlortetracycline 强力霉素 Doxycycline TCs-1 91.64±0.06 41.01±0.03 30.02±0.01 9.38±0.02 TCs-2 83.19±0.04 39.96±0.01 45.91±0.04 33.43±0.01 TCs-3 68.07±0.05 20.48±0.08 50.74±0.06 34.47±0.01 TCs-4 61.22±0.04 15.10±0.01 35.83±0.04 32.00±0.02 TCs-5 82.97±0.03 30.10±0.01 20.43±0.07 4.23±0.04 TCs-6 68.37±0.11 25.06±0.03 37.93±0.10 2.45±0.02 注:降解率为平均数±标准差. Note: degradation rate is mean ± standard deviation. 图1为菌株菌落形态。菌株在培养基上呈淡黄色、凸起、不透明、外缘平整、表面湿润,为革兰氏阴性菌。通过生理生化特征分析(表3),降解菌TCs-2接触酶、淀粉水解、吲哚实验为阳性,甲基红、V-P测定、反硝化和脲酶试验为阴性。
表 3 菌株TCs-2的生理生化特征Table 3. Physiological and biochemical characteristics of TCs-2指标 Indicators 结果 Results 革兰氏染色 − 接触酶 + 甲基红 − V-P测定 − 淀粉水解 + 反硝化 − 脲酶 − 吲哚 + 注:“+”为阳性;“−”为阴性. Note: “+” is positive; “−” is negative. 2.2 TCs-2的16S rRNA分子鉴定
对降解菌TCs-2进行基因组DNA的提取,并完成16S rDNA基因测序,将得到的序列与GenBank中已存在的序列进行比对,并对未知降解菌TCs-2进行系统发育树的构建,结果如图2所示。16S rDNA与同源序列进行比对,降解菌TCs-2与Pandoraea sp.Y1同源性最近,序列相似性高达100%,将降解菌TCs-2所测序列结果提交到Gen Bank数据库,获得序列登录号为MT123006。
2.3 TCs-2生长曲线测定
用浊度法测定菌株的生长曲线,以5%的接种量接种到牛肉膏蛋白胨培养基中,30 ℃、150 r·min−1恒温振荡避光培养,每隔2 h,在紫外分光光度计下测定OD600的值。结果如图3所示。TCs-2的OD600随时间变化呈“S”型,符合一般菌落的生长趋势。TCs-2在液体培养基中滞缓期约4 h,此期间是菌株对新环境的一个适应期,菌株生长繁殖较慢,菌液相对澄清,4—36 h为对数生长期,此时菌株适应新的环境,菌株生长繁殖较快,呈指数增长,菌液变得浑浊,经36 h达到稳定期,菌株生长繁殖达到最大值,生长曲线趋于平缓。通过菌株TCs-2的适应时间可以看出,此菌株适应时间相对较短,由此说明,菌株TCs-2的适应能力较强。
2.4 环境条件对TCs-2降解四环素类抗生素的影响
2.4.1 初始pH对TCs-2降解四环素类抗生素的影响
pH值通常通过影响微生物降解酶的活性,进而影响微生物对目标污染物的降解能力。图4显示了不同pH环境条件下,菌株TCs-2对土霉素、四环素、金霉素、强力霉素的降解能力的变化。由图4可知,在pH=5—9范围内,随着溶液中初始pH的增加,菌株TCs-2对土霉素、四环素、金霉素、强力霉素降解率均呈现先增加后降低的趋势,在pH=6时,降解率最高,对土霉素、四环素、金霉素、强力霉素分别为85.00%、44.58%、57.63%、43.86%。进一步分析发现,菌株TCs-2在中性偏酸性条件下(pH=5、6、7)降解率显著高于碱性条件,说明该菌株适应酸性环境四环素类抗生素的污染修复。
2.4.2 温度对TCs-2降解四环素类抗生素的影响
温度对菌株TCs-2降解土霉素、四环素、金霉素、强力霉素的影响如图5所示。在培养温度20—40 ℃范围内,菌株TCs-2对土霉素、四环素、金霉素、强力霉素降解率均呈现先增加后降低的趋势,最高降解率在T=30℃,对土霉素、四环素、金霉素、强力霉素降解率分别为89.39%、42.78%、56.10%、32.20%,造成这种现象的原因可能是温度过高或过低均会影响微生物降解酶的活性,继而影响其细胞生长速率和生化反应速率。
2.4.3 降解时间对TCs-2降解四环素类抗生素的影响
图6显示了降解时间对菌株TCs-2降解土霉素、四环素、金霉素、强力霉素的影响。由图6可知,随着降解时间的增加,土霉素、四环素、金霉素、强力霉素的降解率缓慢增加,降解时间对四环素类抗生素的降解效果影响并不明显,这可能是因为在3 d以前,菌株生长量已达到最大,在3 d以后,菌株处于生长的衰退期,以及四环素类抗生素的降解产物对菌株存在一定的抑制作用,导致菌株TCs-2降解四环素类抗生素效果处于稳定状态。在11 d时土霉素、四环素、金霉素、强力霉素的降解率分别可达87.62%、42.63%、47.30%、37.96%。
2.5 菌株TCs-2对污染土壤的中四环素类抗生素的修复效果
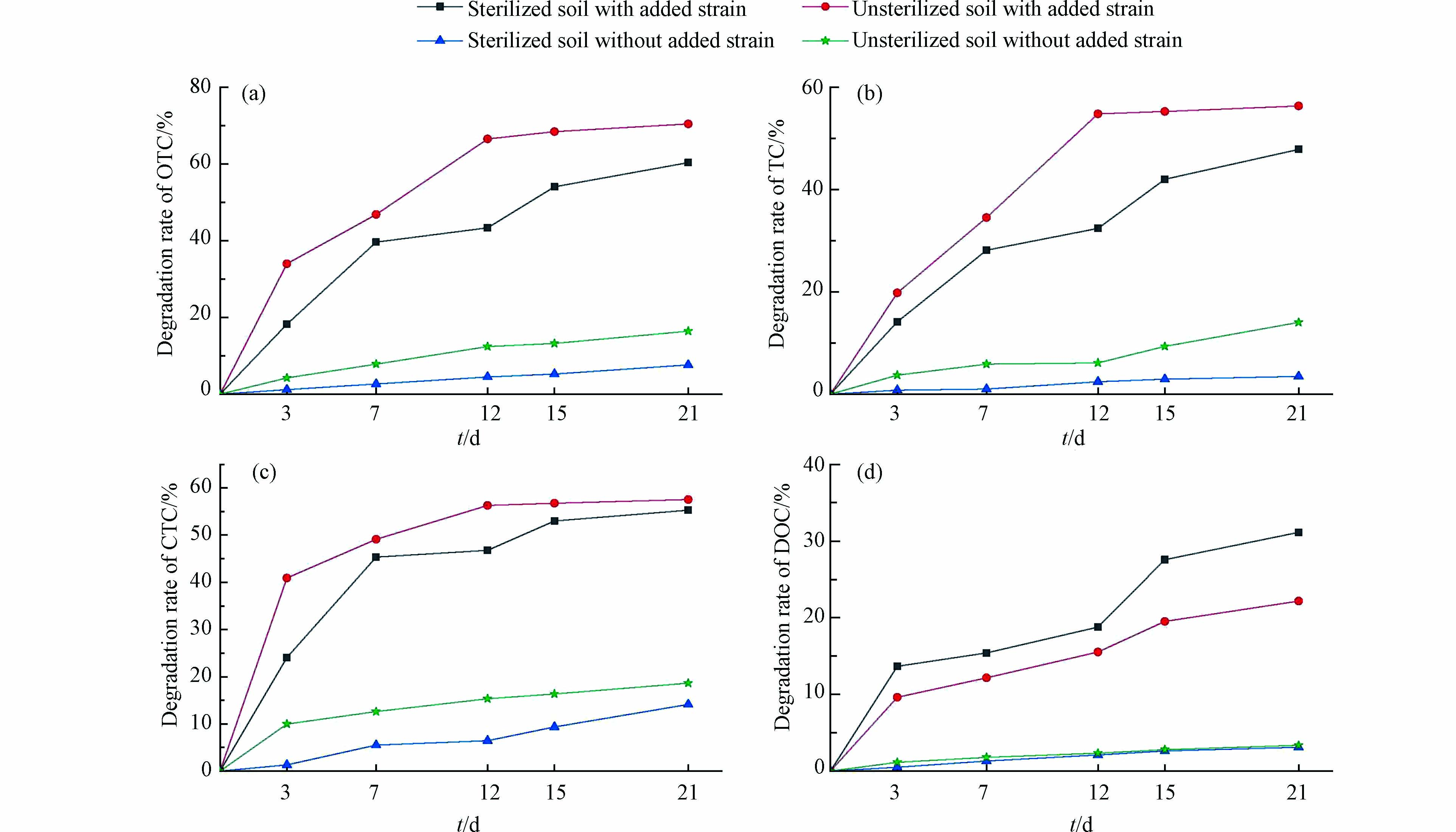
微生物降解是去除土壤中四环素类抗生素的主要方法之一,是微生物在特定的环境条件下产生的酶物质改变TCs化学结构使其失活的过程[26]。土霉素、四环素、金霉素及强力霉素在灭菌+菌悬液、未灭菌+菌悬液、灭菌+未加菌悬液及未灭菌+未加菌悬液土壤中的降解效果如图7所示。由图7可知,在其它因素一定的条件下,随着时间延长,土霉素、四环素、金霉素及强力霉素降解率均在不断增高,但不同种类的四环素类抗生素降解情况也存在一定的差异。
如图7(a)、(b)、(c)所示,当土壤中未加菌悬液时,未灭菌土壤中土霉素、四环素、金霉素的降解率高于灭菌土壤中土霉素、四环素、金霉素的降解率,这表明土壤中存在的土著微生物可降解土壤中微量的土霉素、四环素、金霉素。当土壤中加入菌悬液时,随着培养时间的增加,未灭菌与灭菌土壤中土霉素、四环素、金霉素降解率均呈现先增加后趋于平缓的趋势,21 d时未灭菌土壤中土霉素(70.50%)、四环素(56.38%)、金霉素(57.55%)的降解率高于灭菌土壤中土霉素(60.38%)、四环素(47.89%)、金霉素(55.29%)的降解率,这可能土著微生物与菌株TCs-2以协同方式加速了土壤中土霉素、四环素、金霉素的降解。但是,这均远高于未加菌悬液时未灭菌或灭菌土壤中21 d时土霉素、四环素、金霉素的降解率,由此说明,菌株TCs-2对土壤中土霉素、四环素、金霉素的污染具有较好的修复能力。
由图7(d)可以看出,土壤中强力霉素的降解情况与土霉素、四环素、金霉素存在一定的差异性。在不同时间,未加菌悬液的灭菌及未灭菌土壤中强力霉素的降解率几乎相同。除此以外,加菌悬液的灭菌土壤中强力霉素的降解率高于加菌悬液未灭菌土壤中强力霉素的降解率,这极有可能是土壤中本身存在的微生物抑制了菌株TCs-2对土壤中强力霉素的降解,21 d后,加菌悬液的灭菌土壤及未灭菌土壤中强力霉素C的降解率分别可达到31.15%及22.18%。这远远低于TCs-2对土壤中土霉素、四环素、金霉素的降解率,这是因为分离出的菌株往往对降解单一目标污染物具有良好的降解效果,而同时降解多种目标污染物时,降解能力一般会降低[27-29]。
总体来看,菌株TCs-2可有效去除土壤中残留的四环素类抗生素,菌株TCs-2可用于四环素类抗生素污染土壤中的微生物修复。
3. 结论(Conclusion)
(1)从宁夏某生产TCs药厂的活性污泥中,筛选分离出6株可同时降解土霉素、四环素、金霉素、强力霉素的菌株,其中TCs-2的降解能力最为显著,根据TCs-2的形态、生理生化特征及16S r DNA鉴定,TCs-2属于潘多拉菌属,TCs-2对土霉素、四环素、金霉素、以及强力霉素的降解率分别为83.19%、39.96%、45.91%、33.43%。
(2)不同环境下,菌株TCs-2对四环素类抗生素的降解效果不同。TCs-2降解最佳为pH 6,对土霉素、四环素、金霉素、强力霉素分别为85.00%、44.58%、57.63%、43.86%、;最佳温度为30℃,对土霉素、四环素、金霉素、强力霉素降解率分别为89.39%、42.78%、56.10%、32.20%;在3 d以后,降解时间对菌株降解TCs影响效果并不明显,11 d时土霉素、四环素、金霉素、强力霉素的降解率分别可达87.62%、42.63%、47.30%、37.96%。
(3)TCs-2降解菌对污染土壤中四环素类抗生素具有较好的降解能力。无论是灭菌土壤还是未灭菌土壤中,加入菌悬液均可以加速土壤中TCs的降解,21 d后加入菌悬液的灭菌土壤中土霉素、四环素、金霉素、强力霉素降解率分别为60.38%、47.89%、55.29%、31.15%,加入菌悬液的未灭菌土壤中土霉素、四环素、金霉素、强力霉素降解率分别为70.50%、56.38%、57.55%、22.18%,均高于不加菌悬液土壤中土霉素、四环素、金霉素、强力霉素的降解率。
本实验研究结果对TCs污染的微生物修复具有重要意义,为同一菌株同时降解环境中的不同TCs提供了基础依据。
-
表 1 梯度洗脱程序
Table 1. Gradient elution procedures
时间/minTime 甲醇Methanol 0.01 mol·L−1三氯乙酸0.01mol·L−1 Trichloroacetic acid 0.01 mol·L−1草酸0.01mol·L−1 Oxalic acid 乙腈Acetonitrile 0 1% 20% 75% 4% 6 6% 20% 50% 24% 12 10% 20% 30% 40% 15.5 10% 20% 30% 40% 16 1% 20% 75% 4% 25 1% 20% 75% 4% 表 2 不同菌株的降解率
Table 2. Degradation rate of different strains
降解菌 Degradation bacteria 降解率/% Degradation rate 土霉素 Oxytetracycline 四环素 Tetracycline 金霉素 Chlortetracycline 强力霉素 Doxycycline TCs-1 91.64±0.06 41.01±0.03 30.02±0.01 9.38±0.02 TCs-2 83.19±0.04 39.96±0.01 45.91±0.04 33.43±0.01 TCs-3 68.07±0.05 20.48±0.08 50.74±0.06 34.47±0.01 TCs-4 61.22±0.04 15.10±0.01 35.83±0.04 32.00±0.02 TCs-5 82.97±0.03 30.10±0.01 20.43±0.07 4.23±0.04 TCs-6 68.37±0.11 25.06±0.03 37.93±0.10 2.45±0.02 注:降解率为平均数±标准差. Note: degradation rate is mean ± standard deviation. 表 3 菌株TCs-2的生理生化特征
Table 3. Physiological and biochemical characteristics of TCs-2
指标 Indicators 结果 Results 革兰氏染色 − 接触酶 + 甲基红 − V-P测定 − 淀粉水解 + 反硝化 − 脲酶 − 吲哚 + 注:“+”为阳性;“−”为阴性. Note: “+” is positive; “−” is negative. -
[1] 张浩, 罗义, 周启星. 四环素类抗生素生态毒性研究进展 [J]. 农业环境科学学报, 2008, 27(2): 407-413. doi: 10.3321/j.issn:1672-2043.2008.02.001 ZHANG H, LUO Y, ZHOU Q X. Research advancement of eco-toxicity of tetracycline antibiotics [J]. Journal of Agro-Environment Science, 2008, 27(2): 407-413(in Chinese). doi: 10.3321/j.issn:1672-2043.2008.02.001
[2] ZHOU L J, YING G G, LIU S, et al. Occurrence and fate of eleven classes of antibiotics in two typical wastewater treatment plants in South China [J]. Science of the Total Environment, 2013, 452/453: 365-376. doi: 10.1016/j.scitotenv.2013.03.010 [3] LI S, SHI W Z, YOU M T, et al. Antibiotics in water and sediments of Danjiangkou Reservoir, China: Spatiotemporal distribution and indicator screening [J]. Environmental Pollution, 2019, 246: 435-442. doi: 10.1016/j.envpol.2018.12.038 [4] SUN J T, JIN L, HE T T, et al. Antibiotic resistance genes (ARGs) in agricultural soils from the Yangtze River Delta, China [J]. Science of the Total Environment, 2020, 740: 140001. doi: 10.1016/j.scitotenv.2020.140001 [5] LIU X H, LU S Y, MENG W, et al. Occurrence, source, and ecological risk of antibiotics in Dongting Lake, China [J]. Environmental Science and Pollution Research, 2018, 25(11): 11063-11073. doi: 10.1007/s11356-018-1290-1 [6] 苑学霞, 方丽萍, 张太平, 等. 不同年限设施菜地土壤中重金属和抗生素污染特征 [J]. 生态环境学报, 2020, 29(8): 1669-1674. YUAN X X, FANG L P, ZHANG T P, et al. Characteristics of heavy metals and antibiotics pollution in vegetable greenhouses after different cultivating years [J]. Ecology and Environmental Sciences, 2020, 29(8): 1669-1674(in Chinese).
[7] 李舒涵, 刘琛, 唐翔宇, 等. 果园生态养鸡鸡粪DOM的淋溶特征及其对抗生素迁移的影响 [J]. 农业工程学报, 2020, 36(14): 37-46. doi: 10.11975/j.issn.1002-6819.2020.14.005 LI S H, LIU C, TANG X Y, et al. Leaching characteristics of dissolved organic matter in chicken manure and its effect on antibiotic migration in orchard [J]. Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(14): 37-46(in Chinese). doi: 10.11975/j.issn.1002-6819.2020.14.005
[8] 吕凯, 刘晓薇, 邓呈逊, 等. SPE-RRLC-MS/MS测定河水和沉积物中14种典型抗生素 [J]. 环境化学, 2019, 38(11): 2415-2424. LYU K, LIU X W, DENG C X, et al. Determination of 14 antibiotics in water and sediment by SPE-RRLC-MS/MS [J]. Environmental Chemistry, 2019, 38(11): 2415-2424(in Chinese).
[9] 朱晓萌, 代彬彬, 严亚. 城市河道沉积物中残留医用抗生素对反硝化潜势的抑制作用及机制 [J]. 环境科学学报, 2019, 39(11): 3877-3887. ZHU X M, DAI B B, YAN Y. The inhibition effects of residual antibiotics on denitrification in the urban river sediments [J]. Acta Scientiae Circumstantiae, 2019, 39(11): 3877-3887(in Chinese).
[10] 胡宇玉, 沈丹蕾, 罗帅, 等. 两种不同抗生素在沉积物中吸附的影响因素与模拟研究 [J]. 环境化学, 2019, 38(7): 1570-1581. doi: 10.7524/j.issn.0254-6108.2018091603 HU Y Y, SHEN D L, LUO S, et al. Influencing factors and simulation of adsorption of two different antibiotics in sediments [J]. Environmental Chemistry, 2019, 38(7): 1570-1581(in Chinese). doi: 10.7524/j.issn.0254-6108.2018091603
[11] 周启星, 罗义, 王美娥. 抗生素的环境残留、生态毒性及抗性基因污染 [J]. 生态毒理学报, 2007, 2(3): 243-251. ZHOU Q X, LUO Y, WANG M E. Environmental residues and ecotoxicity of antibiotics and their resistance gene pollution: A review [J]. Asian Journal of Ecotoxicology, 2007, 2(3): 243-251(in Chinese).
[12] MAKI T, HASEGAWA H, KITAMI H, et al. Bacterial degradation of antibiotic residues in marine fish farm sediments of Uranouchi Bay and phylogenetic analysis of antibiotic-degrading bacteria using 16S rDNA sequences [J]. Fisheries Science, 2006, 72(4): 811-820. doi: 10.1111/j.1444-2906.2006.01222.x [13] 陶美, 贺玉龙, 王林, 等. 四环素降解菌的筛选及其降解特性 [J]. 应用与环境生物学报, 2018, 24(2): 384-389. TAO M, HE Y L, WANG L, et al. Screening and degradation characteristics of a tetracycline-degrading bacterial strain [J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(2): 384-389(in Chinese).
[14] 张欣阳, 蔡婷静, 许旭萍. 一株高效四环素降解菌的分离鉴定及其降解性能研究 [J]. 生物技术通报, 2015, 31(1): 173-180. ZHANG X Y, CAI T J, XU X P. Isolation and identification of A tetracycline-degrading bacterium and optimizing condition for tetracycline degradation [J]. Biotechnology Bulletin, 2015, 31(1): 173-180(in Chinese).
[15] 吴学玲, 吴晓燕, 李交昆, 等. 一株四环素高效降解菌的分离及降解特性 [J]. 生物技术通报, 2018, 34(5): 172-178. WU X L, WU X Y, LI J K, et al. Isolation and degradation characteristics of a efficient tetracycline-degrading strain [J]. Biotechnology Bulletin, 2018, 34(5): 172-178(in Chinese).
[16] 王强锋, 朱彭玲, 夏中梅, 等. 三种农用抗生素降解真菌的筛选及其降解性能 [J]. 农业资源与环境学报, 2018, 35(6): 533-539. WANG Q F, ZHU P L, XIA Z M, et al. Screening and degradation properties of three kinds of agricultural antibiotics degrading fungi [J]. Journal of Agricultural Resources and Environment, 2018, 35(6): 533-539(in Chinese).
[17] 于浩, 李晔, 程全国. 土霉素降解菌的筛选及其降解条件优化 [J]. 沈阳大学学报(自然科学版), 2017, 29(1): 21-25. YU H, LI Y, CHENG Q G. Screening and optimization of degradation condition of oxytetracycline degrading bacteria [J]. Journal of Shenyang University (Natural Science), 2017, 29(1): 21-25(in Chinese).
[18] 史艳可. 土霉素高效降解菌OTC-16的降解特性及耐药性初探[D]. 杭州: 浙江农林大学, 2019. SHI Y K. Preliminary study on degradation characteristics and drug resistance mechanism of oxytetracycline-degrading strain OTC-16[D]. Hangzhou: Zhejiang A & F University, 2019(in Chinese).
[19] 张惠艳. 金霉素降解菌株特性及代谢产物研究[D]. 北京: 北京理工大学, 2015. ZHANG H Y. Study of degradation characteristics of microorganism strains and main degradation products for chlortetracycline[D]. Beijing: Beijing Institute of Technology, 2015(in Chinese).
[20] 杨振边. 强力霉素降解菌在蛋鸡粪堆肥中的应用效果[D]. 广州: 华南农业大学, 2016. YANG Z B. The applied effects of doxycycline-degrading-bacteria on the composting of laying-hens manure[D]. Guangzhou: South China Agricultural University, 2016(in Chinese).
[21] 翟辉. 土霉素降解菌的筛选、鉴定及其在污染土壤中的修复模拟[D]. 杨凌: 西北农林科技大学, 2016. ZHAI H. Isolation and identificationof oxytetracycline-degrading strain and its use in bioremediation simulation of contaminated soil[D]. Yangling, : Northwest A & F University, 2016(in Chinese).
[22] 陈海宁. 土霉素高效降解菌降解特性比较及土壤环境模拟试验[D]. 扬州: 扬州大学, 2010. CHEN H N. Comparison of degrading characters of oxytetracycline degrading bacteria and soil environmental simulation test[D]. Yangzhou: Yangzhou University, 2010(in Chinese).
[23] DANTAS G, SOMMER M O A, OLUWASEGUN R D, et al. Bacteria subsisting on antibiotics [J]. Science, 2008, 320(5872): 100-103. doi: 10.1126/science.1155157 [24] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. DONG X Z, CAI M Y. Manual for identification of common bacterial systems[M]. Beijing: Science Press, 2001(in Chinese).
[25] BUCHANAN R E, BERGEY N E. Bergey’s manual of determinative bacteriology, 9th edition[M]. Baltimore: Williams and Wilkins Company, 1994. [26] JOSHI M M, BROWN H M, ROMESSER J A. Degradation of chlorsulfuron by soil microorganisms [J]. Weed Science, 1985, 33(6): 888-893. doi: 10.1017/S0043174500083557 [27] 王静松, 姚一凡. 四环素类抗生素在环境中的迁移转化 [J]. 山东化工, 2020, 49(15): 240-241,247. doi: 10.3969/j.issn.1008-021X.2020.15.105 WANG J S, YAO Y F. Migration and transformation of tetracycline antibiotics in environment [J]. Shandong Chemical Industry, 2020, 49(15): 240-241,247(in Chinese). doi: 10.3969/j.issn.1008-021X.2020.15.105
[28] 秦莉, 高茹英, 徐亚平, 等. 堆肥中高效降解纤维素及金霉素和土霉素的复合菌系的构建 [J]. 农业环境科学学报, 2014, 33(3): 465-470. doi: 10.11654/jaes.2014.03.009 QIN L, GAO R Y, XU Y P, et al. Construction of a high-efficiency complex microbial system to degrade cellulose and chlortetracycline and oxytetracycline in compost [J]. Journal of Agro-Environment Science, 2014, 33(3): 465-470(in Chinese). doi: 10.11654/jaes.2014.03.009
[29] HAMSCHER G, SCZESNY S, HÖPER H, et al. Determination of persistent tetracycline residues in soil fertilized with liquid manure by high-performance liquid chromatography with electrospray ionization tandem mass spectrometry [J]. Analytical Chemistry, 2002, 74(7): 1509-1518. doi: 10.1021/ac015588m -




 DownLoad:
DownLoad: