-
我国能源消费以煤炭为主,约占能源消费总量的60%[1]。研究表明,开采活动加快地下水流速,使水文地球化学作用发生改变,导致矿区地下水环境发生巨大变化[2-6]。Galhardi等[7]对巴西菲盖拉市煤矿研究发现,煤矿开采产生的酸性矿山废水影响该区地下和地表水环境。Raj等[8]对煤矿区土壤重金属污染的研究发现,煤炭开采及运输使周边土壤中Hg、Pb、Mn等重金属的浓度严重超标。随着我国能源基地建设的推进,大型煤矿开发建设数量与日俱增,对土壤及地下水环境造成了不同形式的生态影响与环境污染[9]。我国山西、内蒙等众多地区存在土壤与地下水的铁锰离子污染问题,矿区产生的一系列社会经济与生态环境问题亟待解决,矿区土壤与地下水的修复问题一直是环境工程领域的热点问题。
微生物对外界环境变化灵敏,监测微生物在采矿阶段的规律,对微生物修复技术应用于污染矿区环境治理有重要作用[10]。Ma等[11]通过测序技术分析煤矿废水处理厂的微生物群落特征,利用废水中的微生物群落进行废水的管理。Emenike等[12]发现利用微生物的自然修复能够有效降低重金属离子毒性,使破坏的矿区土地恢复利用。吴海维等[13]通过培养耐铅菌株,发现菌株对铅污染土壤的去除机理包括表面吸附和胞内累积或转化2种形式,对污染土壤中铅离子的去除效率极高。Evanise等[14]借助镉污水污泥中提取的微生物处理镉重金属污染土壤,通过将其固化来解决镉污染土壤修复问题。Cabral等[15]发现假单胞菌能够将甲基汞分解为毒性更低的Hg2+。Malik等[16]发现煤矿中分离出的微生物具有出色的煤炭增溶潜力,它们能够成功用于原位甲烷生产,以满足未来的能源需求。大多数学者致力于研究矿区复垦土壤的微生物特征变化和土壤微生物对矿区重金属浓度的响应,研究矿区开采状态下矿区微生物的空间分布特征和特征金属污染离子之间的关联性研究较少。
本文通过16S rDNA和PCR-DGGE分子生物学技术研究伊敏矿区煤层、地下水、土壤体系中微生物的垂向分布规律和伊敏矿区、生活区、核心采矿区域微生物的横向分布规律,全面探索煤矿开采对矿区土壤与地下水中的微生物尤其是对铁锰微生物的影响,进一步探究铁锰细菌与铁锰元素分布的空间响应关系;再通过为期两个月铁锰溶液对矿区土壤及煤层的淋溶实验,研究矿区中铁锰微生物的种属及其变化规律,以及优势菌株空间分异规律,为更好地发挥微生物在矿区铁锰污染环境中的净化作用,同时为矿区铁锰污染地下水、土壤修复技术和微生物原位修复技术大应用提供参考。
-
研究区伊敏煤矿位于伊敏河中游的伊敏乡境内,海拉尔盆地东部,是典型的草原区煤田,煤矿露天区呈半封闭型的盆地。区内地下水来源主要为春汛冰雪融水和大气降水,地下水的补给时间为每年4月中下旬和6—9月份,区内地形平坦,地表径流差,大气降水和冰雪融化水易积聚,垂直渗入第四系地层,再进一步越流补给煤系各含水层。该区气候类型为中温带大陆性气候。伊敏煤矿采取露天开采方式,产物为优质褐煤,以自移式半连续综合开采工艺为主。露天开采破坏了采场范围内原有的含水层和隔水层,大幅度降低了地下水位,采场内由于基岩裸露,使流入坑内的水体遭到污染,大量含有固体悬浮物及有害杂质的矿坑水被排放,也给周围水系和土壤造成了污染。
-
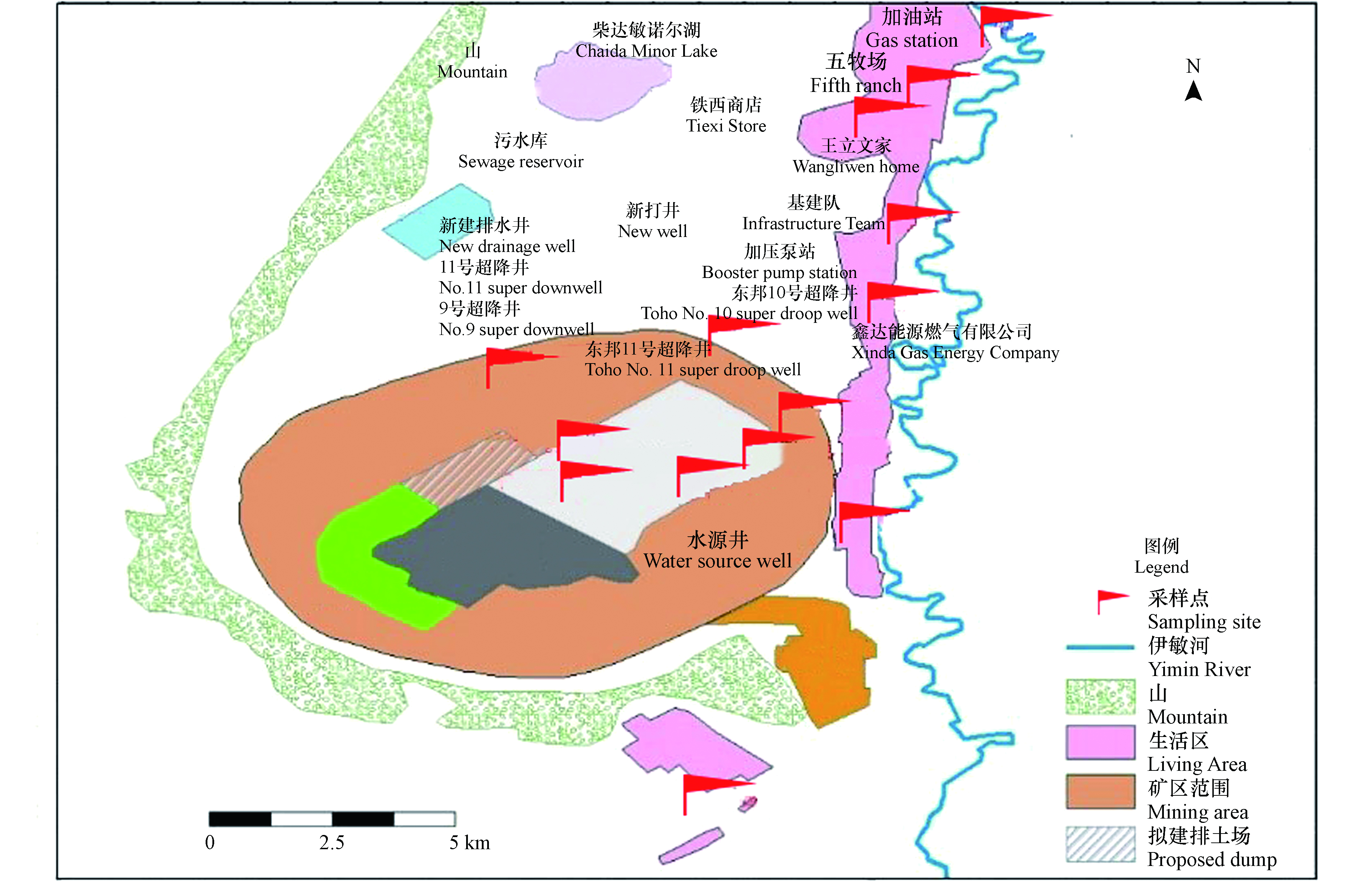
采样范围为整个伊敏露天矿区及其周边地区,样品采集在2017年10月份进行。具体采样点位如图1和表1所示。
地下水采样围绕伊敏露天矿采坑,沿着地下水走势,采用均匀布点法。每个采样点采集50 mL地下水样品,存放于已处理的聚乙烯瓶内,在采样前用待测水样将瓶润洗3遍。采集后的地下水样品立即送至北京市博友顺生物科技有限公司进行微生物菌种鉴定。土壤和煤矿样品采取使用分点采集后混匀的方法。土壤样品和煤矿样品的稳定性较好,采集后用干净纸箱储存,常温条件下保存。分别从3份土壤样品和2份煤矿样品中取50 g样品,送至北京市博友顺生物科技有限公司进行微生物菌种鉴定。其余土壤和煤矿样品用于实验室内控制驯化实验。用于微生物鉴定的样品每个样品3个重复。
-
采用CTAB手提法提取样品基因组DNA。以样品基因组DNA为模板,采用细菌引物GC-357F和517R扩增水样16S rDNA高变区序列;引物GC-338F和518R扩增土壤和煤层样品;引物GC-27F和1492R扩增驯化铁锰细菌。PCR条件为:94 ℃预变性5 min;94 ℃变性1 min,55 ℃复性1 min,72 ℃延伸1 min,30个循环;最终72 ℃延伸10 min。PCR产物采用OMEGA公司DNA Gel Extraction Kit纯化回收。PCR仪为Biometra公司生产的T-gradient,凝胶成像仪为Bio-Rad公司的Gel-Doc2000凝胶成像系统。取10 μLPCR的产物进行变性梯度凝胶电泳(DGGE)分析。采用变性梯度为35%—55%、浓度为7%的聚丙烯酰胺凝胶在1×TAE缓冲液中56 V 60 ℃下电泳14 h。用灭菌的手术刀切下待回收DGGE条带,水样采用使用TaKaRa MiniBEST DNA Fragment Purification Kit进行目的条带的回收;土壤和煤样采用OMEGA公司Poly-Gel DNA Extraction Kit回收目的条带。将重新扩增的DNA片段切胶回收、纯化后,筛选阳性克隆,进行序列测定。
-
根据电泳图谱中样品条带数目及每个条带的强度(灰度),对各样品中细菌多样性香农指数(H)、均匀度(E)和丰富度(S)等指标进行分析。DGGE图谱采用Quantity one软件对每个样品的电泳条带数目、条带密度进行数字化分析。其算法如下:
式中,pi为样品中单一条带的强度在该样品所有条带总强度中所占的比率,N为DGGE图谱单一泳道上所有条带的丰度,Ni为第i条带的丰度;S是某样品中所有条带数目总和。测序结果采用DNAstar和Cluster软件进行序列分析,与GenBank中的序列进行比对,得到条带所代表的细菌类型。每个条带选取3个克隆进行序列测定,然后采用MEGA软件,Neighbor-joining法构建系统发育树,自展数(bootstrap)为1000。
-
分子学鉴定技术的鉴定结果会因测序序列的人为选择具有主观性而造成部分菌株鉴定结果的丢失,为了进一步探究样品中所含的铁锰细菌,本研究设置了室内驯化实验。(1)铁细菌和锰细菌的驯化:取4个灭菌烧杯(编号1、2、3、4),1和3号烧杯分别放入100 g土壤样品,2和4号烧杯分别放入100 g煤矿样品(土壤样品和煤矿样品均经过原始样品的混匀后随机挑选所得)。使用浓度为10 mg·L−1的铁离子溶液和锰离子溶液进行驯化,具体操作为:用无菌吸管吸取5 mL铁离子溶液浇灌1和2烧杯,5 mL锰离子溶液浇灌3和4烧杯,30 ℃恒温培养箱中培养24 h后,向4个烧杯中添加5 mL细菌培养液(牛肉膏蛋白胨液体培养基),继续在30 ℃恒温培养箱中培养,重复上述操作,驯化2个月后进行铁锰细菌的筛选。实验操作均在超净工作台上完成。(2)筛选:配制铁细菌培养基和锰细菌培养基,将1、2烧杯中的铁细菌驯化液和3、4烧杯中的锰细菌驯化液均稀释10倍,各取稀释后的驯化液0.5 mL于灭菌铁平板培养基和锰平板培养基中,每组平行3支,并设置空白组,30 ℃条件下培养3 d;3 d后取出在超净工作台上挑选每种菌于空白的铁细菌或锰细菌培养基上纯化培养,每组平行3支并设置空白对照组,置于30 ℃恒温培养箱中培养3 d;3 d后每种菌挑选3个平板,送至北京市博友顺生物科技有限公司进行菌种鉴定。培养基配置方法如表2所示。
-
本次分析的地下水样在空间分布上以采矿区为中心由近及远,包括核心采矿区域、矿区边界和生活区,围绕伊敏露天矿采坑,沿着地下水走势,可用分析得到其空间分布规律,结合水质数据可进一步分析其关联性。
-
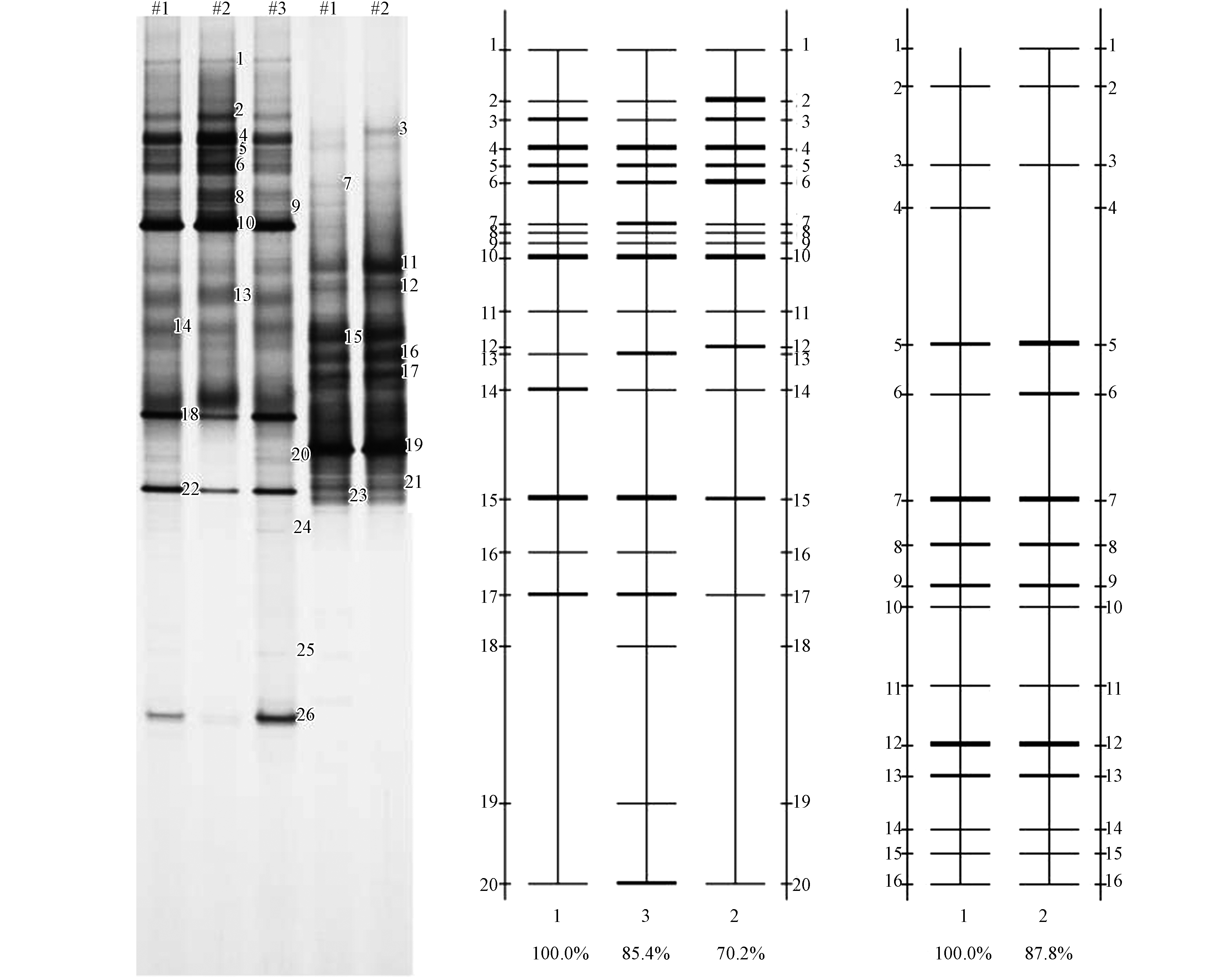
水样通过16S rDNA PCR产物的变性梯度凝胶电泳(DGGE)分析,得到3个水样中细菌的DGGE图谱如图2所示。
同时根据电泳图谱样品中的条带数目及每个条带的强度,对每个样品的香浓指数(H)、均匀度(E)、丰富度(S)等指标进行分析,并通过样品的戴斯系数比较样品的相似性,结果如表3所示。对地下水样品中每个DGGE凝胶回收条带选取3个克隆样进行序列测定,测序结果与Genbank中的序列进行对比,结果如表4所示。
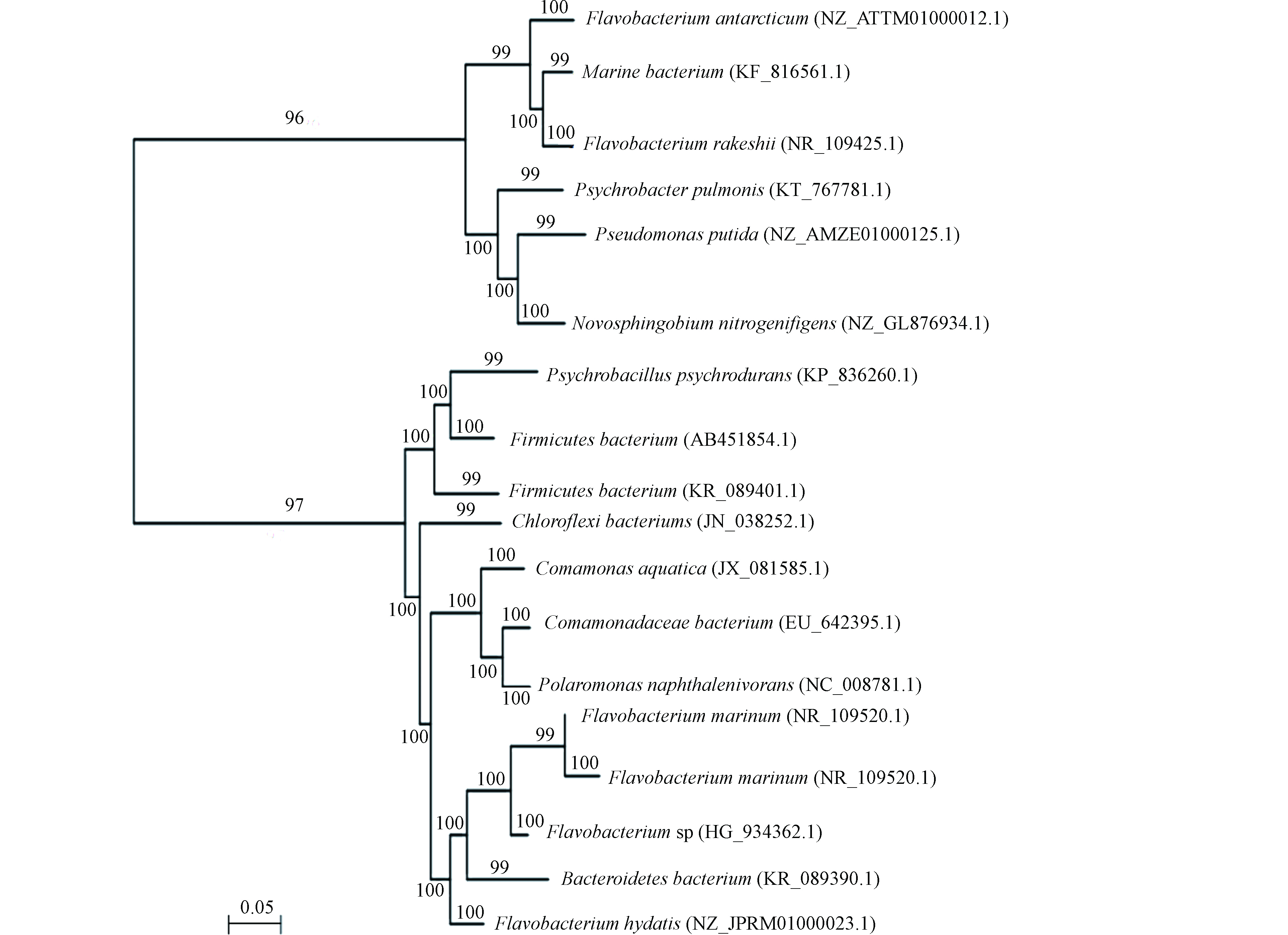
图2为采用Quantity one软件数字化分析所得电泳图-量化分析图,图中得到了特征不同的条带分布强度,位于三采区煤层水的细菌群落组成明显异于矿区边界样品的第三四系混合水和生活区的浅水。量化分析图和表3戴斯系数显示出三采区煤层水与矿区边界水相似性为57%,与生活区地下水相似性仅为40.3%,而W2矿区边界水与W3生活区地下水相似度较高,为64.7%;这一特点说明煤层地下水的微生物具有其独特性。DGGE图谱中每一条带代表样品中的一种微生物,条带在DGGE图谱中越亮,灰度值越高,即微生物优势地位越明显。由图2和表4可以看出煤层水的香浓指数(H)、均匀度(E)与丰富度(S)低于后两者,表明三采区煤层水微生物多样性指数和物种丰富度、均匀度均比矿区边界水和生活区地下水略低,表明原始采矿区域的煤层水环境对微生物的生长并不适宜,但从条带分布可看出其种属相对集中,说明某一类菌群的细菌较适宜在煤层水中生长。
水样微生物序列对比结果如表4。结合图2的DGGE图谱可以看出,(1)W1三采区煤层水的优势条带集中在Band4-16、20、23,以变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为主,主要优势物种包括黄杆菌属(Flavobacterium)、耐冷嗜冷芽孢杆菌(Psychrobacillus psychrodurans)、恶臭假单胞菌(Pseudomonas putida)、海洋细菌(Marine bacterium)、丛毛单胞细菌属(Comamonas aquatica)、新鞘氨醇杆菌属(Novosphingobium nitrogenifigens)、硫细菌(Sulfur bacteria),其中硫细菌(Sulfur bacteria)、耐冷嗜冷芽孢杆菌(Bacillus psychrophilus)、恶臭假单胞菌(Pseudomonas putida)、海洋细菌(Marine bacteria)均为耐铁锰细菌,与伊敏矿区原生地质中铁锰元素含量较高的情况互为响应。(2)W2矿区边界第三四系混合水的优势条带集中在Band10-20,以变形菌门(Proteobacteria)为主,拟杆菌门(Bacteroidetes)次之,主要优势物种包括海洋细菌(Marine bacteria)、黄杆菌属(Flavobacterium marinum)、丛毛单胞细菌属(Comamonas aquatica)、极性单胞菌属(Polaromonas naphthalenivorans)、新鞘氨醇杆菌属(Novosphingobium nitrogenifigens)。矿区边界地下水中耐铁锰细菌在优势菌群中仅存在一种,即海洋细菌(Marine bacterium),属芽孢杆菌属(Bacillus)。(3)生活区浅水的优势条带集中在Band13—20,同样以变形菌门(Proteobacteria)为主,拟杆菌门(Bacteroidetes)次之,主要优势物种包括黄杆菌属(Flavobacterium marinum)、丛毛单胞细菌属(Comamonas aquatica)、极性单胞菌属(Polaromonas naphthalenivorans)、新鞘氨醇杆菌属(Novosphingobium nitrogenifigens)。重金属场地环境行为决定了多相微界面迁移扩散、生物/非生物转化过程[17],结合韩志捷等[18]对微生物在土壤中的迁移研究,推断土壤本身质地、生物过程及矿物含量、溶液离子浓度等的环境介质相似导致生活区浅水和矿区边界地下水菌属优势带一致。另外,还有一个特别的发现,煤层中出现了兼性厌氧生物绿弯菌门细菌,虽然在光合作用中不产生氧气,不能固氮,但能进行光合作用,而原始煤层中均为厌氧生物,说明经过多年煤层水的疏干行为一定程度上影响了地下水文条件,导致煤层中微生物的种群发生变化,部分耐性细菌出现,进而使得微生物的多样性发生变化,这与前人研究一致[19]。
采用MEGA5软件,Neighbor-joining法构建系统发育树,自展系数(bootstrap)为1000,水样的系统发育树如下(图3)。
-
研究前期伊敏露天煤矿地下水水质的全分析结果如表5所示,W1三采区水样pH为酸性,并且其铁锰、高锰酸盐指数均为超标状态;W2矿区边界地下水水样亦为酸性,但W2只有铁锰两个指标为超标状态;W3生活区地下水水质指标只有高锰酸盐指数存在超标状态。其中W1煤层水中锰的超标倍数高达8.49,铁的超标倍数达到2.26,说明矿区煤层水存在明显的铁锰超标问题;W2矿区边界地下水也均呈现较为显著的铁锰超标状态,超标倍数分别为3.89、3.35,但其超标程度低于核心采区。对比分析结果可知,研究区域煤层水铁锰含量超标是影响矿区地下水水质的主要因素,也是影响微生物多样性及种类变化的主要因素。进一步对比分析可以发现,煤层水中铁锰细菌优势条带占比明显高于矿区边界的第四系水和生活区的浅水,即铁锰细菌优势度和多样性与矿产富集度成正比。另外,生活区地下水并未出现铁锰超标现象,但由于矿区周边草原大量放牧及生活区带来的生活源下渗使浅层地下水高锰酸盐指数超标,故W3生活区地下水浅水铁锰细菌明显减少,取而代之的是地下水中的常见菌属黄杆菌属(Flavobacterium marinum)等。
Chen等[20]研究发现,微生物的数量与高锰酸盐指数(CODMn)具有显著的正相关关系。在本研究中W1煤层水和W3生活区浅水的高锰酸盐情况相似,而W3生活区浅水中铁锰含量未超标,但是其Shannon-Wiener指数却与煤层水中的微生物群落相差无几,一方面说明在适宜的高铁锰环境中微生物生长几乎不受影响,多样性表现显著,同时表明理论上微生物技术适用于高铁锰浓度的地下水与土壤修复。矿区和核心采区地下水环境为酸性厌氧环境,而缺氧和酸性环境下会导致矿石中固态铁锰元素的浸出,还会导致铁锰微生物降低对游离态铁锰的固定作用,在低溶解氧的碱性条件下有利于铁锰元素的氧化固定作用。龚琴红等[21]对南昌地区农村应用地下水铁锰污染进行了调查,结果显示该地区地下水铁锰超标可能与当地土壤母质含铁锰量较高,土壤呈酸性以及地下水pH值较低有关。Maurice等[22]通过在有氧的条件下利用一种假单胞菌在高岭石粘土矿物上培养,发现喜氧假单胞菌可以促进高岭石分解以获取铁元素。另一方面在地下水除铁锰的研究中,pH是影响铁锰去除的重要因素。一般而言,pH越高,Fe2+和Mn2+的氧化速度越快,铁锰的去除也就越容易。而从微生物的角度来说,细菌生活在偏中性和碱性的环境中,此时细菌表面总带负电荷,这有利于细菌对阳离子,如Fe2+、Mn2+等的吸收。Crerar和Barnes[23]建立了深海锰结核成因的催化模型,锰的氧化细菌,如生金菌属,在上部氧化带中加速Mn的沉淀;在下部还原带中,相似的微生物群能催化Mn的还原和溶解。所以当矿区地下水体系为偏碱性好氧环境下,有利于游离态的铁锰离子被氧化固定,同时在铁锰氧化菌的协同作用下,可减缓原生地质的铁锰元素大量浸出,可作为微生物原位修复矿区地下水铁锰污染的依据。
通过本次分析结果可见,煤层水中以锰氧化还原菌—假单胞菌(Pseudomonas)和既能氧化铁又可氧化锰的芽孢杆菌属(Bacillus)和硫杆菌(Thiobacillus)为优势,也侧面反映了煤层中富含铁锰的地质条件。随着煤矿的开采,长期不断疏干煤层中地下水会逐步改变煤层水中的氧化还原条件,在铁锰还原菌的协同作用下,铁锰离子更加容易溶解进入水相中,这也解释了矿区普遍存在地下水铁锰超标的原生成因。由表6还可以看出,原生地质层铁锰元素赋存度与地下水中铁锰离子浓度呈正相关,赋存环境催生了铁锰细菌的产生并成为优势种群,在地下水的还原环境中铁锰细菌对矿物质铁锰元素产生还原作用,使铁锰元素由稳定的Fe3+、Mn4+溶出到地下水液相中以Fe2+、Mn2+存在,使地下水环境受铁锰污染;在实际工程中采取措施抑制铁锰细菌的生长或者改变地下水氧化还原条件可以减轻铁锰污染的问题。原生条件下的铁锰细菌一般治理特定环境铁锰污染更为有效。晏平等[24]等从生物法除锰污水厂的滤池壁上筛选了除锰菌种,对Mn2+的去除率均超过95%。Tang等[25]从矿山中获得的Lysinibacillus的菌株MK-1,能够在最佳条件下氧化98%的Mn2+。针对微生物对矿区水质的响应特征,可为特定环境下微生物修复矿区地下水铁锰污染的防治提供一些理论指导。
-
采用上文1.2节中所述方法进行土样与煤样的分析,矿区土壤和煤层中的微生物DGGE电泳图和量化分析如图4所示。土样与煤样的微生物多样性特征和戴斯系数相似性分析如表7—表9所示。
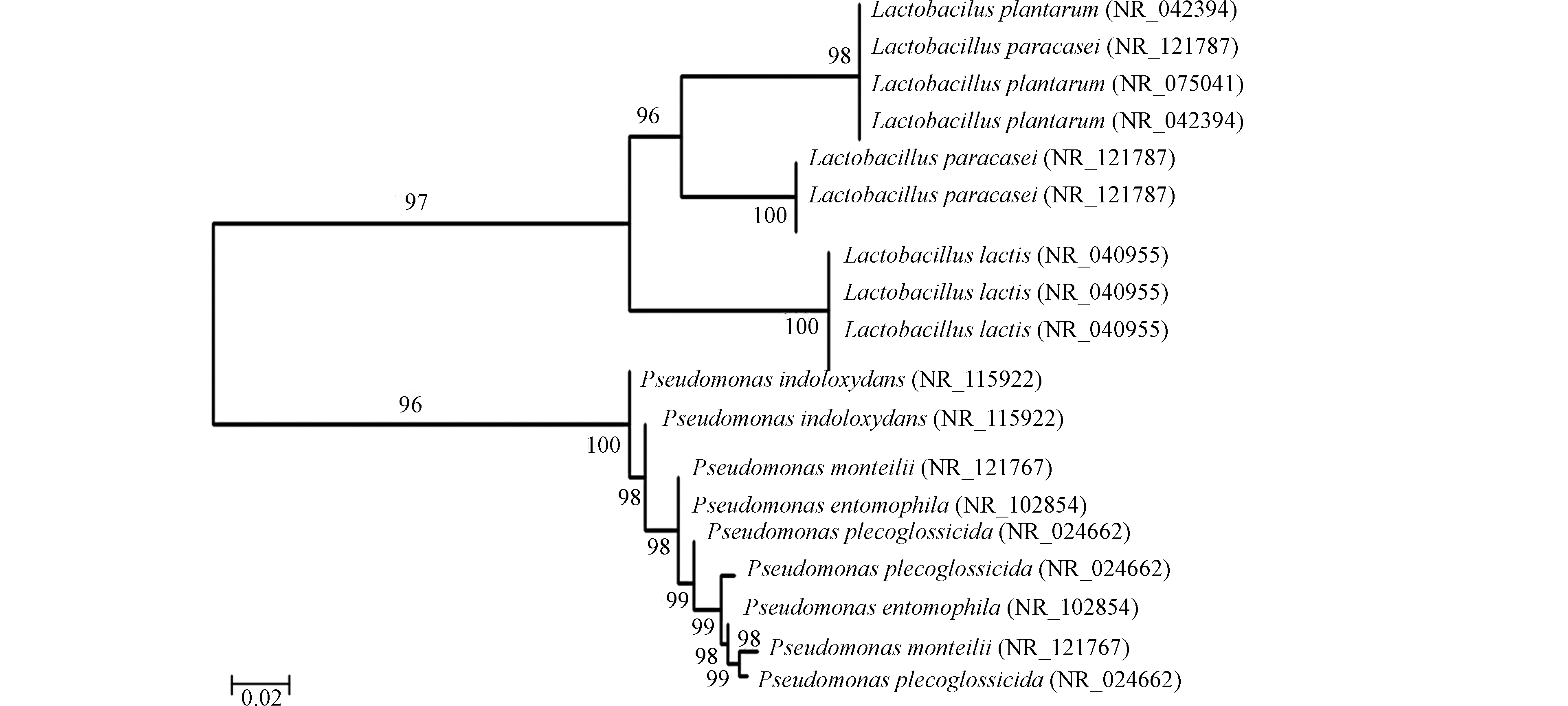
分析图4和表7—表9发现,总体上土壤的微生物多样性和丰富度优于煤层,土壤的物种丰度比煤层更丰富。对于土壤:(1)S3三采区土壤的微生物多样性优于S2矿区土壤和S1生活区土壤,微生物特征较强,但其均匀度略低。土壤样品采集时三采区未进入开采阶段,土壤环境未受到干扰,而生活区土壤和矿区边界土壤分别受到人类活动和采矿作业的影响导致微生物多样性降低。同时,可发现(2)S1生活区土壤与S3三采区土壤的微生物类群较为接近,而矿区土壤由于多年开采剥离表土、挖损岩层以及煤矸石压占等影响与二者差别较大,可见矿区开采作业对土壤类型产生了一定的影响。而两个煤层样品均取自于三采区,样品的微生物多样性、丰富度和均匀度无差别。
对每个DGGE凝胶回收条带选取3个克隆样进行了序列测定,测序结果与Genbank中的序列进行对比,结果如表10所示。
通过对比煤样与土样,可以看出,总体上土样中的微生物丰度和多样性高于煤样,条带集中区也存在差异。对于土壤:S1生活区土壤优势条带为3—6、15、17,主要优势菌种包括植物乳杆菌(Lactobacillus plantarum)、乳酸乳球菌(Lactococcus lactis)、副干酪乳杆菌(Lactobacillus paracasei)、变形假单胞菌(Pseudomonas plecoglossicida),其中变形假单胞菌(Pseudomonas plecoglossicida)为铁锰细菌,S1生活区土样优势条带中铁锰细菌占比16.2%;S2矿区内土壤优势条带为2—6、13、15,主要优势菌种包括植物乳杆菌(Lactobacillus plantarum)、乳酸乳球菌(Lactococcus lactis)、副干酪乳杆菌(Lactobacillus paracasei)、变形假单胞菌(Pseudomonas plecoglossicida)、蒙氏假单胞菌(Pseudomonas monteilii),其中变形假单胞菌(Pseudomonas plecoglossicida)、蒙氏假单胞菌(Pseudomonas monteilii)为铁锰细菌,S2矿区内土样优势条带中铁锰细菌占比28.5%;S3三采区土壤的优势条带为3—7、13、15、17;主要优势菌种与S1、S2相同,同样其中变形假单胞菌(Pseudomonas plecoglossicida)、蒙氏假单胞菌(Pseudomonas monteilii)为铁锰细菌;但S3三采区土样优势条带中铁锰细菌占比23.5%;土样中的优势菌种主要包括厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),其中厚壁菌门占土壤优势种群的70%以上,变形菌门(Proteobacteria)仅占30%。与吴永胜等[26]研究结果显示的内蒙古荒漠草原土壤微生物群落特征结构中变形菌门(Proteobacteria)占克隆总数的17.6%相似,在典型退化样地中土壤微生物群落结构将以某种菌门为优势类群,说明矿区土壤因开采活动呈现退化趋势。对于煤层:煤层中的微生物主要包括变形假单胞菌(Pseudomonas)、蒙氏假单胞菌(Pseudomonas monteilii)、氧化吲哚假单胞菌(Pseudomonas indoloxydans)、虫媒假单胞菌(Pseudomonas entomophila)、乳酸乳球菌(Lactococcus lactis),其中煤层微生物的优势种群中铁锰氧化还原菌假单胞菌属(Pseudomonas)占84%左右,常见菌种只占优势菌种的16%左右。铁锰结核是铁锰氧化物在土壤和沉积物中主要的存在形式,原生地质中煤层铁锰含量较高可看做铁锰结核。有研究[27]指出,分析含有铁锰结核的土壤,即使处于同一点的土壤和铁锰结核,其细菌结构仍然会有很大差异,在土壤中,厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)等为主要细菌种群,占比51.6%—70.5%,变形菌门(Proteobacteria)次之,占比17.7%—29.0%;而铁锰结核中,变形菌门为主要菌群,所占比例可达62.8%—90.5%,而其他菌门占比仅为1.5%—10.1%;与本研究土壤和煤层中微生物群落结构所述结果相同。
采用MEGA5软件,Neighbor-joining法构建系统发育树,自展系数(bootstrap)为1000,构建土样和煤样的系统发育树如图5所示。
-
矿区开采对土壤环境的影响主要是土壤侵蚀、土壤盐碱化、土壤沙化和重金属污染。土壤中的重金属难迁移、不易降解,亟需全面开展理论研究和实践探索[28]。对土壤重金属的空间分布以及风险评价等也成为了近年来研究的热点[29-30]。滕应等[31]发现人为开矿使矿区土壤环境呈现不同程度的重金属污染,且矿区土壤退化也和重金属污染有一定关系,重金属污染使土壤微生物生物量和可培养细菌数量显著降低。经过探究本次矿区土壤质量情况,结果表明(表11),土壤重金属综合污染指数生活区土壤、矿区土壤、三采区土壤分别为0.118、0.311、0.229,相比来说矿区土壤的综合污染程度较高。重金属综合污染程度为矿区土壤>三采区土壤>生活区土壤,但总体来说,除铁锰外其他重金属因子的综合污染指数均小于0.7,表明其他重金属污染程度处于安全警戒线以下,而矿区内土壤的铁锰含量呈现为超标状态,铁锰污染治理迫在眉睫。
伊敏矿区原生地质中铁锰元素含量较高,而S2矿区内土壤铁锰含量较高,可能是由于长期的采矿活动下煤粉飘落矿区内,进而将部分铁锰细菌和铁锰离子带入土壤,而土壤介质相比煤层的营养元素更加丰富,加之铁锰离子的存在使铁锰细菌逐渐成为土壤中的优势菌种。铁锰元素含量在土样中的分布情况为S2矿区土壤>S3三采区土样>S1生活区土样;铁锰细菌在土样中的分布占比为S2矿区土壤(28.5%)>S3三采区土壤(23.5%)>S1生活区土样(16.2%)。通过对比土壤铁锰元素含量与土样中铁锰细菌占比可以看出铁锰元素赋存度与土壤中铁锰离子浓度呈正相关,赋存环境催生铁锰细菌在土壤环境中成为优势种群。在有机质含量高的地区,微生物会创造锰还原的环境,使锰以还原型Mn(Ⅱ)的形式存在,当Mn(Ⅱ)迁移到有机质含量低的地区时,氧化环境又促使微生物把Mn(Ⅱ)氧化成Mn(Ⅳ)[27]. 而土壤相对于煤层来说,有机质含量较高,铁锰还原菌会利用土壤中的有机质进行铁锰元素的还原使铁锰元素以离子形式进入土壤可能是造成矿区土壤铁锰含量较高的成因。Stein等[32]研究太平洋金属结核区和大洋地壳中的铁锰结核及其它铁锰氧化物的微生物多样性研究中,也报道了铁锰微生物的存在且以变形菌为主,证明变形菌在铁锰元素的地球化学循环中发挥着一定的作用。而目前铁锰微生物对土壤中铁锰元素的利用机制还不太明确,还需要进一步探索,才能在了解铁锰细菌分布规律和土壤环境质量的情况下,利用铁锰微生物对铁锰元素的作用机制,指导微生物技术治理铁锰污染。
-
在矿区微生物鉴定与空间分布研究基础上,进一步分析矿区微生物与林地、草地等其他地区微生物在多样性、丰度及菌群方面区别与联系。矿区及周边土壤以栗钙土为主,矿区与内蒙其他地区林地、草地、耕地、荒漠化土地以及矿区复垦土壤的微生物相似性及区别特征结果如表12。
土壤微生物群落多样性对于反映止壤肥力状况及生态系统演变具有重要的指示作用,可以反映出土壤质量和健康状况[38],一直是土壤生态学研究中的热点[19],对于阐明物质元素在土壤中的微生物转化、迁移规律及土壤功能型微生物类群的调控,具有非常重要的意义[39]。由上表可知,矿区土壤微生物多样性指数介于2.57—2.79,丰度为0.95—0.97,厚壁菌门(Firmicutes)占绝对优势。而排土场复垦土壤初期、退化荒漠草原土壤的微生物多样性分别为2.50、2.68—2.84,二者微生物多样性和丰度特征指数与矿区土壤较为接近,优势种群也均以某一种或某两种优势菌门为主。且可以推断矿区土壤质量与排土场复垦土壤初期、退化荒漠草原土壤状况类似,均属于较差类型[40]。这也与矿区及采矿行为对生物多样性和生物丰度产生明显的负面影响形成呼应。对于矿区周围土壤修复可参考乔、灌混交模式对对提高土壤质量有显著作用,沙棘,沙打旺,紫花苜蓿适宜在该地区种植[41]。一般来说,土壤受损对土壤微生物数量和种类产生的影响是负面的,但某些耐性微生物种类在一些极端环境中的数量反而增加[42]。
-
DGGE法只能对微生物群落中数量上大于1%的优势种群进行分析[43]。如果两种微生物16S rDNA的序列组成不一样,但是它们的GC含量是一样的,在DGGE图谱上就是同一条带,从而低估了微生物群落的多样性,产生虚假的认识[44]。因此基于上述情况需对菌种进行驯化。经过铁锰细菌的筛选实验共得到8种平板,每种平板代表一种菌株,其中4个铁细菌平板,4个锰细菌平板。将筛选所得的8种平板送至北京市博友顺生物科技有限公司进行菌种鉴定,鉴定方法同样选择PCR-DGGE技术。在细菌菌种鉴定过程中,由于部分样品在测序步骤时出现套峰,最终4个样品成功完成测序,对这4个平板进行测序,进行NCBI比对结果如表13所示。
4种菌株的鉴定结果分别为:赖氨酸芽孢杆菌属(Lysinibacillus xylanilyticus strain)、赖氨酸芽孢杆菌属(Lysinibacillus macrolides strain)、芽孢杆菌属(Bacillus simplex strain)、短短芽孢杆菌属(Brevibacillus agri strain),均属于芽孢杆菌属(Bacillus simplex strain)。实验得到的芽孢杆菌属(Bacillus simplex strain)是既可氧化铁又可氧化锰的细菌属之一,原生地质中存在的微生物对铁锰离子浓度具有很强的耐受性,且具有生物富集作用,对于治理特定环境中的铁锰污染有一定的优势作用,采用这四种微生物对铁锰污染土壤进行接种修复必将大大提高土壤修复效率。
-
煤层--潜层地下水层--土壤层微生物的垂向分布规律和空间分布规律研究结果表明:垂向分布上,煤样、水样和土样中铁锰离子的浓度均与铁锰细菌的丰度和多样性呈现出正相关关系,以煤层中铁锰细菌丰度最高,占煤层微生物优势种群的84%左右,远高于土样中的丰度值。即垂向上,越接近煤层铁锰菌丰度优势越明显。空间分布上来看,煤矿核心采区铁锰细菌的优势条带在地下水检出条带中所占比例为最高,表明煤层品位越高的区域铁锰细菌所占比例越高,矿区边界和生活区则依次降低。微生物菌属方面,矿区地下水、土样与煤样中铁锰细菌种群大有不同,特别是在核心采区煤层水中发现了兼性菌—绿弯菌门(Chloroflexus),且矿区土壤铁锰元素含量最高,说明采矿活动严重影响了矿区土壤环境氛围。并且矿区土壤及其周边土壤因采矿出现退化趋势。说明长期采矿与疏干煤层地下水的行为一定程度上影响了微生物的种群规律,从而进一步影响了土壤与地下水环境。基于矿区现场样品的菌种筛选,开展室内驯化实验得到了四种既可氧化铁铁又可氧化锰的细菌,分别是:赖氨酸芽孢杆菌属(Lysinibacillus xylanilyticus strain)、赖氨酸芽孢杆菌属(Lysinibacillus macrolides strain)、芽孢杆菌属(Bacillus simplex strain)、短短芽孢杆菌属(Brevibacillus agri strain),均属于芽孢杆菌菌属(Bacillus),此优势菌对铁锰离子浓度具有很强的耐受性,且具有生物富集作用,对铁锰污染的土壤与地下水的生物修复技术具有很好的加持作用,具有成为工程菌的潜质,对于特定环境的修复和污染防治具有重要的借鉴意义。
矿区土壤与地下水中铁锰菌群分布规律及成因解析
Distribution and genetic analysis of iron and manganese microbial community in soil and groundwater of mining area
-
摘要: 针对大量煤矿区地下水环境和土壤中铁锰富集的现象,采用16S rDNA联合DGGE分子生物学方法测定某矿区煤层-潜层地下水-土壤层微生物的垂向分布规律和生活区-矿区边界-核心采矿区中微生物的横向分布规律,与铁锰离子浓度分布进行对比分析,研究铁锰细菌不同种属在空间上的变化规律,揭示区域地下水环境和土壤环境质量铁锰超标的水文地质原因与变化规律。最后通过两个月的铁锰溶液室内驯化实验,全面分析矿区铁锰细菌的生物多样性与种属分类特征。结果显示,矿区地下水中铁锰细菌有硫细菌(Chloroflexi bacterium)、芽孢杆菌(Psychrodurans)、假单胞菌(Pseudomonas),微生物优势条带检出结果表明煤层品位越高的区域铁锰细菌所占比例越高,同时说明铁锰微生物的分布与铁锰元素的分布正向相关。煤层中铁锰细菌优势明显,占到84%左右。矿区土壤中铁锰细菌亦为优势种群,但占比远低于煤层中。非煤区土壤中铁锰细菌则优势不明显,仅占土壤优势菌群的20%。且在核心采区煤层水中发现了兼性菌——绿弯菌门(Chloroflexus),说明长期疏干煤层地下水改变了煤层微生物种群,使得微生物的多样性发生变化。室内驯化实验,得到4种均为芽孢杆菌菌属(Bacillus)的铁锰优势菌,对铁锰离子浓度耐受性较强并且能够进行生物富集,具有成为土壤修复工程菌的潜质。本研究可为矿区土壤与地下水铁锰污染治理提供一定的理论指导。Abstract: Aiming at the phenomenon of iron and manganese enrichment in groundwater environment and soil in a large number of coal mining areas, the vertical distribution of microorganisms among coal-submersible Groundwater-soil Layer in a mining area and the horizontal distribution of microorganisms in a residential mining area boundary-core mining area was determined and analyzed with 16S rDNA combined DGGE molecular biology method. Iron and manganese ion concentration distribution were analyzed. Based on that, the comparison between the microorganisms` distribution rules and the iron-manganese concentration was studied. The results of the spatial variation of different species of ferromanganese(Fe-Mn) bacteria revealed the regional groundwater quality hydrogeological reasons for excess iron manganese and their changing rules. Finally, the biological diversity and species classification characteristics of Fe-Mn bacteria in the mining area were analyzed by indoor domestication experiments for two months. The results show that the iron and manganese bacteria in the groundwater of the mining area include sulfur bacteria, Bacillus, and Pseudomonas. The detection results of the dominant microbial bands show that the higher the coal seam grade is, the higher the proportion of iron and manganese bacteria. It also shows that the distribution of iron and manganese microorganisms is positively correlated with the distribution of iron and manganese. Iron and manganese bacteria have apparent advantages in coal seams, accounting for about 84%. The iron and manganese bacteria in the mining area soil are also the dominant species, but their proportion is much lower than that in the coal seam. The advantages of iron and manganese bacteria in non-coal soil are not obvious, accounting for only 20% of the dominant soil bacteria. Also, the facultative bacteria-Chloroflexus phylum was found in the coal seam water of the core mining area, indicating that the long-term drainage of coal seam groundwater has changed the coal seam microbial population, resulting in changes in microbial diversity. Indoor domestication experiments revealed four dominant iron and manganese bacteria of the genus Bacillus. They a have strong tolerance to iron and manganese ion concentrations and can be bio-enriched, and have the potential to become soil remediation engineering bacteria. This study can provide certain theoretical guidance for the treatment of iron and manganese pollution in soil and groundwater in mining areas.
-
表 1 采样点详细信息
Table 1. Sample point details
矿区编号Mining area number 位置Location 备注Note 样品编号Sample number 水样Water sample 2# 11号超降井 煤层水 W1 6# 新打井 矿区边界水 W2 10# 五牧场 生活区浅水 W3 土样Soil sample 8、9、10# 翻斗连王文立家、加油站、五牧场 生活区土壤 S1 13# 新建排水井旁边 矿区边界土壤 S2 1、2、3、4# 三采区 开采区土壤 S3 煤样Coal sample 1、2# 三采区西南 煤层 C1 3、4# 三采区东北 煤层 C2 表 2 培养基主要配置试剂
Table 2. Main medium configuration reagents
培养基名称Medium name 培养基主要试剂Main reagent of medium 牛肉膏蛋白胨液体培养基 牛肉膏3 g、蛋白胨10 g、NaCl 15 g、去离子水1000 mL、pH 7.4—7.6、琼脂20 g 铁细菌培养基 柠檬酸铁铵10 g、MgSO4·7H2O 0.5 g、K2HPO4 0.5 g、CaCl2 0.2 g、NaNO3 0.5 g、NH4NO3 0.5 g、去离子水1000 mL、琼脂15 g、pH 6.6—7.0 锰细菌培养基 蛋白胨2 g、酵母膏0.5 g、琼脂15 g、MnSO4·4H2O 0.2 g、FeSO4·7H2O 0.001 g、过滤陈海水1000 mL 表 3 水样微生物多样性分析及戴斯系数图谱相似性分析
Table 3. Analysis of microbial diversity of water samples and similarity analysis of Dyce coefficient map
多样性指数Diversity index 水样Samples W1 W2 W3 香农指数H 2.74 2.79 2.76 均匀度E 0.95 0.98 0.96 丰度S 17 18 18 相似度/% W1 100 W2 57 100 W3 40.3 64.7 100 表 4 水样中微生物序列对比结果
Table 4. Comparison of microbial sequences in water samples
条带编号Band No. 最相似菌株Most similar strain 相似度/%Similarity 所属菌门Mycoplasma 登录号Accession No. Band1 Flavobacterium marinum黄杆菌属 99 Bacteroidetes拟杆菌门 NR_109520.1 Band2 Flavobacterium marinum黄杆菌属 99 Bacteroidetes拟杆菌门 NR_109520.1 Band3 Flavobacterium sp.黄杆菌属 100 Bacteroidetes拟杆菌门 HG_934362.1 Band4 Flavobacterium antarcticum黄杆菌属 100 Bacteroidetes拟杆菌门 NZ_ATTM01000012.1 Band5 Bacteroidetes bacterium拟杆菌属细菌 100 Bacteroidetes拟杆菌门 KR_089390.1 Band6 Flavobacterium hydatis水生黄杆菌 96 Bacteroidetes拟杆菌门 NZ_JPRM01000023.1 Band7 Psychrobacillus psychrodurans耐冷嗜冷芽孢杆菌 100 Proteobacteria变形菌门 KP_836260.1 Band8 Psychrobacter pulmonis嗜冷杆菌 99 Proteobacteria变形菌门 KT_767781.1 Band9 Pseudomonas putida恶臭假单胞菌 99 Proteobacteria变形菌门 NZ_AMZE01000125.1 Band10 Marine bacterium海洋细菌 100 Proteobacteria变形菌门 KF_816561.1 Band12 Firmicutes bacterium厚壁菌门细菌 100 Firmicutes厚壁菌门 KR_089401.1 Band14 Flavobacterium rakeshii黄杆菌属 96 Bacteroidetes拟杆菌门 NR_109425.1 Band15 Comamonas aquatica丛毛单胞细菌属 100 Proteobacteria变形菌门 JX_081585.1 Band17 Comamonadaceae bacterium丛毛单胞细菌属 99 Proteobacteria变形菌门 EU_642395.1 Band18 Polaromonas naphthalenivorans极性单胞菌属 99 Proteobacteria变形菌门 NC_008781.1 Band20 Novosphingobium nitrogenifigens新鞘氨醇杆菌属 100 Proteobacteria变形菌门 NZ_GL876934.1 Band23 Sulfur bacteria硫细菌 100 Chloroflexi绿弯菌门 JN_038252.1 Band24 Firmicutes bacterium厚壁菌属细菌 100 Firmicutes厚壁菌门 AB451854.1 表 5 水样超标数据分析表
Table 5. Data Analysis Table for Water Sample Exceeding Standard
样品编号Sample number 编号 水样W1 水样W2 水样W3 测值 标准指数Standard Index 测值 标准指数Standard Index 测值 标准指数Standard Index 温度/℃ 9.2 7.4 8.0 色度 6 0.4 5 0.33 5.5 0.37 浊度 2 0.67 2 0.67 2 0.67 pH 7.66 0.44 7.37 0.247 7.59 0.39 溶解氧 10.88 — 7.72 — 8.36 — ORP/mV -247.2 — -215.3 — -227.3 — 铁 0.677 2.26 1.167 3.89 ≤0.3 — 锰 0.849 8.49 0.335 3.35 ≤0.1 — 铜 <0.010 — <0.010 — <0.010 — 锌 <0.001 — <0.001 — <0.001 — 氨氮 <0.02 — <0.02 — <0.02 — 矿化度 354 — 407 — 399 — 总硬度 230 0.511 203 0.451 322 0.715 磷酸盐 0.068 — <0.02 — <0.02 — 亚硝酸盐氮 0.006 0.3 <0.001 — <0.001 — 重碳酸盐 226 — 379 — 562 — 溶解性总固体 355 0.355 456 0.456 728 0.728 化学需氧量(CODCr) <10 — <10 — <10 — 高锰酸盐指数 3.73 1.24 1.38 0.46 4.43 1.47 氟化物 0.51 0.51 0.65 0.65 0.5 0.5 氯化物 24.2 0.097 28.3 0.113 26.7 0.106 硝酸盐(以N计) 0.15 0.008 <0.05 — 16.5 0.825 硫酸盐 62.5 0.25 33.1 0.132 55 0.22 表 6 各水样地下水水质与微生物特征对比
Table 6. Comparison of groundwater quality and microbial characteristics of each water sample
水样water sample 水质特征Water quality characteristics 微生物特征Microbial characteristics W1 1.铁超标2.26倍;2.锰超标8.49倍;3.高锰酸盐指数超标1.24倍 W1水样中出现了硫细菌(Chloroflexi bacterium)、芽孢杆菌(psychrodurans)、假单胞菌(Pseudomonas)等铁锰细菌,其中芽孢杆菌包括3个优势条带分别为Band7、8、10;假单胞菌包括两个优势条带Band9、18;加上硫细菌优势条带Band23,铁锰细菌优势条带在煤层水所检测出的优势条带中占比46.2%。 W2 1.铁超标3.89倍;2.锰超标3.35倍 W2水样中也出现了硫细菌(Sulfur bacteria)、芽孢杆菌(psychrodurans)、假单胞菌(Pseudomonas)等铁锰细菌,其中芽孢杆菌包括一个优势条带为Band10;假单胞菌包括一个优势条带Band18;加上硫细菌优势条带Band23,铁锰细菌优势条带在矿区边界水样中所检测出的优势条带中占比23.1%。 W3 高锰酸盐指数超标1.47倍 W3水样中只出现了假单胞菌(Pseudomonas)这一种铁锰细菌,优势条带为Band18,占生活区地下水中所检测出的优势条带的14.2%。 表 7 土样微生物多样性分析
Table 7. Analysis of microbial diversity of soil samples
土样Soil sample S1 S2 S3 香浓指数H 2.74 2.68 2.79 均匀度E 0.97 0.97 0.95 丰度S 17 16 19 表 8 戴斯系数图谱相似性分析
Table 8. Analysis of similarity analysis of Dyce coefficient map
相似度/% Similarity S1 S2 S3 S1 100 70.2 85.4 S2 70.2 100 63 S3 85.4 63 100 表 9 煤样微生物多样性分析及戴斯系数图谱相似性分析
Table 9. Analysis of microbial diversity of coal samples and similarity analysis of Dyce coefficient map
煤样 Coal sample C1 相似度/% Similarity C2 香浓指数H 2.57 87.8 2.57 均匀度E 0.95 0.95 丰度S 15 15 表 10 土样与煤样细菌鉴定序列比对分析结果
Table 10. Soil and coal sample bacterial identification sequence alignment analysis results
编号NO. 最相似菌株Most similar strain 登录号Accession No. 相似度/%Similarity 最相似类群Most similar group 土壤样品优势条带Dominant bands of soil samples Band_3 Lactobacillus plantarum植物乳杆菌 NR_075041 100 Firmicutes厚壁菌门 Band_4 Lactobacillus plantarum植物乳杆菌 NR_042394 100 Firmicutes厚壁菌门 Band_5 Lactococcus lactis乳酸乳球菌 NR_040955 100 Firmicutes厚壁菌门 Band_6 Lactococcus lactis乳酸乳球菌 NR_040955 100 Firmicutes厚壁菌门 Band_10 Lactobacillus paracasei副干酪乳杆菌 NR_121787 100 Firmicutes厚壁菌门 Band_13 Pseudomonas monteilii蒙氏假单胞菌 NR_121767 98 Proteobacteria变形菌门 Band_15 Pseudomonas plecoglossicida变形假单胞菌 NR_024662 98 Proteobacteria变形菌门 Band_17 Lactobacillus paracasei副干酪乳杆菌 NR_121787 100 Firmicutes厚壁菌门 煤层样品优势条带Dominant seam sample belt Band_5 Pseudomonas plecoglossicida变形假单胞菌 NR_024662 99 Proteobacteria变形菌门 Band_7 Pseudomonas monteilii蒙氏假单胞菌 NR_121767 98 Proteobacteria变形菌门 Band_8 Pseudomonas indoloxydans氧化吲哚假单胞菌 NR_115922 98 Proteobacteria变形菌门 Band_9 Lactococcus lactis乳酸乳球菌 NR_040955 100 Firmicutes厚壁菌门 Band_12 Pseudomonas entomophila虫媒假单胞菌 NR_102854 98 Proteobacteria变形菌门 Band_13 Pseudomonas monteilii蒙氏假单胞菌 NR_121767 98 Proteobacteria变形菌门 表 11 伊敏矿区重金属累积污染指数及综合污染指数
Table 11. The cumulative pollution index and comprehensive pollution index of heavy metals in Yimin mining area
样品名称Sample name 污染指数 Pollution index 汞Hg 镉Cd 铬Cr 砷As 铅Pb 铜Cu 铁Fe 锰Mn 重金属污染指数Heavy metal pollution index S1 0.04 0.14 0.21 0.21 0.04 0.09 0.32 0.24 0.118 W2 0.03 0.21 0.17 0.38 0.05 0.10 1.14 1.20 0.311 S3 0.15 0.22 0.20 0.25 0.05 0.07 0.78 0.64 0.229 表 12 矿区土壤微生物与内蒙古其它类型土壤对比表
Table 12. Comparison table between soil microorganisms in Yimin mining area and other types of soil in Inner Mongolia
土壤类型Soil type 多样性指数Diversity index 丰度Abundance 优势种群Dominant population 本次研究煤矿土壤Yimin coal mine soil 2.57—2.79 0.95—0.97 厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes),其中厚壁菌门占绝对优势[26]; 退化荒漠草原土壤Degraded steppe soil 2.68—2.84 0.95—0.97 优势菌群为拟杆菌门(Bacteroidetes),酸杆菌门(Acidobacteria),变型菌门(Proteobacteria)的γ、δ类群及厚壁菌门(Firmicutes),其中拟杆菌门占优势[33]; 林地Woodland 3.03—3.13 0.98—0.99 门水平优势细菌7个,分别为:变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospira),其中变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)为多数样品的优势菌群[34-35]; 耕地Arable land 2.61—3.92 0.95—0.99 草地(非牧区)Grassland (non-pastoral) 2.39—4.08 0.96—0.98 草地(牧区)Grassland (pastoral) 3.19—3.57 0.98—0.99 煤矿排土场复垦土壤Coal mine dumps reclaim soil 2.50(复垦初期)—3.51(两年后) — 厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes),其中的放线菌门、拟杆菌门和变形菌门是最主要的细菌类群[36-37]。 表 13 驯化所得铁锰细菌序列比对结果
Table 13. Sequence alignment results of ferromanganese bacteria obtained from domestication
样品编号Sample No. 最相似菌株Most similar strain 相似度/%Similarity 登录号Accession No. 锰/土②Manganese/soil② Lysinibacillus xylanilyticus strain赖氨酸芽孢杆菌属 99 KP644237.1 锰/土④Manganese/soil④ Lysinibacillus macroides strain赖氨酸芽孢杆菌属 99 KR085803.1 铁/土①Iron/soil① Bacillus simplex strain芽孢杆菌属 99 GU201860.1 铁/土②Iron/soil② Brevibacillus agri strain短短芽孢杆菌属 99 NR_040983.1 -
[1] CSY, 2018. 中国统计年鉴[M]. 北京: 中国统计出版社, 2018. CSY, 2018. China Statistical Yearbook[M]. Beijing: China Statistical Publishing House. 2018(in Chinese).
[2] GENG H, CHEN F, WANG Z, et al. Environmental management zoning for coal mining in mainland China based on ecological and resources conditions [J]. Environmental Monitoring and Assessment, 2017, 189(5): 228. doi: 10.1007/s10661-017-5932-4 [3] 李全生. 东部草原区煤电基地开发生态修复技术研究 [J]. 生态学报, 2016, 36(22): 7049-7053. LI Q S. Study on ecological restoration technology for development of coal power base in eastern grassland area [J]. Acta Ecologica Sinica, 2016, 36(22): 7049-7053(in Chinese).
[4] MILDER A I, FERNANDEZ-SANTOS B, MARTINEZ-RUIZ C. Colonization patterns of woody species on lands mined for coal in Spain: preliminary insights for forest expansion [J]. Land Degradation & Development, 2013, 24(1): 39-46. [5] HUANG X J, WANG G C, LIANG X Y, et al. Hydrochemical and stable isotope (δD and δ18O) characteristics of groundwater and hydrogeochemical processes in the ningtiaota coalfield, Northwest China [J]. Mine Water and the Environment, 2018, 37(1): 119-136. doi: 10.1007/s10230-017-0477-x [6] 张发旺, 侯新伟, 韩占涛. 煤炭开发引起水土环境演化及其调控技术 [J]. 地球学报, 2010, 22(4): 345-350. ZHANG F W, HOU X W, HAN Z T. Evolution of water and soil environment caused by coal development and its control technology [J]. Acta Geoscientica Sinica, 2010, 22(4): 345-350(in Chinese).
[7] GALHARDI J A, BONOTTO D M. Hydrogeochemical features of surface water and groundwater contaminated with acid mine drainage (AMD) in coal mining areas: A case study in southern Brazil [J]. Environmental Science And Pollution Research, 2016, 23(18): 18911-18927. doi: 10.1007/s11356-016-7077-3 [8] RAJ D, CHOWDHURY A, MAITI S K. Ecological risk assessment of mercury and other heavy metals in soils of coal mining area: A case study from the eastern part of a Jharia coal field, India [J]. Human and Ecological Risk Assessment, 2017, 23(4): 767-787. doi: 10.1080/10807039.2016.1278519 [9] 刘晓波. 露天煤矿区地下水与土壤环境响应研究—以呼伦贝尔草原伊敏煤矿为例[D]. 呼和浩特: 内蒙古大学, 2018. LIU X B. Study on groundwater and soil environmental response in open-pit coal mine area—A case study of Yimin Coal Mine in hulunbeier grassland[D]. Hohhot: Inner Mongolia University, 2018(in Chinese).
[10] LABBATE M, SEYMOUR J R, LAURO F, et al. Anthropogenic impacts on the microbial ecology and function of aquatic environments [J]. Frontiers in Microbiology, 2016, 7: 1044. [11] MA Q, QU Y Y, ZHANG X W. Identification of the microbial community composition and structure of coal-mine wastewater treatment plants [J]. Microbiological Research, 2015, 175: 1-5. doi: 10.1016/j.micres.2014.12.013 [12] EMENIKE CU, JAYANTHI B, AGAMUTHU P, et al. Biotransformation and removal of heavy metals: A review of phytoremediation and microbial remediation assessment on contaminated soil [J]. Environment Reviews, 2018, 26(2): 156-168. doi: 10.1139/er-2017-0045 [13] 吴海维, 周娜娜, 姜宇, 等. 耐铅菌株的分离鉴定及其吸附特性研究 [J]. 湖南农业科学, 2020(7): 5-8. WU H W, ZHOU N N, JIANG Y, et al. Isolation and identification of lead-tolerant strains and their adsorption characteristics [J]. Hunan Agricultural Sciences, 2020(7): 5-8(in Chinese).
[14] EVANISE S P , GABRIEL C M , THIAGO B M , et al. Combining biochar and sewage sludge for immobilization of heavy metals in mining soils [J]. Ecotoxicology and Environmental Safety, 2019, 172: 326-333. doi: 10.1016/j.ecoenv.2019.01.110 [15] CABRAL L, YU R Q, CRANE S. Methylmercury degradation by Pseudomonas putida V1 [J]. Ecotoxicology and Environmental Safety, 2016, 130: 37-42. doi: 10.1016/j.ecoenv.2016.03.036 [16] MALIK AY, ALI M, JAMAL A, Ali M I. Solation and characterization of coal solubilizing aerobic microorganisms from salt range coal mines, Pakistan [J]. Geomicrobiology Journal, 2017, 34(2): 109-118. doi: 10.1080/01490451.2016.1143538 [17] 滕应, 骆永明, 沈仁芳, 等. 场地土壤-地下水污染物多介质界面过程与调控研究进展与展望[J]. 土壤学报, 2020, 57(6): 1333-1340 TENG Y, LUO Y M, SHEN R F, et al. Research progress and prospects on the process and regulation of multi-media interface between soil and groundwater pollutants on site[J]. Acta Pedologica Sinica, 2020, 57(6): 1333-1340 (in Chinese).
[18] 韩志捷, 李洁, 王伟荔, 等. 微生物在多孔介质中的迁移机制及影响因素 [J]. 安徽农业科学, 2016, 44(2): 127-130,167. doi: 10.3969/j.issn.0517-6611.2016.02.045 HAN Z J, LI J, WANG W L, et al. Migration mechanism and influencing factors of microorganisms in porous media [J]. Journal of Anhui Agricultural Sciences, 2016, 44(2): 127-130,167(in Chinese). doi: 10.3969/j.issn.0517-6611.2016.02.045
[19] 尚文勤. 淮北采煤沉陷区土壤重金属分布赋存及微生物生态特征研究[D]. 合肥: 安徽大学, 2017. SHANG W Q. Study on the distribution and occurrence of soil heavy metals and microbial ecological characteristics in the coal mining subsidence area of Huaibei[D]. Hefei: Anhui University, 2017(in Chinese).
[20] CHEN Z J, YUAN J, SUN F, et al. Planktonic fungal community structures and their relationship to water quality in the Danjiangkou Reservoir, China [J]. Scientific Reports, 2018, 8: 10596. doi: 10.1038/s41598-018-28903-y [21] 龚琴红, 熊江波, 曾建玲. 南昌地区农村饮用地下水铁锰污染调查及水质评价 [J]. 江西化工, 2010(4): 45-49. doi: 10.3969/j.issn.1008-3103.2010.04.014 GONG Q H, XIONG J B, ZENG J L. Investigation of iron and manganese pollution in drinking groundwater in rural areas of Nanchang and water quality evaluation [J]. Jiangxi Chemical Industry, 2010(4): 45-49(in Chinese). doi: 10.3969/j.issn.1008-3103.2010.04.014
[22] MAURICE P A, LEE Y J, HERSMAN L E. Dissolution of Al-substituted goethites by an aerobic Pseudomonas mendocina var. bacteria [J]. Geochimica Et Cosmochimica Acta, 2000, 64(8): 1363-1374. doi: 10.1016/S0016-7037(99)00404-4 [23] CRERAR D A, BARNES H L. Deposition of deep-sea manganese nodules [J]. Geochimica Et Cosmochimica Acta, 1974, 38(2): 279-300. doi: 10.1016/0016-7037(74)90111-2 [24] 晏平, 姜理英, 陈建孟. 锰氧化菌Aminobacter sp. H1的分离鉴定及其锰氧化机制研究 [J]. 环境科学, 2014, 35(4): 1428-1436. YAN P, JIANG L Y, CHEN J M. Isolation and identification of manganese oxidizing bacteria Aminobacter sp H1 and its manganese oxidation mechanism [J]. Environmental Science, 2014, 35(4): 1428-1436(in Chinese).
[25] TANG W W, LIU Y Y, GONG J M, et al. Analysis of manganese oxidase and its encoding gene in Lysinibacillus strain MK-1 [J]. Process Safety and Environmental Protection, 2019, 127: 299-305. doi: 10.1016/j.psep.2019.04.002 [26] 吴永胜. 内蒙古退化荒漠草原土壤细菌群落结构特征 [J]. 生态学报, 2010, 30(23): 6355-6362. WU Y S. Characteristics of soil bacterial community structure in the degraded desert steppe of Inner Mongolia [J]. Acta Ecologica Sinica, 2010, 30(23): 6355-6362(in Chinese).
[27] 张贵友. 几种生境土壤(铁锰结核)中微生物多样性的研究[D]. 武汉: 华中农业大学, 2015. ZHANG G Y. Study on microbial diversity in several habitat soils (iron-manganese nodules)[D]. Wuhan: Huazhong Agricultural University, 2015(in Chinese).
[28] 武钰鼎. 社会工作者介入矿区污染防治初探——评《有色金属矿山重金属污染控制与生态修复》 [J]. 矿业研究与开发, 2019, 39(7): 157. WU Y D. A preliminary study on social workers intervening in pollution prevention and control in mining areas-comment on "heavy metal pollution control and ecological restoration in non-ferrous metal mines" [J]. Mining Research and Development, 2019, 39(7): 157(in Chinese).
[29] 赵艳玲, 刘亚萍, 何厅厅, 等. 金矿区土壤重金属铬和锌的空间变异性研究 [J]. 矿业研究与开发, 2014, 34(5): 128-132. ZHAO Y L, LIU Y P, HE T T, et al. Study on the spatial variability of soil heavy metals chromium and zinc in gold mining area [J]. Mining Research and Development, 2014, 34(5): 128-132(in Chinese).
[30] LIANG J, WU H B, WANG X X. Distribution characteristics and health risk assessment of heavy metals and PAHs in the soils of green spaces in Shanghai, China [J]. Environmental Monitoring and Assessment, 2019, 191(6): 345.1-345.14. [31] 滕应, 黄昌勇, 龙健. 矿区侵蚀土壤的微生物活性及其群落功能多样性研究 [J]. 水土保持学报, 2013, 17(1): 115-118. TENG Y, HUANG C Y, LONG J. Study on microbial activity and community functional diversity of eroded soil in area [J]. Journal of Soil and Water Conservation, 2013, 17(1): 115-118(in Chinese).
[32] STEIN L Y, LA DUC M T, GRUNDL T J, et al. Bacterial and archaeal populations associated with freshwater ferromanganous micronodules and sediments [J]. Environmental Microbiology, 2001, 3(1): 33819704. [33] 夏冬双. 内蒙古西部地区土壤微生物多样性分析[D]. 呼和浩特: 内蒙古大学, 2016 XIA D S. Analysis of soil microbial diversity in western Inner Mongolia[D]. Hohhot: Inner Mongolia University, 2016(in Chinese).
[34] 米媛婷. 内蒙古不同类型草地土壤微生物多样性及群落结构研究[D]. 呼和浩特: 内蒙古大学, 2017. MI Y T. Study on soil microbial diversity and community structure of different types of grassland in Inner Mongolia[D]. Hohhot: Inner Mongolia University, 2017(in Chinese).
[35] 贺龙, 李艳琴, 李彬春. 矿区不同植被复垦模式对土壤细菌群落结构的影响 [J]. 环境科学, 2017, 2(38): 752-759. HE L, LI Y Q, LI B C. Effects of different vegetation reclamation patterns on soil bacterial community structure in mining area [J]. Environmental Science, 2017, 2(38): 752-759(in Chinese).
[36] CHODAK M, PIETRZYKOWSKI M, NIKLINSKA M. Development of microbial properties in a chronosequence of sandy mine soils [J]. Applied Soil Ecology, 2009, 41(3): 259-268. doi: 10.1016/j.apsoil.2008.11.009 [37] 闫瑞瑞, 卫智军, 辛晓平, 等. 放牧制度对荒漠草原生态系统土壤养分状况的影响 [J]. 生态学报, 2010, 30(1): 43-51. YAN R R, WEI Z J, XIN X P, et al. The effect of grazing system on soil nutrient status of desert steppe ecosystem [J]. Acta Ecologica Sinica, 2010, 30(1): 43-51(in Chinese).
[38] 陈欣瑶, 杨惠子, 陈楸健, 等. 重金属胁迫下不同区域土壤的生态功能稳定性与其微生物群落结构的相关性 [J]. 环境化学, 2017, 36(2): 356-364. doi: 10.7524/j.issn.0254-6108.2017.02.2016062401 CHEN X Y, YANG H Z, CHEN C J, et al. The correlation between the stability of soil ecological function and the structure of microbial community in different regions under heavy metal stress [J]. Environmental Chemistry, 2017, 36(2): 356-364(in Chinese). doi: 10.7524/j.issn.0254-6108.2017.02.2016062401
[39] 王远鹏. 重金属污染土壤的微生物分子生态及对修复效应的影响[D]. 杭州: 浙江大学, 2006. WANG Y P. The microbial molecular ecology of heavy metal contaminated soil and its influence on remediation effect[D]. Hangzhou: Zhejiang University, 2006(in Chinese).
[40] 李海宽, 张雅楠. 内蒙古黑岱沟矿区排土场土壤质量评价 [J]. 中国水土保持, 2014(10): 63-66. doi: 10.3969/j.issn.1000-0941.2014.10.025 Li H K, ZHANG Y N. Soil quality evaluation of dumping site in Heidaigou mining area, Inner Mongolia [J]. China Soil and Water Conservation, 2014(10): 63-66(in Chinese). doi: 10.3969/j.issn.1000-0941.2014.10.025
[41] PRADHAN S K, KUMAR U, SINGH N R. Functional diversity and metabolic profile of microbial community of mine soils with different levels of chromium contamination [J]. International Journal of Environmental Health Research, 2020, 30(4): 461-473. doi: 10.1080/09603123.2019.1601686 [42] ORLEWSKA K, PIOTROWSKA-SEGET Z, BRATOSIEWICZ-WĄSIKA J, et al. Characterization of bacterial diversity in soil contaminated with the macrolide antibiotic erythromycin and/or inoculated with a multidrug-resistant Raoultella sp. strain using the PCR-DGGE approach [J]. Applied Soil Ecology, 2018, 126: 57-64. doi: 10.1016/j.apsoil.2018.02.019 [43] ZHOU X Q, WANG Y F, CAI Y, et al. PCR-DGGE detection of the bacterial community structure in the Inner Mongolia steppe with two different DNA extraction methods [J]. Acta Ecological Sinica, 2017, 27(5): 1684-1689. [44] 鲍志戎, 杨宏. 铁, 锰氧化还原细胞研究概况 [J]. 微生物学通报, 1996, 23(1): 48-50. BAO Z R, YANG H. A survey of iron and manganese redox cells [J]. Microbiology Bulletin, 1996, 23(1): 48-50(in Chinese).
-





 下载:
下载: