-
再生水是指污水经生物、化学和物理等方法处理后达到一定水质标准、可再次使用的水资源[1]。由于其水源稳定可靠、环境效益明显,如今已成为城市用水的重要组成部分,常被用于城市景观、天然水体补充等领域,对缓解水资源供需矛盾、改善环境污染等方面起到积极作用[2]。但再生水营养盐含量较高,在特定的条件下容易导致河流富营养化,影响生态系统结构及功能,威胁水体生态健康[3-4]。
浮游动物在水生态系统中主要扮演初级消费者的角色,主要被分为原生动物、轮虫、枝角类和桡足类4大类群[5],是食物链中能量传递的重要环节[6]。在我国大部分区域,以体型较小的原生动物和轮虫为主,较大的枝角类和桡足类数量相对较少[7-9]。其主要依靠水流进行长距离迁移,这种被动运动方式使得其对环境变化异常敏感,因此常被作为水体理化指标和系统营养状况变化的指示生物,枝角类和桡足类比例越大,生态结构越稳健[10]。在再生水补充的河流中,浮游动物群落组成同时也受水体营养状况和季节变化的双重影响[11]。
近些年,关于浮游动物群落调查的研究较多,例如北京潮白河浮游动物的主要类群为原生动物和轮虫,其密度随春、夏、秋季递增[12]。而早在2012年5~12月份对温榆河和清河的调研发现,两条河流中体型较大的浮游动物物种数量均在夏季出现最高值,并在秋季、冬季依次递减[13]。更早(2004~2006年)的一项对温榆河和白河浮游动物的调查,也表明这两条河流以原生动物为主,且物种种类基本相同,但枝角类、桡足类等体型较大的浮游动物差别较大[14]。然而,这些研究主要侧重于生态群落调查,而基于不同再生水混合比差异对河流浮游动物群落结构产生影响的研究较少。实际研究过程中,由于天然降雨量随季节变化和侧渗作用,如何衡量再生水的补给比例是研究过程中面临的一个难题。由于再生水氯离子和天然水体差异很大,其浓度变化为表征水体再生水混合比例提供了方法。
本研究选取北京市完全再生水补给河流(清河)、部分再生水补给河流(温榆河)、无再生水补充的天然河流(白河)为研究对象,分季节调查了3条河流浮游动物的分布特征,旨在揭示再生水补给条件下河流浮游动物分布特征及其季节动态,为城市生态修复过程中采用的生态补水方案提供依据支撑。
全文HTML
-
研究区选择了不同再生水混合比例的3条河流:完全由再生水补充的河流(清河)、部分再生水混合河流(温榆河)、无再生水补充河流(白河)。清河源于西山碧云寺,流经海淀区、朝阳区和昌平区,在顺义区境内纳入温榆河,干线全长23.6 km,河底较为平缓,并且大部分河段硬化。沿途有4家水处理厂的再生水排入,是一条典型的城市完全再生水补给河流,日径流总量约为80万m3/d。温榆河属北运河水系,全长47.5 km,流域面积2 478 km2,是清河的受纳河流,为北京市典型的部分再生水补给河流,径流量约为192万m3/d。白河发源于燕山山脉,途径北京市延庆区、怀柔区山区、进入密云区后流入密云水库,沿途大部分均在人口稀少的山区,极少再生水的补充,为典型天然河流,径流量约为70万m3/d。
-
样品分别采集于2019年春、夏、秋、冬4个季节,同时避开降水等天气影响,具体采样时间为1月22~23日、4月18~19日、7月16~17日和11月20~21日。在密云水库的主要河流白河中游的水泉峪设置1个对照点(40.61°N、116.78°E,由于冰封,未能获取白河冬季数据);根据清河流域特点,在清河上、中、下游共设置6个取样点,分别记为Q1、Q2、Q3、Q4、Q5、Q6。考虑最后对主河道影响,在清河的受纳河流温榆河上游(W1)、温榆河下游(W2)各设置一个采样点。清河、温榆河的采样点,见图1。
-
水样采集和浮游动物定量分析参考2007年出版的《水域生态系统观测规范》[15]。水体理化性质的检测采用原位水质仪检测和室内检测结合的方法。主要检测指标为叶绿素(chl-a)、总氮(TN)、总磷(TP)、化学需氧量(CODCr)、铵态氮(NH4+-N)、硝态氮(NO3−-N)和溶解氧(DO)等理化指标。
-
物种多样性指数是用简单的数值表示群落内种类多样性的程度,是判断群落或生态系统的稳定性、健康状况的指标。物种多样性指数可直观表达物种的分布特征,本文依据浮游动物个体数量对Shannon-Wiener指数(H’)、Margalef指数(D)、均匀度指数(E)、Berger-Parker指数(d)进行计算。其中,Shannon-Wiener 指数表示群落物种多样性指数,Margalef 指数表示物种丰富度指数,均匀度指数表示不同物种在群落中的分布均匀程度,Berger-Parker 指数表示物种优势度指数[16-17]。
-
参考基于湖泊和水库的富营养化等级规范,对3条河流TLIΣ值进行计算[18]。(本研究采用重铬酸盐法对水体CODCr进行检测,在综合营养状态计算过程中,根据王晶[19]的相关报道,已将其转化为CODMn。)
选取Shannon-Wiener多样性指数作为评价水质状况的指标,当H’值在0−1之间时为“ɑ-中污型”,在1−3之间为“β-中污型”,大于3时为“清洁-寡污型”[20]。
-
浮游动物多样性指数的描述性统计分析在MS Excel 2010中完成;利用单因素方差分析(ANOVA)分别比较了不同河流水质差异、两条再生水补给河流和无再生水补给河流之间浮游动物多样性指数以及再生水河流不同季节之间的浮游动物多样性指数的差异;此外,在SPSS 17.0中进行两条再生水河流浮游动物多样性指数与综合营养状态指数TLIΣ值之间线性回归分析。
1.1. 研究区概况
1.2. 采样点设置
1.3. 样品采集与测定
1.4. 数据分析
1.4.1. 多样性指数计算
1.4.2. 水体营养状态指数的计算及水质类型评价
1.4.3. 数理统计
-
对3条河流的主要指标进行了检测,其水质指标差异,见表1。
表1可知,chl-a、CODCr均表现为温榆河显著高于清河和白河,TN、NO3−-N表现为清河和温榆河显著高于白河,DO为温榆河显著高于白河,TP、NH4+-N 在3条河流中未表现出显著差异(P<0.05)。
-
在3条河流中共发现浮游动物90种,包括原生动物30种、轮虫44种、枝角类9种、桡足类7种。其中,清河(完全再生水补给河流)和温榆河(部分再生水补给河流)分别观测到浮游动物物种数为60和59种,白河(无再生水补给河流)观测到11种。3条河流轮虫物种数均最高,原生动物次之,枝角类和桡足类相对较少,见表2。
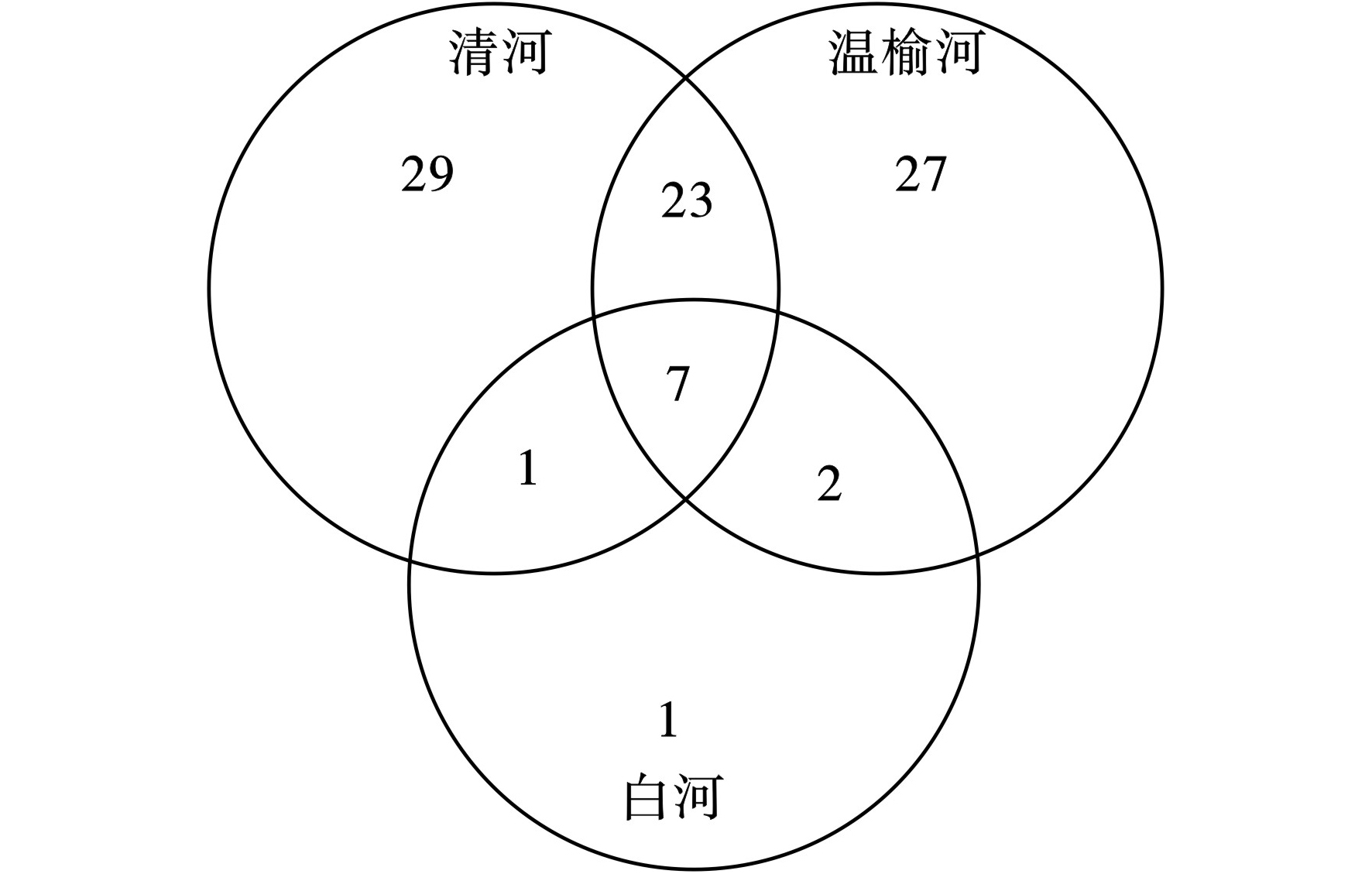
和3条河流观测到的物种总数相似,清河特有种为29种、温榆河27种、白河1种,白河特有种只发现了粗毛溞属(Macrothrix spp.),即相对于无再生水补给河流,再生水河流更易于浮游动物的生长。两条再生水补给河流共有种有30种,占总浮游动物种类的33.33%。3条河流的共有种有7种,占总浮游动物种类的7.78%,见图2。
H’、D指数在3条河流中都表现出温榆河>清河>白河趋势,见表3,其中,清河和温榆河H’指数显著高于白河(P<0.05);d则表现出白河>温榆河>清河,白河d指数显著高于清河(P<0.05),温榆河与其余两条河流差异性不显著。白河除d指数高于再生水河流外,其余指数均低于后者,即在天然河流中,浮游动物多样性、丰富度和均匀度值均较低,而优势种占比较高,可见研究区天然河流相对于再生水补给河流物种更为单一,且数量较少。E指数与d指数表现出相反趋势,即清河≈温榆河>白河,但再生水河流与白河之间没有显著差异。
温榆河浮游动物密度最高,清河次之,白河最低,见表4。
3条河流中轮虫和原生动物为优势类群,桡足类和枝角类密度相对较低;清河轮虫、原生动物密度分别为24.18 ind/L、28.33 ind/L,枝角类和桡足类密度均未达5%;白河轮虫占绝对优势,其次为原生动物。
-
3条河流中浮游动物均在夏季达到最高密度值。清河浮游动物密度按季节排列为夏季>冬季>秋季>春季。春、夏、秋季以原生动物为主,优势种主要为累枝虫属和毛板壳虫(Coleps hirtus);冬季主要以轮虫为主,优势种主要为大肚须足轮虫(Euchlanis dilalata)和萼花臂尾轮虫(Brachionus calyciflorus)。温榆河夏季密度最大,秋季次之,冬季仅为1.16 ind/L;4个季节轮虫占比均最高,优势种主要有前节晶囊轮虫(Asplachna priodonta)和萼花臂尾轮虫。白河3个季节浮游动物密度差异不大(由于天气原因未能获取冬季数据),春、夏季均以轮虫为主,分别占69.16%和100%,且春季优势种为大肚须足轮虫,夏季只发现了前节晶囊轮虫,见表5。
不同季节浮游动物的多样性指数变化存在明显的差异,见表6。清河春、秋季H’指数高于夏、冬季,可见完全再生水补给河流在春、秋季物种多样性较高;秋季物种丰富度明显高于其它季节,物种均匀度(E)和物种优势度(d)均未表现出季节差异。温榆河夏季物种多样性较高,夏季丰富度明显高于其它季节,物种均匀度(E)在秋季表现为最低,物种优势度(d)在各季节未表现出显著差异。白河物种多样性(H′)、物种丰富度(D)、物种均匀度(E)均在春季最高,夏季最低,物种优势度(d)则在夏季最高,春季最低,与其他指数表现出相反趋势。
-
浮游动物丰度与NH4+-N、NO3−-N为极显著负相关关系(P<0.01),与chl-a、CODcr为极显著正相关关系,可见NH4+-N、NO3−-N、chl-a、CODcr是影响丰度的主要因素;H′指数的主要影响因子为chl-a(P<0.01),且与TN、TP为显著正相关(P<0.05);D指数主要影响因子为NH4+-N和chl-a(P<0.01);d指数的主要影响因子为TP(P<0.01)。此外,DO与H′、D、d指数均为负相关;chl-a与丰度、H′、D均为极显著正相关(P<0.01),见表7。
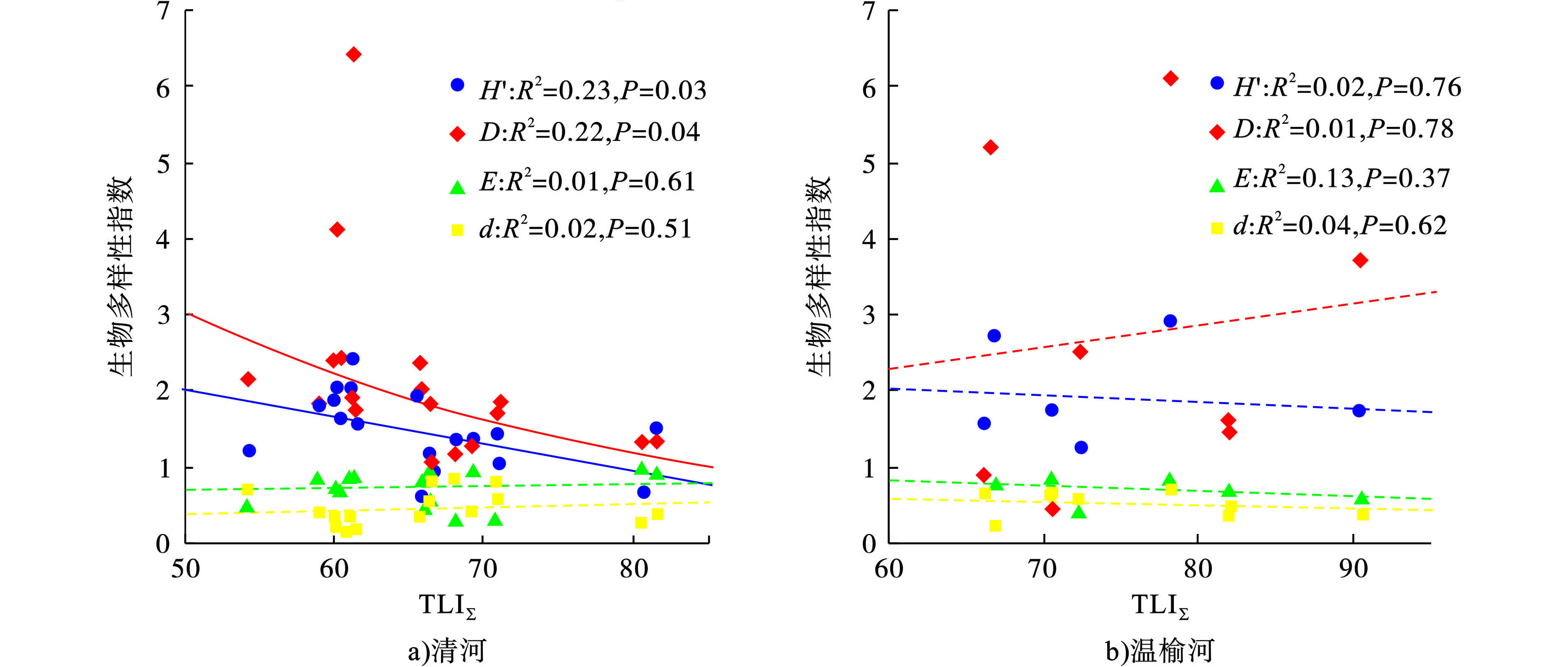
清河和温榆河有较高的综合营养水平,各季节不同采样点水体TLIΣ均值分别为65.5和76.0,天然河流白河的平均TLIΣ值为52.0。在清河,H’和D均随水体综合营养状态指数TLIΣ值的增加而显著降低(P<0.05),E和d随水体TLIΣ值增加无显著趋势(P>0.05)。而H’指数和D指数常被用来反映群落物种数和物种分布均匀度,当两种多样性指数数值越高,群落越结构越复杂、稳定。本文所研究的河流水体营养状况需要在合适水平,营养状况越高浮游动物物种数越低、群落复杂程度越低,不利于浮游动物的生长。与此相对,营养物质越低的白河,其营养物质不足以支撑浮游动物群落的大规模繁殖,其多样性和丰度都大幅降低,见图3。
-
基于Shannon-Wiener多样性指数的水质类型评价主要通过对物种多样性状况进行评估,进而判断群落或生态系统的稳定性、健康状况。清河和温榆河4个季节H′指数均在1到3之间波动,水质类型为“β-中污型”;白河虽然为天然河流,但在浮游动物密度较差,夏季和秋季的H′指数在0~1之间波动(春季为β-中污型,冬季无数据),因此为“α-中污型”。
2.1. 水质指标差异
2.2. 河流浮游动物的总体分布特征
2.3. 季节对浮游动物分布特征影响
2.4. 浮游动物多样性与河水营养状态的的关系
2.5. 基于浮游动物Shannon-Wiener多样性指数的水质类型评价
-
本研究结果表明,在完全再生水补给河流和部分再生水补给河流中,原生动物、轮虫数量均占主导地位,而枝角类和桡足类数量较少。“体型-效率”假说(Size-Efficiency Hypothesis)认为,由于鱼类和浮游动物的捕食关系,为躲避捕食者,浮游动物向小型化发展[21],即当存在捕食者时,小型浮游动物占主导地位,且繁殖周期较短,繁殖数量庞大;而没有捕食者时,大型浮游动物如枝角类和桡足类占主导地位[22]。也有学者认为食物和环境因子是导致大型、小型浮游动物数量的关键因素,VANNI[23]认为当食物来源和生存环境存在较大差异时,浮游动物数量出现一定差异。以上研究在一定程度上解释了研究区3条河流中均以体型较小的原生动物、轮虫为主的现象。
浮游动物密度在3条河流的分布规律为温榆河>清河>白河,即部分再生水补给河流中浮游动物的密度最高,完全再生水河流次之,无再生水补给河流最低。有研究表明当原生动物和轮虫物种数较高、枝角类和桡足类较低时,说明水体营养物质丰盛[10],本研究得出的结论也说明温榆河较于清河有更丰富的营养物质含量。这可能是因为温榆河作为部分再生水补给河流,有来自于再生水营养物质的补给,为浮游动物生长提供营养源;且温榆河较为完整的生态系统结构,为河流生态系统的地球化学循环提供了基础[24],有益于生物的生长[25]。温榆河较高的TN、TP含量为水体提供良好的营养基础,促进浮游植物的生长(chl-a的累积),加快水体有机质的积累,从而导致水体CODCr含量的增加[26-27]。而浮游动物多以浮游植物为食,温榆河含量丰富的浮游植物为浮游动物提供了充裕的食物来源,促进其大量繁殖,且浮游生物的生长需要较为合适的营养物质含量[28]。此外,本研究(2019年)得出温榆河浮游动物物种数(62种)远低于李利娜等[14]于2004~2006年间所得结果(135种),结合以上讨论,其原因可能是2004~2018年间,温榆河水体COD、NH4+-N含量整体呈现下降趋势,并在2018年达到最低水平[29],相对较低的营养状态限制了部分浮游生物的生长[30-31]。但也有研究表明NH4+-N含量过高可对浮游动物产生毒害作用[32],影响浮游动物的群落结构组成。当NH4+-N含量较高时,可导致大型溞(Daphnia magna)等部分枝角类生物繁殖率降低、成熟延迟甚至死亡[33-34],本研究在后续研究中将对该问题进行关注。
在再生水河流清河和温榆河中,H′、D表现出相同变化趋势,且温榆河浮游动物密度高于清河。前期有研究发现温榆河大型浮游动物H′值也高于清河,即温榆河大型浮游动物物种多样性高于清河[11],和本研究基于所有浮游动物的结论相似。可能是因为混合了上游的天然水以及来自清河及其它再生水河流水体后的温榆河更适于浮游动物生长,这可能是由于“中度干扰”对生态系统的刺激作用[35],即来自清河和温榆河两个不同水质的子系统带来了更多样的营养物质资源和浮游生物多样性。但本研究再生水河流浮游动物H’值低于渭河,这可能是由于适中的水体有机质含量更适宜于浮游动物的生长[36]。
-
本研究中,再生水河流浮游动物密度与自然河流具有相似的季节变化趋势,都在夏季达到最高的密度值,且浮游动物的多样性指数变化存在明显的季节差异。一般认为,在时间尺度上,影响浮游动物的关键因素为水温[37],不同的水温对浮游动物的生理状况产生一定影响,进而改变物种组成、密度和多样性[38-39]。在春、夏、秋季,清河以原生动物为主,主要是因为清河再生水补给量较大,且河底硬化,导致温度相对较高,蓝藻等一些浮游植物进行大量繁殖,为原生动物提供充裕食物来源;此外,原生动物较其他浮游动物繁殖速度快、数量庞大,在夏、秋季易占水体主导地位[40]。温榆河在4个季节均以轮虫为主,主要是因为轮虫食谱较广,在缺乏春、冬季节生长的绿藻和裸藻等食物外,水体中有机体碎屑、细菌亦可作为其食物[41],所以其他浮游动物缺乏主要藻类食物时,轮虫可进行正常生理活动[42-43]。
-
本研究表明清河和温榆河综合营养状态指数均高于基于湖泊水质研究确定的富营养临界值50[15],主要是因为再生水河流较高的营养元素输入和有机质含量[27]。以往关于湖泊富营养化评价多以chl-a和透明度等指标为基准构建不同的营养状态指数[44],但不同于湖泊,河流水体有着较高的流动性,在河道中停留时间较短,相同营养盐含量条件下,湖泊更易产生水质恶化现象[45],因此以湖泊综合富营状态指数对河流进行营养状态等级划分,可能高估了河流实际富营养化水平,或者说河流富营养化临界值理论上应高于湖泊和水库。此外,相对于环境因子,生物因子对水体健康状况更为敏感,有研究者曾通过构建大型底栖动物的“生物完整性评估指数(B-IBI)”对浑太河进行了水体健康评估[46],这为“一河一策”提供了良好的实践基础。
浮游生物多样性指数常用来反映浮游生物群落结构特点及水环境质量[47]。本研究中,完全再生水补给河流清河的浮游动物Shannon-Wiener群落物种多样性指数(H′)和Margalef物种丰富度指数(D)与综合营养状态指数值呈显著负相关关系,即随水体综合营养水平的提高,浮游动物的多样性和丰富度均降低。这可能是因为在完全再生水补给河流中,当营养水平较高时,寡污性浮游动物难以生存,降低了浮游动物的多样性和丰富度[48];而当营养水平较低时,对食物含量要求较低且种类繁多的小型浮游动物大量繁殖,本研究也表明原生动物和轮虫(小型浮游动物)的数量远高于桡足类和枝角类(大型浮游动物)。STEMBERGER[49]1985年对轮虫的研究也得出了大型轮虫适宜于高营养水平水体,小型轮虫适宜于低营养水平水体的结论。但在温榆河,H′和D指数随营养水平的变化均未达显著水平,这可能是由于更高的营养水平对河流生态过程产生一定影响。有学者认为,水体污染和基本水质指标等因素可对河流大型底栖动物群落结构产生影响[50],如更高的营养水平水体中溶解氧含量的降低导致滤食性鱼类难以生存,缺少捕食者的浮游动物群落结构发生变化[51],这在一定程度上也解释了温榆河H′和D高于清河的现象。
3.1. 不同再生水混合比河流的浮游动物分布特征
3.2. 不同再生水混合比河流的浮游动物季节性差异
3.3. 再生水河流的营养状态及其与浮游动物多样性的关系
-
(1)三条河流原生动物和轮虫为优势浮游动物类群。浮游动物密度表现为:部分再生水补给河流>完全再生水河流>天然河流。由于水质的持续改善,部分再生水补给河流(温榆河)中的物种数和密度比前期调研结果有了显著的降低。
(2)再生水河流浮游动物密度存在着明显的季节动态。再生水河流与天然河流浮游动物均在夏季达到最高的密度值;浮游动物多样性指数也存在明显的季节差异,但再生水河流除Berger-Parker物种优势度指数在冬季达到最高值外,其他生物多样性指数没有一致的季节化趋势。
(3)再生水补给河流浮游动物丰度及多数多样性指数总体上均高于无再生水补给河流(Berger-Parker指数低于无再生水补给河流),且再生水河流水质优于无再生水补给河流。完全再生水河流中营养物质在浮游动物多样性变化中占重要地位:浮游动物的Shannon-Wiener指数和Margalef指数随水体综合营养状态指数的增高而显著降低。
致谢
感谢中国科学院水生生物研究所冯伟松老师在浮游动物物种鉴定和定量分析方面的技术支持;感谢中国农业大学鲁晓倩和中国环境科学研究院安立会老师在采样方法确定和设备购买方面给予的帮助;感谢任俊澎、李碧滢、巨学森在浮游动物和水体样品采集方面的帮助。




 下载:
下载: