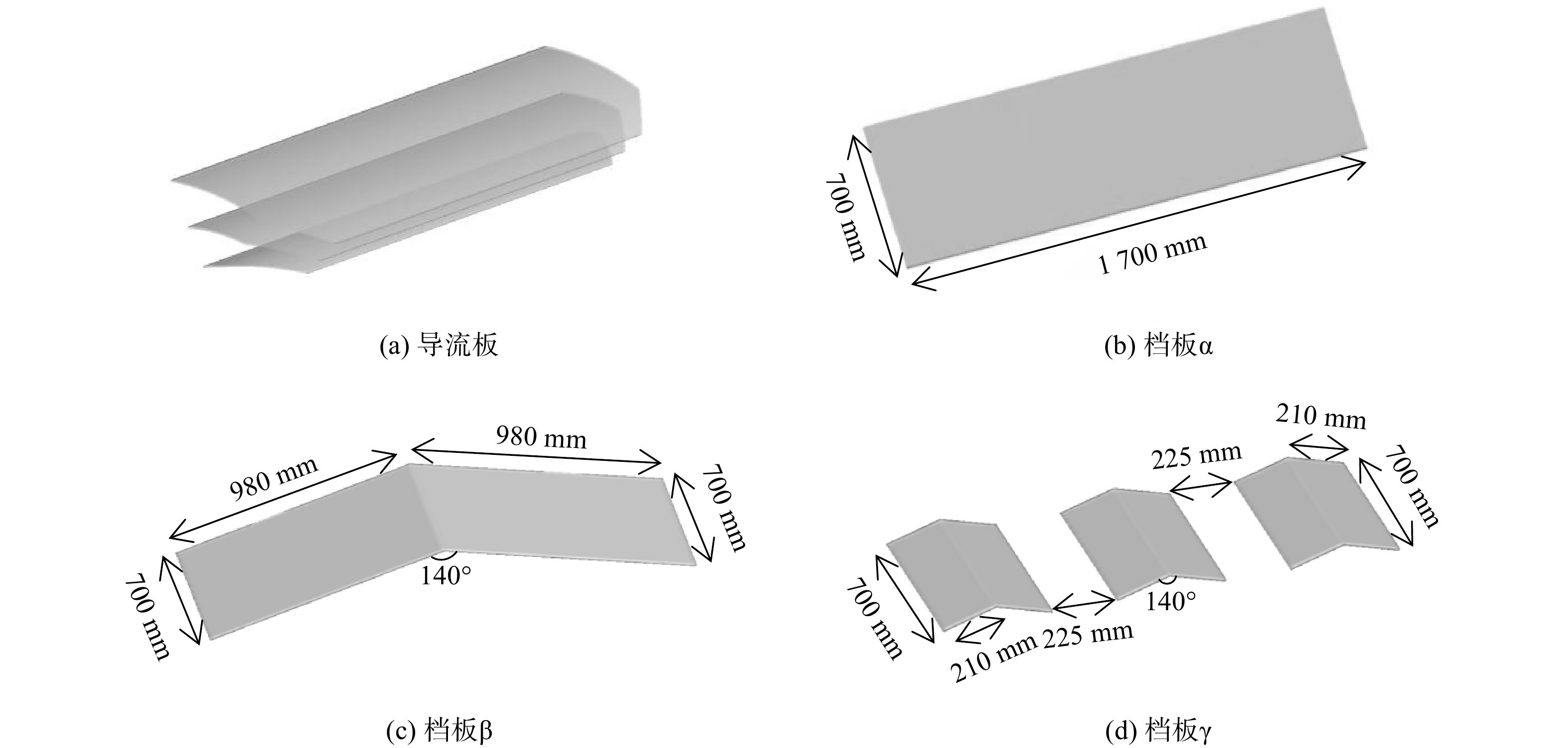
-
苯胺是一种具有强烈气味的微黄色或无色油状液体,主要用于制造药物、树脂、染料和橡胶硫化促进剂等[1],在印染、橡胶和农药等行业的废水中广泛存在,其浓度有时甚至高达上千毫克每升。然而废水中苯胺浓度高于100 mg/L时,对水生生物和人体健康就会造成严重威胁[2],所以苯胺或其衍生物等已被EPA和中国环保部门列入“优先污染物黑名单”[3-4],是如今环保行业水污染治理的重中之重[5]。
苯胺是一类难降解的有机物,现处理该物质的方法一般分为化学法、物理法和生物法。常用的物理处理方法有吸附法、萃取法和膜分离法。吸附法和膜分离法需经常更换吸附物质或膜,两者均成本较高[6];单用萃取法很难使苯胺与需处理的污水完全分离[7]。化学法包括氧化还原法、二氧化氯氧化法和臭氧氧化法等。曹向禹等[8]发现二氧化氯氧化法可去除90%以上的苯胺;胡军等[9]研究表明臭氧氧化法对苯胺的去除率达到96%,且苯胺浓度越高去除效果越显著。
与上述方法相比,生物法操作简单、处理效率高、出水稳定并且处理费用低,也常被应用于处理苯胺[10]。以生物法处理苯胺的首要目标是筛选出苯胺的高效产酶菌。目前已有报道的苯胺高效降解菌有Ochrobactrum anthropic(人苍白杆菌)、Rhodococcuspyridinivorans(食吡啶红球菌)、Bacillus(杆菌)、Delfitiaacidovorans(食酸戴尔福特菌)、Pseudomonassp.(假单胞菌属)和Candida tropicalis(热带假丝酵母)等。Ochrobactrum anthropic在35 ℃、pH=6.5时可完全降解200~800 mg/L苯胺,降解速率为10 mg/(L·h)−1[11];Rhodococcuspyridinivorans最高可耐受5 g/L的苯胺,其降解苯胺的最适温度为30 ℃[12];Bacillus可在60 h内将1.5 g/L的苯胺降解完毕[13];Delfitiaacidovorans为兼性菌,在好氧条件下,30 h内可完全降解100 mg/L苯胺,在厌氧条件下需要7 d才可完全降解[14];当苯胺浓度为400 mg/L时,18 h后Candida tropicalis的降解率可达93%[15]。
在难降解物质的降解过程中,共代谢作用可使微生物酶活性增强,提高降解效率。共代谢是指微生物通过生长基质提供的碳源或氮源等营养,利用菌体内高效酶降解非生长基质(难降解物质)。吴守江等[16]通过实验发现当维生素C的含量与苯胺含量为1∶6时,苯胺降解速率最高,24 h内可将100 mg/L的苯胺降至0.05 mg/L。李剑等[17]研究了以苯胺为唯一碳源或氮源时,共代谢底物对苯胺降解的影响。结果表明,共代谢对苯胺的降解率有显著提高效果。在仅以苯胺为底物时,降解率低于10%,添加葡萄糖或蛋白胨进行共代谢后,菌株对苯胺的降解率提升至70%左右。
文章从某化工厂的苯胺废水中筛选分离到一株苯胺高效降解菌,并对其最佳共代谢碳源及投加比例进行研究。
全文HTML
-
无机盐培养基:NaCl 1 g/L,K2HPO4 1 g/L,KH2PO4 1 g/L,微量元素液 10 mL,pH=7.0~7.2;
微量元素液:MgSO4 0.5 g/L,MnSO4 0.17 g/L,H3BO3 0.12 g/L,ZnSO4·7H2O 0.12 g/L,FeSO4·7H2O 0.3 g/L,自然pH;
富集培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl5 g/L,自然pH;
筛选培养基:在无机盐培养基中添加不同浓度的苯胺作为唯一碳源和氮源;
固体筛选培养基:在筛选培养基中加入1.5%~2%的琼脂,121 ℃灭菌30 min。
-
向装有190 mL富集培养基的三角瓶中投加10 mL苯胺废水,并将置于150 r/min,30 ℃摇床中培养3 d。培养结束后,将10 mL富集菌液接种于90 mL的苯胺浓度为200 mg/L无机盐培养基中,并将其置于150 r/min,30 °C摇床中培养3 d。最后取1 mL驯化后的菌悬液于灭菌后的EP管中,用梯度稀释法将其分别稀释至10−1、10−2······10−8梯度,取10−2~10−8稀释液涂布在以苯胺为唯一碳源和氮源(苯胺浓度为200 mg/L)的无机盐培养基平板上后,置入30 ℃恒温培养箱中倒置过夜培养。
-
取适当稀释的富集菌液涂布在富集培养基平板上,置入30 ℃恒温培养箱培养倒置过夜培养,72 h后观察菌落的大小、形状和颜色等特征,并对其进行革兰氏染色[18]。
-
委托上海生工生物工程有限公司使用16S rRNA序列测定分析法对菌株进行鉴定。
-
以5%的接种量向苯胺浓度分别为200、400、600、800和1 000 mg/L的无机盐培养基中投加富集菌液,在150 r/min、30 ℃的摇床中振荡培养,每24 h测定无机盐培养基中的苯胺剩余浓度。
-
以接种量5%向苯胺浓度为1 000 mg/L的无机盐培养基中接种富集后的菌液,同时向其中分别投加甲醇、抗坏血酸、葡萄糖、淀粉和蔗糖作为外加碳源(苯胺与外加碳源COD比为10∶1),最后将其置于150 r/min、30 ℃的摇床中振荡培养,每24 h测定无机盐培养基中的苯胺剩余浓度。
-
以接种量5%向苯胺浓度为1 000 mg/L的无机盐培养基中接种富集后的菌液,同时向其中分别投加苯胺与共代谢碳源COD比为10∶1、5∶1、2∶1、1∶1和1∶2的外加碳源,将其置于150 r/min、30 ℃的摇床中振荡培养,每24 h测定无机盐培养基中的苯胺剩余浓度。
-
苯胺的浓度测定方法参照《水质 苯胺类化合物的测定N-(1-萘基)乙二胺偶氮分光光度法(GB 11889—89)》[19]。苯胺的去除率按照公式(1)计算。
式(1)中:c0为苯胺初始浓度,mg/L;c1为苯胺剩余浓度,mg/L。
1.1. 培养基
1.2. 实验方法
1.2.1. 菌株的分离筛选
1.2.2. 菌株的形态特征
1.2.3. 菌株的分子水平鉴定
1.2.4. 菌株的苯胺降解能力
1.2.5. 菌株最佳共代谢碳源的选择
1.2.6. 共代谢碳源的最佳投加比例
1.3. 分析测定方法
-
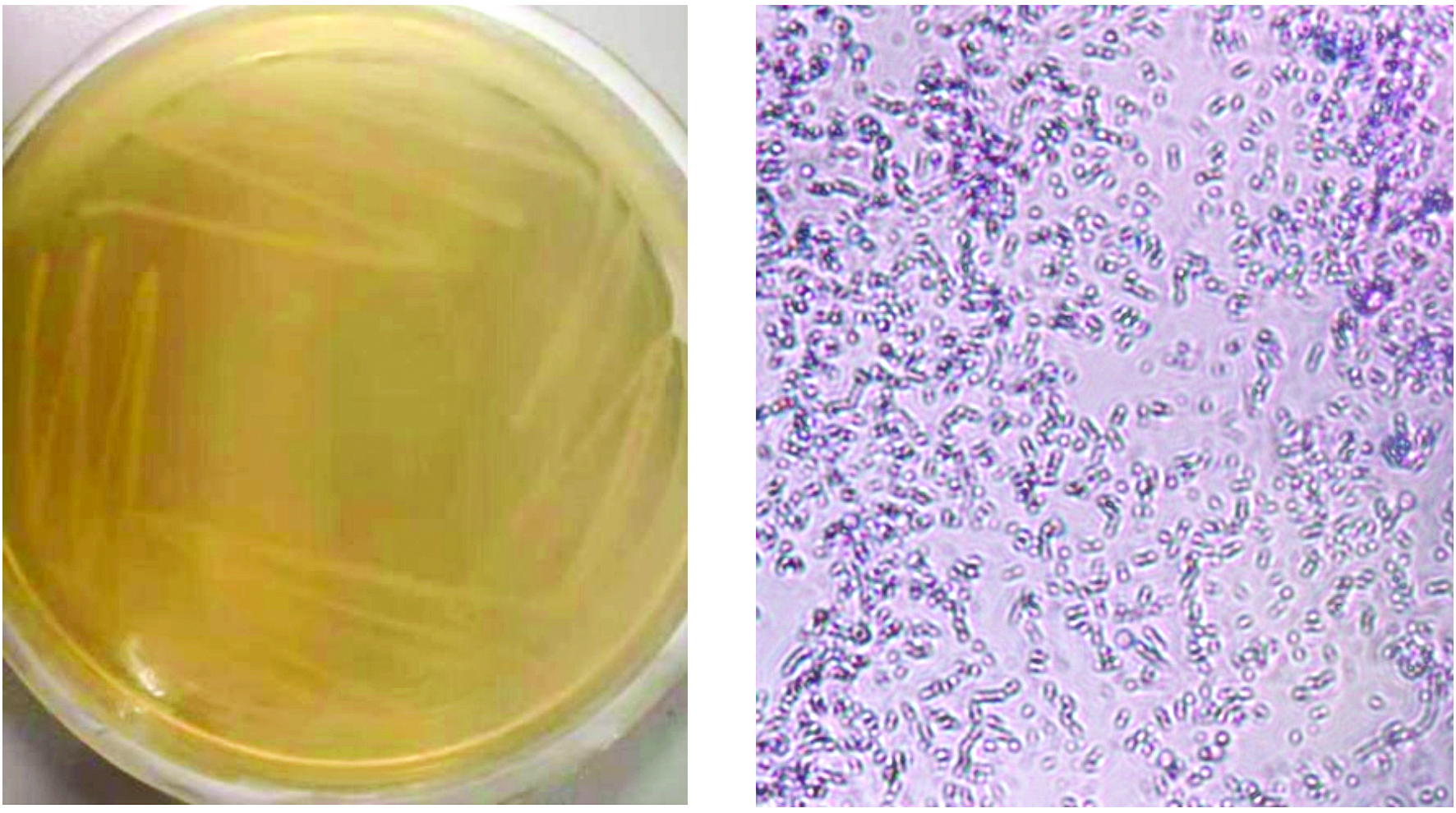
从废水中共筛出3株菌,选择对苯胺降解效果最佳的一株作为实验菌株,将其命名为LS1。将其在富集培养基平板上划线,倒置于30 ℃恒温培养箱中过夜培养48 h,见图1。菌落呈圆形,无色透明,表面光滑,边缘整齐,为革兰氏阴性菌。
-
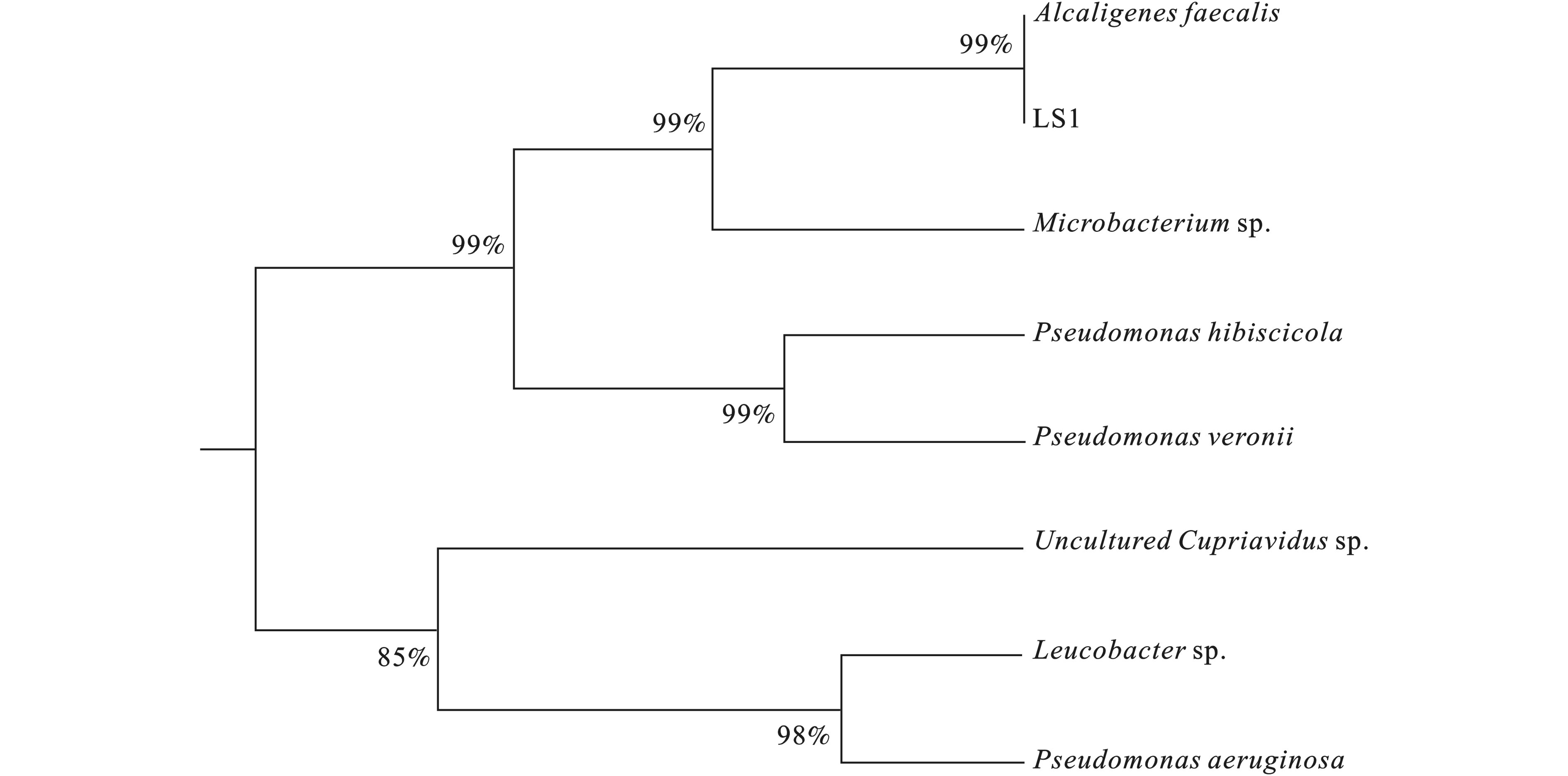
菌株LS1的16S rRNA基因PCR扩增序列长度为1473 bp,将该序列在NCBI的数据库中进行相似性比较,其与粪产碱杆菌(Alcaligenesfaecalis)的序列相似性为99%,确定该菌株LS1为Alcaligenesfaecalis。进行多重序列比对,并构建系统发育树,见图2。
-
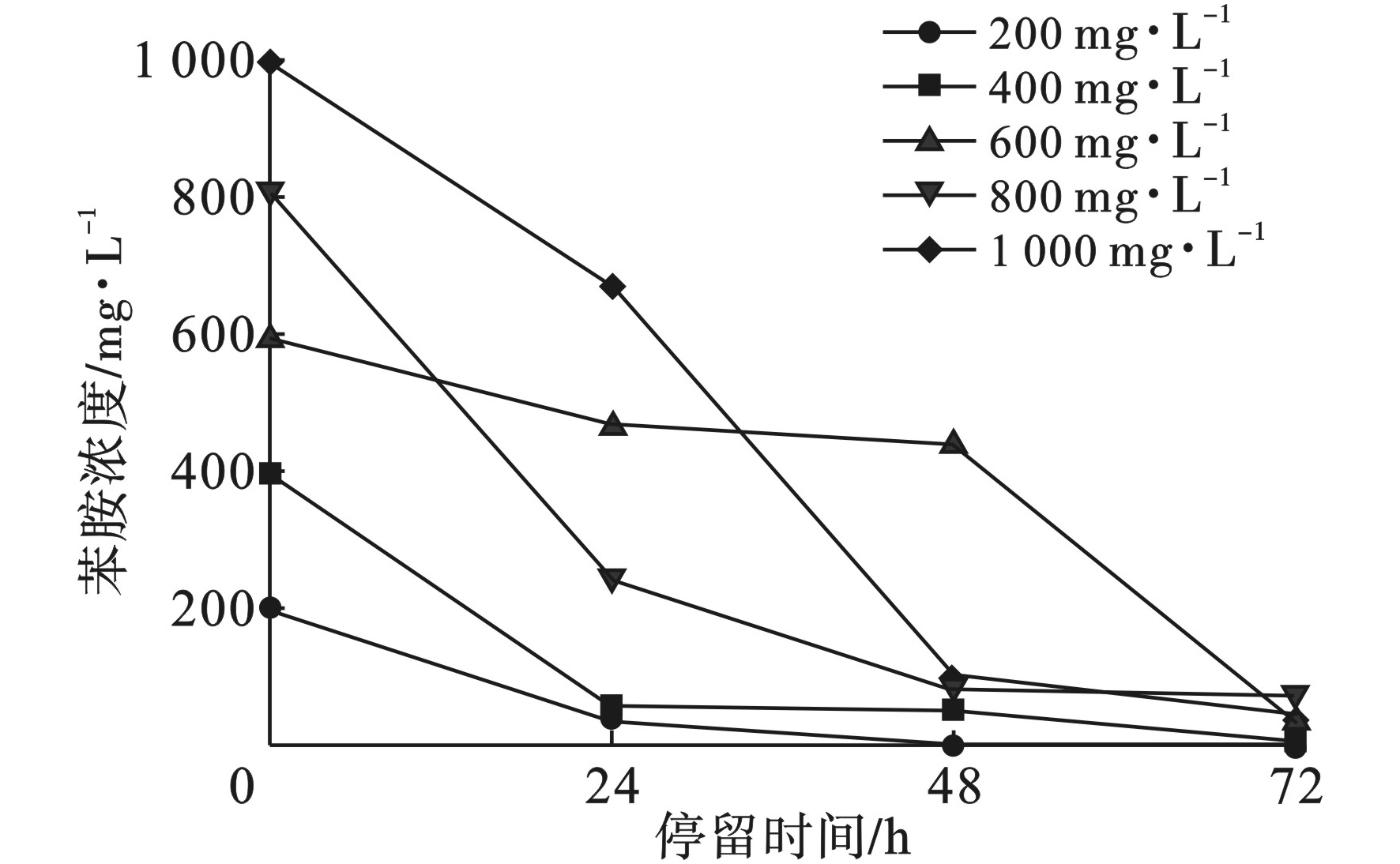
为研究菌株LS1对苯胺的降解能力,以5%的接种量向苯胺浓度分别为200、400、600、800和1 000 mg/L的无机盐培养基中接种处于对数期的菌液,在150 r/min、30 ℃的摇床中振荡培养,每24 h测定无机盐培养基中的苯胺剩余浓度。不同停留时间对苯胺的降解情况见图3。
图3可见,当停留时间延长至72 h时,菌株LS1对苯胺的降解率均达到95%以上,苯胺剩余浓度均低于50 mg/L。苯胺浓度为200 mg/L时,48 h内即可被菌株LS1完全降解;苯胺浓度高于200 mg/L时,菌株LS1将苯胺降解至50 mg/L以下需72 h。苯胺浓度800 mg/L时,降解速率为23.49 mg/(L·h)−1,为苯胺最大降解速率。
-
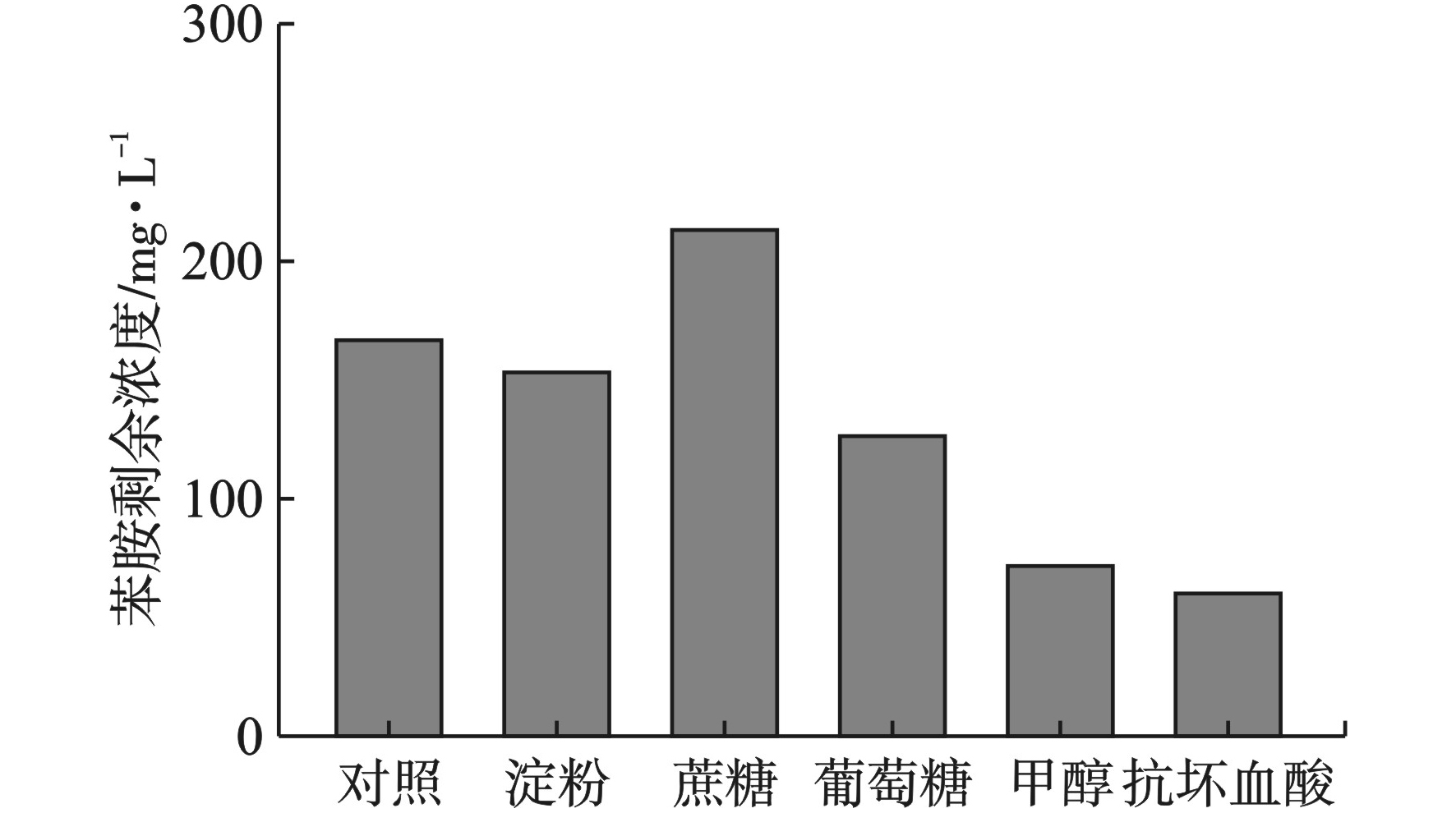
苯胺是高毒有机物,为降低高浓度苯胺对菌株LS1的活性抑制,在无机盐培养基中外加碳源,以期提高菌株LS1对苯胺的降解速率。在苯胺浓度为1 000 mg/L的无机盐培养基中分别投加甲醇、抗坏血酸、葡萄糖、淀粉、蔗糖作为外加碳源(苯胺与外加碳源COD比为10∶1),并接种5%富集菌株LS1,将其置于150 r/min、30 ℃的摇床中振荡培养,每24 h测定无机盐培养基中的苯胺剩余浓度。不同碳源对苯胺降解影响(72 h苯胺出水浓度),见图4。
图4可见,苯胺为唯一氮源和碳源(即对照)时,72 h后剩余苯胺浓度为168.5 mg/L,降解率为83.1%;投加了蔗糖的装置72 h后剩余苯胺浓度为213.7 mg/L,差于以苯胺为唯一碳氮源的装置;其中效果最好的是抗坏血酸,出水浓度为59.6 mg/L,其次是甲醇、葡萄糖、淀粉和蔗糖,都对苯胺的降解有促进作用。
-
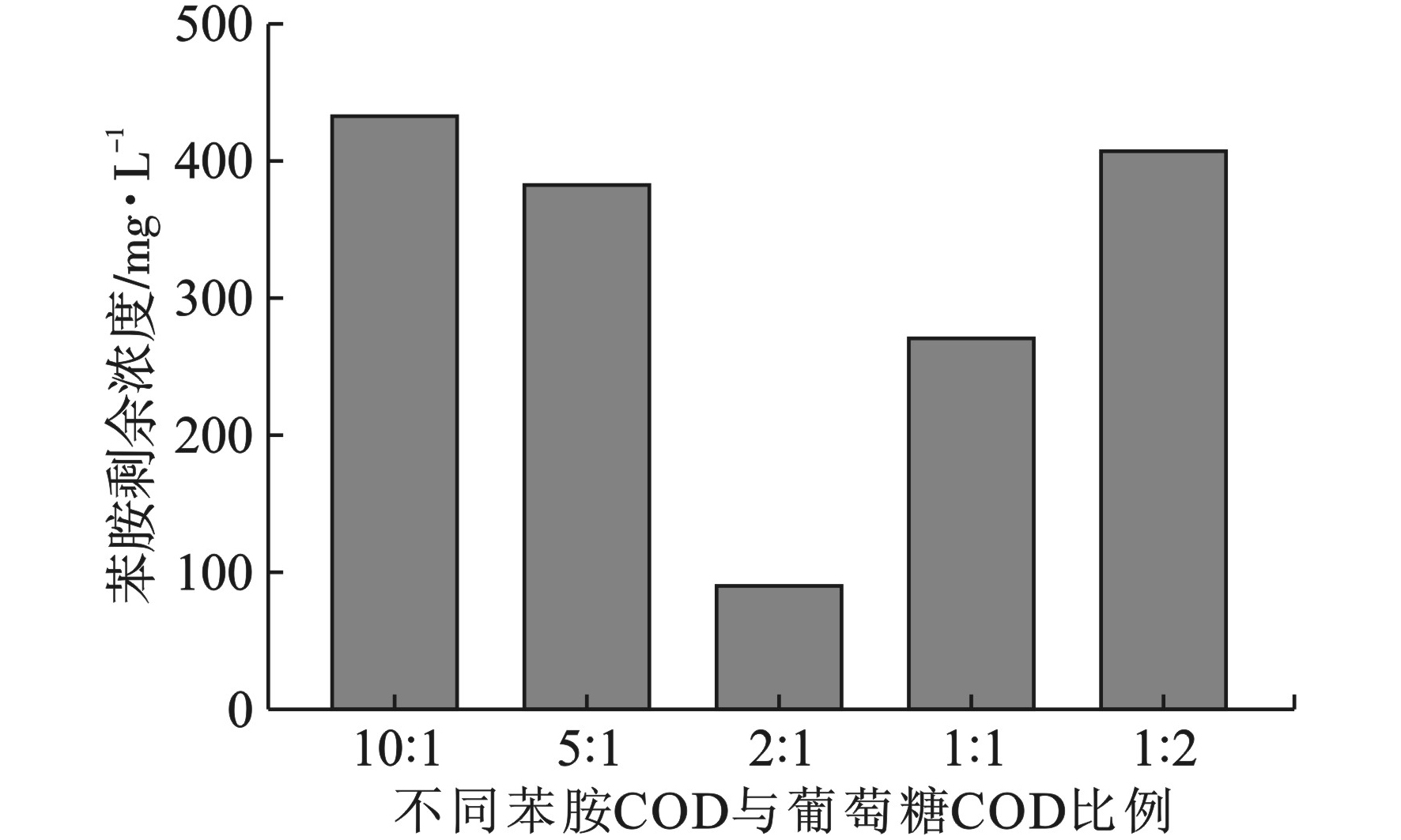
虽然在苯胺无机盐溶液中外加碳源可提高菌株LS1对苯胺的降解速率,但投加量过高或过低都会导致降解速率不升反降。为最大程度提高菌株LS1对苯胺的降解速率,对其共代谢碳源的最佳投加比例进行研究。由于抗坏血酸价格昂贵,甲醇不易保存,故选择葡萄糖为共代谢碳源进行实验。向苯胺浓度为1 000 mg/L的无机盐培养基中分别投加与苯胺COD比为10∶1、5∶1、2∶1、1∶1和1∶2的葡萄糖,并接种5%的富集菌液,将其置于150 r/min、30 ℃的摇床中振荡培养,每24 h测定无机盐培养基中的苯胺剩余浓度。投加不同比例葡萄糖对苯胺降解影响(72 h苯胺出水浓度),见图5。
图5可见,苯胺与葡萄糖COD比为2∶1时,72 h后菌株LS1对苯胺的降解率达到91.1%,是葡萄糖最佳投加比例;其次是苯胺与葡萄糖COD比为1∶1时,效果较佳,降解率达到72.9%。当氮碳源投加比为10∶1时,停留时间为72 h时可能碳源供应不足,降解速率减缓;而当氮碳源投加比为5∶1和1∶2时,虽小幅提高了降解率,但葡萄糖仍存在过低或过高的状况,降解率不理想。因此,苯胺与葡萄糖的COD最佳比为2∶1。
2.1. 菌株形态与特征
2.2. 菌株的鉴定结果
2.3. 菌株对苯胺的降解能力
2.4. 菌株的最佳共代谢碳源
2.5. 共代谢碳源的最佳投加比例
-
此次实验从苯胺废水中分离出3株高效产酶菌,从中择选效果最好的一株作为实验菌株,并对其进行16S rRNA分子学鉴定、苯胺降解能力、最佳共代谢碳源和其投加比例的研究,得出以下结论。
1)以无机盐培养基分离筛选出一株高效产酶菌,经过其形态特征和序列相似性比较,确定该菌株为粪产碱杆菌,并将其命名为LS1;
2)当苯胺浓度为1 000 mg/L以下时,停留时间延长至72 h时,菌株LS1对苯胺的降解率均达到95%以上,苯胺剩余浓度均低于50 mg/L;
3)在外加碳源的情况下,对菌株LS1降解苯胺促进效果最好的是抗坏血酸,72 h出水中苯胺剩余浓度为59.3 mg/L,其次是甲醇、葡萄糖、淀粉和蔗糖;
4)由于抗坏血酸价格昂贵,甲醇不易保存,故选取葡萄糖为最佳投加比实验对象,以1 000 mg/L为苯胺实验浓度。当苯胺与葡萄糖COD比为2∶1,停留时间为72 h时,菌株LS1可降解91.1%的苯胺;其次是投加比为1∶1时,菌株LS1对苯胺的降解率达到72.9%。
文中实验仅以粪产碱杆菌作为实验菌株且并未进行实际废水实验研究,后续研究时可进行多种文献记载的苯胺高效产酶菌对苯胺的降解能力对比,并对其代谢途径进行探索,还应将共代谢实验结果投加至实际工程中进行尝试。





 下载:
下载: