-
目前,很多大型城市采用多水源同时供水的模式以应对城市快速发展带来不断增加的需水量。多水源供水在缓解水量供需矛盾的同时可能导致管网水质不稳定,如用户龙头水出现细菌、浊度、总铁等超标,甚至管网“黄水”现象[1]。
水厂处理后的水在进入管网前,通常采用自由氯或自由氯联合氯胺消毒的方式来保证管网输配过程和龙头水的生物安全性,而消毒过程产生的消毒副产物(disinfection byproducts, DBPs)健康风险是饮用水安全的一个重要方面。DBPs不仅在水厂消毒环节生成并发生转化,在管网输配过程中发生的水解、生物降解和氧化还原反应等复杂过程也可显著影响DBPs的生成和转化[2-3]。这主要表现在:一方面,管网中的物理、化学、生物反应过程高度依赖于水质条件,如溶解性有机碳(dissolved organic carbon, DOC)、温度、pH等[4-6];另一方面,管网中的无内衬铁管、铜管及其腐蚀产物也可为DBPs的进一步生成转化提供反应场所和催化介质[7-9]。管网中DBPs风险与管网的特殊环境有很大关系,其类型和时空分布较复杂。
目前,关于管网DBPs的监测指标选取、监测频率设定和监测点布设等方面尚缺乏足够的科学依据。本研究以我国北方某大城市多水源供水管网为研究对象,系统分析了管网中DBPs的浓度和相对风险,明确了指示性DBPs的种类,通过管网DBPs浓度的时空变化及其与常规水质指标的相关性分析,识别了影响管网DBPs的主要风险因素和管网风险区,并进一步提出了采样频率和采样点布设建议,以期为供水行业管网DBPs风险管控提供参考。
全文HTML
-
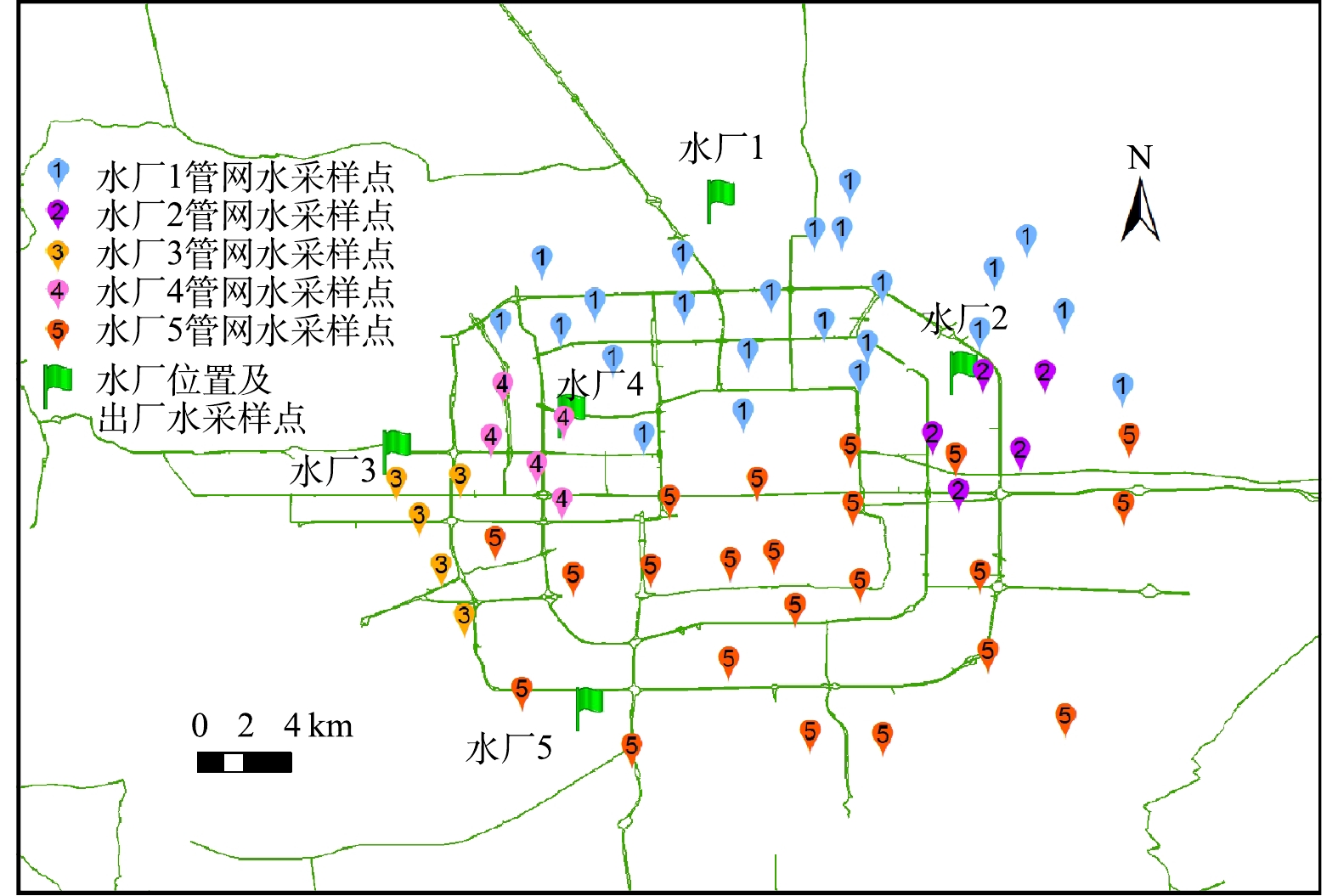
开展调研的北方某大型城市主要有5个供水厂(分别命名为“水厂1”、“水厂2”、“水厂3”、“水厂4”和“水厂5”),水源包括地表水(本地地表水和远距离调水)和地下水。调研过程中分别对各个水厂的出厂水及其供水区域的管网水进行采集,3次采样时间分别在2019年4月、8月和11月,共计175个样品。考虑到尽可能覆盖各水厂供水区域及人口密集区域,采样点以及5个水厂供水范围分布如图1所示(水厂交界处的龙头水的来源会随用水量等因素变化)。其中,水厂1、水厂3、水厂5的水源以地表水为主,水厂2的水源以地下水为主,水厂4的水源以地下水和地表水的混合水源为主。除了水厂1采用次氯酸钠和氯胺消毒以外,其余水厂均采用次氯酸钠消毒。
-
温度、pH、浊度、溶解氧(DO)、自由余氯浓度和总氯浓度均在采样现场检测。自由余氯浓度和总氯浓度采用N,N-二乙基对苯二胺分光光度法测定。耗氧量(CODMn)和氨氮根据《生活饮用水卫生标准检验方法》(GB/T 5750-2006)进行检测。
SO2−4 、Cl−、DOC测定之前,水样先经过孔径为0.45 μm聚醚砜膜过滤,然后SO2−4 和Cl−采用阴离子色谱法进行检测,DOC采用总有机碳分析仪(TOC-VCPH,岛津,日本)测定。这3个月份中,5个水厂出水的常规指标如表1所示。采样时先让龙头水流水5 min,接满5 L水样并加盖密封,尽快运至实验室取2份30 mL水样加入0.15 g抗坏血酸,过0.45 μm聚醚砜膜。卤乙酸(haloacetic acids, HAAs)和三卤甲烷(trihalomethanes, THMs)的测定参考美国环境保护署标准方法(USEPA Standard Methods 551.1和552.3)。样品前处理采用甲基叔丁基醚萃取,HAAs测定还需甲醇酸化处理。采用带电子捕获检测器的气相色谱仪(GC/ECD,GC7890B,美国安捷伦)测定。其中THMs包括三氯甲烷(trichloromethane, TCM)、二氯一溴甲烷(bromodichloromethane, DCBM)、二溴一氯甲烷(chlorodibromomethane, DBCM)和三溴甲烷(tribromomethane, TBM);HAAs包括一氯乙酸(monochloroacetic acid, MCAA)、一溴乙酸(monobromoacetic acid, MBAA)、二氯乙酸(dichloroacetic acid, DCAA)、三氯乙酸(trichloroacetic acid, TCAA)和二溴乙酸(dibromoacetic acid, DBAA)。
分析过程中进行空白样品、质量控制样品和平行样品的检测。其中,每批检测中空白样品、平行样品和质量控制样品各2个。空白样品未检出待测物质;质量控制样品与标准浓度的相对标准偏差小于10%,9种消毒副产物的平均回收率为104.3%~120.8%;平行样品的相对标准偏差在10%以下。
1.1. 采样点布设和水样采集
1.2. 水质指标和DBPs测定
-
本研究中,主要检测了出厂水和龙头水中的HAAs和THMs(国际上饮用水标准普遍采用的DBPs)。我国《生活饮用水卫生标准》(GB 5749-2006)(简称“国标”)对HAAs浓度的规定限值为:DCAA ≤50 μg·L−1,TCAA≤100 μg·L−1。国标对THMs的规定限值为:TCM≤60 μg·L−1,DCBM≤60 μg·L−1,DBCM≤100 μg·L−1,TBM≤100 μg·L−1;TCM、DCBM、DBCM和TBM检测值与相应的标准值比例之和不超过1。
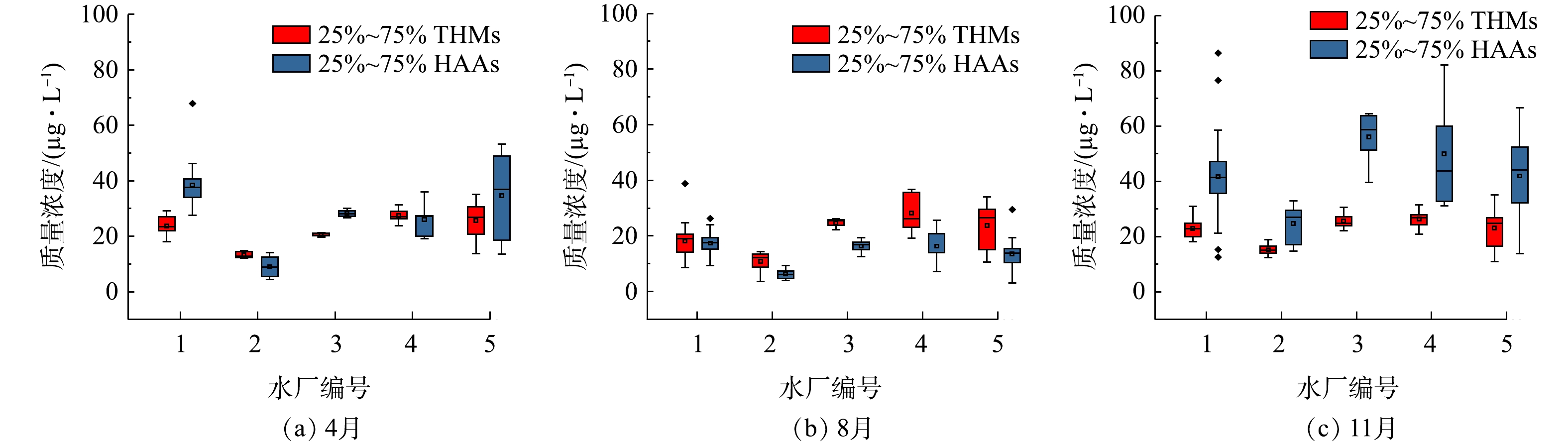
管网水中HAAs和THMs的浓度如图2所示。4月、8月和11月的总HAAs平均质量浓度分别是32.31、13.90和42.97 μg·L−1;4月、8月和11月的总THMs的平均质量浓度分别是23.38、19.77、和21.61 μg·L−1。对龙头水中各类DBPs进行达标分析发现,尽管各水厂供水范围内管网THMs和HAAs在时空分布上有明显差异,但达标率均为100%,表明该市DBPs的超标风险整体处于较低水平。
本研究依据国标中规定的THMs和HAAs质量浓度限值提出风险分级分析方法。基于国标中DBPs限值并参考相关文献,可将DBPs的超标风险分为3个等级:大于或等于现行国标限值属于一级风险;小于现行国标限值但大于现行国标限值的60%属于二级风险;小于或等于现行国标限值的60%,但大于现行国标限值的30%属于三级风险;小于或等于现行国标限值的30%属于低风险[10-11]。各DBPs的风险控制值如表2所示。
由表2可看出,有3个月份管网中的THMs质量浓度都属于三级风险以下,4月和8月管网水中DCAA和TCAA浓度均属于三级风险以下,但11月有7.5%的管网水样DCAA浓度属于二级风险。虽然调研的出厂水中消毒副产物导致的经口致癌风险和非致癌健康风险均在美国环境保护署(USEPA)规定的可接受风险水平,但HAAs的致癌风险较THMs更高[12]。
综上所述,从质量浓度水平和健康风险来看,管网中的HAAs和THMs均处于较低风险水平,但HAAs的风险高于THMs,是DBPs的主要组成成分,因此,应将HAAs作为管网指示性DBPs重点关注。
-
第2.1节中的分析表明,3个月份的管网水中THMs质量浓度变化不大,但HAAs质量浓度有较大变化。8月的龙头水中THMs质量浓度高于HAAs,而11月时HAAs质量浓度明显高于THMs。对比管网中5种HAAs的质量浓度可知,HAAs质量浓度在温度较低的11月相对较高,其中主要组分是DCAA和TCAA。HAAs的变化趋势可从两方面解释:一方面是由于夏季降雨量高,占全年的85%,导致水源水中的有机物浓度降低,8月水厂1、水厂3和水厂4的DOC均比11月低;另一方面是因为,在不增加消毒剂用量时,输配过程的高温条件会加速自由性余氯的消耗,从而减缓DBPs形成,促进DBPs(特别是HAAs)的生物降解[13]。根据所建立的超标风险等级划分标准,11月7.5%的DCAA超标风险属于二级风险,因此,应在温度较低时(水温在20 ℃以下)增加采样监测频率,以便更准确地判断风险状况。
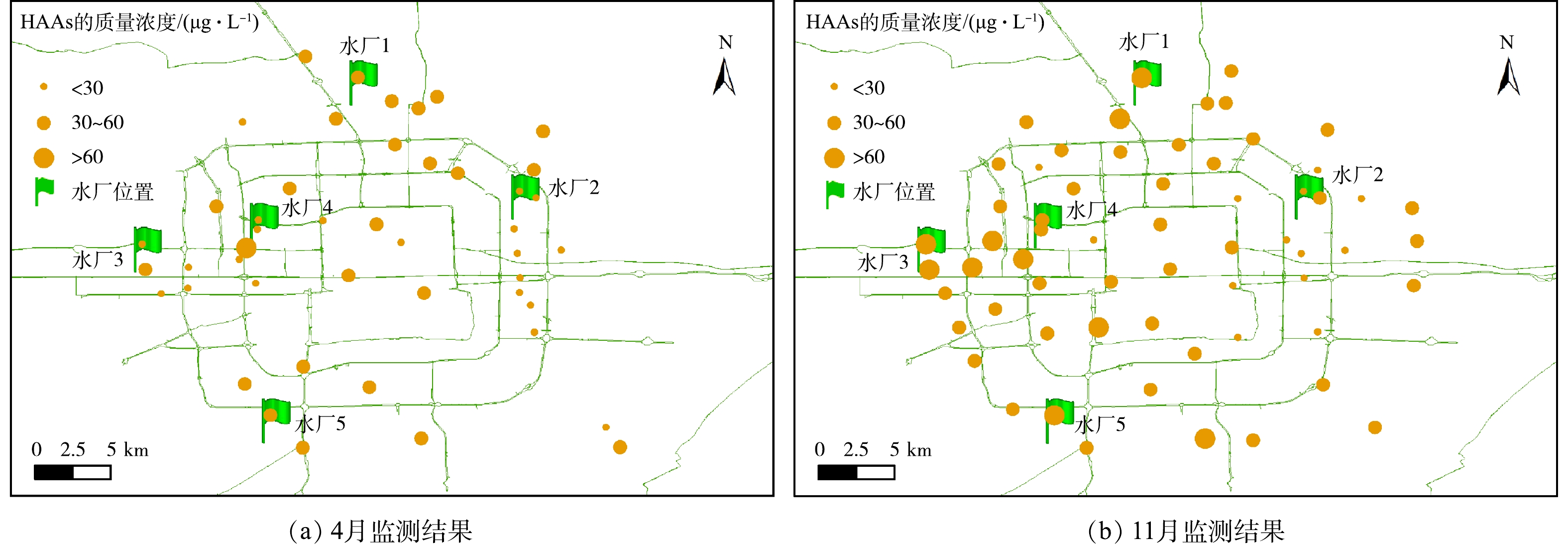
管网中的DBPs质量浓度除了随时间变化外,也随空间发生变化。图3展示了4月和11月HAAs质量浓度在管网中的分布。水厂3和水厂4的供水交叉区域中HAAs质量浓度高于这2个水厂出水中HAAs的质量浓度;4月HAAs质量浓度最高点在水厂3与水厂4的交叉区域;11月水厂3和水厂4的供水交叉区域中HAAs的质量浓度也处于较高水平;水力学分析和经验表明,这些区域是以地下水与地表水为水源的管网水混水区域。经分析还发现,11月水厂4的出厂水中DOC为2.21 mg·L−1,自由余氯质量浓度为0.82 mg·L−1,水厂3出厂水DOC为3.12 mg·L−1,自由余氯质量浓度是0.66 mg·L−1,据此可推测,当2个水厂的出水在管网中混合以后,水厂4供水中较高的自由余氯与水厂3供水中未反应完全的有机物又继续反应生成了新的HAAs。而水厂1、水厂2和水厂5的出厂水中DOC分别是2.23、0.63和1.9 mg·L−1,自由性余氯质量浓度分别是0.49、0.65和0.51 mg·L−1。由此可见,以地下水为水源的水厂2出水中自由性余氯的质量浓度低于水厂4,且其余2个地表水为水源的水厂1和水厂5出厂水DOC也低于水厂3,所以,交叉区域HAAs质量浓度升高的并不明显。因此,在环状管网地下水源与地表水源交叉区域,应避免高自由余氯与高有机物的混合导致消毒副产物的二次生成。
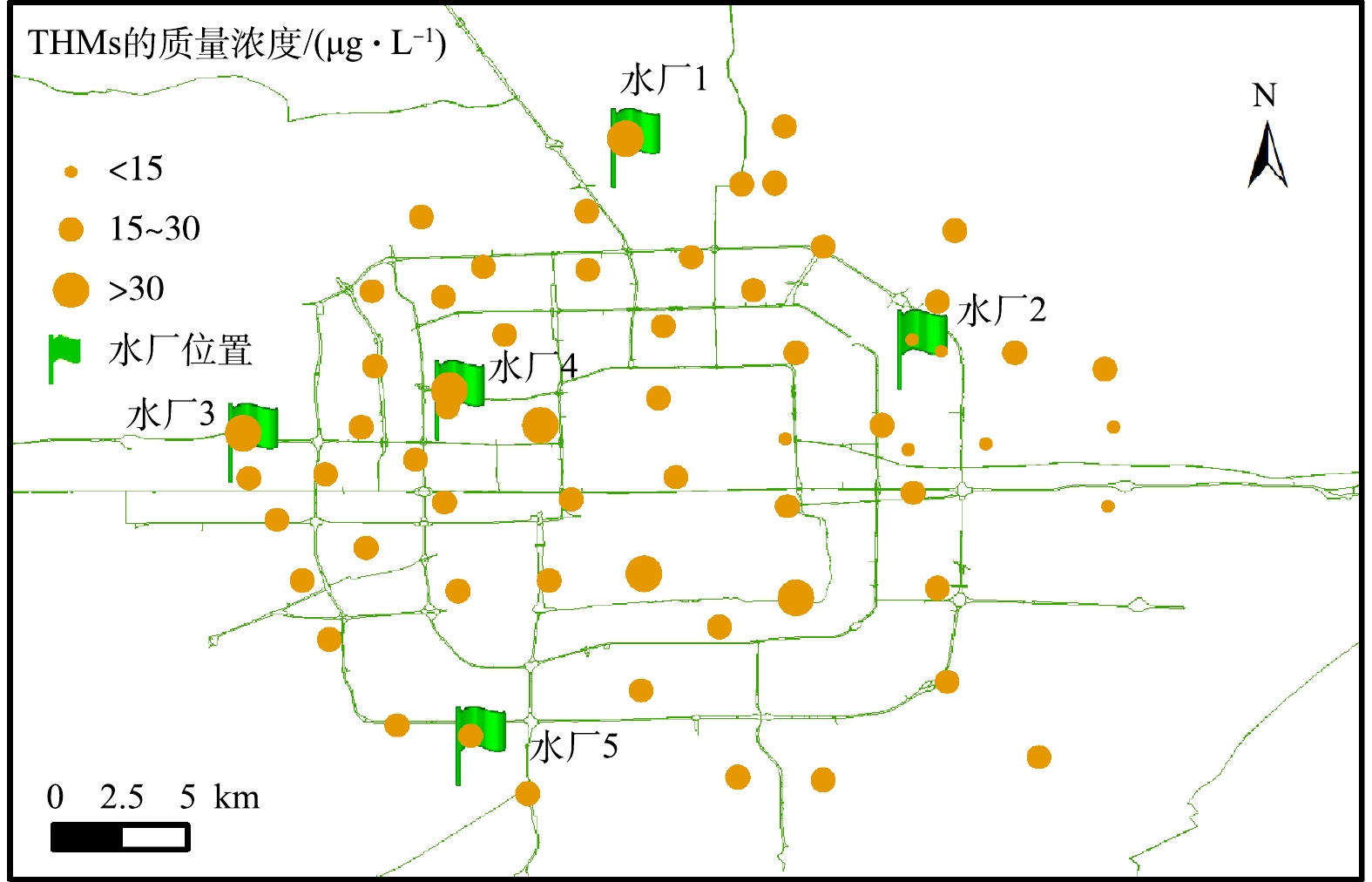
图4是11月管网中THMs的质量浓度分布。与HAAs质量浓度分布不同的是,管网THMs质量浓度较大的点多分布在离水厂较远的地方,说明这类DBPs风险区出现在管网末端,这与文献[14]报道结果一致。这可能是由于THMs在输配过程中不易转化和生物降解,随着输配距离的增加,三卤甲烷前体物与消毒剂持续反应,在管网末端其浓度不断升高。
-
针对管网HAAs比THMs风险相对较高这一情况,对主要水质指标与HAAs质量浓度进行了相关性分析。DOC、总氯和浊度都与HAAs质量浓度之间存在正相关关系,皮尔森相关系数分别为0.186、0.244和0.344,温度与HAAs之间存在显著负相关关系,皮尔森相关系数为−0.578。
HAAs浓度与DOC、温度、消毒剂之间的关系如图5所示。浓度较高的点集中在温度低于20 ℃、DOC大于1.7 mg·L−1、且总氯质量浓度高于0.6 mg·L−1的范围内。值得注意的是,该市水厂有使用自由氯和先自由氯后转氯胺2种消毒方式,而且组成总氯的化合性余氯和自由性余氯在饮用水消毒过程中产生常规DBPs的质量浓度有很大差别。相关分析结果表明,自由性余氯会比化合性余氯产生更多氯代消毒副产物,以11月温度低于20 ℃和DOC高于1.7 mg·L−1的龙头水为例,自由性余氯和化合性余氯的质量浓度与THMs和HAAs质量浓度之和相关性分别是0.513(p=0.000)和0.102(p=0.502)。图5(b)显示了11月管网水的自由性余氯和化合性余氯浓度占比情况。对比图3(b)可知,11月HAAs质量浓度较高的点与总氯质量浓度较高且以自由性余氯为主的采样点几乎重合。当HAAs质量浓度超过60 μg·L−1时,有82%的管网水中自由性余氯质量浓度超过0.5 mg·L−1。因此,风险点大部分集中在温度低于20 ℃、DOC大于1.7 mg·L−1、自由性余氯高于0.5 mg·L−1的范围内。
相关性分析结果表明,管网水浊度对DBPs也有一定影响。11月和8月管网平均浊度分别是0.20 NTU和0.26 NTU,差别不大;但比较HAAs风险点的平均浊度发现,11月平均浊度(0.35 NTU)较8月平均浊度(0.16 NTU)明显增加。这表明11月管网HAAs质量浓度的增加可能是由于沉积物释放进入水体导致浊度升高,同时,吸附在沉积物上的HAAs再次释放进入管网水中。这一现象与文献[15-18]报道的管网冲洗过程中DBPs质量浓度增高的现象一致。
2.1. 管网指示性DBPs的确定
2.2. 管网DBPs的时空变化
2.3. 影响管网DBPs质量浓度的因素
-
1)该市管网水中THMs和HAAs均处于相对较低的风险,但是HAAs的风险较THMs高,可将HAAs作为管网指示性DBPs,重点进行关注。HAAs的质量浓度与水温显著相关,当水温低于20 ℃时,应该增加DBPs的监测频率。
2)该市多水源供水管网区域的风险特征为:以地下水与地表水为水源的管网水混水区域和管网末端;水温低于20 ℃时,DOC高于1.7 mg·L−1、且自由性余氯的质量浓度高于0.5 mg·L−1的区域;存在因水力条件不稳定和存在管网沉积物而导致浊度波动较大的区域
3)建议供水行业针对管网DBPs风险分析时,应先针对管网中各类DBPs的质量浓度水平确定指示性DBPs给予重点关注;然后根据管网DBPs全年浓度变化,对浓度较高时间段进行高频率检测;同时,根据空间分布特征识别出DBPs的风险区,增加采样点的布设。




 下载:
下载: