-
在各种类型的废水排放要求中,总氮(total nitrogen,TN)通常都是一个严格管控的指标,因为过量的氮元素会引起水体的富营养化,危害人类健康和环境生态安全。废水总氮的去除主要包括氨态氮(NH4+-N)的氧化和硝酸盐态氮(NO3−-N)的还原过程,在传统的生物反硝化过程中,硝酸盐态氮的去除比氨氮的氧化更为困难[1],并且很难将氨态氮降低至足够低的水平(<1 mg·L−1)。因此,开发一种将废水中总氮处理至较低水平的技术,以实现直接排放至天然水体,具有重要意义。
去除水中硝酸盐氮的最常见处理方法是离子交换法[2]、电渗析[3]和反渗透法[4],这些方法会产生浓缩的废盐水,可能会造成二次处理问题。相比之下,电化学处理因其便利性、低投资成本和环境友好性而受到越来越多的关注,尤其是可能实现最终产物仅为无害的氮气[5]。自MONICA等[6]在1980年报道,通过电化学过程可以有效地去除与海水混合的生活废水中的氨和有机污染物,之后电化学过程就开始被广泛应用于去除各种废水中的氮元素,如制革厂、发电厂、市政及垃圾填埋场废水等。然而,电化学技术应用于天然水体的研究较少,原因是不同于电解质丰富的工业废水,天然水体的电导率普遍较低,对于含有总溶解固体小于100 mg·L−1的饮用水源,电导率仅在50~500 µS·cm−1,相当于离子强度约为0.002 5 mol·L−1,远低于大多数研究中使用的离子强度[7]。水质电导率对电催化活性有直接影响,因为其决定了回路内电子输送所需的外加电流和电解槽所需的电压[8-9],电导率越低意味着溶液电阻高,电催化效率会因此降低[10],进而导致运行成本显着增加[11]。有研究[12]表明,通过添加硫酸钠等支持电解质解决了水体电导率低的问题。然而从应用的角度来看,添加额外的药剂会导致运营成本的大幅增加,尤其是清淤尾水等大宗废水,甚至还可能导致二次污染。YANG等[13]设计了一种流通阳极膜反应器系统,利用管状Ti4O7陶瓷膜作为阳极,从低电导率(178~832 µS·cm−1)废水中去除抗生素,证明了电化学反应器通过优化结构改善传质可以高效去除低电导率水体中的污染物。实际上,电导率低的废水普遍存在,但很少有针对电导率低的真实废水进行相关动力学的研究,目前的相关研究主要集中在电极的材料选择和制备工艺的创新[14],而真正的工程实践中需要进一步评估多个因素的综合影响,尤其是关键操作参数的动力学规律,将为工程应用提供指导。
本研究针对清淤尾水总氮不达标的问题,利用除氮电解器的电化学氧化还原作用,将废水中NH4+-N和NO3−-N分别在阳极、阴极发生氧化和还原反应,生成氮气进而被脱除。首先,本研究利用极化曲线研究了泡沫铜阴极和Ti/IrO2阳极的工作电位和耐腐蚀性,然后在普通单室电解池中研究了支持电解质、电流密度和电导率对模拟废水中氨氮氧化的影响和去除动力学,对于废水电导率低的问题,通过改进电解池结构利用流动池增强传质,降低低电导率水质的欧姆压降,最后对水库坝前淤积泥水进行顺序电解处理,实现在80 min TN去除率达到95%以上。
-
实验所用溶液由硝酸钾(KNO3,≥99.0%)、氯化铵(NH4Cl,≥99.0%)、无水硫酸钠(Na2SO4,≥99.0%)和超纯水制备。所有化学品均为分析级化学品。
-
电化学测试旨在研究体系的氧化还原电位,通常通过H型电解槽中的三电极系统进行,循环伏安法(CV)或线性扫描伏安法(LSV)可用于初步评估电解液中催化剂对反应物的催化活性,例如,在硝酸盐氮存在下电流密度的增加归因于还原产物的产生。在每个对应电位下,可以根据计算获得相应的硝酸盐转化率、选择性等。因此,可以根据极化曲线选择最佳电位,从而获得最优的电化学性能,此外,不同催化剂的最佳电位应接近硝酸盐电还原的理论电位,因此可以有效避免能耗损失[15]。本实验构建的三电极体系在室温下进行,使用电化学工作站(科斯特,CS310)供应直流电,使用铂片(2 cm×2 cm)和饱和甘汞电极分别作为对电极和参比电极。阴极线性扫描伏安曲线分别在0.1 mol·L−1 Na2SO4、0.1 mol·L−1 Na2SO4+20 mmol·L−1 NO3−-N溶液中进行测试,工作电极为泡沫铜(1 cm×1 cm);阳极线性扫描伏安曲线在0.1 mol·L−1 Na2SO4和0.1 mol·L−1 Na2SO4+20 mmol·L−1 NH4+-N溶液中进行,工作电极为Ti/IrO2(1 cm×1 cm),扫描速率为10 mV·s−1。其中,阴极NO3−-N和阳极NH4+-N分别由NaNO3和(NH4)2SO4提供氮源。
电解实验使用了传统单室电解槽处理模拟废水中氨氮,获得动力学参数。单次处理量为35 mL,阳极板材料为Ti/IrO2,阴极板材料为泡沫铜,面积均为3 cm×3 cm。使用(NH4)2SO4控制溶液中氨氮的浓度,Na2SO4或NaCl溶于去离子水作为支撑电解质并控制电导率,根据天然水体的电导率范围,配置200~1 000 µS·cm−1的含氨溶液,在5~50 mA·cm−2的电流密度下进行电解,分析废水中氨、亚硝酸盐、硝酸盐、总氮的浓度变化。使用流动池处理时,阴阳极室溶液由蠕动泵进行持续输送,流量为20 mL·min−1。
水质氮元素的检测方法为:NH4+-N质量浓度采用纳氏试剂分光光度法(HJ 535-2009),NO3− -N采用紫外分光光度法(GB 3838-2002),N2含量利用元素质量守恒进行计算。
能耗(electrical energy)根据式(1)进行计算。
式中:E为能耗,kWh·m−3;U为电压,V;I为电流,A;t为反应时间,h;
C0 为初始氨氮质量浓度,g·m−3;Ct 为反应t时间氨氮的质量浓度,g·m−3;V为处理废水的体积,m−3。 -
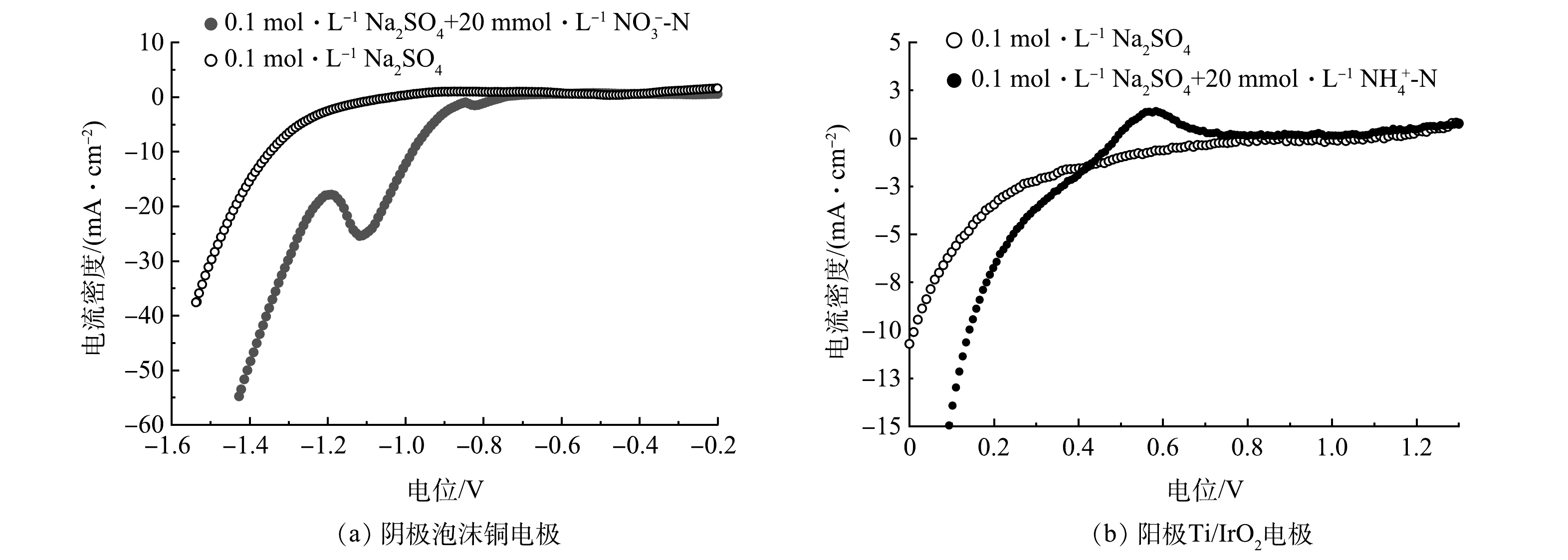
在实际的电解工艺中,通常根据实测的极化曲线来确定合适的工艺参数。如图1(a)所示,线性扫描伏安法(LSV)在泡沫铜阴极的−1.0 V(vs RHE)附近出现一个明显的还原峰,在工作电位更负于−1.0 V时,硝态氮可以被有效还原[16],而泡沫铜阴极的析氢过电位为−1.2 V,因此析氢副反应在硝酸还原反应之后发生。Ti/IrO2阳极在Na2SO4溶液中的LSV曲线如图1(b)所示,背景溶液加入NH4+-N后,在+0.6 V左右观察到明显的氧化峰,与报道的工作电位一致[17],表明在Ti/IrO2阳极的工作电位更高于+0.6 V时NH4+-N可以有效地氧化为N2。
标准情况下,阳极氨氮氧化反应如式(2)[18]所示,阴极硝酸盐态氮还原反应过程可以由式(3)表示,总反应过程如式(4)所示。
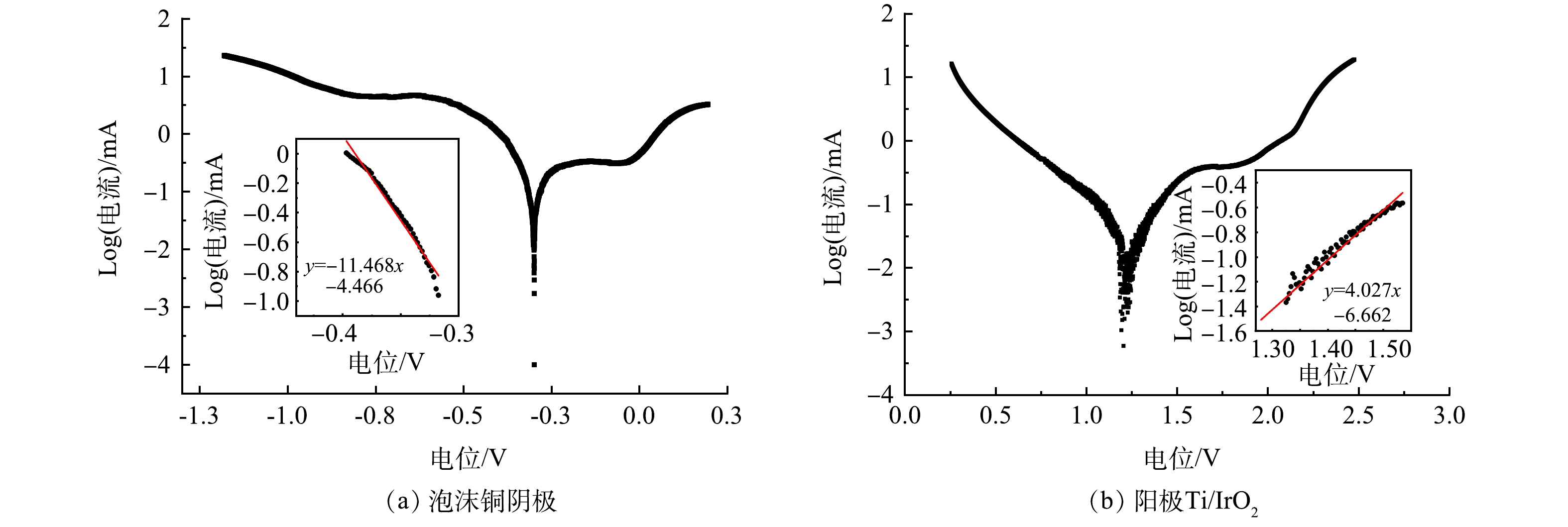
通过Tafel极化测试研究阴极泡沫铜和阳极Ti/IrO2的电化学腐蚀行为,如图2(a),泡沫铜阴极在0.1 mol·L−1 Na2SO4+20 mmol·L−1 NO3−-N溶液的阴极曲线中具有−0.40~−0.30 V的线性区域,其Tafel斜率约为11.468 mV·decade−1,如图2(b)所示,Ti/IrO2阳极在0.1 mol·L−1 Na2SO4+20 mmol·L−1 NH4+-N溶液阳极曲线中具有在1.35~1.50 V的线性区域,其Tafel斜率约为4.027 mV·decade−1。由以上动电位极化曲线中可以得到腐蚀电位和腐蚀电流的值,泡沫铜阴极和Ti/IrO2阳极的腐蚀电流分别为15.57×10−3 mA和11.73×10−3 mA,泡沫铜阴极的腐蚀电位为+0.289 V,Ti/IrO2阳极有相对高的腐蚀电位为+1.221 V,预计该组合极板在TN的电化学去除中可以有较长的使用寿命。
-
1) 支持电解质对于氨氮氧化的影响。天然水体中可能含有各种离子,对于模拟废水的支持电解质的选取,首先分别使用Na2SO4和NaCl配置等电导率的溶液,对比其对于氨氮氧化是否有影响。使用5 mA·cm−2进行恒电流电解实验,表1列出了通过2 h电化学氧化以两种钠盐作为基础电解质的除氨结果。使用Na2SO4作为支持电解质时,在低初始氨约为20 mg·L−1和不同电导率(200和400 µS·cm−1)情况下,2 h内氨浓度没有显著变化(变化幅度小于0.05%),亚硝酸盐氮(NO2−-N)和硝酸盐氮(NO3−-N)均小于氮元素的检测限值0.003 mg·L−1和0.080 mg·L−1,这可能是由于溶液中导电离子浓度较低的情况下,阳极直接氨氧化和羟基自由基间接氧化去除率太慢。在NaCl作为支持电解质氨氮浓度在同样水平的情况下,在电导率为200 µS·cm−1时,2 h内氨氮略有减少,期间产生NO3−-N和NO2−-N的浓度均较低,前者低于检测限,后者在2 h电化学氧化过程中的浓度由0变化至0.028 mg·L−1。添加NaCl增加电导率至400 µS·cm−1时,氨氮氧化速率明显提高,从原本的20.319 mg·L−1降至7.324 mg·L−1,此时的阳极氧化氨氮的机制可以理解为3种机制的共同作用,分别为:直接氧化、羟基自由基间接氧化以及Cl·/ClO·间接氧化。其中Cl·/ClO·来自于NaCl,通电2 h后溶液中63.96%的NH4+-N得以氧化,且基本以氮气的形式从溶液中脱除。Cl·/ClO·间接氧化具体的反应机制可以通过式(5)~式(8)进行解释[19]。
通过本实验可知,废水中Cl−的存在会引入由ClO·带来的额外间接氧化作用,进而大大增强氨氮的氧化。但在实际废水中,尤其是离子浓度有限的天然水体中,不一定能够提供足够的Cl−,因此,后续实验中选择Na2SO4作为支持电解质。
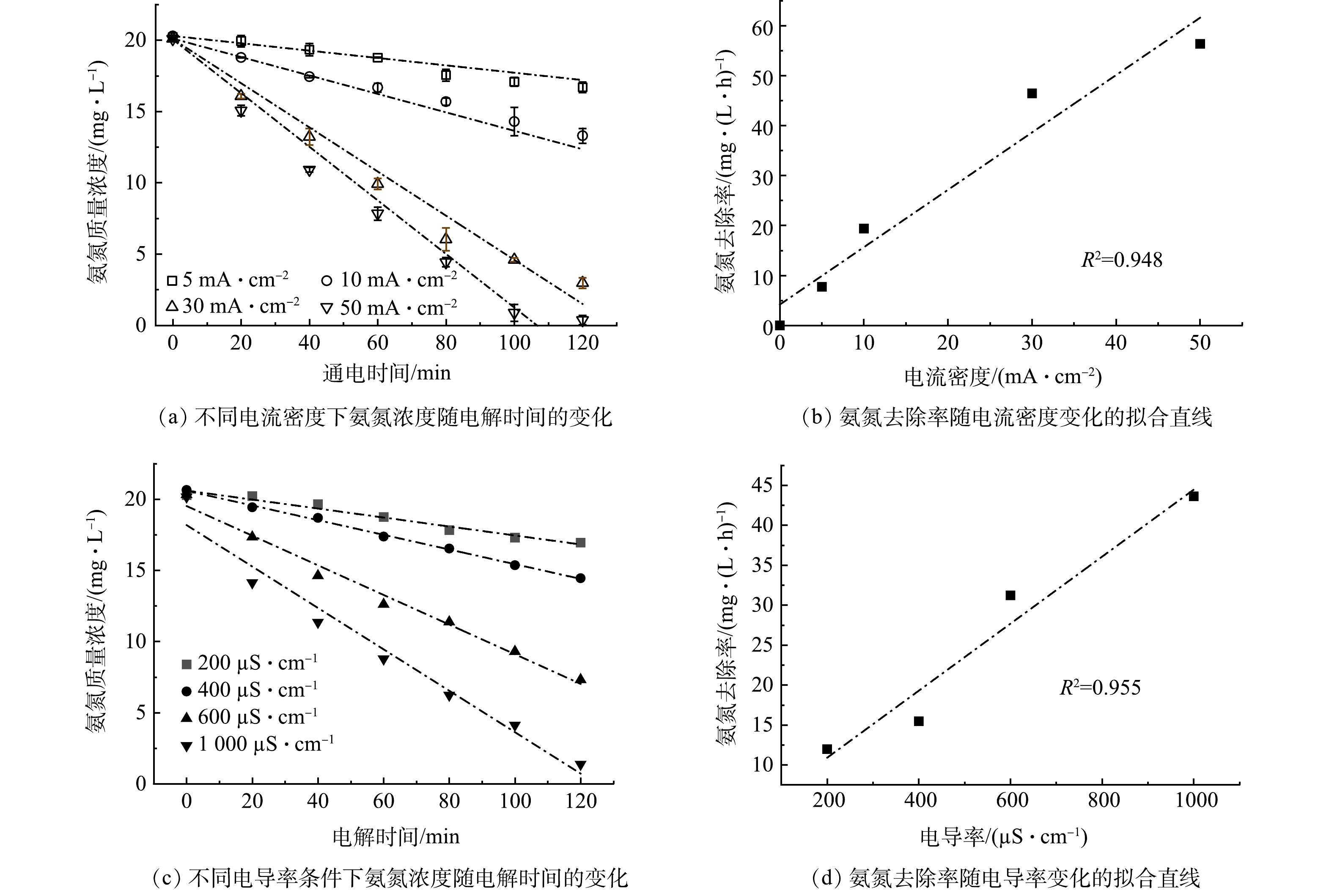
2) 电流密度、电导率对于氨氮氧化的影响。图3(a)为电导率为500 µS·cm−1模拟废水在不同电流密度处理条件下,废水中氨氮的质量浓度随时间的变化情况,图3(c)为配置的不同电导率模拟废水在施加电流密度为15 mA·cm−2时氨氮浓度随电解时间的变化情况。由图3(b)和图3(d)的拟合直线可知,氨氮氧化速率随电流密度和电导率的变化均遵循伪零级动力学过程,在其他条件不变的情况下,单独增加电流密度或废水的电导率均能够有效提升氨氮的氧化速率。
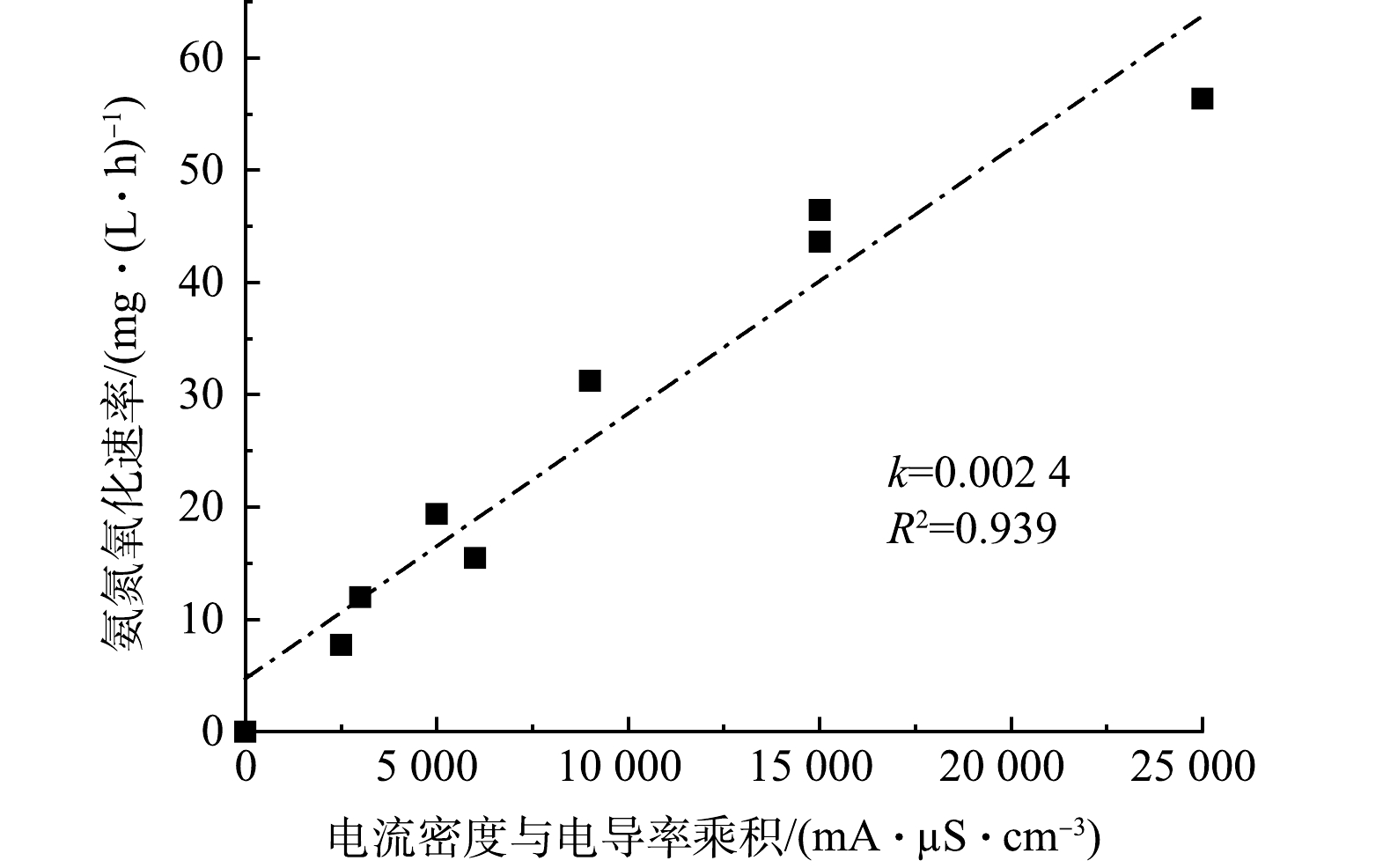
综合考虑电导率和电流密度对氨氮氧化速率的共同影响,由图4中可以看出,氨氧化速率与电导率和电流密度的乘积成正比,斜率为0.002 4,R2为0.939。因此,该影响的伪零级动力学常数如式(9)所示。
式中:σ为电导率,µS·cm−1,电导率为200~
1000 µS·cm−1;i为电流密度,mA·cm−2,模型的应用电流密度为5~50 mA·cm−2。 -
1)流动池参数优化。传统的平板电解槽由阴极和阳极两个水平并列且相通的腔室组成,电极板分别浸入至两极室内,由于结构简单、操作方便通常作为水处理的基础结构。但由于腔室结构不紧凑,浸没在废水中的电极表面会形成一个分界层[20],分界层的存在大大限制了污染物至电极板的传质过程,极大影响污染物的降解效率,更难应用于电导率低的废水。为克服传质限制,有研究通过改进电解槽构型,设计了具有电解液与极板紧密接触特征的流通式反应器。有研究[21]表明,具有高效传质的流通式反应器系统比传统电解槽系统报告的最高传质高出1~2个数量级,得益于优异的传质能力,氧化动力学能实现提高至10倍,降低90%的电能成本。SIMOES等[22]研究表明,极窄电极间隙的流通式反应器实现了传质的增强,反应速率常数比传统电解槽高2倍。GONZAGA等[23]研究表明,具有极窄电极间间隙的流通式反应器提高传质效率进而节约了污染物的降解能耗。
本研究通过改进电解池构型以减小两极板之间的间距,同时使用蠕动泵使得电解液以一定的流速缓慢经过电极表面与电极充分接触,两极室中间使用Nafion117膜使两极室分隔,分别发生还原、氧化反应,其示意图如图5所示。极板间距由改变垫片厚度进行调整,本次实验两极板距离约为8 mm。
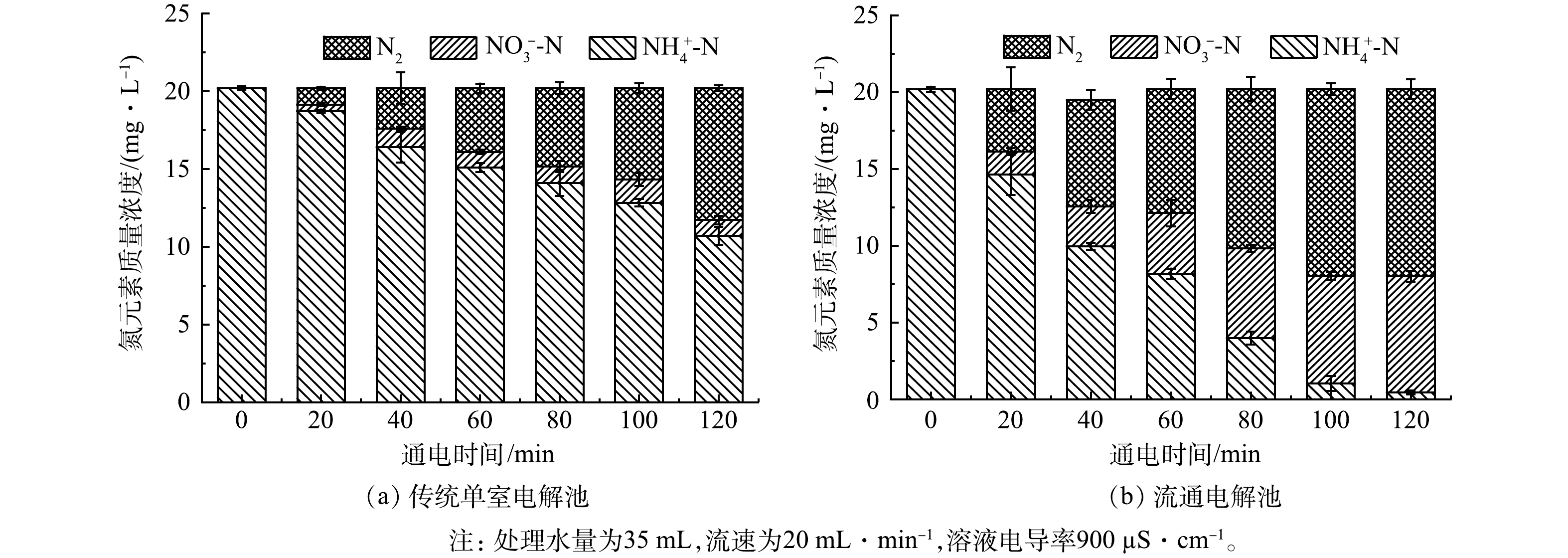
由图6可以看出,当电导率为900 µS·cm−1时,2种电解池的氨氮去除率相比于表2所列在电导率为400 µS·cm−1及以下时均有明显的提升,这也印证了上一部分电导率对于氨氮氧化速率影响的结果。但由于电解过程中废水的电导率低,普通单室电解槽的欧姆压降较大,维持恒电流电解需要很大的电压(维持30 mA·cm−2的电流密度需要电压持续在12 V以上),随之而来的是电能消耗过大,不利于实际应用。而同等条件下,流动池仅需2.17 V的峰值电压,此外,电解2 h后,单室电解槽的氨氮去除率仅在46.45%,而流动电解池氨氮去除率可达97.78%。
如表2所示,本研究所使用的流通式电解池的电能消耗仅为单室槽的16.217%(按照能耗的均值计算),同时也优于已报道的添加电解质、使用固体聚合物电解质和微流控电解工艺的平均能耗。已有研究[13]表明,添加电解质的能耗最高,每降解1个对数阶污染物能耗为6~38 kWh·m−3,微流控反应器系统和固体聚合物电解质系统的电能消耗分别为3.8~35.0 kWh·m−3和2.0~10.2 kWh·m−3。
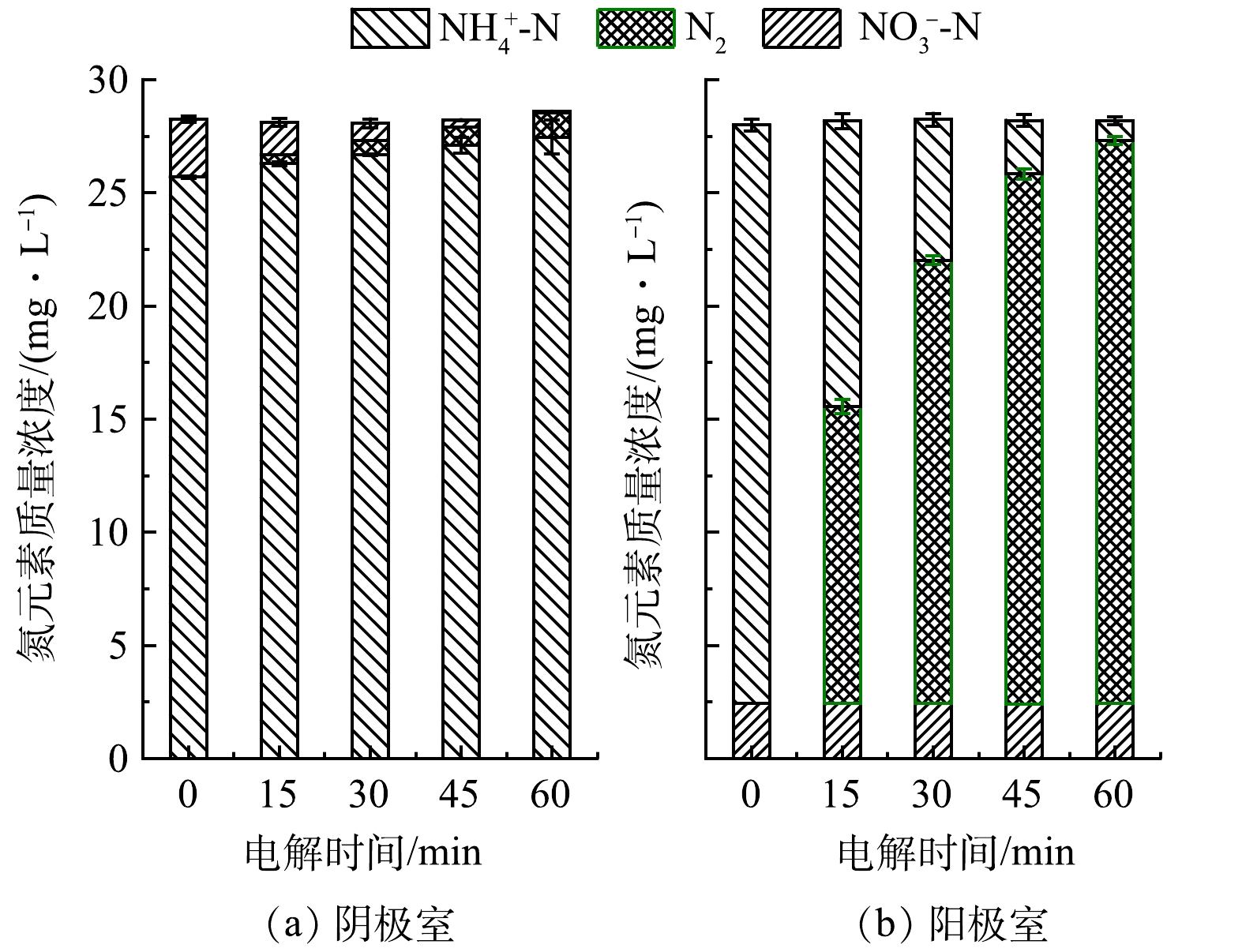
2)顺序电解法去除清淤尾水总氮。本实验废水取自宜昌天福庙水库坝前淤积处,样品为清淤泵吸取的底泥水混合物,过滤后取上清液通入电解器。样品含氨氮25.733 mg·L−1,硝酸盐态氮1.829 mg·L−1,总氮为28.174 mg·L−1,电导率为832 µS·cm−1。不同于模拟废水,真实废水往往存在氨氮和硝酸盐氮共存的现象,单独的氧化还原反应可能会产生含氮副产物,导致体系中TN去除不完全。电解过程中分别对阴阳极室出水进行氮含量测定,结果如图7所示。如图7(b)所示,在阳极室电解过程中,60 min后NH4+-N的去除率达96.63%,几乎全部转化为N2。而从图7(a)可以看出,在通电60 min内,在NO3−-N浓度降低的同时伴随着N2的增加,然而同时也观察到NH4+-N的浓度有轻微的上升,这是硝酸盐态的过度还原导致的。有研究[30]发现,废水中NO3−-N在阴极即使选择性生成主要还原产物N2,但同时仍然会有一部分NO3−-N会不可避免地被还原为NH3-N/NH4+-N(约为20%),这与本研究的实验结果一致。这种现象被称作过度还原,而过度还原产生的副产物NH4+-N仍然会积累在阴极水体中,造成TN含量不达标。
因此,本研究对比了2种电解路线,即单独电解和顺序电解。单独电解是阴、阳极室反应独立发生,顺序电解为使废水顺序通入阳极室和阴极室,依次发生NH4+-N氧化和NO3− -N还原反应,重点是利用阳极和阴极反应的协同作用,提高全局效率从而实现目标污染物的彻底去除,这一反应路线在有机废水的降解中也有报道[31]。
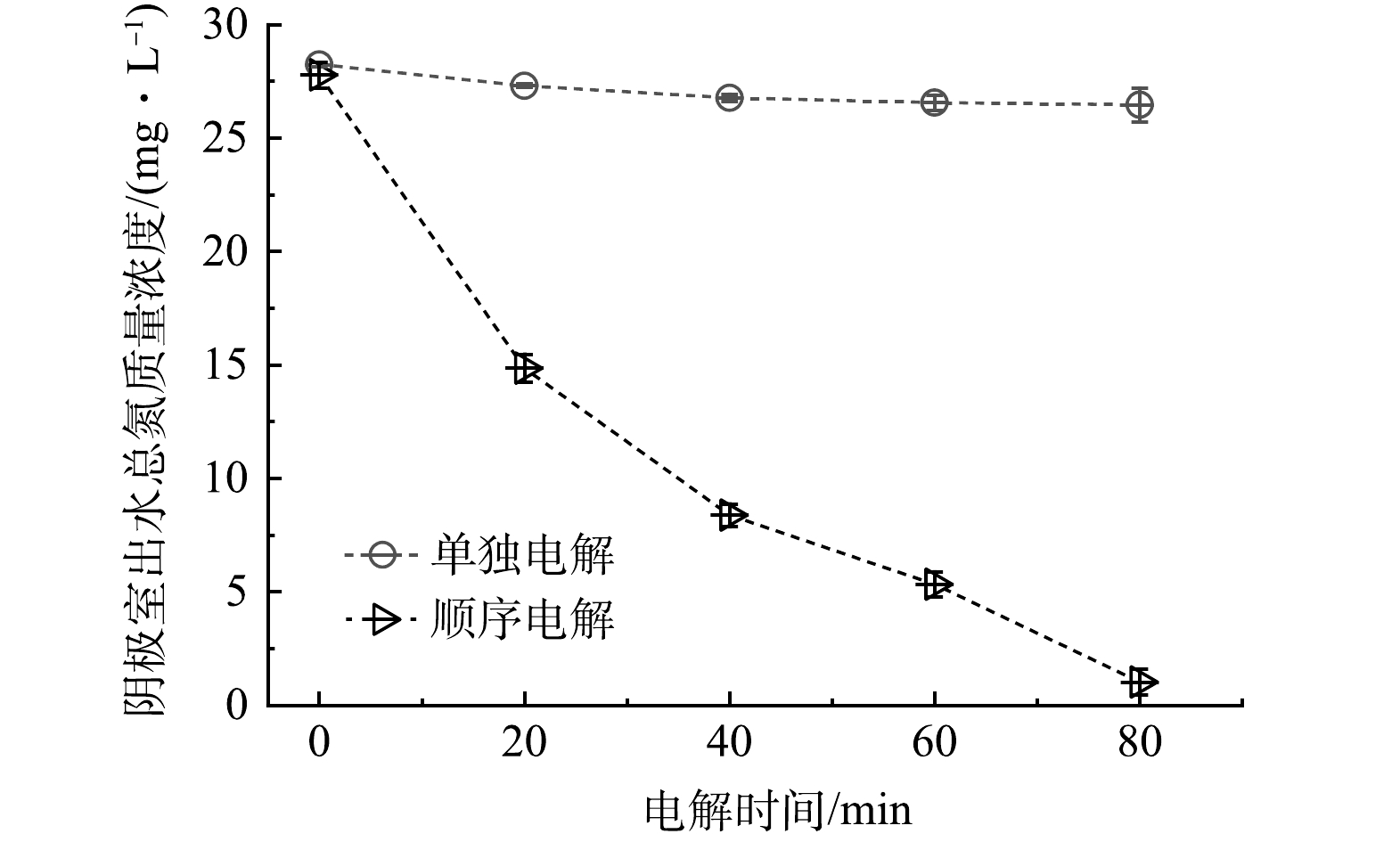
由于顺序电解的最终出水端为阴极室,因此,对2种工艺的阴极出水进行比较。如图8所示,对于单独电解而言,阴极室内脱去的总氮量非常有限。这是由于以下2点原因:首先,原废水中硝酸盐态氮的含量水平较低,其转化为氮气的量有限;其次,正如在图7(a)中讨论的,一部分硝酸盐氮还被过度还原为氨氮继续积累在废水中。相比而言,顺序电解的对于总氮的去除率可达95.33%,其作用机理为:阳极活性涂层与废水中NH4+-N反应迅速转化为N2和少量NO3−-N;阴极将少量的NO3−-N(水体中原本存在的NO3−-N加上前一步过量氧化生成的NO3−-N)还原为N2。顺序电解总氮质量浓度在80 min后降至0.919 mg·L−1,根据我国《地表水环境质量标准》(GB 3838-2002)可知处理后该水质总氮水平介于地表水Ⅲ类至Ⅱ类水质之间,远低于我国《城镇污水处理厂污染物排放标准》(GB 18918-2002)中一级A标准中规定的控制浓度。事实证明,顺序电解工艺能够将低电导率尾水中的总氮转化为氮气,该转化基于在第一阶段阳极反应中将氨氮氧化为氮气和硝酸盐态氮,并在第二阶段阴极反应中将产生的硝酸盐态氮还原成氮气。使用耦合还原和氧化处理工艺可以实现电子的最佳利用,从而节省电能消耗。然而,本研究也发现,在实验结束时,废水中总氮仍然存在少量残留,这可能是反应不彻底或反应中间产物积累所致。理论上,当溶液体系中离子的氧化/还原反应电位低于电解系统所施加的电压时,副反应的发生不可避免,实际废水中杂质离子成分和浓度复杂多样,将除氮电解器广泛应用于真实废水,还要求研究人员进一步对电化学氮循环过程中中间产物的反应途径和生成机理进行完善。
-
本研究针对低电导率清淤尾水的彻底脱氮需求,利用电化学工艺研究了NO3−-N和NH4+-N同时向N2的转化。
1)首先针对低电导率尾水进行了相关动力学的研究,发现电流密度在5~50 mA·cm−2,电导率在200~
1000 µS·cm−1时,氨氮的氧化遵循伪零级动力学,氨氧化速率与电导率和电流密度的乘积成正比,斜率为0.002 4,R2为0.939;使用模拟废水在选择支持电解质的时候发现,废水中如果存在一定的Cl−,会引入由ClO·带来的额外间接氧化作用,进而增强氨氮的氧化;2)为改善低电导率尾水电解时能耗较高的问题,本研究使用的流动电解池可以有效减少极板之间的欧姆降压、增强废水与电极之间的传质,进而使电能消耗相比于传统单室电解槽降低83.783%。
3)将废水依次通过阳极室、阴极室进行顺序电解可以有效避免单独电解导致的过度反应生成含氮副产物的现象。以湖北宜昌天福庙水库坝前淤积泥水混合物为研究对象,过滤后进行顺序电解80 min后总氮含量由28.174 mg·L−1降至0.919 mg·L−1,出水总氮和氨氮浓度远低于我国《城镇污水处理厂污染物排放标准》(GB 18918-2002)中一级A标准中规定的控制浓度,在我国《地表水环境质量标准》(GB 3838-2002)中地表水Ⅲ~Ⅱ类水质之间。
除氮电解器应用于低电导率清淤尾水的性能研究
Performance of a denitrifying electrolyzer applied to low-conductivity dredging tailwater
-
摘要: 为解决清淤尾水总氮超标的问题,本研究开发的除氮电解器使用泡沫铜电极作为阴极,Ti/IrO2作为阳极,利用电化学作用将废水中的NH4+-N和NO3−-N分别在阳极和阴极发生氧化和还原反应,最终生成氮气脱除。首先利用电化学测试极化曲线研究了阴阳两极的工作电位区间和耐腐蚀性,然后在普通单室电解池中研究了支持电解质、电流密度和电导率对模拟废水中氨氮氧化的影响和去除动力学,认为当电流密度在5~50 mA·cm−2,电导率在200~1 000 µS·cm−1时,氨氮的氧化遵循伪零级动力学。为改善低电导率尾水电解时能耗较高的问题,本研究改进电解池构型使用的流通式电解池压缩了两极板之间的间距,有效减少了欧姆降压,相比于单室电解槽每降低一个数量级的氨氮节省83.783%的能耗。最后,为解决过度反应导致副产物的问题,该研究采取了顺序电解的反应路线,并应用于真实清淤废水的处理,实现在80 min内总氮浓度由28.174 mg·L−1降至0.919 mg·L−1,去除率达到95%以上,出水总氮和氨氮浓度远低于我国《城镇污水处理厂污染物排放标准》(GB 18918-2002)中一级A标准中规定的控制浓度,介于我国《地表水环境质量标准》(GB 3838-2002)中地表水Ⅲ类至Ⅱ类水质之间。本研究证明了除氮电解器对于低电导率废水的适用性,为废水的深度脱氮提供了新的思路。Abstract: To address the over standard issue of total nitrogen in dredging tailwater, a nitrogen removal electrolyzer that employs a copper foam electrode as the cathode and Ti/IrO2 as the anode was developed in this study. This system utilizes electrochemical redox reactions to oxidize NH4+-N at the anode and reduce NO3−-N at the cathode, ultimately converting them into nitrogen gas for removal. Initially, the electrochemical polarization curves were used to investigate the working potential ranges and corrosion resistance of both electrodes. Subsequently, the effects of supporting electrolytes, current density, and conductivity on ammonia nitrogen oxidation in simulated wastewater and its removal kinetics were studied in a conventional single-chamber electrolytic cell. The results demonstrated that ammonia nitrogen oxidation followed pseudo-zero-order kinetics at the current density of 5~50 mA·cm−2 and the conductivity of 200~1 000 µS·cm−1. To mitigate the high energy consumption associated with electrolyzing tailwater of low conductivity, the electrolytic cell configuration was improved by using a flow-through electrolytic cell that compresses the distance between the two electrode plates, effectively reducing ohmic voltage drop. Compared to a single-chamber electrolytic cell, this improvement saved 83.783% of energy consumption for each order of magnitude reduction in ammonia nitrogen. Finally, to address the issue of byproducts resulting from overreaction, a "sequential electrolysis" reaction route was adopted and used to the treatment of actual dredging wastewater. Within 80 minutes, the total nitrogen concentration decreased from 28.174 mg·L−1 to 0.919 mg·L−1, achieving a removal rate of over 95%. The concentrations of total nitrogen and ammonia nitrogen in the effluent were far below the control concentrations specified in the Grade 1A standard of China's "Discharge Standard of Pollutants for Municipal Wastewater Treatment Plants" (GB 18918-2002) and fell between the water quality standards for Class III to Class II surface water in the "Environmental Quality Standards for Surface Water" (GB 3838-2002) in China. This study demonstrates the applicability of the nitrogen removal electrolyzer for low-conductivity wastewater and provides a new approach for advanced nitrogen removal from wastewater.
-
持久性和可迁移有机污染物 (persistent and mobile organic contaminants, PMOCs) 是一类人工合成的高极性有机污染物,具有在环境中降解缓慢,在水中有持久性和可迁移性的特点[1]。随着食品制造业、制药业和化工业的快速发展,越来越多的PMOCs随着生活污水和工业废水的排放进入天然水体[2]。目前,监管措施多集中在多氯联苯[3]、有机氯农药[4]这类具有环境持久性 (半衰期长达数年) 、迁移性、生物蓄积性、毒性的有机污染物 (persistent,bioaccumulative and toxic contaminants, PBT) [5],但其在水循环中迁移性较弱,趋向于在生物相和沉积物中会沉积或积聚[6]。PMOCs不仅具有PBT环境持久性的特点,还不容易吸附到土壤和沉积物的表面,在水循环中有很强的扩散能力,会影响到地表水和地下水水质,并最终威胁到饮用水源安全[7]。
目前,气相色谱-质谱联用法 (GC-MS) [8-9]和液相色谱-质谱联用法 (LC-MS) [10-11]是检测PMOCs的主要方法。其中,高效液相色谱-串联质谱技术 (HPLC-MS /MS) 凭借高灵敏度和高选择性的优势在检测极性有机物中更为常用。基于相关文献,本研究选择了17种极性高、环境排放潜力大、难降解的PMOCs作为研究对象,包括人工甜味剂、医药中间体、化工助剂等[12-13]。本研究对固相萃取条件和HPLC-MS/MS 参数进行优化,建立同时测定17种PMOCs的分析方法。在北京潮白河、广东北江和河北滹沱河进行布点采样,测定不同地区水样中的PMOCs的存在水平,旨在为我国水环境中新污染物的监管提供数据支撑。
1. 材料与方法
1.1 实验原料
本研究共购买17种PMOCs标准品,2种人工甜味剂包括安赛蜜 (ACE) 和糖精 (SAC);5种医药中间体包括金刚烷胺 (AMANT)、4-甲基氨基硫脲 (MTSC)、N-氨乙基哌嗪 (PEA)、三氟甲烷磺酸 (TFMSA)、硫酸钾酯钠 (MS);10种化工助剂包括1,3-二邻甲苯基胍 (DTG)、二苯胍 (DPG)、苄基三甲基氯化铵 (BETMA)、己内酰胺 (CAP) 、N,N-二甲基苄胺 (BDMA) 、磷酸三 (2-氯丙基) 酯 (TCPP)、对甲苯黄酰胺 (MBSA) 、二甲苯磺酸钠 (XSA)、2-丙烯酰胺基-2-甲基丙磺酸盐 (AMPSA)、双酚S (BPS)。17种PMOCs标准品 (纯度>99%)、HPLC级甲醇、乙腈、甲酸、乙酸铵和0.45 μm玻璃纤维滤膜购自上海安谱公司,Oasis HLB、Oasis MCX和Envi-18固相萃取柱分别购自美国Waters公司和Supelco公司。用甲醇配制含有待测PMOCs 2 000 mg·L−1的单标储备溶液和混标储备液,根据需要进一步配制使用液。
1.2 样品采集与前处理
依据《地表水和污水监测技术规范》 (HJ/T 91—2002) [14]和《地下水环境监测技术规范》 (HJ 164-2020) [15]分别于2022年4月 (春季,平水期) 、2022年9月 (秋季,丰水期) 采集北京市潮白河地表水和地下水,地表水样品S1和S2取自潮白河上游,S3、S4和S5取自潮白河下游,采集深度为0~1 m;地下水样品1#和2#位于一期工程间歇受水区,3#、4#和5#位于一期工程常年受水区,采集深度为30 m。2022年4月,采集广东北江韶关至佛山段10个地表水样品,采集深度为0~1 m。2022年10月,采集河北滹沱河正定至无极段10个地表水样品,采集深度为0~1 m。每个样点采集水样3 L。
水样采用SPE处理,具体流程为:用0.45 μm玻璃纤维滤膜过滤2 L水样,分别用5 mL乙腈、甲醇和超纯水活化固相萃取柱,2 L水样通过固相萃取柱富集,用10 mL的乙腈对固相萃取柱中的目标物进行洗脱处理,收集洗脱液,用无水硫酸钠脱水后经过旋转蒸发仪和氮吹仪浓缩至0.5 mL待测[16]。
1.3 色谱与质谱条件
高效液相色谱柱 (Inert Suatain C18 column,150 mm×4.6 mm,5 μm) ,进样体积10 μL,柱温40 ℃,用乙腈和含10 mmol·L−1乙酸铵的水溶液作为流动相进行梯度洗脱,0~9 min乙腈由40%升至80%,9~12 min乙腈由80%降至40%,12~15 min保持乙腈为40%平衡3 min,选用电喷雾离子源 (ESI) 和多反应监测模式 (MRM) ,雾化气和干燥器流速分别为3和15 L·min−1,去溶剂温度和加热区温度分别为250 ℃和400 ℃,17种PMOCs的质谱参数如表1 所示。
表 1 17种PMOCs的LC-MS/MS优化参数Table 1. The details of LC-MS/MS operating parameters of 17 PMOCs化合物 出峰时间/min 母离子 (m/z) 定量离子 (m/z) Q1/V CE/V Q3/V BDMA 2.548 135.70 90.90/65.00/38.95 −30 −25/-35/-54 −30/-25/-15 DTG 2.134 239.70 132.95/107.95/106.10 −30 −21/-22/-30 −14/-21/-19 TCPP 7.152 328.60 99.00/174.85/252.95 −23 −23/-13/-9 −19/-19/-29 DPG 2.145 211.60 119.00/76.95/94.00 −29 −22/-40/-21 −22/-28/-18 AMANT 2.294 151.70 135.05/78.9/77.00 −30 −18/-35/-44 −26/-28/-29 BETMA 2.293 150.90 92.05/91.00/65.10 −30 −21/-22/-38 −17/-17/-24 CAP 2.592 111.10 79.95/95.85/81.00 12 22/23/20 30/17/29 MTSC 3.421 111.90 80.05/95.90/80.90 11 22/24/19 30/17/29 PEA 1.464 111.10 79.95/96.00/81.00 11 23/23/19 30/17/30 MBSA 2.053 169.80 106.05/63.85/79.00 18 16/46/27 18/23/30 MS 3.483 111.10 79.95/96.00/81.00 12 24/23/20 30/17/28 ACE 1.488 162.00 82.00/78.05/40.00 11 13/29/28 30/30/14 XSA 1.638 185.20 80.00/121.10/118.85 12 30/22/25 30/22/21 SAC 1.499 182.00 41.90/105.85/62.00 20 36/21/23 14/19/25 AMPSA 1.504 206.00 135.00/79.95/70.00 14 22/29/25 25/30/26 TFMSA 1.987 149.00 79.90/98.80/68.90 16 23/23/31 30/17/27 BPS 2.948 249.00 107.95/92.00/155.90 17 30/36/20 20/30/16 1.4 质量控制与保证
在实验过程中利用超纯水进行空白基质加标实验 (混合溶液的浓度梯度为0、10、30、80、150、300 ng·L−1) ,基于加标回收率和5个平行样的相对标准偏差验证固相萃取前处理方法可靠性。方法检出限( LODs)和方法定量限( LOQs)分别以3倍信噪比 (S /N = 3) 和10倍信噪比 (S /N= 10) 进行计算。每批次样品均分析试剂空白;每分析一批样品至少做1个空白进行校正;仪器每12小时做1次溶剂空白,检查仪器的污染状况。
2. 结果与讨论
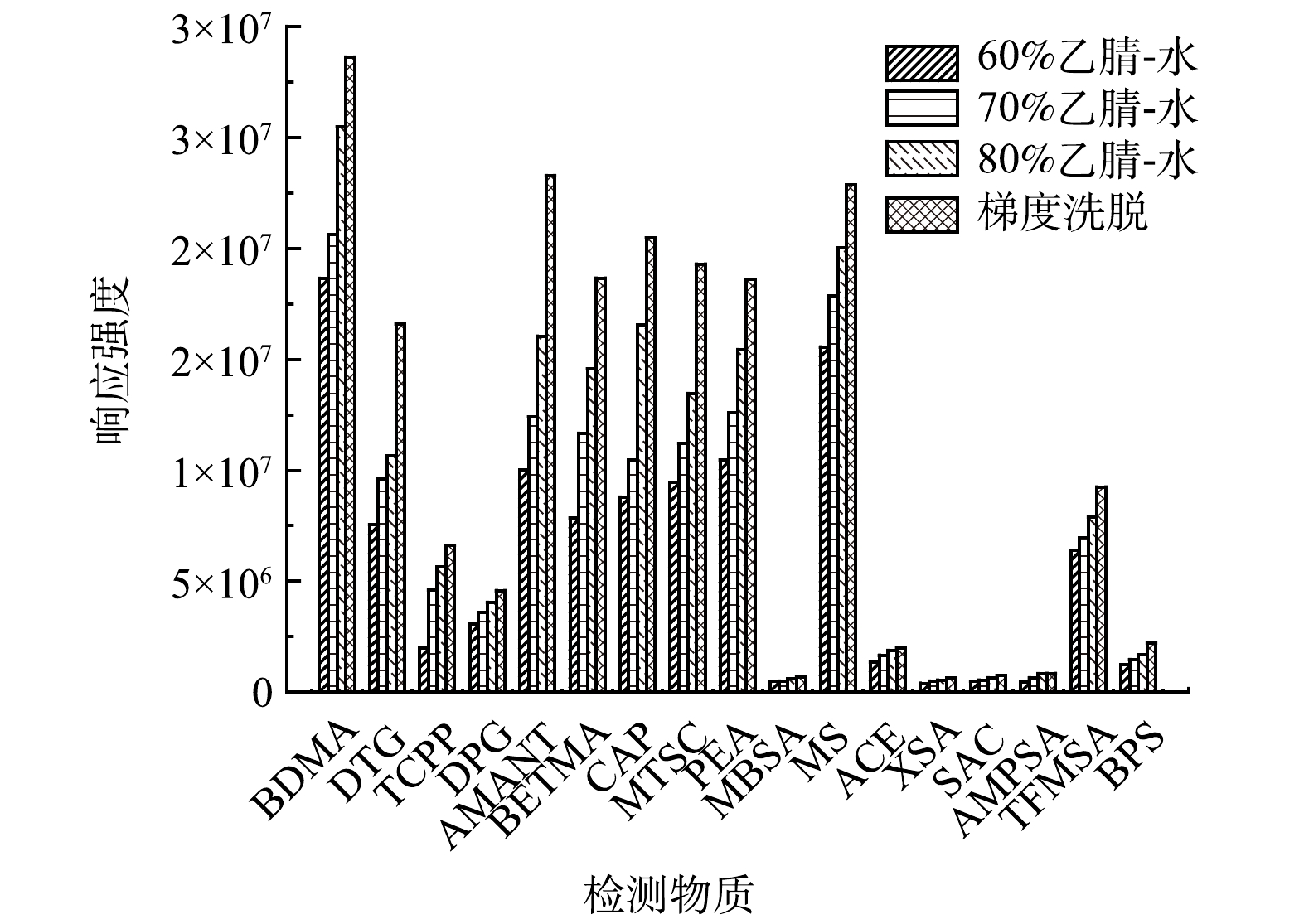
2.1 流动相体系的优化
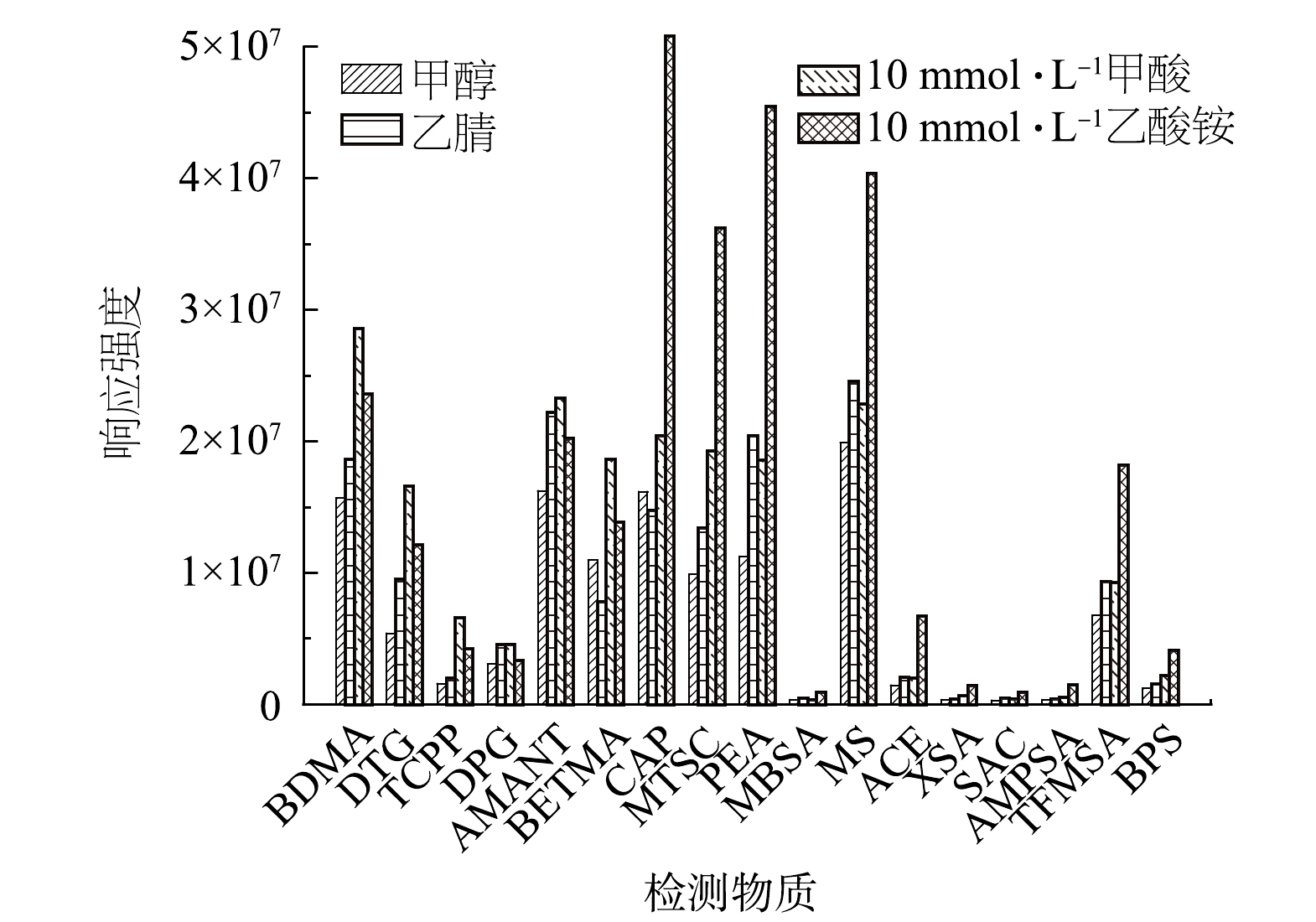
实验优化了流动相水、甲醇和乙腈的组成和比例,BETMA和CAP的响应强度在甲醇-水体系下比乙腈-水体系高28.46%和8.58%,其余的15种PMOCs在乙腈-水体系下响应强度增大18.94%~76.84%,选择乙腈-水体系作为流动相。60%、70%、80%乙腈-水等度洗脱和经过反复优化的梯度洗脱结果如图1所示, 17种PMOCs在梯度洗脱条件下的响应强度最高。HPLC-MS/MS在正离子模式下,加甲酸可以提高其响应强度[17],而在负离子模式下加乙酸铵可以提高其响应强度[18]。实验研究了含10 mmol·L−1甲酸和10 mmol·L−1乙酸铵的水溶液作为无机相分别进行梯度洗脱的效果,实验结果如图2所示,发现含10 mmol·L−1甲酸的水溶液做无机相,正离子模式下的PMOCs响应强度提高了20.04%~53.37%,负离子模式下的PMOCs相应强度降低了6.97%~33.17%。采用含10 mmol·L−1乙酸铵的水溶液作为无机相,负离子模式下的PMOCs响应强度提高12.36%~259.64%,特别是响应强度较低的MBSA、XSA、SAC和AMPSA,增加10 mmol·L−1乙酸铵后,其响应强度提高了94.39%~259.27%。正离子模式下的4种PMOCs响应强度只降低8.77%~23.29%,因此,有机相选择乙腈,无机相选择含10 mmol·L−1乙酸铵的水溶液作为流动相进行检测。
2.2 样品前处理方法的优化
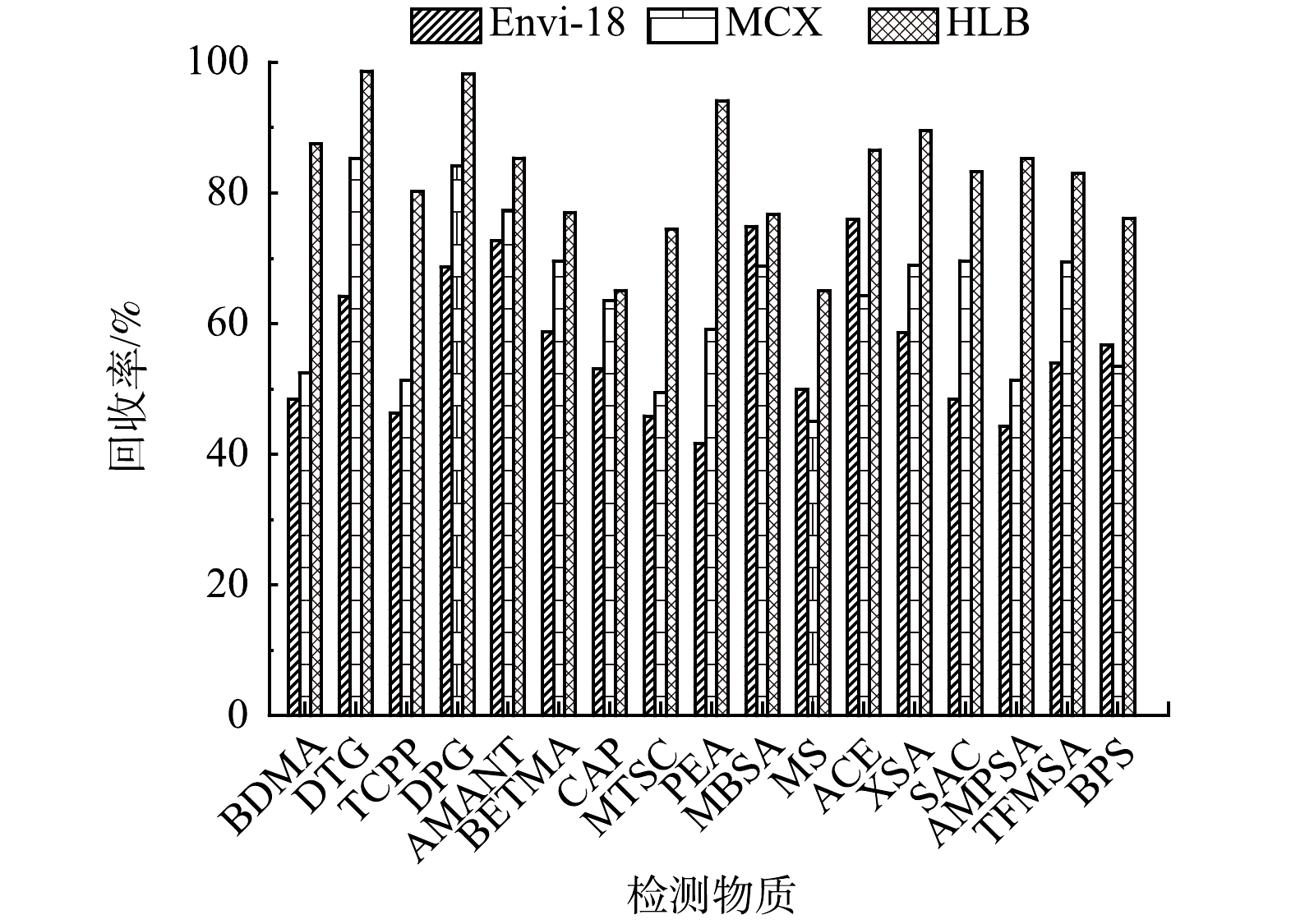
常用的固相萃取柱有Oasis WCX、Oasis HLB、Oasis MCX、Envi-18等[19]。HLB柱含有特定比例的亲水基和疏水基,使其适合提取多种极性的分析物[20]。MCX具有反相和阳离子交换双重保留性能,对碱性化合物有良好的保留能力[21]。Envi-18含碳量大于17%,是一种较为通用的固相萃取柱。比较了Envi-18、MCX和HLB对PMOCs的富集效果。3种固相萃取柱的富集效果如图3所示,HLB柱、MCX柱和Envi-18柱对PMOCs的萃取的回收率分别为76.14%~98.65%、45.03%~85.31%和41.69%~75.92%,故实验中水样固相萃取选择HLB柱。
2.3 方法验证
方法回收率、相对标准偏差 (RSD) 、相关系数R2、检出限 (LODs,S/N=3) 和定量限 (LOQs,S/N=10) ,结果如表2所示:17种PMOCs相关系数均大于0.99,方法检出限为0.04~0.35 ng·L−1,定量限为0.13~1.16 ng·L−1,回收率为65.01%~98.65%,RSD为3.6%~8.9%。MONTES等[22]采用混合模式固相萃取法-液相色谱-串联质谱法检测了西班牙地表水中23种PMOCs,该方法的检出限为0.02~18 ng·L−1,定量限为0.1~60 ng·L−1,回收率为60%~107%。干志伟等[23]采用固相萃取-液相色谱-串联质谱法同时测定水中7种人工甜味剂,该方法定量限为0.1~6 ng·L−1,回收率为82.4%~93.5%。上述方法的回收率与定量限与本研究方法相近。
表 2 17种PMOCs的回收率、相对标准偏差、线性相关系数及检测限Table 2. Recovery rate, RSD, correlation coefficients, detection limit of 17 PMOCs化合物 回收率/% RSD/% 相关系数R2 检出限/(ng·L-1) 定量限/(ng·L-1) BDMA 87.49 4.8 0.998 0.09 0.29 DTG 98.65 8.8 0.999 0.08 0.27 TCPP 80.21 7.1 0.996 0.13 0.43 DPG 98.24 6.1 0.998 0.21 0.69 AMANT 85.32 3.6 0.995 0.12 0.39 BETMA 76.98 8.7 0.999 0.18 0.59 CAP 65.05 5.1 0.995 0.04 0.13 MTSC 74.40 4.9 0.998 0.12 0.39 PEA 94.10 7.5 0.998 0.15 0.49 MBSA 76.73 6.2 0.994 0.31 1.02 MS 65.01 6.1 0.995 0.11 0.36 ACE 86.58 5.4 0.998 0.26 0.86 XSA 89.50 5.6 0.993 0.35 1.16 SAC 83.21 7.6 0.996 0.24 0.79 AMPSA 85.21 8.9 0.995 0.33 1.09 TFMSA 82.99 7.7 0.998 0.17 0.56 BPS 76.12 3.6 0.996 0.16 0.53 2.4 国内不同地区水体中PMOCs的检测
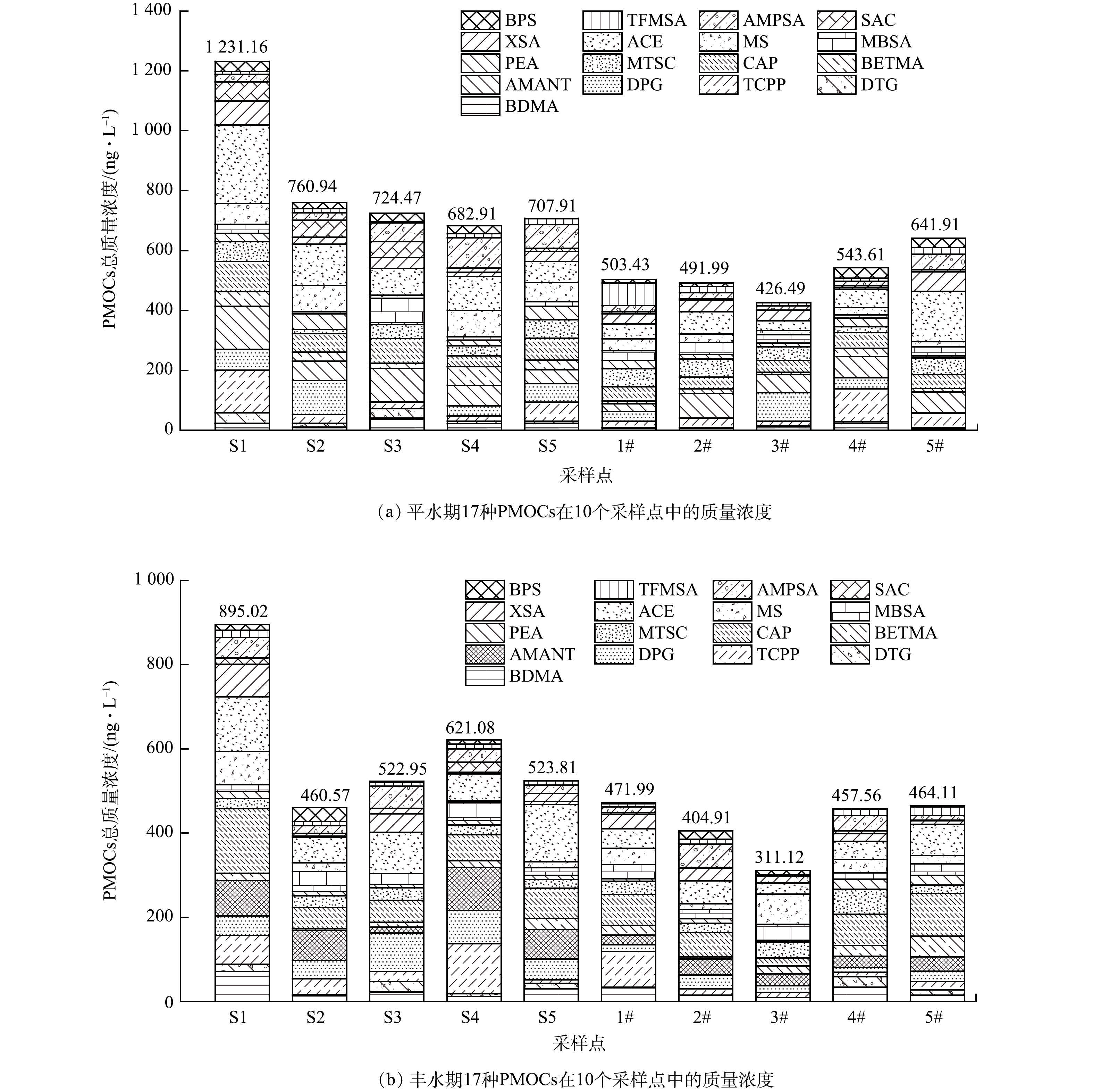
1) 北京潮白河地表水和地下水中PMOCs的检测。潮白河平水期和丰水期水样中PMOCs的检测结果如表3和表4所示,17种PMOCs在地下水和地表水中均有检出,地表水质量浓度范围为ND~261.75 ng·L−1,地下水质量浓度范围为ND~109.69 ng·L−1。地表水中安赛蜜 (ACE) 、金刚烷胺 (AMANT) 和己内酰胺 (CAP) 的质量浓度相对较高,分别为59.78~261.75、13.37~143.84和36.56~153.71 ng·L−1。地下水中安赛蜜 (ACE)、金刚烷胺 (AMANT) 和磷酸三 (2-氯丙基) 酯 (TCPP) 的质量浓度相对较高,分别为25.61~168.11、22.41~70.58和10.61~109.69 ng·L−1。ACE是常用的人工甜味剂,广泛应用于食品、药物和个人护理品。ACE在污水处理厂中去除效果差,并且在环境中难以被吸附或降解[24-25]。AMANT是一种抗病毒药物,可直接或间接引起生物体神经损伤[26]。AMANT由于价格低廉,大量用于养殖业,在生物体中多以原药形式排入外界环境,对环境中的动植物等产生一定的影响[27]。CAP在化工领域的应用极为广泛,因其具有良好的水溶性且具有毒性,中国、美国、欧盟等均将其列入常规监测和优先监测的污染物名单[28]。TCPP作为增塑剂和阻燃剂在聚氨酯泡沫、PVC、纺织品中使用,相关研究表明TCPP具有神经毒性、内分泌干扰性、基因突变性和致癌等多种危害[29]。
表 3 平水期17种PMOCs在10个采样点中的质量浓度Table 3. Mass concentrations of 17 kinds of PMOCs in 10 sampling points in flat water period化合物 地表水质量浓度 /(ng·L−1) 地下水质量浓度 /(ng·L−1) S1 S2 S3 S4 S5 1# 2# 3# 4# 5# BDMA 23.32 11.22 41.03 22.64 23.44 6.97 7.84 14.56 22.46 5.16 DTG 34.56 12.81 31.27 8.19 6.76 2.57 1.65 ND 6.31 5.22 TCPP 143.34 28.77 21.47 17.64 64.64 21.71 31.47 35.85 109.69 45.61 DPG 68.79 113.62 1.70 32.42 61.22 31.79 ND 95.11 36.72 2.98 AMANT 143.84 64.69 111.17 68.97 45.66 25.33 81.70 60.46 70.58 68.84 BETMA 48.82 30.71 18.15 62.59 33.02 9.67 16.11 8.08 28.53 11.88 CAP 101.82 61.26 81.11 36.56 73.27 47.36 39.68 39.58 51.76 46.16 MTSC 64.88 13.41 46.99 33.11 60.55 60.49 59.75 45.66 19.99 55.51 PEA 28.11 52.84 7.41 17.89 45.43 27.34 14.99 11.61 28.17 6.66 MBSA 30.56 6.98 80.56 12.43 14.69 33.36 40.12 28.64 10.82 29.99 MS 69.75 88.29 10.35 87.57 64.73 38.49 27.86 13.49 24.55 17.97 ACE 261.75 137.13 89.38 113.13 69.94 50.24 73.87 32.29 59.74 168.11 XSA 79.45 23.09 35.31 14.29 34.59 33.51 39.81 36.64 7.05 65.09 SAC 63.71 57.21 53.48 14.38 9.60 7.45 4.4 ND 6.02 6.63 AMPSA 25.36 24.08 63.29 100.48 79.66 20.59 20.59 12.90 15.10 52.32 TFMSA 10.29 14.35 3.16 14.26 18.65 74.65 20.66 11.62 10.36 21.24 BPS 33.41 20.52 28.63 26.36 2.06 11.91 11.49 ND 35.76 32.53 ƩPMOCs 1 231.76 760.94 724.47 682.91 707.91 503.43 491.99 446.49 543.61 641.91 注:ND表示未检出。 表 4 丰水期17种PMOCs在10个采样点中的质量浓度Table 4. Mass concentrations of 17 kinds of PMOCs in 10 sampling points in abundant water period化合物 地表水质量浓度/(ng·L−1) 地下水质量浓度/(ng·L−1) S1 S2 S3 S4 S5 1# 2# 3# 4# 5# BDMA 71.23 13.81 22.81 11.77 29.83 32.87 14.07 9.26 34.12 14.96 DTG 17.10 3.29 24.43 6.97 13.67 1.71 1.13 ND 24.65 12.34 TCPP 68.94 36.69 23.82 118.8 8.16 84.53 14.93 12.56 10.61 20.26 DPG 45.91 43.93 91.85 79.25 49.49 15.88 33.27 15.18 11.94 24.58 AMANT 83.84 71.14 13.37 102.18 69.88 22.41 37.23 28.22 26.05 34.21 BETMA 17.42 3.94 11.64 15.80 26.45 23.93 5.39 19.09 25.61 49.03 CAP 153.71 49.94 52.43 61.60 72.01 73.35 57.15 19.38 73.88 101.14 MTSC 23.55 27.84 30.13 22.55 20.07 30.75 22.68 37.84 60.30 19.87 PEA 17.42 10.26 7.52 11.43 9.77 6.24 10.57 3.52 23.25 23.30 MBSA 15.56 48.11 25.82 42.79 18.76 33.42 22.41 38.5 15.08 26.86 MS 79.77 20.65 ND 3.77 13.53 38.69 12.79 71.97 32.11 20.62 ACE 128.72 59.78 98.09 63.61 135.94 46.32 54.75 25.61 42.41 73.37 XSA 77.48 3.25 44.16 3.61 7.72 34.16 30.9 ND 18.65 8.19 SAC 15.46 6.82 12.94 24.16 19.16 4.02 1.76 ND 6.53 2.26 AMPSA 48.70 18.23 52.42 31.02 19.93 13.79 54.72 16.08 36.42 10.20 TFMSA 17.09 9.21 8.26 11.97 9.44 7.43 11.48 3.11 14.55 20.74 BPS 13.13 33.68 3.31 9.82 ND 2.49 19.68 10.81 1.41 2.17 ƩPMOCs 895.03 460.57 522.95 621.08 523.81 471.99 404.91 311.12 457.56 464.11 注:ND表示未检出。 17种PMOCs的时空分布如图4所示,2022年4月地表水ƩPMOCs的质量浓度范围为682.91~1 231.76 ng·L−1,地下水ƩPMOCs的质量浓度范围为446.49~641.91 ng·L−1;2020年9月地表水ƩPMOCs的质量浓度范围为522.95~895.02 ng·L−1,地下水ƩPMOCs的质量浓度范围为311.12~471.99 ng·L−1。PMOCs在地表水中的质量浓度高于地下水中的浓度,这可能是污染物在向地下水迁移的过程中,由于土壤的吸附作用、微生物的生物降解以及污染物在地下水中产生的弥散作用导致地下水中PMOCs的质量浓度减少[30-31] 。潮白河地表水上游S1样点PMOCs质量浓度明显高于地表水其它采样点。5个地下水样点中PMOCs质量浓度相差没有地表水明显,3#样点在减河和潮白河交汇处下游,减河补水稀释作用可能导致此点PMOCs质量浓度低于其它几个样点,4号和5号样点上游存在俸伯桥和彩虹桥排污口,可能导致PMOCs质量浓度有所上升。地表水和地下水在4月份 (平水期) 的PMOCs质量浓度高于9月份 (丰水期) 的PMOCs质量浓度。北京属于典型的暖温带半湿润半干旱季风气候,夏季高温多雨,冬季寒冷干燥,春、秋短促,9月份降水多于4月份,雨水稀释作用可能是9月份PMOCs质量浓度较低的原因。
2) 广东北江地表水中PMOCs的检测。北江水样中PMOCs的检测结果见表5,17种PMOCs均有检出,其质量浓度范围为0.83~444.46 ng·L−1。ƩPMOCs质量浓度最高的采样点为 B01,其质量浓度为1 476.21 ng·L−1。北江中安赛蜜 (ACE) 、磷酸三 (2-氯丙基) 酯 (TCPP) 和己内酰胺 (CAP) 的质量浓度相对较高,分别为60.49~433.14、17.76~444.46和41.68~108.76 ng·L−1。
表 5 北江中PMOCs在10个采样点中的质量浓度Table 5. Mass concentrations of 17 kinds of PMOCs in 10 sampling points in the Beijiang Riverng·L−1 化合物 B01 B02 B03 B04 B05 B06 B07 B08 B09 B10 BDMA 60.65 81.75 52.21 105.47 44.18 60.49 31.53 54.76 20.91 39.72 DTG 21.43 38.15 21.69 17.51 11.97 7.97 9.19 4.19 17.72 7.73 TCPP 444.46 120.06 37.87 57.93 152.75 27.73 17.76 43.50 25.20 72.15 DPG 10.58 23.42 18.97 114.19 3.36 17.87 1.65 31.81 51.42 7.72 AMANT 55.81 25.93 10.42 16.22 10.81 44.99 18.80 36.07 48.21 14.26 BETMA 23.99 79.06 69.55 78.31 27.46 78.42 32.29 30.34 62.82 53.16 CAP 79.44 99.71 96.62 198.76 47.09 41.68 57.76 49.69 64.96 78.87 MTSC 64.84 46.47 31.28 21.37 36.35 30.78 25.32 29.07 43.82 33.06 PEA 6.16 7.37 5.09 7.42 4.23 5.92 7.53 5.96 27.36 8.35 MBSA 38.13 10.63 28.44 18.10 47.27 10.27 9.46 32.28 10.16 8.45 MS 17.16 28.96 18.74 7.48 13.68 20.90 13.15 12.25 26.36 17.62 ACE 433.14 134.13 127.47 26.50 217.85 99.06 270.24 123.51 233.37 60.49 XSA 130.85 38.70 33.05 26.76 20.93 84.65 27.15 24.41 29.34 23.86 SAC 31.70 22.65 15.90 13.74 14.09 6.19 5.65 7.32 9.35 4.54 AMPSA 20.47 18.34 41.14 27.86 35.04 34.71 29.25 58.86 111.40 64.94 TFMSA 36.09 17.65 4.62 16.71 5.14 16.41 6.73 25.37 24.74 7.14 BPS 1.31 1.28 3.41 6.65 2.09 0.83 1.16 0.93 27.59 1.72 ƩPMOCs 1 476.21 794.26 616.47 760.98 694.29 588.87 564.62 570.32 834.73 503.78 注:ND表示未检出。 3) 河北滹沱河地表水中PMOCs的检测。河北滹沱河水样中PMOCs的检测结果见表6,17种PMOCs均有检出,其质量浓度范围为ND~218.10 ng·L−1。ƩPMOCs质量浓度最高的采样点为 H06,其质量浓度为824.11 ng·L−1。滹沱河中金刚烷胺 (AMANT) 、己内酰胺 (CAP) 和磷酸三 (2-氯丙基) 酯 (TCPP) 的质量浓度较高,分别为4.36~218.10、14.33~101.14和11.82~222.60 ng·L−1。
表 6 滹沱河中PMOCs在10个采样点中的质量浓度Table 6. Mass concentrations of 17 kinds of PMOCs in 10 sampling points in the Hutuo Riverng·L−1 化合物 H01 H02 H03 H04 H05 H06 H07 H08 H09 H10 BDMA 11.19 24.74 71.31 31.78 60.38 77.03 28.32 38.08 52.41 35.06 DTG 0.95 1.52 1.27 3.13 13.40 24.80 49.03 3.85 4.84 9.29 TCPP 19.27 222.60 11.82 21.12 77.13 43.66 70.52 20.44 30.51 20.53 DPG 2.04 3.46 47.20 8.18 35.09 14.07 22.06 22.92 94.93 29.86 AMANT 4.36 11.63 14.15 9.72 140.59 218.10 171.78 24.64 69.36 13.86 BETMA 8.07 19.18 9.48 3.84 14.78 54.57 87.63 2.28 159.80 31.46 CAP 73.88 14.33 89.86 141.14 43.80 38.76 53.71 46.21 60.41 73.35 MTSC 17.89 10.28 6.51 4.78 11.59 9.95 23.37 11.08 5.48 2.54 PEA 4.44 9.84 8.93 7.16 11.81 6.83 7.48 4.86 4.05 3.69 MBSA 16.19 19.55 63.20 29.95 4.04 16.76 25.10 89.73 63.49 51.13 MS 2.08 39.42 32.02 33.96 13.87 9.19 24.23 40.88 48.69 18.46 ACE 61.97 6.46 51.61 18.33 86.07 241.16 20.50 24.68 6.89 9.67 XSA 12.67 2.56 5.11 7.24 10.88 43.09 37.60 3.64 6.28 11.35 SAC ND 9.13 1.05 3.93 22.44 2.43 6.13 0.73 0.88 1.18 AMPSA 26.04 55.74 40.45 26.16 41.12 11.33 35.13 17.37 54.92 60.66 TFMSA 3.09 9.19 8.03 6.26 10.21 6.26 6.94 4.06 3.48 3.76 BPS ND 1.16 1.05 1.14 5.35 6.12 4.46 1.31 4.23 1.36 ƩPMOCs 264.13 460.79 463.05 357.82 602.55 824.11 673.99 356.76 670.65 377.21 注:ND表示未检出。 4) 国内外水体中PMOCs存在水平对比。17种PMOCs在潮白河、北江和滹沱河中均有检出,其ƩPMOCs平均质量浓度分别为604.69、740.45和505.11 ng·L−1,北江ƩPMOCs平均质量浓度高于潮白河和滹沱河,其原因可能是北江流域有许多的化工生产企业,而潮白河和滹沱河属于生态涵养区,PMOCs排放源较少。虽然国内关于水体中PMOCs作为一大类物质进行检测还没有相关的文献报道,但是部分研究人员对水体中一些属于PMOCs的物质进行了检测。
桂建业等[24]采用离子色谱-串联质谱法在石家庄地表水中检测到安赛蜜 (ACE) 的质量浓度为32.2~955.1 ng·L−1,地下水中的质量浓度为5.9~92.5 ng·L−1。JIN等[32]采用超高效液相色谱-串联质谱法在太湖、辽河和浑河检测的双酚S (BPS) 质量浓度分别为0.28~37、0.22~52和0.61~46 ng·L−1。李栋等[33]采用液相色谱-质谱联用法在长江南京段水源水中检测到磷酸三 (2-氯丙基) 酯 (TCPP) 的质量浓度为6.02~318.23 ng·L−1。上述三种PMOCs检出质量浓度与本研究水体浓度相近。
水体中PMOCs污染现状系统性的研究主要集中在欧洲。BUERGE等[34] 采用固相萃取法-液相色谱-串联质谱联用法检测到瑞士地表水中ACE质量浓度高达4 700 ng·L−1,地下水中ACE质量浓度为20~2 600 ng·L−1。MONTES等[22]采用混合模式固相萃取法-液相色谱-串联质谱法检测了西班牙地表水中PMOCs,其中糖精 (SAC) 质量浓度为77~7 707 ng·L−1,二甲苯磺酸钠 (XSA) 质量浓度为11~1 767 ng·L−1。SCHULZ等[35] 采用混合模式液相色谱-质谱联用法在德国、西班牙和荷兰各类水体中检出了43种典型PMOCs, 其中苄基三甲基氯化铵 (BETMA) 质量浓度高达400 ng·L−1。潮白河、北江和滹沱河地表水中SAC质量浓度分别为9.60~63.71、4.54~31.70和ND~22.44 ng·L−1,XSA质量浓度分别为14.29~79.45、20.93~130.85和3.64~43.09 ng·L−1,BETMA质量浓度分别为18.15~62.59、 23.99~79.06和2.28~159.80 ng·L−1。欧洲水体中ACE、SAC,XSA和BETMA质量浓度明显高于本研究水体中的浓度,其余PMOCs质量浓度与本研究结果相近。
3. 结论
1) 采用HLB固相萃取柱对水样中17种PMOCs进行固相萃取,用乙腈和含10 mmol·L−1乙酸铵的水溶液作为流动相,该方法的准确度和精密度均可满足水体中PMOCs的检测分析要求,17种PMOCs的方法检出限为0.04~0.35 ng·L−1,定量限为0.13~1.16 ng·L−1,回收率为65.01%~98.65%。
2) 17种PMOCs在潮白河、北江和滹沱河中均有检出,其ƩPMOCs平均质量浓度分别为604.69、740.45和505.11 ng·L−1,北江PMOCs的质量浓度高于潮白河和滹沱河。北京潮白河地表水中ACE、AMANT和CAP的质量浓度相对较高。广东北江中ACE、TCPP和CAP的质量浓度相对较高。石家庄滹沱河中AMANT、CAP和TCPP的质量浓度较高。北京潮白河地表水中PMOCs的质量浓度高于地下水中的质量浓度,地表水和地下水在平水期的PMOCs质量浓度高于丰水期的质量浓度。
-
表 1 在5 mA·cm−2恒电流密度条件下电解2 h内氮元素的质量浓度变化
Table 1. Changes in nitrogen mass concentration during 2 hours of electrolysis at a constant current of 5 mA·cm−2
电解时间/min 氮元素质量浓度/(mg·L−1) 200 µS·cm−1 Na2SO4 400 µS·cm−1 Na2SO4 200 µS·cm−1 NaCl 400 µS·cm−1 NaCl NH4+-N NO2−-N NO3−-N NH4+-N NO2−-N NO3−-N NH4+-N NO2−-N NO3−-N NH4+-N NO2−-N NO3−-N 0 19.84 BD BD 19.78 BD BD 20.288 BD BD 20.319 BD BD 20 19.84 BD BD 19.77 BD BD 20.219 BD BD 17.339 BD BD 40 19.84 BD BD 19.81 BD BD 19.647 BD BD 14.623 BD 0.051 60 19.84 BD BD 19.77 BD BD 18.754 BD BD 12.615 BD 0.070 80 19.84 BD BD 19.78 BD BD 17.833 0.023 BD 11.380 BD 0.124 100 19.84 BD BD 19.78 BD BD 17.299 0.026 BD 9.300 BD 0.203 120 19.84 BD BD 19.78 BD BD 16.951 0.028 BD 7.324 BD 0.241 注:BD表示低于检出限。 表 2 不同废水处理工艺/系统能耗对比
Table 2. Comparison of energy consumption of different wastewater treatment processes/systems
工艺或系统 污染物 浓度 能耗 /(kWh·m−3) 参考文献 单室电解槽 总氮 28.174 mg·L−1 15.9~43.323 本研究 流动池反应器 0.6~10.781 本研究 添加额外电解质 四环素 1 µmol·L−1 28 [24] 磺胺二甲氧嘧啶 1 µmol·L−1 38 左氧氟沙星 1 384 μmol·L−1 25 [25] 诺氟沙星 313 μmol·L−1 6.5~8.5 [26] 固体电解质系统 苯甲酸 200 μmol·L−1 35 [27] 特丁津 0.4~17.4 μmol·L−1 3.8~19.0 [28] 微流控系统 苯甲酸 200 μmol·L−1 4.6~10.2 [27] 敌草隆 43 μmol·L−1 2.0 [29] -
[1] ZHAO H. Nitrogen removal from wastewater plant secondary effluent in a compound natural treatment system[J]. Ecological Engineering, 2013, 57: 361-365. doi: 10.1016/j.ecoleng.2013.04.026 [2] SAMATYA S, KABAY N, YÜKSEL Ü, et al. Removal of nitrate from aqueous solution by nitrate selective ion exchange resins[J]. Reactive and Functional Polymers, 2006, 66(11): 1206-1214. doi: 10.1016/j.reactfunctpolym.2006.03.009 [3] EL MIDAOUI A, ELHANNOUNI F, TAKY M, et al. Optimization of nitrate removal operation from ground water by electrodialysis[J]. Separation and Purification Technology, 2002, 29(3): 235-244. doi: 10.1016/S1383-5866(02)00092-8 [4] SCHOEMAN J J, STEYN A. Nitrate removal with reverse osmosis in a rural area in South Africa[J]. Desalination, 2003, 155(1): 15-26. doi: 10.1016/S0011-9164(03)00235-2 [5] CHEN G. Electrochemical technologies in wastewater treatment[J]. Separation and Purification Technology, 2004, 38(1): 11-41. doi: 10.1016/j.seppur.2003.10.006 [6] MONICA M D, AGOSTIANO A, CEGLIE A. An electrochemical sewage treatment process[J]. Journal of Applied Electrochemistry, 1980, 10(4): 527-533. doi: 10.1007/BF00614086 [7] GARCIA-SEGURA S, NIENHAUSER A B, FAJARDO A S, et al. Disparities between experimental and environmental conditions: Research steps toward making electrochemical water treatment a reality[J]. Current Opinion in Electrochemistry, 2020, 22: 9-16. doi: 10.1016/j.coelec.2020.03.001 [8] MOREIRA F C, BOAVENTURA R A R, BRILLAS E, et al. Electrochemical advanced oxidation processes: A review on their application to synthetic and real wastewaters[J]. Applied Catalysis B: Environmental, 2017, 202: 217-261. doi: 10.1016/j.apcatb.2016.08.037 [9] GARCIA-SEGURA S. Electrochemical oxidation remediation of real wastewater effluents: A review[J]. Process Safety and Environmental Protection, 2018, 113: 48-67. doi: 10.1016/j.psep.2017.09.014 [10] XU H, MA Y, CHEN J, et al. Electrocatalytic reduction of nitrate: A step towards a sustainable nitrogen cycle[J]. Chemical Society Reviews, 2022, 51(7): 2710-2758. doi: 10.1039/D1CS00857A [11] ZOU X, XIE J, WANG C, et al. Electrochemical nitrate reduction to produce ammonia integrated into wastewater treatment: Investigations and challenges[J]. Chinese Chemical Letters, 2023, 34(6): 107908. doi: 10.1016/j.cclet.2022.107908 [12] ELENI T, THEODORA V, ALEXANDROS K, et al. Anodic oxidation of textile dyehouse effluents on boron-doped diamond electrode[J]. Journal of Hazardous Materials, 2012, 207-208: 91-96. doi: 10.1016/j.jhazmat.2011.03.107 [13] YANG K , LIN H , FENG X W , et al. Energy-efficient removal of trace antibiotics from low-conductivity water using a Ti4O7 reactive electrochemical ceramic membrane: Matrix effects and implications for byproduct formation[J]. Water Research, 2022, 224: 119047. [14] GABRIAL A, ANA S. FAJARDO, et al. Enabling circular economy by N-recovery: Electrocatalytic reduction of nitrate with cobalt hydroxide nanocomposites on copper foam treating low conductivity groundwater effluents[J]. Science of the Total Environment, 2023, 887: 163938. doi: 10.1016/j.scitotenv.2023.163938 [15] WANG Y T , WANG C , LI M, et al. Nitrate electroreduction: mechanism insight, in situ characterization, performance evaluation, and challenges[J]. Chemical Society Reviews, 2021, 50: 6720-6733. [16] LAN H, LIU X, LIU H, et al. Efficient nitrate reduction in a fluidized electrochemical reactor promoted by Pd–Sn/AC particles[J]. Catalysis Letters, 2016, 146(1): 91-99. doi: 10.1007/s10562-015-1615-3 [17] BUNCE N J, BEJAN D. Mechanism of electrochemical oxidation of ammonia[J]. Electrochimica Acta, 2011, 56(24): 8085-8093. doi: 10.1016/j.electacta.2011.07.078 [18] HAND S, CUSICK R D. Electrochemical disinfection in water and wastewater treatment: Identifying impacts of water quality and operating conditions on performance[J]. Environmental Science & Technology, 2021, 55(6): 3470-3482. [19] ZHOU C, BAI J, ZHANG Y, et al. Novel 3D Pd-Cu(OH)2/CF cathode for rapid reduction of nitrate-N and simultaneous total nitrogen removal from wastewater[J]. Journal of Hazardous Materials, 2021, 401: 123232. doi: 10.1016/j.jhazmat.2020.123232 [20] LI J, YIN M, WANG Y, et al. Improvement of the conventional flat plate electrode: Application of filtered Pd@Ti electrode in the removal of toxic chlorinated PPCPs[J]. Separation and Purification Technology, 2024, 329: 125120. doi: 10.1016/j.seppur.2023.125120 [21] TRELLU C, COETSIER C, ROUCH J C, et al. Mineralization of organic pollutants by anodic oxidation using reactive electrochemical membrane synthesized from carbothermal reduction of TiO2[J]. Water Research, 2018, 131: 310-319. doi: 10.1016/j.watres.2017.12.070 [22] SIMÕES A J A, DÓRIA A R, VIEIRA D S, et al. Electrochemical degradation of ciprofloxacin using a coupled 3D anode to a microfluidic flow-through reactor[J]. Journal of Water Process Engineering, 2023, 51: 103443. doi: 10.1016/j.jwpe.2022.103443 [23] GONZAGA I M D, DÓRIA A R, MORATALLA A, et al. Electrochemical systems equipped with 2D and 3D microwave-made anodes for the highly efficient degradation of antibiotics in urine[J]. Electrochimica Acta, 2021, 392: 139012. doi: 10.1016/j.electacta.2021.139012 [24] WANG B, SHI H, HABTESELASSIE, et al. Simultaneous removal of multidrug-resistant Salmonella enterica serotype typhimurium, antibiotics and antibiotic resistance genes from water by electrooxidation on a Magnéli phase Ti4O7 anode[J]. Chemical Engineering Journal, 2021, 407: 127134-127141. doi: 10.1016/j.cej.2020.127134 [25] XIA Y, DAI Q. Electrochemical degradation of antibiotic levofloxacin by PbO2 electrode: Kinetics, energy demands and reaction pathways[J]. Chemosphere, 2018, 205: 215-222. doi: 10.1016/j.chemosphere.2018.04.103 [26] CARNEIRO J F, AQUINO J M, SILVA BF, et al. Comparing the electrochemical degradation of the fluoroquinolone antibiotics norfloxacin and ciprofloxacin using distinct electrolytes and a BDD anode: evolution of main oxidation byproducts and toxicity[J]. Journal of Environmental Chemical Engineering, 2020, 8(6): 104433-104442. doi: 10.1016/j.jece.2020.104433 [27] MENG X, CHEN Z, WANG C, et al. Development of a three-dimensional electrochemical system using a blue TiO2/SnO2-Sb2O3 anode for treating low-ionic-strength wastewater[J]. Environmental Science & Technology, 2019, 53(23): 13784-13793. [28] KLIDI N, CLEMATIS D, CARPANESE M P, et al. Electrochemical oxidation of crystal violet using a BDD anode with a solid polymer electrolyte[J]. Separation and Purification Technology, 2018, 208: 178-183. [29] KHONGTHON W, JOVANOVIC G, YOKOCHI A, et al. Degradation of diuron via an electrochemical advanced oxidation process in a microscale-based reactor[J]. Chemical Engineering Journal, 2016, 292: 298-307. doi: 10.1016/j.cej.2016.02.042 [30] ZHANG Y, LI J, BAI J, et al. Extremely efficient decomposition of ammonia N to N2 using ClO · from reactions of HO · and HOCl generated in Situ on a novel bifacial photoelectroanode[J]. Environmental Science & Technology, 2019, 53(12): 6945-6953. [31] MARTÍNEZ-HUITLE C A, RODRIGO M A, SIRÉS I, et al. Single and coupled electrochemical processes and reactors for the abatement of organic water pollutants: A critical review[J]. Chemical Reviews, 2015, 115(24): 13362-13407. doi: 10.1021/acs.chemrev.5b00361 -






 DownLoad:
DownLoad: