-
我国部分地表水质不达标的现象仍然存在。地表水体的污染物源可分为三类:生活污水、工业废水和降水。这些水中的污染物质一般含氮、磷、硫等元素,雨水淋洗生产活动放置在外的原料等,都会随下水管道流入地表水体,处理不当将导致河水富营养化,影响生态环境[1]。国内外也已开展对黑臭河水及河流污染水水质净化技术的研究。过滤、分离及其强化技术,生物及其强化技术,物理、化学及生化联用技术,电化学、磁处理技术,河流水质净化与生态修复集成技术等工艺技术越来越受关注[2]。
微藻由于其环境适应力强、可以利用废弃物质生长并将其降解成单一化合物等优点,废水培养微藻去除污染物已有广泛的研究[3]。藻类可以同化碳、氮和磷,清除废水中的污染物的同时合成碳水化合物、蛋白质和脂质,而菌群可以将有机物分解,产生氨、氮等,故藻菌合作也受到了研究人员的关注。MA等[4]研究发现,在城市原废水中,蛋白核小球藻在第2天即可达到2.01 g·L−1,而在灭过菌的废水中,第3天仅为0.77 g·L−1。但国内将菌藻共生体系运用于黑臭河水及河流污染水水质净化技术的研究并不多见。
微藻和菌之间的协同关系对菌藻共生系统中的微藻的生长及污染物的去除具有积极影响,但现有的研究仍存在不足。2013年,高晨晨[5]将菌藻生物膜系统应用于受污染河水,其仅对COD和氨氮的去除进行了简单的分析(去除率分别为57%和80%),其余水质指标的空白有待补充。2020年,王乐阳等[6]将含有菌藻填料的生态浮床实施于外港河现场,能将水质净化至Ⅳ类标准,如何进一步提升水质标准有待研究。2023年,张正红等[7]构建了颗粒化菌藻系统(光合细菌和小球藻),进行了缓流微污染原水净化,其中总氮的去除效率最好为79.42%,但该系统是否适用于高污染水净化有待考究。国外也有研究利用光合细菌(Rhodobacter sphaeroides)和小球藻混合培养,从废水中有效去除氨氮和总磷[8]。总之,我国地表水修复起步晚于西方国家,且由于我国的地表水体多样,故目前还处在探索实践阶段。因此,更为合理的运用菌藻技术减污,尤其是运用在地表水处理领域是当前亟需解决的问题。
为弥补上述研究的不足,本研究采用活性污泥作为菌藻共生体系中的菌源,比购买单一菌种更具有经济性与多样性,采用耐污能力强,在水质修复中更具有潜力的栅藻[9-12],更合理的构建微藻和细菌的复合体系,更高效的缓解地表水体纳污负荷,提升溶解氧,恢复水体自净能力,具有重要研究意义,具有重大生态效益,符合绿色的、可持续发展的原则。
-
实验材料由菌种和藻种两部分构成。菌群由活性污泥直接提供,活性污泥来自华东理工大学污水处理厂。外源藻种为无毒绿藻斜生四链藻(曾用名斜生栅藻),购于中国科学院淡水藻种库(FACHB)。
-
本研究设计了实验室小试实验和示范装置运行实验两部分。实验室小试实验首先对比纯斜生四链藻体系(简称微藻体系)和斜生四链藻-活性污泥体系(简称藻菌体系)对实际水质的净化能力。对比实验的用水采自江苏新晨环保集团第三产业园河道,经检测定义为微污染水,水质数据如表1所示。其次,在实验室研究了上述藻菌体系对高污染水的净化能力。进水水质为在上述实际地表水中额外添加碳、氮、磷源,使化学需氧量(COD)、总氮(TN,以N计)、氨氮(NH3-N)和 总磷(TP,以P计)含量劣于地表水环境质量标准(GB 3838-2002)Ⅴ类水质标准,使实验结果对不同污染情况的地表水具有更广泛的指导意义。所添加的碳源为葡萄糖和甲醇(分别提供所需COD的50%),氮源为氯化铵,磷源为磷酸二氢钾。除特别说明外,本研究所采用的化学品均为分析纯(AR)。示范装置运行实验的用水同为江苏新晨环保集团第三产业园河道采集的实际地表水,由于实际水质必然波动,故进水水质数据不完全一致。
实验均于第0天进水,停留1个实验周期出水。实验室微污染净化的周期为7 d,高污染净化的周期为20 d。示范装置运行周期为30 d。实验室小试实验反应器为传统的常规柱式光生物反应器,有效容积为1.5 L,示意图和装置图如图1所示。示范装置运行实验采用我们发明的一种生态修复装置(公开号为CN117550725A)[13],装置置于有效容积为150 L的圆形池内(图2)。当运行该生态修复装置时,圆形池内的水会充分地循环流动。
实验室小试实验和示范装置运行实验的曝气系统均提供约3 mg·L−1溶解氧(DO),小试实验水温在25~30 ℃,示范装置水温在15~20 ℃,实验光照周期均为3 h(即每日光照3 h,黑暗3 h,进行4个循环),光照强度均为10 000 Lux。每天固定时间取样进行生物量和水质指标监测。两种体系的外源微藻初始接种密度均为4×106 细胞/mL,接种的微藻处于对数生长期。藻菌体系中初始接种的活性污泥长势良好,MLSS约为1 300 mg·L−1,SVI约为70 mL·g−1。与纯微藻体系不同的是,藻菌体系存在除斜生四链藻以外的其他藻类,这是由于活性污泥中会自带藻孢子,在充足的光照条件下可能会生长和增殖。
-
污泥浓度(MLSS)和污泥体积指数(SVI)的测定方法参照[14]。藻生物量指标用叶绿素a含量间接表示。水质指标分析COD、TP、TN和氨氮(NH3-N)。取适量培养物5 000 r·min−1离心10 min,上清液过0.45 μm的滤膜去除体系内残留菌和藻后用于测水质指标。离心后的底物加入甲醇至原体积,300 W超声破胞20 min,70 ℃水浴提取10 min并再次离心,底物为白色,上清液于653 nm和666 nm波长下测吸光度,由此计算叶绿素a的含量[15]。水质指标分析用哈希试剂,哈希试剂购于美国哈希公司(HACH),其在国内外水质检测领域广泛应用,具体测试方法参照美国哈希公司出版的《Water Analysis Handbook》(化学需氧量(COD),消解比色法
8000 ;总磷,消解-抗坏血酸法8190 ;总氮,过硫酸盐氧化法10071 ;氨氮,水杨酸法10023 )[16-20]。高通量测序技术常用于微生物多样性研究,鉴定微生物种类和确定相对丰度[21-22]。对微生物进行扩增子测序,可以普查群落的结构组成,掌握变化规律,揭示优势物种。本研究将实验室小试实验藻菌体系培养至第4天与第20天的样品用于高通量测序分析,分析微生物在藻菌体系中的作用,将实验室宏观效果与微观机制分析相结合,为示范工程的实施提供理论支持。
-
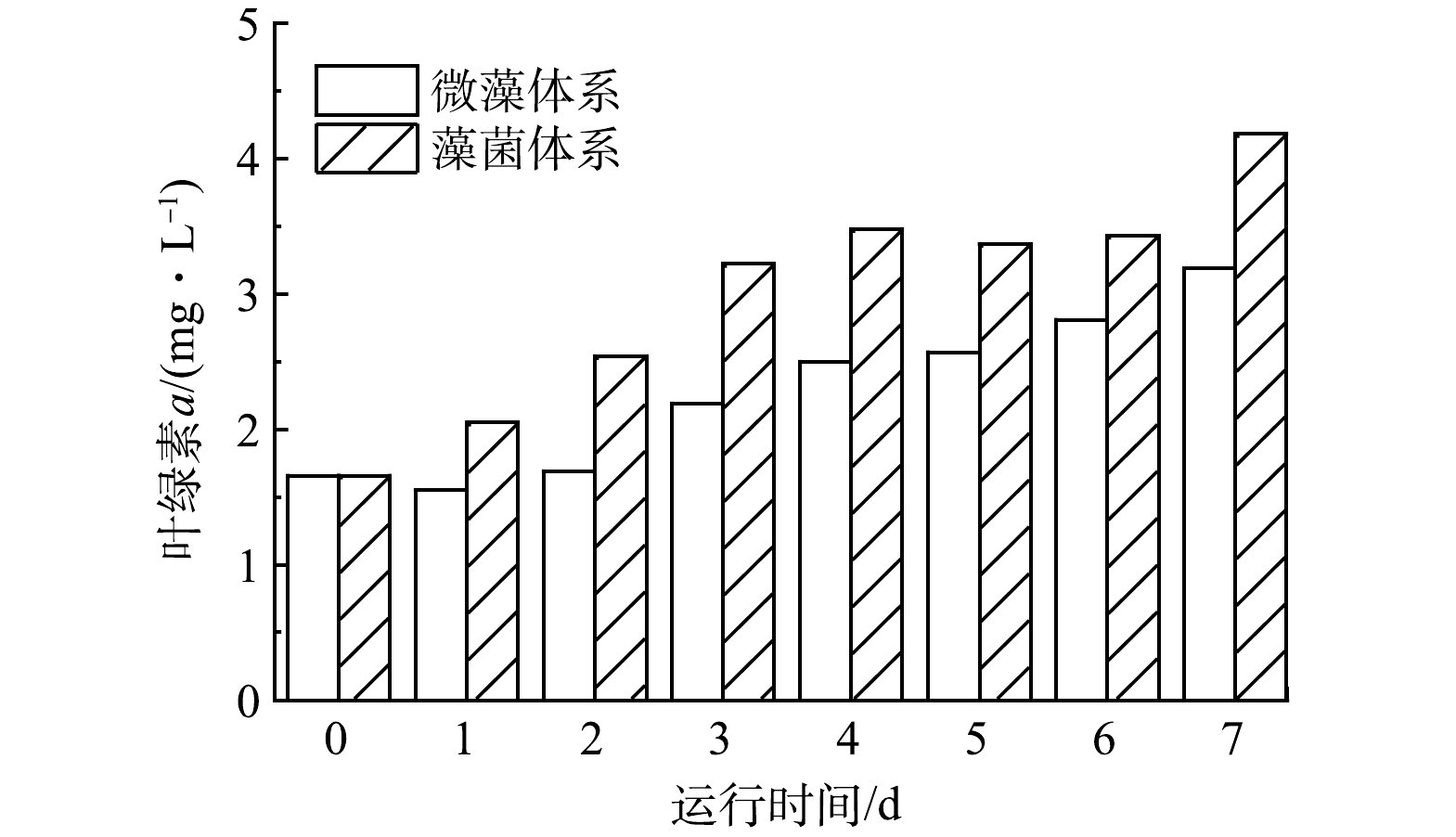
1)微藻体系与藻菌体系藻含量对比。微藻是一类能进行光合作用的微观藻类,叶绿素a含量丰富[23]。体系内生物的良好生长是去除污染物的前提。本研究采用叶绿素a反映体系内微藻的生物量情况,了解微藻的生长速度。微藻体系与藻菌体系生物量对比图如图3所示。
微藻体系与藻菌体系初始接种的藻细胞密度一致,其中的叶绿素a含量也一致为1.66 mg·L−1。在7 d的培养周期内,藻菌体系的叶绿素a含量始终高于微藻体系。藻菌体系中的微藻几乎不存在适应期,而在微藻体系内,第2天才开始出现叶绿素a的增长。到第7天实验结束时,微藻体系的叶绿素a含量为3.19 mg·L−1,低于藻菌体系23.68%,推测可能是由于藻菌体系中微生物的功能多样性带来了比微藻体系更高效的能量流动,活性污泥中的菌群对底物的代谢产物也能够帮助微藻生长,菌群提供的这些营养物质是微藻叶绿素a的重要组成部分[24]。
2)微藻体系与藻菌体系污染物去除情况对比。将COD作为反映有机物含量的综合指标具有重要的评价与指导意义[25](图4(a))。微藻体系与藻菌体系COD、TP、TN和NH3-N在水中的质量浓度随时间的变化情况如图4所示。图中微藻体系与藻菌体系的进水均为表1中的微污染地表水,但藻菌体系的初始污染物质量浓度偏高,是活性污泥的投加引起的,活性污泥的预培养基引入了部分营养物质至该体系中。尽管如此,其出水污染物质量浓度仍均低于微藻体系。微藻体系在第1 天对污染物的降解速度是缓慢的,而藻菌体系则出现断崖式的降解。整体来说,微藻体系每天对污染物的降解率是相近的,但藻菌体系在第5 天之后的降解率减缓,是水中的污染物质量浓度已经非常低的缘故。微藻体系对好氧有机污染物(以COD计)、TP、TN和NH3-N的7 d去除率分别为74.72%、78.26%、67.20%和56.83%,藻菌体系为86.11%、93.88%、91.19%和96.38%。有研究表明相比于利用微藻处理废水,菌藻共生系统对废水中有机碳、氮、磷等营养物质的去除效率更高[26]。在本实验室条件下,微藻和藻菌体系净化实际地表水的对比研究同样发现,藻菌体系优于微藻体系,得益于藻菌体系中生物量的优势,也得益于藻菌良性合作下藻生物量的增加(图3)。
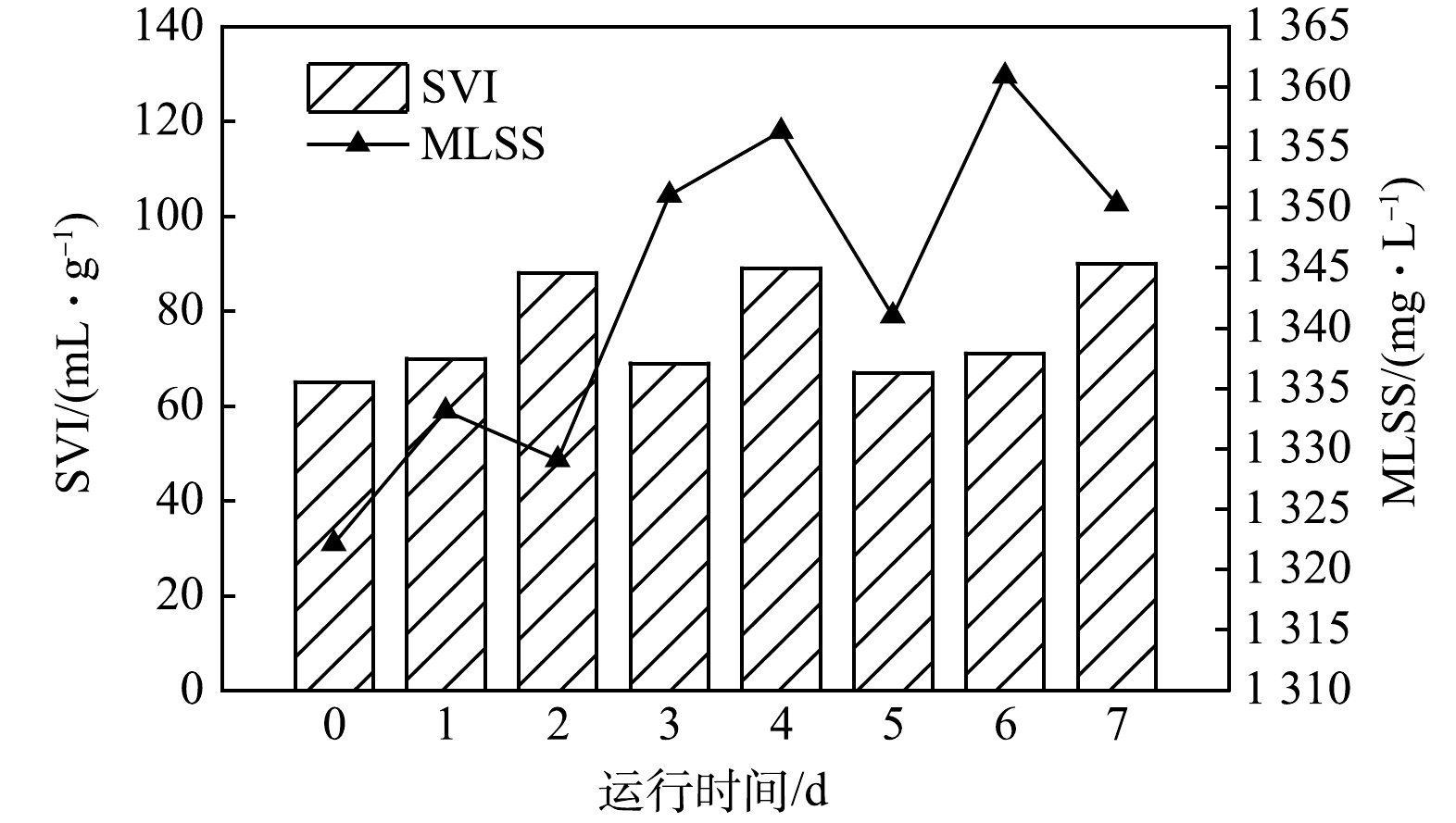
3)藻菌体系污泥浓度和体积指数分析。活性污泥的生物活性和沉降性能对水处理至关重要。MLSS和SVI 是污泥最基本的理化特性,图5反映了光生物反应器运行7 d内藻菌体系总污泥的MLSS和SVI变化情况。生长良好的活性污泥的SVI值在50~100 mL·g−1左右;当SVI值在100~200 mL·g−1时,沉降性能一般;当SVI值大于200 mL·g−1时,沉降性能较差[14]。由图5可知,本体系的活性污泥生长良好,SVI值虽然一直处于波动状态,但始终保持在50~100 mL·g−1。过高的MLSS会妨碍充氧,本实验室藻菌体系的MLSS也一直维持在1 350 mg·L−1左右,污泥浓度不高且较为合适。0~3 d属于污泥的积累过程,其利用水样中的污染物维持自身的增殖,从初始的1 322.13 mg·L−1,到第3天的1 351.01 mg·L−1,此后水中污染物质量浓度降低,污泥不断更新并保持污泥浓度相对稳定。活性污泥的相对稳定也意味着藻菌体系中存在互利关系,营造的环境条件适宜微生物的生长。
-
1)藻菌体系藻含量分析。在高污染地表水中藻菌体系内叶绿素a的含量变化如图6所示。在前12 d属于微藻色素的积累时期,在后8 d较为稳定。其初始叶绿素a含量为2.74 mg·L−1,在第16天达到最高,为11.97 mg·L−1,是初始的4.37倍。有研究[25]表明,细菌可以释放某些生长促进物质来支持微藻的生长,适宜的条件会使微藻细胞能够积累色素,通过光合作用产生氧气和有机物,为细菌提供能源和营养。由图6可以看出这一良好的关系在底物充足的条件下体现得更加明显,劣Ⅴ类水质中含有更多的污染物,使得微藻细胞积累了更多的叶绿素a。
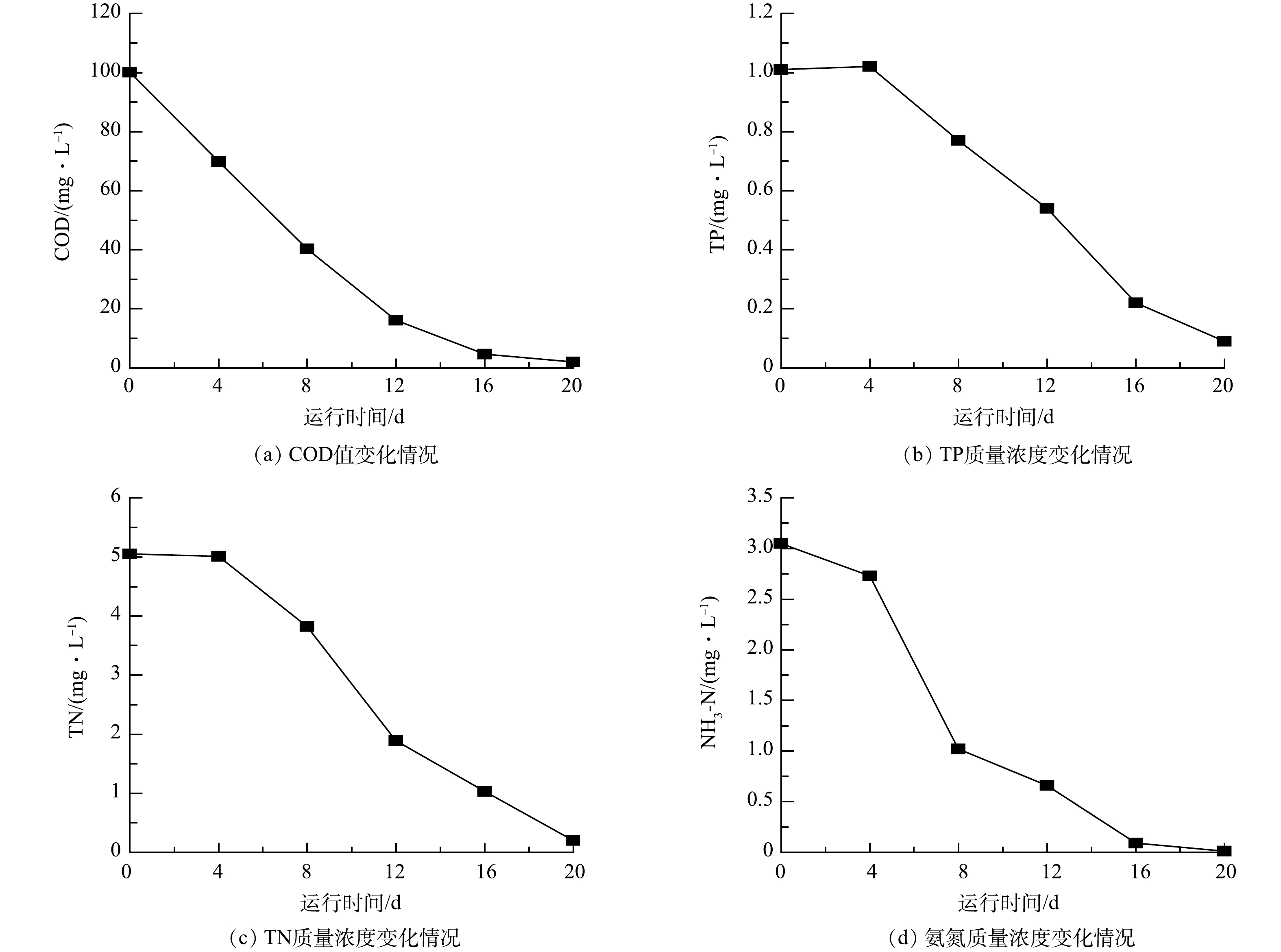
2)藻菌体系污染物降解效果分析。图7反映的是藻菌体系运用于高污染地表水时,好氧有机污染物(以COD计)、TP、TN和NH3-N的降解情况。进水COD、TP、TN和NH3-N的质量浓度分别为100.12、1.01、5.05和3.05 mg·L−1,根据《地表水环境质量标准》(GB3838-2002),该进水属于劣Ⅴ类水,表明地表水环境污染严重。本藻菌体系对好氧有机污染物(以COD计)的降解效果极佳,0~12 d的降解速率极快且不存在前期的适应期。有研究表明,菌藻系统中COD的去除主要依靠细菌的代谢作用,河水中的土著生物也能异养代谢COD[7]。好氧有机污染物(以COD计)的快速降解也与2.2.1节叶绿素a在0~12 d迅速积累相对应,最终耗氧有机污染物的降解率为98.01%。TP与TN的降解趋势相近,在培养初期(0~4 d)出现了小幅上升,这可能是高污染的冲击造成了部分生物的死亡,但这部分氮磷也能在后续的培养中去除,最终降解率分别为91.09%与96.04%。NH3-N的降解曲线呈现出先慢后快再慢的趋势,最终达到了几乎100%的去除。在第20天时,COD、TP、TN和NH3-N的出水质量浓度分别为1.99、0.09、0.20和0.01 mg·L−1,除TP外,其余均达到了Ⅰ类水的标准。
由图7可知,相比之下,TP的去除效果是最差的,因为水中的磷一般需要结合化学的方法将其沉降后分离除去,光合细菌在一定条件下能积累多聚磷酸盐,但也会将其重新释放,而微藻只对正磷酸盐有较强的吸收同化能力[7],故在不排泥的情况下其余磷的去除效果受限。而耗氧有机污染物(以COD计)和NH3-N的去除率均大于98%,与此前赵志瑞[27]等的研究相比去除效果更好,推测是由于其采用的是微球藻与培养的复合菌群形成的菌藻体系,而本研究采用的是斜生四链藻与活性污泥中的土著菌群,形成的藻菌体系生物种类更为丰富。
-
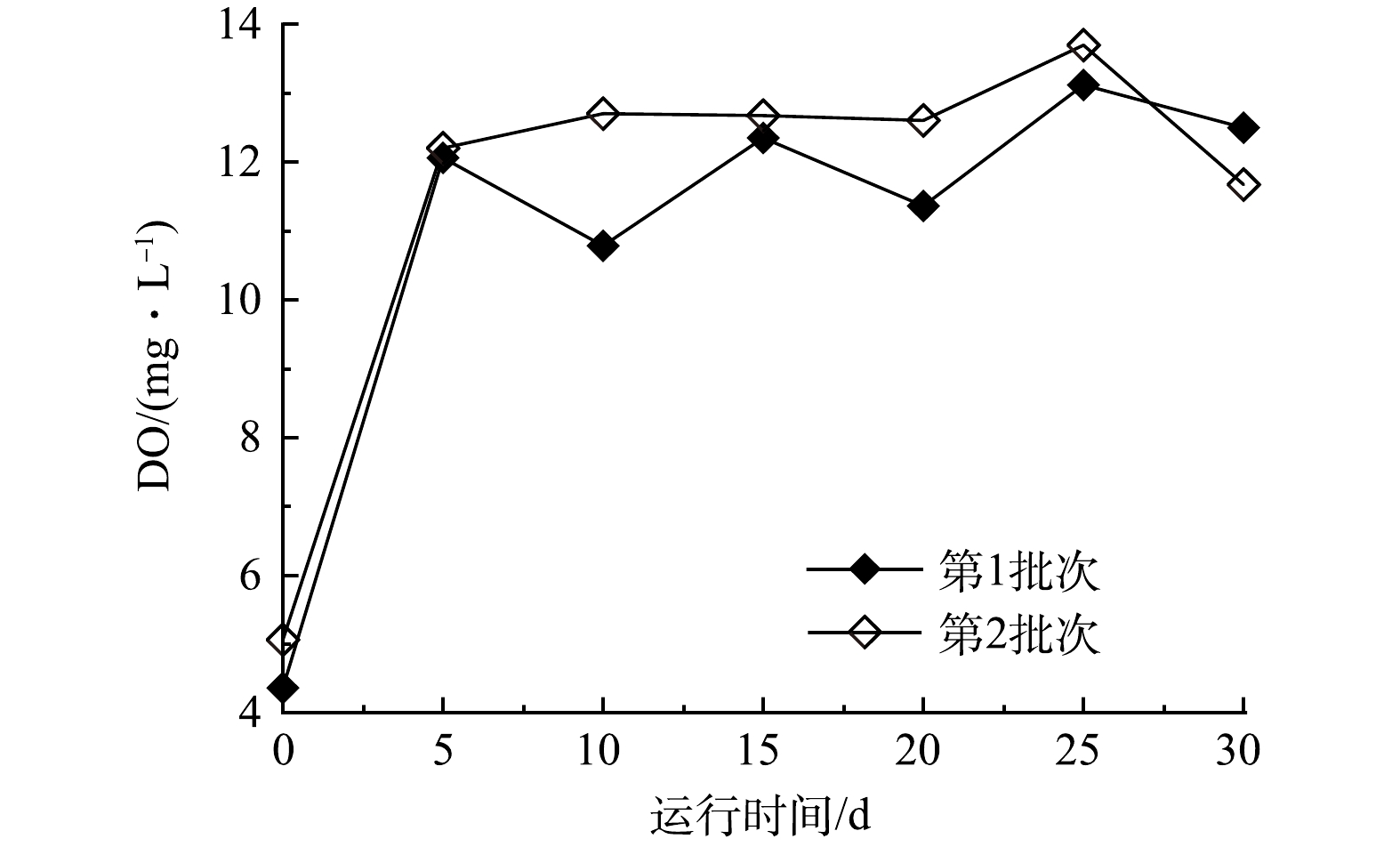
1)藻菌体系示范装置溶解氧监测。藻菌体系示范装置的运行分为两个批次,第1批次引入原始河道排口地表水,且在示范装置内接种藻菌,运行1个月后引入新的河道排口地表水,实施第2批次,第2批次不接入新的藻菌,利用已形成的藻菌体系处理水样,探究该藻菌体系示范装置运行的可持续性。
溶解氧(DO)是一个体现水质的重要指标,一般污染严重的水体DO都非常低,因此,在藻菌体系处理河水时DO的变化是净化能力的直接体现[28]。藻菌体系示范装置DO的变化情况如图8所示。第1批次河水引入藻菌体系示范装置时的溶解氧为4.36 mg·L−1,第2批次为5.06 mg·L−1,均处于较低水平。该藻菌示范装置运行5 d后,两批次河水中的溶解氧均>12 mg·L−1,达到了Ⅰ类水的标准,也意味着水质已经得到了净化,恢复了水体的自净能力。此后,两批次河水中的DO均处于较高水平,维持在Ⅰ类水的标准,但有所波动,属于正常现象,其受到藻菌体系呼吸作用和代谢活动的影响。陈海敏等[29]早期利用光合细菌和小球藻联合处理养殖废水,处理后水中DO可达10 mg·L−1以上,有利于废水的再利用。在本藻菌体系示范装置运行过程中,同样能将水体中的DO提升至10 mg·L−1以上(图8)。
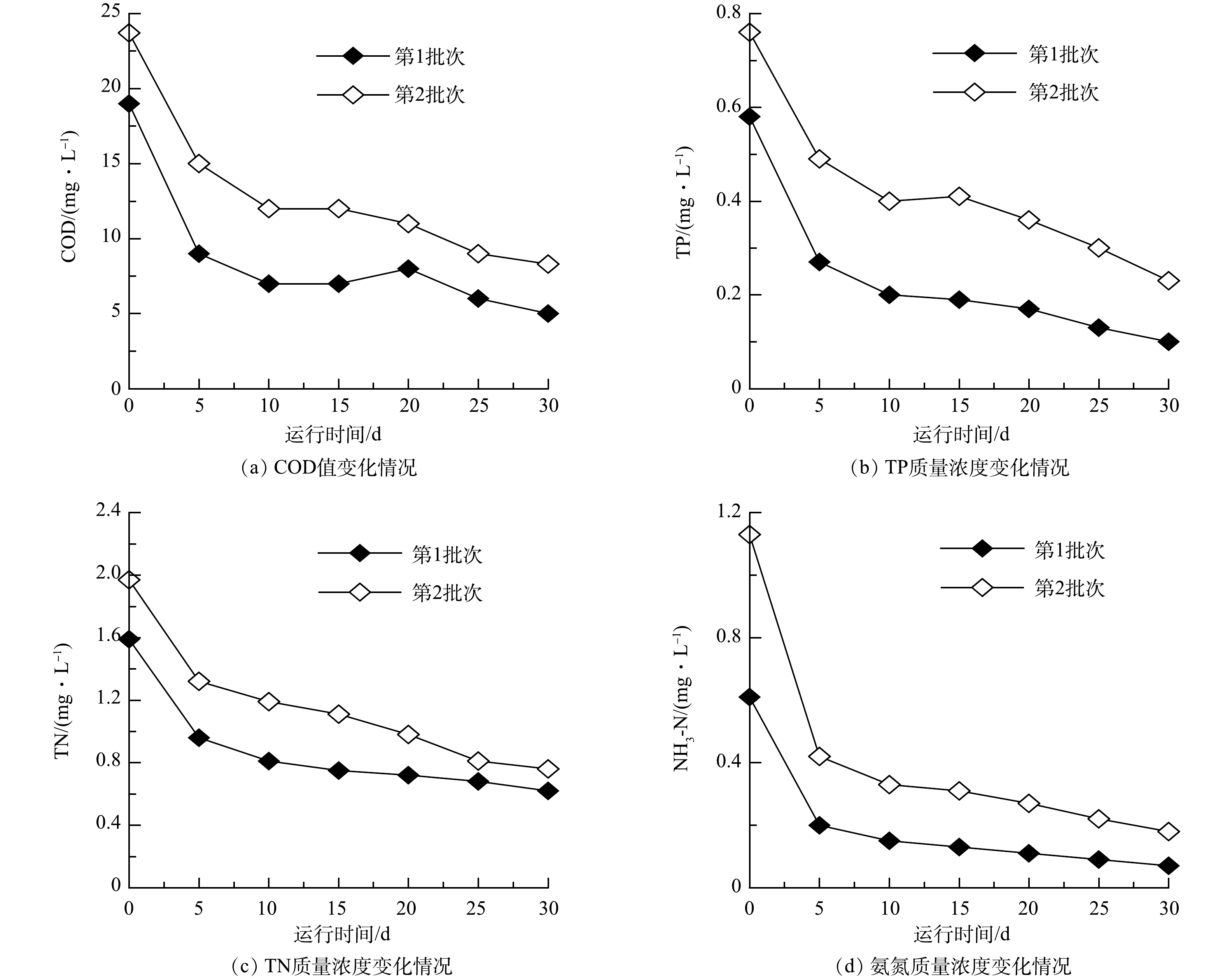
2)藻菌体系示范装置污染物降解效果分析。根据实验室实验效果分析发现,藻菌体系对好氧有机污染物(以COD计)、TP、TN和NH3-N的降解均表现出一定优势,故运行藻菌体系示范装置实施河水水质净化,相关结果如图9所示。引入至本藻菌体系示范装置内的两批次河水初始水质有一定的差异,好氧有机污染物(以COD计)、TP、TN和NH3-N去除均呈现先快后慢的趋势,符合藻菌降解污染物动力学趋势。到第30天时,第1批次的COD值为5.00 mg·L−1,降解率为73.68%,第2批次的COD值为8.30 mg·L−1,降解率为64.98%,出水均达到了《地表水环境质量标准》(GB 3838-2002)Ⅰ类水标准。本藻菌体系示范装置内微藻和菌群相互合作,也实现了对氮磷的去除,出水时,第1批次河水水样中的TP含量为0.10 mg·L−1,符合Ⅱ类水标准,第2批次为0.23 mg·L−1,属于Ⅳ类水;第1批次的TN含量为0.62 mg·L−1,第二批次为0.76 mg·L−1,降解率分别为61.01%和61.42%,与实验室藻菌体系相比低出30%,但TN的出水水质由Ⅴ类提升至Ⅲ类水标准。与此同时,第一批次的NH3-N出水质量浓度为0.07 mg·L−1,去除率为88.52%,符合Ⅰ类水标准,第二批次的NH3-N出水质量浓度为0.18 mg·L−1,去除率为84.07%,符合Ⅱ类水标准。NH3-N可以被菌藻直接同化,在氨氮质量浓度较低的情况下,硝化细菌由于繁殖周期长很难形成优势菌群[28]。本示范装置所采用的河水中的NH3-N初始质量浓度不高,但由于不是单一的菌或微藻的体系,在藻菌的优势作用下,水样中的NH3-N仍得到了很好的去除。
示范装置对地表水质的净化能力虽然不如实验室条件,但仍然大幅提升了水质条件,部分指标达到《地表水环境质量标准》(GB3838-2002)Ⅰ类水标准,且两批次的实验表明该藻菌体系具有一定的可持续性,30 d后不添加新的微藻与活性污泥,同样可以净化水质(图9)。本研究的藻菌体系适用于多种反应器,成功运用于示范装置,对地表水具有可持续的净化能力。
-
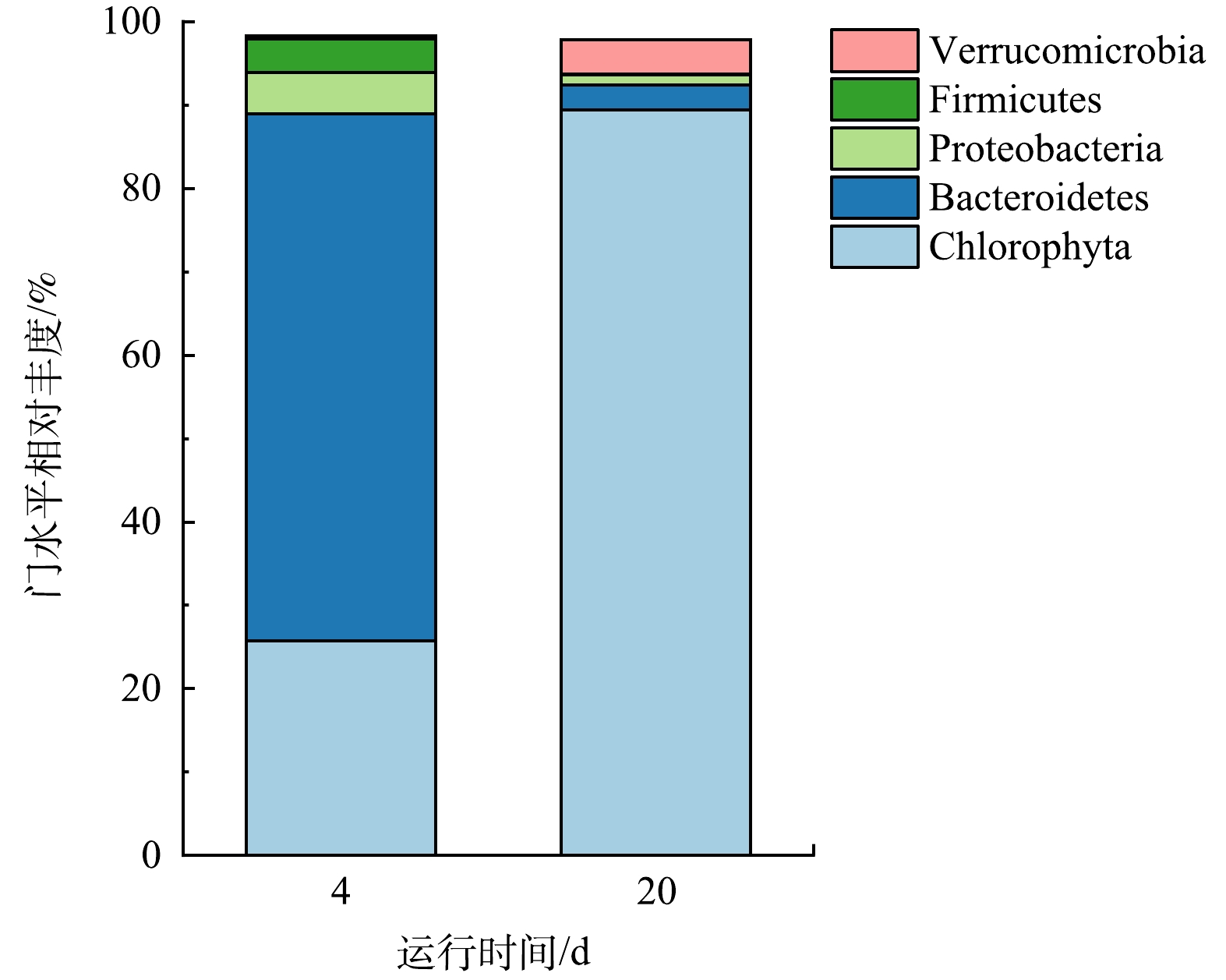
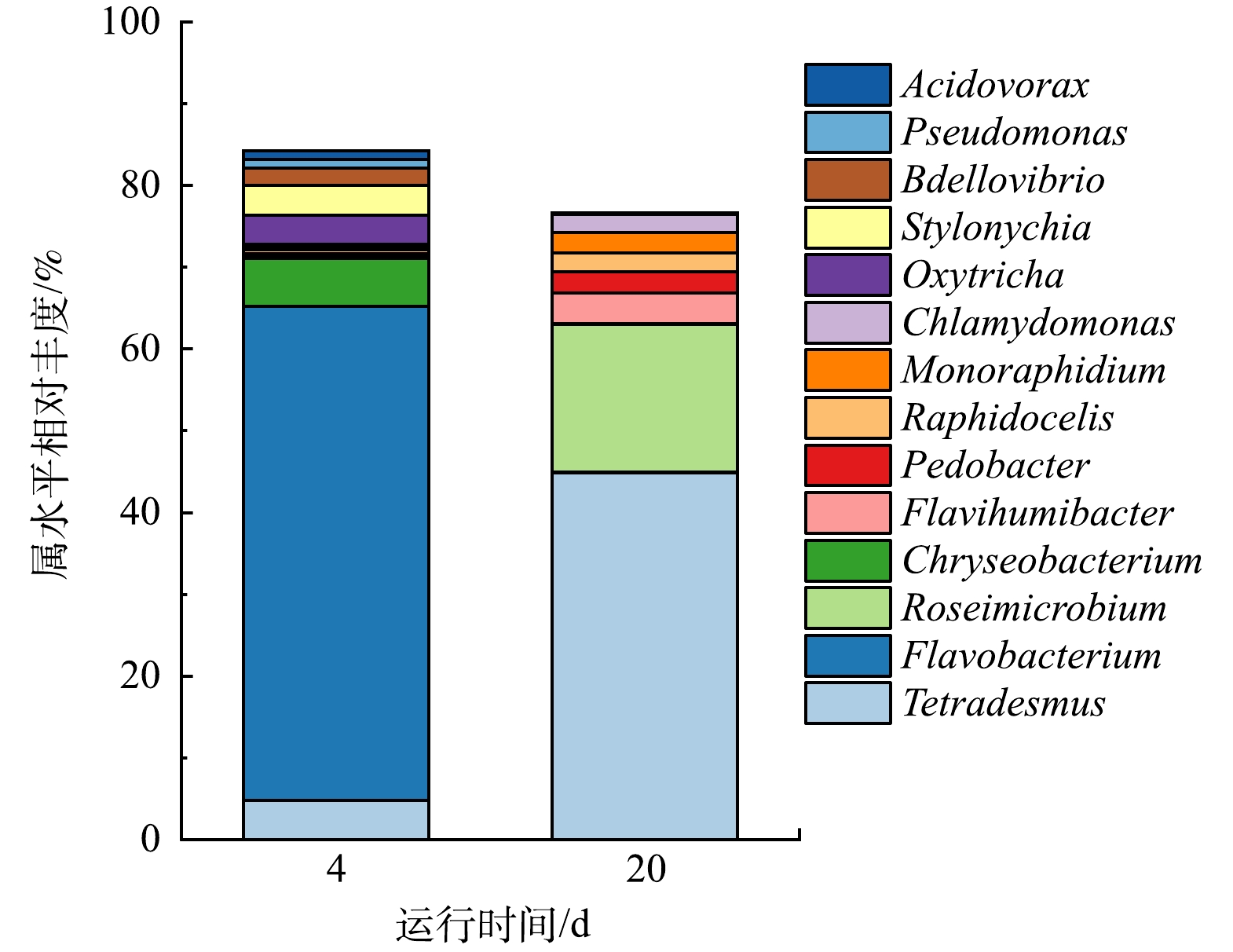
将实验室净化高污染地表水(劣Ⅴ类)的藻菌体系的培养初期(第4天)与培养末期(第20天)的样品进行了测序,筛选了相对丰度变化大于1%的物种。
1)门水平下物种组成相对丰度变化。藻菌体系内第4天与第20天门水平下物种组成相对丰度变化如图10所示。样品在门水平上的相对丰度变化明显。在第4天,藻菌体系中绿藻门(Chlorophyta)、拟杆菌门(Bacteroidetes)、变形杆菌门(Proteobacteria)、厚壁菌门(Firmicutes)和疣微菌门(Verrucomicrobia)的相对丰度为25.70%、 63.20%、5.00%、4.00%和0.40%,而在第20天,其中的相对丰度变为89.40%、3.00%、1.20%、0.10%和4.10%。由图10可以看出,与第4天相比,第20天拟杆菌门(Bacteroidetes)、变形杆菌门(Proteobacteria)和厚壁菌门(Firmicutes)的相对丰度均减少。拟杆菌门(Bacteroidetes)的微生物能生产各种裂解酶并参与降解有机化合物,变形杆菌门(Proteobacteria)是活性污泥中丰富的细菌门,参与污泥脱氮除磷等降解活动[30],厚壁菌门(Firmicutes)中有丰富的合养细菌,可产生挥发性脂肪酸[31],三种菌门丰度的下降,均与第20 d水中污染物得到降解有关。
2)属水平下物种组成相对丰度变化。样品在属水平上的相对丰度变化更为明显。其中值得关注的是,四链藻属(Tetradesmus sp.)的相对丰度从第4天的4.80%增加到第20天的44.80%,但第20天时绿藻门中还出现了其余藻类丰度的增加,分别是相对丰度为2.40%的近头状尖胞藻(Raphidocelis sp.)、2.50%的单针藻(Monoraphidium sp.)、2.20%的衣藻(Chlamydomonas sp.)。图11表明采用活性污泥与外源斜生四链藻构成藻菌体系具有创新性,活性污泥在光的照射下能将内源的藻孢子激活,从而产生内源藻,进而形成更稳定的内外源藻-菌体系。此前的研究从未展示过相关的研究结果。图11所显示出的近头状尖胞藻(Raphidocelis sp.)、单针藻(Monoraphidium sp.)和衣藻(Chlamydomonas sp.)都属于内源藻。此外,上述图10中疣微菌门(Verrucomicrobia)的相对丰度增加,表明地表水质得到净化,其在淡水环境中出现,是碳循环的重要贡献者[32],该门下的Roseimicrobium sp.相对丰度到第20天增加了18.10%(图11)。Roseimicrobium sp.属于益生菌,甚至能作为饲料添加剂[33]。本研究可以用于地表水质净化,为保护自然水环境提供数据支撑。
-
1)采用活性污泥与斜生四链藻构建的藻菌体系,对实际河道水质具有极好的净化效果。微污染水中耗氧有机污染物(以COD计)、TP、TN和NH3-N的7 d去除率最低为86.11%,高污染水(劣Ⅴ类)20 d能提升至Ⅱ类地表水水质。
2)本研究的藻菌体系成功运用于示范装置并展现出可持续的降解效果,在示范装置稳定运行30 d后,不接入新的藻菌,对河水仍有净化效果。
3)微生物群落解析结果表明,在充足的光照条件下,活性污泥中的土著藻孢子能够被激活,内源藻和外源藻的相对丰度都会随培养时间增加,地表水质的大幅净化可能得益于该内外源藻以及多种原生菌群形成的复合体系。
内外源藻-菌体系对河道水质的净化能力分析
Analysis of purification capacity of river water quality by internal and external source algae-bacteria system
-
摘要: 将菌藻共生体系运用于河流污染水净化的技术研究并不多见,但其关乎生态效益和人体健康。分别运用微藻体系和活性污泥与斜生四链藻构成的藻菌体系净化微污染和高污染的河道水,结果表明藻菌体系净化效果优于微藻体系。藻菌体系能将劣Ⅴ类水质提升至Ⅱ类水质。将藻菌体系运用于示范装置的研究表明,运行15 d后,河水中的DO≥12 mg·L−1,运行30 d后,耗氧有机物、TP、TN和NH3-N的降解率至少可达64.98%、69.74%、61.01%和84.07%,并具有可持续的降解性能。运用高通量测序技术分析了藻菌体系群落结构变化,测序结果表明,四链藻属(Tetradesmus sp.)的相对丰度从4 d的4.80%增加到20 d的44.80%,同时,绿藻门中还出现了其余藻类丰度的增加,分别是相对丰度为2.40%的近头状尖胞藻(Raphidocelis sp.)、2.50%的单针藻(Monoraphidium sp.)、2.20%的衣藻(Chlamydomonas sp.),这些藻来源于活性污泥中的内源藻孢子。研究结果为构建更稳定的菌藻共生系统用于各类河道水质净化提供了理论和数据支撑。Abstract: It’s not common for the technical research on the application of bacterial and algal symbiotic systems to purify the polluted river water, while these technologies are related to the ecological efficiency and human health. Both the microalgae system and algae-bacteria system with activated sludge and Tetradesmus obliquus were used to purify micro-polluted and highly polluted river water, respectively, and the results showed that the purification effect of the algal-bacterial system was better than that of the microalgae system. Algae-bacteria system could improve the water quality from the inferior class V standard to class II one. The running of the algal-bacterial system demonstration device showed that the DO in the river water was ≥12 mg·L−1 after 15 d of operation, and the degradation rates of oxygen consumption organic, TP, TN, and NH3-N could reach at least 64.98%, 69.74%, 61.01%, and 84.07% after 30 d of operation, respectively, even the sustainable degradation performance was maintained afterwards. Changes in the community structure of the algal-bacterial system were analyzed using high-throughput sequencing technology, and the sequencing results showed that the relative abundance of Tetradesmus sp. increased from 4.80% at 4 d to 44.80% at 20 d. At the same time, an increase in the abundance of the remaining algae in the Chlorophyta phylum also occurred, including Raphidocelis sp., Monoraphidium sp., and Chlamydomonas sp. with the relative abundance of 2.40% , 2.50% and 2.20%.These algae originated from endogenous algal spores in the activated sludge. The results of the study provide the theoretical and data support for the construction of more stable bacterial-algal symbiotic systems for purifying water quality in various types of river.
-
阿特拉津(2-Chloro-4-ethylamino-6-isopropylamino-s-triazine,ATZ)是一种通过阻断叶绿体中质体醌结合蛋白和抑制光合作用来防治阔叶和禾草类杂草的选择性除草剂,土壤对其吸附性较低,因此极易向地表水、深层土壤和地下中迁移[1]. 低浓度的阿特拉津显著降低作物的株高、根长、根干重,高浓度的阿特拉津甚至会导致植物死亡[2];阿特拉津影响雄性斑马鱼的神经发育和神经功能[3],已成为一种污染源并对动植物和人类健康造成不可忽视的风险[4-5]. 由于阿特拉津严重的危害及影响,2004年在欧盟被禁止使用,但由于它价格低廉而在世界其他地区被广泛使用,仍是国际上销售的主要除草剂之一.
目前,环境中阿特拉津的去除方法主要有吸附法[6]、光催化法[7]、高级氧化法[8]、植物修复法[9-10]、生物法[11]等,其中基于微生物降解的生物修复法不仅效率高,而且几乎不损害生态环境,并且可将ATZ转化为无毒或低毒的物质.很多研究者已筛选出能将阿特拉津作为唯一氮源或碳源的微生物,如细菌Pseudomonas sp. strain AKN5[12]、Klebsiella sp. FH-1[13]、Citricoccus sp. strain TT3[14]、Arthrobacter sp. 30、Pseudomonas sp. AD39[15]和真菌Pleuroyus ostreatus INCQS 40310[16]等. 这些菌株对阿特拉津具有耐受性并能降解高浓度的阿特拉津,Enterobacter sp.LY-2[17]对浓度为100 mg·kg−1的污染土壤具有修复效果,14 d后阿特拉津浓度降低为9.9 mg·kg−1;产脲节杆菌(Arthrobacter ureafaciens)CS3,培养2 d 可将50 mg·L−1的阿特拉津完全降解[18]. 虽然目前报道的去除阿特拉津的微生物种类较多,但仍然存在停滞期长,降解耗时较长,耐受性差等不足。而且大部分菌株来源于中国北部寒冷地区,东北多为黑土,呈中性或偏碱性、有机质及氮磷含量丰富,而长三角地区雨量充沛、气温较高,土壤通透性差、呈弱酸性、有机质及氮磷含量较低,这些菌株可能不适应长三角的土壤环境,因此有必要寻找适合长三角地区的高效阿特拉津降解微生物资源.
本研究从江苏省5个不同地区的农田土壤中筛选分离能适应长三角地区阿特拉津污染土壤的菌株,研究ATZ初始浓度、温度和pH对菌株繁殖和降解效果的影响,判断菌株的适用环境范围,并采用HPLC-MS测定ATZ的降解产物,推断可能存在的降解转化途径.
1. 材料与方法(Materials and methods)
1.1 主要试剂
阿特拉津(>97%)(C18H14ClN5,分子量214.69,密度为1.2 g·cm−1、沸点为200 ℃、熔点为174 ℃,难溶于水)、甲醇、乙醇、葡萄糖、C6H9Na3O9、C9H11NO、C6H7NO3S、C10H9N等. 无机盐培养基(MSM):Mg2SO4·7H2O 0.1 g·L−1、K2HPO4 1 g·L−1、KH2PO4 1 g·L−1、FeSO4·7H2O 0.025 g·L−1、CaCl2 0.025 g·L−1,适量阿特拉津;富集培养基(LB) :牛肉浸膏5 g·L−1、胰蛋白胨10 g·L−1、NaCl 5 g·L−1,加15 g·L−1琼脂即为固体培养基.
1.2 阿特拉津降解菌的筛选与分离纯化
取江苏省5个长期喷洒阿特拉津的农田表层土壤(0—10 cm)进行降解菌株的驯化. 将土壤样品(5 g)分别加入150 mL MSM培养基中(ATZ浓度为50 mg·L−1),培养条件设置为 30 ℃、150 r·min−1. 驯化7 d后将上清液转至新的MSM培养基中,重复3次适应过程. 最后,将梯度稀释的培养液涂布于LB固体培养基,待菌落长成后,将其进行多次划线分离和纯化,并于无机盐培养基验证降解效果. 最终,筛选出一株能够降解阿特拉津的菌株D2,并采用斜面培养基和甘油保存.
1.3 菌株的鉴定
1.3.1 菌株的形态学观察
将菌株接种于固体培养基,2—3 d后观察长出菌落的形态(形状、色泽、透明程度等);采用扫描电镜(Quanta FEG 250)观察菌株 D2放大50000倍后的表面形态.
1.3.2 生理生化试验
革兰氏染色试验、水解产酸、柠檬酸盐利用、V-P、过氧化氢酶等指标,具体测定方法依据《污染控制微生物实验》[19],并参照《常见细菌系统鉴定手册》[20]与类似细菌进行比较.
1.3.3 16S rDNA基因序列分析
将菌株在固体培养基中划线分离,待菌落长成后进行16S rDNA基因鉴定,由上海天霖生物科技有限公司完成. 将D2的 16Sr DNA 基因序列在BLAST系统中与基因库进行比对分析,并使用MEGA 7.0软件绘制系统发育树.
1.4 菌株生长量的测定及生长模型拟合
采用紫外可见分光光度计(INESA-N4)测定菌株生长不同时间段的OD600以推测菌株的生长情况,以原始溶液为空白对照绘制D2的生长曲线,并用 SGompertz模型[21](式(1))和Slogistic模型[22](式(3))拟合D2的生长曲线,并得到菌株最大比生长速率(μ1、μ2):
lgNt1=lgN0+a1×e−e−k1(X−Xc) (1) μ1=a1×k1e (2) 式中,t为时间(h),Nt1为时间t时菌株的数量,N0为初始菌株数量,Xc为达到最大升值速率的时间(h),μ1为菌株的最大比生长速率(h−1),a1为菌株最大生长量.
Nt2=a21+e−k2(X−X0) (3) μ2=a2×k24 (4) 式中,t为时间(h),Nt2为时间t时菌株的数量,X0为达到最大升值速率的时间(h),μ2为菌株的最大比生长速率(h−1),a2为菌株最大生长量.
1.5 菌株D2最佳降解条件的研究
为了探究环境因素对菌株降解阿特拉津的影响,将菌悬液按照体积比为2%的量接种到含阿特拉津的MSM培养基中,研究不同初始浓度(10、20、50、100、150、200 mg·L−1)、不同pH(5.0、7.0、9.0)、不同温度(10、20、30、40 ℃)下菌株对阿特拉津的降解情况,以转速 150 r·min−1 避光培养,溶液经0.22 μm滤膜后测定阿特拉津的浓度.
1.6 阿特拉津及其降解产物的测定
阿特拉津的浓度采用岛津高效液相色谱仪(LC-20AT,Japan)测定. 检测条件:流动相为V(甲醇):V(水)=60:40,流速为1.0 mL·min−1,波长为220 nm. 降解产物定性分析采用带有高效液相色谱仪UltiMate 3000(Thermo Fisher Scientific,USA)和高分辨质谱仪5600 QTOF(AB SCIEX,Framingham,USA)的超高压液相质谱仪HPLC-MS,色谱柱(ACQUITY UPLC HSS T3 1.8 μm ,2.1 mm×100 mm),以水(含有2 mmol·L−1乙酸铵)和乙腈进行梯度洗脱. 条件:轰击能量,30 eV;雾化气压(GS1):60 Psi,辅助气压,60 Psi;气帘气压,35 Psi;温度,650 ℃;喷雾电压,5000 V(正离子模式)或−4000 V(负离子模式).
2. 结果与讨论(Results and discussion)
2.1 阿特拉津高效降解菌株的分离与鉴定
采用以阿特拉津(50 mg·L−1)为碳源和氮源的无机盐培养基对5个种植玉米的农田土壤经过驯化、分离,筛选出8株生长良好且菌落形态不同的菌株,最终选择一株降解效能最好的菌株,将其命名为D2.
菌株D2的菌落形态观察如图1(a),菌落较小,边缘整齐,浅黄色;革兰氏染色结果表明,D2为革兰氏阳性菌 (图1b ). 扫描电镜(×5000)下观察的菌株形态如图1(c)所示,D2呈杆状. 生理生化试验结果显示(表1),硝酸盐还原及过氧化氢酶试验均呈阳性,其余结果均为阴性.
表 1 菌株D2的生理生化特性Table 1. Physiological characteristic of strain D2特征 Characteristic 结果 Results 革兰氏染色 + 淀粉水解 − 吲哚 − 甲基红 − V-P产生 − 柠檬酸盐利用 − 硝酸盐还原 + 过氧化氢酶 + 注:“+”为阳性;“−”为阴性. Note:“+” means positive and “−” means negative. 将PCR扩增后得到的基因片段进行测序,测序结果在 NCBI 上经 BLAST 分析目标序列与同源序列,并绘制系统发育树(图2),对比发现ATZ降解菌株D2与土壤芽孢杆菌(Solibacillus)的核苷酸序列相似率高达99.58%,因此菌株D2经鉴定为土壤芽孢杆菌.
2.2 菌株D2的生长曲线及模型拟合
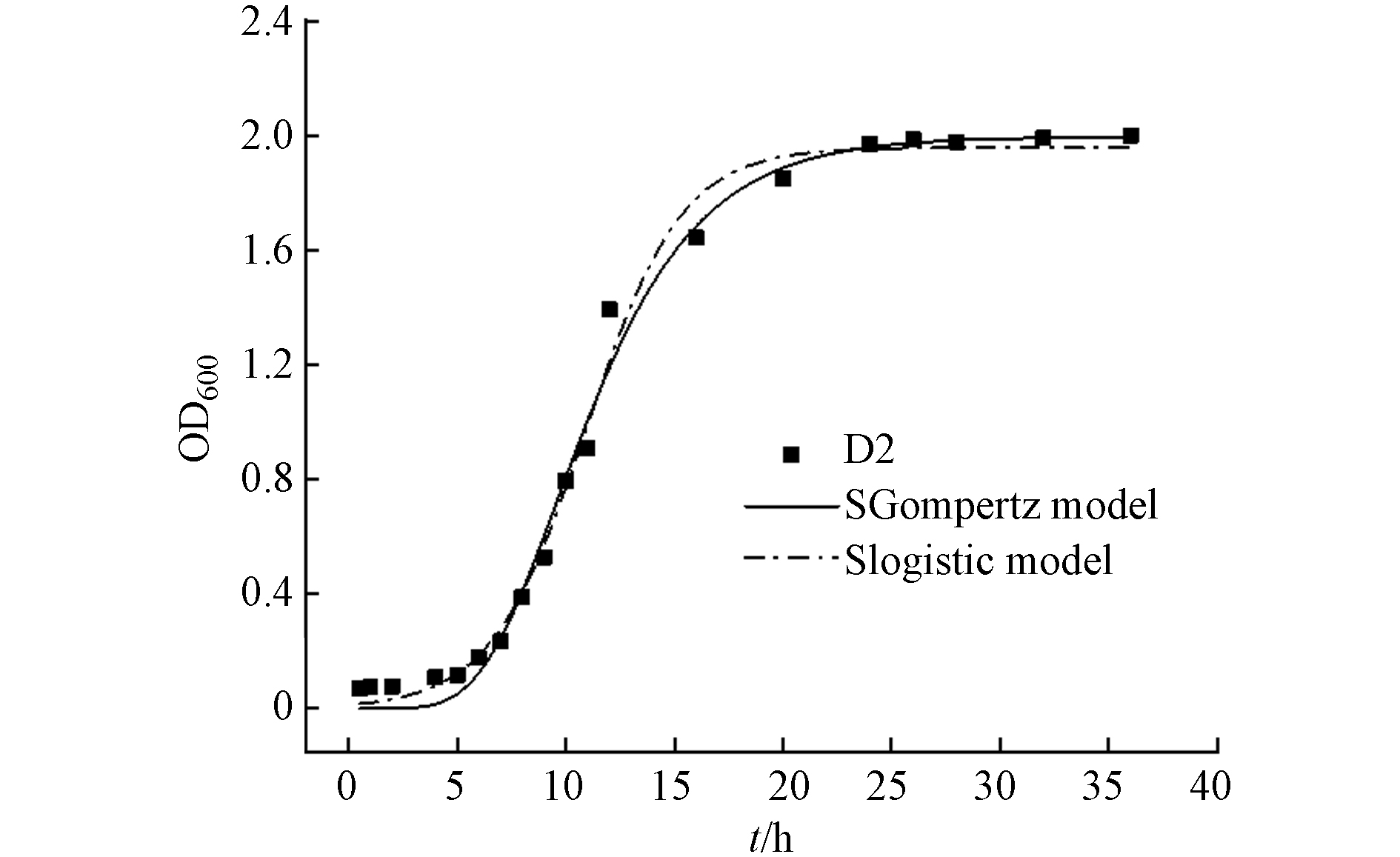
菌株D2的生长曲线见图3. 在LB培养基中,D2经过5 h的适应期后进入菌株代谢旺盛的对数期;12 h后OD600达到1.0,此时的菌株增长速率最快;24 h后达到生长繁殖的峰值,此后OD600不再增长,菌株数量相对趋于稳定.
采用SGompertz模型[23]和Slogistic模型拟合菌株的生长曲线(表2,图3). 结果显示,两种模型均可较好地拟合D2的生长曲线,拟合度(R2)分别为0.991和0.992,在第10 h左右D2到达最大比生长速率,随后比生长速率逐渐降低.
表 2 菌株生长曲线的SGompertz模型和Slogistic模型拟合参数对比Table 2. Comparative list of bacteria growth due to SGompertz and Slogistic model名称 Name SGompertz model Slogistic model R2 a1 K1 XC/h μ1/h−1 R2 a2 K2 X0/h μ2/h−1 D2 0.991 1.995 0.279 9.647 0.214 0.992 1.958 0.454 10.950 0.222 2.3 菌株D2对阿特拉津的降解特性研究
2.3.1 初始浓度对菌株降解阿特拉津的影响
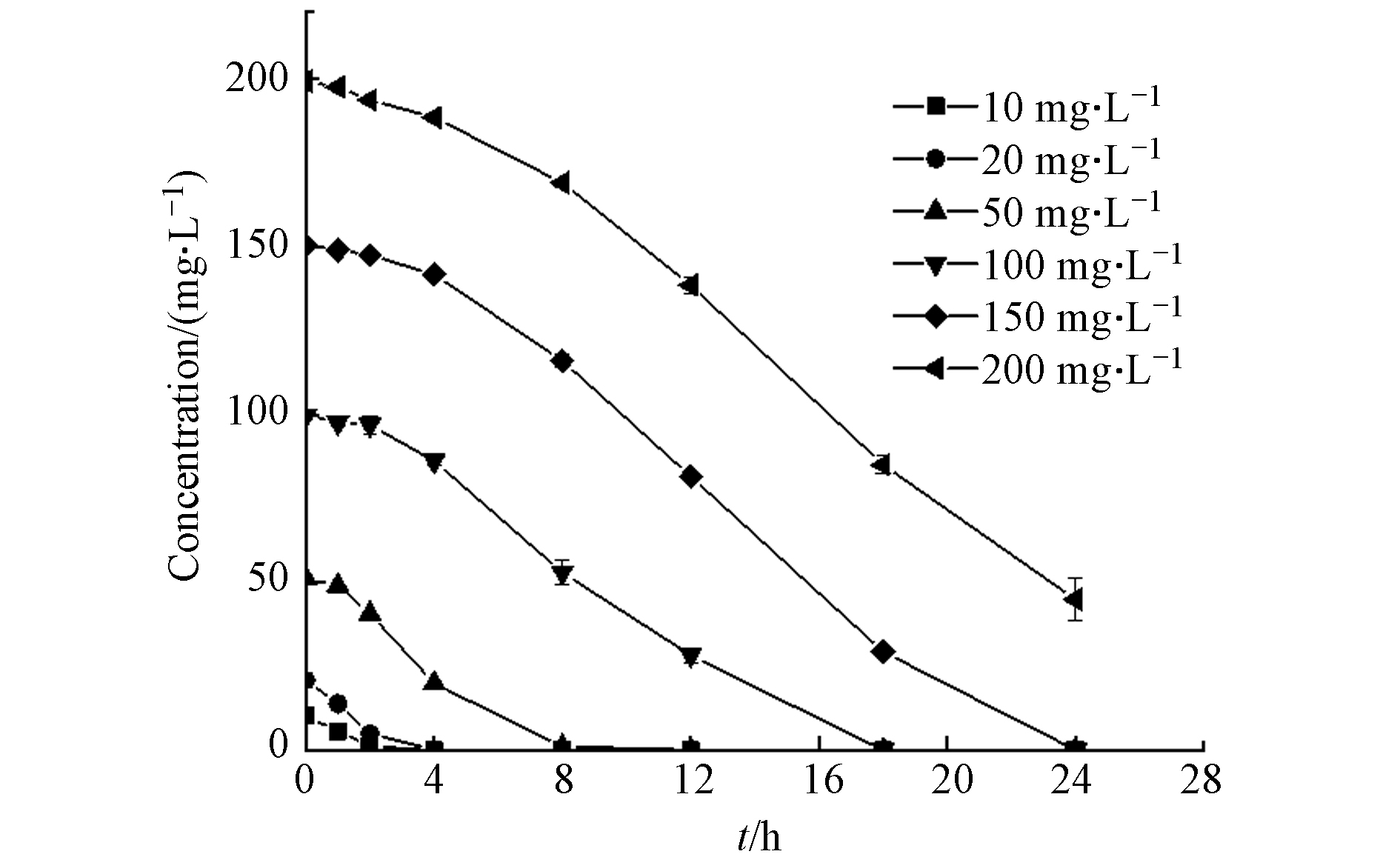
污染物浓度对菌株的影响是评价菌株生长及降解能力的标准之一[24],D2在不同初始浓度下对ATZ的降解效果如图4所示. 当浓度为200 mg·L−1时,D2对ATZ仍具有较高的去除能力,24 h的降解率为77.43%;初始浓度越低,D2的去除效率越高,将初始浓度为150、100、50、20、10 mg·L−1的ATZ完全降解分别需要24、18、8、4、3 h.长三角洲地区农田土壤中ATZ浓度的平均值为5.7 ng·L−1,检出率高达57.7%[25],菌株D2对ATZ的耐受性远高于环境中的平均浓度,因此它是一株在实际污染环境中具有应用价值的降解菌株.
2.3.2 温度和pH对菌株降解阿特拉津的影响
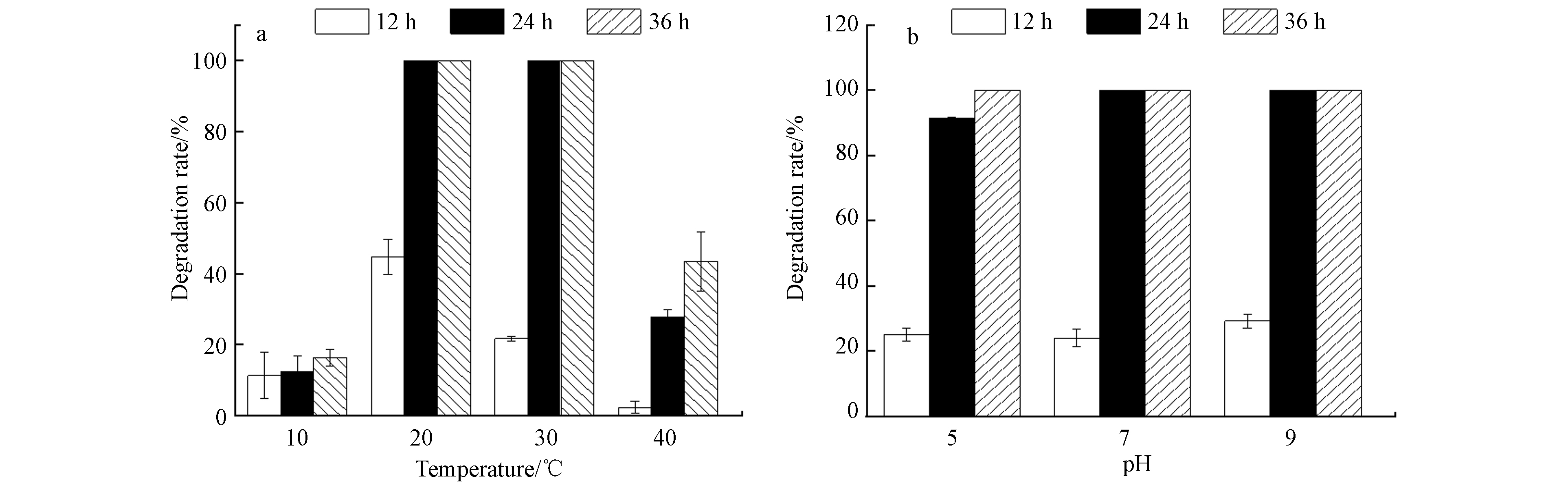
温度和pH会通过影响细菌的生长而影响其降解能力[26-28],不同温度(10、20、30、40 ℃)条件下,D2对初始浓度为100 mg·L−1 ATZ的降解情况见图5a. 当温度为20—30 ℃时,D2在24 h内将ATZ完全降解;但在10 ℃和40 ℃下培养36 h时,D2对ATZ的降解率仅为16.33%和43.48%,说明低温和高温都会抑制菌株的代谢作用,这与菌株的酶活性密切相关[29]. 另外,培养基的酸碱度也会影响细菌酶的合成和催化活性[9],细菌表面的电荷分布随着pH的改变而改变 [26]. 不同pH条件下,D2对初始浓度为100 mg·L−1(培养温度为30 ℃)ATZ的降解率如图5b所示. 当pH为5.0、7.0和9.0 时,经过24 h,D2对ATZ的降解率分别为到91.42%、100%、100%. 据以往研究报道,pH为5.0和9.0时,阿特拉津降解菌(Enterobacter sp.)的降解率低于70%[27],菌株L-6 [28] 仅能适应碱性环境,当pH=6时,降解率为45.6%,因此菌株D2对pH具有较高的适应性.
2.3.3 菌株D2的降解及生长动力学研究
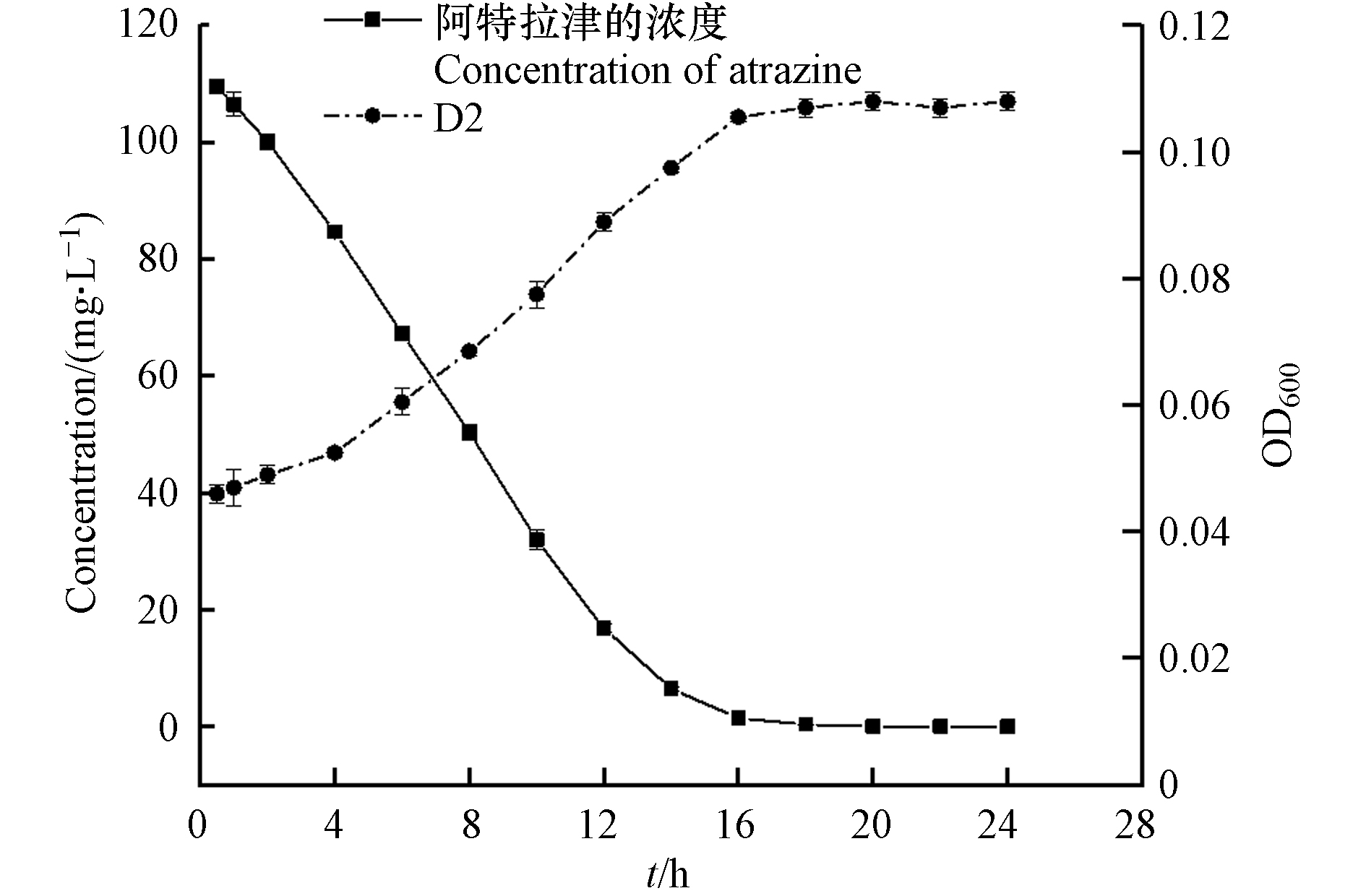
在最佳降解条件下(2%的菌悬液接种量、温度为20 ℃、pH为9.0),将菌株D2接种至初始浓度为100 mg·L−1的ATZ无机盐培养基中,生长及降解动态曲线如图6所示. 菌株D2的生长与ATZ浓度呈较强的负相关(表3,r=−0.983,P<0.01),随着菌株的生长,阿特拉津的浓度急剧降低. 培养初期D2存在短暂的适应期,OD600从0.046增至0.052;培养4 h后进入对数生长期,OD600达到0.097,此时随着菌株的大量生长ATZ被快速降解;在培养14 h以后菌株进入静止期,此时菌株数量达到最大值,其OD600为0.107,ATZ浓度降为6.41 mg·L−1,降解率达到94.33%,在18 h时ATZ被完全去除. 实验结果表明,阿特拉津浓度的降低与D2的数量密切相关,证明菌株D2具有阿特拉津去除能力.
表 3 浓度与OD600的相关性分析Table 3. Correlation analysis between concentration and OD600平均值 Average value 标准差 Standard deviation 浓度 Concentration OD600 浓度 41.093 44.110 1 OD600 0.080 0.026 −0.983** 1 注:* P<0.05,** P<0.01. 2.4 阿特拉津降解产物与降解途径研究
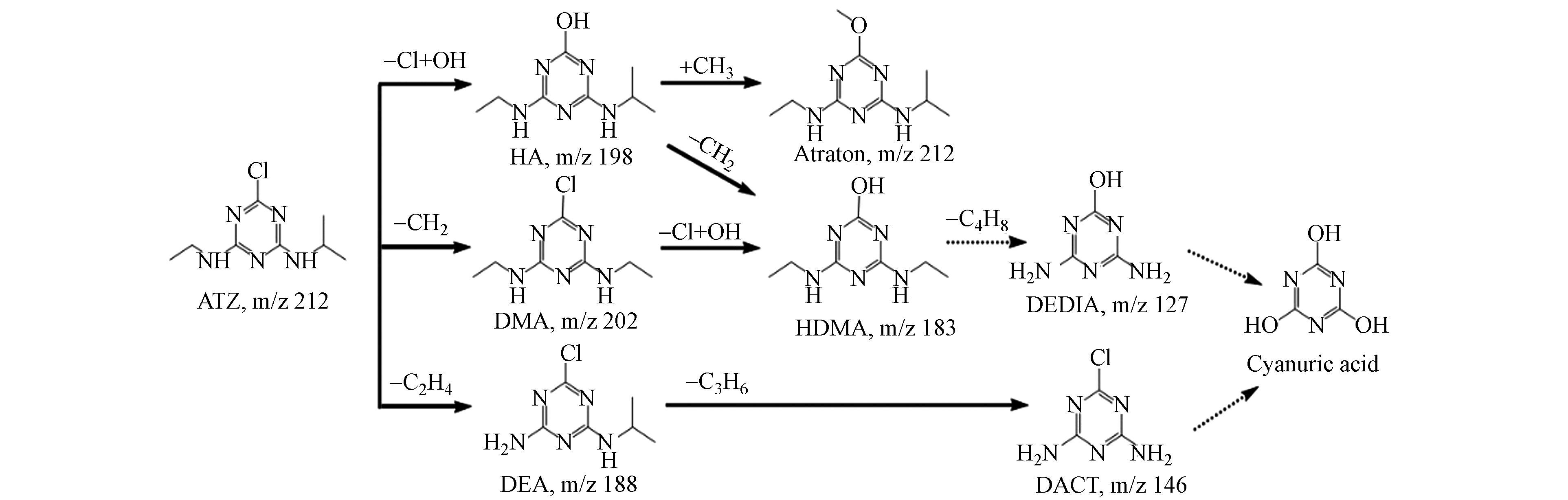
菌株D2于含ATZ的无机盐培养基进行培养,取12 h时的样品进行分析,采用高效液相色谱-质谱联用仪(HPLC-MS)测定其降解产物,共检测出6种可能的代谢物(图7 b—g),质荷比(m/z)分别为146.00、184.12、198.13、202.08、212.15、188.07,与已知标准化合物和报道的阿特拉津代谢物的比较,这6种代谢物分别被确定为脱乙基脱异丙基阿特拉津(DACT)、羟基西玛津(HDMA)、羟基阿特拉津(HA)、西玛津(DMA)、阿特拉通(Atraton)和脱乙基阿特拉津(DEA).
根据产物的结构组成和报道过的阿特拉津降解途径提出菌株D2降解阿特拉津的可能途径,结果如图8所示.
途径Ⅰ:首先羟基取代氯,形成脱氯羟基化的阿特拉津(HA),然后甲基取代HA的氢生成阿特拉通(Atraton),HA也可能通过脱甲基化反应转化为羟基西玛津(HDMA).途径Ⅱ:阿特拉津的异丙基脱甲基化生成西玛津(DMA),然后DMA的氯被一个羟基取代,转化为羟基西玛津(HDMA).途径Ⅲ:阿特拉津经N-脱烷基反应转化为脱乙基阿特拉津(DEA),随后DEA异丙基化为脱乙基脱异丙基阿特拉津(DACT). Liu等[30]在研究土壤中阿特拉津的降解途径时得到了相似的结果,阿特拉津可通过光解、水解及微生物降解转化为羟基阿特拉津、阿特拉通、扑灭津、脱乙基阿特拉津、羟基西玛津、西玛津、去乙基异丙基化阿特拉津等. 而Zhang 等[31]和郭火生等[32]还发现羟基阿特拉津可以被进一步水解为三聚氰酸.通过以上总结推测,阿特拉津的降解中间产物还会通过脱甲基化、脱烷基化和水解等产生三聚氰胺二酰胺(DEDIA)、去乙基异丙基化阿特拉津(DACT)和三聚氰酸等副产物.
2.5 菌株D2的降解能力
将本研究中的D2与已报道过具有阿特拉津降解能力的菌株进行对比,结果汇总如表4所示. 目前已经筛选出很多能以阿特拉津为唯一碳源或氮源生长的菌株,并适用于阿特拉津浓度范围为8—100 mg·L−1的废水,但本研究中的新菌株D2具有更优异的降解性能. 已研究的菌株Acinetobacter lwoffii DNS32 [32]在 20 ℃和 35 ℃时,对阿特拉津的降解率约为 30%—35%,最佳生长pH为7—8,在酸性及pH高于8的条件下,菌株的生长及降解能力受到抑制;菌株C2[33]在20 ℃、30 ℃、40 ℃下培养5 d后,降解率分别为86.7%、97.6%和21.9%;菌株SB5[34]生长的温度范围是25—37 ℃,在pH=8的条件下完全降解ATZ需36 h. 本研究分离出的菌株D2在20 —30 ℃、pH为5.0 — 9.0的范围内,18 h以内即可将100 mg·L−1的阿特拉津完全降解,远远快于培养时间为24 —264 h的其他菌株,且具有更强的pH和温度的适应性,在40 ℃的高温下仍具有一定的活性,降解率高于40%,在10 ℃的条件下,D2对ATZ的降解率仍有近20%. 另外,已报道的菌株大部分来源于北部寒冷地区,而菌株D2来源于江苏省农田土壤,更能适应夏季高温、有机质及氮磷含量低、弱酸性的土壤环境,可成为长三角地区阿特拉津污染土壤和废水修复的微生物资源.
表 4 已报道菌株对阿特拉津的降解效果的比较Table 4. Comparison of atrazine degradation by strains has been reported菌种 Strains 浓度/(mg·L−1)Concentation 温度/℃Temperature pH 地区Region 降解率/% Degradation 时间/h Time 文献来源Literature sources Klebsiella sp. FH1 50 25 9 吉林 81.5% 264 [13] LY-2 100 25 — 35 6 — 9 哈尔滨 98.7% 48 [17] CS3 50 30 7 河北 100% 48 [18] Arthrobacter sp. ZXY-2 50 30 — 35 8 — 9 哈尔滨 100% 6 [35] Arthrobacter sp. DNS10 100 30 7.5 哈尔滨 99.41% 24 [36] Paenarthrobacter sp. W11 100 30 7 吉林 97.1% 60 [37] Paenarthrobacter sp. W24 100 30 7 吉林 94.2% 72 [38] Arthrobacter sp. C2 100 30 7 — 9 吉林 100% 72 [33] Pseudomonas sp. 20 30 / 巴西 99% 24 [39] Achromobacter sp. 20 30 / 巴西 39% 48 [39] Pencillium sp. yz11-22N2 8 28 7 / 91.2% 120 [40] D2 100 20 — 30 5 — 9 江苏 100% 18 本研究 3. 结论(Conclusions)
(1)从江苏省5个不同区域的农田土壤中筛选出一株以阿特拉津为唯一碳源和氮源生长的菌株D2,属于土壤芽孢杆菌(Solibacillus),该菌株能适应长三角地区环境,并有效降解水体和土壤中的阿特拉津.
(2)在pH 5.0—9.0、温度20—30 ℃的条件下,菌株具有良好的降解能力. 最适条件下,D2能在18 h内将100 mg·L−1的ATZ完全降解,具有较高的耐受性及降解效率.
(3)D2主要通过脱氯羟基化、加氢脱烷基化、甲基化、脱烷基化和水解等将ATZ转化为羟基阿特拉津(HA)、阿特拉通(Atraton)、脱乙基阿特拉津(DEA)、西玛津(DMA)、羟基西玛津(HDMA)和脱乙基脱异丙基阿特拉津(DACT).
-
表 1 微污染和高污染实验用水水质数据
Table 1. Water quality data for micro-polluted and highly polluted experimental water
水质指标 COD/(mg·L−1) TN/(mg·L−1) NH3-N/(mg·L−1) TP/(mg·L−1) 微污染地表水 17.84~23.70 1.59~2.50 0.61~1.83 0.46~0.76 高污染地表水 100.12 5.05 3.05 1.01 -
[1] 万晓卉. 臭氧微气泡氧化法处理有机废水研究[D]. 上海: 上海第二工业大学, 2020. [2] 张秀捷. 北运河通州城区段水质净化研究与示范[D]. 北京: 中国农业大学, 2016. [3] CHEW K W, YAP J Y, SHOW P L, et al. Microalgae biorefinery: High value products perspectives[J]. Bioresource Technology, 2017, 229: 53-62. doi: 10.1016/j.biortech.2017.01.006 [4] MA X, ZHOU W, FU Z, et al. Effect of wastewater-borne bacteria on algal growth and nutrients removal in wastewater-based algae cultivation system[J]. Bioresource Technology, 2014, 167: 8-13. doi: 10.1016/j.biortech.2014.05.087 [5] 高晨晨, 孙永利, 葛铜岗, 等. 菌—藻生物膜共生系统的培养[J]. 给水排水, 2013, 49(S1): 186-188. [6] 王乐阳, 张瑞斌, 潘卓兮, 等. 菌藻填料强化生态浮床在河道治理中的应用[J]. 中国环保产业, 2020(1): 44-46. [7] 张正红, 向天勇, 何文辉, 等. 絮凝颗粒化菌藻系统净化缓流微污染河水[J]. 环保科技, 2023, 29(2): 7-12. doi: 10.3969/j.issn.1674-0254.2023.02.002 [8] OGBONNA J C, YOSHIZAWA H, TANAKA H. Treatment of high strength organic wastewater by a mixed culture of photosynthetic microorganisms[J]. Journal of Applied Phycology, 2000, 12(3): 277-284. [9] MA M, Yu Z, JIANG L, et al. Alga-based dairy wastewater treatment scheme: Candidates screening, process advancement, and economic analysis[J]. Journal of Cleaner Production, 2023, 390: 136105. doi: 10.1016/j.jclepro.2023.136105 [10] HUANG H, ZHONG S, WEN S, et al. Improving the efficiency of wastewater treatment and microalgae production for biofuels[J]. Resources, Conservation and Recycling, 2022, 178: 106094. doi: 10.1016/j.resconrec.2021.106094 [11] LAN C N T, THU H Đ T, ĐAO P, et al. Multi-pollutants (organic and inorganic) removal potential of scenedesmus species on municipal sewage water and analyzed their phycoremediation mechanisms[J]. Environmental Research, 2023, 232: 116301. doi: 10.1016/j.envres.2023.116301 [12] SACRISTAN D A M, LUNA-PABWLLO V M, CADENA E, et al. Green microalga scenedesmus acutus grown on municipal wastewater to couple nutrient removal with lipid accumulation for biodiesel production[J]. Bioresource Technology, 2013, 146: 744-748. doi: 10.1016/j.biortech.2013.07.061 [13] 张欣, 董磊, 崔贺, 等. 入河排污口的原位净化及生态修复装置: CN117550725A[P]. 2023-12-08. [14] 章楚卓. 固定化菌藻共生系统去除氮磷的效能研究及EPS在其过程的作用机制[D]. 南昌: 南昌大学, 2023. [15] YU J, DING B, LI R, et al. The efficient capture of polysaccharides in tetradesmus obliquus of indole-3-acetic acid coupling sludge extraction[J]. Science of the Total Environment, 2024, 912: 168963. doi: 10.1016/j.scitotenv.2023.168963 [16] 陈国梅. HACH仪器测定水中的总磷[J]. 工业水处理, 2010, 30(3): 62-63. doi: 10.3969/j.issn.1005-829X.2010.03.020 [17] 董智芝, 马军虎, 何玉龙. 水质分析中国产化试剂替代进口哈希试剂的研究[J]. 中氮肥, 2024(1): 59-61. doi: 10.3969/j.issn.1004-9932.2024.01.017 [18] DOELLE K, QIN Y, WANG Q. Bio-tower application for wastewater treatment[J]. Journal of Engineering Research and Reports, 2020, 11(1): 1-7. [19] MOHD-SALLEH S N A, MOHD-ZIN N S, OTJMAN N, et al. Treat-ability of manihot esculenta peel extract as coagulant aid for stabilised leachate[J]. Pertanika Journal of Science and Technology, 2021, 29(3). [20] TAGHILOU S, PEYDA M, MEHRASBI M R. Modeling of wastewater treatment by azolla filiculoides using response surface methodology[J]. Journal of Environmental Health Science and Engineering, 2021, 19(2): 1723-1733. doi: 10.1007/s40201-021-00727-5 [21] REUTER J A, SPACEK D V, SNYDER M P. High-throughput sequencing technologies[J]. Molecular Cell, 2015, 58(4): 586-597. doi: 10.1016/j.molcel.2015.05.004 [22] 高乾坤, 焦琳舒, 杜贺超, 等. 高通量测序分析不同产地带鱼冷藏时微生物群落多样性[J]. 食品科学, 2018, 39(18): 127-132. doi: 10.7506/spkx1002-6630-201818020 [23] 宋楚儿, 孟振, 张正, 等. 微藻在水产养殖水质净化中的应用[J]. 浙江海洋大学学报(自然科学版), 2023, 42(4): 330-337. [24] YIN S, JIN W, XI T, et al. Factors affect the oxygen production of chlorella pyrenoidosa in a bacterial-algal symbiotic system: Light intensity, temperature, pH and static magnetic field[J]. Process Safety and Environmental Protection, 2024, 184: 492-501. doi: 10.1016/j.psep.2024.02.004 [25] 金忠友, 陈志宏, 郑政, 等. 水环境菌藻共生相互作用研究进展[J]. 环境污染与防治, 2023, 45(6): 870-874+880. [26] MEDINA M, NEIS U. Symbiotic algal bacterial wastewater treatment: Effect of food to microorganism ratio and hydraulic retention time on the process performance[J]. Water Science and Technology, 2007, 55(11): 165-171. doi: 10.2166/wst.2007.351 [27] 赵志瑞, 吴海淼, 马超, 等. 菌藻复合体系氮代谢性能及菌群特征[J]. 环境科学, 2023, 44(5): 2965-2973. [28] 宋学章, 李春岭, 李文敏, 等. 菌藻系统处理养虾海水效果研究[J]. 中国水产, 2010(6): 49-52. doi: 10.3969/j.issn.1002-6681.2010.06.021 [29] 陈海敏, 陈声明. 工厂化水产养殖废水菌藻联合处理模式研究[J]. 浙江树人大学学报, 2002(4): 68-71. [30] CHAO Y, MAO Y, WANG Z, et al. Diversity and functions of bacterial community in drinking water biofilms revealed by high-throughput sequencing[J]. Scientific Reports, 2015, 5(1): 10044. doi: 10.1038/srep10044 [31] KURADE M B, SAHA S, SALAMA E-S, et al. Acetoclastic methanogenesis led by methanosarcina in anaerobic co-digestion of fats, oil and grease for enhanced production of methane[J]. Bioresource Technology, 2019, 272: 351-359. doi: 10.1016/j.biortech.2018.10.047 [32] NIXON S L, DALY R A, BORTON M A, et al. Genome-resolved metagenomics extends the environmental distribution of the verrucomicrobia phylum to the deep terrestrial subsurface[J]. mSphere, 2019, 4(6): 10.1128/msphere. 00613-00619. [33] ZHANG Y, JI T, JIANG Y, et al. Long-term effects of three compound probiotics on water quality, growth performances, microbiota distributions and resistance to aeromonas veronii in crucian carp carassius auratus gibelio[J]. Fish & Shellfish Immunology, 2022, 120: 233-241. -







 下载:
下载: