-
阿特拉津(Atrazine,ATZ)是一种广泛应用于农业的持久性三嗪类除草剂,具有分子结构稳定、半衰期较长、高流动性、低挥发性和高度化学稳定性等特点,易从农田迁移到地表水进而渗入地下水中,威胁水土生态安全[1]。目前,AZT在全球和中国的年使用量分别可达70 000~90 000 t[2]和1 000~1 500 t[3],在地表水、地下水、用于公共供水的水库、湖泊、海洋、以及偏远地区的冰川中已频繁检测出ATZ残留[4-6]。例如,美国自然资源保护委员会2010年调查了美国153个供水系统,结果显示80%的水样中含有ATZ,其中65%的水样中ATZ的含量超过了最高允许质量浓度3 μg·L−1[7];在欧洲,研究人员2010年从23个欧洲国家收集了164个地下水样本,发现ATZ是最常见的污染物之一[8];GENG等[9]研究了中国吉林省迁安市和公主岭市土壤和地下水中的有机污染物,发现土壤和地下水中ATZ的检出率分别为97%和89%。ATZ具有潜在的致癌性和毒性,严重威胁生物健康[10],特别是对鱼类、爬行动物和两栖动物影响重大[11]。例如,XING等[12]研究发现,ATZ会诱导鲤鱼大脑DNA的甲基化,并引起肝脏自噬;HAYES等[13]调查了8个受ATZ污染地区的青蛙生长情况,发现92%的青蛙性腺出现异常,卵细胞形态和睾丸均不正常。此外,ATZ可以通过呼吸、皮肤接触等途径对人体健康造成危害,轻则体重骤减,重则损害人体内分泌系统,还有致癌(卵巢癌和乳腺癌)风险[14]。鉴于ATZ对生态环境的危害,美国环境保护局将其列为可能污染地下水的A类优先化学品;联合国世界卫生组织将其列为C类致癌物质[15]。中国根据《地表水环境质量标准》(GB3838-2002),限制ATZ在地表水中的最大允许质量浓度为3.0 μg·L−1。可见,针对水环境中ATZ等有机除草剂的去除研究具有重要意义。
电化学氧化技术因为具有环境友好、二次污染低、成本低廉、适用性强、操作简单等优点,通常被用于水中有机农药的去除研究。电极材料是影响电化学氧化性能的关键因素,Ti/IrO2、Pb/PbO2、Ti/SnO2-Sb、硼掺杂金刚石(BDD)、Ti/PbO2、Ti/SnO2等高活性阳极已被在用于电化学去除和矿化水中除草剂研究中[16-20]。例如,TRAN等[16]用Ti/PbO2阳极降解水中16.9 mg·L−1的草甘膦溶液,在最优反应条件下反应173 min,草甘膦降解率高达95%,溶液中总有机碳(TOC)去除率可达90.31%;ZAVISKA等[17]分别用圆形Ti/IrO2、Ti/SnO2阳极降解水中ATZ,发现Ti/IrO2降解效果最好,在2.0 A电流下,反应40 min后,ATZ降解率高达95%。WEI等[18]以Ti/SnO2-Sb为阳极降解水中60 mg·L−1丙草铵溶液,在电流密度为20 mA·cm−2、pH=7.2的反应条件下,反应1 h,丙草胺的降解率高达98.8%。SANTOS等[19]用BDD阳极降解水中1-氯-2,4-二硝基苯(DNCB),在pH=3时,DNCB矿化率达62%。然而,目前研究的金属氧化物阳极大多是采用在导电基平板(不锈钢、钛等)上涂覆制成,其电活性面积、稳定性、电极效率均有待提升。
将传统平板电化学阳极改进为多孔或网状结构,有助于提高电极稳定性、电活性面积与传质效率。例如,智丹[21]以Ti4O7为电化学活性膜阳极降解5 mg·L−1的四环素溶液,在最优条件下反应120 min后四环素电化学降解效率和溶液TOC去除率分别达到97.2%和76.8%,且Ti4O7电化学活性膜反应能耗(121.5 KWh·kg−1 TOC)显著低于平板Ti/Ti4O7阳极(271.3 KWh·kg−1 TOC);YOU等[22]用多孔PbO2-CNTs和平板PbO2-CNTs阳极降解水中对硝基苯酚,发现多孔PbO2-CNTs对对硝基苯酚的去除率为96%,TOC的去除率为72%,分别比平板PbO2-CNTs提高了9.6%和14.5%。TANG等[23]制备了多孔Ti/BDD电极和平板Ti/BDD电极进行对比研究,结果表明,多孔Ti/BDD电极的比平板Ti/BDD电极表现出更大的电活性面积,为电化学氧化过程提供了更多的反应和吸附位点。目前还没有活性多孔或网状电化学阳极降解和矿化水中ATZ的相关研究。
为此,本研究拟开展Ti/RuO2-IrO2、Ti/PbO2、Ti/Ti4O7钛网阳极电化学氧化降解和矿化水中ATZ效能及反应路径研究,分析了3种活性钛网阳极表面结构特征和电化学氧化性能;比较和评估了3种钛网阳极电化学降解ATZ效率、溶液TOC去除率、反应能耗;考察了电流密度、ATZ初始质量浓度、溶液初始pH等反应参数对ATZ降解率的影响;探究了ATZ电化学降解中间产物及反应路径,从而为电化学阳极氧化技术去除水中ATZ等有机除草剂农药的实际应用提供参考。
-
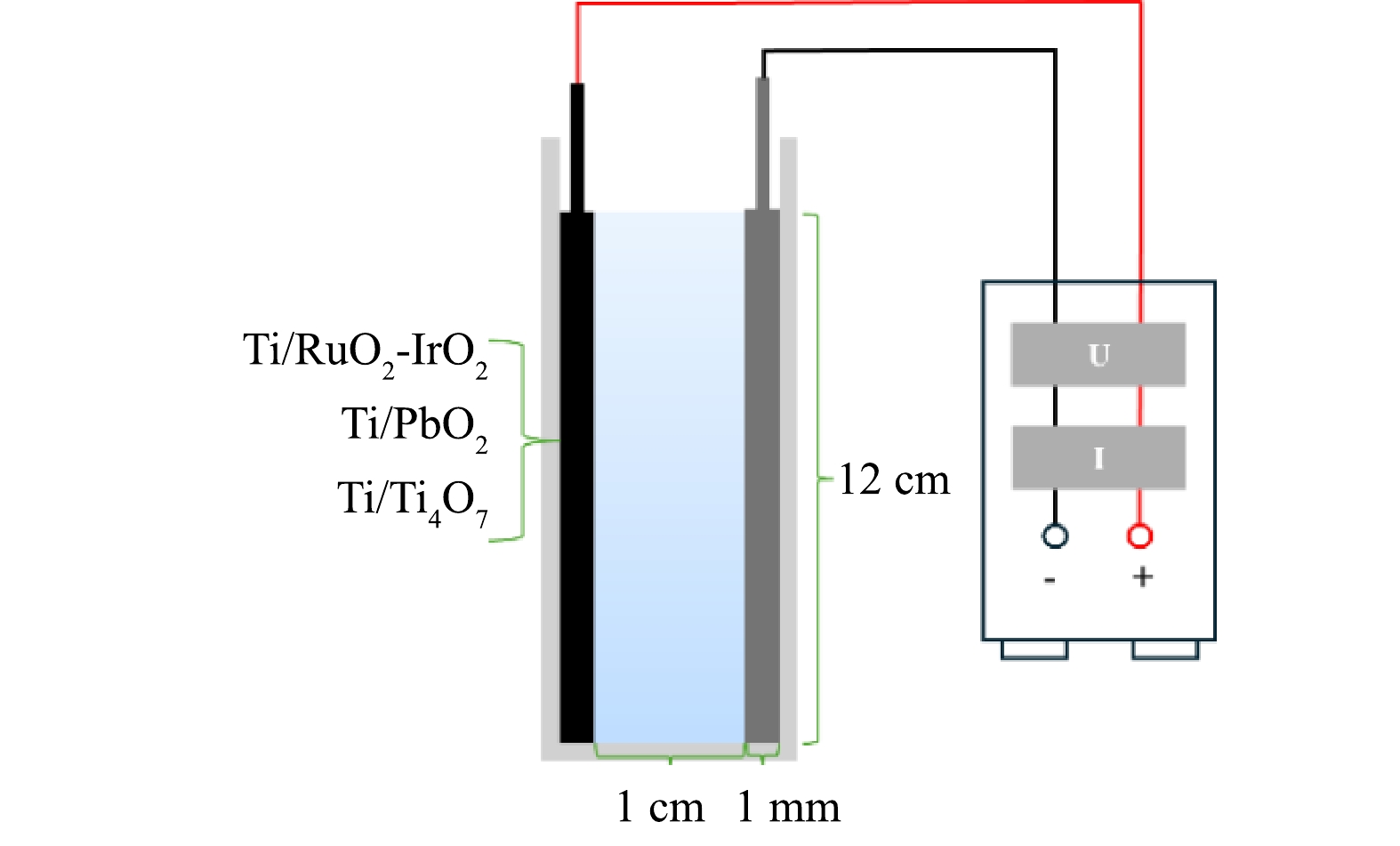
实验所用钛网购自宝鸡智铭特种金属有限公司。Ti/PbO2、Ti/RuO2-IrO2、Ti/Ti4O7钛网阳极的网孔尺寸均在1~4 mm。Ti/PbO2、Ti/RuO2-IrO2、Ti/Ti4O7钛网阳极均以钛网为基板,分别采用电沉积法[24]、热分解法[25]、等离子喷涂法[21]制备,面积为8 cm×12 cm,厚为1 mm,附有1 cm×3 cm接线柱。ATZ(C8H14ClN5,分析纯,99%)、甲醇(色谱纯)、甲酸(色谱纯)、其他试剂(分析纯)均通过湖南省政府采购电子卖场购买,生产厂家为国药集团化学试剂有限公司。
-
电化学氧化降解水中ATZ的反应装置如图1所示,分别以Ti/RuO2-IrO2、Ti/PbO2、Ti/Ti4O7为钛网电极阳极,以钛网为阴极,以长8 cm、宽1.2 cm、高14 cm的有机玻璃反应槽为反应器,阳极和阴极放置在反应器两端,经导线与直流电源正负极相连。在进行电化学氧化降解ATZ实验时,反应器中加入12 cm高的ATZ溶液和30 mmol·L−1的Na2SO4电解质溶液,分析0~90 min内电流密度、ATZ初始质量浓度、溶液初始pH对溶液中ATZ电化学降解效率、溶液TOC去除率的影响。
-
电极形貌结构和表面元素组成采用ZEISS Sigma 300扫描电子显微镜(SEM)进行分析,扫描电压为10 kV,分辨率为2 290 eV。电极表面晶型和强度采用Rigaku Smartlab射线衍射仪(XRD)进行分析,扫描范围为5°~90°,扫描速度1°·min−1。电极线性扫描曲线(LSV)采用电化学工作站(Chenhua, CHI660D, Shanghai)测试,辅助电极采用的是Pt电极,参比电极采用的是饱和甘汞电极。电极表面元素不同价态采用X射线光电子能谱仪(美国Thermo Scientific K-Alpha,XPS)进行分析,激发源Al Kα射线(hv=1 486.6 eV),束斑400 μm。
ATZ质量浓度通过高效液相色谱仪(Agilent,
1100 , USA)测试。色谱柱选用WondaSil C18色谱柱(250 mm×4.6 mm,5 µm),柱温设置为45 ℃,甲醇和去离子水以体积比为70:30的混合作为流动相,流速为1.0 mL·min−1,波长为225 nm,进样量为20 μL,确定质量浓度标准曲线后再进行ATZ质量浓度分析。使用总有机碳测定仪(Shimadzu, TOC-L CPH, Japan)分析溶液TOC变化。使用pH计(FE20K, Mettler-Toledo, Switzerland)测量溶液pH,通过10% H2SO4和1 mg·L−1 NaOH调节pH。ATZ及其电化学降解中间产物采用高效液相色谱三重四极杆串联质谱联用系统(HPLC-MS,API3200,Applied Biosystems,USA)测定。色谱条件为:色谱柱为Arcus EP-C18 Column;流动相A:甲醇,流动相B:0.1%甲酸水,体积比为60:40;流速为0.7 mL·min−1,柱温为35 ℃,进样容量为10 μL;质谱条件:采用的是电喷雾离子源ESI正离子的模式,扫描范围为50~1 000;采用多反应监测(MRM)模式;毛细管电压和锥孔电压分别为3.3 V 和35 V;离子源温度和脱溶剂气温度分别为120 ℃和350 ℃;脱溶剂气流量和锥孔气(流量分别为500 L·h−1 和30 L·h−1)。根据确定的中间产物,结合相应化学原理,推测ATZ电化学降解路径。
电化学氧化降解ATZ的能耗用每去除1 kg TOC需消耗的电能,根据式(1) [26]计算。
式中:E为能耗,kWh·kg−1;U为电压,V;I为电流,A;t为反应时间,h;C为时间t内溶液TOC去除量,mg·L−1;V为溶液体积,L。
-
1) 3种钛网阳极表面形态表征。Ti/RuO2-IrO2、Ti/PbO2、Ti/Ti4O7钛网阳极表面的SEM扫描结果如图2所示。3种钛网阳极的涂层材料在钛网基板表面覆盖均比较整齐、致密,没有明显的裂纹和间隙,其中Ti/RuO2-IrO2钛网阳极表面凹凸不平,存在少量细小的浅裂缝,颗粒形状不规则且尺寸大小不一(图2(a));Ti/PbO2钛网阳极表面由带棱角的晶粒紧密堆积而成,晶体具有较为明显的四棱锥形结构特征,颗粒粗大完整,轮廓均匀清晰(图2(b));Ti/Ti4O7钛网阳极表面呈现互相接连、分布不均匀的团簇结构,且存在许多尺寸大小不一的孔洞,没有明显裂缝(图2(c))。能谱定量数据显示,3种钛网阳极表面均由其活性组分构成元素组成(表1)。其中,Ti/RuO2-IrO2钛网阳极表面的主要组成元素为O、Ti、Ru和Ir,其原子数量占比分别为86.07%、2.70%、9.08%和2.14%,说明电极表面的涂层材料主要是钌和铱的氧化物。Ti元素的检出与SEM图中裂缝的存在相吻合,可能是由于极板表面的涂层不太均匀。Ti/PbO2钛网阳极表面的主要组成元素为O、Pb和Ti,其原子数量占比分别为75.21%、23.97%和0.82%。电极表面Ti的直接暴露非常少,大部分被PbO2覆盖,表明电沉积法制备的Ti/PbO2电极活性层洁净度高、质子分布结构均衡、导电性良好[27]。Ti/Ti4O7钛网阳极表面的主要组成元素为O和Ti,其原子数量占比分别为75.09%和24.91%,说明电极表面的涂层材料主要是钛的氧化物。XRD射线衍射峰数据显示(图3(a)),3种钛网阳极表面活性组分纯度较高,其中Ti/RuO2-IrO2钛网阳极表面的衍射峰位置与RuO2(JCPDS 65-
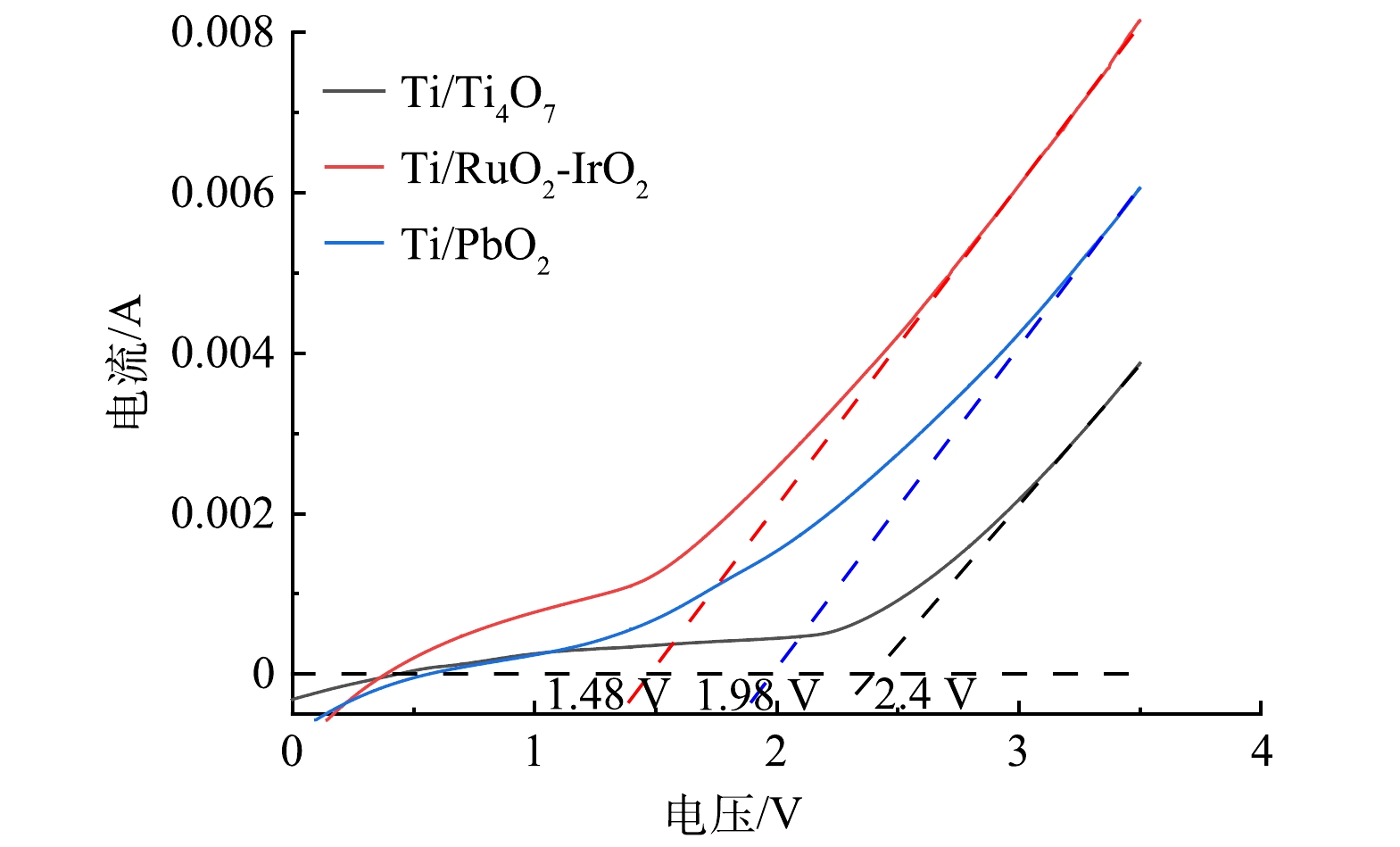
2824 )和IrO2(JCPDS 88-0288)标准衍射峰位置吻合;Ti/PbO2钛网阳极表面的衍射峰位置与PbO2标准衍射峰位置吻合(JCPDS 65-2826 );Ti/Ti4O7钛网阳极表面的衍射峰位置与Ti4O7标准衍射峰位置吻合(JCPDS 50-0787)。此外,Ti/Ti4O7钛网阳极的XPS表征结果(图3(b))表明,其表面含有Ti、O、C元素,O1s在530.1 eV和532.4 eV位置处存在2个明显轨道的峰,分别符合钛氧化物中的晶格氧(Ti—O)和影响电极催化活性的氢氧基团(H—O)的结合能;Ti2p在457.95 eV和458.58 eV位置处存在2个明显对称峰,分别对应+3价Ti和+4价Ti,这与WANG等[28]对Ti4O7材料的XPS表征一致,说明Ti/Ti4O7钛网阳极表面为纯度较高的Ti4O7。可见,Ti/RuO2-IrO2、Ti/PbO2、Ti/Ti4O73种钛网阳极表面活性组分纯度较高且分布致密、均匀,用作电化学降解AZT阳极材料具有优势。2) 3种钛网阳极的电化学性能表征。LSV曲线能反映极板析氧电位(OEP)的变化规律,WANG等[29]研究发现OEP值越高,电化学析氧副反应抑制程度越高,因而电化学氧化有机物的电流效率越高。在0.5 mg·L−1 H2SO4溶液中,对Ti/RuO2-IrO2钛网阳极、Ti/PbO2钛网阳极、Ti/Ti4O7钛网阳极进行LSV测试,扫描电压为0~3.5 V,扫面速率为0.05 V·s−1,测试结果如图4所示。以饱和甘汞电极为参比电极,Ti/RuO2-IrO2钛网阳极的OEP约为1.48 V,Ti/PbO2钛网阳极的OEP约为1.98 V,Ti/Ti4O7钛网阳极的OEP约为2.4V,可见,Ti/Ti4O7阳极析氧电位较高,其电化学氧化有机物的电流效率会更高。
3) 3种钛网阳极的可重复使用性能。在电流密度20 mA·cm−2、ATZ初始质量浓度5 mg·L−1、30 mmol·L−1Na2SO4、pH=7.0的最优反应参数条件下,将Ti/RuO2-IrO2、Ti/PbO2和Ti/Ti4O7钛网阳极用于电化学降解ATZ实验并重复使用30次(每次90 min)后,Ti/Ti4O7钛网阳极对水中ATZ的去除率基本没有变化,Ti/RuO2-IrO2和Ti/PbO2对水中ATZ的去除率随阳极板使用次数的增加呈现下降趋势。可见,对比Ti/RuO2-IrO2和Ti/PbO2,Ti/Ti4O7网板阳极对水中ATZ和TOC去除效果相对较好,其稳定性较好、安全性较高、使用寿命更长[30]。这与对Ti/RuO2-IrO2、Ti/PbO2和Ti/Ti4O7表面形态表征的结果一致。表明Ti/Ti4O7钛网阳极具有良好的重复性,是适合用于ATZ等有机除草剂的降解和矿化的电极。
-
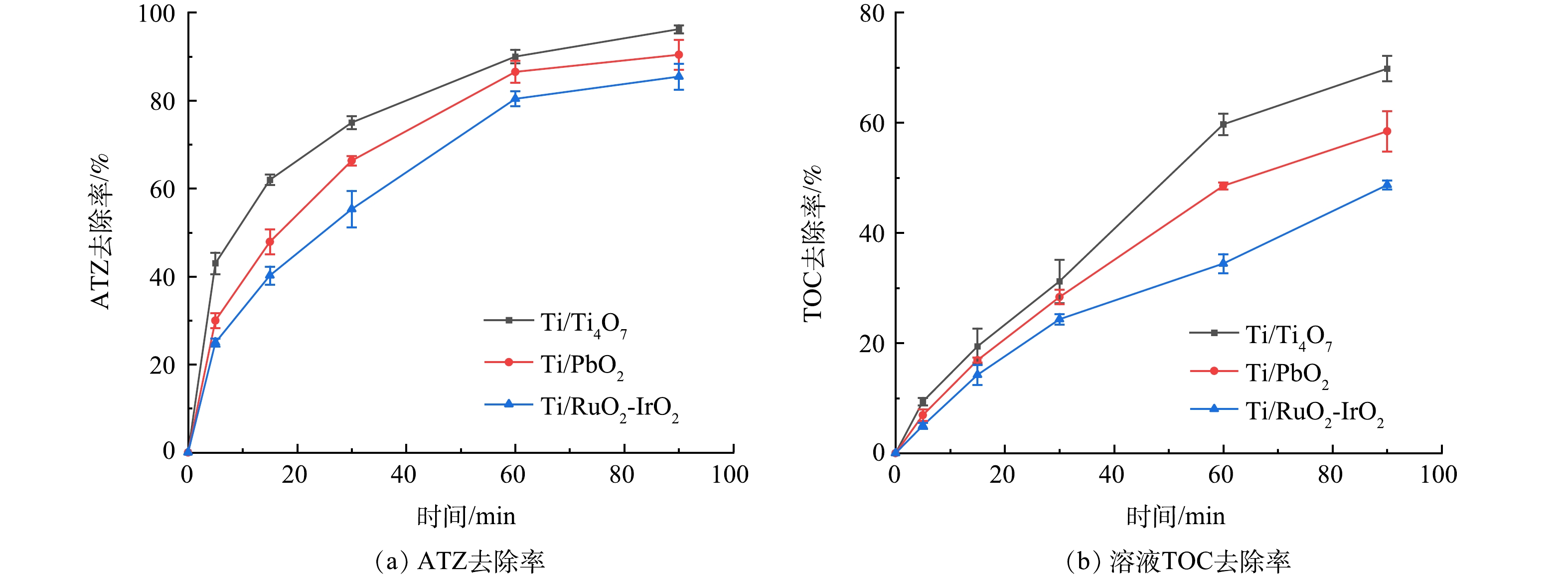
为了评估Ti/RuO2-IrO2、Ti/PbO2和Ti/Ti4O7钛网阳极电化学降解和矿化水中有机除草剂农药效能,在电流密度20 mA·cm−2、ATZ初始质量浓度5 mg·L−1、pH=7.0的最优反应参数条件下,将3种钛网阳极电化学降解ATZ时的ATZ降解效率和溶液TOC去除率进行了比较分析,其结果如图5所示。随着反应时间的延长,3种钛网阳极对水中ATZ降解效率和溶液TOC去除率均呈增加的趋势。当电化学反应到90 min时,Ti/Ti4O7、Ti/PbO2和Ti/RuO2-IrO2降解ATZ效率分别为96.3%、90.4%和85.5%(图5(a))。可见,Ti/Ti4O7降解ATZ效率高于Ti/PbO2和Ti/RuO2-IrO2。当电化学反应到90 min时,Ti/Ti4O7、Ti/PbO2和Ti/RuO2-IrO2降解ATZ时溶液TOC去除率分别为69.8%、58.4%和48.7%(图5(b))。可见,3种钛网阳极电化学降解ATZ时,Ti/Ti4O7钛网阳极对溶液TOC去除率明显高于Ti/PbO2和Ti/RuO2-IrO2钛网阳极。由此可知,与Ti/PbO2和Ti/RuO2-IrO2钛网阳极相比,Ti/Ti4O7钛网阳极对水中ATZ和TOC去除效果相对较好。用于电化学阳极氧化的材料可分为“活性”和“非活性”阳极,有机物分子在“非活性”阳极表面易被水分子氧化生成的羟基自由基(·OH)高效氧化而达到降解的目的,Ti/Ti4O7和Ti/PbO2钛网阳极是较为典型的“非活性”阳极[31]。然而,Ti/PbO2钛网阳极中的Pb金属可能会从阳极中浸出,存在溶液铅污染的隐患[32]。以贵金属为材料的阳极如Ti/RuO2-IrO2被称为“活性”阳极,水分子氧化产生的·OH在其表面会被进一步氧化成一种能与网板共价结合的活性物质(被称为化学吸附的活性氧),活性阳极一般不能将复杂有机物显著矿化[33]。综合来看,Ti/Ti4O7钛网阳极是最为合适的高活性电化学阳极材料。
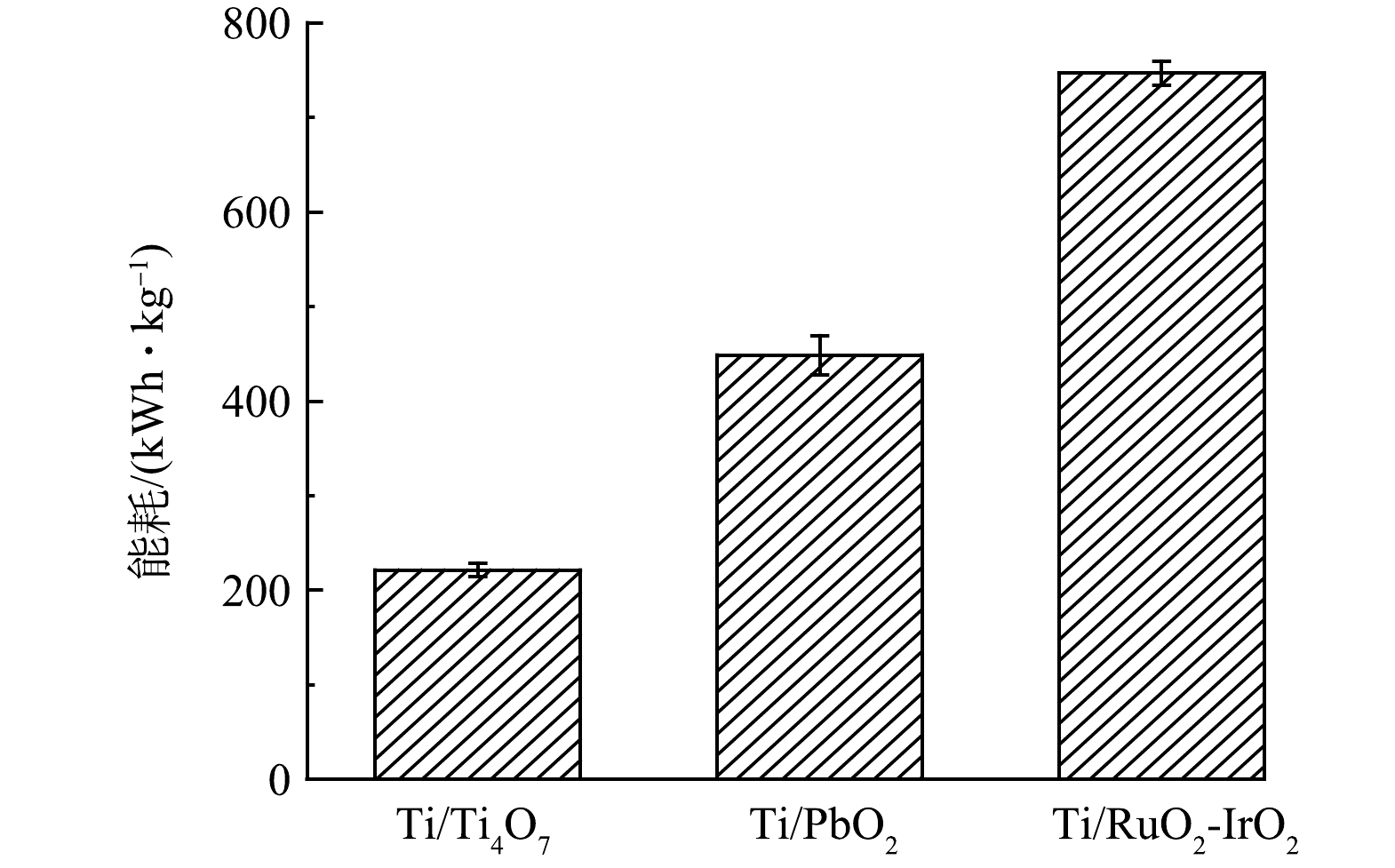
为评估Ti/RuO2-IrO2、Ti/PbO2和Ti/Ti4O7钛网阳极用于水中有机除草剂去除的经济性,将Ti/RuO2-IrO2、Ti/PbO2和Ti/Ti4O7在电流密度20 mA·cm−2、ATZ初始质量浓度5 mg·L−1、pH=7.0的最优反应条件下降解ATZ,达到相近TOC去除率(≈50%)时的反应能耗进行比较分析。由图6中结果可见,Ti/RuO2-IrO2、Ti/PbO2和Ti/Ti4O7反应能耗分别为746.8、448.7和221.4 kWh·kg−1。可见,Ti/Ti4O7钛网阳极电化学降解ATZ时反应能耗明显低于Ti/RuO2-IrO2和Ti/PbO2。因此,Ti/Ti4O7钛网阳极电化学氧化降解ATZ时,不仅对水中ATZ和TOC去除率高于Ti/RuO2-IrO2和Ti/PbO2,且反应能耗明显低于Ti/RuO2-IrO2和Ti/PbO2。
-
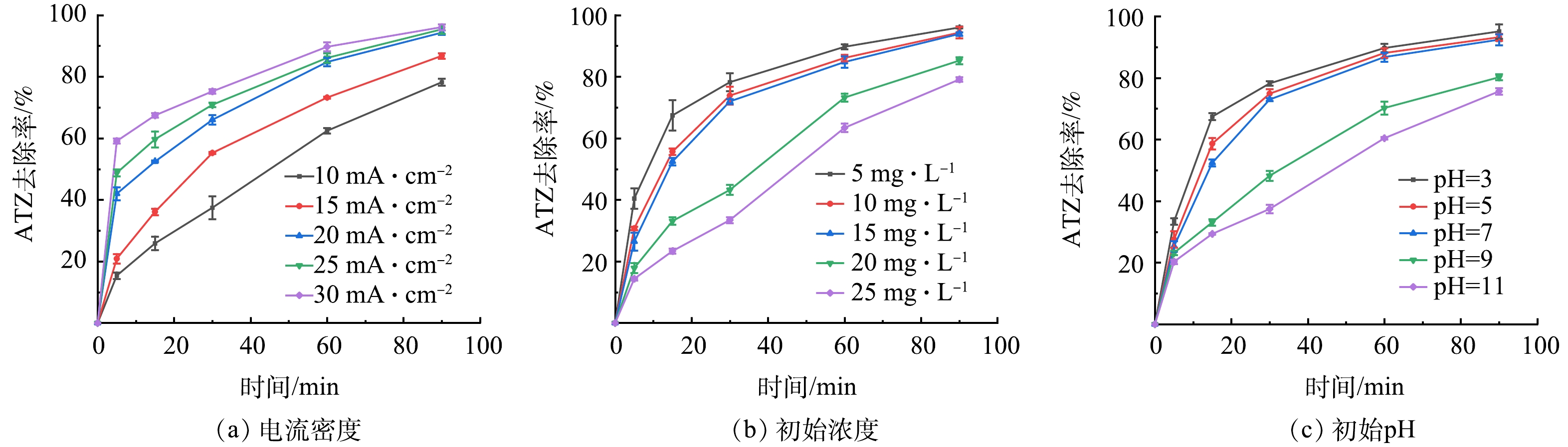
为探究反应参数对Ti/Ti4O7钛网阳极电化学降解ATZ效率的影响,测定了不同电流密度(10~30 mA·cm−2)、ATZ初始质量浓度(5~25 mg·L−1)、溶液初始pH(3~11)的反应条件下,ATZ质量浓度随时间的变化,分析ATZ电化学降解效率变化规律,结果如图7所示。
电流密度对ATZ电化学降解效率的影响如图7(a)所示。整体来看,ATZ电化学降解效率随电流密度的增大而增大。当电化学反应到90 min时,随着电流密度从10 mA·cm−2增大到25 mA·cm−2,ATZ电化学降解率从78.2%增加到96.3%。结果表明,电流密度对电化学氧化对ATZ的降解效率影响较大,通过提高电流密度可以显著提高水溶液中有机污染物的去除和矿化效率。这与王雪等[34]用三维多孔Sb掺杂SnO2阳极电化学降解ATZ时得到的结果一致。当电流密度超过20 mA·cm−2时,继续增加电流密度对ATZ降解率的提升并不显著,这与智丹等[35]使用Ti4O7阳极电化学降解美托洛尔和赵丹荻等[36]使用BDD阳极电化学降解甲氧苄啶时发现的规律一致。这可能是由于电流密度小于20 mA·cm−2时,ATZ电化学氧化反应处于半传质控制,电化学氧化速率与电流密度有关,ATZ降解速率随电流密度的增大而增大;随着电流密度的增大,ATZ电化学氧化反应逐渐处于传质控制,反应符合一级反应动力学规律,电流密度继续增大将不能再使电化学氧化反应速率明显增大[20,35]。此外,电流密度的增加会提高副反应(如析氧反应)的反应速率,从而导致电流效率下降和能源成本增加[37]。因此,在Ti/Ti4O7钛网阳极电化学降解ATZ时,电流密度达到20 mA·cm−2后,为提高ATZ电化学降解效率继续增加电流密度会使反应能耗增加、电极电流效率减小。
ATZ初始质量浓度对其电化学降解效率的影响如图7(b)所示。ATZ电化学降解效率随初始质量浓度的增大有减小趋势。当初始质量浓度从5 mg·L−1增大到25 mg·L−1,ATZ在90 min内电化学降解效率从95.8%降低到79.1%。智丹等[35]用Ti/Ti4O7平板阳极电化学降解水中的美托洛尔时也发现了类似的规律。这可能是由于在一定电流密度下,钛网阳极表面水分子氧化产生的·OH浓度一定。扩散到极板表面的ATZ分子数量随ATZ初始质量浓度的增加而增加,当扩散到极板表面的ATZ分子数量大于氧化这些ATZ分子所需·OH数量时,·OH不足以进行有效地氧化降解ATZ,导致ATZ降解效率降低。
溶液初始pH对ATZ电化学降解效率的影响如图7(c)所示。ATZ电化学降解率随初始pH的增大而减小。随着初始pH从3增大到7,ATZ电化学降解效率变化不大,但当初始pH从7增大到11后,ATZ在90 min内电化学降解率由92.4%降低到75.6%。在酸性条件下,·OH具有更强的氧化能力,且酸性条件有利于·OH的生成[38],从而使ATZ在Ti/Ti4O7阳极达到更高效的电化学氧化。相反,碱性条件可能会抑制·OH的生成,从而阻碍ATZ的氧化降解。这表明ATZ的降解率受溶液pH的影响,ATZ的电化学降解效率随着pH的增大而减小。此现象与GONG等[39]使用Ce掺杂Ti/Ti4O7阳极电化学降解阿替洛尔的研究结果相吻合,在酸性条件下,Ti/Ti4O7-Ce电极对阿替洛尔的降解速度比在碱性条件下更快。
-
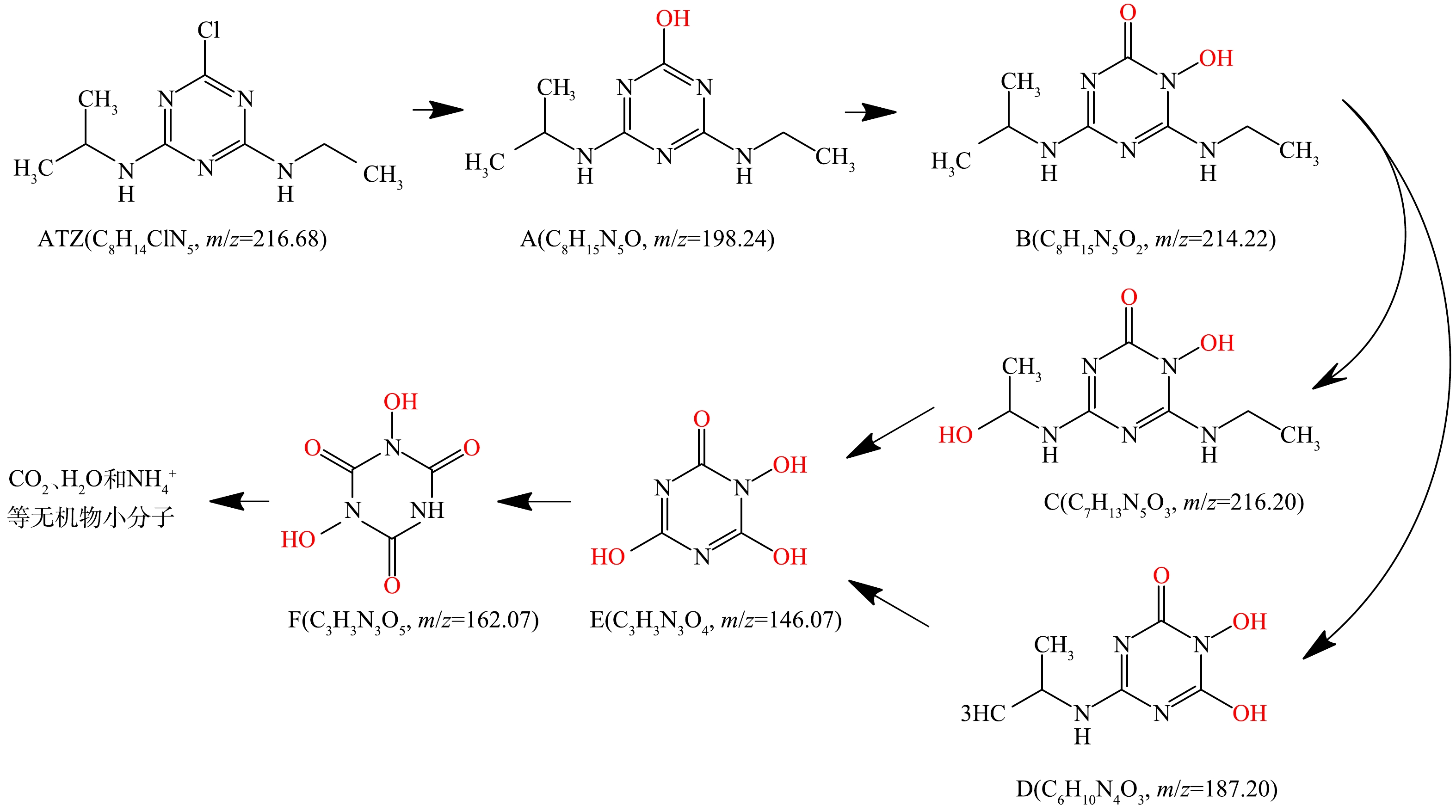
为探究ATZ电化学氧化副产物及其降解路径,以Ti/Ti4O7钛网电极为电化学阳极,通过HPLC-MS对最佳反应条件ATZ电化学反应产物进行了分析。通过对比0 min和30 min的HPLC-MS质谱图,结合ATZ分子自身的化学性质和机构特点,确定了包括ATZ在内的6种ATZ电化学降解中间产物(表2)。根据ATZ电化学降解产物检测结果、结合ATZ分子自身结构特点和相应化学原理,推断首先·OH首先攻击ATZ三嗪环上的氯,发生脱氯羟基化反应形成A(m/z=198.24),随后A上的—OH被氧化为羰基(=O)生成中间体B(m/z=214.22),B进一步通过烷基羟基化反应分别生成了C(m/z=216.20)和D(m/z=187.20),C和D再通过侧链脱烷基化和羟基化进一步降解为E(m/z=146.07)。最终,这些低分子量的物质进一步矿化为CO2、H2O、NH4+以及其他的小分子物质,完成了ATZ在电化学降解过程中的彻底转化,其降解路径见图8。
为了进一步探究ATZ电化学氧化过程中的毒性变化,使用ECOSAR软件对中间产物进行了毒性预测,结果如表3所示。《全球化学品统一分类和标签制度》(GHS)给出了4类毒性值分类,分别是强毒性(LC50/EC50、ChV≤1.0 mg·L−1)、有毒性(1.0 mg·L−1L≤LC50/EC50、ChV≤10.0 mg·L−1)、有害性(10.0 mg·L−1≤LC50/EC50、ChV≤100.0 mg·L−1)、无害性(LC50/EC50、ChV>100.0 mg·L−1)。结合 HPLC-MS 分析结果,ATZ母体是毒性最强的有机物,对于鱼类、水蚤类、藻类的急性毒性分别是32.7、20、20.4 mg·L−1,均属于有害性;对于鱼类、水蚤类、藻类的慢性毒性分别是3.49、2.41、6.31 mg·L−1,均属于有毒性。结合ATZ结构来看,其毒性可能是含氯基团所致。ATZ的电化学氧化中间产物A~F的毒性水平均低于ATZ,其中A和B经过脱氯羟基化后毒性有所降低,但对于慢性毒性水蚤类仍表现为有毒性,其慢性毒性的主要作用方式可能是利用三嗪环及其两侧氨基支链实现的。随着氧化程度的加深,得到中间产物C~F,已经失去其对鱼类、水蚤类、藻类的急性毒性和慢性毒性。
-
1)与Ti/PbO2和Ti/RuO2-IrO2相比,Ti/Ti4O7电化学降解和矿化水中ATZ效果较好,ATZ的降解率和溶液TOC去除率可达96.3%和69.8%;达到相同TOC去除率时Ti/Ti4O7钛网阳极的能耗最低,较Ti/RuO2-IrO2低70%左右,较Ti/PbO2低50%左右,具有较好的实用性;且重复使用多次,其电化学降解ATZ效率基本不变,稳定性较好。
2) ATZ电化学降解率随电流密度增大而增大、随ATZ质量浓度和溶液初始pH的增大而减少。
3)水中ATZ电化学降解生成A(m/z=198.24)、B(m/z=214.22)、C(m/z=216.20)、D(m/z=187.20)、E(m/z=146.07)、F(m/z=162.07)等中间产物,进一步氧化为二氧化碳、水、硝酸根等无机物小分子。
4)采用具有多孔特性的钛网阳极进行难降解有机农药电化学氧化,有助于提高电极稳定性、电活性面积与传质效率,同时克服了平板电极渗透性低和能耗损失大的问题,为进一步提升电极材料的性能、开发更高效的电化学水处理技术、以及推动电化学水处理技术工业化应用提供了新的思路和方向。
5) Ti/Ti4O7钛网阳极工艺成本低、安全性较好,更适合用于ATZ等三嗪类有机除草剂农药的降解,在含有ATZ农药废水的高效降解处理方面具有广泛的应用前景。
3种活性钛网阳极电化学降解水中阿特拉津
Electrochemical oxidation of atrazine in water using three active titanium mesh anodes
-
摘要: 阿特拉津(atrazine, ATZ)等有机杀虫剂的大量生产和使用对水生态安全造成威胁,其可被电化学阳极氧化技术有效降解和矿化。为探究水中ATZ电化学降解效率、能耗与反应路径,以多孔钛网为基板制备Ti/RuO2-IrO2、Ti/PbO2、Ti/Ti4O7钛网阳极,开展电化学降解和矿化水中ATZ研究,分析了3种钛网阳极表面结构特征和电化学性能;比较和评估3种钛网阳极电化学降解ATZ效率、溶液总有机碳(TOC)去除率、反应能耗;考察了电流密度、ATZ初始质量浓度、溶液初始pH等反应参数对ATZ降解效率的影响;探究了ATZ电化学降解中间产物及反应路径。结果表明:Ti/RuO2-IrO2、Ti/PbO2、Ti/Ti4O7钛网阳极表面活性组分覆盖致密、均匀,其电析氧电位为Ti/Ti4O7 (2.4 V)>Ti/PbO2 (1.98 V)>Ti/RuO2-IrO2 (1.48 V);3种钛网阳极电化学降解和矿化ATZ效率较高,ATZ的降解率和溶液TOC去除率分别为85.45%~96.3%和48.7%~69.8%,其中Ti/Ti4O7钛网阳极对ATZ和TOC去除率可达96.3%和69.8%;与Ti/RuO2-IrO2和Ti/PbO2相比,Ti/Ti4O7稳定性较好,反应能耗(221.4 kWh·kg−1)较低;ATZ电化学降解率随电流密度增大而升高、随ATZ初始质量浓度和溶液初始pH的增大而降低;水中ATZ电化学降解产生A(C8H15N5O, m/z=198.24),A继续氧化生成B(C8H15N5O2, m/z=214.22)、C(C7H13N5O3, m/z=216.20)、D(C6H10N4O3, m/z=187.20)、E(C3H3N3O4, m/z=146.07)、F(C3H3N3O5, m/z=162.07)等中间产物。Abstract: The mass production and use of organic pesticides such as atrazine (atrazine, ATZ), which threaten water ecological safety, can be effectively degraded and mineralized by electrochemical anodic oxidation (EAO) technology. To investigate the efficiency, energy consumption, and reaction path of electrochemical degradation of ATZ in water, Ti/RuO2-IrO2, Ti/PbO2, and Ti/Ti4O7 titanium mesh anodes were prepared using a porous titanium mesh substrate, and the tests on the electrochemical degradation and mineralization of ATZ in water were conducted. The surface structural characteristics and electrochemical properties of three titanium mesh anodes were analyzed. The degradation efficiency of ATZ, the total organic carbon (TOC) removal rate from the solution, and the reaction energy consumption were compared and evaluated in the electro-oxidation processes within these three types of titanium mesh anodes. The effects of various reaction parameters, including the current density, the initial concentration of ATZ, and the initial pH, on the degradation efficiency of ATZ were investigated. The degradation intermediates and reaction pathways of ATZ electro-oxidation were also explored. The results showed that the surfaces of the Ti/RuO2-IrO2, Ti/PbO2, and Ti/Ti4O7 titanium mesh anodes were densely and uniformly covered with active components, and their oxygen evolution potentials were Ti/Ti4O7 (2.4 V) > Ti/PbO2 (1.98 V) > Ti/RuO2-IrO2 (1.48 V). The three types of titanium mesh anodes demonstrated high efficiency in the electrochemical degradation and mineralization of ATZ. The degradation efficiency of ATZ and the TOC removal rate from the solution ranged from 85.45% to 96.3% and 48.7% to 69.8%, respectively. Among these, the Ti/Ti4O7 titanium mesh anode could lead to an ATZ degradation efficiency of 96.3% and a TOC removal of 69.8%. Compared with the Ti/RuO2-IrO2 and Ti/PbO2 titanium mesh anodes, the Ti/Ti4O7 titanium mesh anode exhibited better stability and lower energy consumption (221.4 kWh·kg−1). The electrochemical degradation efficiency of ATZ increased with the increase of current density, while decreased with the increase of initial ATZ concentrations or pH. The ATZ in water was gradually degraded into intermediate A (C8H15N5O, m/z=198.24), which was further oxidized into intermediates B (C8H15N5O2, m/z=214.22), C (C7H13N5O3, m/z=216.20), D (C6H10N4O3, m/z=187.20), E (C3H3N3O4, m/z=146.07), and F (C3H3N3O5, m/z=162.07).
-
Key words:
- atrazine /
- electrochemical oxidation /
- titanium mesh anode /
- degradation efficiency /
- reaction pathway
-

-
表 1 Ti/RuO2-IrO2、Ti/PbO2、Ti/Ti4O7钛网阳极组成元素分析
Table 1. The elements content analysis of the Ti/RuO2-IrO2 , Ti/PbO2 , Ti/Ti4O7 titanium mesh anode
钛网阳极 元素 质量分数/% 原子数量占比/% Ti/RuO2-IrO2 O 48.56 86.07 Ir 14.50 2.14 Ru 32.37 9.08 Ti 4.57 2.70 Ti/PbO2 O 19.38 75.21 Pb 79.99 23.97 Ti 0.63 0.82 Ti/Ti4O7 O 50.17 75.09 Ti 49.83 24.91 表 2 HPLC-MS鉴别出的ATZ及其降解中间产物
Table 2. ATZ and their degradation intermediates identified by HPLC-MS
化合物 质荷比/m/z 分子式 ATZ 216.68 C8H14ClN5 A 198.24 C8H15N5O B 214.22 C8H15N5O2 C 216.20 C7H13N5O3 D 187.20 C6H10N4O3 E 146.07 C3H3N3O4 F 162.07 C3H3N3O5 表 3 ATZ及其电化学氧化中间产物毒性值
Table 3. Toxicity values of ATZ and its electrochemical oxidation intermediates
化合物 m/z 急性毒性/(mg·L−1) 慢性毒性(ChV)/(mg·L−1) 毒性分类 鱼类
(LC50)/96 h水蚤类
(LC50)/48 h藻类
(EC50)/96 h鱼类
(LC50)水蚤类
(LC50)藻类
(EC50)ATZ 216.68 32.7a 20a 20.4a 3.49b 2.41b 6.31b 有毒性 A 198.24 134 76.7a 59.2a 13.2a 7.66b 15.8a 有毒性 B 214.22 377 37.9a 43.8a 36.8a 2.64b 12.9a 有毒性 C 216.2 7 330 587 1 060 1 430 32.8a 265 有害性 D 187.2 325 000 131 000 23 800 21 200 4 940 2 900 无害性 E 146.07 250 000 101 000 18 300 16 300 3 800 2 240 无害性 F 162.07 17 700 8 060 2 430 1 330 428 392 无害性 注:表中a代表有害性;b代表有毒性;其余为无毒性。 -
[1] JIANG Q, ZHANG Y, JIANG S, et al. Graphene-like carbon sheet-supported nZVI for efficient atrazine oxidation degradation by persulfate activation[J]. Chemical Engineering Journal, 2021, 403(1): 126309. [2] ZHANG C, QIN L, DOU D C, et al. Atrazine induced oxidative stress and mitochondrial dysfunction in quail (Coturnix C. coturnix) kidney via modulating Nrf2 signaling pathway[J]. Chemosphere, 2018, 212(23): 974-982. [3] YUE L, GE C J, FENG D, et al. Adsorption–desorption behavior of atrazine on agricultural soils in China[J]. Journal of Environmental Sciences, 2017, 57(7): 180-189. [4] NÖDLER K, LICHA T, VOUTSA D. Twenty years later–atrazine concentrations in selected coastal waters of the Mediterranean and the Baltic Sea[J]. Marine Pollution Bulletin, 2013, 70(5): 112-118. [5] CARMO D A, CARMO A P B, PIRES J M B, et al. Environmental behavior and toxicity of herbicides atrazine and simazine[J]. Ambiente e Agua-An Interdisciplinary Journal of Applied Science, 2013, 8(1): 133-143. [6] SUN J T, PAN L L, ZHAN Y, et al. Atrazine contamination in agricultural soils from the Yangtze River Delta of China and associated health risks[J]. Environmental Geochemistry and Health, 2017, 39(2): 369-378. doi: 10.1007/s10653-016-9853-x [7] YILMAZ E, ÖZGÜR E, BERELI N, et al. Plastic antibody based surface plasmon resonance nanosensors for selective atrazine detection[J]. Materials Science and Engineering: C, 2017, 73(4): 603-610. [8] LOOS R, LOCORO G, COMERO S, et al. Pan-European survey on the occurrence of selected polar organic persistent pollutants in ground water[J]. Water Research, 2010, 44(14): 4115-4126. doi: 10.1016/j.watres.2010.05.032 [9] YUE G, JING M A, RAN J I A, et al. Impact of long-term atrazine use on groundwater safety in Jilin Province, China[J]. Journal of Integrative Agriculture, 2013, 12(2): 305-313. doi: 10.1016/S2095-3119(13)60229-4 [10] RENNER R. Atrazine linked to endocrine disruption in frogs[J]. Environmental Science & Technology, 2002, 36(3): 55-56. [11] BOHN T, COCCO E, GOURDOL L, et al. Determination of atrazine and degradation products in Luxembourgish drinking water: origin and fate of potential endocrine-disrupting pesticides[J]. Food Additives & Contaminants: Part A, 2011, 28(8): 1041-1054. [12] XING H, WANG Z, GAO X, et al. Atrazine and chlorpyrifos exposure induces liver autophagic response in common carp[J]. Ecotoxicology and Environmental Safety, 2015, 113(3): 52-58. [13] HAYES T B, COLLINS A, LEE M, et al. Hermaphroditic, demasculinized frogs after exposure to the herbicide atrazine at low ecologically relevant doses[J]. Proceedings of the National Academy of sciences, 2002, 99(8): 5476-5480. doi: 10.1073/pnas.082121499 [14] MUKHERJEE D, KAR S, MANDAL A, et al. Immobilization of tannery industrial sludge in ceramic membrane preparation and hydrophobic surface modification for application in atrazine remediation from water[J]. Journal of the European Ceramic Society, 2019, 39(10): 3235-3246. doi: 10.1016/j.jeurceramsoc.2019.04.008 [15] WU B, ARNOLD W A, MA L. Photolysis of atrazine: Role of triplet dissolved organic matter and limitations of sensitizers and quenchers[J]. Water Research, 2021, 190(3): 11665. [16] TRAN N, DROGUI P, DOAN T L, et al. Electrochemical degradation and mineralization of glyphosate herbicide[J]. Environmental Technology, 2017, 38(23): 2939-2948. doi: 10.1080/09593330.2017.1284268 [17] ZAVISKA F, DROGUI P, BLAIS J F, et al. Experimental design methodology applied to electrochemical oxidation of the herbicide atrazine using Ti/IrO2 and Ti/SnO2 circular anode electrodes[J]. Journal of Hazardous Materials, 2011, 185(2/3): 1499-1507. [18] WEI J, FENG Y, SUN X, et al. Effectiveness and pathways of electrochemical degradation of pretilachlor herbicides[J]. Journal of Hazardous Materials, 2011, 189(5): 84-91. [19] SANTOS J E L, GÓMEZ M A, DE MOURA D C, et al. Removal of herbicide 1-chloro-2, 4-dinitrobenzene (DNCB) from aqueous solutions by electrochemical oxidation using boron-doped diamond (BDD) and PbO2 electrodes[J]. Journal of Hazardous Materials, 2021, 402(2): 12385. [20] 智丹, 王建兵, 周云惠, 等. 钛基锡锑阳极电化学氧化去除水中的四环素[J]. 环境工程学报, 2018, 12(1): 57-64. [21] 智丹. 臭氧氧化复合电化学活性膜去除水中四环素的研究[D]. 北京: 中国矿业大学, 2018. [22] YOU H, CHEN Z, YU Q, et al. Preparation of a three-dimensional porous PbO2-CNTs composite electrode and study of the degradation behavior of p-nitrophenol[J]. Separation and Purification Technology, 2021, 276(23): 119406. [23] TANG Y, LIU M, HE D, et al. Efficient electrochemical degradation of X-GN dye wastewater using porous boron-doped diamond electrode[J]. Chemosphere, 2022, 307: 135912. doi: 10.1016/j.chemosphere.2022.135912 [24] LIU H, ZHAI L, WANG P, et al. Ti/PbO2 rlectrode rfficiency in catalytic chloramphenicol degradation and its effect on antibiotic resistance genes[J]. International Journal of Environmental Research and Public Health, 2022, 19(23): 15632. doi: 10.3390/ijerph192315632 [25] ZHU X, HU W, FENG C, et al. Electrochemical oxidation of aniline using Ti/RuO2-SnO2 and Ti/RuO2-IrO2 as anode[J]. Chemosphere, 2021, 269(8): 128734. [26] ZHI D, WANG J, ZHOU Y, et al. Development of ozonation and reactive electrochemical membrane coupled process: Enhanced tetracycline mineralization and toxicity reduction[J]. Chemical Engineering Journal, 2020, 383(5): 123149. [27] 陈丹妮. 改性Ti/PbO2电极的制备及其电催化氧化降解双酚A的研究[D]. 上海: 华东理工大学, 2021. [28] WANG W, WANG J, WANG J, et al. Enhanced treatment of p-nitrophenol and coking wastewater through electrochemical and electrochemical-ozonation coupling process utilizing a novel Ti4O7 reactive electrochemical membrane anode[J]. Journal of Environmental Chemical Engineering, 2024, 12(3): 112549. doi: 10.1016/j.jece.2024.112549 [29] WANG J, ZHI D, ZHOU H, et al. Evaluating tetracycline degradation pathway and intermediate toxicity during the electrochemical oxidation over a Ti/Ti4O7 anode[J]. Water Research, 2018, 137(10): 324-334. [30] WANG G, LIU Y, YE J, et al. Electrochemical oxidation of methyl orange by a Magnéli phase Ti4O7 anode[J]. Chemosphere, 2020, 241(4): 125084. [31] ZHANG J, ZHOU Y, YAO B, et al. Current progress in electrochemical anodic-oxidation of pharmaceuticals: Mechanisms, influencing factors, and new technique[J]. Journal of Hazardous Materials, 2021, 418(18): 126313. [32] ZHANG Y, HE P, ZHOU L, et al. Optimized terbium doped Ti/PbO2 dimensional stable anode as a strong tool for electrocatalytic degradation of imidacloprid waste water[J]. Ecotoxicology and Environmental Safety, 2020, 188(2): 10992. [33] DONDAPATI J S, THIRUPPATHI A R, SALVERDA A, et al. Comparison of Pt and IrO2-Ta2O5/Ti as a counter electrode in acidic media[J]. Electrochemistry Communications, 2021, 124(3): 106946. [34] 王雪, 谢佳芳, 张健, 等. 新型自支撑锑锡氧化物电极氧化降解阿特拉津性能研究[J]. 工程科学与技术, 2024, 56(4): 46-56. [35] 智丹, 王建兵, 王维一, 等. Ti/Ti4O7阳极电化学氧化降解水中的美托洛尔[J]. 环境科学学报, 2018, 38(5): 1858-1867. [36] 赵丹荻, 贾博, 何亚鹏, 等. 掺硼金刚石阳极电催化降解甲氧苄啶抗生素及其动力学研究[J]. 环境化学, 2022, 41(10): 3425-3434. [37] MARTÍNEZ-HUITLE C A, RODRIGO M A, SIRÉS I, et al. Single and coupled electrochemical processes and reactors for the abatement of organic water pollutants: a critical review[J]. Chemical Reviews, 2015, 115(24): 13362-13407. doi: 10.1021/acs.chemrev.5b00361 [38] ZAMBRANO J, PARK H, MIN B. Enhancing electrochemical degradation of phenol at optimum pH condition with a Pt/Ti anode electrode[J]. Environmental Technology, 2020, 41(24): 3248-3259. doi: 10.1080/09593330.2019.1649468 [39] GONG C, HAN J, HE C, et al. Insights into degradation of pharmaceutical pollutant atenolol via electrochemical advanced oxidation processes with modified Ti4O7 electrode: Efficiency, stability and mechanism[J]. Environmental Research, 2023, 228(13): 115920. -



 下载:
下载: