-
城市内湖作为人居环境的重要组成部分,具有改善生态环境、提高城市生态系统稳定性、调节区域气候等多种功能。然而,快速的经济发展和高密度城镇化干扰了城市内湖的水质安全、生态平衡、生物多样性保护和生态系统服务功能[1-2]。城市化和土地利用变化(如建设用地扩张和土地硬化)导致自然植被丧失和不透水表面增加,故而造成地表径流增加和渗透减少,从而引起湖泊面积减小[3]。同时,由于人类生产生活的负面影响(如生活污水和工农业污染排放),城市内湖水体发生富营养化的风险较大,也会导致生物多样性下降和功能群落组成发生变化[4-5]。
水生态系统的健康状态是衡量水域环境质量和生态平衡的一个重要指标,关系到生物多样性、水资源的可持续利用以及人类社会的福祉。国际科研机构于1982年开始对大型湖泊的生态系统健康开展评价工作[6]。目前,水生态系统的健康评价方法主要包括压力-状态-响应模型(PSR)、神经网络法、遥感与模型综合法、灰色模型、Topsis模型等[7-10]。例如,通过构建多层级的综合健康指数体系,对太湖湖滨带生态系统健康状态进行定量分析[11]。也有研究基于PSR模型建立了包含19 个指标的拉鲁湿地生态系统健康评价指标体系,解析了制约拉鲁湿地生态健康水平的相关要素[12]。
武汉市拥有丰富的水资源,水域面积约占全市国土面积的24.7%,包括165 条河流和166 个湖泊。其中,东湖位于武汉市东部,是长江中游一个典型的城中湖,水域面积32 km2,平均深度2.5 m[13]。东湖作为武汉城市水景观和水生态系统重要的组成部分,其水文和生态特征对城市的水环境管理至关重要。郭郑湖是东湖最大的子湖,水域面积约占东湖总面积的50%,内部地形复杂,深水湖区、浅水湖湾与通江河口交错分布,湖岸紧邻商住街区和高校,周边人类活动干扰强度大,湖区生态环境复杂,对该区域开展准确的生态健康评价,可以为系统性地了解东湖的水生态系统健康状况提供重要参考。由于生态健康综合指数法(EHCI)提供了根据不同生态系统的特性和研究目标来选择和调整指标的灵活性,这一特点使其能够适应各种类型的生态系统评估需求[14]。本研究覆盖了从水体的基本理化性质到浮游动植物多样性,乃至底泥微生物组成的广泛数据,因此本研究基于生态健康综合指数法(EHCI),构建适宜于武汉东湖最大子湖郭郑湖的水生态系统健康评价指标体系,为城市内湖的水资源管理和环境保护提供重要的科学依据。
-
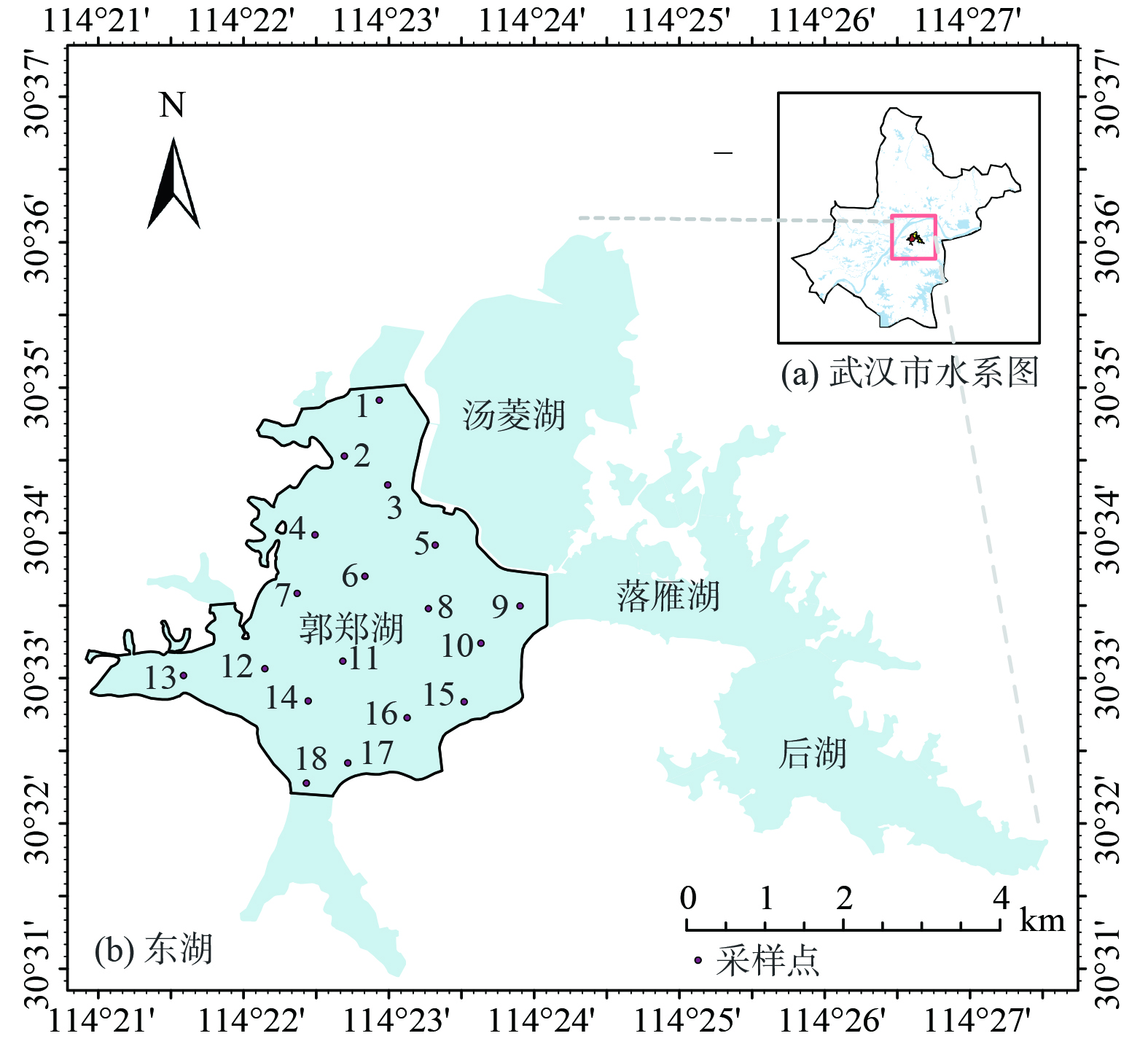
本研究针对武汉市东湖最大子湖郭郑湖[15](面积达12.8 km2,地理坐标114°20'-114°24' E,30°32'-30°35' N)进行现场采样,将湖区分为北部、中部、南部这3 个区域,每个区域布设6 个采样点,共计18 个点位,其中北部湖区样点编号为1~6号,中部湖区7~12号,南部湖区13~18号(图1)。
-
在野外调查过程中,采样点的经度、纬度等地理位置信息,用GPS(VISTA,GARMIN Co. Ltd.)记录。记录每个样点的水深,用塞氏盘测定水体的透明度。每个采样点的水体理化参数(水温、溶解氧、电导率、总含盐量、盐度、pH等)用便携式水质监测仪(PROPLUS,YSI)测定。水体浊度和悬浮物浓度分别使用浊度仪(2100Q,HACH)和便携式分光光度计(DR900,HACH),其他水质指标测试方法如表1所示。
-
1)水生生物采样与统计分析方法。浮游植物的采样,首先利用采水器在每个样点分别提取不同深度的水样,分为上覆水,中层水和底层水,均匀混合后定容至1 L,现场加入鲁格氏液体(1.5%)进行固定,在4~10 °C条件下避光保存带至实验室镜检[16];采集原生动物和轮虫定量样品方法类似于浮游植物,使用5 L采水器按层采集水样。水样经过滤后浓缩至100 mL,并存放于采样瓶中。根据浮游动物密度调整采水量10~50 L。采集定性样品时,使用不同网号采集不同种类的浮游动物,并进行适当固定处理[17];底栖动物的采样,每个位点使用彼得森采泥器采集3~5次,在40目网筛中进行样品冲洗,清除杂质,挑拣出来的生物样品加入70%乙醇保存固定[18]。
浮游动植物鉴定和计数,样品先进行垂直静置72 h以待沉淀。吸取上清液并根据沉淀物量向离心管内加入纯水定容至20~40 mL。样品摇匀后,使用胶头滴管取样,并滴加至血细胞计数板的计数室内。盖上盖玻片,静置5 min后,计数板静置后置于光学显微镜下进行鉴定和计数[16-18],每个样点重复3~5次重复,提高数据的可靠性。
2)沉积物微生物。在郭郑湖采集10 cm表层沉积物样品,使用彼德森采泥器,样品存放于50 mL离心管中,冷冻于−80 °C。按照DNA提取试剂盒(MP Biomedicals,USA)说明提取微生物DNA,用1 %琼脂糖凝胶电泳处理,使用NanodropTM 2000 Spectrophotometer(Nanodrop,Wilmington,DE,USA)检测DNA浓度和质量。PCR反应包含多种成分,反应条件是95 °C变性3 min,27次循环,最后在72 °C延伸10 min。高通量测序数据用QIIME处理,使用UPARSE和RDP对序列进行聚类和分类分析[19]。用于扩增16S rRNA基因的引物是EUB338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和EUB518R(5′-ATTACCGCGGCTGCTGG-3′)。对PCR产品进行鉴定、纯化和定量,根据不同样品的测序数据,调整到一定比例后混合。使用Illumina平台进行高通量测序,利用fastp工具对测序原始数据进行质量控制,使用FLASH工具拼接序列,根据97%相似度将序列聚为操作分类单元(OTU)并移除嵌合体,通过比对数据库中已知的微生物序列,获取每个样点的物种信息,并创建OTU表格。本项研究的PCR和测序工作均由上海美吉生物医药科技有限公司执行。
3)生态健康综合指数法。根据郭郑湖特征,同时参考水生态系统中同类型的评价方法[20],选择浮游植物多样性指数、浮游动物多样性指数、底栖动物生物量、沉积物微生物群落丰富度及水质状况指标(NH3-N、TP、TN)构建综合评价体系。郭郑湖的水生态健康状况使用基于熵权法得出的生态健康综合指数(ecological health comprehensive index,EHCI)进行评估,公式如式(1)所示。
式中:EHCI为生态系统健康的综合指数值,其值的量化范围在0~1之间;Wi表示评价因子在综合评价指标体系中的权重值,大小在0~1之间;Ii代表评价指标的归一化值,其值的大小在0~1之间[21]。最终结果用生态健康综合指数表示,并把生态系统健康状态分为优秀、良好、一般、差、极差五级(表2)。
-
16S rRNA基因序列结果相关的统计分析使用Rstudio (v.2023.03.0 Build 386) 进行处理,使用“Mothur”接口处理多样性分析,使用“vegan”和“phyloseq”库处理非度量多维尺度分析(NMDS)。使用ArcGIS Pro(3.0.2) 软件绘制中插值图,对水生生物多样性及生态健康综合指数(EHCI)进行空间分析及成果展示。
-
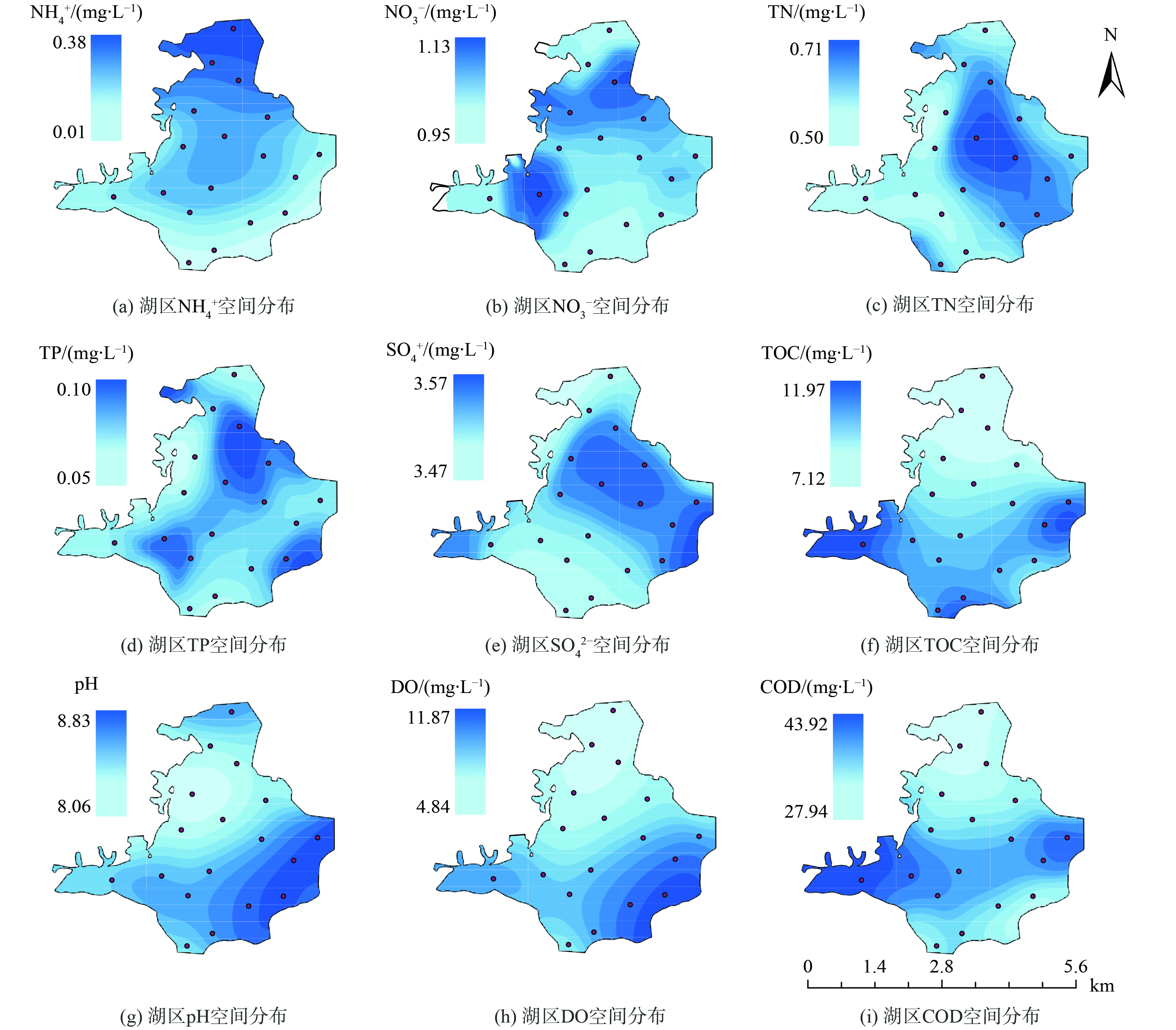
郭郑湖3 个湖区(北部、中部、南部)水体的氨氮均值分别为0.15、0.14和0.06 mg·L-1,北部和中部水体中氨氮含量比南部高1.21~1.36 倍(图2(a));南部水体中的TOC质量浓度比北部高55.96%,而中部水体中的TOC质量浓度比北部高1.15 倍(图2(f));3个湖区的pH值无显著性差异,平均值为8.36,中部和南部水域的pH值比北部高1.04~1.24 倍(图2(g));湖区DO质量浓度的平均值为6.93 mg·L-1,中部和南部湖区比北部湖区的DO质量浓度分别多51.15%和55.47%(图2(h));中部和南部水域中的COD质量浓度比北部高23.52%~58.08%,而中部水域中的COD质量浓度比南部水体中多27.98%(图2(i));3 个湖区的硝氮、总氮和总磷等水质指标并没有显著性差异;北部湖区的水温比其他两个湖区低了5.2%,中部和南部湖区水温并未呈现出明显差异。
-
湖区水生生物的镜检结果,选取浮游动植物数量最多的前15的优势物种和全部底栖动物,统计在各个区域出现频次(表3)。
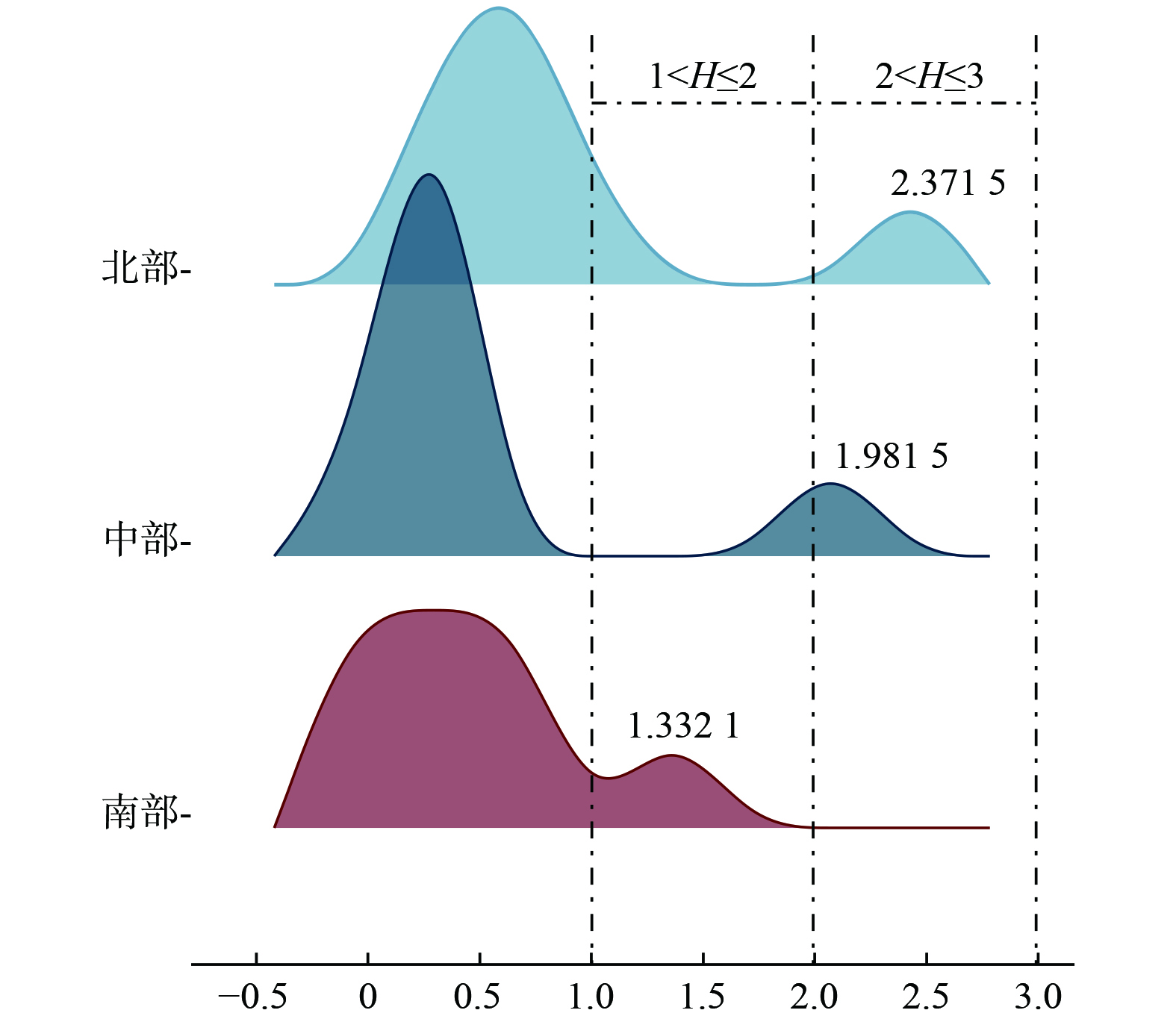
1)北部湖区。经过对6 个采样点的镜检鉴定,北部湖区底栖动物共8 种,香农维纳生物多样性指数为2.37;浮游动物共28 种,香农维纳生物多样性指数为4.02;浮游植物共49 种,香农维纳生物多样性指数为4.15。
在北部湖区采样点1~6号的底栖动物鉴定中,3号采样点的香农维纳生物多样性指数最低,为0.30,4号最高,为0.88。6 个采样点中发现3 个类群:软体动物、节肢动物、环节动物。在北部湖区所有采样点中,1号采样点的浮游动物香农维纳生物多样性指数最高,为2.70。鉴定出的浮游动物中,轮虫类总数最多,数量达16 740,枝角类最少。北部湖区浮游植物的鉴定中发现了6 个门类的物种,其中硅藻门和蓝藻门总数量最多。
2)中部湖区。经过对6 个采样点的镜检鉴定,中部湖区底栖动物共9 种,香农维纳生物多样性指数为1.98;浮游动物共26 种,香农维纳生物多样性指数为3.75;浮游植物共47 种,香农维纳生物多样性指数为4.03。
在中部湖区采样点7~12号的底栖动物鉴定中,9号采样点的香农维纳生物多样性指数最高,为0.47。在中部湖区所有采样点中,8号采样点的浮游动物香农维纳生物多样性指数最高,为2.19,11号最低,为1.79。中部湖区浮游植物的鉴定中发现了5 个门类的物种,其中硅藻门和蓝藻门总数量最多。
3)南部湖区。经过对6 个采样点的镜检鉴定,南部湖区底栖动物共6 种,香农维纳生物多样性指数为1.33;浮游动物共31 种,香农维纳生物多样性指数为3.46;浮游植物共55 种,香农维纳生物多样性指数为4.14。
在南部湖区采样点13~18号的底栖动物鉴定中,17号采样点的香农维纳生物多样性指数最高,为0.69。在南部湖区所有采样点中,14号采样点的浮游动物香农维纳生物多样性指数最高,为1.33。南部湖区浮游植物的鉴定中发现了6个门类的物种,其中硅藻门和蓝藻门总数量最多。
-
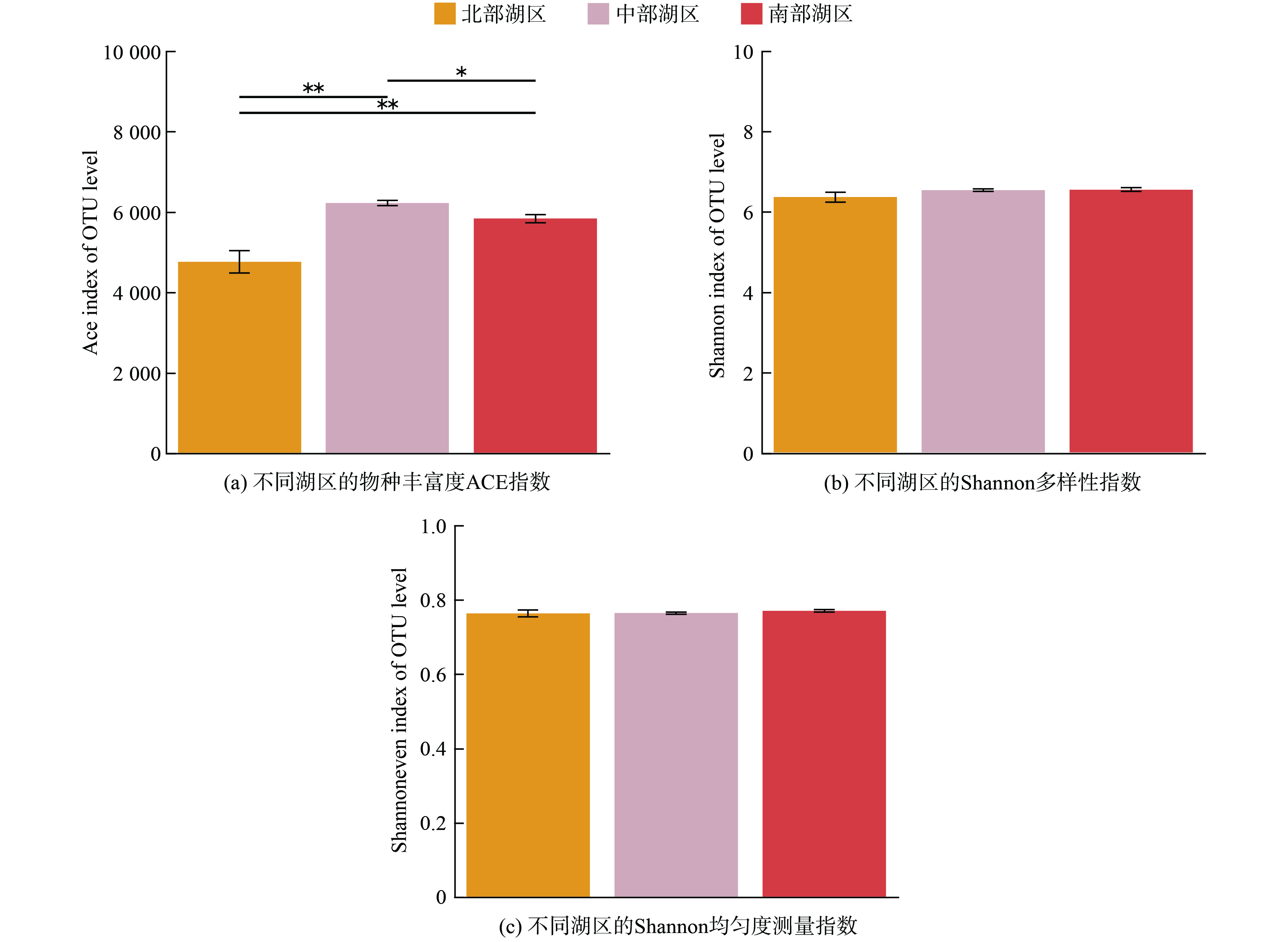
OTU丰富度Shannon和Sobs指数的稀释曲线表明:所产生的序列能够较好的代表大多数细菌多样性。群落相关指数分析结果表明:中部湖区的细菌群落丰富度最高,其次是南部湖区,北部湖区的细菌丰富度最小(图3,*、**、***分别表示P<0.05,P<0.01和P<0.001水平上差异显著)。
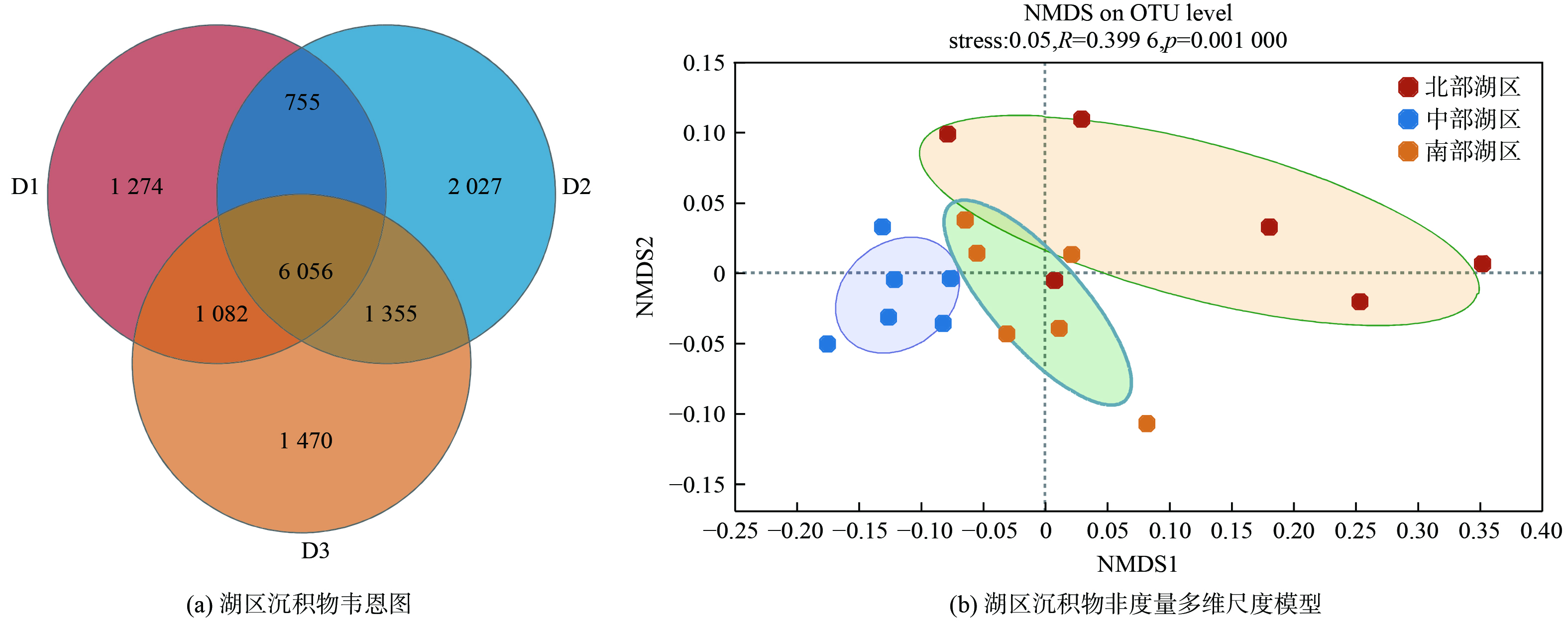
采用NMDS分析对3 个湖区沉积物的微生物群落组成差异组成进行分析,结果表明3 组样本存在显著差异(R=0.399 6,p<0.001),stress值为0.05,并且韦恩图的结果也表明,3组样本中共有的微生物菌群数量有6 056 个,其中中部湖区特有的微生物数量有2 027 个,南部湖区特有的微生物数量有1 470 个,北部湖区特有的微生物数量有1 274 个(图4)。
-
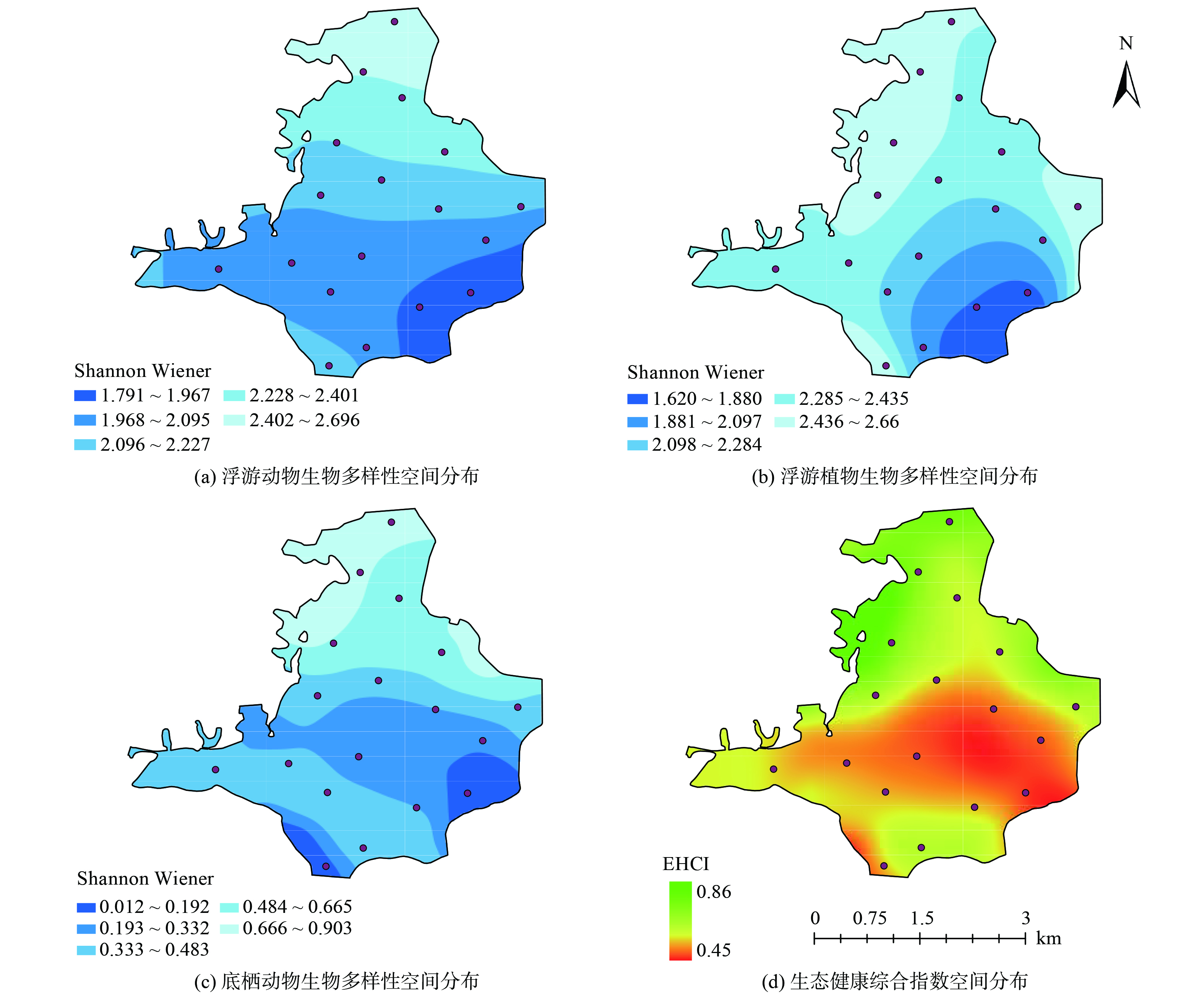
根据评价结果,郭郑湖生态系统健康综合指数(EHCI)评分是0.55,属于《生态系统健康状态分级标准》中三级标准,生态系统处于“一般”状态。中部和南部湖区生态综合评价为“一般”,EHCI分别是0.46和0.54,中部湖区部分点位处于“差”的状态(<0.4)。浮游植物和浮游动物在3个湖区的香农维纳生物多样性指数差异不大,而底栖动物的香农维纳生物多样性指数则有着较大的差距,北部湖区处于轻污染的水平,中部湖区和南部湖区则处于中污染的水平,这与EHCI的评价相吻合。结合各个采样点浮游动物、浮游植物、底栖动物的香农维纳生物多样性指数,使用克里金空间插值法绘制了郭郑湖的水生生物的空间异质性热力图[22],并根据各采样点EHCI得分绘制了郭郑湖生态健康空间图,这些图表清晰地显示,EHCI值从北到南逐渐降低,其中中部湖区的生态健康水平最低。此外,从西向东看,EHCI值呈现上升趋势,表明东部湖区的水生态状况优于西部湖区(图5)。
-
近年来国内学者对武汉市及周边区域城市型湖泊开展的生态健康评价结果表明,武汉市79 个浅水湖泊整体健康状况一般,其中亚健康湖泊占34.6%,一般健康湖泊占41.3%,健康状态较差占24.1%[23]。也有研究报道武汉东西湖区中5 个湖区19 个采样点中健康等级点位占36.84%,亚健康等级点位占42.11%,一般健康等级点位占21.05%[24]。郭郑湖的生态系统健康综合指数(EHCI)揭示了生态健康状态总体处于“一般”水平,中部湖区的某些点位达到了“差”级别。整体上看,郭郑湖的生态健康水平在武汉市及周边区域的城市型湖泊中处于中等水平。
上述研究对城市湖泊的健康评价重点基于微生物完整性、底栖动物多样性等生物指标,研究表明水生生物在自然湖库中具有重要的生态功能。例如,张迪涛等[24]基于微生物完整性指数对武汉市湖泊群的生态系统健康情况进行了评价分析,结果表明在城市干扰水体中,微生物群落结构作为一个整体可能是生态系统健康的敏感指标[24-25]。此外,作为水生食物链中的初级消费者,浮游动物以浮游植物、细菌及腐殖质为食物来源,其个体也可被高等级捕食者摄食,所以水生生物在生态系统的营养循环过程中发挥重要的作用。以郭郑湖3 个区域的底栖动物为例(图6),北部、中部和南部底栖动物Shannon Wiener指数分别为2.37、1.98和1.33。参考前期单一指标评测方法[21,26],郭郑湖生态质量为中等水平。
底栖动物通过影响养分循环来促进湖泊生态健康[27],同时他们有助于调节食物网中的能量流动,并能影响湖泊生态系统的营养结构[28]。因此湖区内底栖动物的多样性丰度是湖泊水生态系统健康状况良好的1个重要指标。如上述讨论中,虽然浮游动植物的多样性在整个湖区没有显著差异,但底栖动物多样性的空间差异却较为显著。底栖动物多样性可能受藻类种群状态和水体理化状态的影响,池仕运等[29]研究发现硅藻和绿藻季节性丰度变化会影响大型底栖无脊椎动物多样性指数,也有研究通过模型拟合发现湖泊生产力随着叶绿素a浓度增加而升高,并且大型无脊椎动物的丰度同样呈现上升趋势[30]。
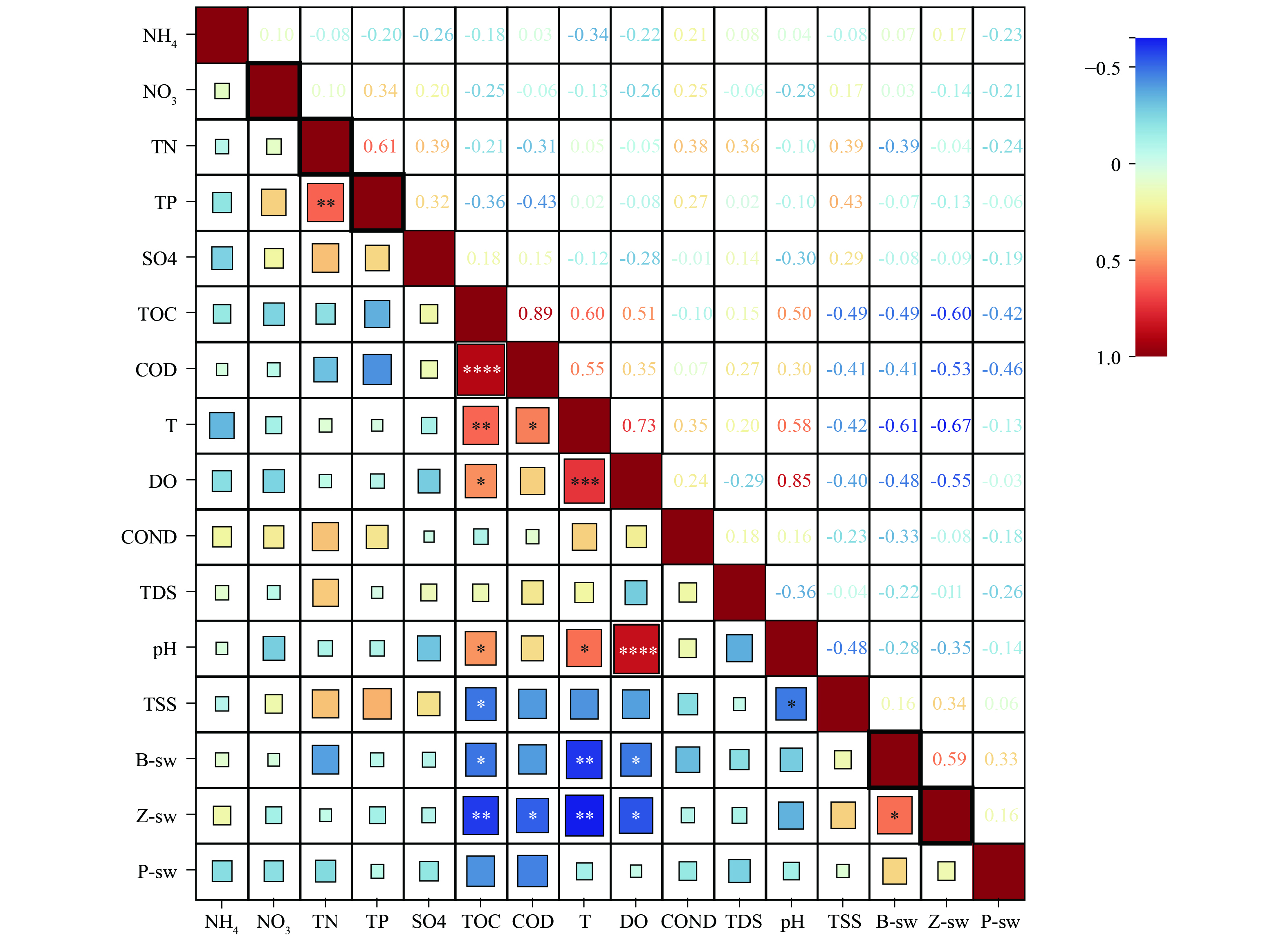
在评价郭郑湖水生态系统健康时,单个生物指标虽然可以反映特定的生态状况,但其无法充分评估整个生态系统的复杂性和动态特征[31]。同时,湖泊的水质等环境因子对生物个体生长、种群密度、群落结构以及生态功能起着重要的驱动作用,进而影响湖泊整体的生态健康状况[32-33]。例如总氮(TN)和总磷(TP)对湖泊生态的综合影响表现在改变湖泊中的营养素平衡[34],影响藻类生长,并通过氮磷比的变化对湖泊生态系统的食物网及其营养状态产生深远影响[35]。为考察郭郑湖水生生物群落结构的潜在水质驱动因子,本研究选择13 种水质参数(NH4+、NO3−、TN、TP、SO42−、TOC、COD、T、DO、COND、TDS、pH、TSS)进行分析。根据Pearson相关性分析,水体理化性质并不能影响浮游植物群落的多样性,而TOC、COD、T、DO水质指标显著改变了浮游动物多样性(p<0.05)(图7,*、**、***、****分别表示P<0.05,P<0.01,P<0.001和P<0.0001水平上差异显著)。水温能够改变浮游动物的生长发育和种群分布,主要是通过改变浮游动物摄食的上行效应、可摄取浮游植物数量的下行效应以及生物个体的生长发育过程,最终影响浮游动物的数量和群落组成[36-37]。除水温外,水体的其他理化性质也是影响浮游动物分布的重要驱动因子[38-39],浮游动物虽然不能完全依靠营养物质生存,但是水环境中的低营养级生物和腐殖质会影响其丰富度、群落结构和生长行为[40-41]。而溶解氧是浮游动物个体生存和群落维持的决定性因素之一,过高的溶解氧会限制轮虫和枝角类浮游动物的生长发育[42-43]。底栖动物群落受到不同时空尺度上物理、化学和生物过程的影响,其生长和多样性是多种因素相互耦合作用的结果。例如,水温会影响底栖动物体内的功能酶活性,从而影响其生长发育、种群繁衍和空间分布[44]。
因此,采用多生物综合评估方法有利于全面理解水生态系统的健康状况。这种方法可以分析生物之间的相互作用和关系[45],还能揭示多种生态压力和干扰对水生态系统健康的累积影响。多生物综合评估还有助于识别生态系统内的潜在威胁和脆弱性,为有针对性的保护和管理提供依据[46]。因此,在对城市湖泊生态健康进行评估时,应结合生态和环境因素,采用多生物综合评估方法,以更准确地反映生态系统的整体健康状况。城市内湖的生态环境近年来逐渐成为关注焦点,在各地持续推进水环境治理的背景下,城市内湖水质状况普遍显示出向好的发展趋势,并保持了相对稳定的营养水平。尽管如此,水质的波动性依旧存在,要持续提升并保持较高的水质状况仍然是一项挑战[47],因此强化保护措施并关注水生态系统的保护与恢复工作是确保城市内湖健康和可持续发展的关键。
-
1)本研究通过对郭郑湖的水质、水生生物和沉积物微生物进行综合分析,揭示了郭郑湖不同区域间的生态健康状况。结果表明北部湖区底栖动物、浮游动植物多样性较高,中部湖区的细菌群落丰富度最高,综合分析结果显示郭郑湖生态系统健康处于“一般”状态。
2)通过对湖区的水质、水生生物和沉积物微生物进行综合分析,揭示了郭郑湖不同区域间的生态健康状况。水质分析结果表示,郭郑湖各区域在氨氮、TOC、COD等方面存在空间差异。水生生物分析表明底栖动物、浮游动植物和沉积物微生物在不同区域的多样性指数各异,反映了生态系统的复杂性。根据Pearson相关性分析的结果,水体的理化性质对浮游植物多样性无显著影响,水温、TOC、COD、DO等水质指标显著影响浮游动物和底栖动物群落的多样性和空间。
3)在未来研究中,建议增加长时间序列的生物样本数据,以获得更全面可靠的结果。此外,EHCI评价方法仍有提升空间,未来工作应着重于结合主观与客观赋权方式,以提高对城市内湖复杂生态系统评估的准确性和综合性。这些发现对于城市湖泊的管理策略、水生生物多样性保护和水生态系统健康恢复具有重要意义。
典型城市内湖水生态健康评价——以武汉市郭郑湖为例
Typical urban inland lake aquatic ecosystem health assessment: a case study of Guozheng lake in Wuhan city
-
摘要: 针对高度人为干扰下的复杂城市内湖进行系统性的生态健康状况评估,是开展生态修复和生物多样性恢复工作的重要基础。本研究以武汉东湖最大子湖郭郑湖为研究区域,通过对北部、中部和南部3 个湖区共18 个点位进行采样分析,构建用于水生态系统健康的评价体系(其中包括水质、水生生物和沉积物微生物等要素)及分级标准。生物镜检结果标明:郭郑湖北部湖区底栖动物多样性较高,Shannon-Wiener指数(2.37)高于中部湖区(1.98)和南部湖区(1.33),北部湖区节肢动物最多,环节动物最少,其中中国长足摇蚊(Tanypus chinensis)是优势种群;浮游动物中轮虫类总数最多,浮游植物中硅藻门和蓝藻门常见种最多。Pearson相关性分析表明,水温、TOC、COD、DO等水质指标显著影响浮游动物多样性。通过高通量测序分析发现北部湖区沉积物细菌群落丰度小于其他湖区。郭郑湖生态系统健康指数(EHCI)总体为0.55,属于分级标准中“一般”水平,而中部和南部地区湖区生态系统健康程度弱于北部湖区。该研究可对特定湖区的生态系统保护与修复提供精准调控的策略,为管理、保护和恢复湖泊生态系统提供依据。Abstract: Conducting systematic assessments of the ecological health status of complex urban lakes under significant human disturbance is a crucial foundation for carrying out ecological restoration and biodiversity recovery effort. The research area is Guozheng Lake in Wuhan, which is the largest sub-lake of East Lake. The study involved analyzing 18 sampling points across the lake's northern, central, and southern areas to establish an evaluation system for aquatic ecosystem health. The system included elements such as water quality, aquatic life, and sediment microorganisms, and corresponding grading standards were developed. After conducting microscopic examinations, it was found that the benthic animal diversity in the northern part of Guozheng Lake was higher, with a Shannon-Wiener index of 2.37, which was higher than that in the central (1.98) and southern (1.33) lake areas. The northern area had the most arthropods and the least annelids, among which Tanypus chinensis was the dominant species; rotifers were the most numerous among planktonic animals, while diatoms and Cyanophyta were the most common among planktonic plants. Pearson correlation analysis showed that water temperature, TOC, COD, DO, and other water quality indicators significantly affected plankton diversity. High-throughput sequencing analysis found that the bacterial community abundance in the sediments of the northern lake area was less than in other areas. High-throughput sequencing analysis revealed that the bacterial community abundance in the sediments of the northern lake area was less than in other areas. The overall ecological health comprehensive index (EHCI) of Guozheng lake was 0.55, which was considered "fair" according to grading standards. However, the ecological health of the central and southern lake areas was weaker than that of the northern lake area. This research can provide precise control strategies for the ecosystem protection and restoration of specific lake areas, offering a basis for the management, protection, and restoration of lake ecosystems.
-
表 1 部分水质指标分析方法
Table 1. Partial Analytical methods of water quality
检测项目 检测仪器 分析方法 方法依据 总氮 紫外分光光度计 碱性过硫酸钾-消解紫外分光光度法 GB/T 11894—1989 氨氮 流动注射分析仪 水杨酸 HJ 666—2013 硝酸盐氮 离子色谱 离子色谱法 HJ/T 84—2001 总有机碳 TOC分析仪 非分散红外吸收法 HJ 501—2009 COD 计量滴定管 酸性法 GB 11892—89 氧化还原电位 氧化还原电位电极 参比电极法 DL/T 1480—2015 表 2 生态系统健康状态分级标准
Table 2. Ecosystem health grade standard
分级 生态系统健康综合指数(EHCI) 健康状态 Ⅰ 0.8~1 优秀 Ⅱ 0.6~0.8 良好 Ⅲ 0.4~0.6 一般 Ⅳ 0.2~0.4 差 Ⅴ 0~0.2 极差 表 3 湖区主要优势水生生物
Table 3. Main dominant aquatic organisms in the lake area
水生生物种类 种名 拉丁文名 检出区域频次 浮游动物 球形砂壳 Difflugia globulosa 北部 (5),中部 (6),南部 (5) 针簇多肢轮虫 Polyarthra trigla 北部 (6),中部 (5),南部 (6) 罗氏异尾轮虫 Trichocerca rousseleti 北部 (5),中部 (3),南部 (3) 等刺异尾轮虫 Trichocerca similis 北部 (6),中部 (6),南部 (6) 裂痕龟纹轮虫 Anuraeopsis fissa 北部 (5),中部 (5),南部 (3) 沟痕泡轮虫 Pompholyx sulcata 北部 (6),中部 (1),南部 (2) 曲腿龟甲轮虫 Keratella valga 北部 (6) ,中部 (2),南部 (4) 角突臂尾轮虫 Brachionus angularis 北部 (4),中部 (4),南部 (6) 剪形臂尾轮虫 Brachionus forficula 北部 (6),中部 (5),南部 (4) 螺形龟甲轮虫 Keratella cochlearis 北部 (6),中部 (2),南部 (3) 浮游动物 桡足类幼体 Copepoda larvae 北部 (6),中部 (6),南部 (6) 萼花臂尾轮虫 Brachionus calyciflorus 北部 (4) ,中部 (5),南部 (3) 广布中剑水蚤 Mesocyclops leuckarti 北部 (6),中部 (6),南部 (6) 瓶砂壳虫 Difflugia urceolata 北部 (3),中部 (1),南部 (4) 拟铃壳虫属 Tintinnopsis 北部 (4),中部 (0),南部 (0) 浮游植物 针杆藻属 Synedra sp. 北部 (6),中部 (6),南部 (6) 固氮鱼腥藻 Anabaena azotica 北部 (6),中部 (6),南部 (6) 颤藻属 Oscillatoria sp. 北部 (6),中部 (4),南部 (6) 鱼腥藻未定种1 Anabaena sp.1 北部 (2), 中部 (2),南部 (0) 伪鱼腥藻属 Pseudanabaena sp. 北部 (3),中部 (3),南部 (5) 螺旋鱼腥藻 Anabaena spiroides 北部 (5),中部 (6),南部 (6) 卷曲鱼腥藻 Anabaena circinalis 北部 (6),中部 (6),南部 (6) 链状伪鱼腥藻 Pseudanabaena catenata 北部 (3),中部 (2),南部 (1) 颗粒直链藻 Melosira granulata 北部 (6),中部 (6),南部 (6) 大螺旋藻 Spirulina major 北部 (6),中部 (3),南部 (5) 鱼腥藻未定种2 Anabaena sp.2 北部 (5),中部 (6),南部 (5) 惠氏微囊藻 Microcystis wesenbergii 北部 (6),中部 (6),南部 (5) 颗粒直链藻极狭变型 Melosira granulata var. angustissima 北部 (6),中部 (6),南部 (6) 小空星藻 Coelastrum microporum 北部 (0),中部 (0),南部 (1) 细小平裂藻 Merismopedia minima 北部 (1),中部 (0),南部 (1) 底栖动物 中华长足摇蚊 Tanypus chinensis 北部 (6),中部 (5),南部 (6) 夹杂带丝蚓 Lumbriculus variegatum 北部 (1),中部 (1),南部 (0) 小摇蚊属 Microchironomus sp. 北部 (0),中部 (1),南部 (0) 带丝蚓科 Lumbriculidae 北部 (0),中部 (0),南部 (1) 方形环棱螺 Bellamya quadrata 北部 (1),中部 (1),南部 (1) 水丝蚓属 Limnodrilus sp. 北部 (0),中部 (2),南部 (0) 泽蛭属 Helobdella sp. 北部 (1),中部 (0),南部 (0) 花翅前突摇蚊 Procladius choreus 北部 (2),中部 (2),南部 (1) 铜锈环棱螺 Bellamya aeruginosa 北部 (3),中部 (1),南部 (1) 雕翅摇蚊 Glyptotendipes sp. 北部 (0),中部 (0),南部 (1) 雕翅摇蚊属 Glyptotendipes sp. 北部 (2),中部 (1),南部 (0) 霍普水丝蚓 Limnodrilus hoffmeisteri 北部 (1),中部 (1),南部 (0) -
[1] COSTADONE L, SYTSMA M D. Identification and characterization of urban lakes across the continental United States[J]. Lake and Reservoir Management, 2022, 38(2): 126-138. doi: 10.1080/10402381.2021.2022044 [2] WALKER C, LUCKE T. Urban lakes as a WSUD system[M]. Approaches to Water Sensitive Urban Design: Potential, Design, Ecological Health, Urban Greening, Economics, Policies, and Community Perceptions, 2018: 269-285. [3] JIGE S B. Impact of development on climate change[M]. Multidisciplinary Approaches to Sustainable Human Development, 2023: 206-219. [4] TEURLINCX S, KUIPER J J, HOEVENAAR E C, et al. Towards restoring urban waters: Understanding the main pressures[J]. Current Opinion in Environmental Sustainability, 2019, 36: 49-58. doi: 10.1016/j.cosust.2018.10.011 [5] KECK F, MILLET L, DEBROAS D, et al. Assessing the response of micro-eukaryotic diversity to the Great Acceleration using lake sedimentary DNA[J]. Nature Communications, 2020, 11(1): 3831. doi: 10.1038/s41467-020-17682-8 [6] LEE B J. An ecological comparison of the McHarg method with other planning initiatives in the Great Lakes Basin[J]. Landscape planning, 1982, 9(2): 147-169. doi: 10.1016/0304-3924(82)90004-1 [7] SHEN D, JIAO L L, CHANG Y, et al. Ecosystem health assessment of Yellow Sea and Bohai coastal areas[J]. Chinese Journal of Ecology, 2015, 34(8): 2362-2372. [8] PANG Z, LIU Y, LIU Z, et al. River health assessment based on an artificial neural network; Proceedings of the lecture notes in electrical engineering, F, 2023[C]. [9] ABBASZADEH TEHRANI N, MOHD SHAFRI H Z, SALEHI S, et al. Remotely-sensed ecosystem health assessment (RSEHA) model for assessing the changes of ecosystem health of Lake Urmia Basin[J]. International Journal of Image and Data Fusion, 2022, 13(2): 180-205. doi: 10.1080/19479832.2021.1924880 [10] LI H, HAN L, YU Q, et al. Assessment on river water ecological health based on grey relation analysis in Liaohe Conservation Area[J]. Journal of Environmental Engineering Technology, 2020, 10(4): 553-561+531. [11] 张雯, 黄民生, 张廷辉, 等. 太湖湖滨带生态系统健康评价及其修复模式探讨[J]. 水生态学杂志, 2020, 41(4): 48-54. [12] 闫钟清, 李勇, 张克柔, 等. 基于PSR模型的西藏拉鲁湿地生态系统健康评价[J]. 湿地科学与管理, 2023, 19(4): 49-53. doi: 10.3969/j.issn.1673-3290.2023.04.10 [13] 武汉市水务局. 2022年武汉市水资源公报[EB/OL]. [2023-04-07]. https://swj.wuhan.gov.cn/szy/202304/P020230407535564030756.pdf, 2023. [14] 许文杰, 许士国. 湖泊生态系统健康评价的熵权综合健康指数法[J]. 水土保持研究, 2008(1): 125-127. [15] 郭雪蕊. 基于水动力学的武汉市东湖水质模拟[D]. 西安: 西安理工大学: 2018. [16] 金磊, 杨义刚, 杨军. 水体浮游植物采集与鉴定[J]. Bio-101, 2021: e2003737. [17] 陈辉煌, 王文平, 杨军. 淡水浮游动物的采集及鉴定[J]. Bio-101, 2021: e2003738. [18] 曹艳霞. 漓江流域大型底栖无脊椎动物群落结构与水质生物评价[D]. 南京: 南京农业大学, 2012. [19] 刘雷. 湖泊沉积物甲烷与汞转化微生物菌群结构分析[D]. 重庆: 西南大学, 2022. [20] 马沛明, 施练东, 张俊芳, 等. 浙江汤浦水库浮游植物季节演替及其影响因子分析[J]. 环境科学, 2016, 37(12): 4560-4569. [21] 王雨路, 袁丹妮, 袁国庆, 等. 武汉东湖夏冬两季浮游动物物种多样性及群落结构研究[J]. 水生生物学报, 2020, 44(4): 877-894. [22] KRIVORUCHKO K, GRIBOV A. Geostatistical interpolation and simulation in the presence of barriers; Proceedings of the geoENV IV—Geostatistics for Environmental Applications: Proceedings of the Fourth European Conference on Geostatistics for Environmental Applications held in Barcelona, Spain, November 27-29, 2002, F, 2004[C]. Springer. [23] 吴俊燕, 赵永晶, 王洪铸, 等. 基于底栖动物生物完整性的武汉市湖泊生态系统健康评价[J]. 水生态学杂志, 2021, 42(5): 52-61. [24] 张迪涛, 张鹏, 王司阳, 等. 基于微生物完整性指数的水生态系统健康评价——以武汉市东西湖区湖泊群为例[J]. 中国环境科学, 2023, 43(6): 3055-3067. [25] 郑小红, 肖琳, 任晶, 等. 玄武湖微囊藻水华暴发及衰退期细菌群落变化分析[J]. 环境科学, 2008(10): 2956-2962. [26] SRIVASTAVA P, GROVER S, VERMA J, et al. Applicability and efficacy of diatom indices in water quality evaluation of the Chambal River in Central India[J]. Environmental Science and Pollution Research, 2017, 24: 25955-25976. doi: 10.1007/s11356-017-0166-0 [27] FU H, ZHANG H, HE L, et al. Energetic asymmetry connected with energy flow changes in response to eutrophication: A study of multiple fish species in subtropical shallow lakes[J]. Polish Journal of Ecology, 2019, 67(4): 305-315. [28] BONADA N, BOGAN M T. Benthic Animals[M]. Wetzel's Limnology: Lake and River Ecosystems, Fourth Edition, 2023: 621-656. [29] 池仕运, 邓燕青, 胡菊香, 等. 江西省浅水湖泊大型底栖无脊椎动物多样性特征和影响因素[J]. 湖泊科学, 2024, 36(3): 858-869. [30] KORNIJÓW R, DUKOWSKA M, et al. Distribution patterns of epiphytic reed-associated macroinvertebrate communities across European shallow lakes[J]. Science of the total Environment, 2021, 760: 144117. doi: 10.1016/j.scitotenv.2020.144117 [31] VILMI A, KARJALAINEN S M, NOKELA T, et al. Unravelling the drivers of aquatic communities using disparate organismal groups and different taxonomic levels[J]. Ecological Indicators, 2016, 60: 108-118. doi: 10.1016/j.ecolind.2015.06.023 [32] JWAIDEH M A, SUTANUDJAJA E H, DALIN C. Global impacts of nitrogen and phosphorus fertiliser use for major crops on aquatic biodiversity[J]. The International Journal of Life Cycle Assessment, 2022, 27(8): 1058-1080. doi: 10.1007/s11367-022-02078-1 [33] SHAKER R R, YAKUBOV A D, NICK S M, et al. Predicting aquatic invasion in Adirondack lakes: A spatial analysis of lake and landscape characteristics[J]. Ecosphere, 2017, 8(3): e01723. doi: 10.1002/ecs2.1723 [34] ZHOU L, WANG X, ZHANG X, et al. Spatiotemporal variations in nitrogen and phosphorus in a large man-made lake and their relationships with human activities[J]. Water (Switzerland), 2020, 12(4): 1106. [35] VERBURG P, HORROX J, CHANEY E, et al. Nutrient ratios, differential retention, and the effect on nutrient limitation in a deep oligotrophic lake[J]. Hydrobiologia, 2013, 718(1): 119-130. doi: 10.1007/s10750-013-1609-3 [36] 林秋奇. 流溪河水库后生浮游动物多样性与群落结构的时空异质性[D]. 广州: 暨南大学, 2007. [37] LOBRY J, DAVID V, PASQUAUD S, et al. Diversity and stability of an estuarine trophic network[J]. Marine Ecology Progress Series, 2008, 358: 13-25. doi: 10.3354/meps07294 [38] JANSSON A, KLAIS-PEETS R, GRINIENĖ E, et al. Functional shifts in estuarine zooplankton in response to climate variability[J]. Ecology and evolution, 2020, 10(20): 11591-11606. doi: 10.1002/ece3.6793 [39] ATHIRA T, NEFLA A, SHIFA C, et al. The impact of long-term environmental change on zooplankton along the southwestern coast of India[J]. Environmental Monitoring and Assessment, 2022, 194(4): 316. doi: 10.1007/s10661-022-09921-w [40] JOSUÉ I I, CARDOSO S J, MIRANDA M, et al. Cyanobacteria dominance drives zooplankton functional dispersion[J]. Hydrobiologia, 2019, 831: 149-161. doi: 10.1007/s10750-018-3710-0 [41] KYATHANAHALLY S P, HARDEMAN T, MERZ E, et al. Deep learning classification of lake zooplankton[J]. Frontiers in microbiology, 2021, 12: 746297. doi: 10.3389/fmicb.2021.746297 [42] BANERJEE A, CHAKRABARTY M, RAKSHIT N, et al. Environmental factors as indicators of dissolved oxygen concentration and zooplankton abundance: Deep learning versus traditional regression approach[J]. Ecological indicators, 2019, 100: 99-117. doi: 10.1016/j.ecolind.2018.09.051 [43] ROMAN M R, BRANDT S B, HOUDE E D, et al. Interactive effects of hypoxia and temperature on coastal pelagic zooplankton and fish[J]. Frontiers in Marine Science, 2019, 6: 139. doi: 10.3389/fmars.2019.00139 [44] CALDWELL T J, CHANDRA S, FEHER K, et al. Ecosystem response to earlier ice break-up date: Climate-driven changes to water temperature, lake-habitat-specific production, and trout habitat and resource use[J]. Global Change Biology, 2020, 26(10): 5475-5491. doi: 10.1111/gcb.15258 [45] ZHAO C, SHAO N, YANG S, et al. Integrated assessment of ecosystem health using multiple indicator species[J]. Ecological Engineering, 2019, 130: 157-168. doi: 10.1016/j.ecoleng.2019.02.016 [46] HAWKINS C P, CARLISLE D M. Biological assessments of aquatic ecosystems[M]. Encyclopedia of Inland Waters, Second Edition, 2022: 525-536. [47] 代晓颖, 徐栋, 武俊梅, 等. 2015-2019年武汉市湖泊水质时空变化[J]. 湖泊科学, 2021, 33(5): 1415-1424. -




 下载:
下载: