-
长荡湖流域地处太湖流域上游,是太湖重要水系。流域总面积2 161.46 km2,地势西高东低;流域内水系发达,流向复杂,主要流向为自西向东。由于大规模的农业耕作、淡水养殖以及快速城镇化,导致长荡湖流域氮、磷污染严重。据报道目前长荡湖流域水质恶化,水体受富营养化和蓝藻水华暴发的影响,进而威胁太湖流域生态安全[1-3]。而研究表明入湖河流是湖泊的主要污染来源[4-5]。如黄明雨[6]研究发现洱海入湖河流的氮磷输入是洱海氮磷的重要来源。谢培等[7]基于EFDC模型模拟不同调水方案下千岛湖上游入流和湖周入流CODMn变化对湖内CODMn的影响,发现上游入流是影响千岛湖湖内CODMn的主要因素。因此对长荡湖入湖河流的水生态环境现状进行全面调查研究是十分必要的。
微生物在维持水生态系统的功能和健康中起着至关重要的作用,它既是全球生物地球化学循环的主要驱动者,也是水生态系统中污染物的主要分解者[8]。由于微生物的存在,水中复杂且难降解的有机污染物才得以分解[9],水生态系统才能良性循环。早期微生物检测技术主要是分离培养法,但此种方法存在培养难度大、周期长等缺陷。为弥补传统培养方法的不足,现代分子生物学技术应运而生,常见的分子生物学方法有高通量测序技术、实时荧光定量PCR和宏基因组测序技术等[10-12]。相比第一代DNA测序技术,高通量测序技术在读取样本数量、测序范围和准确性等方面有绝对优势[13],因此被广泛应用于环境样品的16S rRNA、真菌的ITS区和功能基因的分析中[14]。作为水生态系统重要组成部分,微生物的群落结构与多样性受水体理化性质和外部环境因素的共同影响。张烨以南太湖流域长兴港和西苕溪为研究对象,发现季节变化是引起微生物群落多样性差异的主要因素,且微生物群落特征受水体理化因子影响,如入湖河流中水杆菌属(Aquabacterium)、不动杆菌属(Acinetobacter)、脱氯单胞菌属(Dechloromonas)、噬氢菌属(Hydrogenophaga)与NH4+-N呈正相关、DO呈负相关[15]。刘峰等[16]利用高通量测序技术和典范对应分析(CCA)发现汾河与黄河微生物群落组成具有一定的差异,不同环境因子对不同微生物的影响程度不同,pH和溶解氧是汾河入黄口微生物群落结构的主要影响因子。SHANG等[17]基于16S rRNA高通量测序技术发现温度、pH和DO的快速变化可能是影响呼伦湖季节性细菌多样性变化趋势的主要因素。因此研究水体中微生物群落与环境因子的响应关系,对保护水体、维护水生生态系统平衡具有重要意义。
目前长荡湖流域的研究主要聚焦于长荡湖湖体的水质变化、浮游动物和底栖动物的群落结构特征以及沉积物污染风险等[3,18-21]。如王礼权等[18]采用非度量多维尺度变换(NMDS)和冗余分析等方法探讨了长荡湖浮游植物群落结构组成特征及其与环境因子的关系。巫丹等[19]则利用正定矩阵因子(PMF)模型和主成分分析多元线性回归(PCA-MLR)模型对湖泊重金属污染来源进行解析,并评估了长荡湖沉积物重金属的风险等级。但鲜有研究关注长荡湖入湖河流的微生物群落结构特征及与环境因子的关系。鉴于丰水期水中微生物多样性较高且雨量充沛;同时渔业养殖、农业生产活动强,对入湖河流水质造成较大冲击,且较其他季节的污染更为严重[22-23]。因此本研究基于2021年6月长荡湖入湖河流的采样数据,分析入湖河流的微生物群落结构特征以及与环境因子的关系,以期为长荡湖及其入湖河流污染防治和生态修复提供参考。
-
在综合考虑长荡湖的主要入湖河流和污染源类型等因素的基础上,在入湖河流中布设11个采样点。于2021年6月(丰水期)进行水样采集。采样点根据沿岸污染源类型,分为农村生活污染、农业面源污染和渔业养殖污染3种类型。采样点的具体位置信息见表1和图1。
-
使用有机玻璃采水器采集距水面0.5 m的水样,每个采样点采集1 L水样,保存于已消毒灭菌并用样本底水充分清洗的聚乙烯取样瓶中,并在4 ℃条件下运回实验室。其中500 mL水样用于理化因子测定,500 mL在实验室无菌环境下使用0.45 μm滤膜过滤后放入冻封管并置于-20 ℃冰箱冷冻保存,之后送至公司进行微生物基因测序。
测定的理化因子包括总有机碳(TOC)、总氮(TN)、总磷(TP)、水温(WT)、pH值及溶解氧(DO)。总有机碳(TOC)采用燃烧氧化-非分散红外吸收法;总氮(TN)采用碱性过硫酸钾-紫外分光光度法;总磷(TP)采用钼酸铵分光光度法;采用YSI多参数水质分析仪(YSI PRO1020 美国)现场测定水温(WT)、pH值和DO。
-
使用PowerWater DNA试剂盒(MOBIO, USA)提取基因组DNA。通过1%琼脂糖凝胶电泳检测提取的基因组DNA。使用正向引物341F(5'-CCTAYGGGRBGCASCAG-3')和反向引物806R(5'-GGACTACNNGGGTATCTAAT-3')对V3-V4可变区进行PCR扩增。扩增程序:95 °C预变性3 min,27个循环(95 °C变性30 s,55 °C退火30 s,72 °C延伸30 s),最后72 °C延伸10 min(PCR仪: GeneAmp® 9700,Applied Biosystems, USA)。
使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Union City, CA, USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。测序采用 Illumina MiSeq PE300 高通量测序平台进行测序。利用Uparse软件(7.0.1001版)进行序列分析,将相似性不低于97%的序列分配到同一个OTU进行物种注释。PCR及测序均由上海凌恩生物科技公司完成。
-
基于Microsoft Excel处理的原始实验数据;使用Origin 2018软件绘制物种丰度柱状图,微生物多样性指数使用QIIME软件(1.7.0版)计算。利用R.v3.3.4软件进行ANOSIM分析(相似性分析),用于确定不同分组下微生物相对丰度的差异。依托微生信在线平台绘制Circos图分析不同污染类型的入湖河流中微生物群落结构组成。在Canoco for Windows 5.0软件中使用冗余分析确定微生物群落与理化因子的响应关系。
-
长荡湖入湖河流中污染物浓度与污染类型存在一定关联。如表2所示,农业面源污染的入湖河流中总氮浓度范围为2.71~2.83 mg·L−1,平均浓度为2.77 mg·L−1。总磷浓度范围为0.10~0.12 mg·L−1,平均浓度为0.11 mg·L−1。而农村生活污染和渔业养殖污染的入湖河流中总氮、总磷的平均浓度分别约为1.66、0.96 mg·L−1和0.09、0.04 mg·L−1。由此可见,相比农村生活污染和渔业养殖污染,农业面源污染贡献了更多的有机污染物,特别是含氮污染物。农业面源污染的入湖河流中W150和W151的总氮浓度超过地表水V类水质标准(≤2.0 mg·L−1)。其总氮浓度高的原因是该区为我国重要的商品粮基地,而农业生产需要施加化肥且丰水期是农业生产的关键时期,因此,富氮的农业尾水排入河流,致使周边河流总氮浓度维持在较高的浓度范围。农村生活污染的入湖河流中W153、W154、W155的TOC和TN浓度普遍较高,这是其周边生活着农村居民,大量生活污水被直接排入河中,造成河流有机物及氮素的积累。除W164外,渔业养殖污染的入湖河流中其余点位的总氮、总磷浓度均维持在较低的浓度水平。3种污染类型的入湖河流中WT总体范围为(26.25±1.75) ℃;pH维持在7.93±0.21,呈弱碱性;DO浓度范围处于(6.22±1.67) mg·L−1。
-
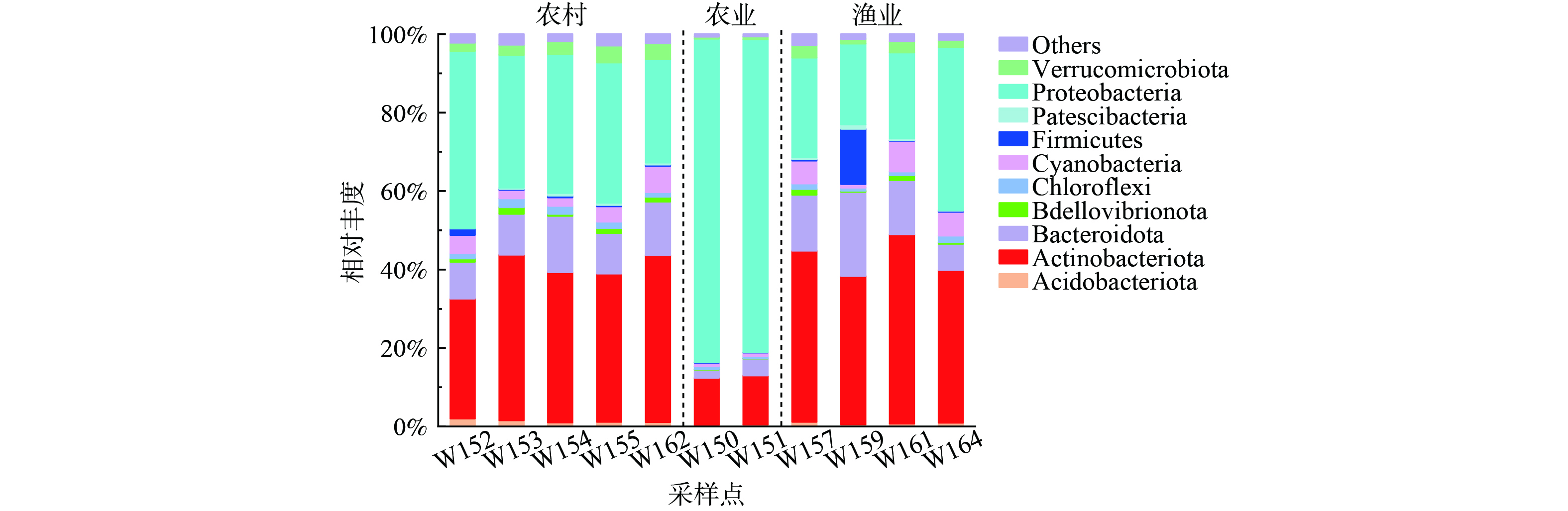
1) 门分类水平微生物群落结构。长荡湖入湖河流的微生物群落在门分类水平上具有较高的多样性。11个采样点中共检测出46种已知微生物菌门,入湖河流微生物在门分类水平上组成如图2所示,其中相对丰度排在10名之后的菌门和其他未知物种归为others。
3种污染类型的入湖河流中优势菌门种类相同,主要包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)。但不同污染类型的入湖河流中优势菌门相对丰度却有所差别。如农业面源污染入湖河流中变形菌门(Proteobacteria)相对丰度为81.09%±1.37%,远高于农村生活污染(31.05%±4.68%)和渔业养殖污染(24.49%±5.98%)。这是因为变形菌门(Proteobacteria)与氮循环有关[24-25],与氮循环密切相关的硝化细菌主要分散在变形菌门(Proteobacteria)的亚群中[26-27]。而农业面源污染的入湖河流中总氮浓度远高于其余污染类型,可见总氮对变形菌门(Proteobacteria)的生长有促进作用。农村生活污染和渔业养殖污染的入湖河流中放线菌门(Actinobacteria)相对丰度范围分别为40.19%±2.37%和38.43%±4.58%,高于农业面源污染(12.26%±0.25%)。因为农业面源污染的入湖河流DO平均浓度为5.13 mg·L−1,低于农村生活污染(6.56 mg·L−1)和渔业养殖污染(7.04 mg·L−1)。表明低DO浓度不利于放线菌门(Actinobacteria)生长。这与李明等[28]的研究结论相似,即厌氧环境能抑制放线菌门(Actinobacteria)的生长。农村生活污染、农业面源污染和渔业养殖污染的入湖河流中拟杆菌门(Bacteroidetes)相对丰度依次为11.89%±2.48%、3.19%±1.13%、8.83%±4.89%。据报道总氮和碱解氮对拟杆菌门菌群丰度起抑制作用[28],而农业面源污染的入湖河流中总氮浓度偏高。这与前人研究结论一致[29]。
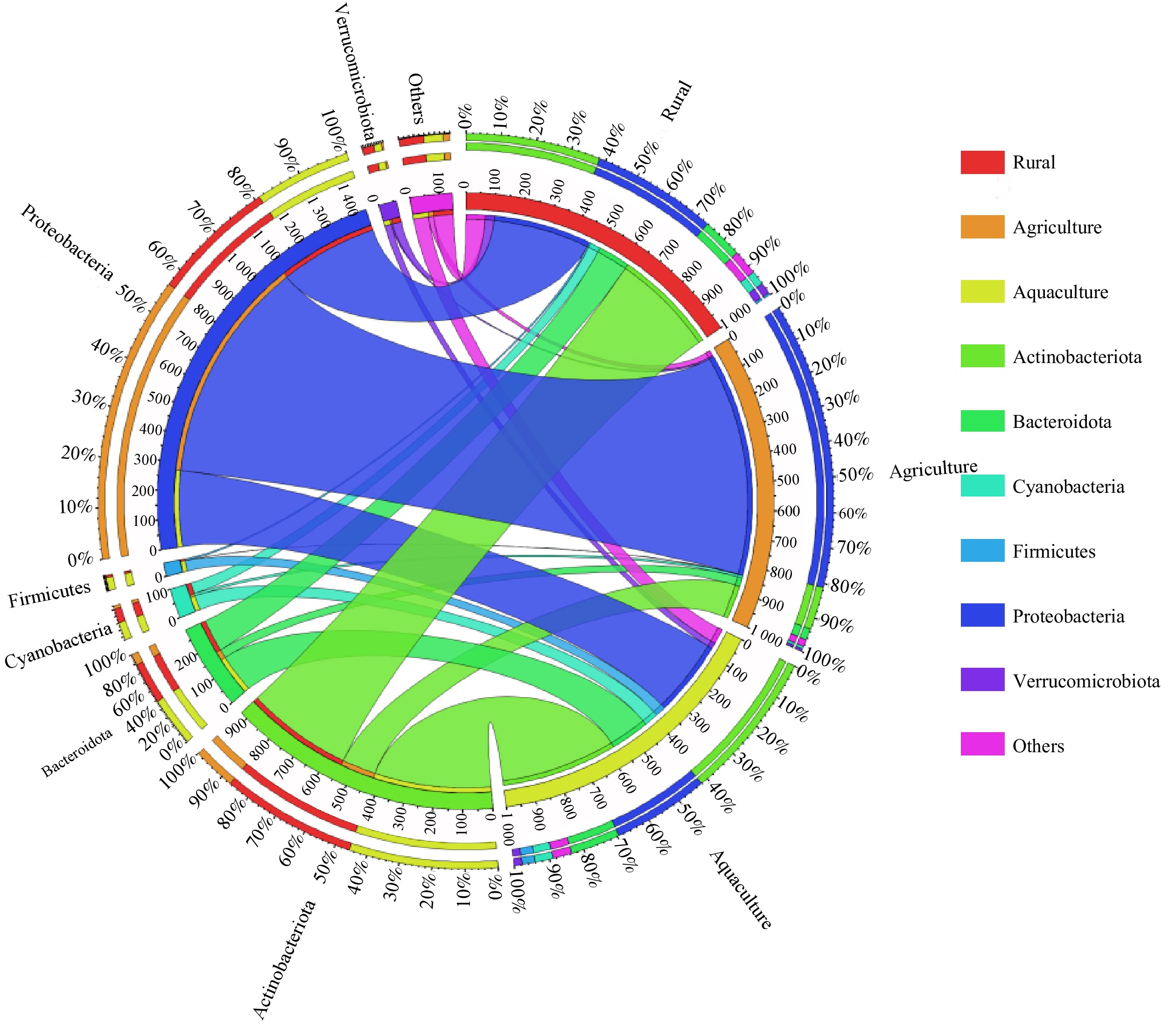
Circos图可以更直观地展现不同污染类型的入湖河流中门分类水平微生物群落组成情况。如图3所示,变形菌门(Proteobacteria)作为长荡湖入湖河流中第一大优势菌门,其在农业面源污染的入湖河流中平均占比最高;而放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和蓝细菌门(Cyanobacteria)在农业面源污染的入湖河流中平均占比最低。再次证明入湖河流中菌门的相对丰度与污染源类型相关。
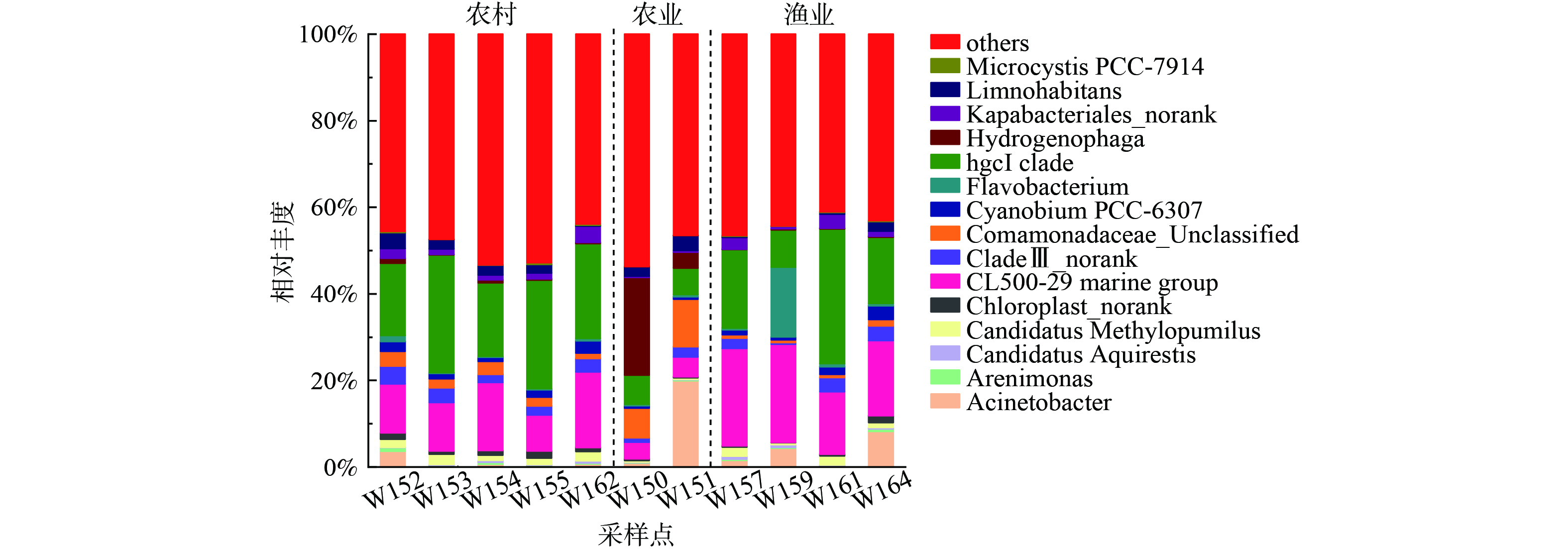
2) 属分类水平微生物群落结构。长荡湖入湖河流属分类水平微生物群落结构组成如图4所示,其中相对丰度排在15名之后的菌属和其他未知物种归为others。11个采样点共检测出617种微生物菌属;但所有采样点均有未能确定其分类学地位的菌属。入湖河流中相对丰度前5的菌属依次为:hgcI clade (6.10%~31.11%)、CL500-29 marine group(3.89%~22.64%)、Acinetobacter(0.15%~19.99%)、Comamonadaceae-Unclassified(0.66%~10.94%)和Hydrogenophaga(0.07%~22.60%)。
不同污染类型的入湖河流中优势菌属种类相似,但相对丰度不同。hgcI clade在农村生活污染和渔业养殖污染的入湖河流中平均占比分别为21.55%、18.28%,高于农业面源污染(6.43%);相同地,CL500-29 marine group在农村生活污染、渔业养殖污染和农业面源污染的入湖河流中占比依次为12.80%、19.25%、4.23%,说明农村生活污染和渔业养殖污染的入湖河流更适合hgcI clade、CL500-29 marine group的生长。反之,hgcI clade、CL500-29 marine group能利用营养物质促进自身生长繁殖,进而改善水质[30]。研究表明hgcI clade相对丰度随温度升高而明显增大,且与水质变好有关[31-32];CL500-29 marine group能够利用含碳有机物改善水质[33]。因此农业面源污染的入湖河流TOC平均浓度(3.10 mg·L−1)低于农村生活污染(5.02 mg·L−1)和渔业养殖污染(3.83 mg·L−1)。农业面源污染的入湖河流中Hydrogenophaga的相对丰度显著高于农村生活污染和渔业养殖污染。XING等[34]研究发现Hydrogenophaga是一种兼性自养菌,能在没有或有残留可生物降解有机物的污水中保持优势地位。所以在农业面源污染的入湖河流中,Hydrogenophaga相对丰度反而更高。
进一步采用ANOSIM分析探究不同污染类型的入湖河流中各采样点微生物的相对丰度差异。结果表明,组间差异大于组内差异,且不同污染类型的入湖河流点位的微生物群落结构存在显著差异(p = 0.002,R = 0.579),证明微生物群落结构与污染源类型相关。
3) 微生物群落Alpha多样性分析。长荡湖入湖河流中微生物群落Alpha多样性分析结果见表3。
长荡湖入湖河流采集的水体样本中,Coverage指数均在0.97以上,说明本次测序深度基本覆盖样品中的物种。3种污染类型入湖河流中Ace指数最高的是农村生活污染(5 590.5±1 147.5),最低的是农业面源污染(3 969.5±164.5);农村生活污染的入湖河流中Chao1指数最高(5 329.0±1 086.0),Chao1指数最低的是农业面源污染(3 906.0±219.0)。说明丰水期农村生活污染的入湖河流中微生物群落的丰富度最高,而农业面源污染的入湖河流中微生物群落丰富度最低。这与ZHANG等[35]研究结论一致。即不同的外部污染输入与细菌群落呈显著相关,如农业污染会导致norank_p_Aminicenantes相对丰度升高。农村生活污染的入湖河流中Shannon指数平均值最高,约为8.464,其次为渔业养殖污染(7.756),农业面源污染(6.704)。Simpson指数与Shannon指数反映的结论一致。整体上,丰水期长荡湖入湖河流的微生物群落丰富度与多样性呈现农村生活污染>渔业养殖污染>农业面源污染的规律。
-
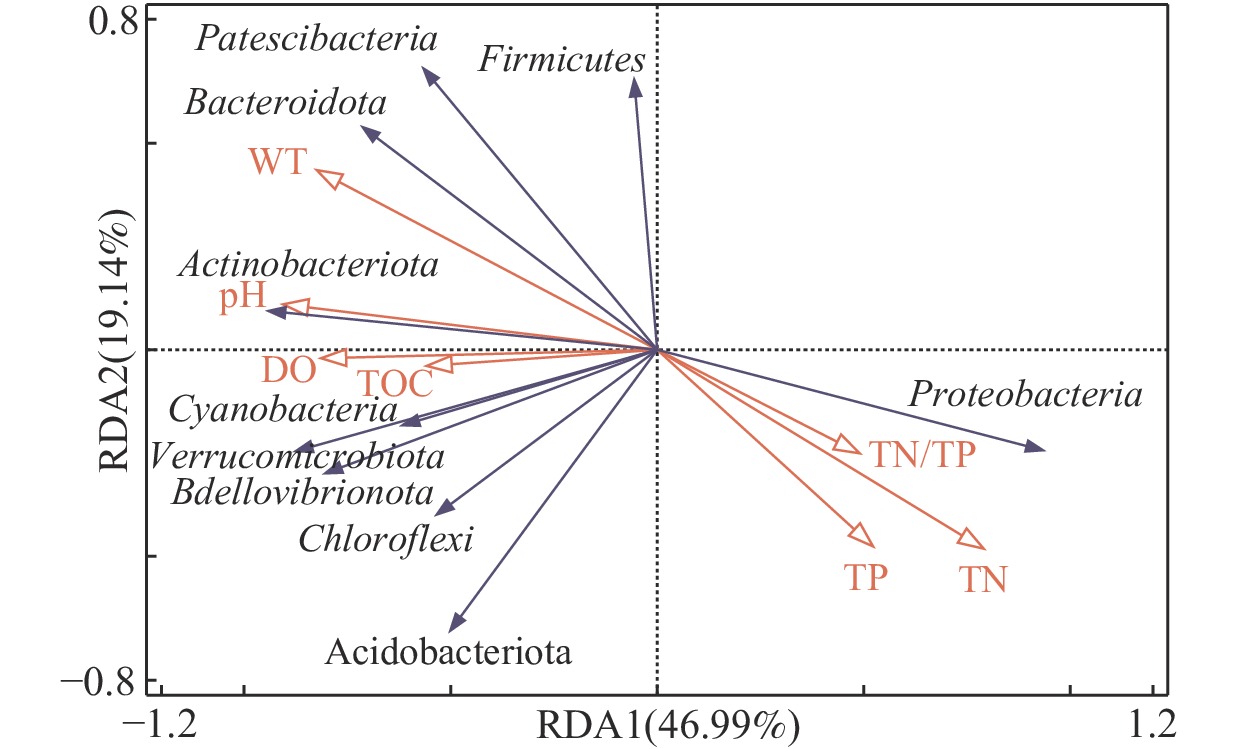
1) 入湖河流优势门分类水平微生物群落与理化因子响应分析。长荡湖入湖河流中相对丰度前10的优势菌门与7个理化因子(DO、pH、WT、TOC、TN、TP和TN/TP)的冗余分析结果如图5所示。pH、TP与长荡湖入湖河流的优势菌门呈显著相关(p<0.05),DO、WT、TOC、TN及TN/TP与长荡湖入湖河流优势菌门的相关性不显著(p>0.05)。
长荡湖入湖河流中DO与Actinobacteria、Cyanobacteria、Verrucomicrobiota等菌门呈正相关,说明DO能促进Actinobacteria、Cyanobacteria、Verrucomicrobiota等菌门的生长[36-37]。同样地,Cyanobacteria也可通过光合作用产生氧气,增加水中溶解氧[38]。而DO与Proteobacteria呈显著负相关,表明随着DO浓度升高,Proteobacteria丰度反而降低,这与李亚莉等[39]研究结论一致。入湖河流中pH与Actinobacteria呈显著正相关,与Proteobacteria呈显著负相关。入湖河流中WT、TOC与Proteobacteria呈显著负相关,但与其余菌门呈一定程度的正相关。这与邹沈娟等[40]研究结论一致,即变形菌门与WT、TOC显著负相关。但刘泽岸和孙琳[41]却有不同的观点,其以浐灞河生态区为研究对象,发现Proteobacteria与WT呈正相关。原因是本文和邹沈娟等[40]研究文章中水样属于同一时间采集,而刘泽岸和孙琳[41]的研究文章中水样分别在夏、冬两季各采集一次。夏、冬两季水样的WT差距较大;同时微生物有适宜的生长温度范围,过高或过低均会降低微生物的丰度[42]。因此造成了不同研究人员研究发现Proteobacteria与WT呈现出相关性不一致的现象。微生物的生长除了WT、pH等影响因素外,营养因素N、P至关重要,许多研究也发现营养因素与微生物群落结构有较大的相关性。如张雅洁等[43]以北海湖为研究对象,发现在TN浓度为0.83~1.67 mg·L−1,TP浓度为0.04~0.11 mg·L−1时,营养盐浓度增加,能显著增加蓝细菌的丰度。薛银刚等[44]研究发现营养盐在微囊藻属的有害增殖过程中起着重要的作用,是推动微囊藻水华暴发的主要因素。但在本研究中,入湖河流中TN、TP和TN/TP除与Proteobacteria呈显著正相关,与其它菌门均呈一定程度的负相关。李先会等[45]研究发现在满足微生物生长需要的条件下,增加微生物生长所需底物(如TN、TP)浓度反而会抑制微生物生长。对比发现,长荡湖入湖河流中TN浓度为0.64~2.83 mg·L−1,TP浓度为0.03~0.12 mg·L−1;高于北海湖TN、TP浓度水平。所以在较高TN、TP浓度的环境下,微生物生长反而受到抑制。而入湖河流中TN、TP和TN/TP与Proteobacteria呈显著正相关,说明Proteobacteria对TN、TP的耐受性较强。
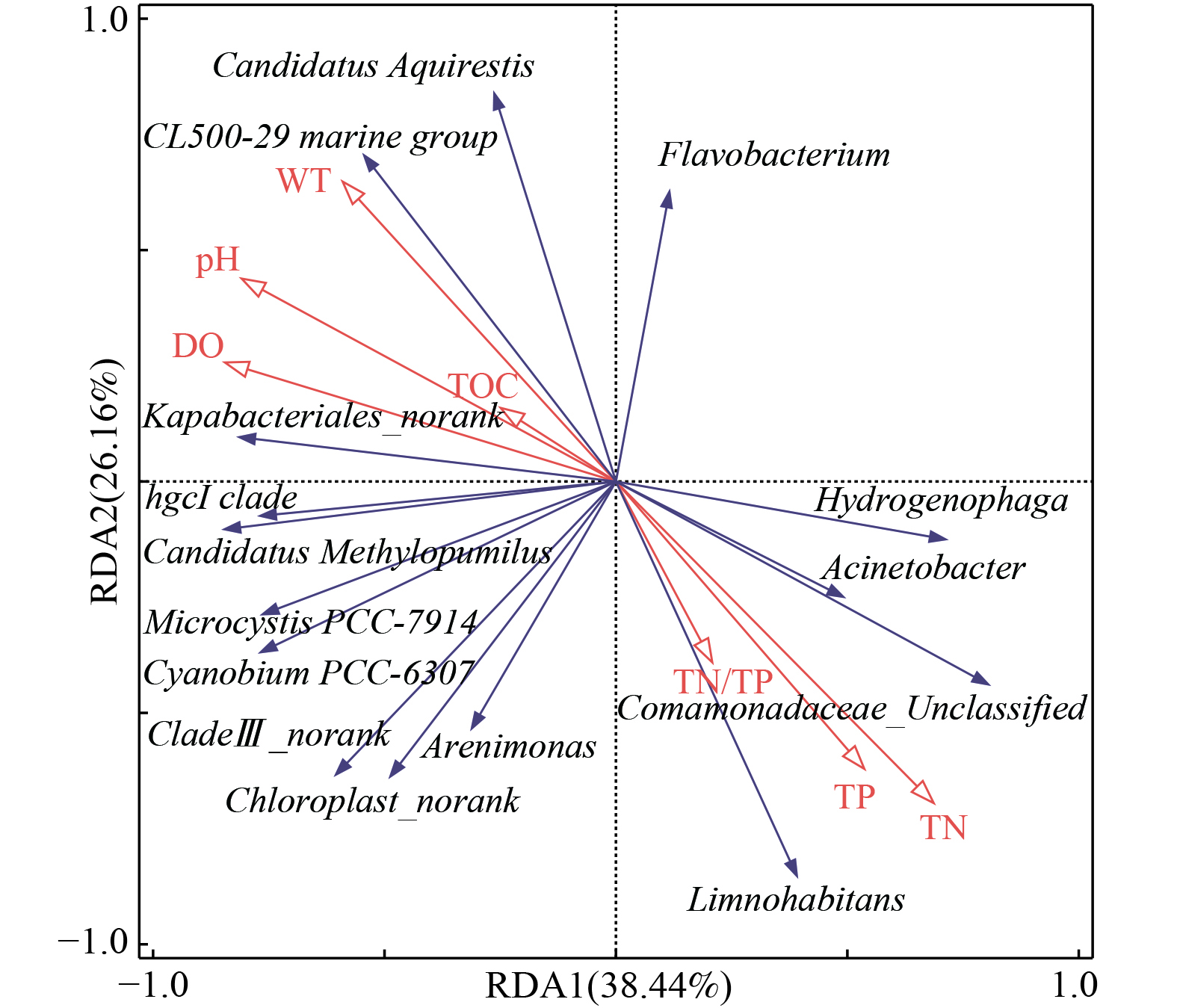
2) 入湖河流优势属分类水平微生物与环境因子响应分析。长荡湖入湖河流中相对丰度前15的优势菌属与7个理化因子(DO、pH、WT、TOC、TN、TP和TN/TP)的冗余分析结果如图6所示。DO、pH与长荡湖入湖河流的优势菌属呈显著相关(P<0.05),WT、TOC、TN、TP和TN/TP与长荡湖入湖河流的优势菌属相关性不显著(P>0.05)。
长荡湖入湖河流中DO、pH与Hydrogenophaga、Acinetobacter、Limnohabitans等菌属呈一定程度的负相关。Acinetobacter属于专性需氧型细菌,能在有氧条件下将氨转化为硝酸[37]。但本研究显示随着DO浓度升高,Acinetobacter生长反而受到抑制。分析可能是受其它环境因子影响或其它优势菌属争夺DO,抑制了Acinetobacter生长。Limnohabitans喜欢非酸性的环境,在溶解氧浓度较低的环境下,生长速率快,生存能力强[46];而长荡湖入湖河流中较多的氮磷等营养物质为Limnohabitans提供了良好的生存条件且水体偏碱性,因此DO升高反而抑制Limnohabitans繁殖。长荡湖入湖河流中WT、TOC与Hydrogenophaga、Acinetobacter、Comamonadaceae_Unclassified、Limnohabitans及Arenimonas呈一定程度的负相关,与CL500-29 marine group、Candidatus Aquirestis、hgcI clade等菌属呈正相关。研究表明温度能影响微生物的活性且不同微生物的生长适宜温度并不相同[47-48],所以当WT处于24.5~28 ℃内,WT偏低有利于Hydrogenophaga、Acinetobacter、Comamonadaceae_Unclassified、Limnohabitans及Arenimonas的繁殖,WT偏高则适宜CL500-29 marine group、Candidatus Aquirestis、hgcI clade等菌属生长。长荡湖入湖河流中TN、TP及TN/TP与Hydrogenophaga、Acinetobacter、Comamonadaceae_Unclassified及Limnohabitans等菌属呈一定程度的正相关,与CL500-29 marine group、Candidatus Aquirestis、hgcI clade等菌属呈负相关。说明长荡湖入湖河流中TN、TP浓度早已超出CL500-29 marine group、Candidatus Aquirestis及hgcI clade等菌属生长所需浓度,因此随着入湖河流中氮磷浓度升高,这些菌属的生长反而受到抑制[45]。
-
1) 高通量测序结果表明,丰水期长荡湖入湖河流11个采样点共检测出微生物群落46门,617属。在门、属分类水平上,入湖河流各采样点的微生物群落中优势菌门、菌属种类相似,但相对丰度却有所差别。进一步采用ANOSIM分析,结果表明长荡湖入湖河流微生物群落与污染源类型相关。
2) 据微生物群落Alpha多样性分析结果显示,3种污染类型的长荡湖入湖河流中微生物群落多样性和丰富度呈现农村生活污染>渔业养殖污染>农业面源污染的规律。
3) 冗余分析表明,pH、TP与长荡湖入湖河流的优势菌门呈显著相关(P<0.05);DO、pH与长荡湖入湖河流的优势菌属呈显著相关(P<0.05),且同一种理化因子与不同菌门、菌属的相关性不同。
丰水期长荡湖入湖河流微生物群落结构特征及影响因素
Characteristics of microbial community structure and influencing factors in rivers entering Changdang Lake during the wet season
-
摘要: 为探究长荡湖入湖河流微生物群落结构特征及与环境因子的响应关系,在综合考虑主要入湖河流和污染源类型等因素的基础上进行分组,分析入湖河流中溶解氧(DO)、pH、氮磷比(TN/TP)、水温(WT)、总有机碳(TOC)、总氮(TN)和总磷(TP)共7个理化因子的分布特征。基于16S rRNA高通量测序技术并结合Circos、ANOSIM和冗余分析(RDA)等方法分析微生物群落结构特征的差异以及微生物群落与理化因子的关系。结果表明:不同污染类型的长荡湖入湖河流中优势菌门、菌属种类相似,但相对丰度却有所差别。优势菌门包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes);优势菌属包含hgcI clade、CL500-29 marine group、Acinetobacter、Comamonadaceae-Unclassified和Hydrogenophaga。ANOSIM分析表明长荡湖入湖河流微生物群落结构特征与污染源类型相关。冗余分析(RDA)结果显示pH、TP与长荡湖入湖河流的优势菌门呈显著相关(P<0.05);DO、pH与长荡湖入湖河流的优势菌属呈显著相关(P<0.05)。入湖河流的微生物群落在门、属分类水平上具有较高多样性且与污染源类型和理化因子相关,这为长荡湖入湖河流污染防治和生态修复提供了数据支撑。Abstract: To understand the structural characteristics of microbial communities in rivers entering Changdang Lake and the response relationship with environmental factors, this study classified these communities based on the comprehensive assessment of the primary rivers flowing into Changdang Lake and the types of pollutant sources. The distribution characteristics of seven physicochemical indices were analyzed in rivers entering Changdang Lake, including dissolved oxygen (DO), pH, ratio of total nitrogen to total phosphorus (TN/TP), water temperature (WT), total organic carbon (TOC), total nitrogen (TN) and total phosphorus (TP). The differences in the structural characteristics of microbial communities and the relationship between microbial communities and physicochemical factors were analyzed based on 16S rRNA high-throughput sequencing technology with Circos, ANOSIM and redundancy analysis (RDA). The results showed that the dominant phyla and genera of microorganisms in rivers entering Changdang Lake with various pollution types were similar, though the relative abundance differed. The dominant phyla included Proteobacteria, Actinobacteria and Bacteroidetes; the dominant genera included hgcI clade, CL500-29 marine group, Acinetobacter, Comamonadaceae-Unclassified and Hydrogenophaga. ANOSIM analyses showed that the microbial community structure characteristics of rivers entering Changdang Lake were related to the type of pollution source. The results of redundancy analysis (RDA) showed that pH and TP were significantly associated with the dominant phylum of bacteria in rivers entering Changdang Lake (P<0.05); DO and pH were extremely associated with the dominant genus of bacteria in rivers entering Changdang Lake (P<0.05). The microbial communities in rivers entering the Changdang Lake were highly diverse at the phylum and genus levels and were correlated with type of pollution sources and physicochemical factors, which provided basis for the pollution prevention and ecological restoration of rivers entering the Changdang Lake.
-
长荡湖流域地处太湖流域上游,是太湖重要水系。流域总面积2 161.46 km2,地势西高东低;流域内水系发达,流向复杂,主要流向为自西向东。由于大规模的农业耕作、淡水养殖以及快速城镇化,导致长荡湖流域氮、磷污染严重。据报道目前长荡湖流域水质恶化,水体受富营养化和蓝藻水华暴发的影响,进而威胁太湖流域生态安全[1-3]。而研究表明入湖河流是湖泊的主要污染来源[4-5]。如黄明雨[6]研究发现洱海入湖河流的氮磷输入是洱海氮磷的重要来源。谢培等[7]基于EFDC模型模拟不同调水方案下千岛湖上游入流和湖周入流CODMn变化对湖内CODMn的影响,发现上游入流是影响千岛湖湖内CODMn的主要因素。因此对长荡湖入湖河流的水生态环境现状进行全面调查研究是十分必要的。
微生物在维持水生态系统的功能和健康中起着至关重要的作用,它既是全球生物地球化学循环的主要驱动者,也是水生态系统中污染物的主要分解者[8]。由于微生物的存在,水中复杂且难降解的有机污染物才得以分解[9],水生态系统才能良性循环。早期微生物检测技术主要是分离培养法,但此种方法存在培养难度大、周期长等缺陷。为弥补传统培养方法的不足,现代分子生物学技术应运而生,常见的分子生物学方法有高通量测序技术、实时荧光定量PCR和宏基因组测序技术等[10-12]。相比第一代DNA测序技术,高通量测序技术在读取样本数量、测序范围和准确性等方面有绝对优势[13],因此被广泛应用于环境样品的16S rRNA、真菌的ITS区和功能基因的分析中[14]。作为水生态系统重要组成部分,微生物的群落结构与多样性受水体理化性质和外部环境因素的共同影响。张烨以南太湖流域长兴港和西苕溪为研究对象,发现季节变化是引起微生物群落多样性差异的主要因素,且微生物群落特征受水体理化因子影响,如入湖河流中水杆菌属(Aquabacterium)、不动杆菌属(Acinetobacter)、脱氯单胞菌属(Dechloromonas)、噬氢菌属(Hydrogenophaga)与NH4+-N呈正相关、DO呈负相关[15]。刘峰等[16]利用高通量测序技术和典范对应分析(CCA)发现汾河与黄河微生物群落组成具有一定的差异,不同环境因子对不同微生物的影响程度不同,pH和溶解氧是汾河入黄口微生物群落结构的主要影响因子。SHANG等[17]基于16S rRNA高通量测序技术发现温度、pH和DO的快速变化可能是影响呼伦湖季节性细菌多样性变化趋势的主要因素。因此研究水体中微生物群落与环境因子的响应关系,对保护水体、维护水生生态系统平衡具有重要意义。
目前长荡湖流域的研究主要聚焦于长荡湖湖体的水质变化、浮游动物和底栖动物的群落结构特征以及沉积物污染风险等[3,18-21]。如王礼权等[18]采用非度量多维尺度变换(NMDS)和冗余分析等方法探讨了长荡湖浮游植物群落结构组成特征及其与环境因子的关系。巫丹等[19]则利用正定矩阵因子(PMF)模型和主成分分析多元线性回归(PCA-MLR)模型对湖泊重金属污染来源进行解析,并评估了长荡湖沉积物重金属的风险等级。但鲜有研究关注长荡湖入湖河流的微生物群落结构特征及与环境因子的关系。鉴于丰水期水中微生物多样性较高且雨量充沛;同时渔业养殖、农业生产活动强,对入湖河流水质造成较大冲击,且较其他季节的污染更为严重[22-23]。因此本研究基于2021年6月长荡湖入湖河流的采样数据,分析入湖河流的微生物群落结构特征以及与环境因子的关系,以期为长荡湖及其入湖河流污染防治和生态修复提供参考。
1. 材料与方法
1.1 采样点设置与采样时间
在综合考虑长荡湖的主要入湖河流和污染源类型等因素的基础上,在入湖河流中布设11个采样点。于2021年6月(丰水期)进行水样采集。采样点根据沿岸污染源类型,分为农村生活污染、农业面源污染和渔业养殖污染3种类型。采样点的具体位置信息见表1和图1。
表 1 长荡湖入湖河流采样点位置信息Table 1. Sampling locations in rivers entering Changdang Lake污染类型 采样点编号 经度 纬度 农村生活污染 W152 119°29′28.67″E 31°37′13.51″N W153 119°29′25.54″E 31°35′1.75″N W154 119°29′9.86″E 31°34′32.47″N W155 119°29′36.09″E 31°32′45.49″N W162 119°35′39.21″E 31°40′28.72″N 农业面源污染 W150 119°31′15.62″E 31°39′31.88″N W151 119°30′30.00″E 31°38′18.13″N 渔业养殖污染 W157 119°33′27.30″E 31°34′43.09″N W159 119°36′34.12″E 31°36′52.48″N W161 119°36′30.18″E 31°39′23.19″N W164 119°32′57.24″E 31°40′17.43″N 1.2 水样采集与测定方法
使用有机玻璃采水器采集距水面0.5 m的水样,每个采样点采集1 L水样,保存于已消毒灭菌并用样本底水充分清洗的聚乙烯取样瓶中,并在4 ℃条件下运回实验室。其中500 mL水样用于理化因子测定,500 mL在实验室无菌环境下使用0.45 μm滤膜过滤后放入冻封管并置于-20 ℃冰箱冷冻保存,之后送至公司进行微生物基因测序。
测定的理化因子包括总有机碳(TOC)、总氮(TN)、总磷(TP)、水温(WT)、pH值及溶解氧(DO)。总有机碳(TOC)采用燃烧氧化-非分散红外吸收法;总氮(TN)采用碱性过硫酸钾-紫外分光光度法;总磷(TP)采用钼酸铵分光光度法;采用YSI多参数水质分析仪(YSI PRO1020 美国)现场测定水温(WT)、pH值和DO。
1.3 微生物群落测序分析方法
使用PowerWater DNA试剂盒(MOBIO, USA)提取基因组DNA。通过1%琼脂糖凝胶电泳检测提取的基因组DNA。使用正向引物341F(5'-CCTAYGGGRBGCASCAG-3')和反向引物806R(5'-GGACTACNNGGGTATCTAAT-3')对V3-V4可变区进行PCR扩增。扩增程序:95 °C预变性3 min,27个循环(95 °C变性30 s,55 °C退火30 s,72 °C延伸30 s),最后72 °C延伸10 min(PCR仪: GeneAmp® 9700,Applied Biosystems, USA)。
使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Union City, CA, USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。测序采用 Illumina MiSeq PE300 高通量测序平台进行测序。利用Uparse软件(7.0.1001版)进行序列分析,将相似性不低于97%的序列分配到同一个OTU进行物种注释。PCR及测序均由上海凌恩生物科技公司完成。
1.4 数据处理与分析
基于Microsoft Excel处理的原始实验数据;使用Origin 2018软件绘制物种丰度柱状图,微生物多样性指数使用QIIME软件(1.7.0版)计算。利用R.v3.3.4软件进行ANOSIM分析(相似性分析),用于确定不同分组下微生物相对丰度的差异。依托微生信在线平台绘制Circos图分析不同污染类型的入湖河流中微生物群落结构组成。在Canoco for Windows 5.0软件中使用冗余分析确定微生物群落与理化因子的响应关系。
2. 结果与讨论
2.1 入湖河流的理化指标
长荡湖入湖河流中污染物浓度与污染类型存在一定关联。如表2所示,农业面源污染的入湖河流中总氮浓度范围为2.71~2.83 mg·L−1,平均浓度为2.77 mg·L−1。总磷浓度范围为0.10~0.12 mg·L−1,平均浓度为0.11 mg·L−1。而农村生活污染和渔业养殖污染的入湖河流中总氮、总磷的平均浓度分别约为1.66、0.96 mg·L−1和0.09、0.04 mg·L−1。由此可见,相比农村生活污染和渔业养殖污染,农业面源污染贡献了更多的有机污染物,特别是含氮污染物。农业面源污染的入湖河流中W150和W151的总氮浓度超过地表水V类水质标准(≤2.0 mg·L−1)。其总氮浓度高的原因是该区为我国重要的商品粮基地,而农业生产需要施加化肥且丰水期是农业生产的关键时期,因此,富氮的农业尾水排入河流,致使周边河流总氮浓度维持在较高的浓度范围。农村生活污染的入湖河流中W153、W154、W155的TOC和TN浓度普遍较高,这是其周边生活着农村居民,大量生活污水被直接排入河中,造成河流有机物及氮素的积累。除W164外,渔业养殖污染的入湖河流中其余点位的总氮、总磷浓度均维持在较低的浓度水平。3种污染类型的入湖河流中WT总体范围为(26.25±1.75) ℃;pH维持在7.93±0.21,呈弱碱性;DO浓度范围处于(6.22±1.67) mg·L−1。
表 2 长荡湖入湖河流水体理化指标Table 2. Physical-chemical indicators of rivers entering Changdang Lake污染类型 点位 TOC/(mg·L−1) TN/(mg·L−1) TP/(mg·L−1) WT/( ℃) pH DO/(mg·L−1) TN/TP 农村生活污染 W152 2.70 1.98 0.10 24.7 7.9 6.34 19.80 W153 5.90 1.94 0.10 26.9 8.02 6.77 19.40 W154 6.10 1.88 0.10 26.6 7.97 5.63 18.80 W155 6.30 1.83 0.11 27.4 8.02 6.56 16.64 W162 4.10 0.69 0.03 27.1 8.09 7.49 23.00 农业面源污染 W150 3.20 2.71 0.12 24.9 7.72 4.55 22.58 W151 3.00 2.83 0.10 24.5 7.83 5.71 28.30 渔业养殖污染 W157 4.20 0.70 0.04 27.2 8.14 7.28 17.50 W159 4.00 0.72 0.04 27.6 8.02 6.43 18.00 W161 4.00 0.64 0.04 28 8.01 7.89 16.00 W164 3.10 1.79 0.05 26.2 8.03 6.57 35.80 2.2 入湖河流微生物群落分布
1) 门分类水平微生物群落结构。长荡湖入湖河流的微生物群落在门分类水平上具有较高的多样性。11个采样点中共检测出46种已知微生物菌门,入湖河流微生物在门分类水平上组成如图2所示,其中相对丰度排在10名之后的菌门和其他未知物种归为others。
3种污染类型的入湖河流中优势菌门种类相同,主要包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)。但不同污染类型的入湖河流中优势菌门相对丰度却有所差别。如农业面源污染入湖河流中变形菌门(Proteobacteria)相对丰度为81.09%±1.37%,远高于农村生活污染(31.05%±4.68%)和渔业养殖污染(24.49%±5.98%)。这是因为变形菌门(Proteobacteria)与氮循环有关[24-25],与氮循环密切相关的硝化细菌主要分散在变形菌门(Proteobacteria)的亚群中[26-27]。而农业面源污染的入湖河流中总氮浓度远高于其余污染类型,可见总氮对变形菌门(Proteobacteria)的生长有促进作用。农村生活污染和渔业养殖污染的入湖河流中放线菌门(Actinobacteria)相对丰度范围分别为40.19%±2.37%和38.43%±4.58%,高于农业面源污染(12.26%±0.25%)。因为农业面源污染的入湖河流DO平均浓度为5.13 mg·L−1,低于农村生活污染(6.56 mg·L−1)和渔业养殖污染(7.04 mg·L−1)。表明低DO浓度不利于放线菌门(Actinobacteria)生长。这与李明等[28]的研究结论相似,即厌氧环境能抑制放线菌门(Actinobacteria)的生长。农村生活污染、农业面源污染和渔业养殖污染的入湖河流中拟杆菌门(Bacteroidetes)相对丰度依次为11.89%±2.48%、3.19%±1.13%、8.83%±4.89%。据报道总氮和碱解氮对拟杆菌门菌群丰度起抑制作用[28],而农业面源污染的入湖河流中总氮浓度偏高。这与前人研究结论一致[29]。
Circos图可以更直观地展现不同污染类型的入湖河流中门分类水平微生物群落组成情况。如图3所示,变形菌门(Proteobacteria)作为长荡湖入湖河流中第一大优势菌门,其在农业面源污染的入湖河流中平均占比最高;而放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和蓝细菌门(Cyanobacteria)在农业面源污染的入湖河流中平均占比最低。再次证明入湖河流中菌门的相对丰度与污染源类型相关。
2) 属分类水平微生物群落结构。长荡湖入湖河流属分类水平微生物群落结构组成如图4所示,其中相对丰度排在15名之后的菌属和其他未知物种归为others。11个采样点共检测出617种微生物菌属;但所有采样点均有未能确定其分类学地位的菌属。入湖河流中相对丰度前5的菌属依次为:hgcI clade (6.10%~31.11%)、CL500-29 marine group(3.89%~22.64%)、Acinetobacter(0.15%~19.99%)、Comamonadaceae-Unclassified(0.66%~10.94%)和Hydrogenophaga(0.07%~22.60%)。
不同污染类型的入湖河流中优势菌属种类相似,但相对丰度不同。hgcI clade在农村生活污染和渔业养殖污染的入湖河流中平均占比分别为21.55%、18.28%,高于农业面源污染(6.43%);相同地,CL500-29 marine group在农村生活污染、渔业养殖污染和农业面源污染的入湖河流中占比依次为12.80%、19.25%、4.23%,说明农村生活污染和渔业养殖污染的入湖河流更适合hgcI clade、CL500-29 marine group的生长。反之,hgcI clade、CL500-29 marine group能利用营养物质促进自身生长繁殖,进而改善水质[30]。研究表明hgcI clade相对丰度随温度升高而明显增大,且与水质变好有关[31-32];CL500-29 marine group能够利用含碳有机物改善水质[33]。因此农业面源污染的入湖河流TOC平均浓度(3.10 mg·L−1)低于农村生活污染(5.02 mg·L−1)和渔业养殖污染(3.83 mg·L−1)。农业面源污染的入湖河流中Hydrogenophaga的相对丰度显著高于农村生活污染和渔业养殖污染。XING等[34]研究发现Hydrogenophaga是一种兼性自养菌,能在没有或有残留可生物降解有机物的污水中保持优势地位。所以在农业面源污染的入湖河流中,Hydrogenophaga相对丰度反而更高。
进一步采用ANOSIM分析探究不同污染类型的入湖河流中各采样点微生物的相对丰度差异。结果表明,组间差异大于组内差异,且不同污染类型的入湖河流点位的微生物群落结构存在显著差异(p = 0.002,R = 0.579),证明微生物群落结构与污染源类型相关。
3) 微生物群落Alpha多样性分析。长荡湖入湖河流中微生物群落Alpha多样性分析结果见表3。
表 3 长荡湖入湖河流微生物Alpha多样性指数Table 3. Alpha diversity index of microorganisms in rivers entering Changdang Lake污染类型 点位名称 Ace Chao1 Shannon Simpson Coverage 农村生活污染 W152 5897 5619 8.5312 0.0114 0.974 W153 5733 5537 8.3473 0.0129 0.978 W154 6051 5856 8.6283 0.0101 0.977 W155 6738 6415 8.7358 0.0118 0.970 W162 4443 4243 8.0785 0.0166 0.973 农业面源污染 W150 4134 4125 6.5501 0.0572 0.977 W151 3805 3687 6.8585 0.0376 0.983 渔业养殖污染 W157 3698 3619 7.9462 0.0133 0.973 W159 3733 3606 7.4672 0.0249 0.975 W161 3763 3632 7.3288 0.0339 0.978 W164 4997 4849 8.2801 0.0135 0.973 长荡湖入湖河流采集的水体样本中,Coverage指数均在0.97以上,说明本次测序深度基本覆盖样品中的物种。3种污染类型入湖河流中Ace指数最高的是农村生活污染(5 590.5±1 147.5),最低的是农业面源污染(3 969.5±164.5);农村生活污染的入湖河流中Chao1指数最高(5 329.0±1 086.0),Chao1指数最低的是农业面源污染(3 906.0±219.0)。说明丰水期农村生活污染的入湖河流中微生物群落的丰富度最高,而农业面源污染的入湖河流中微生物群落丰富度最低。这与ZHANG等[35]研究结论一致。即不同的外部污染输入与细菌群落呈显著相关,如农业污染会导致norank_p_Aminicenantes相对丰度升高。农村生活污染的入湖河流中Shannon指数平均值最高,约为8.464,其次为渔业养殖污染(7.756),农业面源污染(6.704)。Simpson指数与Shannon指数反映的结论一致。整体上,丰水期长荡湖入湖河流的微生物群落丰富度与多样性呈现农村生活污染>渔业养殖污染>农业面源污染的规律。
2.3 入湖河流微生物群落与理化因子相关性分析
1) 入湖河流优势门分类水平微生物群落与理化因子响应分析。长荡湖入湖河流中相对丰度前10的优势菌门与7个理化因子(DO、pH、WT、TOC、TN、TP和TN/TP)的冗余分析结果如图5所示。pH、TP与长荡湖入湖河流的优势菌门呈显著相关(p<0.05),DO、WT、TOC、TN及TN/TP与长荡湖入湖河流优势菌门的相关性不显著(p>0.05)。
长荡湖入湖河流中DO与Actinobacteria、Cyanobacteria、Verrucomicrobiota等菌门呈正相关,说明DO能促进Actinobacteria、Cyanobacteria、Verrucomicrobiota等菌门的生长[36-37]。同样地,Cyanobacteria也可通过光合作用产生氧气,增加水中溶解氧[38]。而DO与Proteobacteria呈显著负相关,表明随着DO浓度升高,Proteobacteria丰度反而降低,这与李亚莉等[39]研究结论一致。入湖河流中pH与Actinobacteria呈显著正相关,与Proteobacteria呈显著负相关。入湖河流中WT、TOC与Proteobacteria呈显著负相关,但与其余菌门呈一定程度的正相关。这与邹沈娟等[40]研究结论一致,即变形菌门与WT、TOC显著负相关。但刘泽岸和孙琳[41]却有不同的观点,其以浐灞河生态区为研究对象,发现Proteobacteria与WT呈正相关。原因是本文和邹沈娟等[40]研究文章中水样属于同一时间采集,而刘泽岸和孙琳[41]的研究文章中水样分别在夏、冬两季各采集一次。夏、冬两季水样的WT差距较大;同时微生物有适宜的生长温度范围,过高或过低均会降低微生物的丰度[42]。因此造成了不同研究人员研究发现Proteobacteria与WT呈现出相关性不一致的现象。微生物的生长除了WT、pH等影响因素外,营养因素N、P至关重要,许多研究也发现营养因素与微生物群落结构有较大的相关性。如张雅洁等[43]以北海湖为研究对象,发现在TN浓度为0.83~1.67 mg·L−1,TP浓度为0.04~0.11 mg·L−1时,营养盐浓度增加,能显著增加蓝细菌的丰度。薛银刚等[44]研究发现营养盐在微囊藻属的有害增殖过程中起着重要的作用,是推动微囊藻水华暴发的主要因素。但在本研究中,入湖河流中TN、TP和TN/TP除与Proteobacteria呈显著正相关,与其它菌门均呈一定程度的负相关。李先会等[45]研究发现在满足微生物生长需要的条件下,增加微生物生长所需底物(如TN、TP)浓度反而会抑制微生物生长。对比发现,长荡湖入湖河流中TN浓度为0.64~2.83 mg·L−1,TP浓度为0.03~0.12 mg·L−1;高于北海湖TN、TP浓度水平。所以在较高TN、TP浓度的环境下,微生物生长反而受到抑制。而入湖河流中TN、TP和TN/TP与Proteobacteria呈显著正相关,说明Proteobacteria对TN、TP的耐受性较强。
2) 入湖河流优势属分类水平微生物与环境因子响应分析。长荡湖入湖河流中相对丰度前15的优势菌属与7个理化因子(DO、pH、WT、TOC、TN、TP和TN/TP)的冗余分析结果如图6所示。DO、pH与长荡湖入湖河流的优势菌属呈显著相关(P<0.05),WT、TOC、TN、TP和TN/TP与长荡湖入湖河流的优势菌属相关性不显著(P>0.05)。
长荡湖入湖河流中DO、pH与Hydrogenophaga、Acinetobacter、Limnohabitans等菌属呈一定程度的负相关。Acinetobacter属于专性需氧型细菌,能在有氧条件下将氨转化为硝酸[37]。但本研究显示随着DO浓度升高,Acinetobacter生长反而受到抑制。分析可能是受其它环境因子影响或其它优势菌属争夺DO,抑制了Acinetobacter生长。Limnohabitans喜欢非酸性的环境,在溶解氧浓度较低的环境下,生长速率快,生存能力强[46];而长荡湖入湖河流中较多的氮磷等营养物质为Limnohabitans提供了良好的生存条件且水体偏碱性,因此DO升高反而抑制Limnohabitans繁殖。长荡湖入湖河流中WT、TOC与Hydrogenophaga、Acinetobacter、Comamonadaceae_Unclassified、Limnohabitans及Arenimonas呈一定程度的负相关,与CL500-29 marine group、Candidatus Aquirestis、hgcI clade等菌属呈正相关。研究表明温度能影响微生物的活性且不同微生物的生长适宜温度并不相同[47-48],所以当WT处于24.5~28 ℃内,WT偏低有利于Hydrogenophaga、Acinetobacter、Comamonadaceae_Unclassified、Limnohabitans及Arenimonas的繁殖,WT偏高则适宜CL500-29 marine group、Candidatus Aquirestis、hgcI clade等菌属生长。长荡湖入湖河流中TN、TP及TN/TP与Hydrogenophaga、Acinetobacter、Comamonadaceae_Unclassified及Limnohabitans等菌属呈一定程度的正相关,与CL500-29 marine group、Candidatus Aquirestis、hgcI clade等菌属呈负相关。说明长荡湖入湖河流中TN、TP浓度早已超出CL500-29 marine group、Candidatus Aquirestis及hgcI clade等菌属生长所需浓度,因此随着入湖河流中氮磷浓度升高,这些菌属的生长反而受到抑制[45]。
3. 结论
1) 高通量测序结果表明,丰水期长荡湖入湖河流11个采样点共检测出微生物群落46门,617属。在门、属分类水平上,入湖河流各采样点的微生物群落中优势菌门、菌属种类相似,但相对丰度却有所差别。进一步采用ANOSIM分析,结果表明长荡湖入湖河流微生物群落与污染源类型相关。
2) 据微生物群落Alpha多样性分析结果显示,3种污染类型的长荡湖入湖河流中微生物群落多样性和丰富度呈现农村生活污染>渔业养殖污染>农业面源污染的规律。
3) 冗余分析表明,pH、TP与长荡湖入湖河流的优势菌门呈显著相关(P<0.05);DO、pH与长荡湖入湖河流的优势菌属呈显著相关(P<0.05),且同一种理化因子与不同菌门、菌属的相关性不同。
-
表 1 长荡湖入湖河流采样点位置信息
Table 1. Sampling locations in rivers entering Changdang Lake
污染类型 采样点编号 经度 纬度 农村生活污染 W152 119°29′28.67″E 31°37′13.51″N W153 119°29′25.54″E 31°35′1.75″N W154 119°29′9.86″E 31°34′32.47″N W155 119°29′36.09″E 31°32′45.49″N W162 119°35′39.21″E 31°40′28.72″N 农业面源污染 W150 119°31′15.62″E 31°39′31.88″N W151 119°30′30.00″E 31°38′18.13″N 渔业养殖污染 W157 119°33′27.30″E 31°34′43.09″N W159 119°36′34.12″E 31°36′52.48″N W161 119°36′30.18″E 31°39′23.19″N W164 119°32′57.24″E 31°40′17.43″N 表 2 长荡湖入湖河流水体理化指标
Table 2. Physical-chemical indicators of rivers entering Changdang Lake
污染类型 点位 TOC/(mg·L−1) TN/(mg·L−1) TP/(mg·L−1) WT/( ℃) pH DO/(mg·L−1) TN/TP 农村生活污染 W152 2.70 1.98 0.10 24.7 7.9 6.34 19.80 W153 5.90 1.94 0.10 26.9 8.02 6.77 19.40 W154 6.10 1.88 0.10 26.6 7.97 5.63 18.80 W155 6.30 1.83 0.11 27.4 8.02 6.56 16.64 W162 4.10 0.69 0.03 27.1 8.09 7.49 23.00 农业面源污染 W150 3.20 2.71 0.12 24.9 7.72 4.55 22.58 W151 3.00 2.83 0.10 24.5 7.83 5.71 28.30 渔业养殖污染 W157 4.20 0.70 0.04 27.2 8.14 7.28 17.50 W159 4.00 0.72 0.04 27.6 8.02 6.43 18.00 W161 4.00 0.64 0.04 28 8.01 7.89 16.00 W164 3.10 1.79 0.05 26.2 8.03 6.57 35.80 表 3 长荡湖入湖河流微生物Alpha多样性指数
Table 3. Alpha diversity index of microorganisms in rivers entering Changdang Lake
污染类型 点位名称 Ace Chao1 Shannon Simpson Coverage 农村生活污染 W152 5897 5619 8.5312 0.0114 0.974 W153 5733 5537 8.3473 0.0129 0.978 W154 6051 5856 8.6283 0.0101 0.977 W155 6738 6415 8.7358 0.0118 0.970 W162 4443 4243 8.0785 0.0166 0.973 农业面源污染 W150 4134 4125 6.5501 0.0572 0.977 W151 3805 3687 6.8585 0.0376 0.983 渔业养殖污染 W157 3698 3619 7.9462 0.0133 0.973 W159 3733 3606 7.4672 0.0249 0.975 W161 3763 3632 7.3288 0.0339 0.978 W164 4997 4849 8.2801 0.0135 0.973 -
[1] 刘维淦, 林琪, 张科, 等. 太湖流域长荡湖近百年生态环境演变过程[J]. 湖泊科学, 2022, 34(2): 675-683. [2] 赵苇航, 朱彧, 朱亮, 等. 长荡湖水环境变化趋势及其主要影响因子[J]. 水资源保护, 2014, 30(6): 48-53. [3] 王菲菲, 李小平, 陈小华, 等. 长荡湖近15年营养状态评价及限制因子研究[J]. 环境科学与技术, 2012, 35(S1): 353-357. [4] 胡晓燕, 朱元荣, 孙福红, 等. 河流氮磷和水量输入对太湖富营养化的影响机理研究[J]. 环境科学研究, 2022, 35(6): 1407-1418. [5] 高可伟, 朱元荣, 孙福红, 等. 我国典型湖泊及其入湖河流氮磷水质协同控制探讨[J]. 湖泊科学, 2021, 33(5): 1400-1414. doi: 10.18307/2021.0509 [6] 黄明雨. 环洱海主要入湖河流水质特征及入湖污染负荷估算[J]. 人民长江, 2022, 53(1): 61-66. [7] 谢培, 高峰, 王书航, 等. 入湖河流对千岛湖水质影响研究—以CODMn为例[J]. 环境工程技术学报, 2019, 9(6): 692-700. doi: 10.12153/j.issn.1674-991X.2019.04.300 [8] 胡佳欣, 陈瑜, 袁伟皓. 太湖入湖河口表层沉积物细菌群落结构和功能演变规律研究[J]. 环境科学学报, 2023, 43(10): 371-381. [9] YIN Y R, W H, JIANG Z H, et al. Degradation of triclosan in the water environment by microorganisms: A review[J]. Microorganisms, 2022, 10(9): 1713. doi: 10.3390/microorganisms10091713 [10] YE L, SHAO M F, ZHANG T, et al. Analysis of the bacterial community in a laboratory-scale nitrification reactor and a wastewater treatment plant by 454-pyrosequencing[J]. Water Research, 2011, 45: 4390-4398. doi: 10.1016/j.watres.2011.05.028 [11] LI S, XIAO X, YIN X, et al. Bacterial community along a historic lake sediment core of Ardley Island, west Antarctica[J]. Extremophiles, 2006, 10: 461-467. doi: 10.1007/s00792-006-0523-2 [12] LEE D H ZO Y G, KIM S J. Nonradioactive method to study genetic profiles of natural bacterial communities by PCR-single-strand-conformation polymorphism[J]. Applied and Environmental Microbiology, 1996, 62: 3112-3120. doi: 10.1128/aem.62.9.3112-3120.1996 [13] NILSSON R H, RYBERG M, ABARENKOV K, et al. The ITS region as a target for characterization of fungal communities using emerging sequencing technologies[J]. Fems Microbiology Letters, 2009, 296: 97-101. doi: 10.1111/j.1574-6968.2009.01618.x [14] KIM S J, PARK S J, CHA I T, et al. Metabolic versatility of toluene-degrading, iron-reducing bacteria in tidal flat sediment, characterized by stable isotope probing-based metagenomic analysis[J]. Environmental Microbiology, 2014, 16: 189-204. doi: 10.1111/1462-2920.12277 [15] 张烨. 南太湖流域典型入湖河流水质与微生物菌群时空分布研究[D]. 浙江大学, 2020. [16] 刘峰, 冯民权, 王毅博. 汾河入黄口夏季微生物群落结构分析[J]. 微生物学通报, 2019, 46(1): 54-64. [17] SHANG Y Q, WU X Y, WANG X B, et al. Factors affecting seasonal variation of microbial community structure in Hulun Lake, China[J]. Science of the Total Environment, 2022, 805: 150294. doi: 10.1016/j.scitotenv.2021.150294 [18] 王礼权, 刘钰, 张毅敏, 等. 长荡湖、滆湖、竺山湾藻类功能群结构组成与环境因子的关系[J]. 水资源保护, 2023, 39(2): 224-232. doi: 10.3880/j.issn.1004-6933.2023.02.027 [19] 巫丹, 凌虹, 娄明月, 等. 长荡湖沉积物重金属污染特征及生态风险评价[J]. 环境污染与防治, 2023, 45(3): 370-375+399. [20] 郭刘超, 韩庚宝, 邓俊辰, 等. 长荡湖浮游动物群落结构特征及影响因子分析[J]. 江苏水利, 2019(2): 1-5+10. [21] 蔡永久, 刘劲松, 戴小琳, 等. 长荡湖大型底栖动物群落结构及水质生物学评价[J]. 生态学杂志, 2014, 33(5): 1224-1232. [22] 刘荣坤, 徐锦前, 张颖, 等. 洪泽湖湖滨带丰水期水质空间分异特征及其影响因素[J]. 长江流域资源与环境, 2023, 32(1): 151-161. [23] EMBONG D B, ALISA W, PATCHARAPORN K, et al. Spatial and seasonal variability of reef bacterial communities in the upper gulf of Thailand[J]. Frontiers in Marine Science, 2018, 5: 441. doi: 10.3389/fmars.2018.00441 [24] 高志伟, 刘凡惠, 贾美清, 等. 基于Illumina高通量测序的天津北大港湿地沉积物细菌群落特征和多样性分析[J]. 天津师范大学学报(自然科学版), 2021, 41(4): 45-52. [25] 程豹, 望雪, 徐雅倩, 等. 澜沧江流域浮游细菌群落结构特征及驱动因子分析[J]. 环境科学, 2018, 39(8): 3649-3659. [26] 王春香, 刘常敬, 郑林雪, 等. 厌氧氨氧化耦合脱氮系统中反硝化微生物研究[J]. 中国给水排水, 2015, 31(13): 19-22. [27] 赵志瑞, 马斌, 张树军, 等. 高氨氮废水与城市生活污水短程硝化系统菌群比较[J]. 环境科学, 2013, 34(4): 1448-1456. [28] 李明, 马飞, 陈晓娟, 等. 不同土地利用方式对宁夏盐渍化土壤细菌群落的影响[J]. 西北植物学报, 2021, 41(12): 2153-2162. [29] 杨阳, 章妮, 蒋莉莉, 等. 青海湖高寒草地土壤理化性质及微生物群落特征对模拟降水的响应[J]. 草地学报, 2021, 29(5): 1043-1052. [30] 王松鸽, 赖子尼, 麦永湛, 等. 珠江河网冬季浮游细菌群落结构及其影响因素[J]. 中国水产科学, 2019, 26(3): 522-533. [31] 刘芹, 彭党聪. 城市污水生物脱氮系统中DNRA的检测与分析[J]. 中国给水排水, 2019, 35(19): 1-6. [32] ELIU J W, EFU B B, EYANG H M, et al. Phylogenetic shifts of bacterioplankton community composition along Pearl Estuary: the potential impact of hypoxia and nutrients[J]. Frontiers in Microbiology, 2015, 6: 64. [33] V M L, ROBERT L, RICKARD D, et al. Consequences of increased terrestrial dissolved organic matter and temperature on bacterioplankton community composition during a Baltic Sea mesocosm experiment[J]. Ambio, 2015, 44 Suppl 3(3S). [34] XING W, LI J, LI P, et al. Effects of residual organics in municipal wastewater on hydrogenotrophic denitrifying microbial communities[J]. Journal of Environmental Sciences, 2018, 65(3): 262-270. [35] ZHANG L, ZHAO F, LI X, et al. Contribution of influent rivers affected by different types of pollution to the changes of benthic microbial community structure in a large lake[J]. Ecotoxicology and Environmental Safety, 2020, 198(C): 110657. [36] 张燕伟, 程方, 李奕辉, 等. 低碳氮比下MABR同步硝化反硝化过程的构建[J]. 工业水处理, 2020, 40(5): 70-76. doi: 10.11894/iwt.2019-0411 [37] 姚源, 竺建荣, 唐敏, 等. 好氧颗粒污泥技术处理乡镇污水应用[J]. 环境科学研究, 2018, 31(2): 379-388. [38] J A H, M M G. An investigation into the effects of increasing salinity on photosynthesis in freshwater unicellular cyanobacteria during the late Archaean[J]. Geobiology, 2019, 17(4): 343-359. doi: 10.1111/gbi.12339 [39] 李亚莉, 杨正健, 许尤, 等. 清江上游利川段浮游细菌群落结构特征及其影响因素[J]. 生态学杂志, 2020, 39(11): 3756-3765. [40] 邹沈娟, 尹立强, 赵博礼, 等. 梁子湖与后官湖浮游细菌的群落结构特征[J]. 水生态学杂志, 2021, 42(2): 33-41. [41] 刘泽岸, 孙琳. 浐灞河生态区冬夏季节微生物群落结构特征研究[J]. 环境污染与防治, 2022, 44(9): 1202-1208. [42] SONG Y H, MAO G N, GAO G H, et al. Structural and functional changes of groundwater bacterial community during temperature and pH disturbances[J]. Microbial ecology, 2019, 78(2): 428-445. doi: 10.1007/s00248-019-01333-7 [43] 张雅洁, 李珂, 朱浩然, 等. 北海湖微生物群落结构随季节变化特征[J]. 环境科学, 2017, 38(8): 3319-3329. [44] 薛银刚, 刘菲, 孙萌, 等. 太湖竺山湾春季浮游细菌群落结构及影响因素[J]. 环境科学, 2018, 39(3): 1151-1158. [45] 李先会, 朱建坤, 施练东, 等. 富营养化水体细菌去除氮磷能力研究[J]. 环境科学与技术, 2009, 32(4): 28-32. doi: 10.3969/j.issn.1003-6504.2009.04.007 [46] KASALICKY V, JEZBERA J, HAHN W M, et al. The diversity of the Limnohabitans genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains[J]. PLoS ONE, 2017, 8(3): e58209. [47] SHERIDAN A J, BICKFORD D. Shrinking body size as an ecological response to climate change[J]. Nature Climate Change, 2011, 1(8): 401-406. doi: 10.1038/nclimate1259 [48] 韩秋影, 张泽玉, 刘红霞, 等. 温度胁迫对日本鳗草(Zostera japonica)叶际可培养细菌的影响[J]. 生态学杂志, 2017, 36(9): 2564-2571. -




 DownLoad:
DownLoad: