-
高氯酸根与人体特异性膜蛋白 (Na+/I-Symporter, NIS) 的结合度高,其电荷和离子半径与碘离子的非常相近,与碘离子竞争转运蛋白使甲状腺对碘的吸收减少,会导致甲状腺激素T3和T4的合成量下降,从而影响甲状腺正常的功能、代谢和发育,严重时诱发甲状腺癌[1-6]。若婴幼儿体内高氯酸盐过量,造成碘缺乏,就会出现学习障碍、不可逆的智商发育迟缓、多动症、注意力分散、弱智等症状,严重时可直接促使人体脑瘫或死亡。整体上,缺碘儿童的IQ比正常儿童约低10个点[7-9]。另有研究发现乳腺、肾脏等组织器官中也能检测到高氯酸盐, 因此认为其在人体组织中存在迁移和累积,甚至可通过脐带传递给下一代[10]。二十世纪八十年代,美国公共健康服务组织对加州、犹他州和亚里桑那州的健康普查数据表明,在高氯酸根排放集中的地区,婴儿先天性甲状腺机能不足的患病率高于全国平均水平2~3倍[11]。
高氯酸盐因其溶解性和扩散性广泛的分布于饮用水和食品中,因其稳定性可在生物体内持续存在。自1977年,美国加利福尼亚州饮用水中检测到较高浓度的高氯酸盐,此后陆续在该国其他州也发现饮用水高氯酸盐浓度偏高的现象。目前,已经有多个国家和组织规定了饮用水中高氯酸盐的限值。2005年,加拿大将水中高氯酸盐质量浓度限定为 6 μg·L−1,2020年11月又将其更新为4 μg·L−1 [12];韩国环境保护部门亦将高氯酸盐列入水污染物名单,并规定其限值为 15 μg·L−1 [13];日本供水公司在2015年提出水源地地下水中高氯酸盐质量浓度限值,为5 μg·L−1 [14];世界卫生组织 (World Health Organization,WHO) 于2017年制定了饮用水中高氯酸盐质量浓度限值为70 μg·L−1 [15];2009年1月,美国环保署 (Environmental Protection Agency,EPA) 饮用水中高氯酸盐的推荐参考剂量为15 μg·L−1 [16];2019年6月,EPA在《联邦公报》 (Federal Register) 中提出,建议饮用水中高氯酸盐限值最高为56 μg·L−1,但不作为参考剂量。
我国是高氯酸盐生产和排放较多的国家,且部分地区饮用水高氯酸盐污染严重,但仍缺乏全国性研究,《生活饮用水卫生标准》 (GB5749-2006) 及各历史标准中均未将其列入水质标准中并给出限值。为了更全面、充分地了解高氯酸盐对人类健康的现实威胁,应对饮用水中高氯酸盐质量浓度进行持续动态监测。本研究基于我国多个流域的水环境高氯酸盐浓度和人体对碘吸收的抑制效应评估我国人群高氯酸盐暴露风险,同时推算饮用水水质安全基准值,以期为我国饮用水高氯酸盐标准制定提供支撑。
-
本研究的实测数据主要来自于2009年11月—2017年12月对北京、上海、成都等全国47个城市396个水厂出厂水质进行的2次大规模水质调查,方法检测限为0.01 μg·L−1。
-
人群高氯酸盐暴露途径有3种:经口摄入、呼吸和皮肤接触。其中,主要暴露途径为经口摄入暴露,占总暴露的98.80%,其中饮用水途径占32.02%[17]。该值为全国不同地区饮用水途径暴露贡献率分布的期望值,具有全国代表性,用于国家标准制定的参考。而不同省份饮用水途径的暴露贡献率差别较大 (5.60%~87.70%) ,这将会在地方标准中体现。结合中国人群暴露手册成人卷、儿童卷的详细参数,不同年龄人群体重、饮用水摄入量、各膳食高氯酸盐浓度及膳食摄入量[18-19],参照公式 (1) ,即可求出单位体重下高氯酸盐的慢性每日摄入量(chronic daily intake, CDI)。
式中:Cdrw为饮用水中高氯酸盐质量浓度μg·L−1;C为食品中高氯酸盐质量浓度μg·L−1[19];IH为每天饮用水摄入量[18];IR为每天各类膳食摄入量kg·d−1[20] 。
-
采用国际通用的综合考虑人群的暴露分布和个体敏感性的概率方法,通过个体敏感性对数正态分布代替以往不确定系数。表1为文献汇总的高氯酸盐对人体无可见有害作用水平值 (levels of no observed adverse effect,NOAEL) 。
本研究采用R统计计算软件“fitdist”函数对我国饮用水高氯酸盐质量浓度和人体无可见有害作用水平2个数据集进行拟合,发现饮用水高氯酸盐质量浓度的自然对数和NOAEL值所对应的浓度值的自然对数呈现正态分布,通过公式 (2) 得到正态分布的均值和标准差。
式中:高氯酸盐质量浓度的自然对数分布为μ1=0.85,σ1=1.33;而NOAEL转换后的自然对数值分布为μ2=5.66,σ2=1.58。
根据公式 (3) 计算人群暴露超过NOAEL值的风险概率,式中F为标准正态分布 (0,1) 的累积概率密度函数。风险值即人群暴露超过NOAEL的概率。
-
非致癌物质的毒性效应有阈值,即不超过阈值污染物不会产生危害;非致癌物质依据参考剂量,并设定人体体重、人体日均饮水量等,再根据污染物的饮水贡献率进行推导。其公式如见式 (4) 。
式中:WQC (water quality criteria) 表示饮用水水质安全基准值 (μg·L−1) 。为了制定基准值,必需应用某些参数设定,此处RSC (relative source contribution) 代表饮用水途径贡献率为32.02%[17];成年人每日饮用水消费量 (daily intake,DI) 和体重 (body weight,BW) 的默认设定值参考WHO标准分别为2 L和60 kg。
最大可接受日摄入量计算参考式 (5) 。
式中:RfD为参考剂量,μg·(kg·d)−1,指包括特殊敏感人群 (如儿童、孕妇、老年人)推荐的最大剂量或每日摄入量;NOAEL为无可见有害作用水平,LOAEL (levels of lowest observed adverse effect) 为最低可见有害作用水平,单位均是 μg·(kg·d)−1,UF是种内不确定因子,用来保护比测试种群更敏感的种群[26];MF为修正子,表示没有明确包括在不确定因子中的其他不确定性。修正因子的取值0<MF≤10,默认值为1 (无量纲)。
-
地下水中的高氯酸盐主要源自大气沉积物的冲刷与渗透作用。高氯酸盐水溶性高,易在水环境中流动,而不易在固体介质上吸附,经降雨、土壤沉积、灌溉、食物链、生物累积富集在动植物体中,最终传递给人类[27]。高氯酸盐对人产生毒性最主要的暴露途径是通过摄入含有高氯酸盐的水和食物,而皮肤吸收和呼吸吸入可以忽略不计,饮用水途径摄入的高氯酸盐占总膳食摄入的32.02%[17]。在地下水、饮用水,以及肉制品、谷物、果蔬、饮料、茶叶等食品中均普遍存在不同程度高氯酸盐污染,且菠菜、生菜等叶片蔬菜中高氯酸盐浓度很高,可能是喷洒灌溉叶片与空气和水的接触面积大有关。固态的高氯酸盐以粉尘颗粒的形式通过呼吸系统、皮肤接触进入人和动物体内,约占人群高氯酸盐总暴露量的1.20%[17]。
-
2008年,我国启动国家水体污染治理重大专项 (“十一五”“十二五”) ,并于近10年来针对高氯酸盐进行连续监测,包括全国47个城市水质普查及重点流域的水质调查。在2009—2017年检测的610个数据中,512个样品中高氯酸盐有检出,检出率为84%。高氯酸盐检出范围为0.05~152 μg·L−1,均值为 (6.59±15.99) μg·L−1,这说明我国饮用水存在高氯酸盐污染。以湖南、四川和江西为代表的长江流域地区,饮用水高氯酸盐平均质量浓度为16.68 μg·L−1,最高可达152 μg·L−1,长江流域地区28%水样高氯酸盐质量浓度超过EPA于2009年设定的暂定限值 (15 μg·L−1) [28]。这与采样时上游存在高氯酸盐污染源和烟花爆竹生产基地有关。其他地区饮用水高氯酸盐质量浓度均低于EPA推荐值,且存在明显的季节性变化,枯水期浓度高于丰水期浓度。
-
美国最早开展环境中的高氯酸盐的研究。美国环境保护署 (EPA) 在1998年根据对高氯酸盐的初步风险评估提出高氯酸盐的参考剂量为0. 10~0.50 μg·(kg·d)−1,并于2005年提出包括婴幼儿及孕妇等敏感人群在内,高氯酸盐摄入的参考剂量为0.70 μg·(kg·d)−1 [26]。2002年,GREER等[24]建议健康人群高氯酸盐摄入的参考剂量为7 μg·(kg·d)−1。通过对我国12个省份共14个主要城市 (福州、厦门、银川、哈尔滨、沈阳、南宁、西安、郑州、石家庄、武汉、大连、南昌、上海、成都) 的数据计算得到,我国人群高氯酸盐总暴露量约为0.42 μg·(kg·d)−1。暴露途径主要为经口暴露,均值为0.41 μg·(kg·d)−1,其中,饮用水暴露量约为0.15 μg·(kg·d)−1,食品途径暴露量约为0.36 μg·(kg·d)−1。对比EPA敏感人群参考剂量,中国人群高氯酸盐暴露量处于安全范围的中等偏高水平。其中,成都成人饮用水暴露量约为1.75 μg·(kg·d)−1,儿童饮用水暴露量约为2.32 μg·(kg·d)−1,均明显高于敏感人群总暴露量的安全值0.70 μg·(kg·d)−1,处于较高暴露风险中。
-
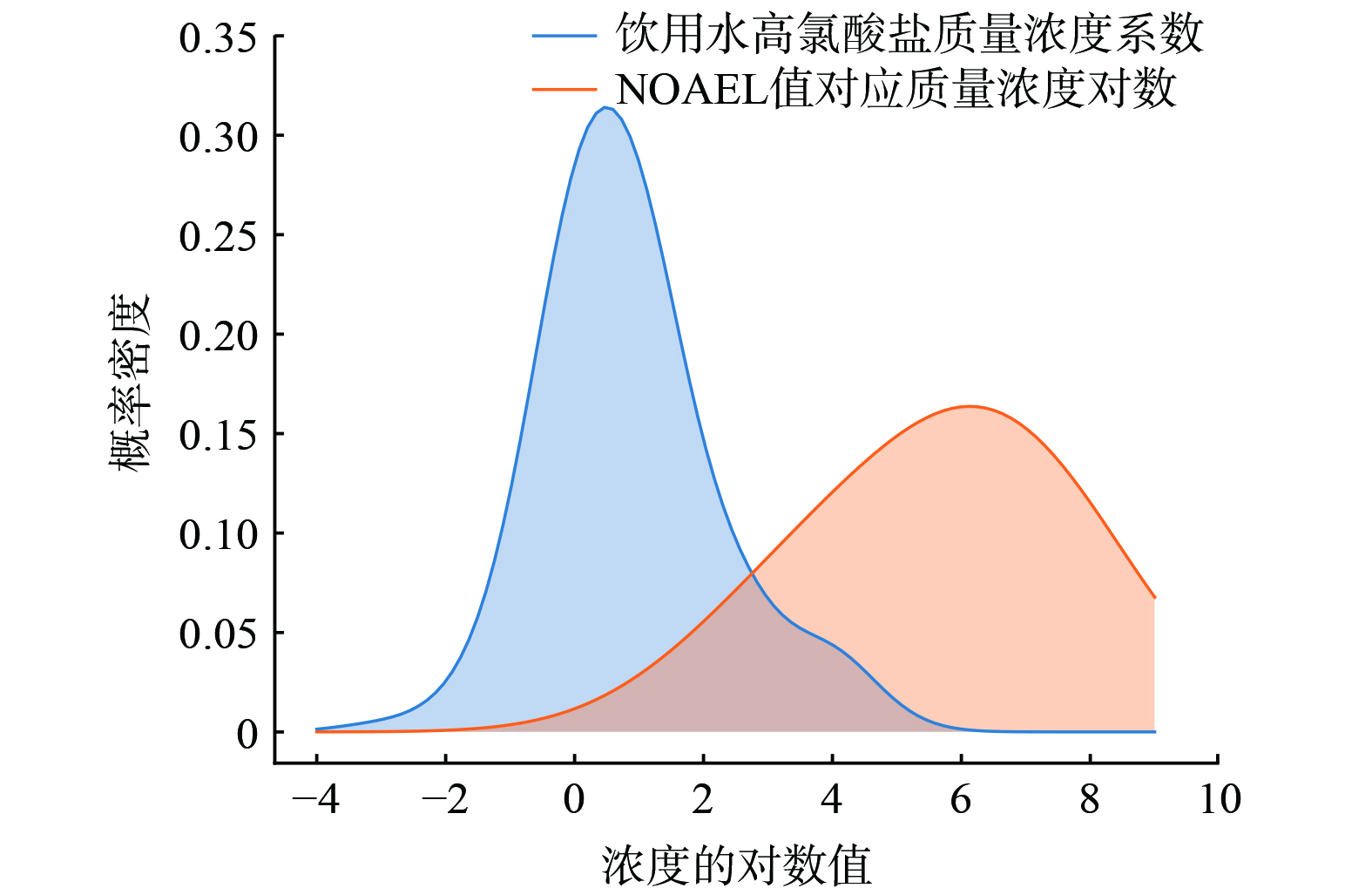
通过公式 (4) 和公式 (5) ,将表1汇总的高氯酸盐NOAEL值转化为对应的饮用水质量浓度值,将此浓度值的自然对数值与396个水厂610个出水样品高氯酸盐质量浓度经均值处理后的自然对数值做联合概率分布,结果如图1所示。2个曲线之间有明显重叠,最终计算得到高氯酸根引起水厂超过无可见有害作用水平值的发生概率是2.18×10−4。这些较高风险水厂主要集中在湖南、四川和上海等地。
-
表1中高氯酸盐对人体碘吸收抑制的毒理实验结果显示最低NOAEL值为7 μg·(kg·d)−1 [24],该值显示有98.2%的碘吸收,因为该实验受试群体主要为妇女等敏感人群,故将种内不确定因子取为1,得到参考剂量 (RfD) 为7 μg·(kg·d)−1。为验证该参考剂量,采用美国EPA基准剂量软件“Benchmark”中的“Hill”模型针对高氯酸盐对碘的抑制作用进行模拟验证,结果如图2所示。以低于5%的人群受影响度确定基准剂量下限,由此得到的基准剂量下限(baseline dose lower limit,BMDL)为4 μg·(kg·d)−1,这个数字与GREER等[24]确定的RfD的数量级相同且数值相差不大。
鉴于中国饮用水中高氯酸盐检出范围广,不同地区浓度差异较大,人群中存在由饮用水高氯酸盐摄入导致碘缺乏疾病发生的可能性。同时,为了安全和考虑人群中最敏感的部分 (孕妇、婴儿或已有甲状腺功能障碍人群) ,通过公式 (4) 计算得我国高氯酸盐水质安全基准值为70 μg·L−1。在该安全基准值下,此次调查数据显示全国水厂出水高氯酸盐质量浓度超过70 μg·L−1的概率为0.8×10−2,且超标水厂均位于湖南省,其他地区水厂高氯酸盐质量浓度均低于70 μg·L−1。通过上述健康风险评估和计量-反应分析确定高氯酸盐的饮用水安全基准值,同时考虑检测方法和处理技术等因素,推荐饮用水高氯酸盐的卫生标准为70 μg·L−1.
-
尽管上述推荐的饮用水高氯酸盐安全基准值与2017年世界卫生组织 (WHO) 饮用水指南中高氯酸盐质量浓度的限值相同,均为70 μg·L−1,但二者参考剂量 (RfD) 和饮用水贡献率的取值不同。WHO以抑制50%碘摄取的BMDL50为基础,不确定因子数为10,计算暂定最大日摄入量 (provisional maximum daily intake,PMTDI) 作为参考剂量 (RfD) ,为10 μg·(kg·d)−1 ,而本研究以无可见有害作用水平 (NOAEL) 推出参考剂量 (RfD) 为7 μg·(kg·d)−1。在贡献率方面,WHO标准中饮用水高氯酸盐贡献率为20%,而我国调查数据为32.02%[17]。与美国2009年推荐的饮用水高氯酸盐标准值15 μg·L−1相比较,本研究采用的不确定因子数、人均体重及饮用水贡献率均不同,美国的不确定因子数取值为10,人均体重为70 kg,饮用水贡献率为62%[29],而中国和WHO的人均体重取值为60 kg。参数对比如表2所示。
-
本研究的不确定性主要来自参数的简化和分布模型的拟合优化。为估计参数,对实际问题进行了简化,如假设相同年龄人群膳食摄入量、体重都相等。在参考剂量 (RfD) 计算中将种内不确定因子UF的取值为1,而实际的不确定因子值因不同环境下人群差异而不同,从动物实验外推到人存在不确定性 (10倍) ,同种内之间差别 (10倍) ,个体之间的差距等,最终外推到人大约存在0~3 000倍不确定性。为计算超标风险,对饮用水高氯酸盐质量浓度和人体无可见有害作用水平 (NOAEL) 的分布进行了模拟,以简化计算的复杂性。
-
1) 高氯酸盐作为一种典型的可从源头控制的持久性污染物,暴露在全球多个国家和地区中,对生态环境和人体健康造成不利影响。2009—2017年中国高氯酸盐暴露风险最高城市为成都,超过EPA推荐的敏感人群暴露参考剂量0.70 μg·(kg·d)−1。2) 根据分布模拟和计算,得到我国自来水厂出水高氯酸盐质量浓度超过无可见有害作用水平的发生概率是2.18×10−4,风险较高。3) 根据计算推荐我国高氯酸盐水质安全基准值为70 μg·L−1,在该基准值下,除湖南省部分水厂出水高氯酸盐质量浓度超标外,其他地区质量浓度均低于该值。
《生活饮用水卫生标准》 (GB 5749-2022) 中高氯酸盐指标及限值的制定思路
The formulation of perchlorate limits in GB 5749-2022 “Drinking Water Sanitation Standard”
-
摘要: 高氯酸盐干扰人体甲状腺对碘的吸收,扰乱甲状腺激素水平,导致甲状腺体积增大、增生、功能减退等健康问题,引起国内外专家的关注。美国、加拿大等国已开始对饮用水高氯酸盐浓度进行限定。我国是高氯酸盐生产和消耗大国,水源地普遍检出且局部存在高浓度污染,然而却缺乏饮用水高氯酸盐暴露的人群风险评估和相应的安全基准值。基于“十一五”和“十二五”期间全国重点城市饮用水水质监测数据,评估了我国水环境中高氯酸盐的污染状况和暴露风险,发现我国水厂出水高氯酸盐浓度超过安全阈值的发生概率为2.18×10−4。根据敏感人群无有害可见作用水平,结合我国人群饮用水途径高氯酸盐暴露的贡献率,计算并推荐我国饮用水高氯酸盐安全基准浓度为70 μg·L−1,该研究结果为我国饮用水高氯酸盐标准制定提供支撑。Abstract: Perchlorate interferes with the absorption of iodine by the human thyroid, disrupts the level of thyroid hormone, and leads to health problems such as thyroid hypertrophy、hyperplasia and hypothyroidism, which has attracted the attention of experts at home and abroad. The United States, Canada and other countries had begun to limit the concentration of perchlorate in drinking water. China produces and consumes a lot of perchlorate, and high concentrations of pollution are commonly detected in water sources. However, there is a lack of risk assessment and corresponding safety benchmark for people exposed to perchlorate in drinking water. Based on during the period of "11th five-year plan" and the "12th five-year plan " national key urban drinking water quality monitoring data, evaluated the perchlorate pollution condition of water environment and the risk of exposure. The results show that the occurrence probability of perchlorate concentration exceeding the safety threshold is 2.18×10−4. According to the level of no harmful visible effects in sensitive population, combined with the contribution rate of perchlorate exposure in drinking water route of Chinese population, the safe baseline concentration of perchlorate in drinking water is calculated and recommended to be 70 μg·L−1, The results of this study provide support for the formulation of perchlorate standards for drinking water in China.
-
Key words:
- perchlorate /
- drinking water safety /
- exposure risk /
- water quality benchmark
-
以行政村计,2017年我国农村生活污水治理率仅为22%;以自然村计,2019年我国有250万个自然村、6.7亿农村人口,但污水治理率不足10%[1]。为提高我国农村生活污水的治理率,2018年9月,住建部和生态环境部联合发布了《关于加快制定地方农村生活污水处理排放标准的通知》。江苏省制定的《农村生活污水处理设施水污染物排放标准》(DB 32/3462-2020)已于2020年11月13日开始施行,该标准适用于日处理能力<500 m3的农村生活污水处理设施的水污染物排放。随着各地农村生活污水排放标准的相继颁布,农村生活污水处理技术与模式的选择应结合当地实际情况,因地制宜地进行选择。
在许多发展中国家的农村地区,由于缺乏污水收集系统,导致未经处理的分散污水直接排入水环境系统,污染了生态环境并且对农村地区的居民健康构成威胁[2-4]。传统的集中式污水处理系统通常是在远离污水产生源头的地方进行处理,需要铺设污水收集管网。但由于农村的聚落分散,聚落内部密度低,造成采用集中式污水处理系统需要负担的管道铺设成本较高。分散式污水处理系统是在污水产生源头或附近收集和处理污水,可以大大减少污水处理系统的建设成本和泵送成本[5]。因此,对于人口密度低的农村地区,分散式污水处理系统更为可取[6]。目前应用于农村地区的分散式污水处理方法包括化粪池、生物膜法、人工湿地、氧化塘和土地处理等[7]。其中微生物附着生长的生物膜法,具有占地面积小,操作灵活,处理效果好的优势而被认为适合应用于分散式污水处理[8]。一方面是因为微生物在载体上的附着生长可以降低功能菌群的流失,适用于小型污水处理设施[9];另一方面是由于生物膜中含有的丰富胞外聚合物(extracellular polymeric substances, EPS)可以保护微生物免受进水水质波动和极端条件的影响而失活,具有一定的抗冲击负荷能力[10]。
对于分散式生活污水的处理,紧凑的处理流程是推荐选用的方案[11]。一体化处理设施由于其污水处理工艺流程短、占地面积小,可以实现对污水的就地就近处理而具有其独特的优势[12]。目前应用于分散式污水处理的一体化反应器主要有膜生物反应器(membrane bio-reactor, MBR)和移动床生物膜反应器(moving bed biofilm reactor, MBBR)。其中MBR以膜组件替代传统工艺中的二沉池,可以实现对微生物的有效截留,但膜组件的费用较高并且容易产生膜污染问题。MBBR则兼具传统流化床和生物接触氧化法的优点,具有较强的抗冲击负荷能力[13]。本研究基于单户或相邻连户的模式,设计了侧向回流一体化生物膜反应器,以期为农村分散式生活污水的处理提供新的思路。与传统活性污泥法需要二沉池和再循环系统不同,侧向回流一体化生物膜反应器将污染物去除、污泥沉淀和出水回流集成在一个反应器内,可以大大简化污水处理流程和节约占地面积。侧向回流通道的设置可以稀释进水,提高反应器的抗冲击负荷能力和强化对污染物的去除效果。反应器内填充的是改性聚氨酯海绵悬浮填料,在气流和水流的作用下呈流化状态,有利于基质渗入填料内部,可增强传质作用,提高微生物代谢能力。此外,反应器内部的水流剪切力可以有效控制填料区的生物膜厚度,稳定反应器的污染物去除能力。
为了评估侧向回流一体化生物膜反应器的运行性能,本研究通过调节水力停留时间和气水比,根据反应器在不同运行条件下对COD、氨氮、总氮和总磷的去除效果,综合考虑反应器的建设成本、运行成本和处理水量优化其运行条件,力求在满足处理要求的同时尽可能节约能耗。
1. 材料与方法
1.1 实验用水水质
实验设计以农村单户或相邻农户排放的黑水经化粪池厌氧处理后与灰水混合作为反应器的进水。采用人工配水的方法,以葡萄糖作为碳源,氯化铵作为氮源,磷酸二氢钾作为磷源,添加一定的碳酸氢钠补充硝化反应所消耗的碱度以维持正常的反应速率,同时添加适量的微量元素维持微生物的正常新陈代谢[14]。反应器进水相关水质参数如表1所示。
表 1 进水水质Table 1. Influent water qualitymg·L-1 统计值 COD NH+4 TN TP 范围 220~280 35~40 40~45 2.7~3.5 均值 250 37 42 2.9 1.2 实验装置
采用自主设计的侧向回流一体化生物膜反应器,结构如图1所示。与其他一体化生物膜反应器相比,本研究设计的侧向回流通道强化了反应器内部的水流混合效果;采用悬浮填料,填料在反应器填料填充区内可以自由移动,有利于填料上生物膜的生长与传质;反应器上部分为气升区和出水沉淀区两部分,气升区提供了气体排出的通道,防止气体对出水产生紊动影响,以实现出水沉淀区较好的泥水分离效果;反应器下部为污泥沉淀区,污泥收集斜板的设置避免了上方曝气气流对下方污泥沉淀区产生的搅动作用。
反应器采用亚克力材质,有效容积为6.5 L。填料区装填品名为AQ-30的改性聚氨酯海绵填料,填料的空孔率为95%,气孔数为0.8个·mm−1,气孔径为1.5 mm,比表面积为91 000 m2·m−3,真比重为1.1 g·cm−3。设计待处理污水从反应器底部进入,在气流的推动下污水向上流动经过填料区[15],污水中的污染物被填料上生长的生物膜吸附转化降解,从而污水得到净化[16-17]。由于侧向回流通道的存在,填料区出水一部分回流至反应器底端,与进水充分混合。设计的侧向回流通道能够起到稀释进水,提高一体化反应器的抗冲击负荷能力的作用。填料区上部设置的挡板起到泥水分离的作用,并且使出水不易受气流紊动。反应器下部设置的泥斗收集填料上脱落下沉的生物膜,通过排泥管定期排放。
1.3 实验方法
侧向回流一体化生物膜反应器在连续进出水和连续曝气的条件下运行,采用快速排泥法进行挂膜。挂膜成功后,为探究反应器在不同运行参数下对分散式生活污水中污染物的去除效果,在填料填充率为35% 的条件下,依次调节反应器运行的水力停留时间和气水比,监测反应器对COD、氨氮、总氮和总磷处理效果,以优化反应器的运行条件。
1.4 水质检测指标及方法
采用哈希快速消解法测定COD(哈希消解器DRB200,哈希可见光分光光度计DR3900);采用纳氏试剂分光光度法测定氨氮含量(HJ535-2009);采用碱性过硫酸钾消解紫外分光光度法测定总氮含量(HJ636-2012);采用钼酸铵分光光度法测定总磷含量(GB11893-89);使用便携式YSI-100pH 测定仪测定pH含量;使用YSI550A溶解氧测量仪测定DO含量。
2. 结果与讨论
2.1 水力停留时间对侧向回流一体化生物膜反应器处理效果的影响
水力停留时间对侧向回流一体化生物膜反应器的处理效果有着重要的影响。水力停留时间过短时,污水中的污染物还未完全去除就已被排出,导致对污染物的去除效果差;水力停留时间过长,在相同的日处理能力下,反应器的体积增大,会增加反应器的建设成本[18]。因此,选择适宜的水力停留时间对反应器的处理效果和节约成本是至关重要的。本实验在反应器填充率为35%,气水比为7.5的条件下,考察了反应器在不同水力停留时间下对各污染物的去除效果,以确定最优的水力停留时间。
1)水力停留时间对COD去除效果的影响。由图2可以看出,侧向回流一体化生物膜反应器对COD在不同水力停留时间下的平均去除率随水力停留时间的延长而升高,COD平均去除率由91.36%升至98.78%,出水COD平均值逐渐下降,由21.33 mg·L−1降低至3 mg·L−1。水力停留时间的延长,一方面缓解了水流对生物膜的冲击和洗刷效应,使附着在填料上的生物膜能够稳定生长;另一方面使微生物与污水中污染物的反应时长增加。两方面均可提升反应器对COD的处理效果。侧向回流一体化生物膜反应器在不同的水力停留时间下对COD均有较好的去除效果,这说明反应器在不同的水力停留时间下填料上的生物膜均能生长稳定,水流的剪切作用能将生物膜厚度控制在合适的范围内。反应器出水COD平均值均小于60 mg·L−1,能够满足江苏省农村生活污水排放的地方标准《农村生活污水处理设施水污染物排放标准》(DB32/ 3462-2020)中的一级A水质标准的要求。
2)水力停留时间对氨氮去除效果的影响。由图3可以看出,侧向回流一体化生物膜反应器对氨氮的平均去除率随水力停留时间的延长先升高后略微下降。当水力停留时间为4 h时,反应器对氨氮的平均去除率仅为64.55%。这表明水力停留时间过短不利于世代时间长的硝化菌生长繁殖[19],从而引起出水氨氮平均质量浓度较高。当水力停留时间在6 h以上时,氨氮的平均去除率稳定在98% 以上;此时再延长水力停留时间,氨氮的平均去除率略微下降。这表明反应器对氨氮的去除效果并不是随着水力停留时间的延长而增强。NOGUEIRA R等[20]通过研究在2种不同水力停留时间下运行的同一种生物膜反应器内的微生物种群动态和反应器运行性能发现:在水力停留时间较短时,反应器可以同时实现较好的硝化效果和有机碳的去除;而延长水力停留时间则不能够同时改善生物膜反应器的硝化效果和有机碳的去除,在水力停留时间较长时,异养菌的过度繁殖会在硝化生物膜顶部会形成较厚的异养微生物层,限制了硝化菌的氧气供应,从而引起硝化效率的下降。侧向回流一体化生物膜反应器在水力停留时间为6~8 h内对氨氮的去除效果最好,出水氨氮平均质量浓度低于1 mg·L−1,能够满足江苏省农村生活污水排放的地方标准《农村生活污水处理设施水污染物排放标准》(DB32/3462-2020)中的一级A水质标准的要求。
3)水力停留时间对总氮去除效果的影响。由图4可以看出,随着水力停留时间的延长,侧向回流一体化生物膜反应器对总氮的平均去除率先升高后降低,总氮平均去除率为33.02%~58.87%。当水力停留时间为8 h时,反应器对总氮的平均去除率达到最大值58.87%,此时出水总氮平均质量浓度为16.53 mg·L−1。当反应器的水力停留时间分别为4、6、8、10和12 h时,反应器内的溶解氧平均质量浓度分别为3.93、4.07、4.18、4.21和4.54 mg·L−1。在一定范围内延长水力停留时间,反应器内溶解氧质量浓度的提升有利于促进硝化,同时又不削弱因填料内部存在的缺氧微环境而发生的反硝化,因此,能够提高反应器对总氮的去除效果。然而,当水力停留时间过长时,会使反应器内能够进行反硝化过程的缺氧区域缩小,从而降低反应器对总氮的去除效果。王鸿远[21]采用 MBR处理农村生活污水,研究了不同混合液回流比(40%、80%、120%、160%和200%)对MBR处理农村生活污水效果的影响,当混合液回流比为200%时,总氮的去除率最高为44.37%。而本文设计的侧向回流一体化生物膜反应器在不额外设置混合液回流系统的条件下,依靠侧向回流通道实现出水的部分回流,在较好去除总氮的同时也能够节约能耗和占地面积。
4)水力停留时间对总磷去除效果的影响。由图5可以看出,随着水力停留时间的延长,侧向回流一体化生物膜反应器对总磷的平均去除率先升高后降低。水力停留时间为6 h时,反应器对总磷的平均去除率达到最大值36.53%,此时总磷的平均出水质量浓度为1.78 mg·L−1。唐舒雯[22]运用陶瓷膜生物反应器处理农村分散式生活污水,在常规运行下,陶瓷膜生物反应器对TP的平均去除率为12.32%。本研究中的侧向回流一体化生物膜反应器内微生物生长的载体为改性聚氨酯海绵填料,具有很大的比表面积和孔隙率,能够同时实现多种微生物的富集生长和对污染物的拦截,故反应器对总磷的去除效果优于常规生物膜反应器。综上所述,为了较好地兼顾污水处理效果与污水处理量,侧向回流一体化生物膜反应器运行的水力停留时间选择6.5 h较为适合。
2.2 气水比对侧向回流一体化生物膜反应器处理效果的影响
气水比影响着侧向回流一体化生物膜反应器内部的溶解氧质量浓度。在不同的气水比下,反应器内部的溶解氧质量浓度也不同,从而影响反应器内部的微生物种群丰度。气水比的增加可以提高反应器内部的溶解氧质量浓度,促进硝化细菌的生长繁殖,进而促进硝化作用。但反应器内部的氧传递效率并不能随着气水比的增大而一直升高,当气水比过大时,气流对填料的冲刷作用也会更加强烈,容易引起生物膜的脱落。并且,反应器的气水比越大,相应的运行成本也就越高。因此,探究反应器运行时较合适的气水比对提高反应器的处理效能和降低能耗都是十分有意义的。本实验在反应器填充率为35%,水力停留时间为6.5 h的条件下,考察了反应器在不同气水比下对各污染物的去除效果,以确定反应器运行时最优的气水比。
1)气水比对COD去除效果的影响。由图6可以看出,随着气水比的增大,侧向回流一体化生物膜反应器对COD的平均去除率逐渐升高,升高趋势逐渐趋于平缓。当气水比为2.5时,COD的平均去除率最低,为85.66%;当气水比为15.0时,COD的平均去除率最高,为98.19%。当气水比较低时,增大气水比,反应器内部溶解氧质量浓度增加,促进异养好氧菌的生长繁殖,COD的去除率升高较快。但由于氧传质速率和污染物在生物膜内外的传质都是有一定限度的,且当气水比较大时,生物膜容易受到曝气的冲刷作用而脱落,所以COD的去除率在气水比较高时升高幅度越来越小。侧向回流一体化生物膜反应器在不同气水比下对COD的去除效果较好。在气水比为2.5、5.0、7.5、10.0、12.5和15.0的条件下,出水COD平均值分别为33.91、25.85、16.01、11.57、6.28和4.62 mg·L−1,均能够满足江苏省农村生活污水排放的地方标准《农村生活污水处理设施水污染物排放标准》(DB32/ 3462-2020)中的一级A水质标准的要求。潘伟亮等[23]利用MBBR探究其对农村污水的处理效果,结果表明,当水力停留时间为8 h,气水比为3:1,硝化液回流比为150% 时,MBBR对COD的平均去除率为75.40%。侧向回流一体化生物膜反应器表现出的对COD较优去除效果归因于侧向回流通道的部分出水回流提高了反应器内的水力混合效果,微生物与污水中的污染物接触充分。
2)气水比对氨氮去除效果的影响。由图7可以看出,侧向回流一体化生物膜反应器对氨氮的平均去除率随着气水比的增大而升高。当气水比由2.5升高至10.0时,氨氮平均去除率由54.12% 升高到97.34%,升高幅度较大;当气水比由10.0升高至15.0时,氨氮平均去除率仅由97.34%升至98.21%,升高幅度较小。在气水比较低时,异养菌在与硝化菌对溶解氧的竞争中占优势地位,硝化菌所能利用的溶解氧量很少,反应器对氨氮去除效果不理想。此时增大气水比能够营造较好的好氧环境,促进硝化过程的进行,故氨氮的出水平均质量浓度迅速下降。当反应器内部的溶解氧质量浓度增加到一定程度时,再增大气水比,反应器内部的溶解氧质量浓度增加幅度并不大,氨氮的出水平均质量浓度趋于稳定。当气水比为7.5时,氨氮的平均出水质量浓度为 5.50 mg·L−1(<8 mg·L−1),能够满足江苏省农村生活污水排放的地方标准《农村生活污水处理设施水污染物排放标准》(DB32/ 3462-2020)中的一级A水质标准的要求。温凯茵[24]采用一体化膨胀生物滤池处理农村生活污水,稳定运行期间对氨氮的平均去除率为94.20%。侧向回流一体化生物膜反应器对氨氮的去除效果与温凯茵报道的结果相当。
3)气水比对总氮去除效果的影响。由图8可以看出,随着气水比的增大,侧向回流一体化生物膜反应器对总氮的平均去除率逐渐上升,总氮平均去除率为39.26%~68.12%。当反应器的气水比分别为2.5、5.0、7.5、10.0、12.5和15.0时,反应器内的溶解氧平均质量浓度分别为3.81、3.89、4.14、4.19、4.24和4.38 mg·L−1,反应器内溶解氧质量浓度随着气水比的增大而逐渐增加。当气水比较低时,反应器内部溶解氧质量浓度较低,硝化作用较弱,出水中的氨氮质量浓度增加,则经过侧向回流通道流经填料区底部中的硝态氮质量浓度减少,也就使填料内部形成的缺氧微环境反硝化可以利用的硝态氮质量浓度下降,从而使总氮的去除率下降[25]。当气水比较高时,一方面填料区好氧部分的生物膜外侧溶解氧质量浓度充足,不仅能够满足生长在生物膜外侧的异养菌去除COD的需求,也能够满足硝化菌进行硝化作用对溶解氧的需求,此时硝化作用进行的彻底,使经过侧向回流通道流至填料区底部进而流至缺氧区的硝态氮质量浓度增加,反硝化速率上升,总氮的去除率上升[26];另一方面,较高的气水比会导致异养菌的增殖加快,加快利用污水中的氮物质合成细胞组成成分,因而会进一步降低出水总氮质量浓度。当气水比为7.5时,总氮的平均出水质量浓度为 18.31 mg·L−1(<20 mg·L−1),能够满足江苏省农村生活污水排放的地方标准《农村生活污水处理设施水污染物排放标准》(DB32/ 3462-2020(中的一级A水质标准的要求。
4)气水比对总磷去除效果的影响。由图9可以看出,侧向回流一体化生物膜反应器对总磷的去除效果较为一般。随着气水比的增大,侧向回流一体化生物膜反应器对总磷的平均去除率先较快升高后缓慢下降。当气水比为2.5时,总磷的平均去除率最低,仅为17.16%。当气水比为7.5时,总磷的平均去除率最高为36.15%。污水中磷的去除是依靠聚磷菌在厌氧环境下释放磷和在好氧环境下过量吸收磷,并通过剩余污泥的排放来实现的[27]。反应器内填充的改性聚氨酯海绵填料,粒径为2 mm,填料气孔径为1.5 mm。在填料生物膜外侧固然是好氧环境,但填料内部由于氧分子不易进入导致溶解氧质量浓度较低,呈现缺氧状态甚至厌氧状态。当气水比较低时,反应器内部的溶解氧质量浓度较低,聚磷菌的好氧过量吸磷能力减弱,此时增大气水比,总磷的去除率会升高;并且,此时气水比的增大促进了反应器内异养菌的增殖,异养菌利用进水中的磷合成细胞组成物质,共同引起出水磷质量浓度的下降。但若溶解氧质量浓度过高,则会引起聚磷菌的胞内聚-β-羟基丁酸减少,从而抑制聚磷菌的过量吸磷过程[28]。当气水比大于7.5时,总磷的平均去除率出现缓慢下降的趋势。综合考虑侧向回流一体化生物膜反应器在不同气水比下对各污染物的处理效果和能耗大小,气水比选择7.5较合适,此时既能够实现对污染物的较好去除,又能够节约能耗和降低成本。
3. 结论
1)侧向回流一体化生物膜反应器内填充的改性聚氨酯海绵填料可以在填料区有限范围内移动,强化了传质效果,反应器对COD和氨氮表现出很好的去除效果。在填料填充率为35%,水力停留时间为6.5 h,气水比为7.5的条件下,反应器对COD和氨氮的平均去除率分别为94.04%和98.25%。此时,出水COD平均值为14.42 mg·L−1,出水氨氮平均质量浓度为0.64 mg·L−1。
2)侧向回流一体化生物膜反应器内部设置的侧向回流通道能使部分出水回流至底端,从宏观上改善了整个反应器的水力混合效果,提高了反应器的脱氮能力。改性聚氨酯海绵填料巨大的比表面积和孔隙率改善了填料对磷的拦截作用。在填料填充率为35%,水力停留时间为6.5 h,气水比为7.5的条件下,反应器对总氮和总磷的平均去除率分别为47.89%和35.08%。此时,出水总氮平均质量浓度为21.88 mg·L−1,出水总磷平均质量浓度为1.87 mg·L−1。
3)当侧向回流一体化生物膜反应器的处理规模<5 m3·d−1时,出水水质可以满足江苏省农村生活污水排放的地方标准《农村生活污水处理设施水污染物排放标准》(DB32/ 3462-2020)中的一级A水质标准的要求;当侧向回流一体化生物膜反应器处理规模≥5 m3·d−1时,对于总氮和总磷的去除,需要增加生态处理设施以保障出水水质达标。
-
表 1 高氯酸盐对人体无可见有害作用水平值汇总
Table 1. Summary of values for levels of no observed adverse effect of perchlorate on humans
表 2 本研究与国外饮用水高氯酸盐标准的参数取值对比
Table 2. Comparison of the perchlorate standard parameters of drinking water in this study and foreign countries
研究来源 参考剂量 /(μg·(kg bw·d)−1) 不确定因子数 体重/kg 饮用水贡献率 美国EPA 0.7 10 70 62% 世界卫生组织 (WHO) 10 10 60 20% 本研究 7 1 60 32% -
[1] 郭玉印, 郭晓楠. 32例地方性甲状腺肿地区的甲状腺癌[J]. 临床与实验病理学杂志, 1988(1): 19-20. [2] 关海霞, 滕卫平, 杨世明, 等. 不同碘摄入量地区甲状腺癌的流行病学研究[J]. 中华医学杂志, 2001(8): 13-14. [3] 林昌万, 崔长山, 关维世. 地甲病区地方性甲状腺肿与甲状腺癌关系的探讨[J]. 中国地方病防治杂志, 1987(4): 253-254. [4] 滕卫平. 碘摄入量与甲状腺癌[C]//中国中西医结合学会内分泌专业委员会. 第十二次全国中西医结合内分泌代谢病学术大会暨糖尿病、甲状腺疾病高峰论坛论文资料汇编. 沈阳, 2019: 2. [5] 张恩勇, 宋博, 潘若望, 等. 碘摄入量与甲状腺癌的相关性研究[J]. 中国地方病防治杂志, 2016, 31(6): 615-616. [6] KOLONEL L N, HANKIN J H, Wilkens L R, et al. An epidemiologic study of thyroid cancer in Hawaii[J]. Cancer Causes and Control, 1990, 1(3): 223-34. doi: 10.1007/BF00117474 [7] 薛淑莲, 赵淑芳, 曲成毅, 等. 碘缺乏地区补碘后儿童智力发育及尿碘调查分析[J]. 山西医学院学报, 1996, 37(3): 43-45. [8] 钱明, 王栋, 陈祖培. 碘缺乏致智力损伤36篇文献的Meta分析[J]. 中华预防医学杂志, 2000, 47(2): 12-14. [9] 刘永孝, 张健勤, 亚为太, 等. 缺碘对儿童智力的影响[J]. 河南预防医学杂志, 1995, 23(2): 69-71. [10] 张可佳, 高乃云, 隋铭皓, 等. 饮用水中高氯酸盐污染现状与去除技术的综述[J]. 四川环境, 2008, 29(1): 91-95. [11] 王诤, 付学起. 饮用水中的高氯酸盐[J]. 净水技术, 2001, 19(4): 3-4. [12] CEPA. Drinking water screening value for perchlorate-Technical summary [J/OL]. (2020-11).https://www.canada.ca/en/services/health/publications/healthy-living/drinking-water-screening-value-perchlorate.html. [13] CALDERON R, GODOY F, ESCUDEY M, et al. A review of perchlorate (ClO4−) occurrence in fruits and vegetables[J]. Environmental Monitoring and Assessment, 2017, 189(2): 82. doi: 10.1007/s10661-017-5793-x [14] SONG Z, SHEN J, ZHANG A, et al. Research progress in toxicological effects of perchlorate and its detection methods[J]. Science & Technology of Food Industry, 2018, 39(8): 341-751. [15] COTRUVO J A. 2017 WHO Guidelines for drinking water quality: First addendum to the fourth edition[J]. Journal American Water Works Association, 2017, 109(7): 44-51. doi: 10.5942/jawwa.2017.109.0087 [16] KUCHARZYK K H, CRAWFORD R L, COSENS B, et al. Development of drinking water standards for perchlorate in the United States[J]. J Environ Manage, 2009, 91(2): 303-10. doi: 10.1016/j.jenvman.2009.09.023 [17] 陈文秀, 何纳轮, 史亚利, 等. 我国人群高氯酸盐暴露途径及贡献率分析[J]. 科学通报, 2020, 65(14): 1387-1394. [18] 段雯娟. 中国人群暴露参数[J]. 地球, 2014, 33(6): 80-83. [19] 杨佳佳. 中国居民膳食高氯酸盐和溴酸盐暴露水平研究[D]. 武汉: 武汉工业学院, 2012: 37-14. [20] 赵丽云, 房玥晖, 何宇纳, 等. 1992—2012年中国城乡居民食物消费变化趋势[J]. 卫生研究, 2016, 45(4): 522-6. [21] STRAWSON J, ZHAO Q Y, DOURSON M. Reference dose for perchlorate based on thyroid hormone change in pregnant women as the critical effect[J]. Regulatory Toxicology and Pharmacology, 2004, 39(1): 44-65. doi: 10.1016/j.yrtph.2003.10.003 [22] LAWRENCE J E, LAMM S H, PINO S, et al. The effect of short-term low-dose perchlorate on various aspects of thyroid function[J]. Thyroid, 2000, 10(8): 659-63. doi: 10.1089/10507250050137734 [23] LAWRENCE J, LAMM S, BRAVERMAN L E. Low dose perchlorate (3 mg daily) and thyroid function.[J]. Thyroid:official journal of the American Thyroid Association, 2001, 11(3): 295. doi: 10.1089/105072501750159796 [24] GREER M A, GOODMAN G, PLEUS R C, et al. Health effects assessment for environmental perchlorate contamination: The dose response for inhibition of thyroidal radioiodine uptake in humans[J]. Environmental Health Perspectives, 2002, 110(9): 927-37. doi: 10.1289/ehp.02110927 [25] STRAWSON J, DOURSON M L, ZHAO Q Y . The NAS perchlorate review: Is the RfD acceptable?[J]. Environmental Health Perspectives, 2005, 113(11). [26] Integrated Risk Information System (IRIS). Perchlorate (ClO4) and Perchlorate Salts[J/OL]. (2005). https://cfpub.epa.gov/ncea/iris/iris_documents/documents/supdocs/1007index.html. [27] 牟世芬, 朱岩, 刘克纳. 离子色谱方法及应用[M]. 3版. 北京: 化学工业出版社, 2018.1038. [28] KUCHARZYK K H, CRAWFORD R L, COSENS B, et al. Development of drinking water standards for perchlorate in the United States [J]. Journal of Environmental Management. 2009, 91(2): 303-310. [29] USEPA. Drinking water: Preliminary regulatory determination on perchlorate [J/OL]. (2008-10-10).https://www.federal.register.gov/documents/2008/10/10/E8-24042/drinking-water-preliminary -regulatory-determination-on-perchlorate. -





 DownLoad:
DownLoad: