-
石油烃 (PHC)是目前环境中广泛存在的有机污染物,是多种烃类 (正烷烃、支链烷烃、环烷烃、芳烃)和少量其他有机物的混合物[1-2]。PHC进入土壤后,不仅会破坏土壤结构,影响其通气性,而且石油烃进入食物链后会对人体产生不可逆性的致癌、致畸、致突变的三致作用[2]。因此,如何经济、快速、有效地去除土壤中的石油污染物成为研究的重点[3]。微生物修复技术因成本低、环境友好等优势成为目前处理处置PHC污染土壤的热点方法[4-5]。
PHC微生物修复技术是以PHC作为底物,利用微生物活动过程中发生的一系列生化反应所进行的代谢降解[6-7]。微生物修复技术在降解有害物质过程中不会破坏动植物生长的土壤环境,并且可以有效地去除土壤中的有机污染物[8]。该技术根据反应过程中是否需氧气可分为好氧修复和缺氧修复[9]。由于缺氧条件下 PHC降解速率比好氧条件下的低 (1-2个数量级),目前利用微生物降解PHC的现场和室内研究多集中在好氧条件下[10-11]。在好氧条件下土著微生物利用氧气作为电子受体降解环境中的污染物,能够在较短的时间内达到较高的去除效率 [12]。
然而由于地下储油罐或输油管线的渗泄漏、土壤表层污染物的向下迁移等,存在着大量被PHC污染的深层土壤[12]。土壤中氧气浓度会随土壤深度的增加而降低,即使深层土壤中存在一定量的氧气也会很快被微生物好氧呼吸消耗殆尽。因此PHC污染的深层土壤往往处于缺氧条件[13]。与好氧微生物降解不同,缺氧微生物降解过程中不需要补充氧气/空气,且能够适应复杂的环境条件,并且修复成本相对较低[14]。因此,PHC的缺氧微生物降解具有明显优势。尽管如此,目前PHC缺氧微生物降解规律尚不清楚。本研究以PHC污染的深层土壤为对象,探索不同种类和质量分数的电子受体对土壤中土著微生物丰度、群落结构以及PHC缺氧降解的影响规律。研究结果可为深层PHC污染土壤修复技术的研发提供技术支持。
-
实验所用土壤来自华北地区某加油站地下深度2~5 m处。采集来的土壤样品现场过2 mm 筛并充分混合后装于自封袋中,保存于盛有冰袋的保温箱中快速运回实验室,采用四分法混匀备用。本研究所用土壤样品理化性质:pH为8.41;含水率为2.23%;TOC为1.44%;总铁为2.16%;硝酸根、硫酸根离子质量分数分别为36.60、133.42 mg·kg−1;土壤中黏土61.91%,粉土37.98%,砂土0.11%。实验所用硝酸钠 (NaNO3)、无水硫酸钠 (Na2SO4)均为分析纯;正己烷 (C6H14)、二氯甲烷 (CH2Cl2)均为色谱纯;高纯氮气 (N2,99.999%);石油烃 (C10~C40)标准溶液 (1 mg∙L−1,美国AccuStandard公司)。
本研究土壤中PHC质量分数见表1。由于原土中C31~C40组分质量分数低 (仅占C10~C40的1.6%),在后续实验结果中对此组分不做进一步讨论。本研究主要探讨碳链长度为C1 (C10~C16)、C2 (C17~C23)、C3 (C24~C30)组分的降解规律。本研究原土中石油烃污染物以C2组分为主,其次为C1组分,C3组分占比最少。与原土 (YT)相比,灭菌土 (YTS)中C1组分的损失率最大 (35.36%),其次是C2组分 (33.65%),C3组分损失率最小 (17.33%)。
-
本实验以PHC污染的深层土壤为对象,考察不同质量分数 (500、1 500、5 000 mg·kg−1)的硫酸盐、硝酸盐电子受体或混合电子受体对PHC缺氧降解的影响。将15g PHC污染土壤置于50 mL血清瓶中,依次加入6 mL去离子水、硝酸盐、硫酸盐溶液或硝酸盐硫酸盐混合溶液,保持水土比为0.4∶1,土壤中电子受体质量分数为0、500、1 500、5 000 mg·kg−1。将电子受体处理组记作LS、MS、HS、LN、MN、HN、HNS。其中L、M、N代表电子受体质量分数,分别为500、1 500、5 000 mg·kg−1;S、N、NS代表电子受体种类,分别为硫酸盐、硝酸盐、硫酸盐硝酸盐混合电子受体。另设置未添加电子受体的灭菌处理 (MJ)和未灭菌 (CK)处理作为对照。所有添加电子受体和未添加电子受体的处理组均重复9次 (共计9个血清瓶)。待土壤样品准备完成后,将配有专用铝盖的血清瓶转移到密闭手套箱中完成缺氧处理后密封[14]。操作步骤:在保证手套箱密闭的情况下,启动真空泵将手套箱内部空气抽出,待压力表指针示数稳定在0.1 MPa以下时,关闭真空泵并维持手套箱内真空状态30 min后再向箱体内缓缓充入高纯氮气,待压力表指针示数略高于大气压时,停止充入氮气并维持手套箱内充满氮气状态30 min。重复上述过程3次后,在缺氧手套箱内将血清瓶压上铝盖后转移至30 ℃恒温培养箱中避光培养。本研究中去离子水、电子受体溶液以及土壤样品灭菌处理操作参照文献报道方法进行[15]。在缺氧培养30、90、150 d后进行破坏性取样 (每次随机取出3个血清瓶)并做好时间标记。所有灭菌和未灭菌处理组在30、90、150 d检测土壤中PHC质量分数,未灭菌处理组在30、90、150 d测试微生物指标。
-
土壤中PHC的提取采用超声萃取法[16]。称取2 g干燥土壤样品放入40 mL聚四氟乙烯管中,分别加入正己烷和二氯甲烷各20 mL的混合溶剂进行超声萃取30 min,高速 (5 000 r·min−1)离心10 min,此过程重复3次。将离心所得上清液过滤后通过旋转蒸发仪和氮吹仪浓缩至1 mL,转移至2 ml棕色玻璃瓶。采用气相色谱仪 (GC,Agilent 7890B型)进行PHC的浓度测定,利用外标法峰面积进行定量分析。气相色谱柱型号为HP-5MS (30 m×0.25 mm×0.25 μm)。测定条件:进样口温度300 ℃,不分流进样,进样量1.0 μL;柱箱初始温度为50 ℃,保持2 min,以40 ℃·min−1升至230 ℃,再以20 ℃·min−1升至320 ℃,保持20 min;气体流量为高纯氮气1.5 mL·min−1,氢气30 mL·min−1,空气300 mL·min−1。
-
土壤DNA采用MOBIO Power Soil DNA Isolation Kit试剂盒提取,细菌丰度的测定采用实时定量PCR扩增技术[17]。以16S rDNA作为靶基因对细菌丰度进行检测。细菌引物为338F (5'-ACTCCTACGGGAGGCAGCAG-3')和806R (5'-GGACTACHVGGGTWTCTAAT-3'),片段大小为420。反应条件为:95 ℃预变性3 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,35个循环。完成上述操作后,将待测样品放在荧光定量PCR仪中进行反应,实时定量PCR扩增效率为92.20%。
微生物群落结构分析测试参照FREY等[18]的方法,使用Fastp软件对原始测序序列进行质控,采用Flash软件进行拼接 (最小重叠长度为10 bp,重叠区允许的最大错配比为0.2)。使用UPARSE软件在97%的相似度对序列进行OTU聚类分析。采用RDP classifier分类器对每条序列进行物种分类注释,比对Silva 16S rRNA数据库进行物种注释分析 (比对阈值为80%),统计各样品的细菌群落组成。
-
不同种类和质量分数的电子受体对土壤中细菌丰度的影响随时间变化规律如图1所示。PHC污染原土 (YT)中细菌基因拷贝数lg值为6.28 g−1,经过30、90、150 d缺氧培养后,对照组 (CK)土壤中细菌基因总量分别增加了0.10、0.21、0.30 g−1 (图1)。表明在不加入电子受体进行缺氧培养的情况下,土壤中的细菌丰度随着培养时间的增加有所增长,但增长速度缓慢。添加不同种类和质量分数的电子受体缺氧培养150 d后,土壤中细菌基因总量与对照组 (CK)相比增加了0.38~0.70个数量级,表明缺氧条件下加入电子受体促进了土壤中细菌丰度增长 (图1)。土壤中加入不同种类和质量分数的电子受体缺氧培养30、90、150 d后,土壤中细菌总量与第0 d (YT)相比分别增加了0.12~0.39、0.30~0.49、0.67~1.00个数量级,表明添加电子受体后,土壤中细菌丰度随着培养时间的增加而增长 (p<0.05)。
土壤中加入不同种类和质量分数电子受体缺氧培养150 d后,硫酸盐处理组LS、MS、HS土壤中细菌基因总量与对照组 (CK)相比增加了0.38、0.57、0.58个数量级;硝酸盐处理组LN、MN、HN土壤中细菌基因总量与对照组 (CK)相比增加了0.47、0.57、0.70个量级;混合电子受体组HNS土壤中细菌基因总量与对照组 (CK)相比增加了0.60个数量级 (图1)。总的来看,PHC污染土壤中添加电子受体种类相同时,细菌丰度随电子受体质量分数的增加而增加;添加电子受体质量分数相同时,细菌丰度从高到底排序为硝酸盐处理组>混合电子受体处理组>硫酸盐处理组。
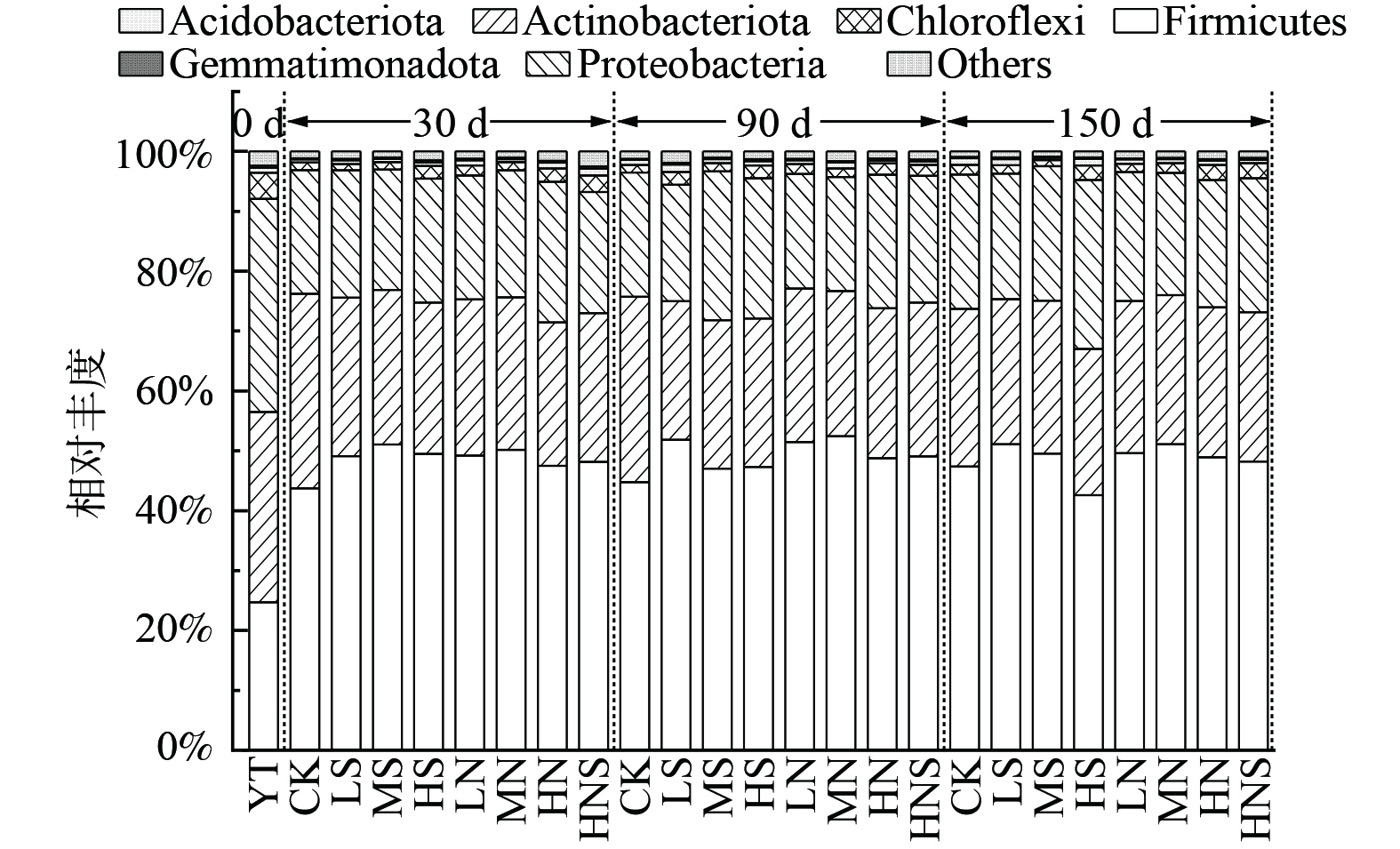
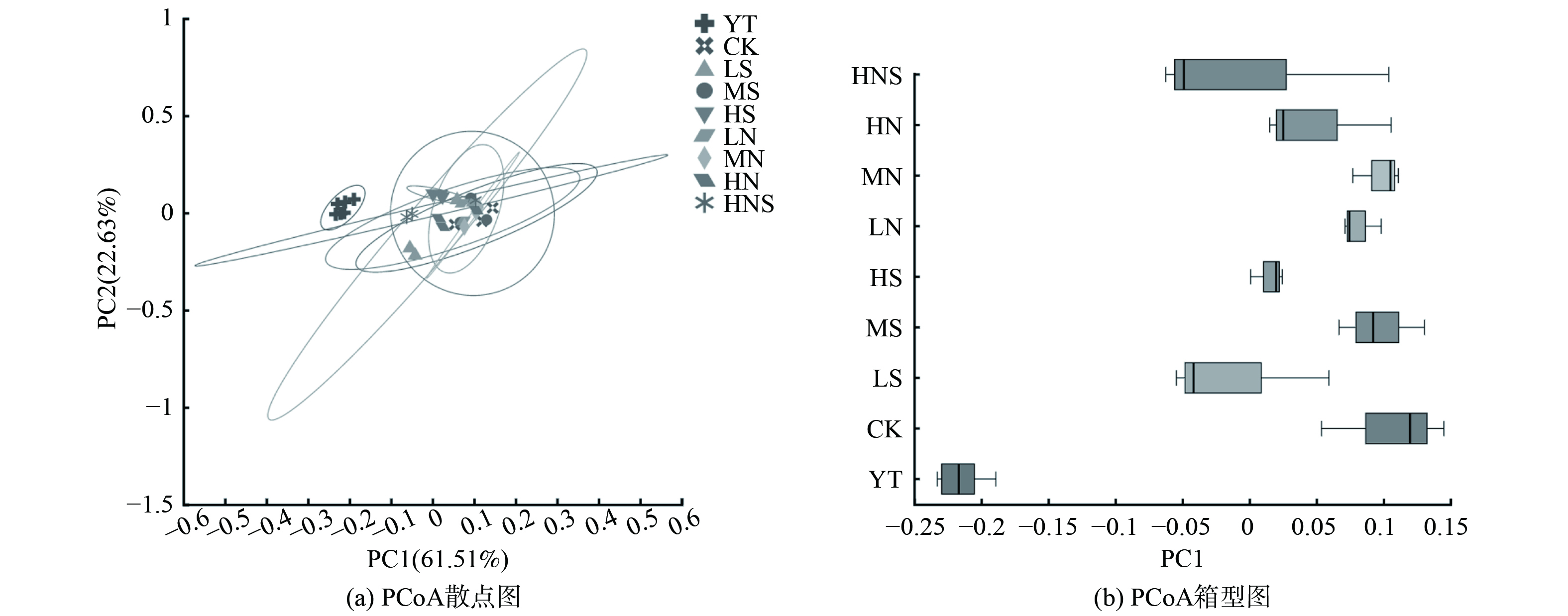
添加不同种类和质量分数电子受体的土壤微生物在门水平上的群落结构及其变化如图2所示。与原土 (YT)中的优势菌种主要为变形菌门 (Proteobacteria, 35.59%)、放线菌门 (Actinobacteria, 31.80%)和厚壁菌门 (Firmicutes, 24.69%)。向PHC污染土壤中加入不同种类和质量分数的电子受体缺氧培养30、90 d和150 d后,与相同培养时间的对照组 (CK)土壤中细菌群落结构相比,经过30、90、150 d缺氧培养的电子受体处理组土壤中放线菌门的相对丰度均有所降低,厚壁菌门的相对丰度均有所增加 (150 d的HS处理组除外),变形菌门相对丰度无明显变化。对土壤中原土 (YT)和经过150 d缺氧培养的对照组 (CK)、电子受体处理组门水平细菌群落结构进行主坐标分析 (Principal Co-ordinates Analysis, PCoA)(图3)。结果表明,原土 (YT)与对照组 (CK)、电子受体处理组之间土壤中细菌群落结构组成在门水平存在明显差异;而对照组 (CK)和电子受体处理组之间土壤中细菌群落结构组成在门水平相似 (图3)。
缺氧条件下PHC降解菌主要属于变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)[19-20]。本研究中,缺氧培养150 d后对照组 (CK)中 Proteobacteria和Firmicute基因拷贝数总量lg值为6.42g−1,与第0 d相比分别增加了0.36个数量级。缺氧培养150 d后硫酸盐处理组 (LS、MS、HS)和硝酸盐处理组 (LN、MN、HN)土壤中Firmicutes和Proteobacteria的总数量lgN较对照组 (CK)分别增加了0.39、0.53、0.58个数量级和0.47、0.58、0.70个数量级;HNS处理土壤中Firmicutes和Proteobacteria的总数量lgN较对照组 (CK)分别增加了0.60个数量级。结果表明,当土壤中加入电子受体种类相同时,土壤中PHC潜在降解菌随着电子受体的质量分数增加而增加;加入的电子受体质量分数相同时,土壤中PHC潜在降解菌丰度从高到低分别为硝酸盐、混合电子受体、硫酸盐。
-
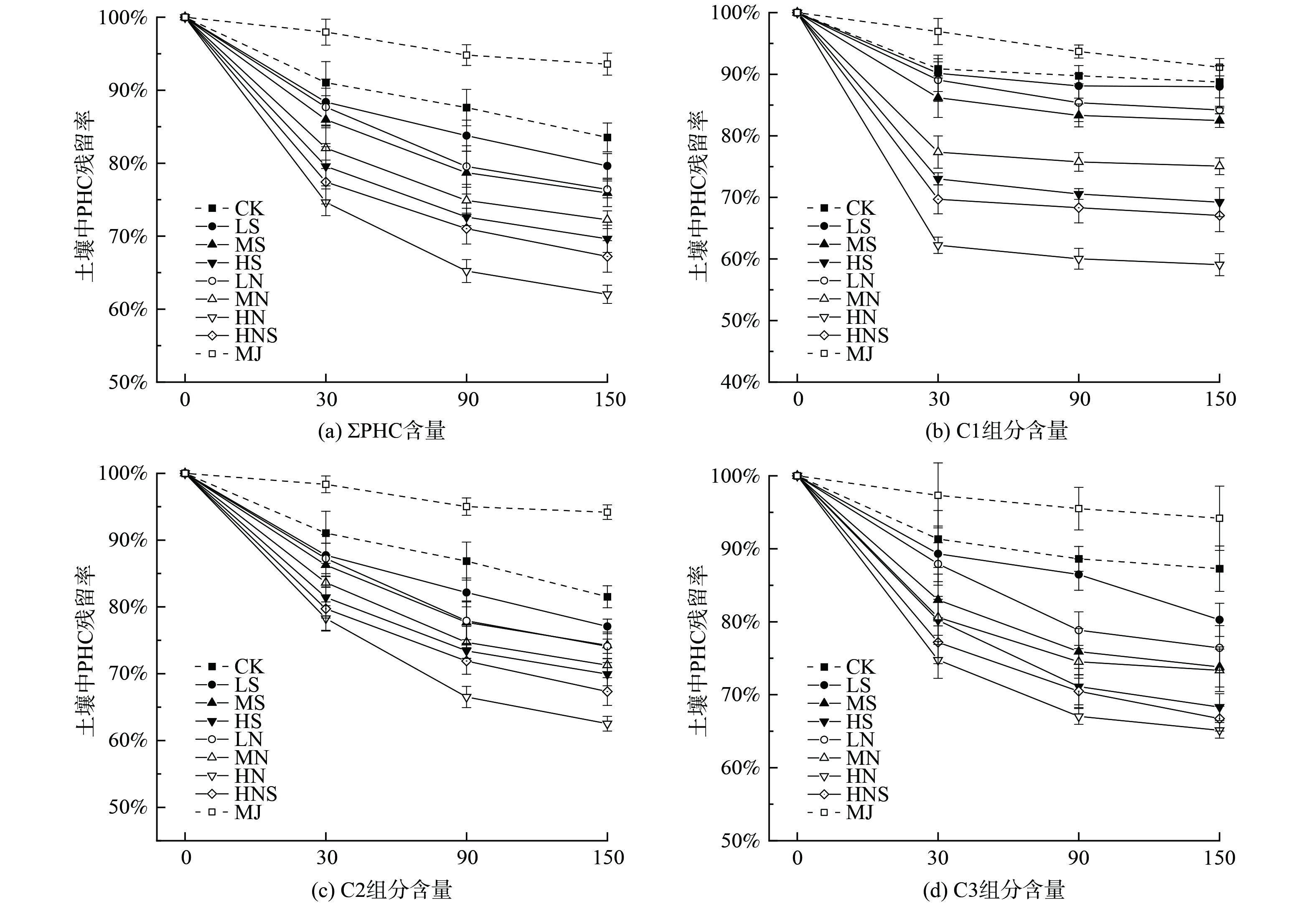
缺氧培养150 d后,灭菌处理 (MJ)和未灭菌处理 (CK)土壤中ΣPHC和C1、C2、C3降解率变化如图4所示。在灭菌处理中,ΣPHC和C1、C2、C3降解率均未超过8.85%,未明显观察到PHC的去除 (p<0.05);而未灭菌处理中,ΣPHC和C1、C2、C3组分有较好的去除效果 (p<0.05)(图4),降解率与原土 (YT)相比增加了11.25%~18.48%,表明PHC在缺氧培养150 d内发生了生物降解。有机污染场地土壤中往往存在着潜在降解菌[20]。本研究原土 (YT)中潜在降解菌 (Proteobacteria和Firmicute)基因拷贝数lg值为6.06 g−1。此外,硝酸盐和硫酸盐可作为缺氧条件下有机污染物微生物降解的电子受体[21]。本研究土壤中硝酸盐、硫酸盐的质量分数分别为36.60 mg·kg−1和133.42 mg·kg−1。由于所用土壤存在潜在降解菌和电子受体,缺氧培养150 d的对照处理组中发生了PHC缺氧降解。
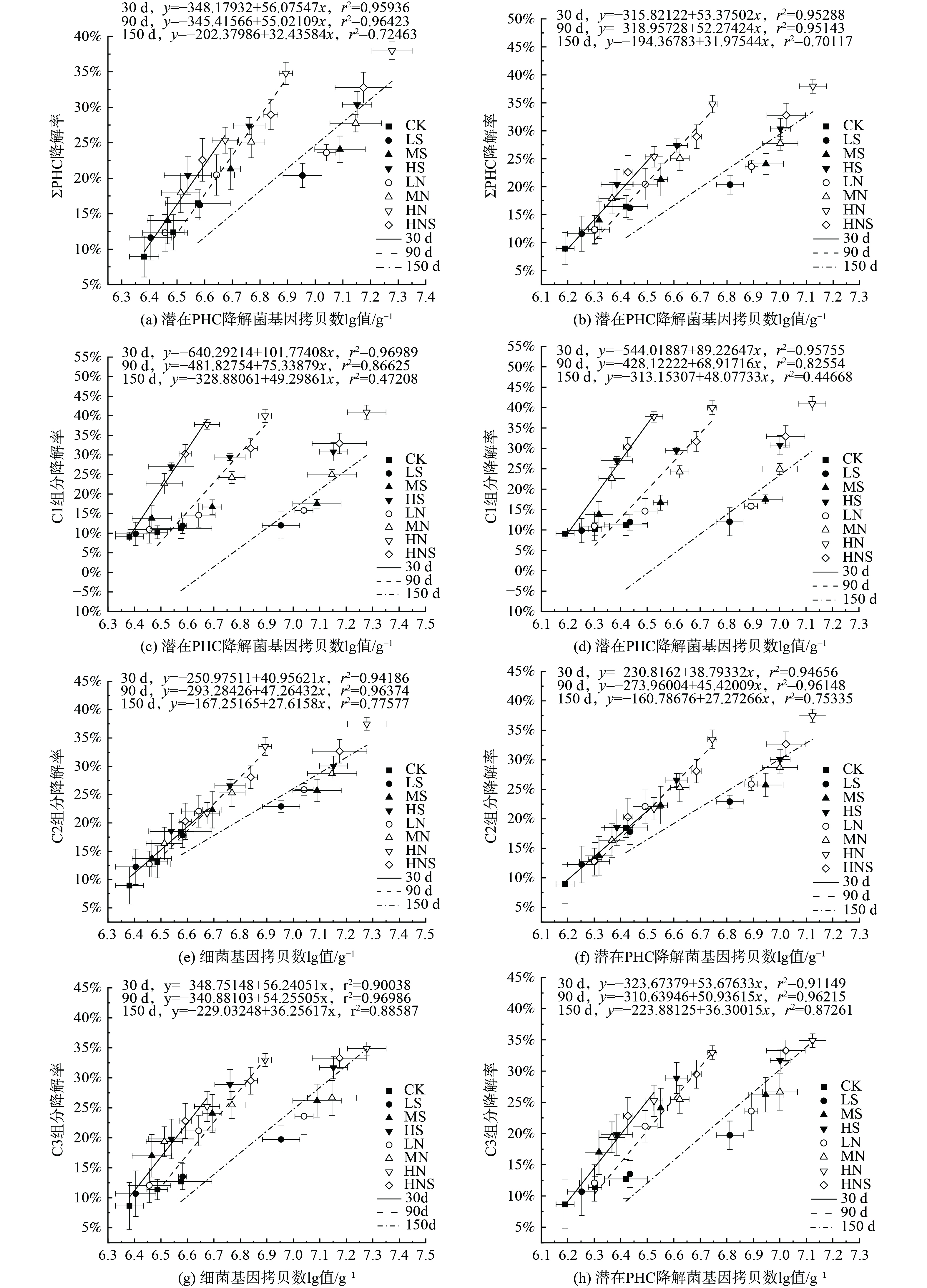
如图4所示,添加不同种类和质量分数的电子受体缺氧培养150 d后,土壤中ΣPHC和C1、C2、C3组分降解率与CK相比分别增加了3.91%~21.50%和0.76%~29.67%、4.44%~19.01%、7.00%~22.14%,明显促进了PHC的缺氧降解 (p<0.05)。从图1和图2中可以看出向PHC污染深层土壤中加入硫酸盐、硝酸盐溶液缺氧培养150 d后,土壤中潜在降解菌总数量lgN与CK相比增加了0.39~0.58、0.47~0.70个数量级,促进了土壤中土著微生物的生长,土壤中PHC潜在降解菌随着电子受体的质量分数增加而增加。进一步探究土壤中PHC降解率与微生物之间的关系,发现ΣPHC和C1、C2、C3组分的降解率均随土壤中细菌丰度和潜在PHC降解菌丰度增加而增加,PHC降解率与土壤中细菌丰度/潜在PHC降解菌丰度存在正相关关系 (图5)。
本研究中,缺氧培养150 d后硫酸盐处理组 (LS、MS、HS)和硝酸盐处理组 (LN、MN、HN)土壤中ΣPHC组分降解率较CK分别增加了3.91%、7.61%、13.89%和7.13%、11.28%、21.50%,使C1-C3组分降解率较CK分别增加了0.76%~7.00% (LS)、6.27%~c13.46% (MS)、11.59%~19.53% (HS)和4.56%~7.41% (LN)、13.68%~13.92% (MN)、19.01%~29.67% (LN)(图4);HNS处理土壤中ΣPHC和C1、C2、C3组分的降解率较CK分别增加了11.59%和21.69%、14.19%、20.55% (图4)。此结果表明,添加相同种类的电子受体促进了土壤中ΣPHC和C1、C2、C3组分的缺氧生物降解,降解率随着电子受体的质量分数增加而增加;添加质量分数相同的不同种类电子受体土壤中ΣPHC和C1、C2、C3组分的降解率由高到低分别为硝酸盐、混合电子受体、硫酸盐。
虽然添加不同种类和质量分数的电子受体明显促进了PHC的降解 (图4),但所有处理中ΣPHC和C1、C2、C3组分在30 d内快速降解;而随着时间的推移 (培养90 d后),各处理组中PHC的降解速率都明显减慢或停止 (图5)。由于有机污染物进入土壤后往往会经历一个较长时间的“老化”过程,往往以“快”、“慢”、“极慢”等解吸组分形式存在[22-25]。污染物的“快”解吸组分易于生物利用,“慢”和“极慢”等解吸组分不易被生物利用,难以进一步去除[26-28]。因此,在培养前期易被生物利用的PHC可能已经被生物降解去除,致使培养的后期阶段 (如培养90 d后)PHC的降解速率均明显减慢或停止。
如图4(b)~图4(d)所示,添加不同种类和质量分数的电子受体缺氧培养150 d后,土壤中C1和C2、C3组分缺氧降解率均在HN处理组最高 (降解率为40.92%和37.48%、34.87%),HS处理组最低 (降解率为30.78%和30.07%、31.70%),HNS处理组介于二者之间 (降解率为32.94%和32.67%、33.28%)。由此可以观察到在所有5 000 mg·kg−1处理中,随着碳数的增加,PHC去除率降低,各组分PHC降解率为C1>C2>C3。这表明土壤中添加不同组分PHC的缺氧降解效果与其碳链长度成反比。C1组分具有高挥发性和较低的分子量,且疏水性弱、易被生物利用[29],其降解率甚至达到30.78%~40.92% (图4)。随着C2、C3组分碳链长度增加,分子量逐渐增大,物质结构更加稳定,其生物有效性也更低,难以被生物利用[30],其降解率为30.07%~37.48%、31.70%~34.87%。此外,土壤中C1组分在培养30 d后残留率迅速降低,随着时间的推移趋于稳定或停止;C2、C3组分在培养30 d后降解速率显著降低但未停止,随着时间的推移 (90 d)后趋于稳定或停止 (图4)。这可能是由于土壤中C1组分生物有效性更高更易被生物利用;而C2、C3组分生物因其有效性低而难以被微生物降解去除,导致其降解速率减慢。
-
1)向PHC污染的深层土壤中加入的电子受体种类相同时,土壤中细菌丰度、潜在PHC降解菌丰度随电子受体的质量分数增加而增加,ΣPHC和C1、C2、C3组分的降解率也随加入电子受体的质量分数增加而增加。
2)向PHC污染深层土壤中加入相同质量分数的不同种类电子受体时,土壤中细菌丰度和PHC潜在降解菌丰度从高到低分别为硝酸盐、混合电子受体、硫酸盐。ΣPHC和C1、C2、C3组分降解率为硝酸盐处理>混合电子受体处理>硫酸盐处理。
3)土壤中ΣPHC和C1、C2、C3组分的降解率随着土壤中细菌丰度、潜在PHC降解菌丰度的增加而增加,PHC的降解率与土壤中细菌丰度/潜在PHC降解菌丰度存在正相关关系。
电子受体对深层土壤中石油烃缺氧降解的影响
Effect of electron acceptor on anoxic biodegradation of petroleum hydrocarbons in subsurface soil
-
摘要: 微生物降解是处理土壤中石油烃 (PHC)污染的有效技术,目前对PHC微生物降解的研究多集中在好氧条件下,对PHC缺氧微生物降解的研究较少,PHC缺氧降解规律尚不清楚。以PHC污染的深层土壤为对象,探究不同质量分数 (500、1 500、5 000 mg·kg−1)的硫酸盐、硝酸盐或混合电子受体对土壤中土著微生物丰度、群落结构以及PHC缺氧降解的影响规律。结果表明,150 d缺氧培养后,添加相同种类电子受体的土壤处理中细菌丰度、潜在PHC降解菌 (变形菌门和厚壁菌门)丰度随电子受体的质量分数增加而增加;添加相同质量分数的不同种类电子受体土壤处理中细菌丰度、潜在PHC降解菌丰度从高到低分别为硝酸盐、混合电子受体、硫酸盐。添加相同种类电子受体的土壤处理中ΣPHC (C10~C30)和C1 (C10~C16)、C2 (C17~C23)、C3 (C24~C30)组分的降解率随着加入电子受体质量分数增加而增加;相同质量分数的不同种类电子受体土壤处理中ΣPHC和C1、C2、C3组分的降解率从高到低分别为硝酸盐、混合电子受体、硫酸盐。土壤中PHC缺氧降解率与细菌丰度、潜在PHC降解菌丰度均存在正相关关系。研究结果可为石油烃污染土壤的修复技术研发提供技术支持。Abstract: Anoxic biodegradation is an attractive approach to the removal of petroleum hydrocarbons (PHC)in soil. At present, the biodegradation of PHC is mostly focused on aerobic conditions. There are fewer studies on anoxic biodegradation of PHC, and the law of anoxic biodegradation of PHC is still unclear. In this study, the effect of electron acceptor (nitrate, sulfate and mixed electron acceptor)at different mass fraction (500, 1 500, 5 000 mg·kg−1)on anoxic biodegradation of PHC in subsurface soil were investigated. Dynamic changes in the soil bacterial abundance and community composition were also examined. The results showed that after 150 d of anoxic incubation, the abundance of bacteria and potential PHC-degrading bacteria (Firmicutes and Proteobacteria)in the soil treated with the same types of electron acceptors increased with the increase of electron acceptor concentration; the abundance of bacteria and potential PHC-degrading bacteria in the soil treated with the same concentration of different types of electron acceptors, in descending order, were nitrate, mixed electron acceptor, and sulfate, respectively. The biodegradation rates of ΣPHC (C10~C30)and C1 (C10~C16), C2 (C17~C23), and C3 (C24~C30)fractions in soil treated with the same types of electron acceptor added increased with the increase in the concentration of electron acceptor added; the biodegradation rates of ΣPHC and C1, C2, and C3 fractions in soil treated with the different types of electron acceptor added at the same mass fraction, in descending order, were nitrate, mixed electron acceptors, and sulfate, respectively. There was a positive correlation between the anoxic biodegradation rate of PHC in soil and the abundance of bacteria and potential PHC-degrading bacteria. The results can provide technical support for the development of remediation technologies for petroleum hydrocarbon contaminated soils.
-
Key words:
- electron acceptor /
- petroleum hydrocarbon /
- anoxic biodegradation /
- microorganism
-
石油烃 (PHC)是目前环境中广泛存在的有机污染物,是多种烃类 (正烷烃、支链烷烃、环烷烃、芳烃)和少量其他有机物的混合物[1-2]。PHC进入土壤后,不仅会破坏土壤结构,影响其通气性,而且石油烃进入食物链后会对人体产生不可逆性的致癌、致畸、致突变的三致作用[2]。因此,如何经济、快速、有效地去除土壤中的石油污染物成为研究的重点[3]。微生物修复技术因成本低、环境友好等优势成为目前处理处置PHC污染土壤的热点方法[4-5]。
PHC微生物修复技术是以PHC作为底物,利用微生物活动过程中发生的一系列生化反应所进行的代谢降解[6-7]。微生物修复技术在降解有害物质过程中不会破坏动植物生长的土壤环境,并且可以有效地去除土壤中的有机污染物[8]。该技术根据反应过程中是否需氧气可分为好氧修复和缺氧修复[9]。由于缺氧条件下 PHC降解速率比好氧条件下的低 (1-2个数量级),目前利用微生物降解PHC的现场和室内研究多集中在好氧条件下[10-11]。在好氧条件下土著微生物利用氧气作为电子受体降解环境中的污染物,能够在较短的时间内达到较高的去除效率 [12]。
然而由于地下储油罐或输油管线的渗泄漏、土壤表层污染物的向下迁移等,存在着大量被PHC污染的深层土壤[12]。土壤中氧气浓度会随土壤深度的增加而降低,即使深层土壤中存在一定量的氧气也会很快被微生物好氧呼吸消耗殆尽。因此PHC污染的深层土壤往往处于缺氧条件[13]。与好氧微生物降解不同,缺氧微生物降解过程中不需要补充氧气/空气,且能够适应复杂的环境条件,并且修复成本相对较低[14]。因此,PHC的缺氧微生物降解具有明显优势。尽管如此,目前PHC缺氧微生物降解规律尚不清楚。本研究以PHC污染的深层土壤为对象,探索不同种类和质量分数的电子受体对土壤中土著微生物丰度、群落结构以及PHC缺氧降解的影响规律。研究结果可为深层PHC污染土壤修复技术的研发提供技术支持。
1. 材料与方法
1.1 实验材料
实验所用土壤来自华北地区某加油站地下深度2~5 m处。采集来的土壤样品现场过2 mm 筛并充分混合后装于自封袋中,保存于盛有冰袋的保温箱中快速运回实验室,采用四分法混匀备用。本研究所用土壤样品理化性质:pH为8.41;含水率为2.23%;TOC为1.44%;总铁为2.16%;硝酸根、硫酸根离子质量分数分别为36.60、133.42 mg·kg−1;土壤中黏土61.91%,粉土37.98%,砂土0.11%。实验所用硝酸钠 (NaNO3)、无水硫酸钠 (Na2SO4)均为分析纯;正己烷 (C6H14)、二氯甲烷 (CH2Cl2)均为色谱纯;高纯氮气 (N2,99.999%);石油烃 (C10~C40)标准溶液 (1 mg∙L−1,美国AccuStandard公司)。
本研究土壤中PHC质量分数见表1。由于原土中C31~C40组分质量分数低 (仅占C10~C40的1.6%),在后续实验结果中对此组分不做进一步讨论。本研究主要探讨碳链长度为C1 (C10~C16)、C2 (C17~C23)、C3 (C24~C30)组分的降解规律。本研究原土中石油烃污染物以C2组分为主,其次为C1组分,C3组分占比最少。与原土 (YT)相比,灭菌土 (YTS)中C1组分的损失率最大 (35.36%),其次是C2组分 (33.65%),C3组分损失率最小 (17.33%)。
表 1 土壤中PHC质量分数Table 1. Mass fraction of PHC in soil组名 碳原子数 原土PHC质量分数/ (mg·kg−1) 各PHC组分占原土中PHC质量分数的比例/% 灭菌土PHC质量分数/ (mg·kg−1) 各PHC组分占灭菌土中PHC质量分数的比例/% C1 C10~C16 184.68±5.21 20.72 119.37±1.52 19.86 C2 C17~C23 626.99±14.69 70.36 416.02±6.55 69.21 C3 C24~C30 79.51±2.53 8.92 65.73±2.84 10.93 C4 C31~C40 14.53±2.08 — 13.25±1.97 — ΣPHC C10~C30 891.18±23.86 — 601.12±13.25 — 1.2 电子受体对深层土壤中PHC缺氧微生物降解影响
本实验以PHC污染的深层土壤为对象,考察不同质量分数 (500、1 500、5 000 mg·kg−1)的硫酸盐、硝酸盐电子受体或混合电子受体对PHC缺氧降解的影响。将15g PHC污染土壤置于50 mL血清瓶中,依次加入6 mL去离子水、硝酸盐、硫酸盐溶液或硝酸盐硫酸盐混合溶液,保持水土比为0.4∶1,土壤中电子受体质量分数为0、500、1 500、5 000 mg·kg−1。将电子受体处理组记作LS、MS、HS、LN、MN、HN、HNS。其中L、M、N代表电子受体质量分数,分别为500、1 500、5 000 mg·kg−1;S、N、NS代表电子受体种类,分别为硫酸盐、硝酸盐、硫酸盐硝酸盐混合电子受体。另设置未添加电子受体的灭菌处理 (MJ)和未灭菌 (CK)处理作为对照。所有添加电子受体和未添加电子受体的处理组均重复9次 (共计9个血清瓶)。待土壤样品准备完成后,将配有专用铝盖的血清瓶转移到密闭手套箱中完成缺氧处理后密封[14]。操作步骤:在保证手套箱密闭的情况下,启动真空泵将手套箱内部空气抽出,待压力表指针示数稳定在0.1 MPa以下时,关闭真空泵并维持手套箱内真空状态30 min后再向箱体内缓缓充入高纯氮气,待压力表指针示数略高于大气压时,停止充入氮气并维持手套箱内充满氮气状态30 min。重复上述过程3次后,在缺氧手套箱内将血清瓶压上铝盖后转移至30 ℃恒温培养箱中避光培养。本研究中去离子水、电子受体溶液以及土壤样品灭菌处理操作参照文献报道方法进行[15]。在缺氧培养30、90、150 d后进行破坏性取样 (每次随机取出3个血清瓶)并做好时间标记。所有灭菌和未灭菌处理组在30、90、150 d检测土壤中PHC质量分数,未灭菌处理组在30、90、150 d测试微生物指标。
1.3 PHC的提取与测定
土壤中PHC的提取采用超声萃取法[16]。称取2 g干燥土壤样品放入40 mL聚四氟乙烯管中,分别加入正己烷和二氯甲烷各20 mL的混合溶剂进行超声萃取30 min,高速 (5 000 r·min−1)离心10 min,此过程重复3次。将离心所得上清液过滤后通过旋转蒸发仪和氮吹仪浓缩至1 mL,转移至2 ml棕色玻璃瓶。采用气相色谱仪 (GC,Agilent 7890B型)进行PHC的浓度测定,利用外标法峰面积进行定量分析。气相色谱柱型号为HP-5MS (30 m×0.25 mm×0.25 μm)。测定条件:进样口温度300 ℃,不分流进样,进样量1.0 μL;柱箱初始温度为50 ℃,保持2 min,以40 ℃·min−1升至230 ℃,再以20 ℃·min−1升至320 ℃,保持20 min;气体流量为高纯氮气1.5 mL·min−1,氢气30 mL·min−1,空气300 mL·min−1。
1.4 微生物指标分析方法
土壤DNA采用MOBIO Power Soil DNA Isolation Kit试剂盒提取,细菌丰度的测定采用实时定量PCR扩增技术[17]。以16S rDNA作为靶基因对细菌丰度进行检测。细菌引物为338F (5'-ACTCCTACGGGAGGCAGCAG-3')和806R (5'-GGACTACHVGGGTWTCTAAT-3'),片段大小为420。反应条件为:95 ℃预变性3 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,35个循环。完成上述操作后,将待测样品放在荧光定量PCR仪中进行反应,实时定量PCR扩增效率为92.20%。
微生物群落结构分析测试参照FREY等[18]的方法,使用Fastp软件对原始测序序列进行质控,采用Flash软件进行拼接 (最小重叠长度为10 bp,重叠区允许的最大错配比为0.2)。使用UPARSE软件在97%的相似度对序列进行OTU聚类分析。采用RDP classifier分类器对每条序列进行物种分类注释,比对Silva 16S rRNA数据库进行物种注释分析 (比对阈值为80%),统计各样品的细菌群落组成。
2. 结果与讨论
2.1 电子受体对土壤中细菌丰度和群落结构的影响
不同种类和质量分数的电子受体对土壤中细菌丰度的影响随时间变化规律如图1所示。PHC污染原土 (YT)中细菌基因拷贝数lg值为6.28 g−1,经过30、90、150 d缺氧培养后,对照组 (CK)土壤中细菌基因总量分别增加了0.10、0.21、0.30 g−1 (图1)。表明在不加入电子受体进行缺氧培养的情况下,土壤中的细菌丰度随着培养时间的增加有所增长,但增长速度缓慢。添加不同种类和质量分数的电子受体缺氧培养150 d后,土壤中细菌基因总量与对照组 (CK)相比增加了0.38~0.70个数量级,表明缺氧条件下加入电子受体促进了土壤中细菌丰度增长 (图1)。土壤中加入不同种类和质量分数的电子受体缺氧培养30、90、150 d后,土壤中细菌总量与第0 d (YT)相比分别增加了0.12~0.39、0.30~0.49、0.67~1.00个数量级,表明添加电子受体后,土壤中细菌丰度随着培养时间的增加而增长 (p<0.05)。
土壤中加入不同种类和质量分数电子受体缺氧培养150 d后,硫酸盐处理组LS、MS、HS土壤中细菌基因总量与对照组 (CK)相比增加了0.38、0.57、0.58个数量级;硝酸盐处理组LN、MN、HN土壤中细菌基因总量与对照组 (CK)相比增加了0.47、0.57、0.70个量级;混合电子受体组HNS土壤中细菌基因总量与对照组 (CK)相比增加了0.60个数量级 (图1)。总的来看,PHC污染土壤中添加电子受体种类相同时,细菌丰度随电子受体质量分数的增加而增加;添加电子受体质量分数相同时,细菌丰度从高到底排序为硝酸盐处理组>混合电子受体处理组>硫酸盐处理组。
添加不同种类和质量分数电子受体的土壤微生物在门水平上的群落结构及其变化如图2所示。与原土 (YT)中的优势菌种主要为变形菌门 (Proteobacteria, 35.59%)、放线菌门 (Actinobacteria, 31.80%)和厚壁菌门 (Firmicutes, 24.69%)。向PHC污染土壤中加入不同种类和质量分数的电子受体缺氧培养30、90 d和150 d后,与相同培养时间的对照组 (CK)土壤中细菌群落结构相比,经过30、90、150 d缺氧培养的电子受体处理组土壤中放线菌门的相对丰度均有所降低,厚壁菌门的相对丰度均有所增加 (150 d的HS处理组除外),变形菌门相对丰度无明显变化。对土壤中原土 (YT)和经过150 d缺氧培养的对照组 (CK)、电子受体处理组门水平细菌群落结构进行主坐标分析 (Principal Co-ordinates Analysis, PCoA)(图3)。结果表明,原土 (YT)与对照组 (CK)、电子受体处理组之间土壤中细菌群落结构组成在门水平存在明显差异;而对照组 (CK)和电子受体处理组之间土壤中细菌群落结构组成在门水平相似 (图3)。
缺氧条件下PHC降解菌主要属于变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)[19-20]。本研究中,缺氧培养150 d后对照组 (CK)中 Proteobacteria和Firmicute基因拷贝数总量lg值为6.42g−1,与第0 d相比分别增加了0.36个数量级。缺氧培养150 d后硫酸盐处理组 (LS、MS、HS)和硝酸盐处理组 (LN、MN、HN)土壤中Firmicutes和Proteobacteria的总数量lgN较对照组 (CK)分别增加了0.39、0.53、0.58个数量级和0.47、0.58、0.70个数量级;HNS处理土壤中Firmicutes和Proteobacteria的总数量lgN较对照组 (CK)分别增加了0.60个数量级。结果表明,当土壤中加入电子受体种类相同时,土壤中PHC潜在降解菌随着电子受体的质量分数增加而增加;加入的电子受体质量分数相同时,土壤中PHC潜在降解菌丰度从高到低分别为硝酸盐、混合电子受体、硫酸盐。
2.2 电子受体对土壤中ΣPHC缺氧降解的影响
缺氧培养150 d后,灭菌处理 (MJ)和未灭菌处理 (CK)土壤中ΣPHC和C1、C2、C3降解率变化如图4所示。在灭菌处理中,ΣPHC和C1、C2、C3降解率均未超过8.85%,未明显观察到PHC的去除 (p<0.05);而未灭菌处理中,ΣPHC和C1、C2、C3组分有较好的去除效果 (p<0.05)(图4),降解率与原土 (YT)相比增加了11.25%~18.48%,表明PHC在缺氧培养150 d内发生了生物降解。有机污染场地土壤中往往存在着潜在降解菌[20]。本研究原土 (YT)中潜在降解菌 (Proteobacteria和Firmicute)基因拷贝数lg值为6.06 g−1。此外,硝酸盐和硫酸盐可作为缺氧条件下有机污染物微生物降解的电子受体[21]。本研究土壤中硝酸盐、硫酸盐的质量分数分别为36.60 mg·kg−1和133.42 mg·kg−1。由于所用土壤存在潜在降解菌和电子受体,缺氧培养150 d的对照处理组中发生了PHC缺氧降解。
如图4所示,添加不同种类和质量分数的电子受体缺氧培养150 d后,土壤中ΣPHC和C1、C2、C3组分降解率与CK相比分别增加了3.91%~21.50%和0.76%~29.67%、4.44%~19.01%、7.00%~22.14%,明显促进了PHC的缺氧降解 (p<0.05)。从图1和图2中可以看出向PHC污染深层土壤中加入硫酸盐、硝酸盐溶液缺氧培养150 d后,土壤中潜在降解菌总数量lgN与CK相比增加了0.39~0.58、0.47~0.70个数量级,促进了土壤中土著微生物的生长,土壤中PHC潜在降解菌随着电子受体的质量分数增加而增加。进一步探究土壤中PHC降解率与微生物之间的关系,发现ΣPHC和C1、C2、C3组分的降解率均随土壤中细菌丰度和潜在PHC降解菌丰度增加而增加,PHC降解率与土壤中细菌丰度/潜在PHC降解菌丰度存在正相关关系 (图5)。
本研究中,缺氧培养150 d后硫酸盐处理组 (LS、MS、HS)和硝酸盐处理组 (LN、MN、HN)土壤中ΣPHC组分降解率较CK分别增加了3.91%、7.61%、13.89%和7.13%、11.28%、21.50%,使C1-C3组分降解率较CK分别增加了0.76%~7.00% (LS)、6.27%~c13.46% (MS)、11.59%~19.53% (HS)和4.56%~7.41% (LN)、13.68%~13.92% (MN)、19.01%~29.67% (LN)(图4);HNS处理土壤中ΣPHC和C1、C2、C3组分的降解率较CK分别增加了11.59%和21.69%、14.19%、20.55% (图4)。此结果表明,添加相同种类的电子受体促进了土壤中ΣPHC和C1、C2、C3组分的缺氧生物降解,降解率随着电子受体的质量分数增加而增加;添加质量分数相同的不同种类电子受体土壤中ΣPHC和C1、C2、C3组分的降解率由高到低分别为硝酸盐、混合电子受体、硫酸盐。
虽然添加不同种类和质量分数的电子受体明显促进了PHC的降解 (图4),但所有处理中ΣPHC和C1、C2、C3组分在30 d内快速降解;而随着时间的推移 (培养90 d后),各处理组中PHC的降解速率都明显减慢或停止 (图5)。由于有机污染物进入土壤后往往会经历一个较长时间的“老化”过程,往往以“快”、“慢”、“极慢”等解吸组分形式存在[22-25]。污染物的“快”解吸组分易于生物利用,“慢”和“极慢”等解吸组分不易被生物利用,难以进一步去除[26-28]。因此,在培养前期易被生物利用的PHC可能已经被生物降解去除,致使培养的后期阶段 (如培养90 d后)PHC的降解速率均明显减慢或停止。
如图4(b)~图4(d)所示,添加不同种类和质量分数的电子受体缺氧培养150 d后,土壤中C1和C2、C3组分缺氧降解率均在HN处理组最高 (降解率为40.92%和37.48%、34.87%),HS处理组最低 (降解率为30.78%和30.07%、31.70%),HNS处理组介于二者之间 (降解率为32.94%和32.67%、33.28%)。由此可以观察到在所有5 000 mg·kg−1处理中,随着碳数的增加,PHC去除率降低,各组分PHC降解率为C1>C2>C3。这表明土壤中添加不同组分PHC的缺氧降解效果与其碳链长度成反比。C1组分具有高挥发性和较低的分子量,且疏水性弱、易被生物利用[29],其降解率甚至达到30.78%~40.92% (图4)。随着C2、C3组分碳链长度增加,分子量逐渐增大,物质结构更加稳定,其生物有效性也更低,难以被生物利用[30],其降解率为30.07%~37.48%、31.70%~34.87%。此外,土壤中C1组分在培养30 d后残留率迅速降低,随着时间的推移趋于稳定或停止;C2、C3组分在培养30 d后降解速率显著降低但未停止,随着时间的推移 (90 d)后趋于稳定或停止 (图4)。这可能是由于土壤中C1组分生物有效性更高更易被生物利用;而C2、C3组分生物因其有效性低而难以被微生物降解去除,导致其降解速率减慢。
3. 结论
1)向PHC污染的深层土壤中加入的电子受体种类相同时,土壤中细菌丰度、潜在PHC降解菌丰度随电子受体的质量分数增加而增加,ΣPHC和C1、C2、C3组分的降解率也随加入电子受体的质量分数增加而增加。
2)向PHC污染深层土壤中加入相同质量分数的不同种类电子受体时,土壤中细菌丰度和PHC潜在降解菌丰度从高到低分别为硝酸盐、混合电子受体、硫酸盐。ΣPHC和C1、C2、C3组分降解率为硝酸盐处理>混合电子受体处理>硫酸盐处理。
3)土壤中ΣPHC和C1、C2、C3组分的降解率随着土壤中细菌丰度、潜在PHC降解菌丰度的增加而增加,PHC的降解率与土壤中细菌丰度/潜在PHC降解菌丰度存在正相关关系。
-
表 1 土壤中PHC质量分数
Table 1. Mass fraction of PHC in soil
组名 碳原子数 原土PHC质量分数/ (mg·kg−1) 各PHC组分占原土中PHC质量分数的比例/% 灭菌土PHC质量分数/ (mg·kg−1) 各PHC组分占灭菌土中PHC质量分数的比例/% C1 C10~C16 184.68±5.21 20.72 119.37±1.52 19.86 C2 C17~C23 626.99±14.69 70.36 416.02±6.55 69.21 C3 C24~C30 79.51±2.53 8.92 65.73±2.84 10.93 C4 C31~C40 14.53±2.08 — 13.25±1.97 — ΣPHC C10~C30 891.18±23.86 — 601.12±13.25 — -
[1] 宋泽贤, 吴宜霖, 张腾飞, 等. 表面活性剂SDBS和Tween 80强化过硫酸盐氧化后土壤中石油烃的缺氧生物降解[J]. 环境工程学报, 2023, 17(3): 900-908. [2] 王泽明, 尹利军, 王长祥, 等. 地下污水厂PHC桩挤土消除液化效应的关键技术[J]. 中国给水排水, 2020, 36(2): 79-84. doi: 10.19853/j.zgjsps.1000-4602.2020.02.015 [3] 柴小康, 黄国和, 解玉磊, 等. 某燃煤超低排放机组非常规污染物脱除[J]. 环境工程学报, 2020, 14(12): 3480-3494. [4] ZHOU Y, QIU S, GUO W, et al. Construction of hierarchical Ti3C2TX@PHbP-PHC architecture with enhanced free-radical quenching capability: Effective reinforcement and fire safety performance in bismaleimide resin[J]. Chemical Engineering Journal, 2022, 427: 131634. doi: 10.1016/j.cej.2021.131634 [5] REDDY MULE A, RAMULU B, SU YU J. Tri-metallic core-shell structures by confining crystalline nanorod and amorphous nanosheet architectures for high-performance hybrid supercapacitors[J]. Chemical Engineering Journal, 2023, 451: 139018. doi: 10.1016/j.cej.2022.139018 [6] KLEINHEINZ G T, BAGLEY S T. A filter-plate method for the recovery and cultivation of microorganisms utilizing volatile organic compounds[J]. Journal of Microbiological Methods, 1997, 29(2): 139-44. doi: 10.1016/S0167-7012(97)00033-X [7] MICLE V, SUR I M, CRISTE A, et al. Lab-scale experimental investigation concerning ex-situ bioremediation of petroleum hydrocarbons-contaminated soils[J]. Soil & Sediment Contamination, 2018, 27(8): 692-705. [8] LIU Y Q, SUN Y J, YU J S, et al. Impacts of groundwater level fluctuation on soil microbial community, alkane degradation efficiency and alkane-degrading gene diversity in the critical zone: Evidence from an accelerated water table fluctuation simulation[J]. Environmental Science and Pollution Research, 2022, 29(55): 83060-83070. doi: 10.1007/s11356-022-21246-2 [9] CAI M M, YAO J, YANG H J, et al. Aerobic biodegradation process of petroleum and pathway of main compounds in water flooding well of Dagang oil field[J]. Bioresource Technology, 2013, 144: 100-106. doi: 10.1016/j.biortech.2013.06.082 [10] LI F Z, ZHANG Y P, WANG S, et al. Insight into ex-situ thermal desorption of soils contaminated with petroleum via carbon number-based fraction approach[J]. Chemical Engineering Journal, 2020, 385: 123946. doi: 10.1016/j.cej.2019.123946 [11] GHATTAS A-K, FISCHER F, WICK A, et al. Anaerobic biodegradation of (emerging)organic contaminants in the aquatic environment[J]. Water Research, 2017, 116: 268-295. doi: 10.1016/j.watres.2017.02.001 [12] 叶茜琼. 微生物修复对石油烃的去除特性及土壤微生态环境变化研究[D]. 西安建筑科技大学, 2018. [13] 姜正平, 宋旭艳, 周展钊, 等. 垃圾焚烧飞灰的石材化固化处理[J]. 环境工程学报, 2016, 10(4): 2046-2050. [14] LI C H, ZHOU H W, WONG Y S, et al. Vertical distribution and anaerobic biodegradation of polycyclic aromatic hydrocarbons in mangrove sediments in Hong Kong, South China[J]. Science of the Total Environment, 2009, 407(21): 5772-5779. doi: 10.1016/j.scitotenv.2009.07.034 [15] ITURBE R, FLORES C, CASTRO A, et al. Sub-soil contamination due to oil spills in six oil-pipeline pumping stations in northern Mexico[J]. Chemosphere, 2007, 68(5): 893-906. doi: 10.1016/j.chemosphere.2007.02.004 [16] HE F, ZHANG Z, WAN Y, et al. Polycyclic aromatic hydrocarbons in soils of Beijing and Tianjin region: Vertical distribution, correlation with TOC and transport mechanism[J]. Journal of Environmental Sciences, 2009, 21(5): 675-685. doi: 10.1016/S1001-0742(08)62323-2 [17] TZOVOLOU D N, BENOIT Y, HAESELER F, et al. Spatial distribution of jet fuel in the vadoze zone of a heterogeneous and fractured soil[J]. Science of the Total Environment, 2009, 407(8): 3044-3054. doi: 10.1016/j.scitotenv.2009.01.020 [18] FREY B, RIME T, PHILLIPS M, et al. Microbial diversity in European alpine permafrost and active layers[J]. FEMS Microbiology Ecology, 2016, 92(3): fiw018. doi: 10.1093/femsec/fiw018 [19] ZHANG Z T, WANG C Y, HE J Z, et al. Anaerobic phenanthrene biodegradation with four kinds of electron acceptors enriched from the same mixed inoculum and exploration of metabolic pathways[J]. Frontiers of Environmental Science & Engineering, 2019, 13(5): 80. [20] SARKAR J, SAHA A, ROY A, et al. Development of nitrate stimulated hydrocarbon degrading microbial consortia from refinery sludge as potent bioaugmenting agent for enhanced bioremediation of petroleum contaminated waste[J]. World Journal of Microbiology & Biotechnology, 2020, 36(10): 156. [21] YANG S C, GOU Y L, SONG Y, et al. Enhanced anoxic biodegradation of polycyclic aromatic hydrocarbons (PAHs)in a highly contaminated aged soil using nitrate and soil microbes[J]. Environmental Earth Sciences, 2018, 77(12): 11. [22] BAJAGAIN R, GAUTAM P, JEONG S W. Biodegradation and post-oxidation of fuel-weathered field soil[J]. Science of the Total Environment, 2020, 734: 7. [23] ZHAO L M, ZHANG C C, LI H S, et al. Regulation of different electron acceptors on petroleum hydrocarbon biotransformation to final products in activated sludge biosystems[J]. Bioprocess and Biosystems Engineering, 2019, 42(4): 643-55. doi: 10.1007/s00449-019-02070-4 [24] GOU Y L, ZHAO Q Y, YANG S C, et al. Enhanced degradation of polycyclic aromatic hydrocarbons in aged subsurface soil using integrated persulfate oxidation and anoxic biodegradation[J]. Chemical Engineering Journal, 2020, 394: 13. [25] HATZINGER P B, ALEXANDER M. Effect of aging of chemicals in soil on their biodegradability and extractability[J]. Environmental Science & Technology, 1995, 29(2): 537-545. [26] BOOPATHY R. Anaerobic degradation of No. 2 diesel fuel in the wetland sediments of Barataria-Terrebonne estuary under various electron acceptor conditions[J]. Bioresource Technology, 2003, 86(2): 171-175. doi: 10.1016/S0960-8524(02)00162-1 [27] 李佳斌. 土壤中石油烃的芬顿氧化实验研究[D]. 轻工业环境保护研究所, 2016. [28] FURTADO R X D, SABATINI C A, SAKAMOTO I K, et al. Biodegradation mechanism of perfluorooctane sulfonic acid (PFOS)in domestic sewage: Specific methanogenic activity, molecular biology, and ecotoxicological aspects[J]. Journal of Water Process Engineering, 2023, 51: 7. [29] DA SILVA M L B, RUIZ-AGUILAR G M L, ALVAREZ P J J. Enhanced anaerobic biodegradation of BTEX-ethanol mixtures in aquifer columns amended with sulfate, chelated ferric iron or nitrate[J]. Biodegradation, 2005, 16(2): 105-114. doi: 10.1007/s10532-004-4897-5 [30] CHAKRABORTY R, COATES J D. Anaerobic degradation of monoaromatic hydrocarbons[J]. Applied Microbiology and Biotechnology, 2004, 64(4): 437-446. doi: 10.1007/s00253-003-1526-x -




 DownLoad:
DownLoad: