-
焦化废水是典型的高碳氮比且成分复杂的工业废水[1]。其中主要有机污染物为苯酚,约占耗氧有机物(以COD计)的50%~60%,吡啶、喹啉等杂环化合物约占15%~20%,其他主要还有苯衍生物、多环芳烃等物质[2]。生物法因其工艺简单、成本低廉、无二次污染,是常用的焦化废水处理方法之一。红球菌属是一类具有强大降解能力的细菌,很多红球菌均具有降解有机化合物的能力,包括石油烃(链烃、芳香烃和环烷烃等)、有机腈和链霉毒素等[3]。关于红球菌及菌株固定化应用于焦化废水生物处理也有大量学者进行研究。朱顺妮等[4]分离出的一株喹啉降解菌Rhodococcus sp.QL2具有降解苯酚、吡啶、喹啉等焦化废水特征污染物的降解能力。马馨月[5]使用竹炭、海藻酸钠、壳聚糖等载体对Rhodococcus sp. PB-1进行固定化,所制得的固定化微球可以显著提高菌株PB-1的稳定性和降解效率,并且具有循环使用特性。虽然固定化技术可以显著提高微生物的降解效率,但在一些极端营养环境下,比如碳氮比例失衡的废水中,微生物因缺乏可利用碳源或氮源,不能发挥最佳降解效果,需要额外的碳氮源或其他营养的投加补充[6]。传统投加方式多以直投为主,这种方法虽然简单但有可能造成资源浪费和二次污染,采用缓释技术可以控制碳氮源的释放速度,使其在系统内保持一定的有效浓度[7],同时还可以提高资源利用率避免浪费。
近年来,缓释技术也开始用于环境污染治理并显示出很大的应用潜力[8]。XING等[9]以廉价的农业废弃物为碳源,制备了一种内层为大分子碳源、外层为小分子的新型双层缓释碳源微球,研究了花生壳、玉米芯和核桃壳3种农业废弃物在不同粒径下的碳释放性能和反硝化性能,通过改变微球层数来控制微球的碳源释放速率,结果表明,粒径小于0.125 mm的玉米芯具有较好的碳释放性能,双层缓释碳源微球比单层缓释碳源微球具有更大的脱氮潜力。王允等[10]首次以淀粉为碳源原料,聚乙烯醇(PVA)为载体,α-淀粉酶作为添加剂,采用共混技术制备2种脱氮原位反应格栅(PRB)缓释有机碳源(SOC)材料为微生物脱氮提供碳源。研究发现,材料内部形成淀粉分子填充的PVA 网络骨架,缓释碳符合二级动力学过程。HSIA等[11]以稻壳粉、硫酸镁及聚乳酸制备了新型原位硫酸盐释放生物屏障(SRM),用于长期硫酸盐释放,以增强厌氧石油烃的生物降解与硫酸盐还原机制。目前关于缓释材料在环境污染治理中的研究多为缓释碳源和缓释硫酸盐,对缓释氮源材料研究较少,且缓释材料多为单独使用,鲜少与固定化微生物结合研究。
本研究利用实验室保存的Rhodococcus sp.W7为固定化菌株,对比筛选氮源和条件优化制备出了可缓释氮源的固定化微生物颗粒(immobilized microbe particle, IMP),旨在探索固定化微生物在氮匮乏条件下对底物降解能力。通过对颗粒结构表征和缓释性能研究揭示了缓释尿素固定化微生物颗粒(controlled urea immobilized microbe particle, CUIMP)的降解特性和缓释机制。本研究结果对生物法在极端营养环境中发挥修复作用可提供参考。
-
菌株Rhodococcus sp.W7(Genebank MK424264)为本实验室筛选获得,分离自北京某废弃焦化厂污染土壤中。该菌株可高效降解苯酚、吡啶及喹啉等污染物。无氮无机盐培养基包括1.0 g·L−1 NaCl、1.0 g·L−1 K2HPO4、0.5 g·L−1 KH2PO4、0.2 g·L−1 MgSO4,该溶液自然pH=7.0。含氮无机盐培养基包括1.0 g·L−1 NaCl、1.34 g·L−1 NH4Cl、1.0 g·L−1 K2HPO4、0.5 g·L−1 KH2PO4、0.2 g·L−1 MgSO4,该溶液自然pH=7.0。液体LB培养基包括5.0 g·L−1 牛肉膏、10.0 g·L−1 蛋白胨、5.0 g·L−1 NaCl,调节pH为7.0~7.2。固体LB培养基即在液体LB培养基中加入20.0 g·L−1琼脂粉[12]。
-
称取8 g聚乙烯醇、2 g海藻酸钠于烧杯中,搅拌粉末使其混合均匀,加入去离子水后在80 ℃水浴中搅拌使其混合均匀,然后,置于121 ℃条件下湿热灭菌20 min,灭菌完成后常温下冷却至室温,得到凝胶溶液。将一定量的Rhodococcus sp.W7菌悬液与一定量凝胶溶液混合(总体积约为100 mL左右),加入适量氮源,使用玻璃棒在无菌条件下搅拌使其混合均匀,之后静置等待气泡完全消失,再使用20 mL注射器将混合液匀速滴入无菌的交联剂中,放入4 ℃冰箱中交联24 h。交联完成后,使用无菌水清洗固定化颗粒3次以洗去表面交联剂,然后将颗粒浸泡在无氮无机盐培养基中,并放入4 ℃冰箱中保存备用[12]。
-
1)不同种类氮源对制备IMP的影响。选择氯化铵、硝酸钠、尿素为包埋氮源,按照1.2所述方法制备IMP,观察制备过程中和培养过程中颗粒性能的变化。
2)交联方法对制备CUIMP的影响。硼酸交联法:使用电子天平称量3 g CaCl2固体,加入100 mL饱和硼酸溶液中,搅拌溶解得到硼酸交联剂。在此交联剂中交联24 h;硼酸-硫酸钠复合法:在硼酸交联剂中交联2 h后转移至0.5 mol·L−1硫酸钠溶液中再交联22 h。观察制备过程中颗粒性能变化,将两种方法制得的固定化颗粒置于无机盐培养基中培养,10 d后取出,测定2种交联方法制得固定化颗粒溶胀率的差异。
3)不同尿素添加量对制备CUIMP的影响。分别在100 mL凝胶溶液中添加5、10、20、30 g尿素,观察制备过程和培养过程中颗粒的性能及机械强度的变化。
称取20 g CUIMP(湿重,含水率约80%)于100 mL苯酚质量浓度为100 mg·L−1的无氮无机盐培养基中,置于摇床中于30 ℃、180 r·min−1条件下培养,定期更换新鲜无氮无机盐培养基。连续20 d监测固定化颗粒的缓释与降解能力,并在第10天测定颗粒溶胀率的差异。
4)菌液和凝胶溶液体积比对制备CUIMP的影响。调整凝胶溶液的体积分别为95、90、80、70 mL,对应添加菌液(OD600≈2.7)的体积分别为5、10、20、30 mL,即菌液与凝胶溶液体积比为1∶19、1∶9、1∶4、3∶7。制备CUIMP并驯化,将驯化后颗粒投入苯酚质量浓度为100 mg·L−1的100 mL无机盐培养基中,置于摇床中于30 ℃、180 r·min−1条件下培养,间隔一定时间取样测定剩余苯酚质量浓度,每组实验设置3个平行。
-
待CUIMP交联完成后取出,测量剩余交联剂溶液体积。取剩余交联剂1 mL,置于离心机中离心5 min,设置转速为12 000 r·min−1。取上清液,使用紫外分光光度法检测溶液中尿素的质量浓度[13-14],固定化颗粒的尿素包封率根据式(1)进行计算。取适量固定化颗粒,使用滤纸吸去表面水分,称量其质量。将颗粒浸泡于无氮无机盐培养基中培养48 h,取出颗粒,吸去表面水分并称量,颗粒溶胀率[15]根据式(2)进行计算。
式中:H为固定化颗粒的尿素包封率,%;V1为剩余交联剂溶液体积,mL;C1为剩余交联剂溶液中尿素质量浓度,g·mL−1;W1为初始加入尿素质量,g。
式中:Q为颗粒溶胀率,%;W0为浸泡前颗粒质量,g;W1为浸泡后颗粒质量,g。
将粒径大小相同、数量相等的固定化颗粒以10%的固液比加入100 mL无氮无机盐培养基中,置于摇床中在30 ℃、180 r·min−1条件下振荡3 d,观察颗粒的破碎情况[16]。将固定化颗粒置于水平光滑的玻璃板上按压,观察颗粒形状变化及是否回弹判断颗粒弹性。将冷冻干燥后的颗粒进行预处理,采用扫描电镜(JSM-IT300LV)观察颗粒表面及内部结构与样貌[17],分别对制备初期和缓释后期的颗粒进行观察。用滤纸将固定化颗粒表面吸干水分,用傅里叶变换衰减全反射红外光谱仪分析固定化颗粒的官能团,参考ZIBA等[18]的方法:扫描区域为4 000~400 cm−1,分辨率为4 cm−1,扫描16次,测量温度为室温。采用热重分析仪对固定化颗粒的热稳定性进行分析,测试温度为40~800 ℃,升温速率为20 ℃·min−1,采用氮气气氛[19]。
-
1)最佳固液比例选择。制备多瓶100 mL无氮无机盐培养基,分别添加6、8、10、15、20 g(湿重,含水率约80%)CUIMP,即固液比分别为6%、8%、10%、15%、20%(W/V)。加入相同浓度的苯酚溶液,在相同条件下驯化培养。更换新鲜无氮无机盐培养基,使得体系中苯酚质量浓度为100 mg·L−1,置于摇床中在30 ℃、180 r·min−1条件下培养,每隔2 h取样1次,取上清液测定剩余苯酚质量浓度。
2)单底物降解实验。分别配制含100 mg·L−1苯酚、100 mg·L−1吡啶、100 mg·L−1喹啉的无机盐溶液。按照最佳固液比将CUIMP加入至100 mL无氮无机盐培养基中。将锥形瓶置于摇床中在30 ℃,180 r·min−1条件下培养,每隔一段时间取样测定培养基中剩余底物质量浓度。
3)混合底物降解实验。按照最佳固液比将CUIMP加入至100 mL无氮无机盐培养基中。使培养基中苯酚、吡啶、喹啉质量浓度分别为100、10和10 mg·L−1。在30 ℃,180 r·min−1条件下培养,每隔一段时间取样测定培养基中剩余苯酚、吡啶和喹啉质量浓度。
4)降解动力学分析。按照最佳固液比将CUIMP加入苯酚质量浓度分别为100、200、300、500 mg·L−1的无氮无机盐培养基中。在30 ℃,180 r·min−1条件下培养,每隔2 h取样,测定其中剩余苯酚质量浓度[20]。
-
将缓释颗粒经真空冷冻干燥,取10粒干燥后的颗粒,称重。将颗粒置于容器中,加少量超纯水,使用超声波细胞破碎仪[21]在功率比50%(最大功率1000W)条件下将干燥后的颗粒完全破碎成为液体,加入超纯水定容至一定体积,检测破碎后溶液中的尿素含量。
-
苯酚、吡啶、喹啉使用高效液相色谱仪(岛津LC-20AT)进行测定;尿素含量按照对二甲氨基苯甲醛显色分光光度法[22]进行测定。
-
1)包埋不同种类氮源的IMP差异。在制备过程和后期培养过程中,观察到3种氮源制得的IMP在形态和机械强度方面具有明显差异。在清洗交联剂过程中,以氯化铵为氮源的固定化颗粒呈现边缘透明的现象,而以硝酸钠、尿素为氮源的固定化颗粒未出现此种现象。在后续的摇床培养过程中,每日监测颗粒外观变化,结果如表1所示。
以氯化铵为包埋氮源的IMP在培养过程中逐渐变为透明色,且颜色不均,培养基逐渐变为白色浑浊状态。在摇床中振荡约3 d后,可以观察到颗粒机械强度下降,弹性降低,伴有颗粒破碎的现象,随着时间的增加,破碎情况逐渐显著。以硝酸钠为包埋氮源的IMP在培养过程中发生黏连,并出现材料脱落和破碎的现象,培养基液体也逐渐变为白色浑浊的状态,且较为黏稠。这可能与硝酸钠和聚乙烯醇的交联作用有关,使得一部分聚乙烯醇与硝酸钠反应,影响了凝胶溶液比例和硼酸交联效果[23]。在整个制备和培养的过程中,以尿素为包埋氮源的IMP性能最佳,外观形态和机械强度均未出现明显的变化,颗粒的弹性较好,可以满足实际应用需求,故后续实验中选择使用尿素为包埋氮源进行缓释。
2)交联方法对制备CUIMP的影响。使用硼酸-硫酸钠复合法制得的颗粒相比传统的硼酸交联法制得的颗粒在性能上具有明显增强。硼酸交联法制得的颗粒溶胀率在98%~105%,在培养一段时间后颗粒体积大小变化明显,弹性较差。而硼酸-硫酸钠复合法制得的颗粒溶胀率在18%~25%,溶胀率大大降低,颗粒体积仅有轻微变化,机械强度与弹性较好。这可能是因为使用硫酸钠为交联剂二次交联的过程中,未反应完全的羟基、氨基等亲水基可以与硫酸根继续反应,降低了颗粒的亲水性,进而减小了颗粒的吸水溶胀性[24]。颗粒吸水溶胀,可能会导致少量载体及内部营养物质和微生物溶出,影响颗粒的机械强度,加入硫酸钠为交联剂,可以减小固化颗粒的溶胀,减少内部包埋尿素的损失,更有利于颗粒的缓释作用。因此,硼酸-硫酸钠复合法制得的CUIMP在性能上更具有优势,故本论文选择使用硼酸-硫酸钠复合法进行下一步的实验。
3)不同尿素添加量制备CUIMP的差异。尿素添加量对CUIMP的缓释天数和溶胀率可造成明显的影响。如图1(a)所示,随着尿素添加量的增加,CUIMP中可供缓释的氮源增加,可维持更长时间的降解能力。同时,由于尿素中氨基(-NH2)的亲水性,CUIMP溶胀率也随之提高。如图1(b)所示。尿素添加量为5 g时,溶胀率约为8.8%,尿素添加量在10~20 g时,颗粒溶胀性差别较小;溶胀率约为22%左右,而当尿素添加量为30 g时,溶胀率达到30%以上,溶胀率大小对颗粒的机械强度造成影响。综合颗粒的缓释能力和溶胀性,当尿素添加量在10~20 g时,CUIMP的性能最佳,本研究在后续实验中选择10 g尿素添加量制备CUIMP。
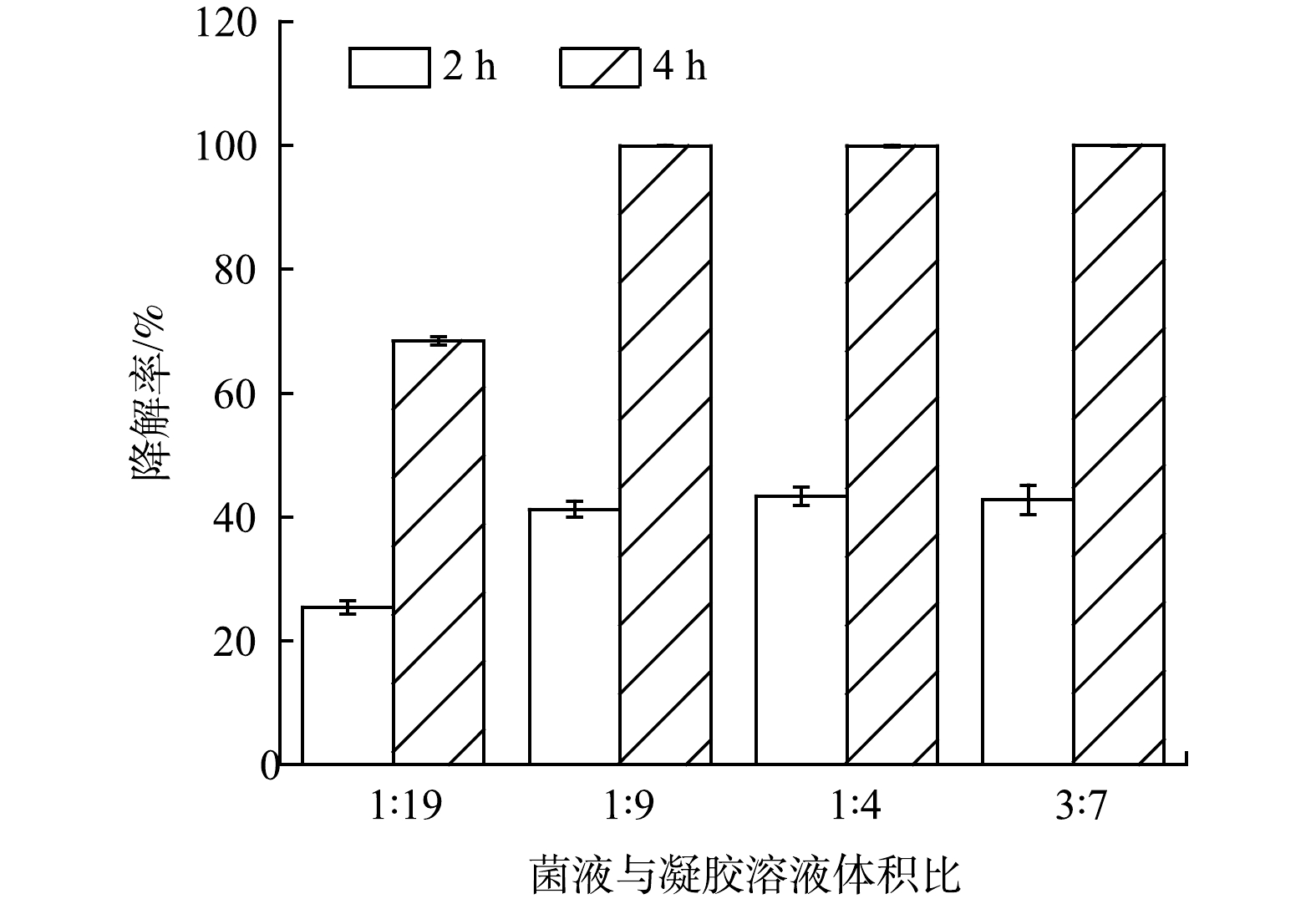
4)菌液和凝胶溶液比例对制备CUIMP影响。不同菌液和凝胶溶液比例制得CUIMP降解性能差异如图2所示。在处理100 mg·L−1苯酚2 h时,体积比为1∶19所制得的CUIMP对苯酚的降解率约为25%,低于其它处理;在处理时间达到4 h时,体积比为1∶19所对应的降解率约为68%,而其它体积比制得的CUIMP对苯酚的降解率已达100%。对比1∶9、1∶4、3∶7对应的降解率发现随着菌液体积占比的增加,无明显降解差异。因此,考虑节省应用投入成本,后续选择菌液和凝胶溶液体积最佳比例为1∶9。
5)CUIMP物理性能与外观特征。按照上述方法及条件制得的CUIMP直径约4~5 mm,尿素包封率在98%~99%,颗粒吸水溶胀率在15%~25%。图3为CUIMP在无氮培养基中底物只有苯酚情况下培养数天后表观颜色变化。可以发现,随着培养时间的增加,颗粒颜色由白色变为粉色最后变为较深的橙红色。这因为颗粒内部包埋的微生物为红球菌(菌落呈橙红色),红球菌以颗粒内部尿素为氮源、苯酚为碳源大量生长繁殖,使得颗粒颜色逐渐加深。
-
1)扫描电镜分析。CUIMP经过连续缓释、降解实验,颗粒形貌结构发生了明显变化。如图4(a)和图4(b)所示,缓释前颗粒表面结构较为光滑致密,缓释后则变得较为粗糙,存在大量的中空凸起。这与尹冬雪[25]研究中所对应的结构特征相似,可能是颗粒中的尿素缓慢释放后形成的,同时这些凸起也形成了颗粒内外物质运输的通道。颗粒内部结构在缓释前后也发生了明显的变化,结果如图4(c)、图4(d)所示。缓释前颗粒内部结构较为光滑、呈多孔结构,微生物在其中附着;缓释后,颗粒内部呈现较为规则的结构,孔隙较缓释前数目增多、孔径增大,更有利于氧气和底物传递,这一特点与高华崇等[26]研究结果相似。
2)红外光谱分析。图5为PVA、SA及CUIMP缓释前后的红外光谱图。在波数为3 435 cm−1附近均出现O—H伸缩振动引起的特征峰;在2 924 cm−1和1 419 cm−1附近出现C—H的伸缩振动峰和面内弯曲振动引起的特征峰[27];而1 633 cm−1和1 030 cm−1处的吸收峰分别为海藻酸钠中—COO—的伸缩振动和C—O的伸缩振动引起[27-30],缓释前后的固定化颗粒均在2 350 cm−1出现较弱吸收峰,归属于硼酸的B—H的伸缩振动峰[31]。观察缓释前固定化颗粒光谱图,NH2面内弯曲振动峰出现在1 633 cm−1附近,在此处与C=O形成CO—NH2组峰[28];此外,在1 360~1 020 cm−1 内也可以观察到C—N的峰值[27],这也证实了尿素负载,对比缓释前后图谱,可以发现NH2和C—N的特征峰在缓释后明显减弱,这可能是由于缓释尿素造成基团减少导致。
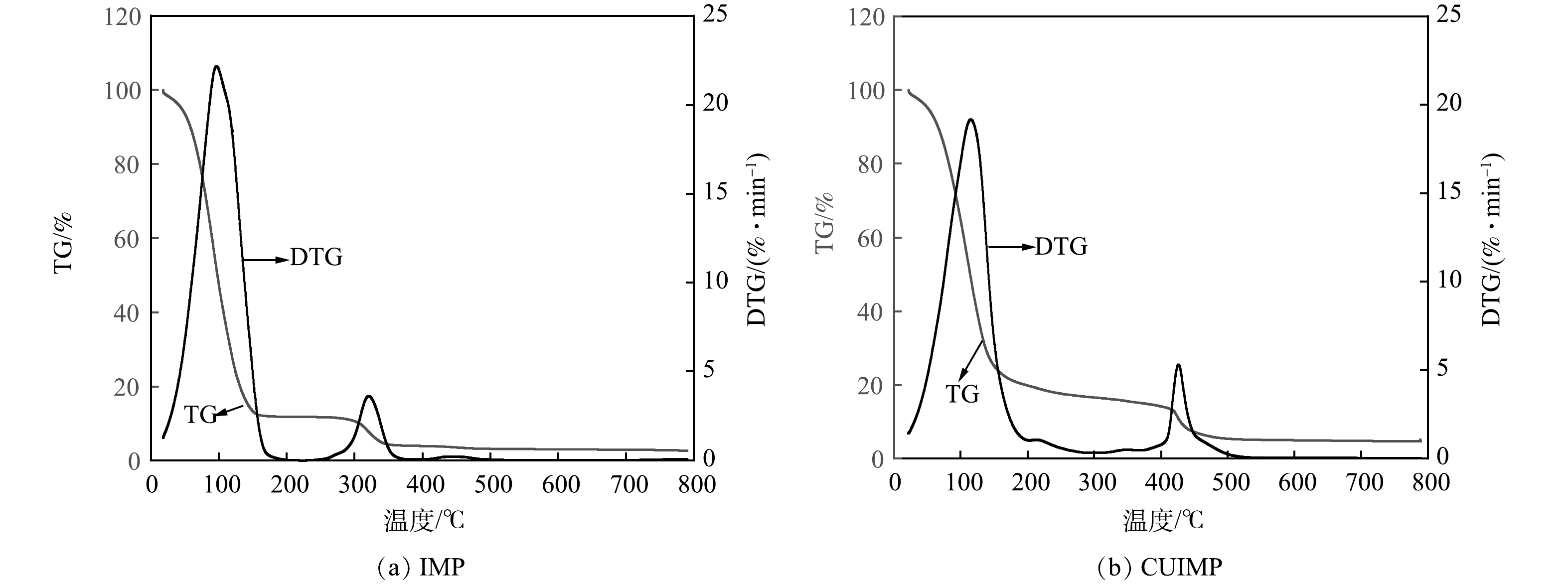
3)热重分析。图6所示为CUIMP热重分析结果。从热重曲线(TG)和微商热重曲线(DTG)中可见,温度在155~160 ℃时,出现较大的质量损失,IMP质量损失约为85%,CUIMP质量损失约为77.5%,这一阶段主要为颗粒中结合水的脱除,CUIMP相比IMP受热更稳定;第2阶段为160~452 ℃,这一阶段海藻酸钠开始裂解并趋于稳定,生成为较为稳定的中间产物,聚乙烯醇分子链氢键断裂,侧基消除生成水和醋酸,对比图6(a)、图6(b)可以发现,IMP热稳定性较差,在温度为350 ℃左右时便达到最大损失,质量损失约为97%,而CUIMP在452 ℃时达到最大质量损失,受热稳定性更强[19,31]。
-
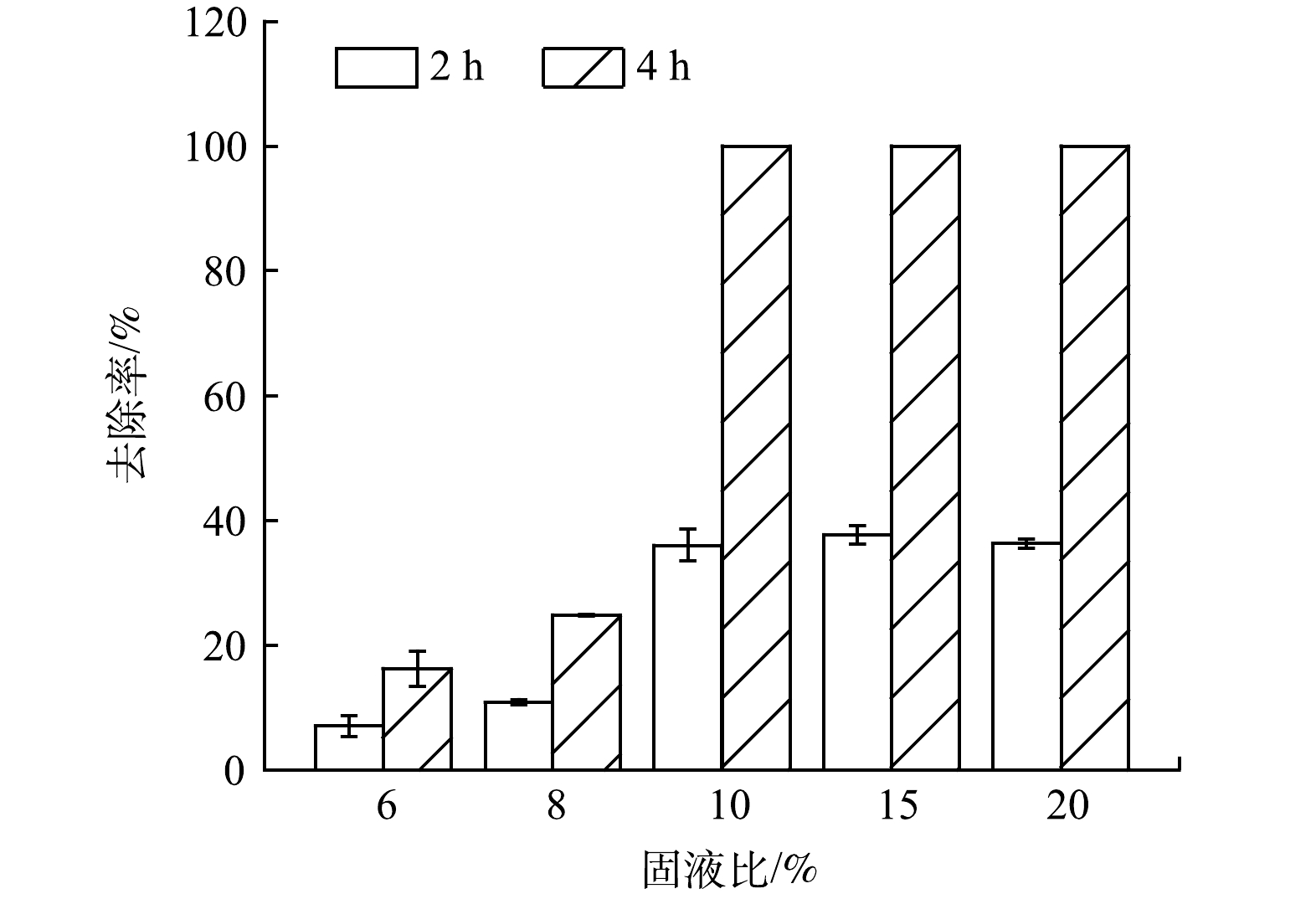
1)最佳固液比例。不同固液比对降解100 mg·L−1苯酚的影响如图7所示。不同固液比对去除率的影响有明显差异。当固液比为6%和8%时,CUIMP在4 h内对100 mg·L−1的去除率均在25%以下,而当固液比提高到10%时,去除率可达到100%。当固液比为10%以上时,2 h和4 h的去除率与固液比为10%时去除率基本相同。因此,考虑到应用经济性确定最佳CUIMP投加比例为10%。
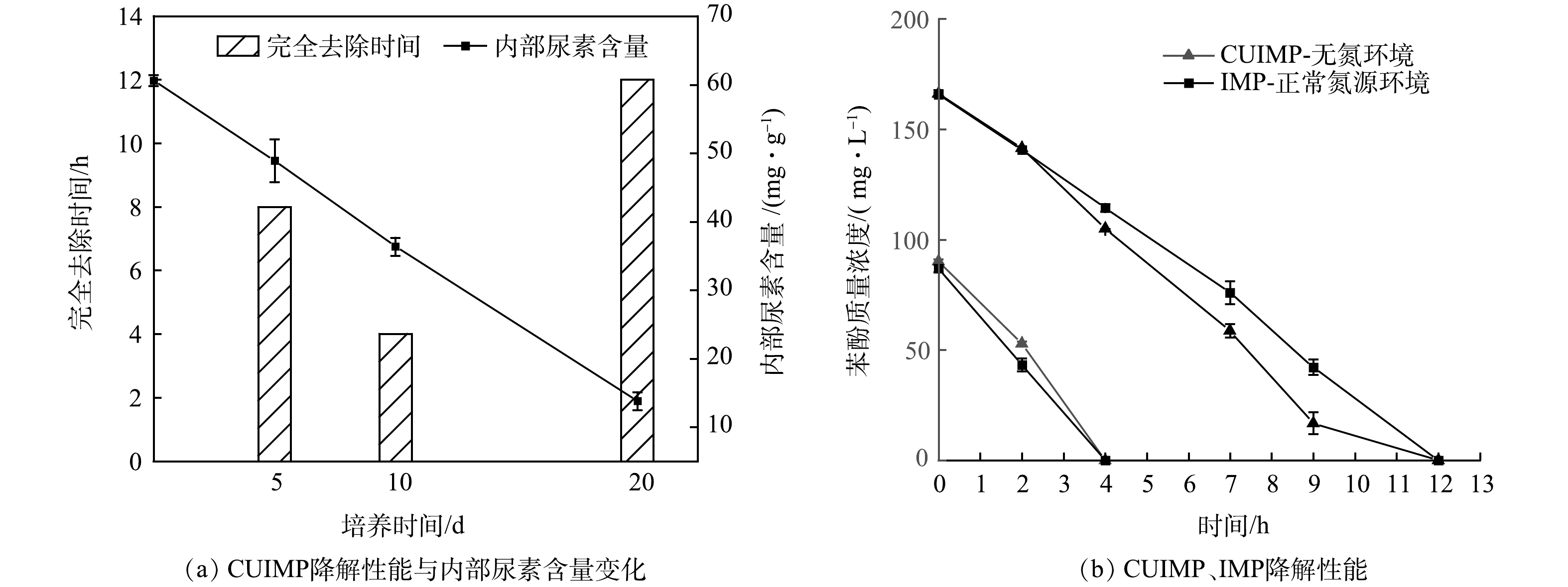
2) CUIMP降解特性分析。图8(a)、图8(b)、图8(c)为CUIMP降解单底物过程,在无氮环境下,CUIMP可分别在4、8、12 h内完全降解100 mg·L−1苯酚、吡啶、喹啉,相比于IMP有明显的降解优势。将CUIMP置于高碳氮比的混合底物环境中,仍具有良好的降解效果。如图8(d)所示。苯酚、吡啶、喹啉几乎同时达到完全降解,耗时约6 h,与仅降解100 mg·L−1苯酚相比,所需时间约增加2 h。由此可见,CUIMP中的尿素可以供微生物利用,帮助微生物在无氮或高碳氮比的环境下高效降解污染物。
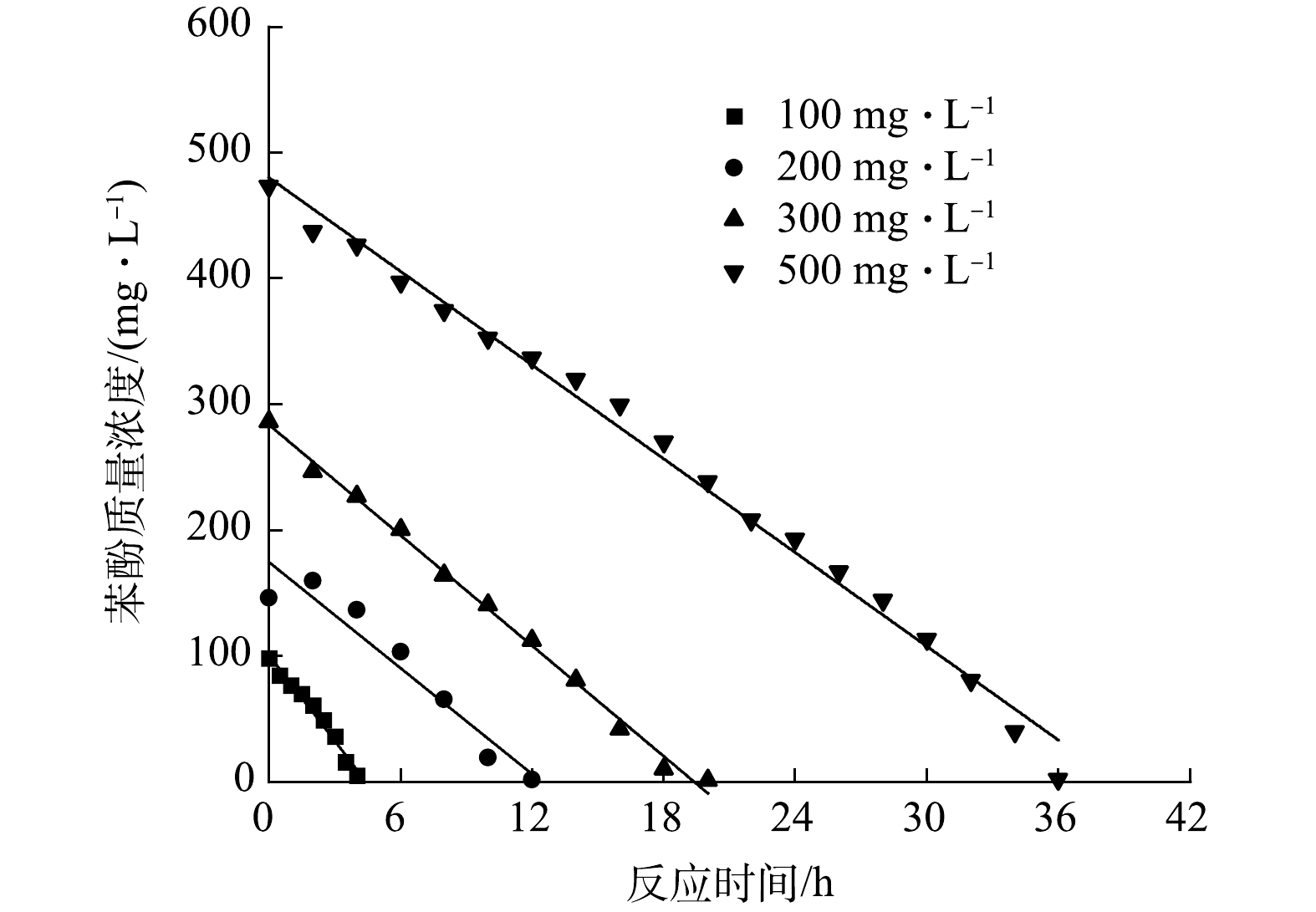
3)苯酚降解动力学分析。以不同初始质量浓度苯酚为唯一碳源,缓释尿素为唯一氮源进行降解动力学研究。如图9所示,当初始苯酚质量浓度为100 mg·L−1时,CUIMP完成降解过程仅需4 h。随着苯酚浓度的升高,降解速率降低,完全降解所需时间延长。为了模拟颗粒降解苯酚的动力学行为,采用多种模型进行拟合[20,32-33],对比发现可以用零级反应方程来描述不同质量浓度下CUIMP的降解过程。
表2列出了不同初始质量浓度苯酚下拟合的回归参数。可以看出相关系数(R2)值均大于0.91,表明不同初始质量浓度的苯酚降解都能较好地用零级反应形式表示。
-
微生物生长降解需要的氮源主要依靠CUIMP内部的尿素缓释。CUIMP内部的尿素含量变化及降解性能变化如图10(a)所示。在制备初期,CUIMP内部的尿素未被利用,尿素含量约为60.6 mg·g−1,之后每日添加100 mg·L−1苯酚进行驯化培养,不额外添加其它氮源。在培养到第5天时CUIMP完全降解100 mg·L−1苯酚需要8 h,颗粒内部尿素含量约为48.9 mg·g−1,释放量约为19%左右。在培养达到第10天时,CUIMP达到最佳降解效果,完全降解100 mg·L−1苯酚仅需4 h,颗粒内部尿素含量约为36.3 mg·g−1,释放量约为40%。这可能是因为尿素通过缓释被微生物利用,使得微生物得以生长繁殖,进而大大提高了苯酚降解性能。随着培养天数不断增加,CUIMP内部尿素含量逐渐减少,颗粒降解性能经过了一个高效降解向降解能力退化的过程,在培养第20天时,CUIMP完全降解100 mg·L−1苯酚需要12 h,颗粒内部尿素含量降为13.8 mg·g−1左右,20 d尿素释放量约为77%。由此可见,CUIMP所包含的尿素提供的氮源能满足固定化微生物每天降解100 mg·L−1苯酚并持续20 d。
另外,在培养到第10天前后时,即CUIMP降解性能最佳时,对CUIMP与IMP进行了降解性能比较。如图10(b)所示,对100 mg·L−1苯酚的降解过程较快,CUIMP在无氮环境下的降解速率与IMP在正常氮源环境下降解速率无较大差别;对于处理200 mg·L−1苯酚,CUIMP在无氮环境下的降解速率要高于IMP在正常氮源环境下的降解速率。由此可见,CUIMP通过利用缓释氮源可达到相当或更佳的降解效果。
-
1)以尿素作为氮源制备的可缓释尿素的固定化微生物颗粒最佳制备条件为:尿素添加比例为10%~20%(W/V)、菌液和凝胶溶液体积比为1:9、交联方法为硼酸-硫酸钠复合法,制得的CUIMP吸水溶胀率小、机械强度高且更有利于颗粒的缓释。
2)无氮条件下,CUIMP可在4、8、12 h内分别完成对100 mg·L−1苯酚、吡啶、喹啉的降解。其对100~500 mg·L−1苯酚的降解符合零级反应动力学模型。此外,CUIMP也可以在6 h内完成对100 mg·L−1苯酚、10 mg·L−1吡啶、10 mg·L−1喹啉的混合底物降解。
3) CUIMP所包含的尿素提供的氮源能满足固定化微生物每天降解100 mg·L−1苯酚并持续20 d。
缓释氮源的固定化Rhodococcus sp.W7颗粒处理焦化废水
Treatment of coking wastewater by immobilized Rhodococcus sp.W7 particles with controlled release of nitrogen source
-
摘要: 本研究将固定化微生物与氮源缓释相结合,以提高一般固定化微生物在氮源缺乏环境中的生物降解效率。利用尿素作为缓释氮源,通过将聚乙烯醇-海藻酸钠混合凝胶(包含尿素)在3% CaCl2 饱和硼酸溶液中一次交联,在0.5 mol·L−1硫酸钠溶液中二次交联,最终制得的缓释尿素固定化微生物颗粒包封率高达98%以上,溶胀率在15%~25%,同时有较高的机械强度。在无氮条件下,颗粒可在4、8、12 h内分别完成对100 mg·L−1苯酚、吡啶或喹啉的降解;在高碳氮比的模拟焦化废水环境下,可在6 h内完成对100 mg·L−1苯酚、10 mg·L−1吡啶及10 mg·L−1喹啉混合底物的降解。另外,固定化微生物颗粒所包含的尿素提供的氮源能满足固定化微生物每天降解100 mg·L−1苯酚并持续20 d。以上研究结果表明所制备的缓释尿素固定化微生物颗粒可应用于氮源匮乏的污水治理中并有较好的应用效果。Abstract: In this study, the immobilized microorganisms coupling with controlled release of nitrogen source was used to improve the biodegradation efficiency of common immobilized microorganisms in nitrogen source deficient environment. Urea was used as the controlled release of nitrogen source. The mixed gel (containing urea) of polyvinyl alcohol and sodium alginate was first crosslinked in 3% CaCl2 saturated boric acid solution and then crosslinked in 0.5 mol·L−1 sodium sulfate solution. The prepared immobilized microbial particles with controlled release of urea had an encapsulation efficiency of higher than 98%, swelling rate of 15%~25% and high mechanical strength. In nitrogen free environments, 100 mg·L−1 phenol, pyridine or quinoline could be biodegraded by these particles within 4, 8 and 12 hours, respectively. In the simulated coking wastewater with high C/N ratio, the mixture of 100 mg·L−1 phenol, 10 mg·L−1 pyridine and 10 mg·L−1 quinoline could be degraded within 6 hours. Meanwhile, the nitrogen source provided by the urea in the immobilized microbial particles could meet the needs of the immobilized microorganisms to degrade 100 mg·L−1 phenol every day for 20 days. The above results show that the prepared immobilized microbial particles with controlled release of urea can be used to treat wastewater lack of nitrogen source and have a good application effect.
-
Key words:
- controlled-release nitrogen sources /
- Urea /
- immobilized microorganism /
- biodegradation
-
土壤是人类农业生产的物质基础,一旦遭受污染,会对粮食安全和人体健康造成危害。2014年发布的《全国土壤污染状况调查公报》[1]显示,我国土壤重金属污染问题不容乐观,污染土壤中约82.4%的土壤受到重金属及准金属污染,且土壤重金属污染具有隐蔽性、滞后性、治理难、周期长的特点[2]。重金属极易在土壤-植株体系内迁移和累积,会造成环境污染和生态破坏。因此,对土壤重金属的治理迫在眉睫。
目前,土壤重金属的处理方法包括物理法(土壤淋洗、蒸汽浸提、电动力学修复)、化学法(化学修复剂)和生物法(微生物催化降解、植物修复、动物修复)[3]。化学原位钝化技术因其成本低、见效快、处理效果显著而得到广泛的应用[4]。常用的钝化剂主要有石灰[5]、磷酸盐[6]、有机质[7-8]、金属氧化物[9-11]和黏土矿物[12]。其中,凹凸棒石是一种典型的含水富镁铝硅酸盐黏土矿物,具有独特的化学成分和物理结构,内表面积大、孔隙较多、离子交换能力强,在化工、环保和印染等领域得到了广泛的应用。谭科艳等[13]研究了凹凸棒石对铜锌镉重金属污染土壤的修复效果,结果表明,适量添加凹凸棒石黏土矿物可对Cu的平均修复率达到31.50%,对Zn元素的平均修复率达到26.15%,对Cd元素的平均修复率达到34.92%,能够有效减少蔬菜对Cu、Zn、Cd元素的吸收。马博[14]研究表明,凹凸棒石综合钝化能力更强,且在酸性较高的极端条件下效果优于膨润土和沸石,低配比凹凸棒石对衡阳尾矿中Cr、Zn、Cd、Pb、Cu的钝化效果显著。ZHANG等[15]发现,凹凸棒石的施加可显著降低Cu的生物可利用态质量分数,缓解重金属Cu对油菜植株的生理胁迫效应。
常用的凹凸棒石改性方法有无机改性、有机改性、生物质改性和微波改性[16]。LIANG等[17]通过制备巯基改性凹凸棒石钝化Cd污染土壤,可显著增强土壤颗粒对Cd的吸附,抑制农作物对重金属Cd的吸收。XU等[18]将纳米零价铁负载凹凸棒石施用进土壤中,可有效促进重金属Cd、Cr和Pb发生形态转变,并将其固定下来。甘肃省具有丰富的凹凸棒石矿藏,但常常因为品位较低未能得到大规模开发利用。为解决此问题,制备5种不同体积分数H2SO4、不同改性时间的酸改性凹凸棒石,探讨不同钝化材料的添加量对土壤重金属Cu和Zn的钝化效果,并结合环境风险指数和重金属修复效率评估酸改性凹凸棒石的最佳投加量,以期为农田重金属污染土壤的治理和甘肃省凹凸棒石的应用提供参考。
1. 材料与方法
1.1 实验原料
重金属复合污染土壤采自甘肃省白银市东大沟(36° 59′ 96′′ N,104° 22′ 76′′ E)。土壤的基本理化性质为pH 7.28、土壤电导率(EC)1457 µS·cm−1、重金属Cu质量分数为1029.11 mg·kg−1、重金属Ni质量分数为87.18 mg·kg−1、重金属Zn质量分数为707.51 mg·kg−1。其中,Cu和Zn均远超国家标准限值,分别为《土壤环境质量农用地土壤污染风险管控标准》(GB 15618-2018)[19]的5.15倍和2.83倍。
凹凸棒石质黏土复合矿物(简称为“凹凸棒石”)购自甘肃当地,原矿采自甘肃省临泽县板桥镇红色凹凸棒石矿,土状结构,粒度为2 mm左右,主要的矿物成分为凹凸棒石29.7%、石英21.8%、长石14.6%、白云石 6.3%、其他组分27.6%,是一种由凹凸棒石为主,石英和长石以及碳酸盐矿物等伴生的黏土质复合非金属矿物。其主要化学成分为:SiO2 48.38%、Al2O3 11.24%、Fe2O3 4.78%、MgO 7%、CaO 7.41%[20]。
1.2 实验方法
称取定量凹凸棒石,破碎、研磨,过200目筛(直径0.075 mm)。基于49种酸改性钝化材料的研究[21],制备5种优选酸改性凹凸棒石,具体配制条件见表1。将凹凸棒石粉末与不同体积分数的H2SO4溶液混合,固液比为1∶10(m∶v),500 r·min−1转速下搅拌一定时间后,烘干、研磨、过筛制得钝化材料。按2、4、8、16、24 g·kg−1的添加量,将酸改性凹凸棒石钝化材料加入到1.5 kg实际重金属复合污染土壤中,混合均匀,重量法添加去离子水,保持70%的田间持水量,钝化培育30 d后测定土壤的理化性质和重金属形态,每组处理设置不添加任何钝化材料的土壤样品作为对照,记为CK。
表 1 酸改性凹凸棒石的制备方法Table 1. The preparation method of acid modified attapulgite实验编号 H2SO4体积分数/% 反应时间/h A1 10.0 72 A2 12.5 48 A3 12.5 72 A4 12.5 96 A5 15.0 72 1.3 分析方法
采用X射线衍射仪(MiniFlex600,日本Rigaku公司)分析改性前后的凹凸棒石晶体物相组成,扫描速度为10°·min−1,角度为5°~80°,扫描过程采用Cu-Kα 辐照。采用扫描电子显微镜(GeminiSEM500,德国ZEISS公司)观察改性前后凹凸棒石的表面形貌,将样品过200目筛网,在15 kV电压下以相同倍率下放大观察分析。
采用pH计(pHS-3C,上海仪电科学仪器股份有限公司)测定土壤pH,固液比为1∶2.5(m∶v)。采用电导率仪(DDS-307A,上海仪电科学仪器股份有限公司)测定土壤EC,固液比为1∶5(m∶v)。采用BaCl2-H2SO4强迫交换法测定土壤阳离子交换量(CEC)。采用BCR连续提取法测定土壤重金属化学形态。土壤重金属总量经HCl-HNO3-HF-HClO4消解后,火焰原子吸收分光光度计(TAS-990,北京普析通用仪器有限责任公司)测定浓度。
本实验选用H2O和DTPA作为提取剂来评价土壤重金属的生物有效性。土壤重金属水溶态测定时,称取5 g土壤样品与50 mL蒸馏水均匀混合,25 ℃下充分振荡24 h,火焰原子吸收分光光度法测定上清液中重金属浓度。土壤重金属DTPA提取态测定时,称取2 g土壤样品与40 mL DTPA提取液均匀混合,25 ℃下振荡12 h,火焰原子分光光度法测定上清液中重金属浓度。
1.4 指数计算与数据处理方法
污染土壤的生态风险指数(Ecological risk index,ERI)指土壤中活性较高的生物有效态质量分数与重金属总量之比,用于表示土壤中重金属的生态环境风险,常用于底泥沉积物、土壤和污泥中重金属的风险评价,通常分为5个等级,即无风险(<1%)、低风险(1%~10%)、中风险(10%~30%)、高风险(30%~50%)、极高风险(>50%)。按式(1)计算[22-23]。
ERIm=CbsCs×100% (1) 式中:Cbs为土壤中有效态重金属的质量分数,mg·kg−1,Cs为土壤中重金属的质量分数,mg·kg−1。
此外,潜在风险指数(potential ecological risk index)可用于评价多种重金属复合污染的生态风险,可按式(2)、式(3)计算。
Eir=TirCidCib (2) RI=∑ni=1Eir (3) 式中:
Eir Cid Cib CCub CZnb Tir TCur TZnr 表 2 土壤中单一重金属(Er)的潜在生态风险指数Table 2. The potential ecological risk index of single heavy metal (Er) in SoilEr 风险程度 Er ≤ 40 低风险 40 ≤Er <80 中风险 80 ≤ Er < 160 较高风险 160 ≤ Er < 320 高风险 Er > 320 极高风险 表 3 土壤中复合重金属(RI)的潜在生态风险指数Table 3. The potential ecological risk index of total heavy metals (RI) in SoilRI 风险程度 RI ≤ 150 低风险 150 ≤ RI <300 中风险 300 ≤ RI <600 高风险 RI ≥ 600 极高风险 污染土壤中重金属的修复效率(Remediation ratio,RR)指BCR多级提取法中较稳定的重金属残渣态(S4)与土壤重金属4种形态总和的比值,可用于评估重金属的潜在活化风险,按式(4)计算[24]。
RR=S4S1+S2+S3+S4×100% (4) 式中: S1为重金属元素酸溶态质量分数,mg·kg−1;S2为重金属元素还原态质量分数,mg·kg−1;S3为重金属元素氧化态质量分数,mg·kg−1;S4为重金属元素残渣态质量分数,mg·kg−1。
2. 结果与讨论
2.1 土壤理化性质
土壤pH、电导率和阳离子交换量影响着重金属的化学形态,是评价重金属迁移转化和作物生长发育情况的重要指标[25]。施用不同酸改性凹凸棒石后的土壤pH见图1(a),与对照组相比,向土壤中施加5种酸改性凹凸棒石后,土壤pH均呈现显著降低的趋势。在同一投加量水平下,A3处理组pH显著低于其他处理组。这是因为,天然的凹凸棒石本身呈弱碱性,含有大量的羟基等官能团[26],而改性添加的H2SO4具有强酸性,能够和土壤及凹凸棒石中的碱性物质发生反应,从而降低土壤pH,调节土壤的酸碱度。本研究采用的实际污染土壤为北方地区常见的碱性土壤,酸改性凹凸石的施用有效改善了土壤的酸碱环境。不同酸改性凹凸棒石处理后的土壤EC见图1(b),在同一酸改性凹凸棒石处理组中,土壤EC随着添加量的增加而显著增加,且A5处理组EC值显著高于其他处理组。土壤CEC随着凹凸棒石添加量的增加而增加,但不同添加量间差异性不显著(图1(c))。除A4材料投加量为8 mg·kg−1时土壤CEC较高外,其他投加量水平下,A5处理组CEC也显著高于其他处理组。一方面,凹凸棒石的表面带有Na+、K+和Ca2+等阳离子,本身具有较高的阳离子交换容量,随着投加量的增加,土壤中带电的离子浓度升高,从而提高土壤电导率[27];另一方面,当改性时添加的H2SO4体积分数较大时,凹凸棒石表面会带有大量的H+,这些活泼的阳离子可能会和土壤中的Cu2+、Zn2+发生阳离子交换反应,提高土壤的EC和CEC [28]。
2.2 土壤重金属的生物有效态
土壤中重金属的水溶态可直观地反映重金属的生物可利用度,这部分形态的重金属质量分数很低,但是却可以直接被植物吸收利用,具有极强的迁移性和毒性,因此常常作为土壤重金属污染评价的重要指标[29]。不同改性凹凸棒石处理后的土壤生物有效态重金属质量分数见图2。从图2可以看出,添加酸改性凹凸棒石后,水溶态Cu和Zn的质量分数均较对照组显著降低。尽管随着投加量的增加,水溶态重金属质量分数出现了先降低后轻微升高的趋势,但差异并未达显著水平。实验结果表明,当投加量为16 g·kg−1时,酸改性凹凸棒石对Cu、Zn的钝化效果最好。其中,A5处理组中水溶态Cu的质量分数最低,较对照组降低了47.38%;A3处理组中水溶态Zn的质量分数最低,较对照组降低了64.44%。土壤中DTPA提取态重金属质量分数常常用来评估植物对重金属的吸收情况,DTPA络合剂能够与重金属离子结合,形成稳定的水溶性络合物,可直观地评价重金属的生物有效性[30]。添加酸改性凹凸棒石后,Cu和Zn的DTPA提取态质量分数均较对照组显著降低。当投加量为16 g·kg−1时,A5处理组中DTPA提取态Cu的质量分数最低,较对照组下降了24.25%,A3处理组中DTPA提取态Zn的质量分数最低,较CK下降了46.77%。DTPA提取态重金属的降低趋势与水溶态重金属基本保持一致。这与罗宁临等[31]的研究结果基本一致。造成以上结果的原因可能是:1)酸改性使得凹凸棒石表面和孔隙内的碳酸盐杂质得以去除,晶束团聚结构变得更加紧密,内表面积和缝隙增大,增强了其对重金属Cu、Zn的吸附能力[32];2)酸改性凹凸棒石的施用提高了土壤的阳离子交换容量,土壤中游离的Cu2+、Zn2+通过阳离子交换作用,与带有负电荷的凹凸棒石和土壤颗粒结合,显著降低了重金属的生物有效性[27,33];3)凹凸棒石表面带有大量的硅羟基等官能团,能与重金属发生络合反应,从而将其固定[14,34]。本研究结果说明,采用优质的钝化材料是降低土壤重金属毒性的关键,而控制合适的投加量对农田土壤的修复也至关重要。
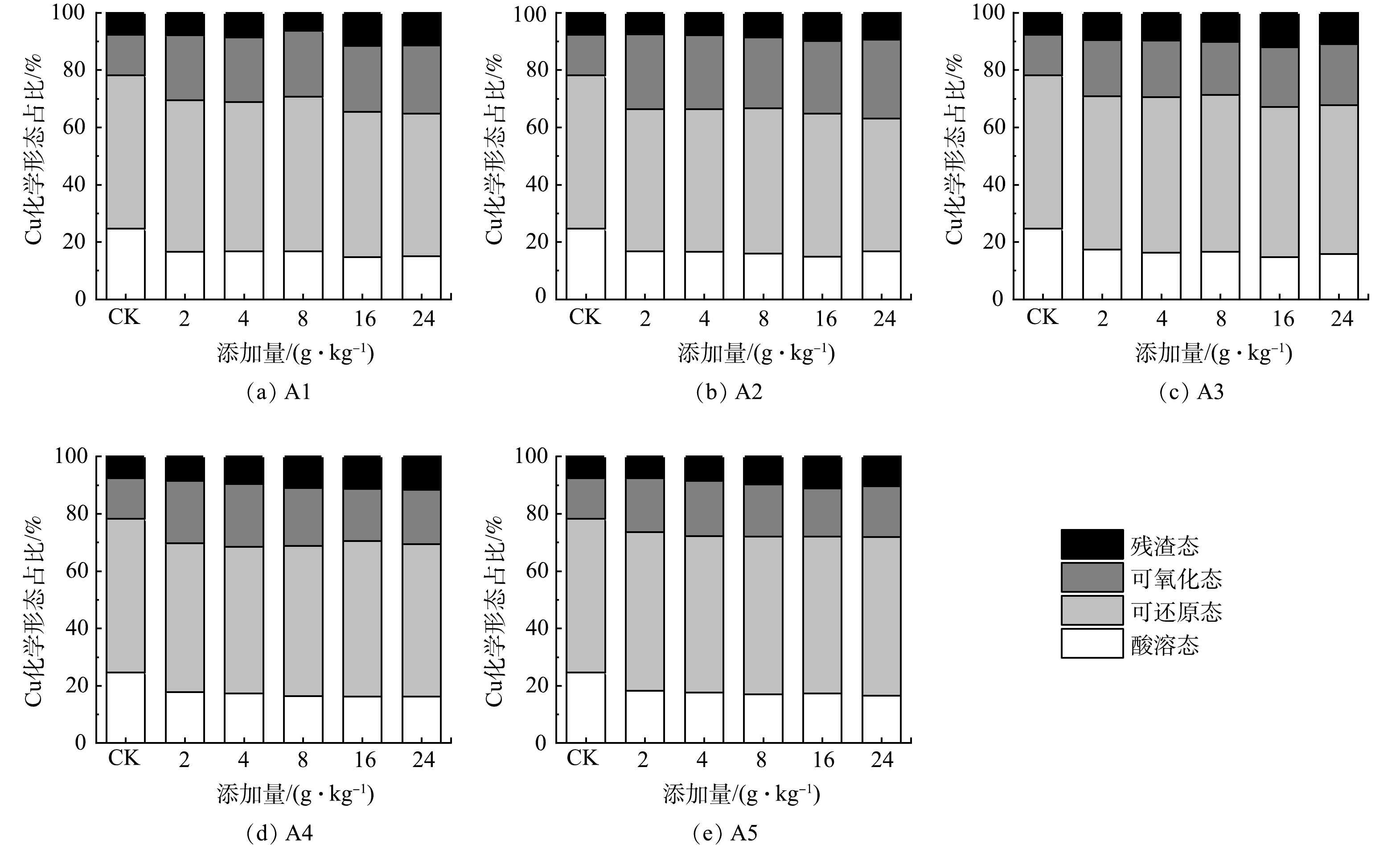
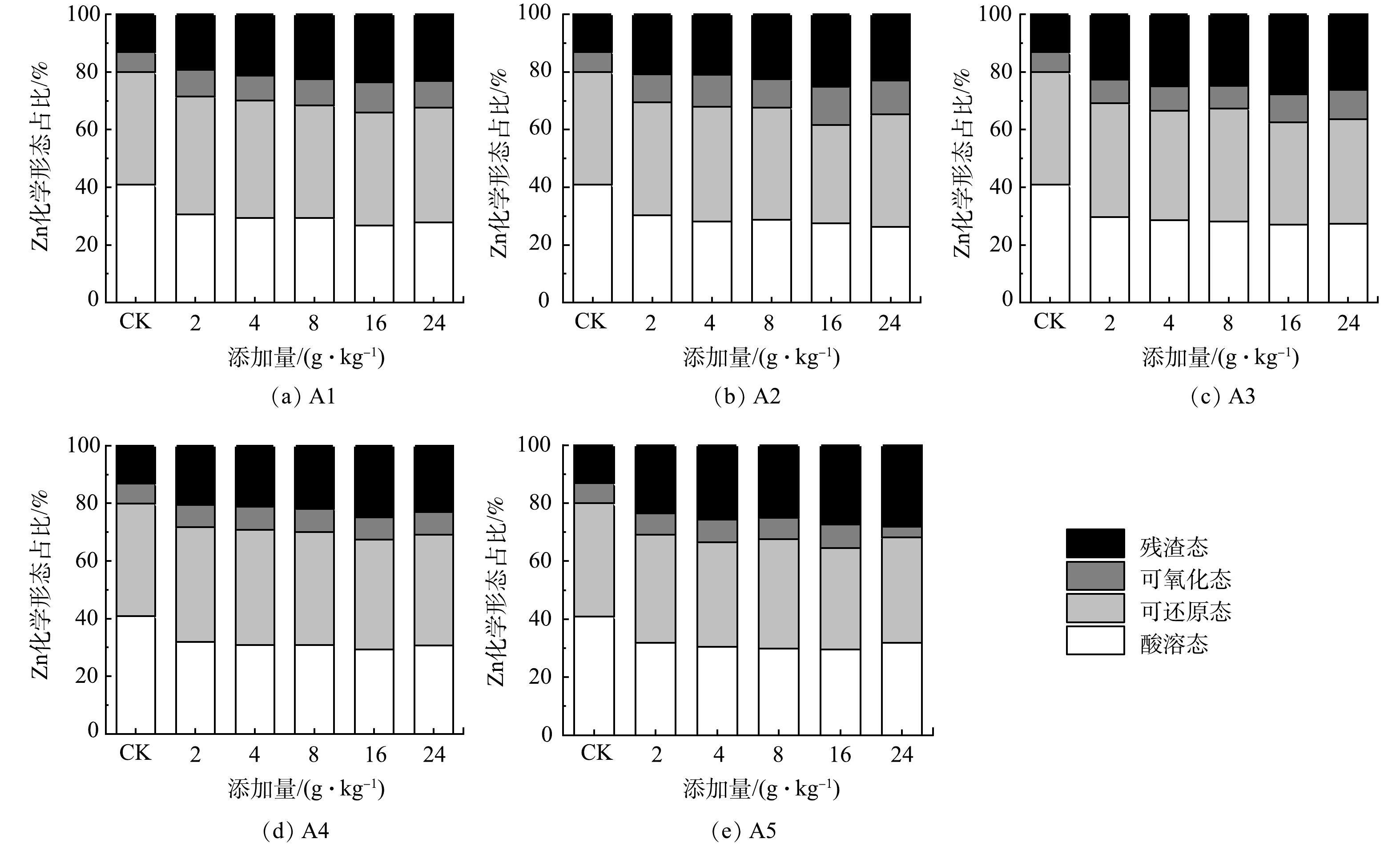
2.3 土壤重金属形态分布
BCR多级提取法中,重金属各种形态的活性大小依次为酸溶态>可还原态>可氧化态>残渣态[35]。其中,酸溶态重金属的生物可利用度最高,可还原态和可氧化态重金属容易随着pH和氧化还原电位等环境条件的变化而变化,重新释放到环境介质中,残渣态重金属最稳定,不易在土壤中迁移转化,生态毒性最低[35-37]。酸改性凹凸棒石钝化后土壤中重金属形态分布见图3和图4。添加不同酸改性凹凸棒石后,酸溶态Cu和Zn的质量分数较对照组显著降低,而残渣态Cu和Zn的质量分数上升(图3,图4)。当投加量为16 g·kg−1时,A3处理组中酸溶态Cu和Zn的占比最低,残渣态Cu的比例较对照组上升了3.96%;残渣态Zn的比例较对照组上升了15.26%,这与武成辉等[38]和陶玲等[39]的研究结果一致。添加不同酸改性凹凸棒石可影响重金属在土壤中的形态,促进重金属从活性较高的酸溶态、可还原态向活性较低的可氧化态、残渣态转变,降低了Cu、Zn的生态毒性,实现了土壤的钝化修复。其原因可能是:1)凹凸棒石及其改性材料的添加可通过一系列吸附、离子交换、沉淀和络合作用降低酸溶态Cu、Zn质量分数[40];2)凹凸棒石经过酸处理后,起支撑作用的八面体和四面体溶解,导致凹凸棒石的孔道增大,比表面积增加,凹凸棒石的吸附性能提高[41];3)残渣态重金属 Cu、Zn一般存在于硅酸盐、原生和次生矿物等土壤的晶格中,当向污染土壤中施用酸改性凹凸棒石后,随着钝化时间的延长,低价的Cu2+、Zn2+可能会在凹凸棒石八面体或四面体结构中与Si4+发生晶格置换,能长期稳定在土壤中[42]。
2.4 酸改性凹凸棒石的表征分析
为验证上述作用机理,本实验对凹凸棒石改性前后的微观形貌和晶体结构进行表征,扫描电子显微镜图像如图5所示。供试凹凸棒石原矿(ATP)主要呈棒状晶束堆积结构,晶束较长,棒晶密实,孔道结构较少。经不同浓度H2SO4和不同活化时间处理后,凹凸棒石的棒晶发生解束,晶束变短,排列相对松散,可直接接触的点位增多,增强了凹凸棒石对重金属的吸附能力。这与陈雪芳[43]等的研究结果一致:酸改性能够溶解凹凸棒石中的八面体阳离子和四面体硅,使得八面体结构起主要的支撑作用,凹凸棒石孔道开放,孔径增大,比表面积增大,吸附性能提高。但是,当酸浓度较高时,会对层间的阳离子起较强的溶出作用,破坏晶体结构,进而降低凹凸棒石的吸附性能[44]。
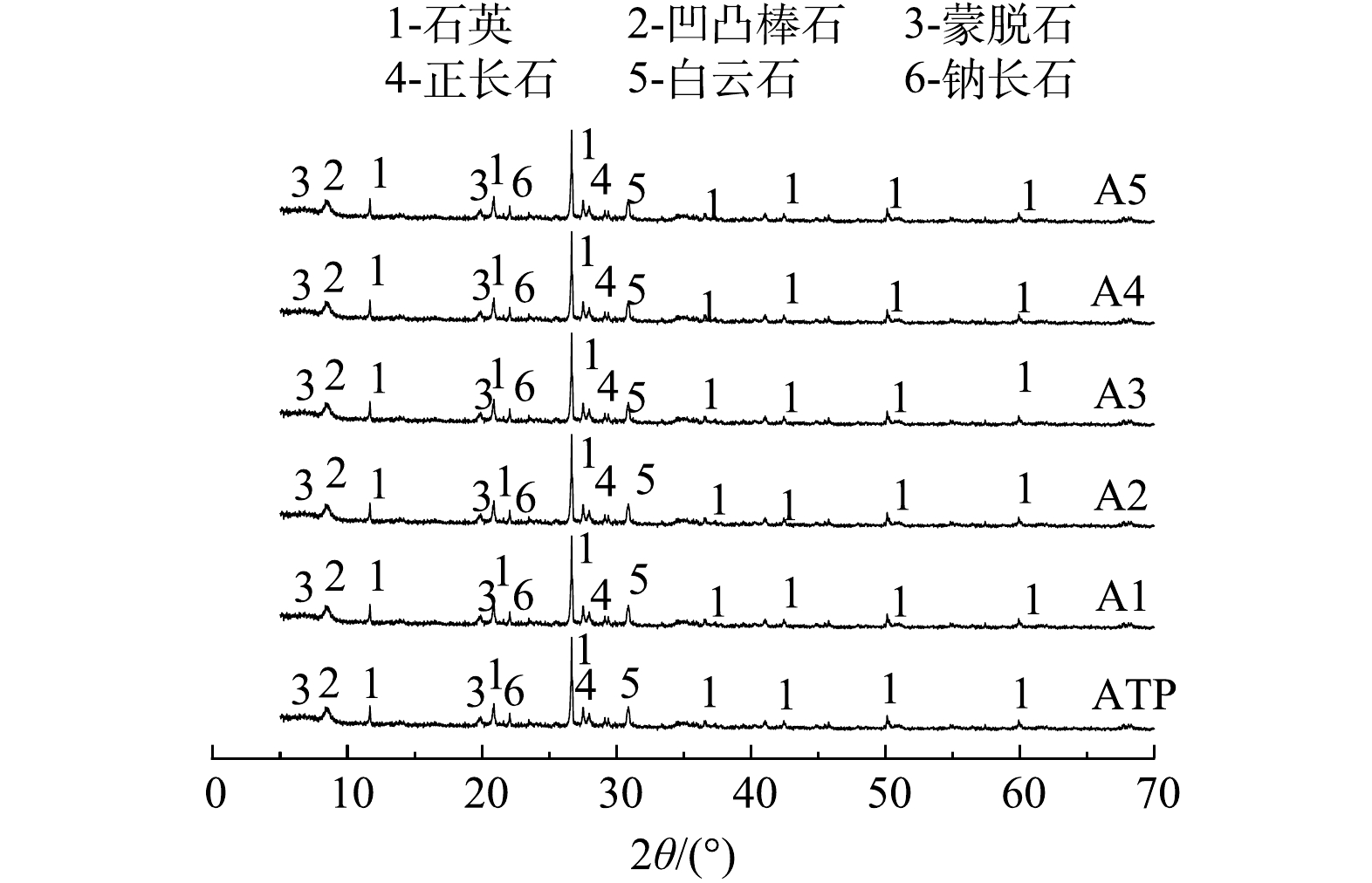
酸改性凹凸棒石的X射线衍射图谱结果见图6。凹凸棒石的特征峰位于8.40°处,与标准衍射图谱(JCPDFNo.020018)一致。石英特征衍射峰的存在证实了凹凸棒石中伴生有其他物相的杂质。从图中可以看出,经过酸改性后,凹凸棒石质黏土复合矿物物相组成及凹凸棒石、白云石物相的衍射峰峰强度没有明显改变,石英杂质的峰强度有轻微减弱。这表明,酸改性过程溶解了碳酸盐等杂质,但是并未破坏凹凸棒石的骨架结构。该结果与雷春生等[45]和张萍等[46]的研究结果一致。本研究结果表明,适宜的酸浓度和改性时间能够有效改善天然凹凸棒石原矿的表面形貌和孔隙结构,使得钝化材料孔隙结构增多,孔径变大,比表面积增大,促进了其对重金属的钝化修复。
2.5 土壤重金属的环境风险评价和钝化修复效率
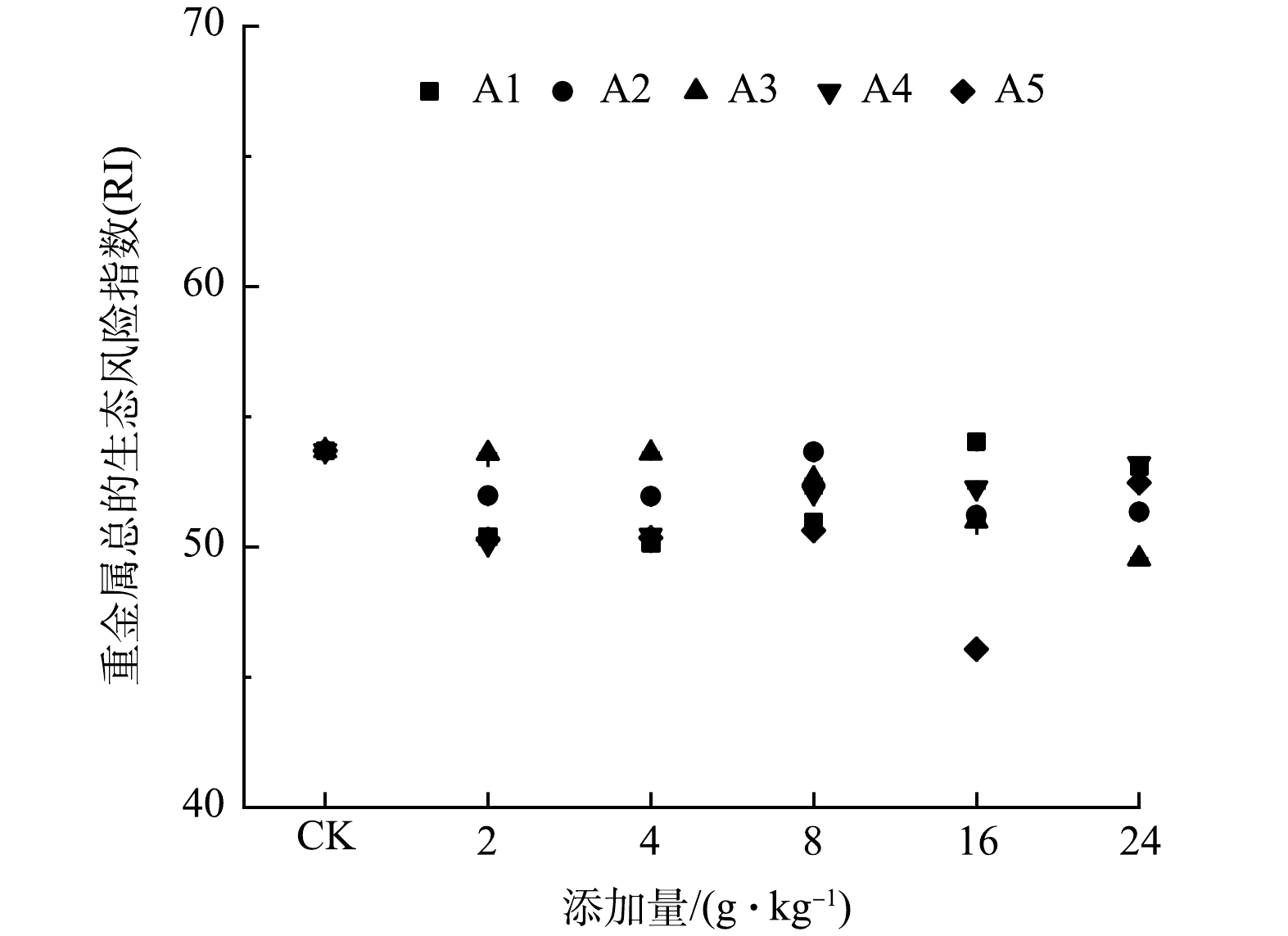
与土壤中重金属的总量相比,水溶态Cu和Zn的质量分数占比不到0.01%。因此,本研究根据DTPA提取态重金属的质量分数来评价酸改性凹凸棒石钝化剂对土壤重金属的修复效率和生态风险。对照组污染土壤中Cu和Zn的环境风险指数分别对应为24.4%和11.51%。经不同的钝化材料处理后,土壤重金属的环境风险均较对照组显著降低(表4)。当施用A5钝化材料且投加量为16 g·kg−1时,酸改性凹凸棒石处理后Cu的环境风险指数降至最低。土壤Zn的环境风险由中风险降为低风险(表5),当施用A3材料且投加量为16 g·kg−1时,Zn的环境风险指数最低。
表 4 不同添加量酸改性凹凸棒石钝化土壤中Cu的环境风险指数Table 4. The environmental risk index of Cu in soil stabilized with different amount of acid-modified attapulgite酸改性凹凸棒石添加量/(g·kg−1) ERI/% A1 A2 A3 A4 A5 2 21.81±0.13Aa 20.80±0.02Ab 20.40±0.11Ac 20.35±0.07Ac 20.49±0.23Ac 4 21.72±0.06Aa 20.32±0.14Bb 19.88±0.26BCc 19.77±0.15BCc 20.28±0.13Ab 8 20.26±0.07Ba 19.97±0.14Cb 20.10±0.13ABab 19.42±0.18Dab 19.36±0.06Bc 16 19.80±0.15Ca 19.35±0.21Db 19.67±0.11Ca 19.87±0.07Ba 18.48±0.17Dc 24 19.43±0.18Dab 19.24±0.15Db 19.35±0.17Dab 19.56±0.10CDab 18.78±0.09Cc 注:大写字母表示不同投加量之间的差异性,小写字母表示不同钝化材料之间的差异性。 表 5 不同添加量酸改性凹凸棒石钝化土壤中Zn的环境风险指数Table 5. The environmental risk index of Zn in soil stabilized with different amount of acid-modified attapulgite酸改性凹凸棒石添加量/(g·kg−1) ERI/% A1 A2 A3 A4 A5 2 9.47±0.03Aa 8.85±0.09Ab 8.55±0.11Ac 8.24±0.11Ad 8.31±0.04Ad 4 8.52±0.11BCab 8.59±0.11Ba 8.36±0.06Abc 8.00±0.08Bd 8.31±0.15Ac 8 8.83±0.10BCa 8.39±0.10Cb 8.48±0.19Ab 7.29±0.15Cc 8.21±0.20Ab 16 8.27±0.06Ca 8.13±0.09Da 6.13±0.10Bc 7.09±0.10Db 8.11±0.16Aa 24 8.88±0.66Ba 8.14±0.15Db 6.23±0.22Bd 7.00±0.09Dc 8.26±0.14Ab 注:大写字母表示不同投加量之间的差异性,小写字母表示不同钝化材料之间的差异性。 在复合重金属污染土壤中,除了考虑单一重金属的环境风险外,受元素共存的联合作用影响,本研究评价了多种重金属的总环境风险指数RI。除添加量为16 g·kg−1的A1处理外,其他处理均显著降低了土壤RI。由图7可知,A3材料在较高添加量(≥8 g·kg−1)时,土壤RI指数随着添加量的增加显著降低。施用A5材料且添加量为16 g·kg−1时土壤中Cu、Zn的总生态风险指数达到最低。
钝化完成后,通常根据土壤中重金属的修复效率来评价钝化材料的实际应用价值。添加酸改性凹凸棒石后,Cu的修复效率随着投加量的增加呈先升高后轻微降低的趋势(表6),当钝化材料的投加量为16 g·kg−1时,重金属Cu的修复效率明显高于其他处理组。其中,A3处理组的钝化修复效率最高,达11.96%。重金属Zn修复效率的变化趋势与Cu基本一致(表7),当向土壤中施加16 g·kg−1的酸改性凹凸棒石后,Zn的修复效率明显高于其他处理组。其中,A3处理组Zn的钝化修复效率最高,为27.70%。
表 6 不同添加量酸改性凹凸棒石钝化土壤中Cu的修复效率Table 6. The remediation ratio of Cu in soil stabilized with different amount of acid-modified attapulgite酸改性凹凸棒石添加量/(g·kg−1) RR/% A1 A2 A3 A4 A5 2 7.90±0.22Dc 7.48±0.26Cc 9.52±0.12Ca 8.55±0.58Cb 7.64±0.17Dc 4 8.56±0.12Cb 7.82±0.31BCc 9.74±0.25Ca 9.62±0.23BCa 8.55±0.26Cb 8 9.11±0.12Bcd 8.53±0.24Bd 10.20±0.45BCb 11.01±0.62ABa 9.76±0.20Bbc 16 11.51±0.30Aa 9.87±0.28Ab 11.96±0.93Aa 11.24±0.15Aab 11.15±0.32Aab 24 11.30±0.31Aab 9.47±0.88Ac 11.00±0.38Bab 11.58±0.60Aa 10.35±0.74Bbc 注:大写字母表示不同投加量之间的差异性,小写字母表示不同钝化材料之间的差异性。 表 7 不同添加量酸改性凹凸棒石钝化土壤中Zn的修复效率Table 7. The remediation ratio of Zn in soil stabilized with different amount of acid-modified attapulgite酸改性凹凸棒石添加量/(g·kg−1) RR/% A1 A2 A3 A4 A5 2 19.21±0.40Cc 20.83±0.38Cb 22.62±0.47Da 20.51±0.98Db 23.52±0.99Ca 4 21.20±0.48Bb 20.86±0.46Cb 24.86±1.00Ca 21.18±0.30CDb 25.63±0.30ABa 8 22.39±0.72ABb 22.50±0.60BCb 24.74±0.34Ca 21.97±0.52BCb 25.14±0.72BCa 16 23.55±0.12Ac 25.16±0.15Abc 27.70±0.11Aa 24.82±0.11Ac 27.40±0.14Aab 24 23.06±0.70Ab 22.91±0.15Bb 26.23±0.36Ba 23.06±0.39Bb 26.77±0.12ABa 注:大写字母表示不同投加量之间的差异性,小写字母表示不同钝化材料之间的差异性。 3. 结论
1)当H2SO4的体积分数为12.5%和15%,改性时间为72 h时,制得的酸改性凹凸棒石对Cu、Zn的钝化效果最佳,其最优投加量为16 g·kg−1。
2)向土壤中施加酸改性凹凸棒石,可显著降低重金属Cu、Zn的生物有效态质量分数,当钝化材料的投加量为16 g·kg−1时,H2O提取态Cu、Zn分别降低了25.91%~47.87%和49.69%~65%,DTPA提取态Cu、Zn分别降低了8.63%~24.30%和28.26%~46.84%。这说明,16 g·kg−1凹凸棒石可以有效降低Cu、Zn的生物有效性。
3)酸改性凹凸棒石的添加促使重金属Cu、Zn由活性较高的酸溶态向活性较低的残渣态转变,提高土壤重金属修复效率,当H2SO4的体积分数为12.5%,改性时间为72 h时,向土壤中投加16 g·kg−1酸改性凹凸棒石,Cu、Zn的修复效率最高,可达11.96%和27.70%,此时Zn的环境风险最低,降至6.13%,处于低风险。
-
表 1 不同种类氮源的固定化颗粒对比
Table 1. Comparison of immobilized particles with different types of nitrogen sources
氮源种类 颗粒颜色 材料脱落程度 是否黏连 破碎程度 培养基液体颜色状态 NH4Cl 中心白色、边缘透明 ++ N ++ 白色浑浊 NaNO3 白色 + Y + 白色浑浊、黏稠 尿素 白色 − N − 澄清透明 注:++表示严重;+表示轻微;−表示无;Y表示是;N表示否。 表 2 苯酚降解的动力学方程
Table 2. Kinetic equations of phenol degradation
苯酚初始质量浓度C/(mg·L−1) 动力学方程 速率常数k0/(mg·(L·h)−1) R2 100 C=−22.69t+100.61 22.69 0.976 200 C=−14.04t+174.64 14.04 0.914 300 C=−14.64t+283.8 14.64 0.995 500 C=−12.42t+480.26 12.42 0.991 -
[1] 康晓跃, 陈啊聪, 韦托, 等. 工艺组合对焦化废水中核心污染物的去除及其能耗分配[J]. 环境工程学报, 2022, 16(2): 684-696. [2] 张发奎. 微生物固定化技术强化焦化废水生化处理实验研究[D]. 兰州: 兰州交通大学, 2022. [3] 郑淑奇. 四株红球菌的分类鉴定及其降解多环芳烃的途径[D]. 呼和浩特: 内蒙古大学, 2023. [4] ZHU S N, LIU D Q, FAN L, et al. Degradation of quinoline by Rhodococcus sp. QL2 isolated from activated sludge[J]. Journal of Hazardous Materials, 2008, 160(2/3): 289-294. doi: 10.1016/j.jhazmat.2008.02.112 [5] 马馨月. 红球菌Rhodococcus sp. 及固定化对苯酚和苯胺去除机理研究[D]. 武汉: 武汉大学, 2020. [6] 刘欢. 淀粉/聚乙烯醇缓释碳源的制备及反硝化应用研究[D]. 济南: 山东建筑大学, 2020. [7] 冯文来, 赵平. 控制释放技术发展及展望[J]. 化学工业与工程, 1996, 13(1): 49-52. [8] WANG L, LIU X. Sustained release technology and its application in environmental remediation: A review[J]. International Journal of Environmental Research and Public Health, 2019, 16(12): 2153. doi: 10.3390/ijerph16122153 [9] XING Y, ZHANG D, CAI L, et al. An innovative double-layer microsphere used as slow-release carbon source for biological denitrification[J]. Water, Air, & Soil Pollution, 2020, 231(3): 1-12. [10] 王允, 张旭, 张大奕, 等. 用于地下水原位生物脱氮的缓释碳源材料性能研究[J]. 环境科学, 2008, 29(8): 2183-2188. [11] HSIA K F, CHEN C C, OU J H, et al. Treatment of petroleum hydrocarbon-polluted groundwater with innovative in situ sulfate-releasing biobarrier[J]. Journal of Cleaner Production, 2021, 295: 126424. doi: 10.1016/j.jclepro.2021.126424 [12] 许文帅. 固定化Rhodococcus sp. W7处理焦化废水的研究及应用[D]. 天津: 天津科技大学, 2021. [13] 刘童斌, 林鹏, 张晓明, 等. 阿托伐他汀钙缓释微球制备方法的优化[J]. 中国组织工程研究, 2022, 26(4): 535-539. [14] 常亚南, 刘浩, 冯成宝, 等. 人工软骨支架中TGF-β1缓释壳聚糖微球对ATDC-5细胞生长的促进作用[J]. 生物工程学报, 2017, 33(4): 664-671. [15] 吴国杰. 固定化载体材料壳聚糖基水凝胶的研究[D]. 西安: 西北工业大学, 2006. [16] 房玉婷. 强化降酚菌固定化微球的制备及性能研究[D]. 西安: 陕西科技大学, 2021. [17] ZHANG Y S, YU Z H, HU Y S, et al. Immobilization of nitrifying bacteria in magnetic PVA-SA-diatomite carrier for efficient removal of NH4+-N from effluents[J]. Environmental Technology & Innovation, 2021, 22: 101407. [18] ZAKERI Z, SALEHI R, MAHKAM M, et al. Optimization of argon-air DBD plasma-assisted grafting of polyacrylic acid on electrospun POSS-PCUU[J]. Journal of Physics and Chemistry of Solids, 2023, 178: 111311. doi: 10.1016/j.jpcs.2023.111311 [19] 李珍珍. 石油烃污染土壤固定化菌剂的缓释修复技术研究[D]. 成都: 西南石油大学, 2018. [20] 朱顺妮, 刘冬启, 樊丽, 等. 喹啉降解菌 Rhodococcus sp. QL2的分离鉴定及降解特性[J]. 环境科学, 2008,29(2): 2488-2493. [21] 邵钱. 基于固定化细胞的三相流化床反应器净化四氢呋喃废气的研究[D]. 杭州: 浙江工业大学, 2013. [22] 苗晓杰, 蒋恩臣, 王佳, 等. 对二甲氨基苯甲醛显色分光光度法检测水溶液中常微量尿素[J]. 东北农业大学学报, 2011, 42(8): 87-92. [23] CHANG C C , TSENG S K. Immobilization of Alcaligenes eutrophus using PVA crosslinked with sodium nitrate[J]. Biotechnology Techniques, 1998, 12(12): 865-868. [24] 茆云汉, 王建龙. 聚乙烯醇固定化微生物新方法的研究[J]. 环境科学学报, 2013, 33(2): 370-376. [25] 尹冬雪. 生物炭微生物缓释肥的制备与特性研究[D]. 长春: 吉林大学, 2020. [26] 高华崇, 乔丽丽, 尹莉, 等. 包埋微生物固定化载体的结构性能研究[J]. 能源环境保护, 2017, 31(1): 29-33. [27] JIANG Z, ZHENG Z, WU J, et al. Synthesis, characterization and performance of microorganism-embedded biocomposites of LDH-modified PVA/SA hydrogel beads for enhanced biological nitrogen removal process[J]. Process Biochemistry, 2022, 121: 542-552. doi: 10.1016/j.procbio.2022.07.033 [28] ARAFA E G, SABAA M W, MOHAMED R R, et al. Preparation of biodegradable sodium alginate/carboxymethylchitosan hydrogels for the slow-release of urea fertilizer and their antimicrobial activity[J]. Reactive and Functional Polymers, 2022, 174: 105243. doi: 10.1016/j.reactfunctpolym.2022.105243 [29] HEMALATHA K, SOMASHEKARAPPA H, SOMASHEKAR R. Preparation and characterization of MMT doped PVA/SA polymer composites[J]. Advances in Materials Physics and Chemistry, 2014, 4(9): 172-172. doi: 10.4236/ampc.2014.49020 [30] KAMOUN E A, KENAWY E R S, TAMER T M, et al. Poly (vinyl alcohol)-alginate physically crosslinked hydrogel membranes for wound dressing applications: characterization and bio-evaluation[J]. Arabian Journal of Chemistry, 2015, 8(1): 38-47. doi: 10.1016/j.arabjc.2013.12.003 [31] 谭炳琰, 储昭瑞, 吴桂荣, 等. PVA-SA水凝胶生物载体的制备及其性能研究[J]. 广州大学学报(自然科学版), 2018, 17(2): 81-87. [32] GOVEAS L C, SELVARAJ R, VINAYAGAM R, et al. Biodegradation of benzo (a) pyrene by Pseudomonas strains, isolated from petroleum refinery effluent: Degradation, inhibition kinetics and metabolic pathway[J]. Chemosphere, 2023, 321: 138066. doi: 10.1016/j.chemosphere.2023.138066 [33] SARAVANAN P, PAKSHIRAJAN K, SAHA P. Batch growth kinetics of an indigenous mixed microbial culture utilizing m-cresol as the sole carbon source[J]. Journal of Hazardous Materials, 2009, 162(1): 476-481. doi: 10.1016/j.jhazmat.2008.05.069 -






 DownLoad:
DownLoad: