-
对于草型湖泊型湿地,水生植物生长发育与环境相互作用改变水体的理化性质[1],从而加速水体营养盐的快速氧化分解[2]。水生植物在水生生态系统的营养循环、能量流动和水质净化方面发挥重要作用[3]。然而,水生植物进入衰亡腐败期,形成凋落物会积存于湖泊水体中[4]。凋落物腐败分解是水生生态系统发生的一个自然过程,分解释放的营养物质释放到上覆水中,迁移吸附至沉积层逐渐累积,且未完全分解的凋落物堆积在沉积物中,将直接影响水环境状况[4-5]。
凋落物分解过程中的养分释放及其对水环境的影响已有不少研究。王晓栋[6]研究了南四湖主要水生植物菹草、水花生、莲、香蒲和芦苇分解过程中主要污染物的释放规律,估算发现每年430.92 ×104 t水生植物分解总有机碳(total organic carbon, TOC)、TN、NH4+-N和TP最大释放量分别为56 245.73、14 145.82、3 945.38和1 575.46 t。WU等[7]研究发现,水葫芦、黑藻和香蒲凋落物分解造成水体处于厌氧状态,释放大量的TOC、TN、NH4+-N和TP显著影响水环境质量,尤其是对水体DO和TOC的影响最显著。此外,YUAN等[8]研究表明,水生植物分解可产生大量的DOM,水中过量的DOM会导致溶解氧量和污染率增加[9],对水质造成潜在风险。
DOM由两类不同分子特征的混合物组成[10],一类是较易降解的氨基酸、酚类和有机酸等蛋白类物质,另一类是较难降解的类腐殖酸和类富里酸物质[11]。不同凋落物分解产生的DOM组分和含量不同[11-12],导致水体有机物污染程度不同[13]。因此,DOM组分和含量对上覆水水质有重要影响。WU等[14]研究发现香蒲凋落物分解过程上覆水中DOM质量浓度随着生物量增加而升高。ZHANG等[12]研究发现不同生物量凋落物分解产生的DOM组分和含量不同。然而,较少研究不同生物量凋落物分解过程中DOM的释放过程和结构特征的变化,以及其对水体有机物污染的影响程度。
水生植物的生物量和种类决定了植物自身营养物质含量不同,会导致其凋落物分解释放的DOM特性不同。沉水植物、浮游植物和挺水植物广泛分布于湿地水生生态系统,对水生生态系统产生重大影响。因此,以金鱼藻、菹草、浮萍和睡莲为代表进行分解实验,分析不同生物量凋落物分解过程中DOM的释放特征以及COD释放量与分解时间的关系,预测凋落物分解对水体有机物污染影响程度。研究结果可为水质恢复中湿地植物的种植密度和植物凋落物管理提供技术指导。
-
以金鱼藻、菹草、浮萍和睡莲为代表进行分解实验。植物与底泥均采自华北地区最典型的草型湖泊湿地——白洋淀。收集的植物凋落物用自来水冲洗去除表面杂质,风干3 d并置于85 ℃的烘箱中烘干至恒重,将其剪成约1 cm长的碎片,均匀混合茎、叶后置于干燥器内以备使用。测试烘干后的初始植物凋落物C、N含量(平均值±标准差,n=3),结果见表1。
-
设置3个生物量密度,分别为0.1、0.5、1.0 g·L−1(以干质量记)。用100目尼龙网袋(孔径0.2 mm,10 cm×10 cm)将不同干质量的烘干植物凋落物包裹后,置于容量为2 L含0.2 L白洋淀底泥(约2 cm高,C含量为2.04%)的塑料烧杯中模拟凋落物分解。所有植物凋落物均浸于水下,置于底泥上。然后缓慢加入2 L自来水,放置2 d,自来水与底泥进行充分传质模拟湿地上体,水温为11 ℃,初始TOC质量浓度为23.82 mg·L−1,COD值为13.55 mg·L−1。以不含植物凋落物样品为空白对照组,于第0、2、4、8、15、30、45和60天进行采样监测,并补充等量的自来水。
-
植物凋落物中的碳和氮、底泥中的碳使用元素分析仪(Vario MACRO Cube)测定。根据国家标准方法(国家环保总局《水和废水监测分析方法》第四版)测定化学需氧量(COD)。使用岛津TOC分析仪采用燃烧氧化-非分散红外吸收法测定溶解态的TOC,TOC的质量浓度可以近似用来表示DOM的质量浓度。所有测量重复3次,取平均值。
利用紫外-可见光分光光度计(U-3900)分析DOM吸收特性,以超纯水作为空白样进行校正,使用1 cm的石英器皿测定200~700 nm内的吸光度,选择紫外参数SUVA254(254 nm的吸光度乘以100与DOC的比值,与DOM相对分子质量和芳香化程度成正比[10])分析DOM特性的变化。采用荧光分光光度计(日立F-700)表征DOM的类型和三维荧光光谱(excitation-emission matrix spectroscopy, EEMs),配以1 cm石英比色皿,150 W氙灯为激发光源,PMT电压为700 V,水样过0.45 μm微孔滤膜,激发波长为200~450 nm,发射波长为250~600 nm,狭缝宽带为5 nm,扫描速率为2 400 nm·min−1,响应时间设置为自动。所有光谱需减去由超纯水测定的空白光谱[15],并结合Delaunnay三角形内插值法修正去除拉曼峰散射和瑞利散射[16]。采用寻峰法确定荧光峰类型。所有样品均在室温(25 ℃)下测定,样品所有参数的测定均在同一天内完成。
-
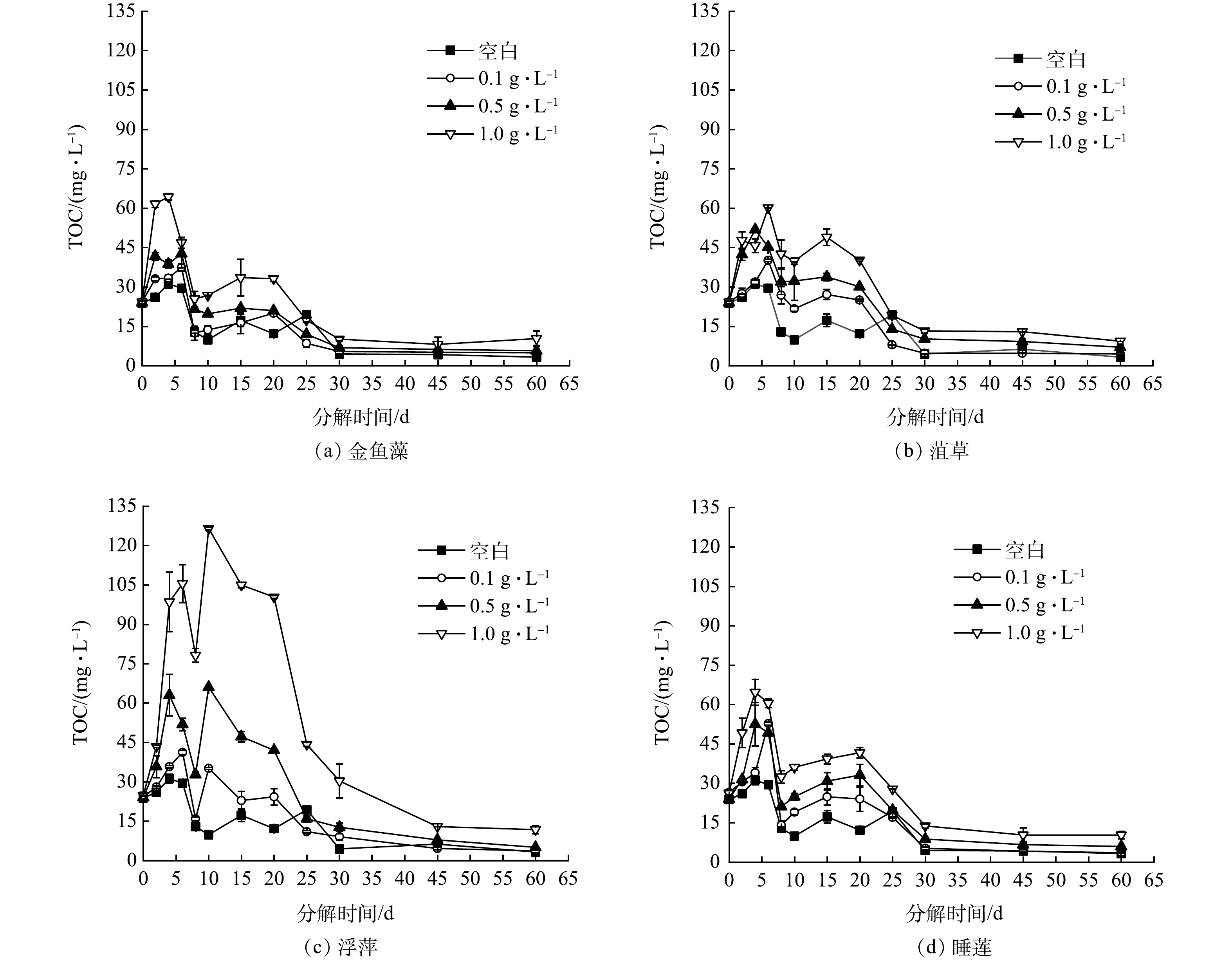
如图1所示,不同生物量下4种水生植物分解过程中上覆水DOM质量浓度变化趋势相似,先迅速增加(0~15 d)后下降(15~30 d)直至相对稳定(30~60 d),说明凋落物分解对水体有机物的影响呈阶段性。本研究上覆水中DOM质量浓度变化与ZHANG等[12]对狐尾藻分解的研究结果不同,说明不同种凋落物分解对DOM的影响具有差异性。DOM质量浓度随着生物量的增加而逐渐增加,即分解释放的有机物量越多,尤其是在分解初期(0~15 d)和分解缓慢期(15~30 d)对水质的影响最大。这可能与大量凋落物表面可溶性有机物(多糖和羧酸)的快速溶出有关[14]。分解相对稳定期(30~60 d)可能由于未分解部分凋落物的减少或被微生物利用[17]对上覆水DOM质量浓度的影响较小,但在分解结束时(60 d),高生物量(≥0.5 g·L−1)的凋落物分解体系DOM质量浓度均远高于空白(3.26 mg·L−1),说明高生物量加速凋落物分解营养物质释放[14],使得分解对水体有机物污染有明显影响。整个分解实验过程中,对照组DOM质量浓度(26.13~31.25 mg·L−1)仅在2~6 d高于初始值(23.82 mg·L−1),其余分解时期质量浓度较低(3.26~19.34 mg·L−1),说明沉积物中有机物发生缓慢释放,但沉积物中有机物释放量对凋落物分解实验影响较小。本研究不同生物量对上覆水DOM质量浓度的影响与WU等[7]研究结果一致。浮萍分解对上覆水有机物的影响程度远大于其余植物,在生物量为0.1、0.5、1.0 g·L−1时,DOM质量浓度最大值分别达到35.78、63.01、104.95 mg·L−1。这可能由于凋落物C、N含量、C/N值以及结构特征不同,从而导致凋落物分解速率不同[18],使得不同种凋落物分解对上覆水DOM质量浓度的影响具有差异性。
-
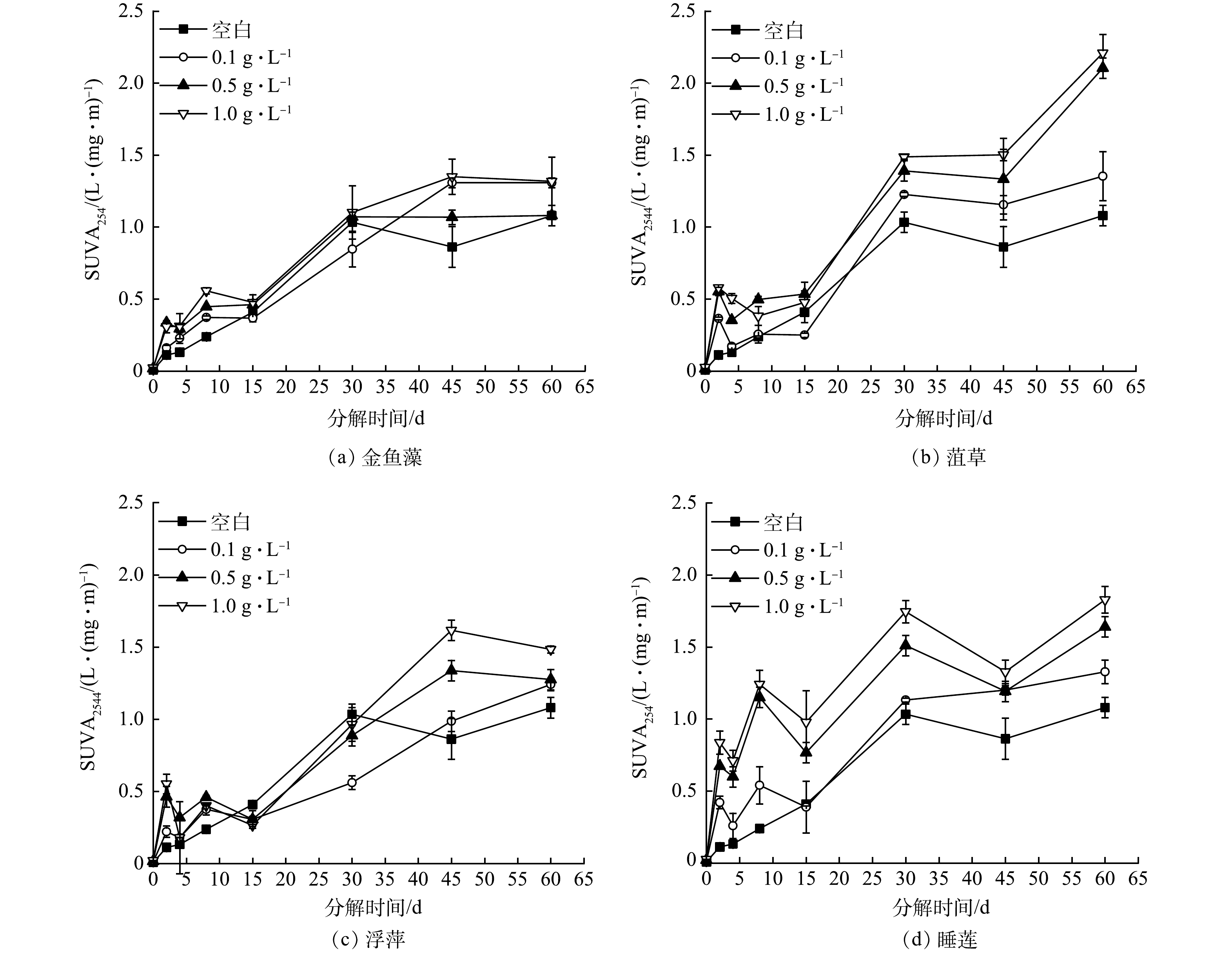
不同生物量下4种水生植物分解过程中上覆水DOM的SUVA254值变化如图2所示。可见,所有样品的SUVA254值逐渐增大,说明上覆水中难降解的腐殖质类物质比例逐步升高[4],但上覆水DOM呈现低腐殖化、低芳香化特征[19]。SUVA254值随着生物量的增加而逐渐增加,即上覆水中难降解有机物越多,尤其是分解相对稳定期(30~60 d),凋落物分解速率下降[12],分解残留的凋落物含有大量的难降解物质以及微生物利用易降解有机物导致的难降解有机物累积,最终可能造成水环境可生化性变差[20]。高生物量(≥0.5 g·L−1)的凋落物分解体系DOM芳香化程度为菹草(0.02~2.21)>睡莲(0.02~1.83)>浮萍(0.02~1.62)>金鱼藻(0.02~1.32),而且分解结束时(60 d),菹草分解体系SUVA254值(超过2.0)最大,可能与参与分解的微生物群落不同有关[12],从而造成凋落物分解的差异[21]。这说明菹草分解体系中大分子质量DOM较多,有机质较稳定,不易被微生物降解,更可能加剧水体腐殖化程度。本研究上覆水中DOM的吸收特性与洪志强等[19]对水生植物分解的研究结果不同,说明不同种凋落物分解释放的DOM特性具有差异性。
-
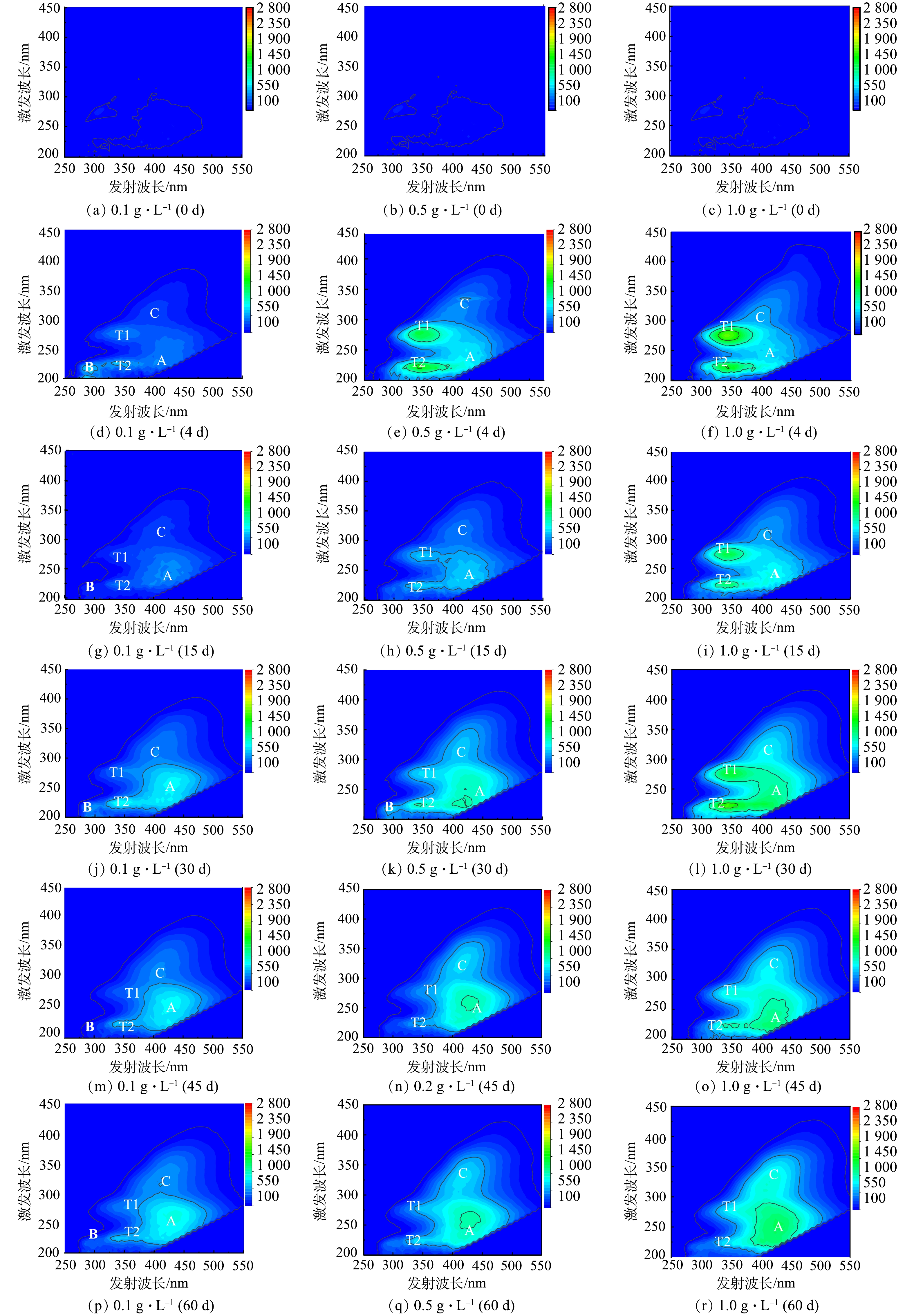
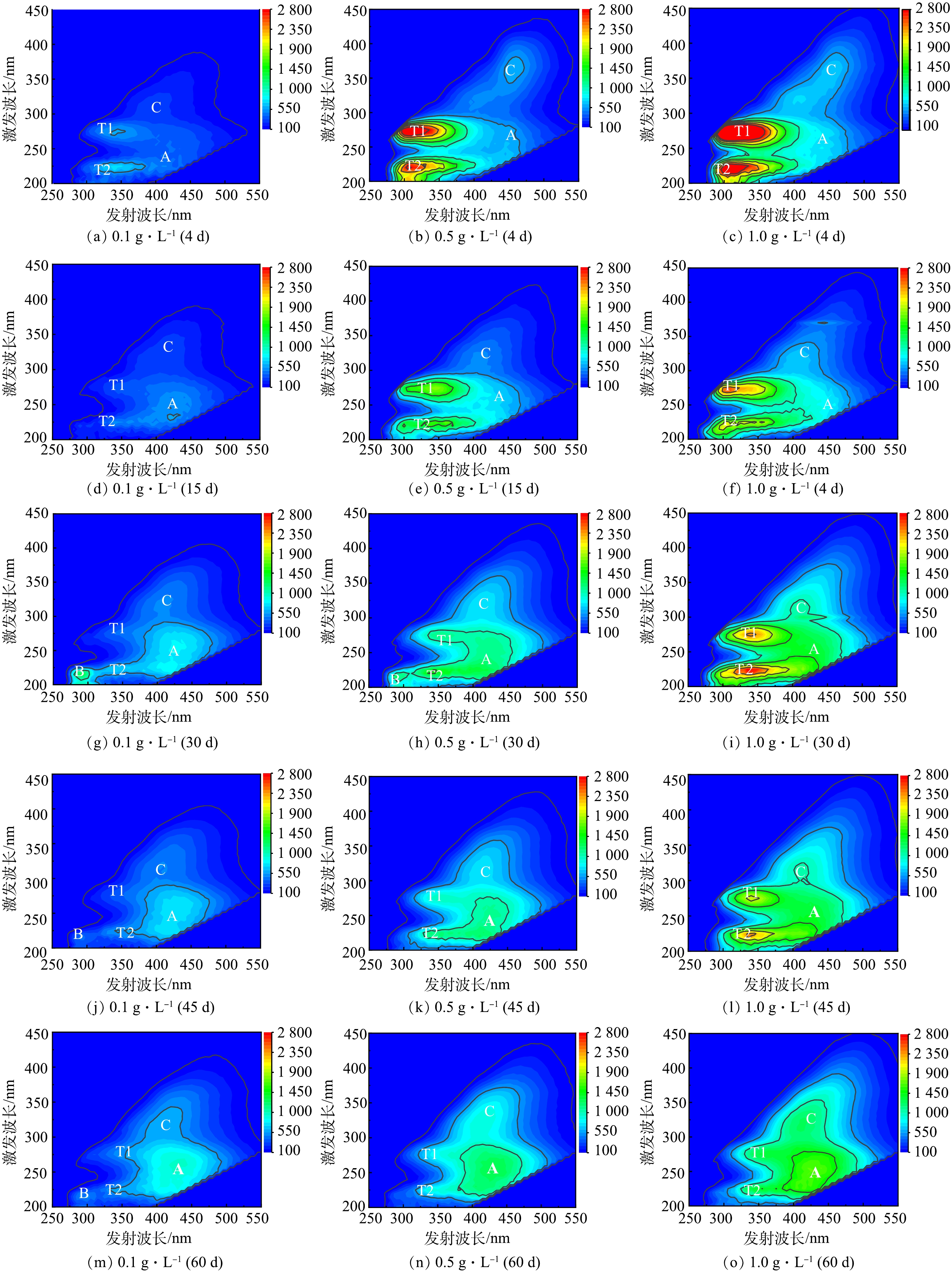
不同生物量下4种水生植物分解过程上覆水DOM的EEMs如图3、图4、图5和图6所示。可见,与高生物量(1.0 g·L−1)相比,低生物量(0.1 g·L−1和0.5 g·L−1)下4种水生植物分解过程上覆水DOM的EEMs种多检出1个峰B,其余均检测出4个明显的荧光峰(峰T1、T2、A、C),但荧光强度值不同。DOM各类荧光组分相对应的荧光峰激发波长和发射波长见表2。EEMs分析结果表明,DOM各类荧光峰的强度大小随着生物量的增加而逐渐增强,与紫外吸收参数SUVA254值分析结果一致(图2)。分解初期(0~15 d),高生物量显著促进凋落物分解释放易降解的类蛋白物质(峰T1和峰T2),尤其是浮萍凋落物分解释放的有机物最多(图1);分解相对稳定期(30~60 d),高生物量显著促进凋落物分解释放难降解的类富里酸和类腐殖酸物质(峰A和峰C),加剧上覆水的腐殖化程度,尤其是菹草凋落物(峰A和峰C荧光强度最强)。
凋落物分解过程中上覆水DOM不同组分在水环境中发挥着不同的作用。分解初期(0~15 d),上覆水DOM以峰T1、T2和B这2类蛋白质为主,此时DOM稳定性弱,其可降解性高,分解与移动速度快[22],其中,类色氨酸组分很可能是水体COD的重要来源[23]。15 d后峰T1、T2和B荧光强度减弱,峰A和C荧光强度逐渐增强。在分解相对稳定期(30~60 d),难降解的腐殖质物质逐渐积累[12],荧光峰强度大小为A峰>C峰>T1峰>T2峰>B峰。这说明类富里酸物质和类腐殖酸物质是凋落物分解过程中上覆水DOM的主要组分,此时上覆水DOM稳定性增强,其可降解性低,对COD的贡献不明显[24],但大量存在会导致水体的可生化性变差[20]。
因此,DOM组分和含量对水环境质量可能造成潜在的风险,这与YUAN等[8]研究结果一致。此外,DOM结构特性的变化能引起微生物活性变化[25],进而影响水生生态系统的新陈代谢以及有机碳循环[26],最终影响碳是否留在沉积物中或返回大气[27-28]。
-
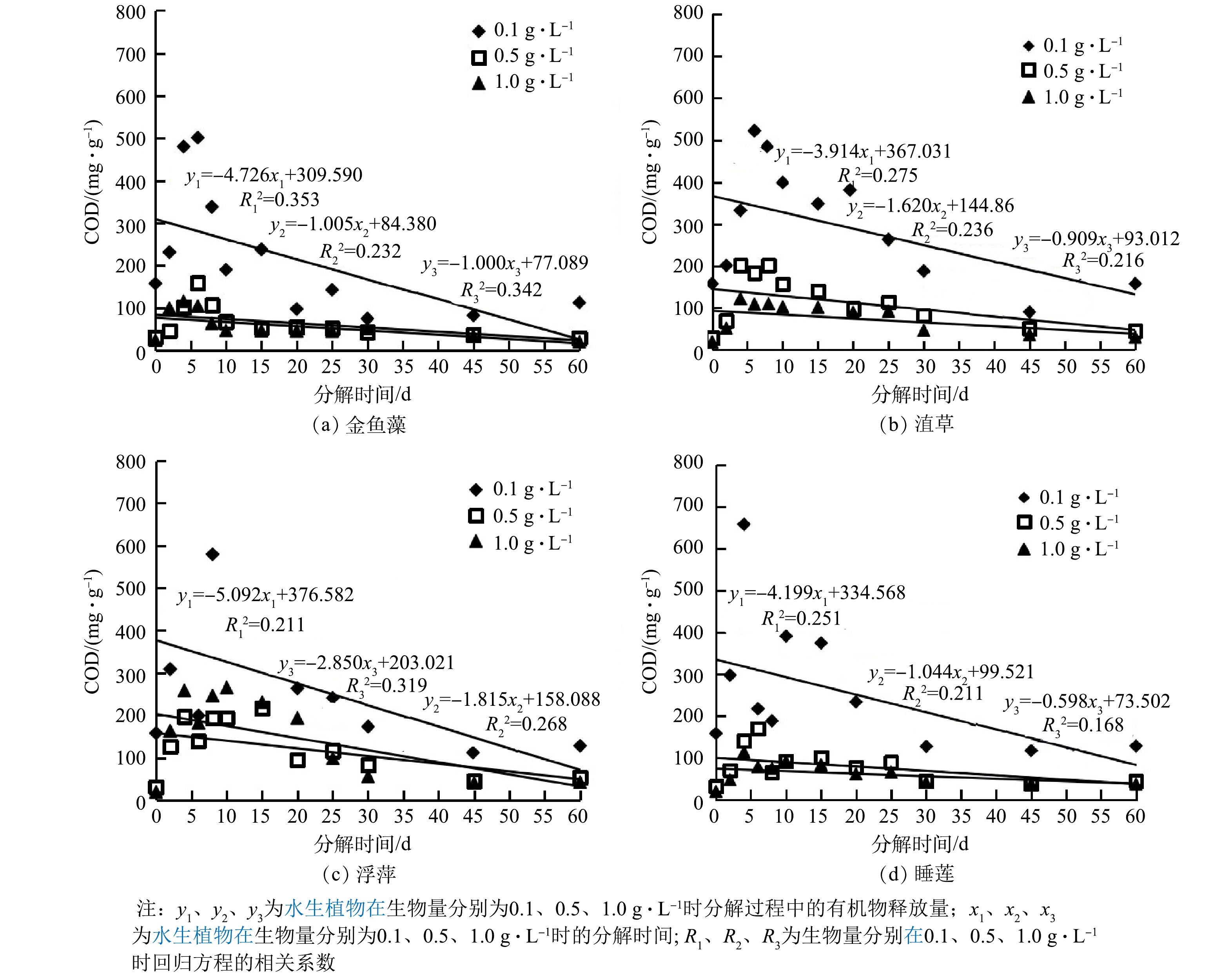
本研究采用室内模拟凋落物分解,没有外源污染进入,所以水体污染加重的影响只有植物凋落物本身。同时,凋落物分解实验是在同一地点、尽量避光等环境下进行的,影响凋落物分解的关键因素存在较小的差异,所以仅有凋落物分解释放的DOM与分解时间2个变量。在水生生态环境中,COD常用来评价水体有机物的污染程度[29]。因此,采用线性回归分析COD释放量与分解时间的关系。利用SPSS 20.0进行回归分析,得出的回归分析结果见图7。随着生物量增加,COD释放量下降速率(k)变慢,说明更多的凋落物分解产生更多的有机物(图1),但可利用有机物减少(图2、图3、图4、图5和图6),加重了水体有机物污染。随着分解时间的延长,浮萍分解体系COD释放量下降速率(k≥1.815)最快,菹草和睡莲(1.0 g·L−1)分解体系COD释放量下降速率(k<1.000)最慢,说明浮萍凋落物分解产生更多的有机物(图1和图5)可被微生物利用,但菹草和睡莲产生的可利用有机物较少,而难降解有机物逐渐积累(图1、图4和图6)。这与紫外吸收参数SUVA254值和EEMs分析结果一致。
不同生物量下4种水生植物对水体有机物污染程度有较大差异。金鱼藻凋落物分解对水体有机物污染影响程度较小(1 g干质量凋落物分解COD释放量最大值为501.80 mg),持续时间短(水体有机物含量最先达到最小值);浮萍对水体有机物污染影响程度较大(1 g干质量凋落物分解COD释放量最大值为805.75 mg),持续时间短(1.815≤k≤5.092),影响时间相对集中(分解初期COD释放量最大,之后快速下降至最小);菹草和睡莲对水体有机物污染持续时间长,影响程度深,累积效应更大(图1、图4和图6)。因此,金鱼藻和浮萍凋落物分解对水体有机物的贡献主要在前期,菹草和和睡莲凋落物分解对水体有机物的贡献主要在后期。
-
在“双碳”目标背景下,碳元素在湿地水生生态系统的循环得到重视。本研究发现,植物凋落物生物量、种类以及凋落物分解时期会影响其向上覆水的碳输入,同时输入新鲜的有机碳可能影响上覆水有机碳的分解模式(矿化或腐殖化)[28],从而影响有机碳最终的去处,是通过吸附沉降至沉积物中还是以CH4和CO2的形式离开湿地体系。例如,高生物量(≥0.5 g·L−1)的浮萍凋落物在分解初期(0~15 d)上覆水中易降解有机物含量多,易降解有机物发生矿化作用使得碳元素以CH4和CO2的形式离开湿地体系,此时水生植物腐烂分解使湿地成为大气温室气体的“源”[30];而高生物量(≥0.5 g·L−1)的菹草凋落物在分解相对稳定期(30~60 d)上覆水中难降解有机物含量增加,其可在吸附沉降至沉积物中累积,此时水生植物腐烂分解使湿地成为“碳汇”,但沉降到沉积物中的大量有机物进行厌氧分解,形成大量的CH4和CO2气体[31],又使湿地成为碳源。邓焕广等[30]和张新厚[32]研究也表明湿地水生植物凋落物分解是大气温室气体的“源”。此外,没有形成气体排出的碳以自身吸附沉降的方式在沉积物中累积,会增加沉积物腐殖化程度,影响其与有机污染物的相互作用[19],甚至很可能成为湿地水体难降解DOM的一个重要内源。因此,为避免大量植物凋落物分解造成的潜在风险,应及时控制水体中植物凋落物量。
-
1)在不同生物量下4种水生植物分解过程中上覆水DOM质量浓度变化趋势相似,0~15 d迅速增加,随后下降直至30~60 d达到相对稳定,但也表现出各自的释放特征。有机物释放量为浮萍>睡莲>菹草>金鱼藻,DOM芳香化程度为菹草>睡莲>浮萍>金鱼藻。
2)凋落物分解过程中上覆水DOM质量浓度和结构特性因生物量、植物种类和分解时期不同存在显著差异。DOM质量浓度随着生物量增加而增加,对水体有机物污染程度越大和持续时间越久(下降速率k变慢)。高生物量(≥0.5 g·L−1)凋落物分解体系易降解的类蛋白物质(0~15 d)与难降解的类富里酸、类腐殖酸有机物(30~60 d)含量显著增加。
3)凋落物分解过程中上覆水DOM不同组分在水环境中发挥着不同的作用。0~15 d,DOM以易降解的类蛋白有机物为主,COD释放量显著增加;30~60 d,难降解的类富里酸和类腐殖酸有机物含量逐渐增加,对COD贡献不明显,但可能加剧水体腐殖化程度。因此,为避免大量植物凋落物分解造成的潜在风险,应及时控制水体中植物凋落物量。
不同种类水生植物分解过程中溶解性有机物的释放特征
Release characteristics of dissolved organic matter during decomposition of different aquatic plants
-
摘要: 为研究水生植物分解对水体有机物污染的影响,对不同生物量(0.1、0.5、1.0 g·L−1)下金鱼藻、菹草、浮萍和睡莲凋落物分解过程中溶解性有机物(dissolved organic matter, DOM)的释放特征进行了研究。结果表明,不同生物量下4种水生植物分解过程中上覆水DOM质量浓度变化趋势相似,0~15 d迅速增加,15~60 d缓慢下降直至相对稳定。有机物释放量为浮萍>睡莲>菹草>金鱼藻,DOM芳香化程度为菹草>睡莲>浮萍>金鱼藻。0~15 d,DOM以易降解的类蛋白有机物为主,此时COD释放量显著增加;30~60 d,难降解的类富里酸和类腐殖酸有机物含量逐渐增加,对COD贡献不明显。DOM质量浓度随着生物量的增加而逐渐增加。高生物量(≥0.5 g·L−1)凋落物分解体系易降解的类蛋白物质(0~15 d)与难降解的类富里酸、类腐殖酸有机物(30~60 d)含量显著增加。分析发现植物凋落物生物量、种类以及凋落物分解时期可影响DOM质量浓度和特性,进而可能影响水体有机物的污染状况。因此,为避免大量植物凋落物分解造成的潜在风险,应及时控制水体中植物凋落物量。Abstract: In order to study the effect of decomposition of aquatic plants on organic matters pollution in water body, the release characteristics of dissolved organic matter during the decomposition of litters of Ceratophyllum demersum L., Potamogeton crispus L., Lemna minor L. and Nymphaea tetragona L. at different biomass levels (0.1, 0.5, 1.0 g·L−1) were investigated. Results suggested that the variation trend of DOM mass concentration in the overlying water was similar during decomposition process of four aquatic plants with different biomass levels, a rapid increase from 0 to 15 d followed by a slow decrease until relatively stable from 15 to 60 d.The release of organic matters was Lemna minor L.>Nymphaea tetragona L.>Potamogeton crispus L.>Ceratophyllum demersum L., and the humification degree of DOM was Potamogeton crispus L.>Nymphaea tetragona L.>Lemna minor L.>Ceratophyllum demersum L. From 0 to 15 d, DOM was dominated by the easily biodegradable protein-like organic matters, and COD release increased significantly. From 30 to 60 d, the amount of the difficultly biodegradable fulvic acid-like and humic acid-like organic matters increased gradually, while their contribution to COD was not obvious. DOM mass concentration increased gradually with the increase of biomass levels. In high biomass (≥0.5 g·L−1) litter decomposition system, the content of easily biodegradable protein-like organic matters (0~15 d) and difficultly biodegradable fulvic acid-like and humic acid-like organic matters (30~60 d) increased significantly. The results showed that biomass levels, species and decomposition period of plant litters affected the mass concentration and characteristics of DOM, then they affect organic matters pollution of water body. Therefore, to avoid the potential risk caused by a large number of plant litter decomposition, the amount of plant litter in water body should be controlled in time.
-
Key words:
- aquatic plants /
- biomass levels /
- dissolved organic matter /
- release characteristics
-

-
表 1 植物凋落物中C和N含量
Table 1. Contents of C and N in plant litters
植物凋落物 C/% N/% C/N 金鱼藻 37.53±0.59 3.19±0.28 12:1 菹草 39.33±1.03 3.83±0.34 10:1 浮萍. 40.04±0.18 2.03±0.01 20:1 睡莲 39.46±0.86 3.39±0.11 11:1 -
[1] GAO J Q, XIONG Z T, ZHANG J D, et al. Phosphorus removal from water of eutrophic Lake Donghu by five submerged macrophytes[J]. Desalination, 2009, 242(1/2/3): 193-204. [2] 李俊, 李科林. 水生植物处理污染水研究现状及应用前景[J]. 安徽农业科学, 2007, 35(34): 11159-11161. doi: 10.3969/j.issn.0517-6611.2007.34.099 [3] LI W T, CHEN S Y, XU Z X, et al. Characterization of dissolved organic matter in municipal wastewater using fluorescence PARAFAC analysis and chromatography multi-excitation/emission scan: a comparative study[J]. Environmental Science & Technology, 2014, 48(5): 2603-2609. [4] 刘新, 刘浩, 江和龙, 等. 不同水生植物腐解过程中有色可溶有机物 (CDOM) 的产生过程及微生物群落变化分析[J]. 长江流域资源与环境, 2020, 29(5): 1140-1149. [5] 汪琪. 4种大型水生植物腐烂分解过程研究[D]. 淮南: 安徽理工大学, 2020. [6] 王晓栋. 南四湖主要水生植物腐烂过程及污染释放通量研究[D]. 济南: 山东建筑大学, 2019. [7] WU S Q, HE S B, ZHOU W L, et al. Decomposition characteristics of three different kinds of aquatic macrophytes and their potential application as carbon resource in constructed wetland[J]. Environmental Pollution, 2017, 231(1): 1122-1133. [8] YUAN D H, GUO X J, WEN L, et al. Detection of copper (II) and cadmium (II) binding to dissolved organic matter from macrophyte decomposition by fluorescence excitation-emission matrix spectra combined with parallel factor analysis[J]. Environmental Pollution, 2015, 204: 152-160. doi: 10.1016/j.envpol.2015.04.030 [9] CHIBA DE CASTRO W A, CUNHA-SANTINO M B, BIANCHINI J. Anaerobic decomposition of a native and an exotic submersed macrophyte in two tropical reservoirs[J]. Brazilian Journal of Biology, 2017, 73(2): 299-307. [10] LI P H, HUR J. Utilization of UV-Vis spectroscopy and related data analysis for dissolved organic matter (DOM) studies: A review[J]. Critical Reviews in Environmental Science and Technology, 2017, 47(3): 131-154. doi: 10.1080/10643389.2017.1309186 [11] 于莉莉. 富营养化湖泊植物源溶解性有机质光降解行为及影响因素[D]. 哈尔滨: 东北林业大学, 2020. [12] ZHANG L S, ZHANG S H, LV X Y, et al. Dissolved organic matter release in overlying water and bacterial community shifts in biofilm during the decomposition of Myriophyllum verticillatum[J]. Science of the Total Environment, 2018, 633: 929-937. doi: 10.1016/j.scitotenv.2018.03.275 [13] 杨枫. 滇池COD特征及升高原因解析[D]. 北京: 中国环境科学研究院, 2017. [14] WU S Q, HE S B, HUANG J C, et al. Decomposition of emergent aquatic plant (Cattail) litter under different conditions and the influence on water quality[J]. Water, Air, & Soil Pollution, 2017, 228 (2) : 1-14. [15] HUDSON N, BAKER A, REYNOLDS D. Fluorescence analysis of dissolved organic matter in natural, waste and polluted waters—a review[J]. River Research and Applications, 2007, 23(6): 631-649. doi: 10.1002/rra.1005 [16] ZEPP R G, SHELDON W M, MORAN M A. Dissolved organic fluorophores in southeastern US coastal waters: correction method for eliminating Rayleigh and Raman scattering peaks in excitation-emission matrices[J]. Marine chemistry, 2004, 89(1): 15-36. [17] WU H, LU X, YANG Q, et al. The early stage litter decomposition and its influencing factors in the wetland of the Sanjiang Plain, China[J]. Acta Ecologica Sicica, 2007, 7(10): 4027-4035. [18] 曹培培, 刘茂松, 唐金艳, 等. 几种水生植物腐解过程的比较研究[J]. 生态学报, 2014, 34(14): 3848-3858. [19] 洪志强, 熊瑛, 李艳, 等. 白洋淀沉水植物腐解释放溶解性有机物光谱特性[J]. 生态学报, 2016, 36(19): 6308-6317. [20] 杜伊, 胡玮璇, 王晓燕, 等. 北京市北运河水体中化学需氧量组分含量及其可生化性研究[J]. 湿地科学, 2017, 15(3): 470-477. doi: 10.13248/j.cnki.wetlandsci.2017.03.022 [21] MIGLIORINI G H, ROMERO G Q. Warming and leaf litter functional diversity, not litter quality, drive decomposition in a freshwater ecosystem[J]. Scientific Reports, 2020, 10(1): 20333. doi: 10.1038/s41598-020-77382-7 [22] FELLMAN J B, HOOD E, SPENCER R G M. Fluorescence spectroscopy opens new windows into dissolved organic matter dynamics in freshwater ecosystems: A review[J]. Limnology and Oceanography, 2010, 55(6): 2452-2462. doi: 10.4319/lo.2010.55.6.2452 [23] AOKI S, FUSE Y, YAMADA E. Determinations of humic substances and other dissolved organic matter and their effects on the increase of COD in Lake Biwa[J]. Analytical Sciences, 2004, 20(1): 159-164. doi: 10.2116/analsci.20.159 [24] GUO W D, XU J, WANG J P, et al. Characterization of dissolved organic matter in urban sewage using excitation emission matrix fluorescence spectroscopy and parallel factor analysis[J]. Journal of Environmental Sciences, 2010, 22(11): 1728-1734. doi: 10.1016/S1001-0742(09)60312-0 [25] 王彤, 文刚, 黄廷林, 等. 水库热分层期沉积物中有机物特性及对好氧反硝化细菌脱氮的影响[J]. 环境科学, 2020, 41(11): 5027-5036. doi: 10.13227/j.hjkx.202004250 [26] HOSEN J D, MCDONOUGH O T, FEBRIA C M, et al. Dissolved organic matter quality and bioavailability changes across an urbanization gradient in headwater streams[J]. Environmental Science & Technology, 2014, 48(14): 7817-7824. [27] YAN J F, WANG L, HU Y, et al. Plant litter composition selects different soil microbial structures and in turn drives different litter decomposition pattern and soil carbon sequestration capability[J]. Geoderma, 2018, 319: 194-203. doi: 10.1016/j.geoderma.2018.01.009 [28] 闫兴成, 张重乾, 季铭, 等. 富营养化湖泊夏季表层水体温室气体浓度及其影响因[J]. 湖泊科学, 2018, 30(5): 1420-1428. doi: 10.18307/2018.0523 [29] 张运林, 朱广伟, 秦伯强, 等. 有色可溶性有机物 (CDOM) 吸收作为湖库化学需氧量监测替代指标的探讨[J]. 湖泊科学, 2020, 32(6): 1575-1584. doi: 10.18307/2020.0602 [30] 邓焕广, 张智博, 刘涛, 等. 城市湖泊不同水生植被区水体温室气体溶存浓度及其影响因素[J]. 湖泊科学, 2019, 31(4): 1055-1063. doi: 10.18307/2019.0409 [31] 王荣欣. 白洋淀典型水生植物腐解水质变化特征与元素释放、归趋分析[D]. 郑州: 华北水利水电大学, 2022. [32] 张新厚. 三江平原湿地植物立枯分解研究[D]. 长春: 中国科学院研究生院 (东北地理与农业生态研究所) , 2015. -



 下载:
下载: