-
污染物通常是以多种共存的形式被释放在生态系统中,一般具有伴生性和综合性[1]。因此,某一污染物在生态系统(土壤、水体、沉积物等)中的吸附行为必定会受到其他共存污染物的影响。共存的多环芳烃和重金属是环境中典型的2种污染物[2-3]。多环芳烃由2个或2个以上的碳和氢原子的聚合芳香烃环组成,其分子质量越大,水溶性越低,属于难降解的持久性有机污染物[4-5]。重金属-多环芳烃复合污染主要来源于家庭和工业废物不完全燃烧,直接或间接从空气和水中释放进入河流和土壤中[6]。根据重金属和多环芳烃与吸附剂结合方式的不同,重金属和多环芳烃之间可能存在的作用有互不影响、竞争吸附、共沉淀等[7]。二者在环境中的滞留会产生严重的生物毒性危及所有生物,并且研究发现复合污染的毒性机理也更加复杂。所以探究复合污染吸附影响机制刻不容缓。
生物膜能够有效结合重金属且对有机污染物具有较强的亲和力。水体生物膜由微生物和细胞外聚合物质组成,通常存在于几乎所有水生环境系统中[8-9]。有研究[10-11]表明,生物膜对有机污染物(包括疏水性和亲水性)的吸附与生物膜的有机质含量呈线性相关,有机质部分被认为是影响生物膜吸附的一个重要因素。不同水体、不同季节生长的生物膜被认为是微量污染吸附的关键因素[12]。HUANG等[13]研究发现生物膜对微量有机污染物的吸附机理较为复杂,吸附可由静电、阳离子交换和络合相互作用等多种机制参与。重金属对疏水性有机污染物的吸附存在争议,有研究[14]表明,重金属通过与疏水性有机污染物争夺吸附表面活性位点来抑制疏水性有机污染物的吸附。有研究表明,某些重金属如Ag+、Cu2+、Fe3+和Cd2+有助于芳香族有机化合物(多环芳香烃在木质碳[15]、蓝藻[16]和细菌[17])的吸附。
目前,重金属和多环芳烃复合污染对生物膜吸附性能的影响机制仍不清楚。因此,本研究选取新疆乌鲁木齐市某含油污水库的生物膜,以镉Cd(Ⅱ)和菲(PHE)为重金属和PAHs的模型化合物,探究了污水生物膜在有Cd2+和无Cd2+条件下对PHE的吸附影响及机理,以期能为新疆含油污染水体中重金属-多环芳烃复合污染防治提供参考。
-
主要化学试剂包括PHE、氯化钾、甲醇、盐酸、氢氧化钠均购自天津市北联精细化学品开发有限公司,均为AR级;叠氮化纳、硝酸镉购自国家有色金属及电子材料分析测试中心,均为AR级。
主要仪器:101-2AB电热鼓风干燥箱(天津市泰斯特仪器有限公司);AL204分析天平(梅特勒-托利多仪器有限公司);ZHTY-70V恒温振荡器(上海知楚仪器有限公司);HITACHI U-3310紫外光谱分析仪(天美科技有限公司)。
-
采用扫描电子显微镜(SEM,JSM7610FPlus,日本)分析样品表面的形态、样貌等微观结构;采用傅立叶变换红外光谱仪(FT-IR,TENSOR 27,德国)用于分析样品的官能团结构,在4 000~400 cm−1内进行测试;采用X射线光电子能谱(XPS,赛默飞世尔,美国)测定样品表面元素及其价态。
-
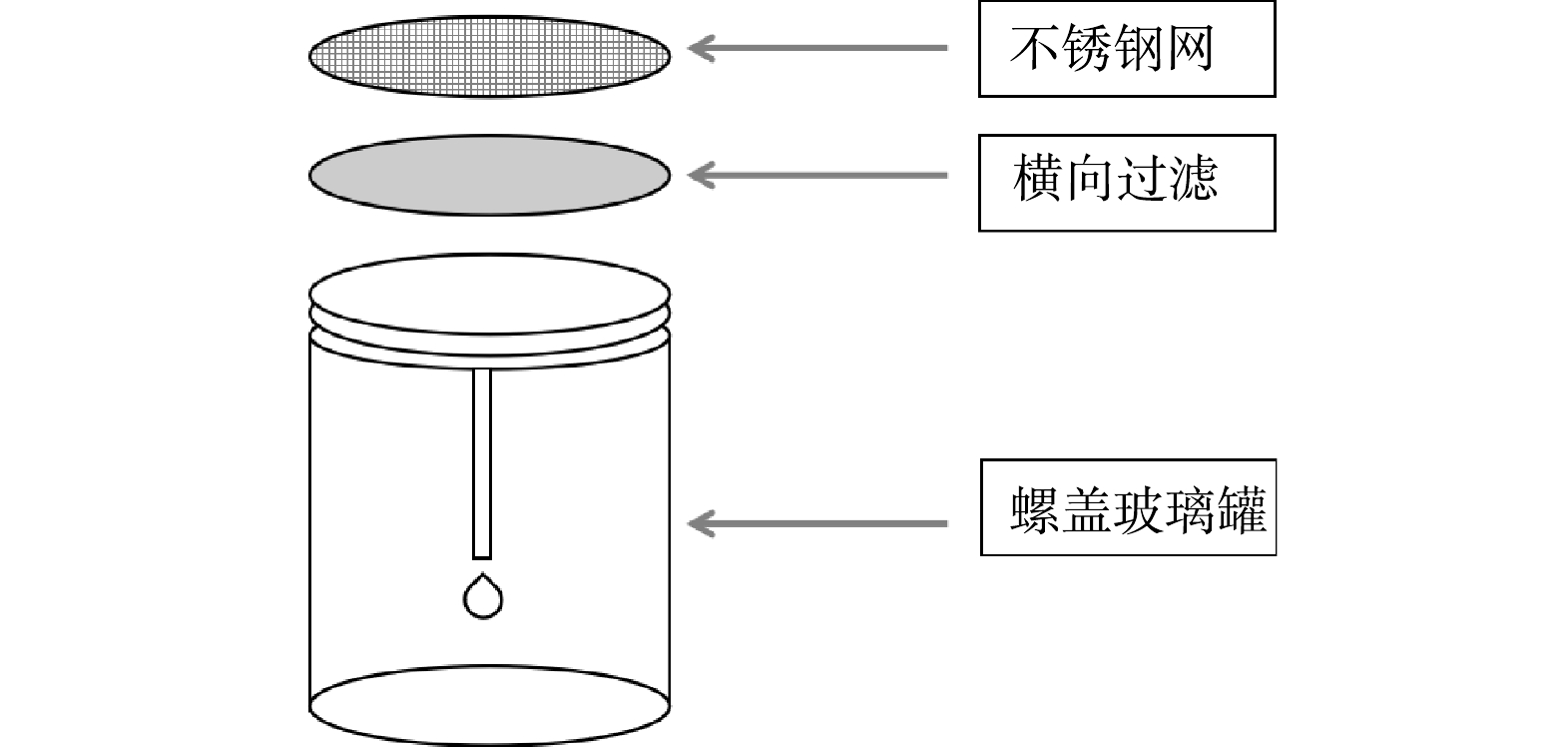
于2020年9月采集了乌鲁木齐某石油污水库(44°11'24〃N,87°42'27〃E)的水样,在实验室模拟自然条件培养生物膜。采集的污水库污水作为培养生物膜的水体,采用不锈钢网瓶作为生物膜附着的基质,污水生物膜附着装置如图1所示。
将采集的污水样经孔径为0.45 μm的微孔滤膜过滤,以除去原水样中的悬浮杂质。将不锈钢网瓶使用15%的HNO3溶液浸泡24 h后再用去离子水冲洗干净。随后把不锈钢网瓶放置于培养皿中,加入采集的污水进行培养,放置时尽量保证各位点的光照、水深和水体流态等环境条件相同,以避免除污染程度外其他环境因素的影响。向培养皿中滴加微量矿物盐溶液,以满足生物膜生长所需的各种无机盐。培养过程中,应定期向培养皿中添加培养所用污水库水样,以弥补因蒸发而减少的水分,确保培养装置始终浸没在水中。生物膜培养周期为35 d。培养结束后,用无菌刷将生物膜从培养装置上刮至250 mL的锥形瓶中以供测试。
-
如表1所示,污灌区水体中氨氮、总氮含量远超国家地面水环境质量标准(GB 3838-02),COD值和溶解氧均为国家Ⅳ类水体标准。
-
在质量浓度为1.25 mg·L−1的PHE背景溶液中,使用0.1 mol·L−1的稀盐酸溶液与氢氧化钠调节溶液的pH至3~10(间隔为1等量增加),考察pH对污水生物膜吸附PHE的影响; 将干质量为0.11 g的污水生物膜加入到锥形瓶中密封,在25 ℃下,以200 r·min−1转速避光恒温振荡直到平衡后取样测定样品中的PHE含量。
在250 mL 1.25 mg·L−1 PHE的背景溶液中,调节溶液的pH至6.0,将干质量为0.11 g的污水生物膜加入到锥形瓶中密封,选取15、25、35、45 ℃以200 r·min−1转速避光恒温振荡,直到平衡后取样测定样品中的PHE含量,以考察温度对污水生物膜吸附PHE的影响。
在250 mL 1.25 mg·L−1 PHE的背景溶液中,调节溶液的pH至6.0,将干质量为0.11 g的污水生物膜加入到锥形瓶中密封在25 ℃下,以200 r·min−1避光恒温振荡,间隔一定时间取样,取样时间分别为5、15、30、60、90、120、240、360、480、600、1 200 min,直到溶液中PHE的浓度不再发生明显变化。
在进行污水生物膜吸附PHE的等温线实验时,分别配置0.75、1.25、2.5、5、7.5 mg·L−1 PHE溶液250 mL。分别调节溶液的pH至6.0,将干质量为0.11 g的污水生物膜加入到各锥形瓶中密封在25 ℃下,以200 r·min−1避光恒温振荡,到1 200 min后取样测定各样品中的PHE含量。本组设置为无Cd2+组。
配置含有5 mg·L−1 Cd2+与一定量的PHE溶液至250 mL,此组为有Cd2+组,重复上述实验;上述实验均设置3组平行。将水样用0.45 μm有机膜过滤后待测,其中PHE浓度使用紫外分光光度计进行测定,波长为251 nm。
-
污水生物膜对PHE平衡吸附量根据式(1)进行计算,采用拟一级(式(2))和拟二级动力学方程(式(3))对所得实验结果进行拟合,采用Langmuir(式(4))和Freundlich模型(式(5))拟合平衡吸附数据。
式中:qe为平衡吸附量,mg·g−1;M吸附剂质量,g;V水溶液体积,L;C0为吸附溶液中的初始浓度,mg·L−1;Ce为吸附溶液中的平衡浓度,mg·L−1。
式中:a、b 为常数;x为吸附量,mg·g−1;y为拟合后污水生物膜吸附PHE的含量,mg·g−1。
式中:k为吸附速率常数,g·(mg·h)−1;qt和qe分别是时间t时对PHE的吸附量和平衡吸附量,mg·g−1。
式中:qm是最大吸附量,mg·g−1;KL为吸附平衡常数。
式中:qe是平衡吸附量,mg·g−1;n、KF分别为方程式中常数。
-
污水生物膜吸附前后扫描电镜图如图2所示。由图2(a)以看出,污水生物膜为表面粗糙片状且含有絮状结构。由图2(b)和图2(c)可见,在有Cd2+和无Cd2+条件下吸附PHE后,污水生物膜表面颗粒和粗糙度均有所增加。有Cd2+存在下污水生物膜表面颗粒堆积更明显,表明Cd2+的存在有利于污水生物膜对PHE的吸附。这可能是因为金属离子容易被生物膜中固相有机质吸附,并以键桥的方式结合固相载体介质中的溶解性有机物,进而使污水生物膜表面有机质含量增多。
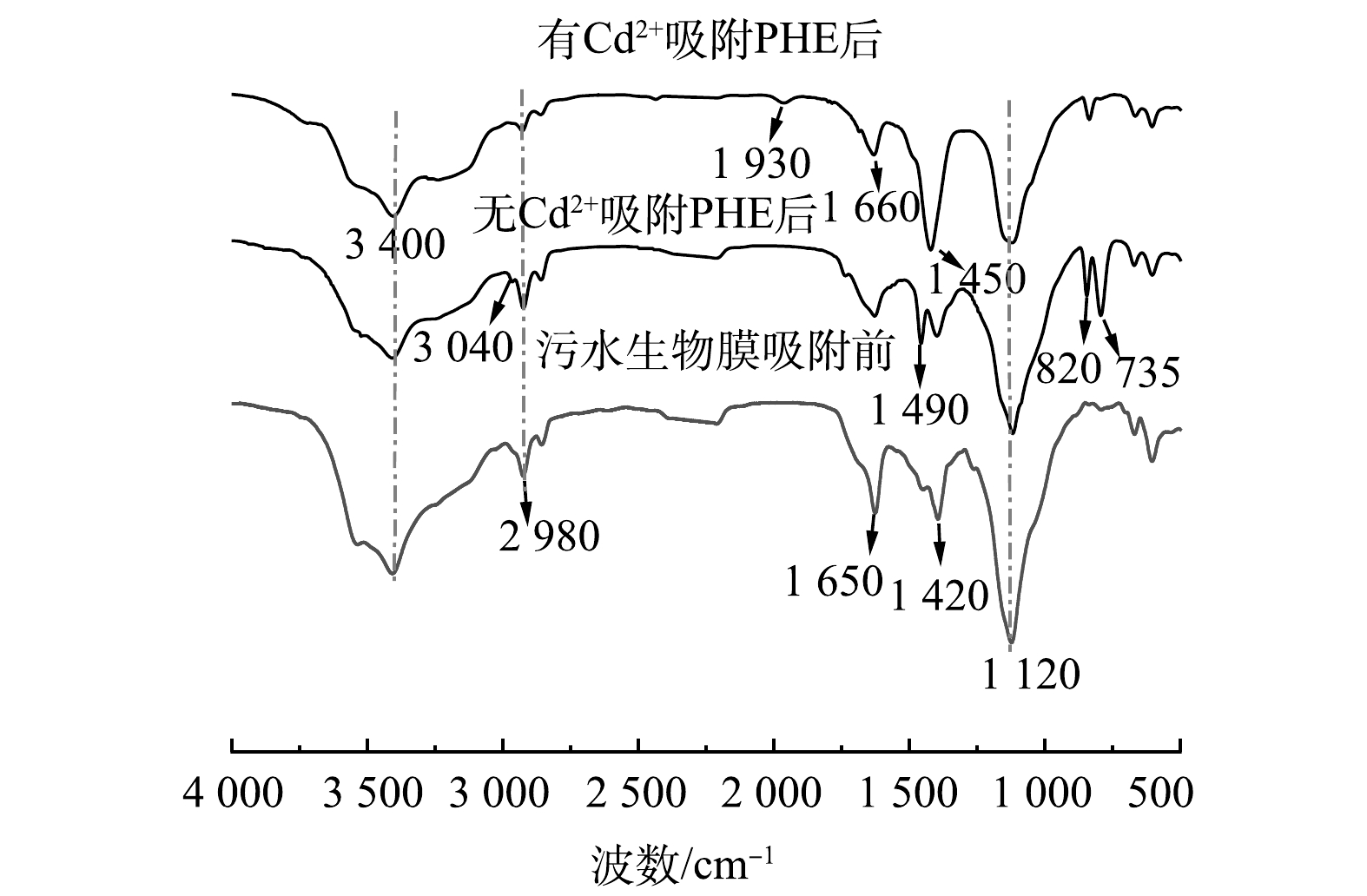
图3为污水生物膜吸附前后红外光谱图。由图3可知,有Cd2+和无Cd2+ 条件下,污水生物膜吸附PHE后,吸收峰的位置和强度均发生变化。3 400 cm−1处为—OH伸缩振动峰,吸附PHE后此峰的强度减弱并且发生了偏移,表明—OH与PHE发生化学键合导致官能团被掩蔽。在2 980 cm−1处特征峰是芳香族的C—H伸缩振动峰,吸附PHE后强度减弱,表明PHE和污水生物膜发生化学键合。在有Cd2+和无Cd2+ 条件下,污水生物膜吸附PHE后,1 650 cm−1为C=O伸缩振动峰,峰强减弱。吸附PHE后,在1 420 cm−1处苯环的骨架振动峰增强,说明PHE被成功附着在污水生物膜上。有Cd2+存在的条件下,污水生物膜吸附PHE后,在1 930 cm−1处出现的弱峰为苯环C—H面外弯曲振动峰。在无Cd2+条件下,污水生物膜吸附PHE后,1 120 cm−1处的C—O键的伸缩振动峰强度有所减弱,可能是蛋白质中酰胺的C—O键参与了反应[18-19]。735 cm−1和820 cm−1处是苯环的面外变形振动峰,在有Cd2+和无Cd2+ 条件下,污水生物膜吸附PHE后此峰均增强,表明与苯环相关的质子键发生变化[20]。这进一步证实污水生物膜与PHE的苯环发生了化学键合,并且PHE分子在污水生物膜上的吸附主要通过π—π键相互作用,因为PHE分子富含π电子,具有较高的电子供体性质。在有Cd2+和无Cd2+条件下,污水生物膜吸附PHE前后,污水生物膜上发生反应的化学基团基本相同,污水生物膜与PHE结合的主要基团是—OH、C=O和酰胺基团。
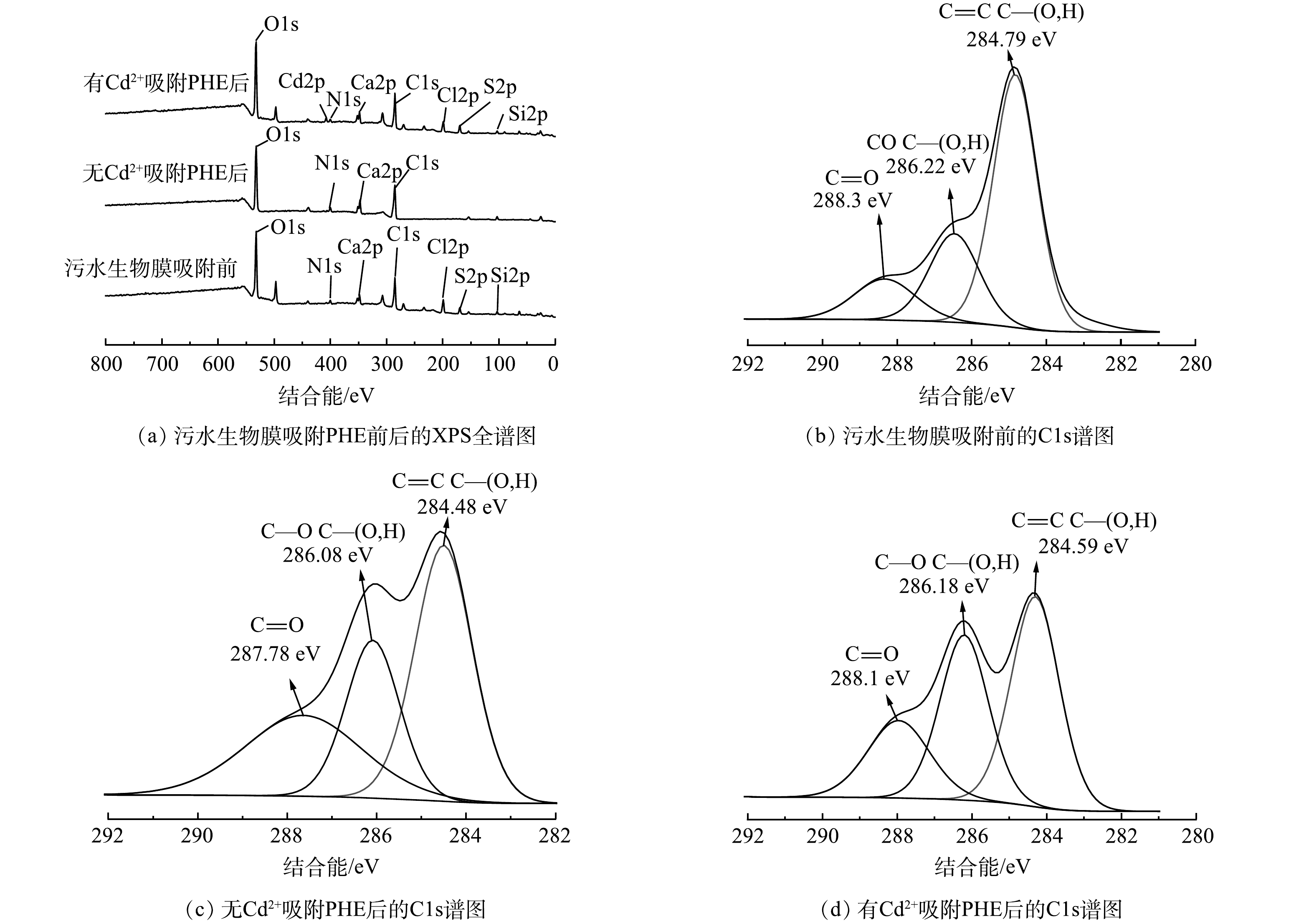
图4(a)为污水生物膜吸附PHE前后XPS谱图。可以看出,吸附前后,有Cd2+和无Cd2+条件下,污水生物膜的特征区域变化均不大,说明PHE并未破坏污水生物膜的结构。此外,有Cd2+和无Cd2+ 条件下,污水生物膜吸附PHE后的O、C含量有所增加,这是污水生物膜中的C—O、O—C—O等键与PHE的化学键合所致。进一步说明污水生物膜与PHE发生反应的主要基团可能为C=O和酰胺基团。
污水生物膜吸附前的C元素XPS分析结果如图4(b)所示。C1s光谱显示了C原子的3个可能环境峰,分别为C—C或C=C、C—O、C=O、C—N和C=N。286.22 eV对应C—O、C—N或C=N的吸收峰,归属于酰胺或胺类物质。在288.30 eV处的峰对应C=O或—COO,归属于羧酸或羰基。有Cd2+和无Cd2+条件下污水生物膜吸附PHE后的C元素XPS分析结果如图4(c)和4(d)所示。发现C=C、C—O、C=O、C—N的结合能,相比吸附前强度均发生了变化。有Cd2+和无Cd2+条件下污水生物膜吸附PHE后C—O和C=O贡献均增多,而C—C或C=C的贡献减小。这表明吸附主要发生在C=C、C—O、C=O和C—N上。
-
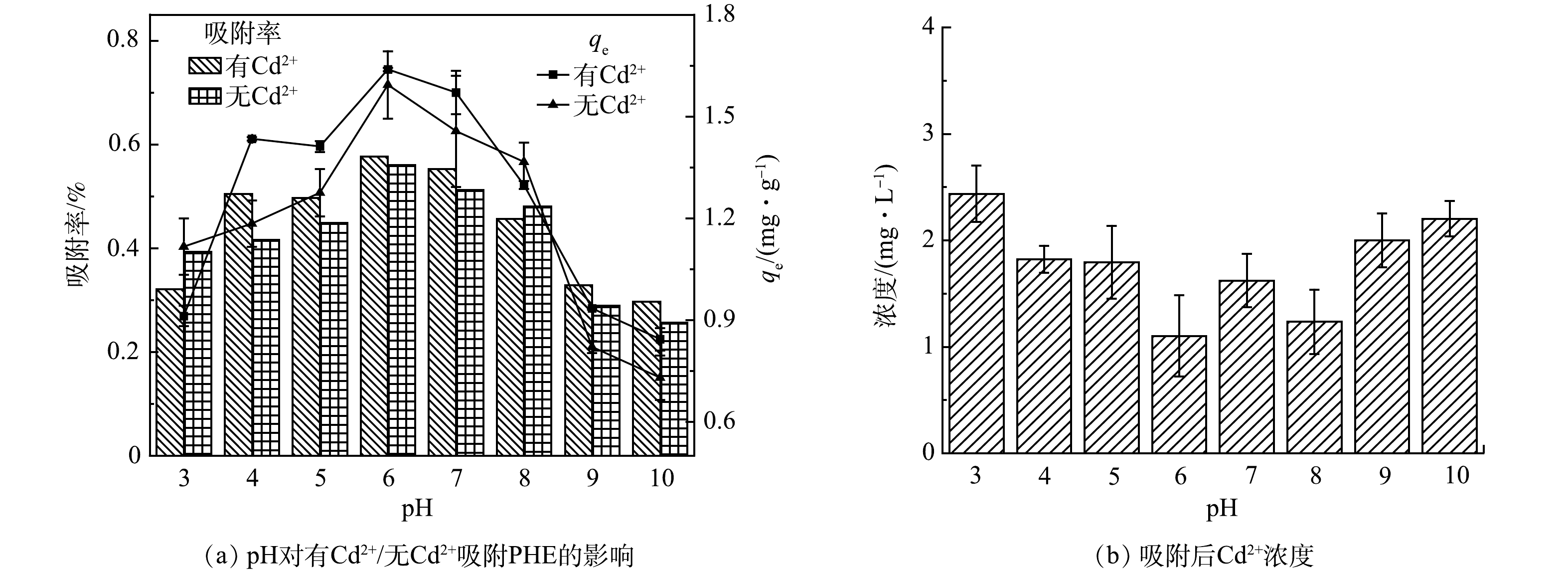
不同pH对PHE的吸附影响如图5所示。在pH=3~10,在无Cd2+和有Cd2+条件下,污水生物膜对PHE的吸附有着相似的趋势。在pH<5和pH>8时,吸附能力变弱。在pH=6时,有Cd2+和无Cd2+条件下,污水生物膜吸附PHE的最大吸附量分别为1.64 mg·g−1和1.60 mg·g−1,最大吸附率分别为58.2%和56.5%;在pH=10时,最大吸附量分别为0.84 mg·g−1和0.73 mg·g−1,吸附率为29.7%和25.7%。由此可见,随着pH的升高,污水生物膜吸附PHE的效率明显下降,容易受到pH的影响。这是因为生物膜中的基团使污水偏酸性,在酸性条件下,生物膜中的有机质更容易与PHE进行结合。在pH=4~7时,Cd2+的存在对污水生物膜吸附PHE无明显差异。同时有Cd2+条件下污水生物膜吸附PHE后,Cd2+质量浓度明显减小。随pH的增大,Cd2+质量浓度逐渐减小且使污水生物膜对PHE的吸附效果逐渐增强,在pH为6时Cd2+质量浓度最降到最低,为1.10 mg·L−1,此时有Cd2+对污水生物膜吸附PHE有最大影响。这证实了Cd2+会与污水生物膜中的固相有机质进行反应。
-
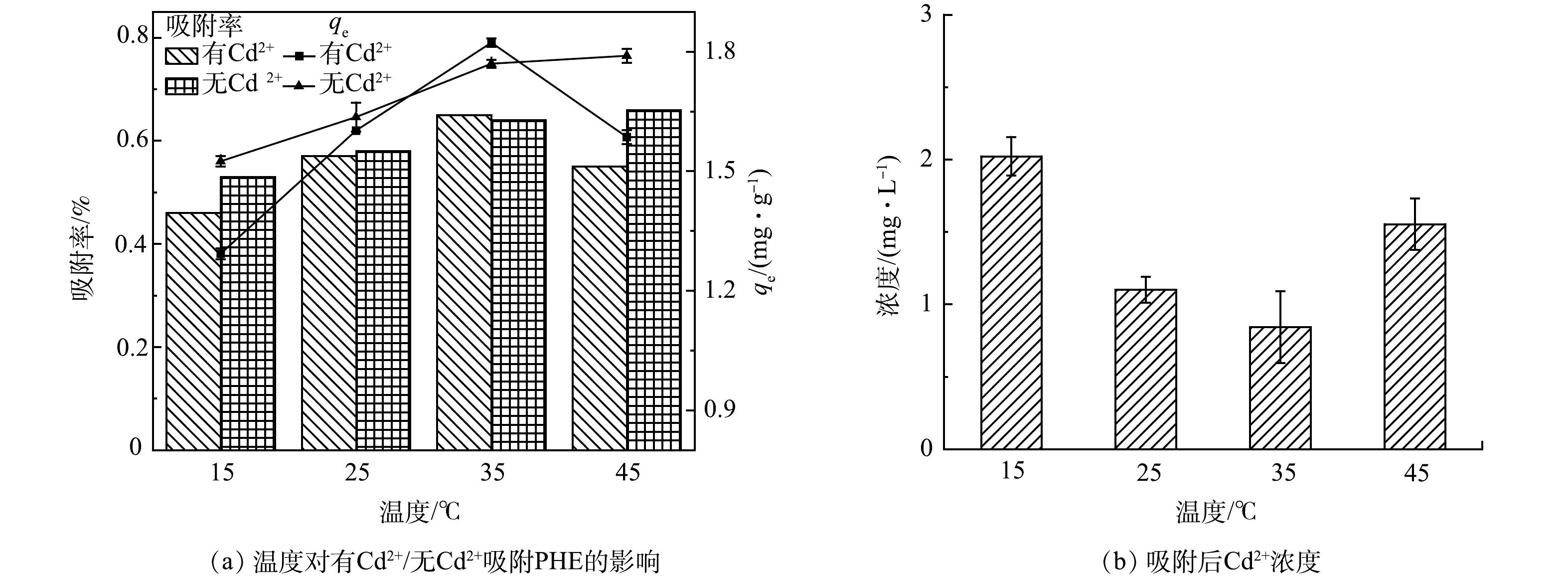
温度对污水生物膜吸附PHE的影响结果如图6所示,在15~35 ℃、有Cd2+和无Cd2+条件下,污水生物膜对PHE的吸附量均随温度升高而增大。这是由于低温时生物膜中的活性因子即酶活性较低,从而导致生物膜对PHE的吸附量较低。在45 ℃时,有Cd2+组,污水生物膜吸附量下降较明显;无Cd2+组,吸附量相比较趋于平缓。有Cd2+条件下污水生物膜吸附PHE后,Cd2+浓度明显减小。随温度的升高,Cd2+质量浓度逐渐减小,而在45 ℃时Cd2+质量浓度相比较于25 ℃和35 ℃有明显增高。35 ℃时Cd2+质量浓度最低至0.84 mg·L−1,此时有Cd2+组污水生物膜吸附PHE的吸附量最大,为1.82 mg·g−1,并且有Cd2+组中污水生物膜吸附PHE的能力均强于无Cd2+组,在15、25和45 ℃时,Cd2+的存在对污水生物膜吸附PHE均有促进作用。可能主要有2点原因:一方面,因为金属离子容易被生物膜中固相有机质吸附,并以键桥作用结合固相载体介质的溶解性有机物,进而有机质含量增多,促进了污水生物膜对PHE的吸附;另一方面,离子强度的增加可以压缩生物膜表面双电层,使得有机质结构发生变化,从而增强了污水生物膜对PHE的吸附[21-22]。
-
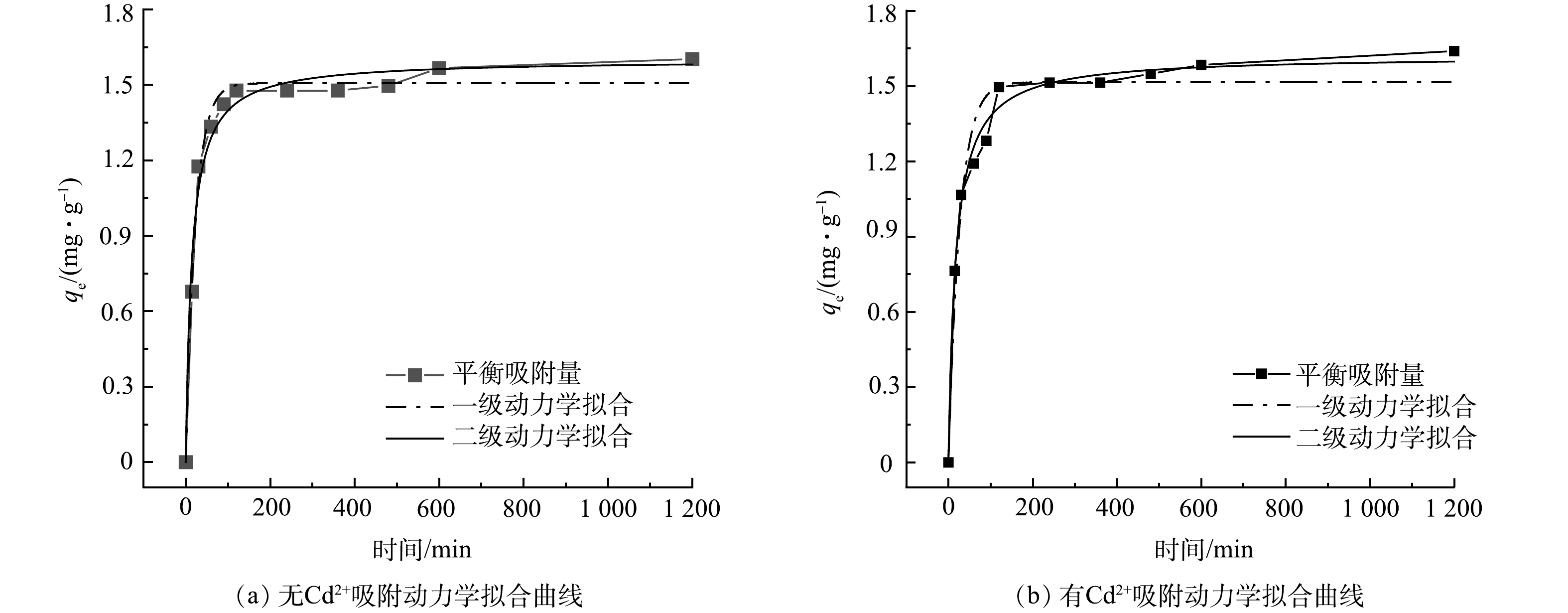
由图7可知,有Cd2+和无Cd2+条件下,在污水生物膜吸附PHE的过程中,在前120 min内,对PHE吸附属于快速吸附,吸附量随时间的延长而增大,在240 min左右时,吸附曲线趋于平缓,1 200 min时吸附达到平衡。在无Cd2+条件下,污水生物膜对PHE的最大吸附量为1.6 mg·g−1,吸附率为56.5%;而在有Cd2+时则为1.64 mg·g−1,吸附率为58.2%,有Cd2+条件下污水生物膜对PHE的吸附率比无Cd2+高1.7%,二者相差不大。采用拟一级、拟二级动力学方程对污水生物膜吸附PHE过程进行拟合,拟合结果如表2所示。
拟一级动力学模型代表快速吸附阶段,为物理吸附过程。由表2可见,污水生物膜在有Cd2+和无Cd2+时吸附PHE均可用拟二级动力学更好地拟合。在无Cd2+条件下,污水生物膜对PHE的拟合最大吸附量为1.60 mg·g−1;有Cd2+条件下,吸附量为1.62 mg·g−1。由于该过程遵循拟二级动力学模型,说明污水生物膜主要通过化学作用将PHE与污水生物膜表面官能团键合在一起。添加Cd2+可促进污水生物膜对PHE的吸附,这是由于污水生物膜中微生物表面与Cd2+之间的静电吸引比微生物表面与PHE之间的范德华力更强,重金属占据了微生物表面PHE的吸附区域,随着金属阳离子集中在微生物表面,微生物逐渐被中和,而微生物表面的亲水性降低,这促进了污水生物膜对PHE的吸附。此外,由于阳离子—π键的相互作用,PHE被聚集到Cd2+上,从而促进污水生物膜对PHE的吸附[23]。
-
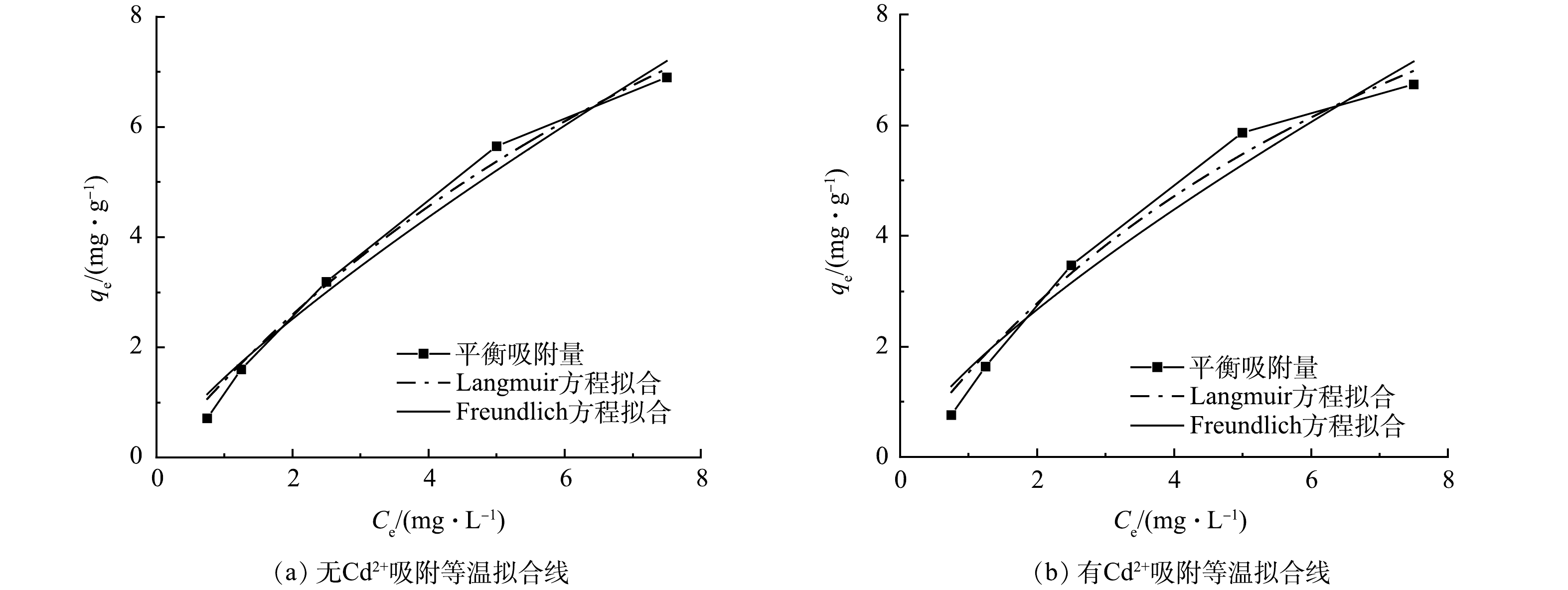
由图8可知,在有Cd2+和无Cd2+时,随着PHE浓度的升高,污水生物膜对PHE的吸附量逐渐增大,且呈非线性增长,但随着PHE浓度的继续增加,吸附量逐渐趋于平缓。由Freundlich拟合方程可以得出,吸附等温线呈现倒L型,这表明随着初始浓度的增加,吸附等温线斜率减小,说明污水生物膜上吸附单层位点被PHE覆盖,膜上吸附位点减少,导致吸附量会随着PHE初始浓度的增加而降低。 Langmuir、Freundlich方程的拟合结果如表3所示。由表3可见,Langmuir方程更符合等温状态下污水生物膜对PHE吸附过程。在无Cd2+和有Cd2+条件下,Langmuir方程的相关系数R2分别为0.988 4和0.977 5,相关度均较高,这说明无Cd2+和有Cd2+条件下,污水生物膜吸附PHE均是单层吸附。采用Langmuir方程拟合,污水生物膜中无Cd2+条件下其最大吸附量为15.53 mg·g−1,有Cd2+条件下其最大吸附量为18.91 mg·g−1;在有Cd2+条件下时,污水生物膜对PHE的最大吸附量比无Cd2+时高出21.8%。
-
1)发现有Cd2+条件下污水生物膜对PHE的吸附有一定促进作用,且有Cd2+条件下污水生物膜吸附PHE的吸附效率高于无Cd2+条件下。在pH=6、温度为35 ℃时有Cd2+条件下污水生物膜对PHE的吸附效果最好,最大吸附量为1.82 mg·g−1。
2)拟合动力学和吸附等温线模型显示,有Cd2+和无Cd2+ 条件下污水生物膜吸附PHE均符合单分子层的化学吸附,且吸附前后污水生物膜的SEM和FT-IR表征结果均无明显差异,而XPS表征发现污水生物膜吸附PHE后O、C含量有所增加,表明吸附主要发生在污水生物膜表面的C=C、C—O、C=O和C—N上。
3)有Cd2+和无Cd2+ 条件下污水生物膜对PHE的吸附机理主要有π—π键和阳离子—π键相互作用。
重金属镉对污水生物膜吸附菲的影响机制
The influence mechanism of heavy metal cadmium on phenanthrene adsorption onto sewage biofilm
-
摘要: 为了探究重金属镉(Cd)对污水生物膜吸附菲(phenanthrene,PHE)的影响及机制,以新疆乌鲁木齐某含油污水库生物膜为研究对象,通过对比有Cd2+和无Cd2+条件下,污水生物膜对PHE的吸附性能,Cd2+的存在对污水生物膜吸附PHE有促进作用。有Cd2+和无Cd2+条件下,在pH=6、温度为35 ℃时污水生物膜对PHE的吸附效果最好;吸附动力学和吸附等温线方程均符合拟二级动力学和Langmuir模型,说明吸附以单分子层的化学吸附为主,并且有Cd2+时污水生物膜对PHE的最大吸附量比无Cd2+时高出21.8%。SEM、FTIR和XPS的表征分析结果表明,有Cd2+和无Cd2+条件下污水生物膜表面与PHE发生作用的基团基本相同,吸附过程中的主要官能团为有机质中的羟基、羧基和酰胺基团。Abstract: To explore the effect and mechanism of cadmium (Cd) on phenanthrene (PHE) adsorption onto sewage biofilm, Urumqi oil reservoir biofilm was taken as the research object, then the PHE adsorption performance onto the sewage biofilm was compared with and without Cd2+. The results showed that PHE adsorption onto the sewage biofilm was promoted in the presence of Cd2+. Whether with or without Cd2+, the best PHE adsorption effect onto the sewage biofilm occurred at pH 6 and 35 ℃. The simulated kinetics and isotherm equations were consistent with the pseudo-second-order kinetics and Langmuir model, indicating that the adsorption is dominated by the chemisorption of monolayers, and the maximum PHE adsorption amount with Cd2+ was 21.8% higher than that in the absence of Cd2+. The result of SEM, FTIR, and XPS characterization indicated that the groups on the sewage biofilm surface absorbing PHE with or without Cd2+ were basically same, and the main functional groups in organics were hydroxyl, carboxyl, and amide ones.
-
Key words:
- cadmium /
- phenanthrene /
- sewage biofilm /
- adsorption
-
随着城市化进程的加快,城市绿化也因其在提高城市环境质量、维持城市生态平衡等方面的重要作用得以迅速发展。我国城市园林绿化产生的落叶、剪草、枯枝等绿色废弃物,年产量已增加到3.5×108 t左右[1]。堆肥化处理由于可以将废弃物转化为对植物生长和土壤改良有促进效果的堆肥产品,已成为高效处理并实现废弃物再利用的重要途径。绿化废弃物含有丰富的有机物质,这一特点使其腐熟后更容易获得高养分的肥料;但另一方面,绿化废弃物中大量结构紧密的木质纤维素成分使他们不易被微生物分解[2],而且处理不当会造成腐熟缓慢,产生气味污染以及堆肥产品降解不完全等问题。
由于堆肥是以微生物为主导的有机废弃物降解过程,因此,可以通过添加微生物菌剂来加快木质纤维素降解。杭怡琼等[3]研究发现,白腐真菌能够有效且有选择性地降解植物纤维原料中的木质素。黄丹莲[4]发现,木霉菌等真菌不仅能分泌胞外酶,还可以利用菌丝穿插破坏纤维素结构,实现对纤维素的高效分解。此外,纤维素酶作为一种可以促进木质纤维素糖化的酶制剂,在动物饲料和纸浆生产等领域已被广泛应用[5-6]并显示出良好的降解效果,但是在堆肥领域却鲜有关于纤维素酶的应用研究。同时,有研究[2,7-9]表明,适宜的粒径可以提高堆肥期间的微生物活性,从而加快大分子物质的降解速度。过大的粒径会导致通风过度,热量散失;过小的粒径会使持水量过高,通氧量不足,这些都不利于微生物进行代谢活动。已有研究[10]提出的最佳堆肥粒径为5~30 mm,没有统一的标准;而且大部分研究[11-12]缺少对微生物指标的分析或是采用传统的DGGE技术进行微生物检测,无法准确地反映粒径与微生物群落结构和堆肥腐熟效果的关系。因此,初始粒径对绿化废弃物堆肥的影响仍需进一步研究,这也影响着外源添加剂的作用效果。
本研究采用由白腐真菌和木霉菌组成的微生物菌剂,结合纤维素酶制成外源添加剂,进行不同粒径的绿化废弃物堆肥,通过分析堆肥的理化性质和细菌群落结构,探究不同初始粒径和外源添加剂对绿化废弃物堆肥腐熟度的促进效果,并提出最优参数组合,为提高绿化废弃物堆肥质量提供了参考。
1. 材料与方法
1.1 实验材料和仪器
实验材料:作为堆肥原材料的绿化废弃物主要来自于北京市城市景观维护过程中产生的枯枝落叶和修剪的枝条(多为柳树、槐树、杨树等),分别粉碎至2 mm和5 mm;微生物菌剂包括木霉菌和白腐真菌,推荐接种量(g/g)为3%~5%;纤维素酶的酶活为2×104 U·g−1;干羊粪用于调整原料的C/N至28左右;发芽实验选择白菜种子进行。供试材料和堆肥初始性质如表1所示。
表 1 供试原料基本性质Table 1. Basic properties of raw materials for compost供试材料 pH 有机碳/(g·kg−1) 全氮/(g·kg−1) 碳氮比 绿化废弃物 6.76 480.2 8.9 54 干羊粪 7.41 261.2 13.9 18.8 2 mm绿化废弃物堆肥 7.75 336.4 11.6 29 5 mm绿化废弃物堆肥 7.66 340.2 12.6 27 实验仪器:恒温培养箱(RXZ-500A,宁波江南仪器有限公司);精密pH/EC仪(MP522,上海精密科学仪器有限公司);TOC分析仪(TOC-5000A,日本岛津公司);紫外可见分光光度计(TU-1810DS,北京普析通用仪器有限责任公司)。
1.2 实验设计和取样
实验共有8个处理(T1~T8)(表2),设计2 mm和5 mm 2种粒径,纤维素酶和菌剂的接种量(g/g)分别设置为物料干质量的0、2%和0、2%、4%,按表2所示的比例混配后作为外源添加剂。所有处理重复3次。每个处理按设计参数混配1 000 g(干质量)混合物,放入塑料长方体(35 cm×22 cm×10 cm)发酵容器中,添加蒸馏水,将每个处理的水分含量统一调节至65%,最后将发酵容器密封,并置于恒温培养箱中,于50 ℃下发酵22 d。每3 d进行翻堆和补水,以保证每个容器中的堆肥有适宜的氧气和水分。堆肥结束后,于每个处理的顶部、中部和底部共取样200 g,混合均匀。一部分样品作风干处理用于有机碳、全氮、pH、电导率(EC)和腐殖指标的测定;剩余新鲜样品与去离子水按1∶10(g∶mL)混合,振荡2 h浸提后过滤,在25 ℃恒温的培养箱内培养白菜种子,放置48 h后,取出记录发芽种子个数和根长,计算发芽指数[13]。实验第2天、12天、22天,对T1~T8实验组取样进行细菌高通量分析,分别标注为T1D2~T8D2、T1D12~T8D12和T1D22~T8D22,代表初期堆肥、中期堆肥和末期堆肥。
表 2 实验因素水平设计Table 2. Standard parameters of composting处理组 粒径/mm 纤维素酶∶菌剂 T1 2 0∶0 T2 2 0∶4 T3 2 2∶2 T4 2 2∶4 T5 5 0∶0 T6 5 0∶4 T7 5 2∶2 T8 5 2∶4 1.3 检测和分析方法
有机碳、全氮、pH和EC值参照文献的方法[14]测定:有机碳采用外加热法测定;全氮采用凯氏定氮法测定;使用pH/EC仪测定pH和EC值。微生物指标参照MAO等[15]的方法测定,并在门水平注释其群落的物种信息。根据鲍士旦[16]的方法提取腐殖质和胡敏酸,提取液使用TOC分析仪分别测定得腐殖质和胡敏酸含量[17];腐殖质提取液采用紫外可见分光光度计测定吸光度比值(E4/E6)[14]。
腐殖质系数[12]按式(1)计算,发芽指数[18]按式(2)计算。
FHI=CHACT×100% (1) FGI=ST⋅LTSC⋅LC×100% (2) 式中:FHI为腐殖质系数;CHA为胡敏酸含量,g·kg−1,CT为总有机碳含量,g·kg−1;FGI为发芽指数;ST为处理组平均发芽数量;LT为处理组平均根长,mm;SC为对照组平均发芽数量;LC为对照组平均根长,mm。
使用CANOCO 5软件进行RDA分析,采用SPSS 23软件进行方差分析和主成分提取,依据参考文献的方法[19]进行主成分分析。
2. 结果与讨论
2.1 初始粒径和外源添加剂对碳氮比的影响
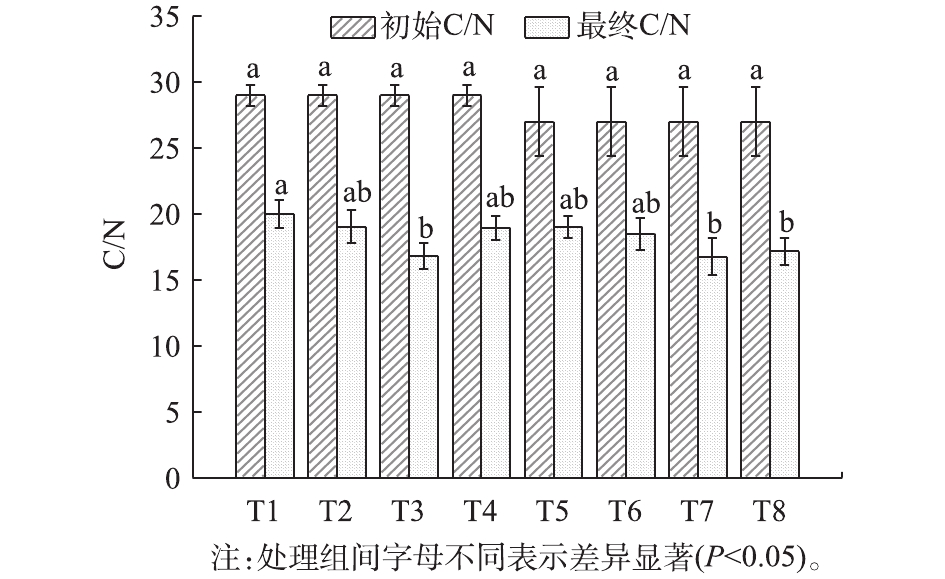
在堆肥过程中,微生物不断分解利用有机物质进行繁殖和代谢,作为其主要能量来源的碳素以远大于氮素的速度被消耗,C/N整体呈下降趋势,与堆肥产品的腐熟程度密切相关。由图1可知,堆肥结束后,除对照组T1外的所有处理C/N均低于20,满足腐熟要求[20]。各处理C/N降幅排序为T3>T7>T4>T2>T8>T1>T6>T5。2 mm粒径组平均降幅较5 mm处理组提高12.7%,说明2 mm粒径更有利于有机质降解活动的进行;同时,添加纤维素酶和菌剂的处理T3和T7在各自粒径组中降幅最大,这是因为菌剂可以直接扩大微生物数量;另外,纤维素酶可以有针对性地提高纤维素的水解效率,生成更利于被微生物分解的单糖[21],进而提高微生物活性,在二者共同作用下,对促进腐熟起到协同效果。
2.2 初始粒径和外源添加剂对pH和EC的影响
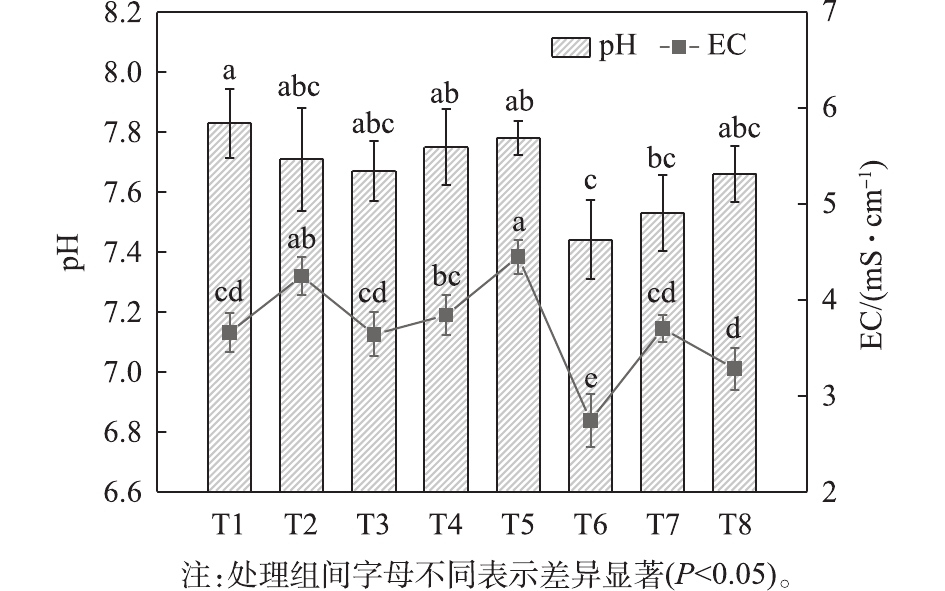
pH与堆肥微生物的活性关系密切。有研究[22-23]指出,pH为7~8.5时,堆肥常见微生物的活性和繁殖力最强。如图2所示,堆肥结束后,所有处理的pH都呈弱碱性,从大到小顺序为T1>T5>T4>T2>T3>T8>T7>T6,2种粒径组对照处理的pH均高于同组其他处理。这说明添加剂对降低pH有一定影响。原因是,当有机化合物被分解时,具有外源添加剂的处理可促使微生物生成有机酸[24]。从粒径对pH的影响来看,2 mm处理组pH更高。这可能是由于2 mm处理的绿化废弃物在堆肥过程中,有利于能促进有机酸分解的微生物的生长,从而影响了发酵环境酸碱度。
EC反映了堆肥产品中总盐的含量,可用作有机物分解动力学的判定指标[15]。在本研究中,堆肥末期各处理的EC值排序依次为T5>T2>T4>T7>T1>T3>T8>T6,2 mm粒径组的平均EC较5 mm粒径组高8.6%。这表明具有较小粒径的堆肥含有较多的盐和小分子物质[25]。这一结果可能是因为小粒径堆肥的较高比表面积增加了离子交换能力造成的[26]。
2.3 初始粒径和外源添加剂对发芽指数的影响
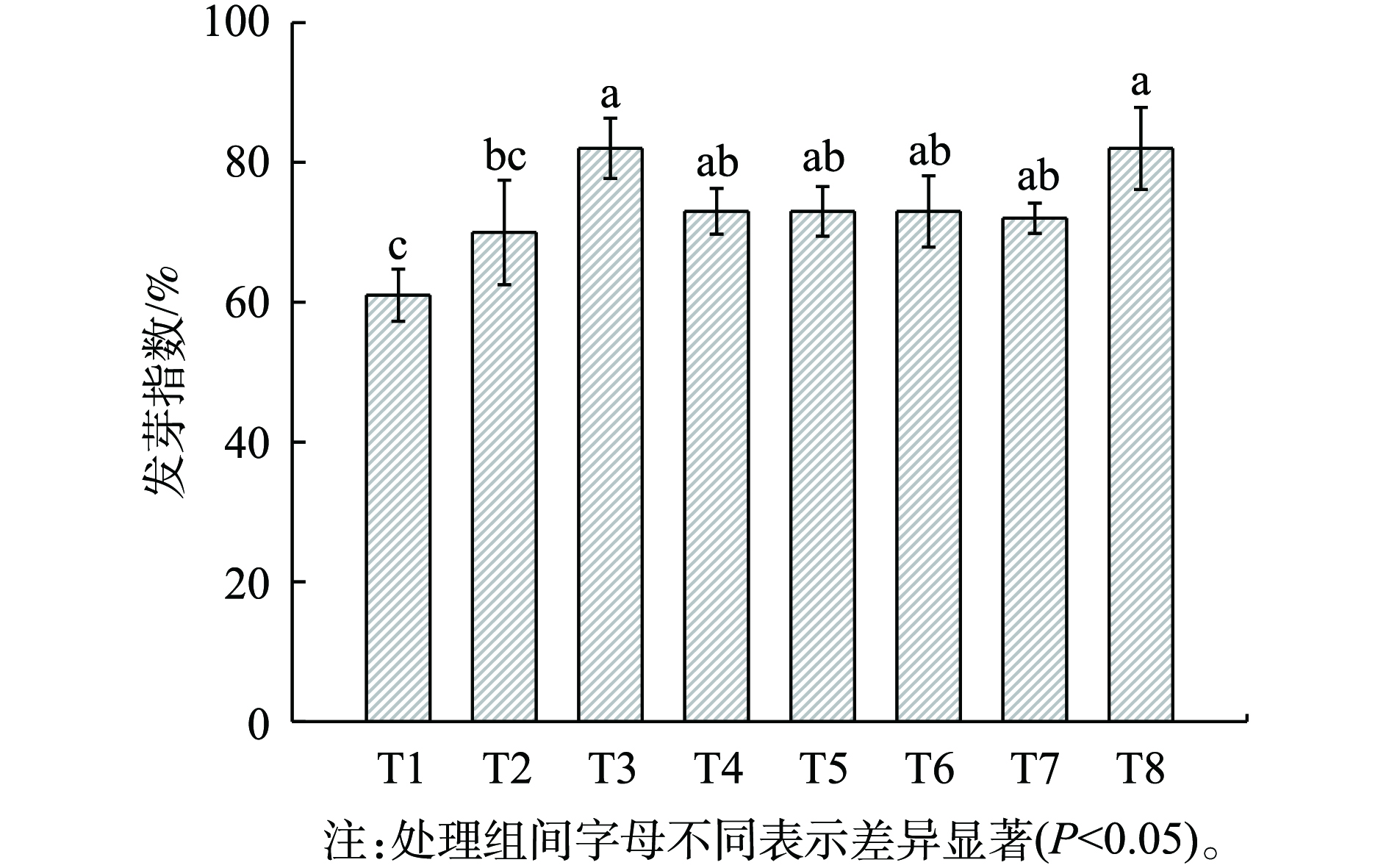
未腐熟堆肥中的毒性物质会抑制植物的生长,因此,堆肥浸提液对植物生长的影响可用于评价堆肥的植物毒性,用发芽指数[27](GI)表示。图3显示,GI值从大到小依次为T3>T8>T4>T6>T5>T7>T2>T1,所有堆肥的GI均大于60%,高于腐熟标准要求的50%的阈值[28]。在2 mm粒径处理中,具有外源添加剂的处理组GI值较对照组增加了15%~36%;在5 mm粒径处理中,增加了2%~16%。这表明纤维素酶和菌剂的添加对有机毒物的降解产生了积极影响,能有效改善GI,2 mm粒径更有利于增强添加剂的作用效果。
2.4 初始粒径和外源添加剂对吸光度比值的影响
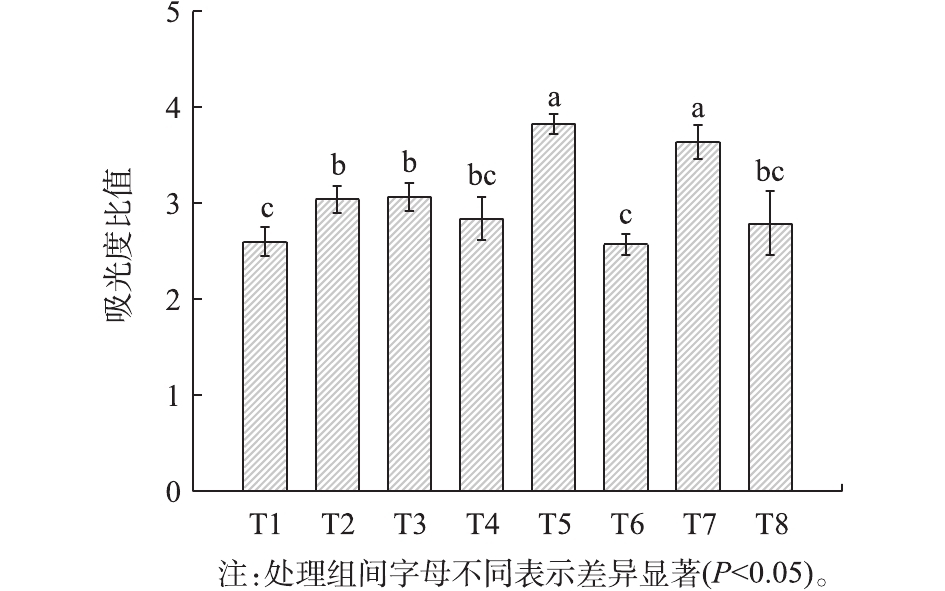
腐殖酸在波长465 nm和665 nm处具有特异吸收峰值。在堆肥过程中,2个波长处的吸光度比值(E4/E6)随着腐殖酸分子缩合度的增大而减小[29],成为评价堆肥结构稳定性的重要参数之一。如图4所示,堆肥结束时,各处理堆肥的E4/E6排序为T5>T7>T3>T2>T4>T8>T1>T6,在5 mm处理组中获得相对较高的E4/E6比值,较2 mm组高11.1%。这说明2 mm处理可使堆肥中的腐殖酸有更高的聚合度和稳定性,品质更佳。
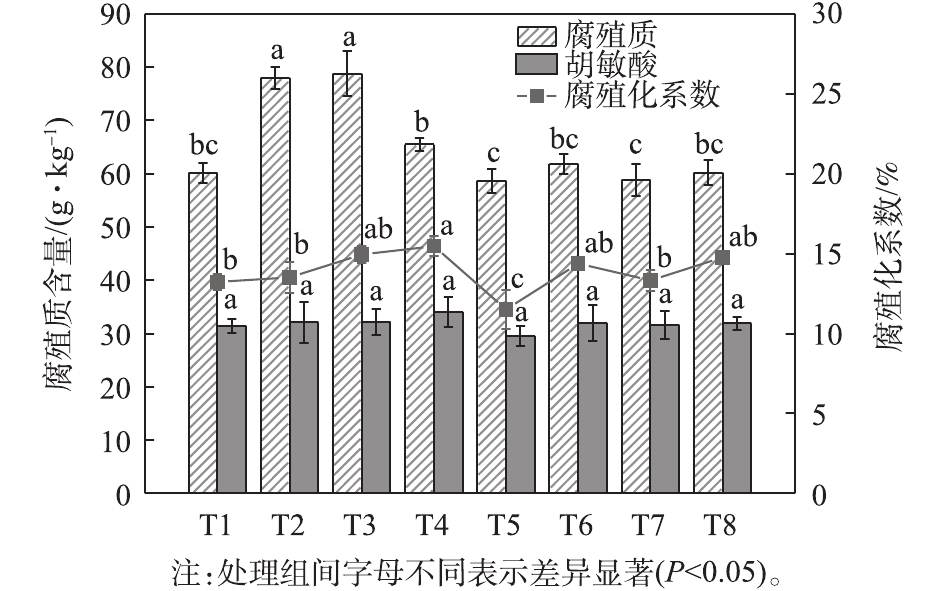
2.5 初始粒径和外源添加剂对腐殖化指标的影响
堆肥是大分子碳水化合物通过微生物转化为腐殖质的过程。图5显示,堆肥末期,2 mm处理的腐殖质和胡敏酸的平均含量分别比5 mm处理高17.9%和3.7%。这可能是由于小粒径处理中的纤维素材料更容易被分解,为氧化和芳香结构的形成提供了丰富的底物。在相同的粒度组中,对照组的腐殖质和胡敏酸含量最小,这归因于添加纤维素酶和菌剂能增加相关功能菌的数量,促进腐殖质的形成。除了腐殖质含量的变化,腐殖化系数(HI)被认为可以更准确地反映腐殖化程度[30]。在堆肥过程中,腐殖化系数呈上升趋势,分子质量较低的富里酸在矿化过程中降解,并浓缩成结构更复杂的大分子胡敏酸,使腐殖质更加稳定。在堆肥结束时,腐殖化系数排序为T4>T3>T8>T6>T2>T7>T1>T5,纤维素酶和菌剂对腐殖化系数有显著影响(P=0.001<0.05),说明二者的添加对提高堆肥腐熟程度有重要作用。
2.6 初始粒径和外源添加剂对微生物的影响
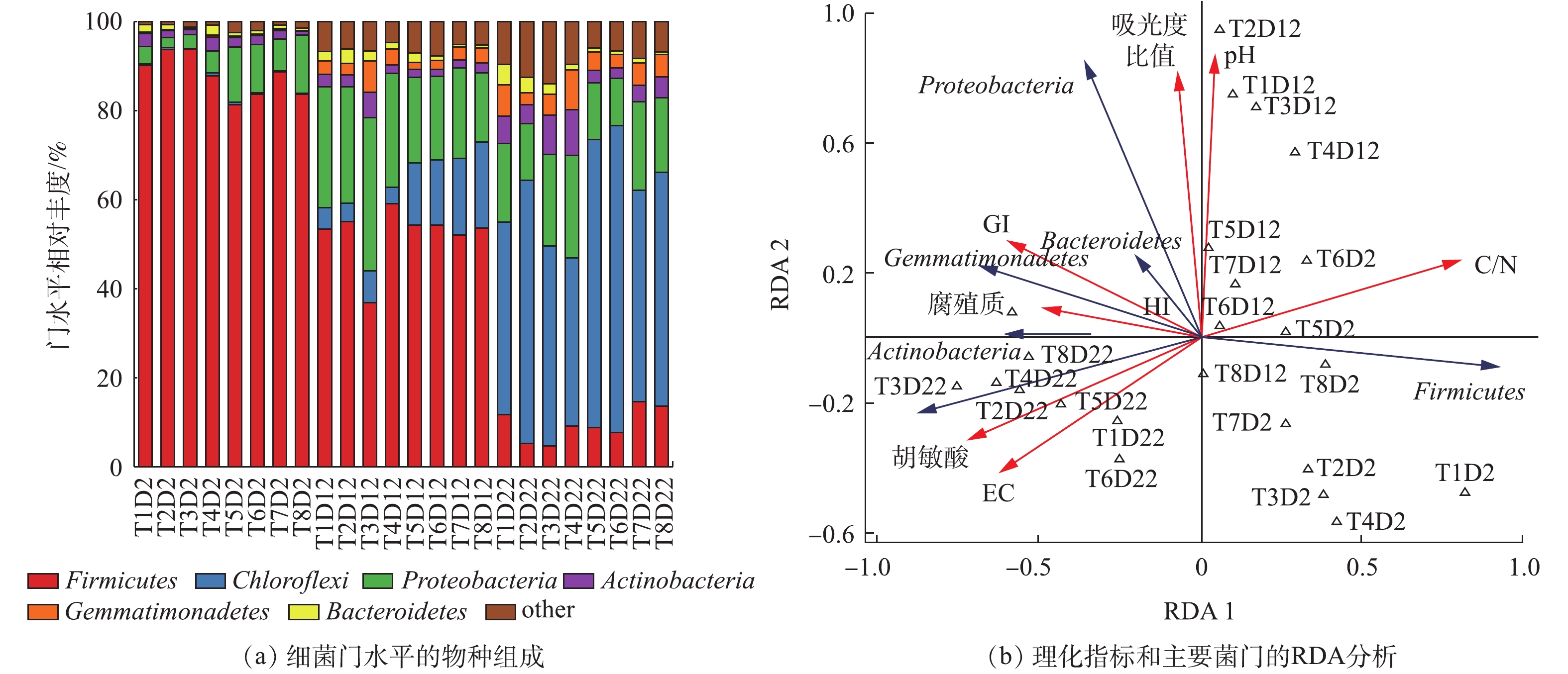
堆肥理化指标的分析表明,2 mm粒径和外源添加剂处理组对改善堆肥理化性质有积极作用。为了从微生物角度解释粒径和添加剂对理化性质的影响,对粒径和添加剂对微生物群落组成以及特定功能微生物的影响进行了分析。好氧堆肥中的细菌被公认是堆腐基质中数量最大、分布最广泛的微生物类群,不仅分解单糖效率高,也兼具了真菌和放线菌分解木质纤维素的能力[31]。由图6(a)可知,整个堆肥过程的优势菌门的排序为厚壁菌门(Firmicutes)>绿弯菌门(Chloroflexi)>变形菌门(Proteobacteria)>放线菌门(Actinobacteria)>芽单胞菌门(Gemmatimonadetes)。堆肥初期,能有效地利用碳水化合物的厚壁菌门是优势菌种,平均丰度高达87.8%;堆肥中期,随着碳水化合物的减少,厚壁菌门丰度下降,变形菌门丰度增加至23.4%;堆肥末期,绿弯菌门平均丰度迅速增加到52.5%,放线菌门和芽单胞菌门也成为主要菌种。在堆肥过程中,具有降解纤维素功能的放线菌[32]的相对丰度持续上升,各个处理放线菌的增长比例排序为T3>T4>T8>T1>T2>T7>T5>T6,2 mm处理是5 mm处理的3.15倍。可见,2 mm更适合具有分解纤维素能力的细菌生长繁殖。在同粒径组中,只添加菌剂的处理表现不佳。其原因可能是,外源菌的介入对原生菌群的演替有一定影响,而同时具有纤维素酶和菌剂的外源添加剂处理与对照处理相比,放线菌数量有明显提升。这说明纤维素酶对降解功能菌的繁殖代谢有积极作用,从而有效优化堆肥性质。
为进一步研究细菌群落组成与理化性质之间的关系,对堆肥理化性质与堆肥样品的主要菌门进行了RDA分析(图6(b))。结果显示,C/N、pH、GI和胡敏酸与细菌群落呈显著相关(P<0.05)。C/N和pH分别与厚壁菌门和变形菌门呈正相关,发芽指数和胡敏酸与成熟阶段的主要细菌活性相关。通过分析不同堆肥时期的主导菌群发现,在堆肥初期和中期,与5 mm相比,2 mm处理组中主导菌群(厚壁菌门和变形菌门)数量更多。这表明2 mm粒径能为这些微生物提供更适合生长繁殖的环境,加快堆肥进程。在腐熟阶段,2个粒径组与能促进腐殖化的末期主导细菌(放线菌门、芽单胞菌门)[28]的相关性分别为T3>T4>T2>T1和T7>T8>T5>T6。在同粒径组中,同时添加纤维素酶和菌剂的处理与腐殖功能菌相关性更大,对其生长繁殖有积极作用,从而提高了GI、腐殖质和胡敏酸含量。这说明添加纤维素酶和菌剂能促进堆肥后期熟化,与腐殖化分析所得结论一致。因此,粒径和添加剂可以通过影响细菌群落来优化理化性质,2 mm处理组和同时具有纤维素酶与菌剂的处理组能有效促进相关功能菌增长,改善堆肥质量。
2.7 堆肥产品腐熟效果的综合评价
为避免单个指标评价的偏差和片面性,本研究采用主成分分析法,综合8项理化指标对所有处理进行综合量化评价,以更全面客观地评估不同处理的堆肥质量。分析共提取3个主成分,方差贡献率累计达85.676%,满足大于85%的要求[19]。主成分提取结果见表3,各处理的主成分综合评分见表4。
表 3 堆肥指标主成分提取Table 3. Principal component extraction of compost index主成分 分析指标 特征根 贡献率/% 累计贡献率/% 第1主成分 pH、EC、腐殖化系数、胡敏酸含量 3.204 40.055 40.055 第2主成分 C/N、GI、E4/E6 2.054 25.673 65.728 第3主成分 腐殖质含量 1.596 19.948 85.676 表 4 堆肥主成分综合评分Table 4. Principal component comprehensive score of composts处理组 F1得分 F2得分 F3得分 F得分 F排名 T1 −1.476 −1.244 −0.666 −1.174 8 T2 −0.734 −0.155 1.500 0.080 4 T3 1.460 0.519 1.527 1.178 1 T4 1.029 −0.880 1.145 0.452 3 T5 −3.352 1.574 −0.209 −0.893 7 T6 1.803 −0.698 −1.938 −0.049 5 T7 −0.152 0.699 −0.911 −0.094 6 T8 1.421 0.210 −0.448 0.508 2 由表4可知,所有处理从优至劣依次是T3>T8>T4>T2>T6>T7>T5>T1,表现最好的是处理T3,即2 mm粒径添加由2%纤维素酶和2%菌剂组成的外源添加剂,综合分数为1.178分;表现最差的是2 mm粒径不加外源添加剂的处理T1,综合分数为−1.174分。2 mm粒径组平均得分高于5 mm粒径组,2 mm粒径组内排序为T3>T4>T2>T1,5 mm粒径组内排序为T8>T6>T7>T5。2种粒径组中有外源添加剂的处理表现均好于对照处理。其中,2 mm的最优处理是T3,纤维素酶和菌剂比例为2∶2;5 mm的最优处理是T8,纤维素酶和菌剂比例为2∶4。
主成分分析结果表明,2 mm处理组的表现整体优于5 mm处理组。究其原因可能包括2个方面:一是绿化废弃物含有大量结构紧密的纤维素和半纤维素,粒径决定了酶与这些大分子物质的接触面积和降解效率,2 mm粒径处理可以增加堆料表面积,提升酶解效果和速率;二是在孔隙率、温度和湿度等方面,2 mm粒径组为微生物提供了更好的生长代谢环境。张璐[14]曾提出,适当的粒径可以提高绿化废弃物堆料的通气透水性,并减少水从表面蒸发,改善微生物活动的物理微环境。
在同样添加4%菌剂的条件下,混配纤维素酶的外源添加剂效果优于只具有菌剂的外源添加剂。具体表现在:添加2%纤维素酶的T4组和T8组较不添加纤维素酶的T2组和T6组分别高0.372分和0.557分,表明纤维素酶对促进堆肥腐熟有至关重要的作用。其原因可能是,外源酶可以补充堆料中纤维素酶数量的不足,提升胞外纤维素酶的活力;同时,针对无法直接利用纤维素的微生物,纤维素酶作为中间介质将纤维素分解成微生物易利用的单糖,能有效提高生物质的水解。
在同样添加2%纤维素酶的条件下,分别混配2%和4%的菌剂,在不同粒径条件下的堆肥效果有明显差异。在2 mm粒径组中,添加2%菌剂的T3组效果优于添加4%菌剂的T4组,而5 mm粒径条件下则刚好相反。这可能归因于2 mm较5 mm粒径条件更适合高温堆肥细菌群落,并促进具有降解纤维素能力的细菌的生长和繁殖,添加过多菌剂导致微生物数量过多,发酵过程中的微生物环境平衡被破坏,微生物活性受到抑制[33];相反,5 mm条件下接种更多菌剂可以在合理范围内增加微生物数量,促进堆肥的腐熟。这也说明粒径对添加剂的作用效果有重要影响,相似观点是ZHANG等[34]的研究,在不同堆肥粒径下,添加鼠李糖脂,堆肥性质表现出显著差异。
3. 结论
1) 2 mm粒径的堆肥处理较5 mm能促进C/N和E4/E6值下降,提高腐殖质含量、胡敏酸含量和腐殖化系数,有利于堆肥腐殖化和稳定化;外源纤维素酶和菌剂可以降低C/N,提高发芽指数和各项腐殖化指标,促进了有机质降解,提高了堆肥质量。
2)厚壁菌门、绿弯菌门、变形菌门、放线菌门和芽单胞菌门是堆肥的主要菌门。2 mm处理组和同时具有纤维素酶与菌剂的处理组能通过促进功能菌增长,优化堆肥理化性质。
3)采用主成分分析法进行综合评价可得:纤维素酶和菌剂混配的促腐效果好于单一成分的外源添加剂,2 mm粒径可以增强添加剂的作用效果;T3组(2 mm粒径添加配比为2∶2的外源添加剂)综合评分最高,是最优堆肥处理。
-
表 1 污灌区采样水质测定分析表
Table 1. Analysis table for water quality determination at sampling sites
项目 采样坐标 pH 溶解氧/(mg·L−1) COD/(mg·L−1) 氨氮/(mg·L−1) 总氮/(mg·L−1) 总磷/(mg·L−1) 污灌区水体 44°11'24〃N,87°42'27〃E 7.4 4.6 31 8.4 5.9 0.18 水环境质量标准(GB3838-02)Ⅳ类 — 6~9 3 30 1.5 1.5 0.3 超标倍数 — — 0.53 0.03 4.6 2.93 — 表 2 污水生物膜吸附PHE的拟一级动力学及拟二级动力学参数
Table 2. Parameters of pseudo-first-order kinetics and pseudo-second-order kinetics fitting PHE adsorption onto sewage biofilm
有(无)Cd2+ 拟一级动力学模型 拟二级动力学模型 a b R2 q k R2 无Cd2+ 1.507 0.043 0.986 2 1.60 0.043 0.989 9 有Cd2+ 1.515 0.037 0.955 7 1.62 0.035 0.990 1 表 3 生物膜吸附PHE的Langmuir和Freundlich吸附拟合参数
Table 3. Parameters of Langmuir and Freundlich adsorption model fitting PHE adsorption onto sewage biofilm
有(无)Cd2+ Langmuir 模型 Freundlich 模型 k q R2 a b R2 无Cd2+ 0.109 15.53 0.988 4 1.588 1.339 0.974 6 有Cd2+ 0.079 18.91 0.977 5 1.445 1.255 0.953 4 -
[1] 杨悦锁, 陈煜, 李盼盼, 等. 土壤、地下水中重金属和多环芳烃复合污染及修复研究进展[J]. 化工学报, 2017, 68(6): 2219-2232. [2] CHEN R, ZHANG Q, CHEN H, et al. Source apportionment of heavy metals in sediments and soils in an interconnected river-soil system based on a composite fingerprint screening approach[J]. Journal of Hazardous Materials. 2021, 411(5): 125125. [3] AL S A, DEBADE X, CHEEBBO G, et al. Contribution of atmospheric dry deposition to stormwater loads for PAHs and trace metals in a small and highly trafficked urban road catchment[J]. Environmental Science and Pollution Research. 2017, 24(34): 26497-26512. doi: 10.1007/s11356-017-0238-1 [4] ABDEL-SHAFY H I, MANSOUR M. A review on polycyclic aromatic hydrocarbons: Source, environmental impact, effect on human health and remediation - Science Direct[J]. Egyptian Journal of Petroleum. 2016, 25(1): 107-123. doi: 10.1016/j.ejpe.2015.03.011 [5] OKERE U V, SEMPLE K T. Biodegradation of PAHs in 'pristine' soils from different climatic regions[J]. Journal of Bioremediation & Biodegradation. 2012, 1(2): 1-11. [6] WU S, ZHOU S, BAO H, et al. Improving risk management by using the spatial interaction relationship of heavy metals and PAHs in urban soil[J]. Journal of Hazardous Materials. 2019, 364(15): 108-116. [7] 李兴国, 张克峰, 刘雷, 等. 镉存在条件下湖泊表层沉积物对菲的吸附[J]. 净水技术, 2020, 39(10): 155-161. doi: 10.15890/j.cnki.jsjs.2020.10.024 [8] 宋娜. 自然水体生物膜对菲、林丹和氧氟沙星的吸附特征及机制研究[D]. 吉林: 吉林大学, 2018. [9] WANG L, HUA X Y, ZHANG L, et al. Influence of organic carbon fractions of freshwater biofilms on the sorption for phenanthrene and ofloxacin: The important role of aliphatic carbons[J]. Science of the Total Environment. 2019, 685: 818-826. doi: 10.1016/j.scitotenv.2019.06.203 [10] DONG D, LI L, ZHANG L, et al. Effects of lead, cadmium, chromium, and arsenic on the sorption of lindane and norfloxacin by river biofilms, particles, and sediments[J]. Environmental Science & Pollution Research International. 2017, 25(1): 1-11. [11] HUA X, GUO Z, LAN X. Evidence for a mutual effect of biofilms, suspended particles and sediments on DDT sorption[J]. Environmental Chemistry Letters. 2012, 10(4): 407-411. doi: 10.1007/s10311-012-0369-z [12] HUA X Y, DONG D M , DING X O, et al. Pb and Cd binding to natural freshwater biofilms developed at different pH: the important role of culture pH[J]. Environmental Science & Pollution Research International, 2013, 20 (1) : 413-420. [13] HUANG P, GE C, FENG D, et al. Effects of metal ions and pH on ofloxacin sorption to cassava residue-derived biochar[J]. Science of the Total Environment. 2018, 616: 1384-1391. [14] TAO, YU Q, YAO, et al. Effects of Heavy Metals on the Sorption of Polycyclic Aromatic Hydrocarbons by Microcystis aeruginosa[J]. Journal of Environmental Quality. 2014, 43(6): 1953-1962. doi: 10.2134/jeq2014.01.0028 [15] KONG Q, WU H, LEI L, et al. Solubilization of polycyclic aromatic hydrocarbons (PAHs) with phenol in coking wastewater treatment system: Interaction and engineering significance[J]. Science of the Total Environment, 2018, 628ent, 2018, 62. [16] TAO Y Q, LI W, XUE B, et al. Different effects of copper (II) , cadmium (II) and phosphate on the sorption of phenanthrene on the biomass of cyanobacteria[J]. Journal of Hazardous Materials. 2013, 261(5/6): 21-28. [17] TAO K L, ZHAO S, GAO P , et al. Impacts of Pantoea agglomerans strain and cation-modified clay minerals on the adsorption and biodegradation of phenanthrene[J]. Ecotoxicology and Environmental Safety, 2018, 161: 237otoxi. [18] CHEN W, HABIUL N, LIU X Y, et al. FT-IR and synchronous fluorescence heterospectral two-dimensional correlation analyses on the binding characteristics of copper onto dissolved organic matter[J]. Environmental Science & Technology. 2015, 49(4): 2052-2058. [19] WEI D, Li M T, WANG X, et al. Extracellular polymeric substances for Zn (II) binding during its sorption process onto aerobic granular sludge[J]. Journal of Hazardous Materials. 2016, 301(1): 407-415. [20] TARAFDAR A, SARKAR T K, CHAKRABORTY S, et al. Biofilm development of Bacillus thuringiensis on MWCNT buckypaper adsorption-synergic biodegradation of phenanthrene[J]. Ecotoxicology and Environmental Safety. 2018, 157(8): 327-334. [21] 吴文伶. 离子型化合物对菲吸附解吸影响研究[D]. 天津: 南开大学, 2010. [22] 徐仁扣, 李九玉, 姜军. 可变电荷土壤中特殊化学现象及其微观机制的研究进展[J]. 土壤学报, 2014, 51(2): 207-215. doi: 10.11766/trxb201311100523 [23] ZHANG W, ZHUANG L, YUAN Y, et al. Enhancement of phenanthrene adsorption on a clayey soil and clay minerals by coexisting lead or cadmium[J]. Chemosphere. 2011, 83(3): 302-310. doi: 10.1016/j.chemosphere.2010.12.056 -




 DownLoad:
DownLoad: