-
河道藻类大量繁殖不仅会造成水华,而且藻类会释放大量的胞内有机质 (intracellular dissolved organic matter, I-DOM) ,导致水体化学需氧量 (chemical oxygen demand, COD) 升高,产生色、嗅、味等水质问题,给水质净化带来挑战[1-2]。I-DOM在河道会参与一系列光化学过程和生物化学过程,这些过程会加快I-DOM的降解,有利于降低I-DOM对饮用水安全的不利影响[3];同时,这些过程也导致I-DOM的分子组分发生变化,影响其在河道中的迁移转化和环境效应[4-5]。因此,有必要研究I-DOM的光降解和生物降解机制。
I-DOM是水环境中溶解性有机质 (dissolved organic matter, DOM) 的重要来源之一,I-DOM中各组分的丰度可能与总体DOM有所不同。分子特征不同的DOM在光照和生物作用下会表现出不同的降解特性[6]。HANSEN等[7]研究表明,低分子量、低氧化度以及脂肪族含量较高的DOM分子,如蛋白质、碳水化合物和有机酸,易被生物降解。微生物也能改变有机物的形态,产生分高子量的芳香物质,比如黄腐酸和腐殖酸;高分子量、高芳香性的DOM分子易被光照分解为低分子量有机化合物或完全氧化为无机物,如溶解无机碳 (dissolved inorganic carbon, DIC) 、CO2或CO[8];此外,光照也会影响DOM的生物降解特性[9]。BERTILSSON等[10]的研究发现,光照可以产生易被生物利用的低分子量酸或醛,促进生物降解;而CORY等[11]的研究表明,光照将可生物降解的DOM直接矿化或将其转化为不可生物降解的DOM,抑制生物降解。BITTAR等[2]通过培养铜绿微囊藻,并提取I-DOM探究其光-生物降解特性,结果表明铜绿微囊藻来源I-DOM的光降解和生物降解之间存在竞争关系。
I-DOM具有复杂的化学和结构组成。孙伟等[3]研究发现,太湖蓝藻I-DOM中主要含有类腐植酸和类色氨酸2种物质:类腐植酸物质在紫外光下可以快速降解,在可见光条件下降解很慢,而类色氨酸物质在紫外和可见光条件下均能快速降解。张巧颖等[9]研究发现,太湖蓝藻I-DOM在生物降解过程中,类色氨酸组分的含量逐渐降低,类腐殖质组分变化趋势复杂,其先下降后增加,随后又下降。目前的研究主要应用三维荧光光谱来研究I-DOM的组成、来源和降解特性,缺乏新的表征方法从分子层面解释光降解、生物降解以及有无光照条件对生物降解过程的影响;此外,关于河道藻类来源I-DOM光-生物降解过程中光降解和生物降解间的协同/竞争机制需要进一步探究。
本研究拟通过光化学降解、生物降解以及光-生物降解实验,研究I-DOM在光照和微生物作用下的降解规律,使用傅里叶变换离子回旋共振质谱 (fourier transform ion cyclotron resonance mass, FT-ICR MS) 以期从分子层面探究I-DOM在光降解、生物降解以及二者协同/竞争作用机制,以期为河道水质调控提供参考。
-
藻类样品采集于北京市海淀区清河 (40°0′49.716″N, 116°17′6.695″E) 。使用25号浮游生物网采集河道中的藻类,置于5 L避光、无菌采样瓶中保存。水样以10 000 r·min−1的转速离心10 min分离藻细胞,将藻细胞用超纯水清洗3遍后置于常温或−20 ℃冰箱内反复冻融3次。用孔径为0.22 μm的混合纤维素滤膜过滤得到I-DOM溶液[12]。将上述I-DOM溶液稀释至约5 mg·L−1,保存于无菌玻璃瓶中。
-
光降解实验采用模拟太阳光源 (Sol 2A ABA,美国Newport公司) ,采用持续光照模式,使I-DOM被充分的光降解。辐照度设置为1 000 W·m−2,此时近似地模拟北京夏季正午的太阳光照强度。取1.68 L I-DOM溶液放入2 L无菌透明玻璃瓶中,用橡胶塞密封后置于恒温水浴装置 (25±0.5 ℃) 中持续光照7 d,每天光照24 h。生物降解实验采用恒温生物培养箱,取1.68 L I-DOM溶液放入2 L无菌透明玻璃瓶中,加入1%体积的微生物接种液 (经1.2 μm孔径滤膜过滤的清河水样[13]) 和营养物质[14] (NO3NH4, 50 μmol·L−1和KH2PO4, 5 μmol·L−1) ,并用橡胶塞密封。最后用锡箔纸包裹后在25±0.5 ℃条件下培养7 d。光-生物降解实验是将I-DOM溶液在上述光降解实验条件下光照24 h后用0.22 μm的滤膜过滤,再按照上述生物降解实验条件向I-DOM溶液中加入1%体积的微生物接种液和营养物质并用锡箔纸包裹后培养7 d。光降解和生物降解实验均在第0、1、3、5和7 d取样。光-生物降解实验中,在光降解的第0和1 d以及生物降解的第0、1、3、5和7 d取样。样品经孔径为0.22 μm的滤膜过滤后进行DOC浓度测定和I-DOM的固相萃取。
-
采用TOC分析仪 (TOC-L, Shimazu,日本) 测定样品的DOC浓度。采用便携式气体检测仪 (uSafe 2000/3000,山盾科技有限公司) 和便携式溶解氧检测仪 (JPB-607A,上海仪电科学仪器股份有限公司) 分别测定二氧化碳 (CO2) 和溶解氧 (dissolved oxygen, DO) 的浓度。用产生的CO2与消耗的O2摩尔比,即呼吸商 (respiratory quotient, RQ) 评估微生物呼吸作用[15]。
-
采用固相萃取装置 (Agilent Vac Elut SPS 24,安捷伦科技(上海)有限公司) 和安捷伦Bond Elut PPL固相萃取柱 (200 mg、3 mL) 对样品进行固相萃取以富集I-DOM[16]。具体操作步骤为:1) 用盐酸调节I-DOM样品pH至2.0;2) 在固相萃取装置上安装好PPL柱,先后用6 mL甲醇 (色谱纯) 和6 mL盐酸水溶液 (pH = 2) 淋洗活化柱子;3) 向PPL柱缓慢加入样品,样品以20 mL·min−1的流速通过固相萃取柱以富集I-DOM;4) 样品流完后加入6 mL盐酸水溶液 (pH = 2) 淋洗柱子,以除去盐分;5) 氮吹干燥柱子,然后用6 mL甲醇洗脱,收集洗脱液;6) 在真空条件下干燥洗脱液至甲醇完全挥发,FT-ICR MS测定前用1 mL甲醇溶解。
-
采用Bruker公司的Solarix XR型FT-ICR MS对I-DOM的分子组成进行分析,其磁场强度为15.0 T;离子源采用电喷雾 (ESI) 离子源,进样方式采用直接连续进样,进样流速为120 μL·h−1;离子源喷针电压设置为4.0 kV,样品采用负离子宽谱扫描模式进行分析,离子在碰撞池中储存时间为0.06 s,每个样品采集300次扫描并叠加 (每个样品重复测定3次) 以提高信噪比;质量扫描范围 (m/z) 200~1 000。仪器测定样品前,采用10 mmol·L−1甲酸钠 (50%异丙醇水溶液) 校准液进行外标校准。质谱数据采用Data Analysis软件 (Bruker Daltonics, version 4.2) 进行分析。
根据H/C和O/C的范围将所得分子式分子划分为7类[17],包括:脂质 (H/C = 1.5~2.0;O/C = 0~0.3) ;蛋白质 (H/C = 1.5~2.2;O/C = 0.3~0.67) ;木质素 (H/C = 0.7~1.5;O/C = 0.1~0.67) ;碳水化合物 (H/C = 1.5~2.0;O/C = 0.67~1.2) ;不饱和烃 (H/C = 0.7~1.0;O/C = 0~0.1) ;稠环芳烃 (H/C = 0.2~0.7;O/C = 0~0.67) ;单宁 (H/C = 0.5~1.5;O/C = 0.67~1.2) 。修正的芳香指数 (modified aromaticity index, AImod) 、等效双键数 (double bond equivalent, DBE) 、DBE-O和碳的平均氧化状态 (nominal oxidation state of carbon, NOSC) 具体计算方法如式(1)~式(4)所示。
式中:C、H、O、N、S、P分别是相应原子的个数;Mi为各分子的相对丰度。
-
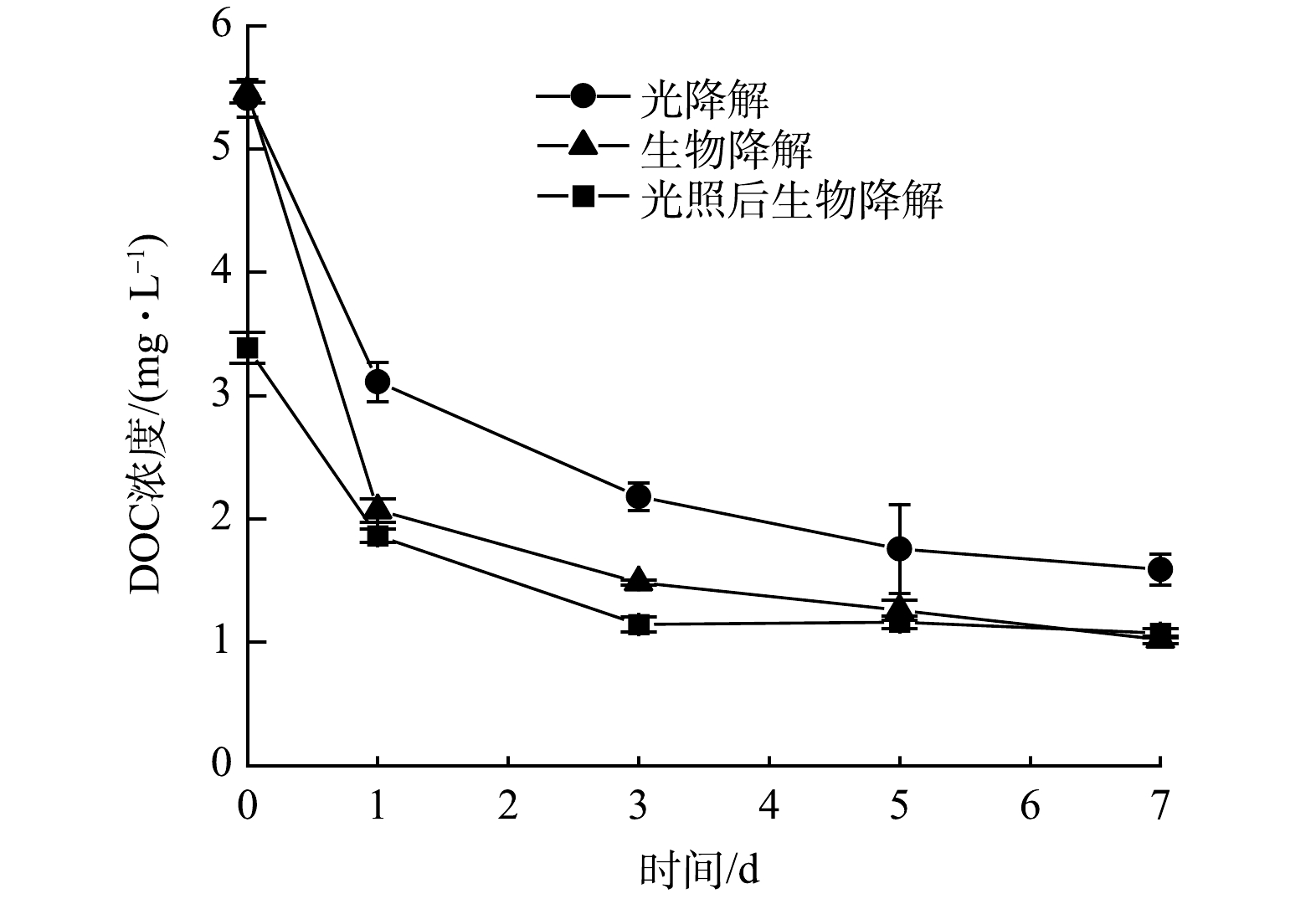
在光降解、生物降解和光-生物降解实验中DOC浓度随时间变化如图1所示。I-DOM经7 d光降解和生物降解后,DOC的去除率分别为70%和81%。而在光-生物降解实验中,I-DOM经1 d光降解,DOC浓度由5.5±0.08 mg·L−1降低至3.4±0.12 mg·L−1,随后经7 d生物降解,DOC浓度由3.4±0.12 mg·L−1降低至1.0±0.04 mg·L−1,DOC的总去除率为81%。光降解和生物降解均能有效地去除DOC,DOC的生物降解去除率略高于光降解,这是由于藻类的初级生产含有较多的碳水化合物和氨基酸类物质,而具有芳香性的化合物含量较低,因此I-DOM更易被生物降解[18]。而光-生物降解过程中光照并没有提高DOC的去除率,光照抑制了I-DOM的生物降解效率,这与OBERNOSTERER和BENNER[19]的研究结果一致。
RQ为表征生物呼吸所时利用底物的性质和氧气供应状态的一种重要指标。经计算,I-DOM生物降解过程的RQ为1.1;光-生物降解过程中,光照后生物降解过程的RQ为2.0。I-DOM光-生物降解过程的RQ高于生物降解过程,表明光照后生物呼吸时所利用I-DOM的性质发生了改变[15],进而影响了生物呼吸时O2的消耗和CO2的产生。
-
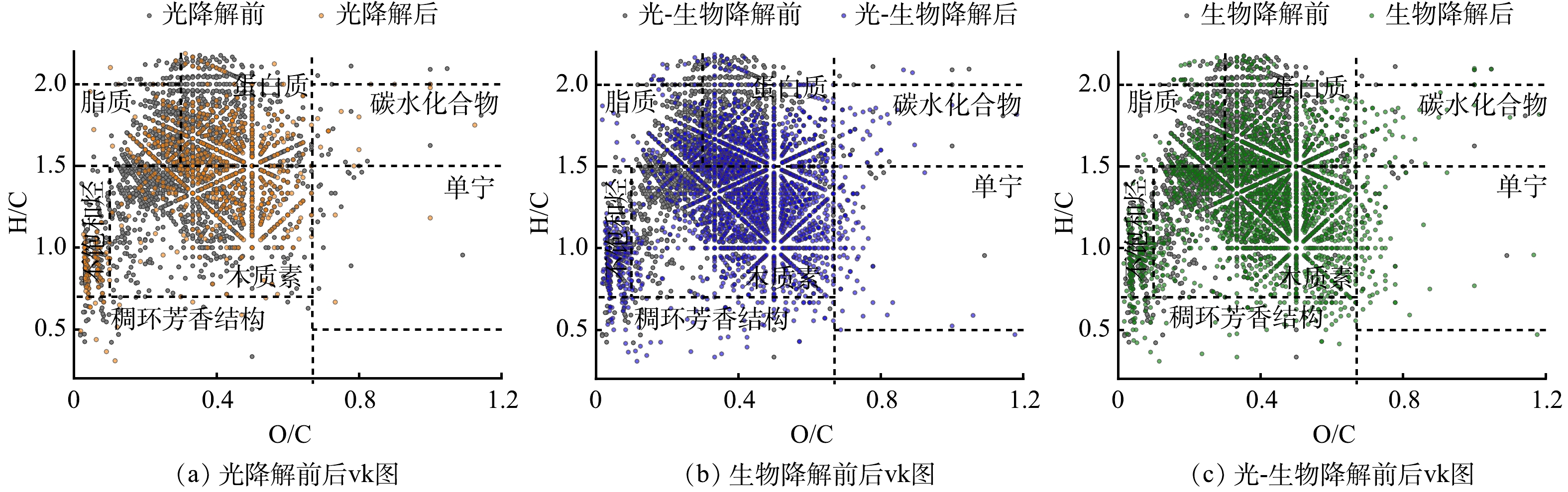
光降解、生物降解及光-生物降解前后I-DOM的分子组分的变化如图2和表1所示。经光降解,I-DOM的分子总数减少了63%,平均分子量从431 Da下降到374 Da,表明光照能够将I-DOM中的大分子物质分解成小分子物质[5]。这是由于I-DOM中的木质素、腐殖质等物质具有共轭结构及苯环等光敏基团,光照能够破坏这类高分子聚合结构,使其裂解形成小分子量的化合物或者分解为无机物,如CO2、CO等[20];同时,H/C降低、O/C和AImod升高,表明光照使I-DOM的芳香性增加,且引入了含氧官能团,这与TRANVIK等[21]研究一致,光照能将I-DOM氧化成不易被生物降解的芳香性I-DOM。这是由于光照产生的自由基能产生交联反应。简单化合物,特别是脂质,经过交联反应能逐渐转化为具有芳香性和异质结构的腐殖质类物质[22]。经生物降解,I-DOM的分子总数增加了29%、平均分子量下降18 Da以及AImod略微升高,这些结果共同表明生物降解产生了具有芳香性的大分子物质补充原有I-DOM体系。这与LECHTENFELD等[23]研究一致,微生物能利用简单的底物产生化学性质复杂的分子;此外,H/C降低和O/C升高,这同样表明I-DOM经生物降解后引入了含氧官能团。相比较而言,光氧化过程略弱于生物氧化过程[24]。光-生物降解后分子总数增加了24%,平均分子量下降了24 Da,其分子组成特征与生物降解后差异不大。光-生物降解过程中的光降解对I-DOM分子特征的改变与单独光降解基本一致。在光-生物降解过程中,I-DOM经光照后,微生物呼吸过程的RQ值明显升高,可能是因为光照将I-DOM中的大分子物质分解成高O/C比的小分子物质[15],微生物代谢时消耗O2减少;同时,小分子物质更易被生物降解矿化生成CO2。
光降解和生物降解后I-DOM的DBE升高,表明光降解和生物降解均能使I-DOM的不饱和度增加[25],但生物降解导致的DBE增加要强于光降解,这可能由于生物降解能够生成富含苯环的芳香性物质。DBE-O通过减去C=O (如,羰基) 对不饱和度的贡献,来更好的反应反映C=C对不饱和度的贡献。结果表明,I-DOM中C=O对不饱和度的贡献远大于烯烃、芳香环以及环烯烃等含C=C结构的物质[26]。I-DOM的NOSC为负值,表明其还原状态较强[27]。经光降解和生物降解后NOSC升高,说明光化学和生物过程均对I-DOM有氧化作用,且生物氧化大于光氧化,这与I-DOM经光降解和生物降解后O/C升高的结果一致。
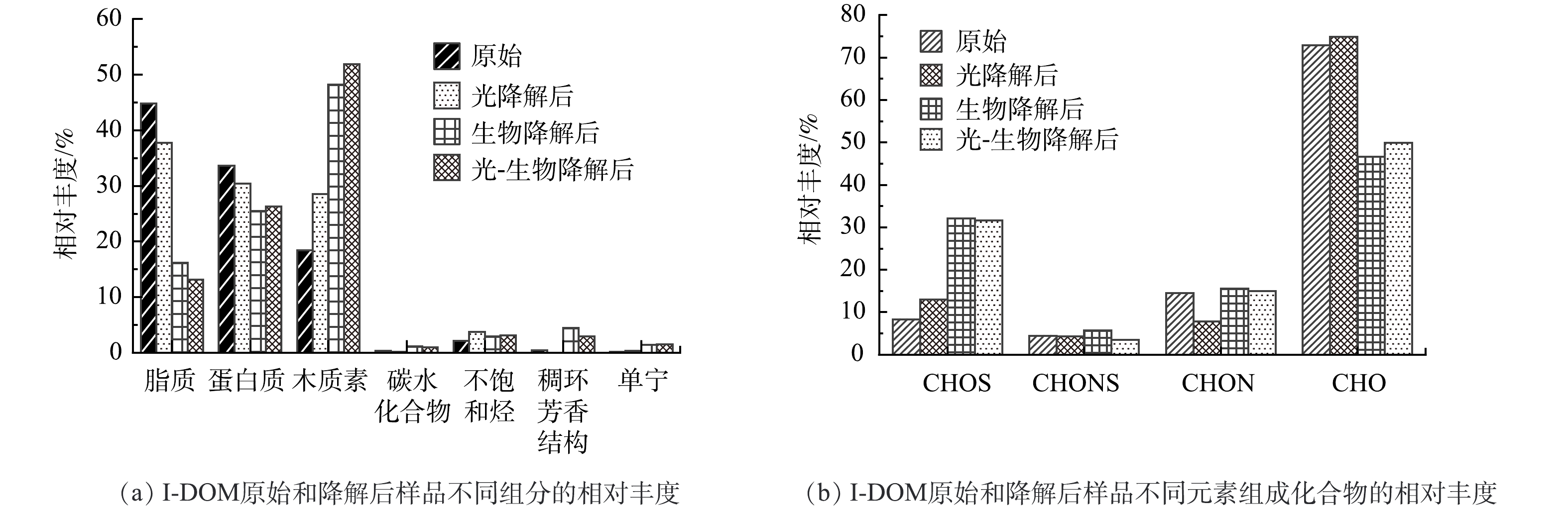
I-DOM原始样品和不同降解过程后样品各组分的相对丰度如图3(a)所示。原始I-DOM中脂质类组分相对丰度最高 (44.8%) ,其次是蛋白质类组分 (33.7%) 和木质素类组分 (18.4%) 。这与LEE等[28]通过三维荧光光谱分析I-DOM组成的结果相似,即I-DOM主要由类似色氨酸的荧光团组成,这一荧光团与蛋白质类化合物有关。这是由于I-DOM中含有许多功能性和结构性的细胞成分,如蛋白质、核酸和叶绿素[2]。光降解后,脂质和蛋白质类组分的相对丰度分别降低了7%和3%,生物降解使脂质和蛋白质类化合物的相对丰度分别降低了29%和8%。木质素类化合物在光降解和生物降解后相对丰度分别增加了10%和30%,这表明与脂质和蛋白质类组分相比,木质素的光化学活性或生物活性较低或者结构转化不完全[24]。此外,由图2可以看出I-DOM经生物降解后生成了木质素类物质。这与张巧颖等[9]研究结果相似,生物降解能产生不易被生物降解的类腐殖质,其可能发生沉降而埋藏在河道沉积物中[29]。光-生物降解与生物降解后,I-DOM各组分的相对丰度的差异不大。
I-DOM原始样品和不同降解过程后样品由不同元素组成化合物的相对丰度如图3(b)所示。原始I-DOM中仅由CHO元素组成的物质相对丰度最高 (73%) ,其次是由CHON元素组成的物质 (14%) 和由CHOS元素组成的物质 (8%) 。含N元素物质的相对丰度高于含S物质,这是由于I-DOM中含有许多功能性和结构性的细胞成分,这些成分会使I-DOM具有较高的N/C[2, 30]。由CHO元素组成的物质经光降解后相对丰度略微增加,经生物降解后其相对丰度降低了26%。在生物降解后含有杂原子的物质相对丰度有所增加,表明不含杂原子的简单DOM易被生物利用,可能对应脂质和蛋白质类组分;而一些含有杂原子的物质易被微生物代谢释放[29],可能对应木质素和一些不易被生物利用的物质。这与JIAO等[31]研究结果一致,即DOM通过生物代谢后具有更高的化学复杂性。光降解和生物降解在消耗由不同元素组成的组分时,也会产生这些组分,这也导致了在转化过程中,各组分的变化是比较复杂的,观测到的各组分变化是其消耗和产生的净结果。
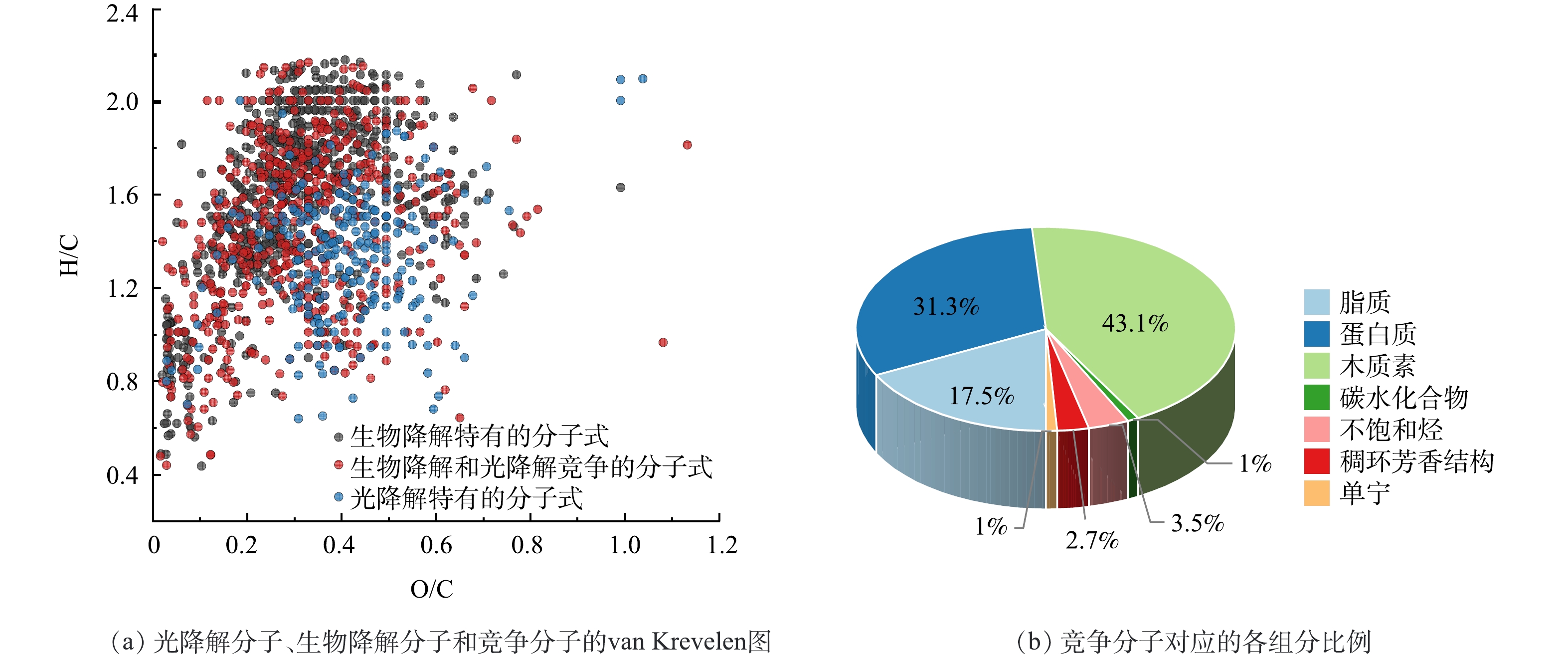
光照可以通过消耗可生物降解的分子从而抑制DOM的生物降解过程[13]。本研究将光-生物降解过程中,光降解和生物降解的共同的分子定义为竞争分子。I-DOM光-生物降解过程中的光降解分子、生物降解分子和竞争分子的van Krevelen图以及竞争分子对应的各组分比例如图4所示。由图4(a)可看出,在光-生物降解过程中,光降解和生物降解存在竞争关系,竞争分子的个数占可生物降解分子个数的47%。由图4(b)可看出,在竞争分子中,木质素类组分的占比最高 (43.1%) ,其次是蛋白质 (31.1%) 和脂质 (17.5%) 。AMADO等[14]研究证明光降解与生物降解竞争氨基酸,其是光降解和生降解之间相互作用的核心物质,而氨基酸正是构成蛋白质的基本单位。结合I-DOM不同组分相对丰度的变化过程,上述结果说明光-生物降解过程中,光降解与生物降解主要竞争脂质、蛋白质和木质素类组分,而且这些组分大部分含有CHO和N元素[2]。先前的研究表明,光照抑制DOM的生物降解过程可主要归因于:1) 光照产生不易被生物降解的物质[32];2) 光降解和生物降解竞争相同的底物[2]。综合可知,在I-DOM光-生物降解过程中光照对生物降解有抑制作用主要是因为光降解和生物降解竞争相同的底物。
-
1) I-DOM较易被光照和微生物降解,经7 d光降解和生物降解后,DOC的去除率分别为70%和81%。虽然在光-生物降解过程中光照1 d能去除38%的DOC,但后续生物降解 (光-生物降解) 与无光照生物降解对DOC的去除效率一致。
2) 通过FT-ICR MS分析光-生物降解过程中分子组分的变化,发现光降解过程消耗了I-DOM中可生物降解的脂质、蛋白质和木质素类组分,导致后续生物降解效率降低。
3) 在生物降解过程中微生物主要利用原始的I-DOM分子,而在光-生物降解过程中,生物降解过程中微生物主要利用经光降解转化后的I-DOM分子。光-生物降解过程中,光照将I-DOM中的大分子物质分解成高O/C比的小分子物质,使微生物代谢需要的O2减少,小分子物质则更易被生物降解矿化生成CO2,导致RQ升高。
河道藻源胞内有机质光化学-生物降解机制
Photochemical-biodegradation mechanism of intracellular dissolved organic matter from river algae
-
摘要: 藻细胞破裂后会向水体释放大量的胞内有机质 (intracellular dissolved organic matter, I-DOM) 。I-DOM在河道中将经历复杂的光降解和生物降解过程,影响其在河道中的迁移转化和环境效应。为了探明光照和微生物对I-DOM的降解机制,开展了光降解、生物降解和光-生物降解实验。结果表明,I-DOM经7 d光降解和生物降解后,溶解性有机碳 (dissolved organic carbon, DOC) 的去除率分别为70%和81%;虽然光照1 d能去除38%的DOC,但后续生物降解 (光-生物降解) 与无光照生物降解对DOC的去除效率一致。进一步的研究表明,生物降解过程中的呼吸商 (respiratory quotient, RQ) 低于光-生物降解过程,说明相比于生物降解过程,光-生物降解过程中经光照后生物呼吸时所利用I-DOM的性质发生了改变,进而影响了生物呼吸时O2的消耗和CO2的产生。生物降解过程中微生物主要利用原始的I-DOM分子;而在光-生物降解过程中,生物降解过程的微生物主要利用经光降解转化后的I-DOM分子。光-生物降解过程中,光照消耗了I-DOM中可生物降解的脂质、蛋白质和木质素类组分,导致I-DOM的生物降解效率降低;同时,光照将I-DOM中的大分子物质分解成高O/C的小分子物质,使微生物代谢需要的O2减少,小分子物质则更易被生物降解矿化生成CO2,导致RQ升高。本研究结果可为河道水质调控提供参考。
-
关键词:
- 生物降解 /
- 光降解 /
- 胞内有机质 /
- 傅里叶变换离子回旋共振质谱
Abstract: The rupture of algal cells leads to the release of a significant amount of intracellular dissolved organic matter (I-DOM) into the aquatic environment. I-DOM undergo complex photodegradation and biodegradation processes in river, affecting its migration, transformation and environmental effects. To investigate the degradation mechanism of I-DOM by irradiation and microorganisms, photodegradation, biodegradation, and photo-biodegradation experiments were conducted. The results showed that after 7 days of photodegradation and biodegradation, the removal rates of dissolved organic carbon (DOC) of I-DOM were 70% and 81%, respectively. Although irradiation for one day can remove 38% of DOC, the subsequent biodegradation (photo-biodegradation) removal efficiency of DOC was the same as that of non-irradiation biodegradation. Further research showed that the respiratory quotient (RQ) during biodegradation process was lower than during photo-biodegradation process, indicating that compared with the biodegradation process, the properties of I-DOM used by microbial respiratory after irradiation in the photo-biodegradation process changed, further affecting the consumption of O2 and the production of CO2 during biological respiration. In the process of biodegradation, microorganisms mainly used the original I-DOM molecules, while in the process of photo-biodegradation, microorganisms mainly used the I-DOM molecules transformed by photodegradation. In the process of photo-biodegradation, irradiation consumed the biodegradable lipid, protein and lignin components in I-DOM, resulting in a decrease in the biodegradation efficiency of I-DOM. At the same time, irradiation decomposes high molecular weight I-DOM into low molecular weight I-DOM with high O/C, reducing the O2 required for microbial metabolism. The low molecular weight substances were more likely to be biodegraded and mineralized to produce CO2, resulting in a significant increase in RQ. This study contributes to our understanding of the migration and transformation of I-DOM in rivers and provides reference for water quality control. -

-
表 1 I-DOM原始样品和降解后的FT-ICR MS表征
Table 1. I-DOM FT-ICR MS characterization of initial and after degradation samples
分子水平参数 原始 光降解 生物降解 光-生物降解 分子数 2167 809 2790 2677 H/C 1.61 1.47 1.39 1.38 O/C 0.31 0.35 0.37 0.38 AImod 0.10 0.16 0.19 0.19 平均分子量 431 374 418 407 DBE 5.24 6.18 7.28 7.10 DBE-O −0.56 −0.04 0.49 0.18 NOSC −1.00 −0.77 −0.64 −0.61 -
[1] 叶琳琳, 史小丽, 吴晓东, 等. 西太湖秋季蓝藻水华过后细胞裂解对溶解性有机碳影响[J]. 中国环境科学, 2011, 31(1): 131-136. [2] BITTAR T B, VIEIRA A A H, STUBBINS A, et al. Competition between photochemical and biological degradation of dissolved organic matter from the cyanobacteria Microcystis aeruginosa[J]. Limnology and Oceanography, 2015, 60(4): 1172-1194. doi: 10.1002/lno.10090 [3] 孙伟, 巩小丽, 陈煜, 等. 太湖藻源溶解性有机质光化学降解研究[J]. 湖泊科学, 2018, 30(1): 91-101. [4] YIN H, WANG Y, HUANG J. Photodegradation-induced biological degradation of treated wastewater effluent organic matter in receiving waters[J]. Water Research, 2021, 204: 117567. doi: 10.1016/j.watres.2021.117567 [5] ZHANG H, ZHENG Y, WANG X C, et al. Characterization and biogeochemical implications of dissolved organic matter in aquatic environments[J]. Journal of Environmental Management, 2021, 294: 113041. doi: 10.1016/j.jenvman.2021.113041 [6] CORY R M, KLING G W. Interactions between sunlight and microorganisms influence dissolved organic matter degradation along the aquatic continuum[J]. Limnology and Oceanography Letters, 2018, 3(3): 102-116. doi: 10.1002/lol2.10060 [7] HANSEN A M, KRAUS T E, PELLERIN B A, et al. Optical properties of dissolved organic matter (DOM): Effects of biological and photolytic degradation[J]. Limnology and Oceanography, 2016, 61(3): 1015-1032. doi: 10.1002/lno.10270 [8] GOLDSTONE J, PULLIN M, BERTILSSON S, et al. Reactions of hydroxyl radical with humic substances: Bleaching, mineralization, and production of bioavailable carbon substrates[J]. Environmental Science & Technology, 2002, 36(3): 364-372. [9] 张巧颖, 孙伟, 杜瑛珣, 等. 太湖蓝藻胞内有机质的微生物降解[J]. 环境科学, 2021, 42(4): 1870-1878. doi: 10.13227/j.hjkx.202007227 [10] BERTILSSON. S, STEFAN. L. Photochemically produced carboxylic acids as substrates for freshwater bacterioplankton[J]. Limnology and Oceanography, 1998: 885-895 [11] BOWEN J C, KAPLAN L A, CORY R M. Photodegradation disproportionately impacts biodegradation of semi-labile DOM in streams[J]. Limnology and Oceanography, 2020, 65(1): 13-26. doi: 10.1002/lno.11244 [12] LI L, GAO N, DENG Y, et al. Characterization of intracellular & extracellular algae organic matters (AOM) of Microcystic aeruginosa and formation of AOM-associated disinfection byproducts and odor & taste compounds[J]. Water Research, 2012, 46(4): 1233-1240. doi: 10.1016/j.watres.2011.12.026 [13] WARD C P, NALVEN S G, CRUMP B C, et al. Photochemical alteration of organic carbon draining permafrost soils shifts microbial metabolic pathways and stimulates respiration[J]. Nature Communications, 2017, 8(1): 772. doi: 10.1038/s41467-017-00759-2 [14] AMADO A M, COTNER J B, CORY R M, et al. Disentangling the interactions between photochemical and bacterial degradation of dissolved organic matter: amino acids play a central role[J]. Microbial Ecology, 2015, 69(3): 554-566. doi: 10.1007/s00248-014-0512-4 [15] ALLESSON L, STRöM L, BERGGREN M. Impact of photochemical processing of DOC on the bacterioplankton respiratory quotient in aquatic ecosystems[J]. Geophysical Research Letters, 2016, 43(14): 7538-7545. doi: 10.1002/2016GL069621 [16] HAN R, LV J, LUO L, et al. Molecular-scale investigation of soil fulvic acid and water-extractable organic matter by high-resolution mass spectrometry and 1H NMR spectroscopy[J]. Environmental Chemistry, 2019, 16(2): 92-100. doi: 10.1071/EN18124 [17] HOCKADAY W C, PURCELL J M, MARSHALL A G, et al. Electrospray and photoionization mass spectrometry for the characterization of organic matter in natural waters: a qualitative assessment[J]. Limnology and Oceanography:Methods, 2009, 7(1): 81-95. doi: 10.4319/lom.2009.7.81 [18] 王新科, 金红, 梁生康, 等. 长江口不同来源溶解有机质光化学/微生物降解作用及机制研究[J]. 中国海洋大学学报, 2020, 50(12): 88-97. [19] OBERNOSTERER I, BENNER R. Competition between biological and photochemical processes in the mineralization of dissolved organic carbon[J]. Limnology and Oceanography, 2004, 49(1): 117-124. doi: 10.4319/lo.2004.49.1.0117 [20] ZHANG Y, LIU X, OSBURN C L, et al. Photobleaching response of different sources of chromophoric dissolved organic matter exposed to natural solar radiation using absorption and excitation–emission matrix spectra[J]. PLoS ONE, 2013, 8(10): e77515. doi: 10.1371/journal.pone.0077515 [21] TRANVIK L, OLOFSSON H, BERTILSSON S. Photochemical effects on bacterial degradation of dissolved organic matter in lake water[A]. In Microbial Biosystems: New Frontiers, Proceedings of the th International Symposium on Microbial Ecology. Atlantic Canada Society for Microbial Ecology Halifax,1999:193-200. [22] KIEBER R J, HYDRO L H, SEATON P J. Photooxidation of triglycerides and fatty acids in seawater: Implication toward the formation of marine humic substances[J]. Limnology and Oceanography, 1997, 42(6): 1454-1462. doi: 10.4319/lo.1997.42.6.1454 [23] LECHTENFELD O J, HERTKORN N, SHEN Y, et al. Marine sequestration of carbon in bacterial metabolites[J]. Nature Communications, 2015, 6: 6711. doi: 10.1038/ncomms7711 [24] LIU Y F, WANG M L, YIN S J, et al. Comparing photoactivities of dissolved organic matter released from rice straw-pyrolyzed biochar and composted rice straw[J]. Environmental Science & Technology, 2022, 56(4): 2803-2815. [25] RIVAS-UBACH A, LIU Y, BIANCHI T S, et al. Moving beyond the van Krevelen diagram: A new stoichiometric approach for compound classification in organisms[J]. Analytical Chemistry, 2018, 90(10): 6152-6160. doi: 10.1021/acs.analchem.8b00529 [26] PHUNGSAI P, KURISU F, KASUGA I, et al. Changes in dissolved organic matter composition and disinfection byproduct precursors in advanced drinking water treatment processes[J]. Environmental Science & Technology, 2018, 52(6): 3392-3401. [27] BROOKER M R, LONGNECKER K, KUJAWINSKI E B, et al. Discrete organic phosphorus signatures are evident in pollutant sources within a lake erie tributary[J]. Environmental Science & Technology, 2018, 52(12): 6771-6779. [28] LEE D, KWON M, AHN Y, et al. Characteristics of intracellular algogenic organic matter and its reactivity with hydroxyl radicals[J]. Water Research, 2018, 144: 13-25. doi: 10.1016/j.watres.2018.06.069 [29] JIAO N, HERNDL G J, HANSELL D A, et al. Microbial production of recalcitrant dissolved organic matter: long-term carbon storage in the global ocean[J]. Nature Reviews Microbiology, 2010, 8(8): 593-599. doi: 10.1038/nrmicro2386 [30] FANG J, YANG X, MA J, et al. Characterization of algal organic matter and formation of DBPs from chlor(am)ination[J]. Water Research, 2010, 44(20): 5897-5906. doi: 10.1016/j.watres.2010.07.009 [31] JIAO N, CAI R, ZHENG Q, et al. Unveiling the enigma of refractory carbon in the ocean[J]. National Science Review, 2018, 5(4): 459-463. doi: 10.1093/nsr/nwy020 [32] TRANVIK L J, BERTILSSON S. Contrasting effects of solar UV radiation on dissolved organic sources for bacterial growth[J]. Ecology Letters, 2001, 4(5): 458-463. doi: 10.1046/j.1461-0248.2001.00245.x -



 下载:
下载: