-
排水管网沉积物淤堵问题越来越引起广大水处理研究人员的关注。造成市政管网淤堵的沉积物主要包括无机颗粒、有机颗粒以及一些固体垃圾(如树叶、塑料、生活垃圾等)。其中,有机颗粒主要是人和动物的排泄物以及厨余垃圾等[1]。这些有机物质长期存在于市政管网中,不仅降低了管网的输水能力,还在厌氧微生物代谢作用下产生酸性物质腐蚀管道,并且产生有毒有害气体,严重威胁管道维修工人及人民的生命安全[2]。目前国内常用的市政管网清淤方法主要以机械清淤为主,包括人工清淤法、缓车清淤法、高压水射流清淤法、水冲刷清淤法等[3]。这些清淤措施效果较好,但人力物力消耗较大,影响道路的正常交通,且清淤频率过高。因此,延缓管道沉积物沉积对缓解管网淤堵和方便管网维护具有重要意义。
污水管网中有机质的沉积促进了厌氧微生物的大量繁殖,而厌氧微生物在生命活动过程中分泌大量具有黏性的高分子胞外聚合物质(EPS)[4],进而又促进了沉积物在管网内壁上的粘附以及对流水中有机物的吸附作用,这不仅增加了沉积物沉积的速率,还增加了沉积物被水流冲走的难度,造成管道淤堵程度的加深。生物酶是一种具有高催化效能和专一性的特殊蛋白质,它能有效地破坏微生物细胞及EPS结构,并将大分子有机质水解成微生物可利用的小分子物质[5],具有反应条件温和、不会造成金属离子污染等优点,近年来在剩余污泥处理方面备受关注[6]。例如,罗琨等[7]通过外加生物酶促进剩余污泥中悬浮固体的溶解和大分子有机物的降解,蛋白酶和淀粉酶的配比为1:3时,水解效果最佳,VSS去除率达68.24%;宋勇[8]采用溶菌酶对活性污泥进行减量研究,结果表明溶菌酶添加系统相对传统活性污泥系统的污泥减量效果达37.33%;ZOU等[9]采用溶菌酶和蛋白酶的比例为4:1混合水解剩余污泥,污泥细胞和EPS结构破坏,胞内物质释放,胞外蛋白和多糖分别增加了118%和64% ,处理后的污泥可直接作为反硝化碳源。针对以有机质淤堵为主的市政排水管网,采用生物酶技术进行处理,可以水解有机物及破坏微生物EPS结构,促进有机质分子由固相向液相转移,减缓管网淤堵的速率的效能,但目前这方面的研究国内外尚为空白。
基于以上研究,本研究采用生物酶处理排水管网沉积物,对比研究了中性蛋白酶、α-淀粉酶、纤维素酶和溶菌酶对沉积物水解效果的影响,选择性价比最优酶制剂,考察了酶投加量、反应时间、反应温度和pH等对沉积物水解效果的影响,并根据反应前后沉积物EPS、三维荧光光谱和SEM表征结果进行了机理探讨。
-
实验所用管网沉积物取自天津市某小区检查井,取回后封装于样品袋中,于4 ℃的冰箱里冷藏待用。沉积物有机质含量为(49.37±2.64)%,pH=7.28±0.42;沉积物上清液中SCOD值为(259.03±24.71) mg·L−1、氨氮为(23.02±2.14) mg·L−1、多糖为(14.21±3.43) mg·L−1、蛋白质为(0.08±0.01) mg·mL−1,实验所用酶制剂见表1 ;其他化学试剂均为分析纯,实验用水为去离子水。
实验主要仪器包括SX-GO7103马弗炉(天津中环);YH-3BS远红外线恒温干燥箱(天津中环);TDL-40B低速离心机(上海安亭);MY3 000-6B混凝实验搅拌仪器(武汉梅宇仪器);721型可见分光光度计(上海佑科); FY-1C-N真空泵(浙江飞越);PHS-3E型pH计(雷磁);HH-4电热恒温水浴锅(绍兴苏珀)。
-
在250 mL烧杯中加入150 mL实验沉积物样品,向沉积物中投加0%~10%(质量百分比,酶质量/沉积物干质量)中性蛋白酶,调节pH至5~10,将烧杯放入水浴锅预热,使沉积物到目标温度(4~65 ℃)后,将酶制剂投到沉积物中,以200 r·min−1连续搅拌混合,反应0~6 h。反应结束后,一部分样品进行有机质含量检测;另一部分样品于4 000 r·min−1 离心15 min ,取上清液经 0.45 µm 滤膜过滤,检测滤液中SCOD 、氨氮、多糖,并在最佳反应条件下,分析EPS、沉积物表面结构形态以及有机物变化情况。
-
溶解性化学需氧量(SCOD)采用5B-1型COD快速测定仪(兰州连华环保科技有限公司)进行测定;多糖含量采用苯酚-硫酸法( NY/T 1 676-20 );氨氮含量采用纳氏试剂分光光度法( HJ535-2 009);蛋白质含量采用改良 Lowry 法;pH 采用 pH 计测定;沉积物结构变化利用7610F型扫描电子显微镜(日本电子株式会社)观测;EPS采用热提取法;EPS中各类物质变化采用三维荧光扫描光谱仪(安捷伦1260)检测,激发波长(Ex)为220~450 nm,发射波长(Em)为250~550 nm,Ex扫描间隔5 nm,Em扫描间隔10 nm。
沉积物中有机质含量测定采用《中华人民共和国城镇建设行业标准》(CJ/T96-1 999)中有机质灼烧法[10],有机质含量根据式(1)计算。
式中:C为沉积物有机质含量,%; m1为坩埚和烘干沉积物质量,g;m2为坩埚和灼烧后沉积物质量,g;m样为沉积物质量,g;Χ 为沉积物样品含水率,%。
-
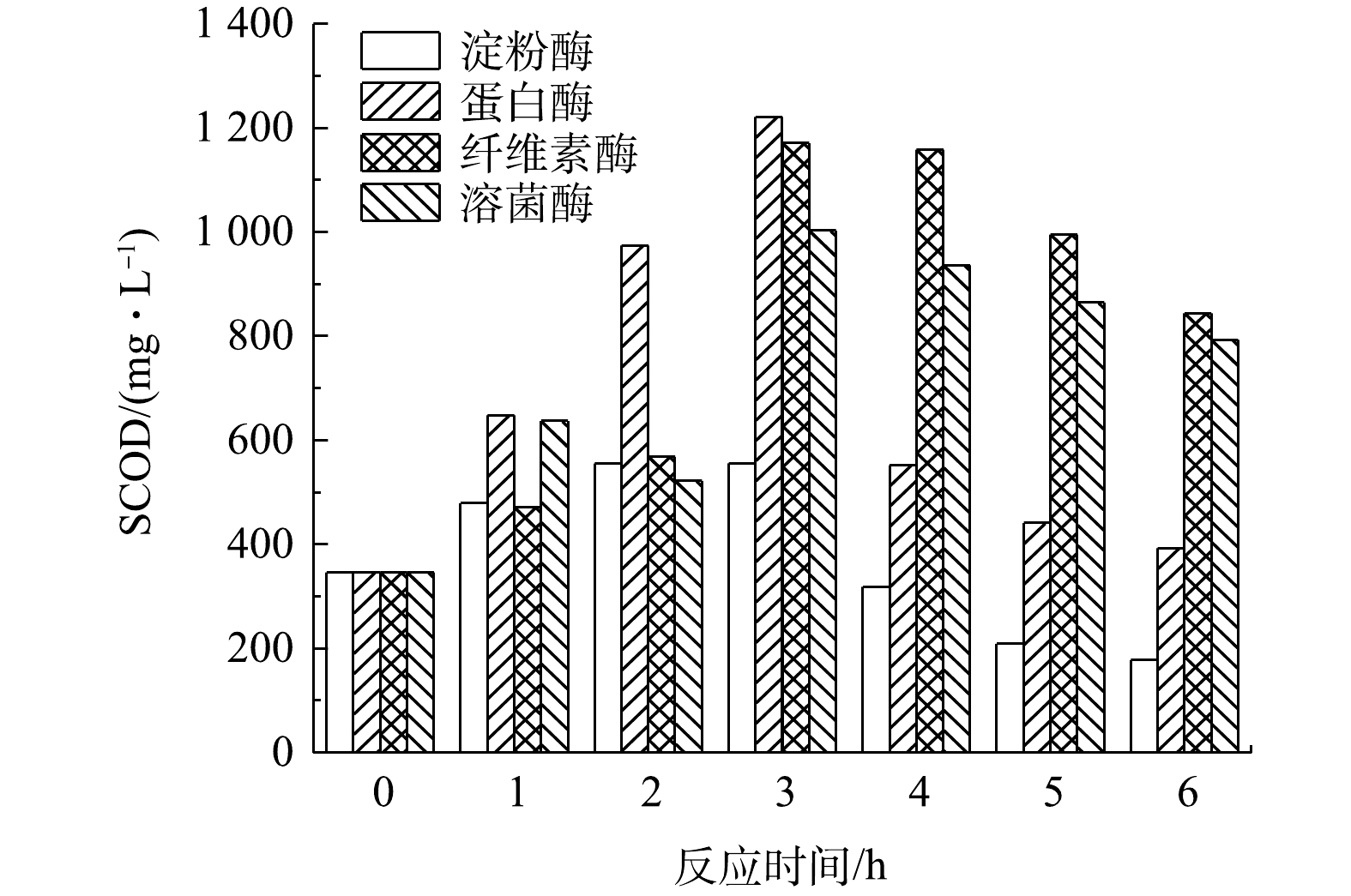
实验首先选取1%(质量百分数)的α-淀粉酶、中性蛋白酶、纤维素酶以及溶菌酶来水解管网沉积物,在25 ℃、pH=7 的条件反应 6 h,结果如图1所示。由图1可知,4种酶水解沉积物后SCOD均随反应时间的延长先升高后下降,反应 3 h时水解效果最好,在3 h时4种酶制剂的水解效果由大到小依次为中性蛋白酶>纤维素酶>溶菌酶>α-淀粉酶。单独投加中性蛋白酶与纤维素酶后,SCOD由原始的346.44 mg·L−1 分别上升到1 221.50 mg·L−1和1 170.80 mg·L−1。这可能是由于酶制剂具有专一性,而沉积物中蛋白类与纤维素类物质含量较多,从而使得经中性蛋白酶与纤维素酶水解后沉积物上清液的SCOD相较于经α-淀粉酶与溶菌酶处理后的上清液SCOD升高的较快。投加溶菌酶后SCOD提高到1 003.30 mg·L−1,这是由于溶菌酶能有效分解细菌细胞壁的肽聚糖[11],致使管网微生物胞内物质溶出。由于沉积物中可供淀粉酶水解的糖类、淀粉类物质较少,导致淀粉酶效果最差,SCOD 仅上升到 555.80 mg·L−1。
中性蛋白酶与纤维素酶水解效果在3 h 相差不明显,中性蛋白酶的水解效果更佳,但在3~6 h 内,纤维素酶水解效果要优于中性蛋白酶。考虑到纤维素酶(72元·g−1)相对于中性蛋白酶(2.4 元·g−1)来说更加昂贵,从经济性角度与水解效果来看,选择中性蛋白酶更为合适。
-
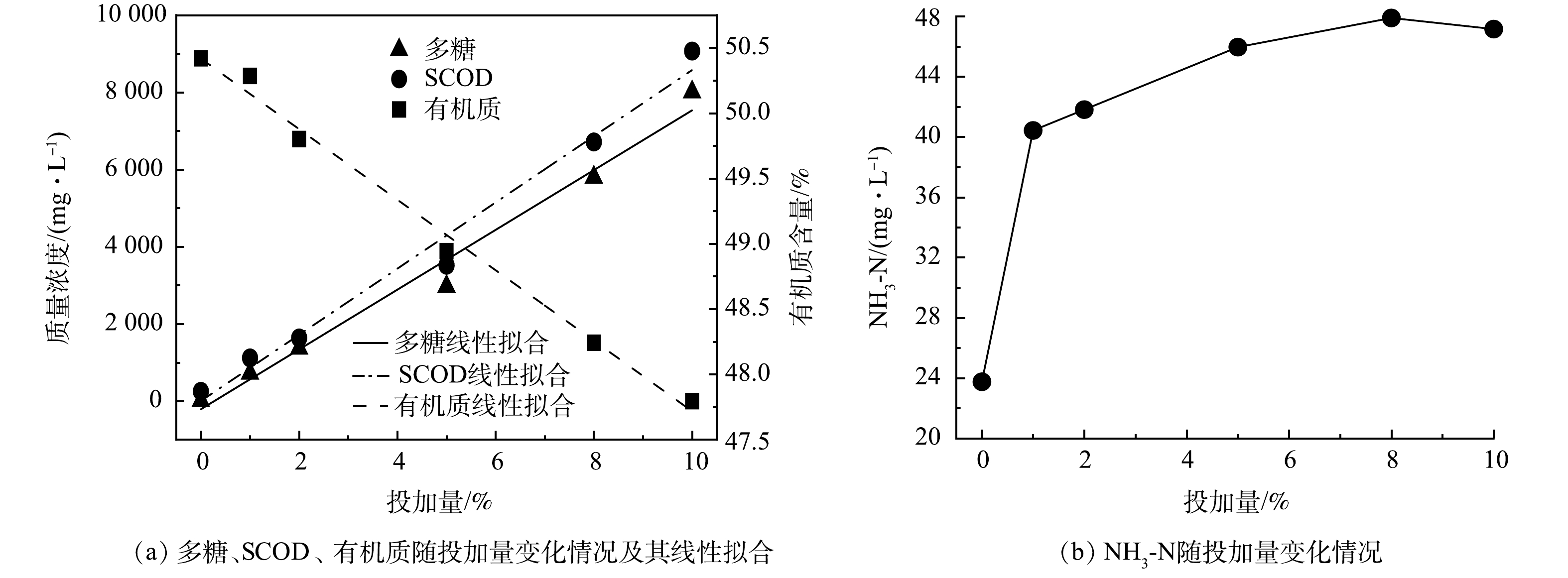
中性蛋白酶的用量直接影响沉积物水解的效果与成本。在pH=7、反应时间3 h 、温度25 ℃的条件下,研究了中性蛋白酶投加量为0%、1%、2%、5%、8%和10%(质量百分数)时对管网沉积物中有机质、SCOD、多糖与氨氮的影响(图2)。由图2(a)可知,当酶投加量从0增加到5%时,多糖和SCOD分别从12.14 mg·L−1和253.20 mg·L−1增加到2 970.23 mg·L−1和3 520.30 mg·L−1 ;此后,随着投加量的进一步增加,SCOD和多糖迅速增加,当中性蛋白酶投加量为10%时,两者分别达到8 009.16 mg·L−1和9 070.60 mg·L−1。这是由于在该投加量范围内,管网沉积物中有机质含量远大于酶含量,根据酶促反应动力学可知,当底物浓度远高于酶浓度时,随着酶浓度的升高,酶反应速率快速上升,并与酶浓度成线性关系,表现为一级反应[12-13]。由图2(a)可见,SCOD 和多糖均随酶投加量的增加呈线性增加,属于一级反应,对应的拟合度均为R12=0.984。而有机质含量的变化趋势与SCOD、多糖不同(图2(a)),其随中性蛋白酶投加量的增多呈线性降低,对应R22=0.992,当投加量为10%时,有机质含量由原始的50.42%降为47.79%。
由图2(b)可见,氨氮的变化趋势与中性蛋白酶投加量之间不存在线性关系。在中性蛋白酶投加量为1%时,氨氮由原始沉积物的23.75 mg·L−1 迅速升至40.43 mg·L−1 ;此后,随着中性蛋白酶投加量的增加缓慢增加,在投加量为8%时,氨氮质量浓度达到最大值,为47.89 mg·L−1 ;此后,随着投加量的进一步增加,氨氮浓度基本不变。根据SCOD、多糖、氨氮及有机质含量的变化可知,中性蛋白酶可以水解沉积物中的有机质,将大分子有机质水解为多糖、氨氮等物质并释放至液相。在投加量为0%~10%时,中性蛋白酶水解沉积物效果随投加量增大而增大,但从经济性和水解效果两方面考虑,选择8%为最佳投药量。
-
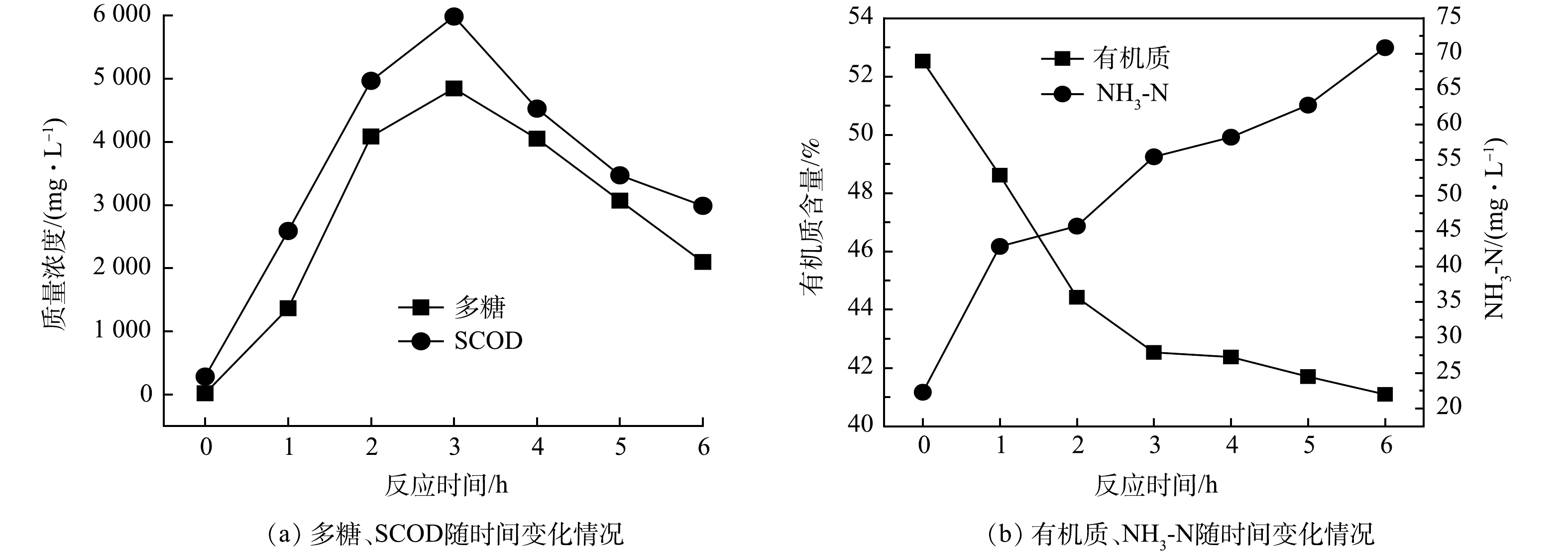
图3为中性蛋白酶投加量为8%,pH 7,温度25 ℃时,反应时间对上清液中 SCOD、多糖、氨氮和有机质变化的影响。由图3(a)可以看出,SCOD和多糖均随着反应时间的延长呈先升高而后降低的趋势。其中,多糖和SCOD 在 3 h 时达到最大值 ,分别为4 844.92 mg·L−1和 5 984.30 mg·L−1 。这是因为在0~3 h时,中性蛋白酶保持高活性状态,随着反应时间的延长,水解速率增高,多糖等物质溶出,SCOD升高;当反应时间大于3 h后,随着反应时间的延长,酶催化活性逐渐降低,多糖的生成速率低于其分解速率,或又重新吸附到沉积物固体表面,而使多糖浓度降低,SCOD下降[13]。
由图3(b)可以看出,有机质在0~3 h降低迅速,反应3 h时较原污泥降低了10%,3 h以后降低趋势变缓;氨氮随反应时间增加而持续增加。结果表明,中性蛋白酶在与管网淤泥中有机质接触的过程中逐渐将大分子的蛋白质水解成小分子的二肽、多肽与氨基酸[14],氨基酸进一步水解成氨氮和CO2等物质,致使氨氮值逐渐升高;与此同时,沉积物和生物酶本身也发生水解反应,沉积物中微生物的胞内物质及中性蛋白酶内多糖、氨氮等都向外溶出[11],进而促进液相中了氨氮的增加。
-
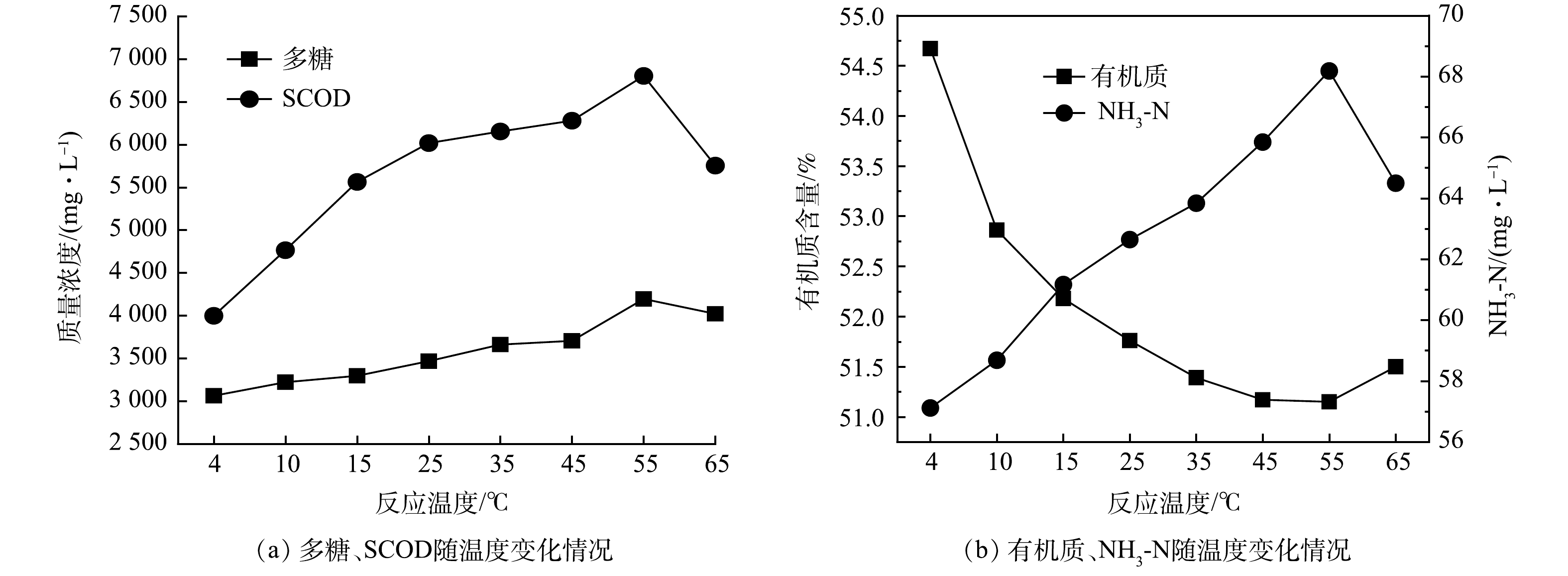
图4 为中性蛋白酶投加量为8%、pH=7、反应时间 3 h 的条件下,温度对中性蛋白酶水解沉积物的影响。由图4可以看出,SCOD、多糖、氨氮均随温度的升高逐渐升高,在55 ℃时达到最佳值,此时上清液中SCOD、多糖、氨氮分别为 6 803.20、4 195.54和 68.18 mg·L−1;而有机质的变化呈相反趋势,随温度升高而下降,55 ℃时,有机质含量由54.67%下降到51.15%。当温度进一步升高到65 ℃时,SCOD、多糖和氨氮三者均下降,有机质升高。
上述结果表明,温度是中性蛋白酶水解沉积物中一个关键的影响因素。根据修正后的 Arrhenius 公式(γ(T)=γ(20 ℃)θ(T-20)),在酶适宜的温度范围内,每升高10 ℃,反应速率可提高1~2倍[15]。在热效应和酶的水解催化作用下,难溶性有机物分解成多糖、氨氮等溶解性有机物,SCOD增加。但并不是温度越高越利于水解反应生成,这是由于中性蛋白酶本质为一种蛋白质,在超高温条件下蛋白质容易发生不可逆变性而失活,丧失部分催化能力[16]。然而,酶在最适温度下才能使水解速率达到最大,但在管网常温条件(25 ℃)下,多糖、SCOD、氨氮分别升高到3 467.93 、 6 717.5和62.64 mg·L−1,有机质下降到51.76%,仍能达到较好的效果。
-
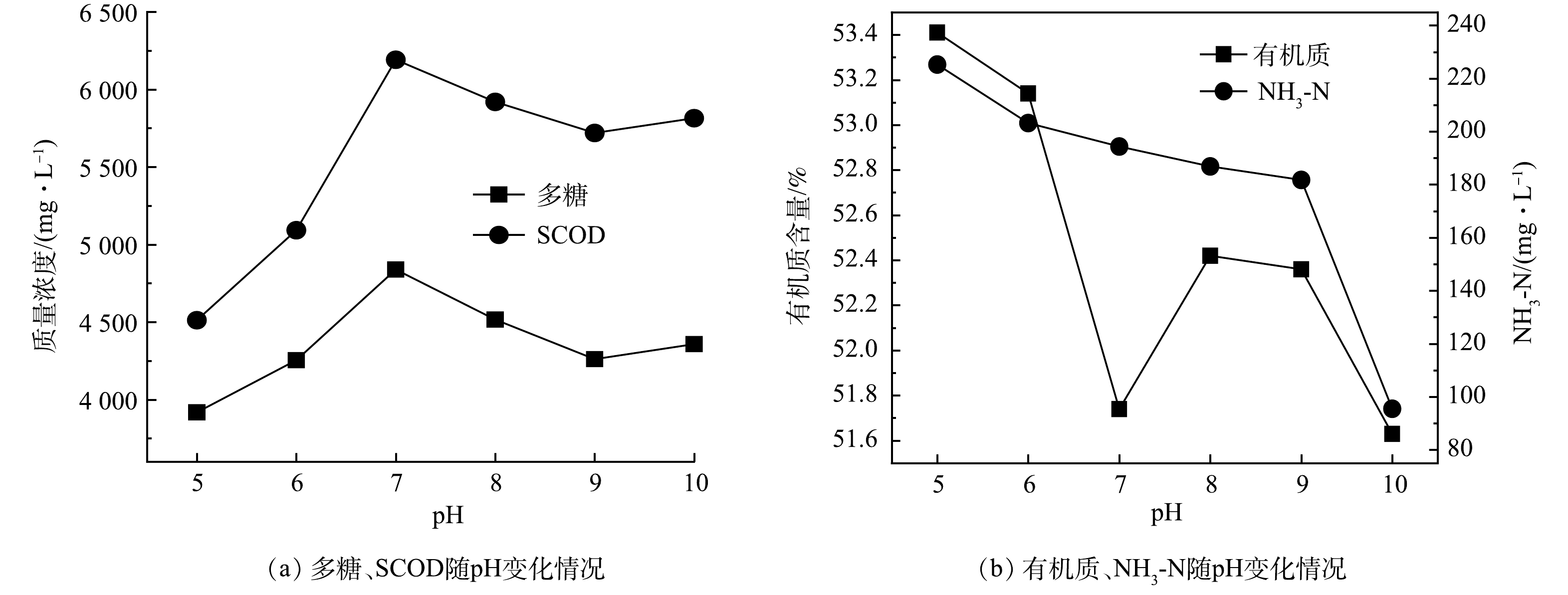
pH与温度一样,对生物酶水解效果会产生较大影响,在中性蛋白酶投加量为8%,温度25 ℃,反应时间 3 h 的条件下,研究了pH为 5~10时对沉积物水解效果的影响,见图5 。由图5(a)可以看出,在pH=5~7时,随pH升高,多糖与SCOD增加;在pH=7时,多糖、SCOD均达到峰值,分别为4 839.28 mg·L−1和6 191.50 mg·L−1;在pH=7~9时,pH增加,多糖、SCOD下降。这可能是由于中性蛋白酶在pH=7时活性最高,处于或高或低的pH环境下,水解速率均受到一定程度的抑制。然而,当pH=10时,SCOD与多糖均有所回升。这可能是由于碱性条件下,固相中的有机质发生碱解,细胞破碎,释放多糖等物质进入液相,SCOD上升[17]。由图5(b)可见,氨氮和有机质含量变化与多糖和SCOD不同。其中,在pH为5~9时,氨氮浓度随pH增加缓慢下降, 当pH在9~10时出现了陡降。这可能是因为在碱性条件下,当氨氮达到一定浓度时,打破气-液平衡,一部分铵根和OH−发生反应生成自由氨释放到气相从而导致氨氮减少[18]。有机质在pH为5~7时逐渐下降,并在pH=7时出现最低点,为51.74%,较原始值 53.41% 降低了1.67%;当pH为8~9时,由于中性蛋白酶水解能力变弱,有机质含量有所回升;当pH进一步升高至10时,尽管中性蛋白酶的活性受到抑制,但有机质含量却再一次显著降低。这是因为在pH=10时,会引起聚合物组成的变化,发生碱解,大分子物质被破坏,并且在高pH下,糖蛋白中的二硫键被破坏,糖醛酸被降解[4],固体有机质由内向外转化成溶解性有机质[19],从而致使有机质含量降低。综上所述,酶制剂发挥最大的水解效果需要最适宜的pH环境,而中性蛋白酶在酸性或碱性条件下酶活降低或失活,水解速率受到抑制,在pH=7时水解沉积物速率较高。
-
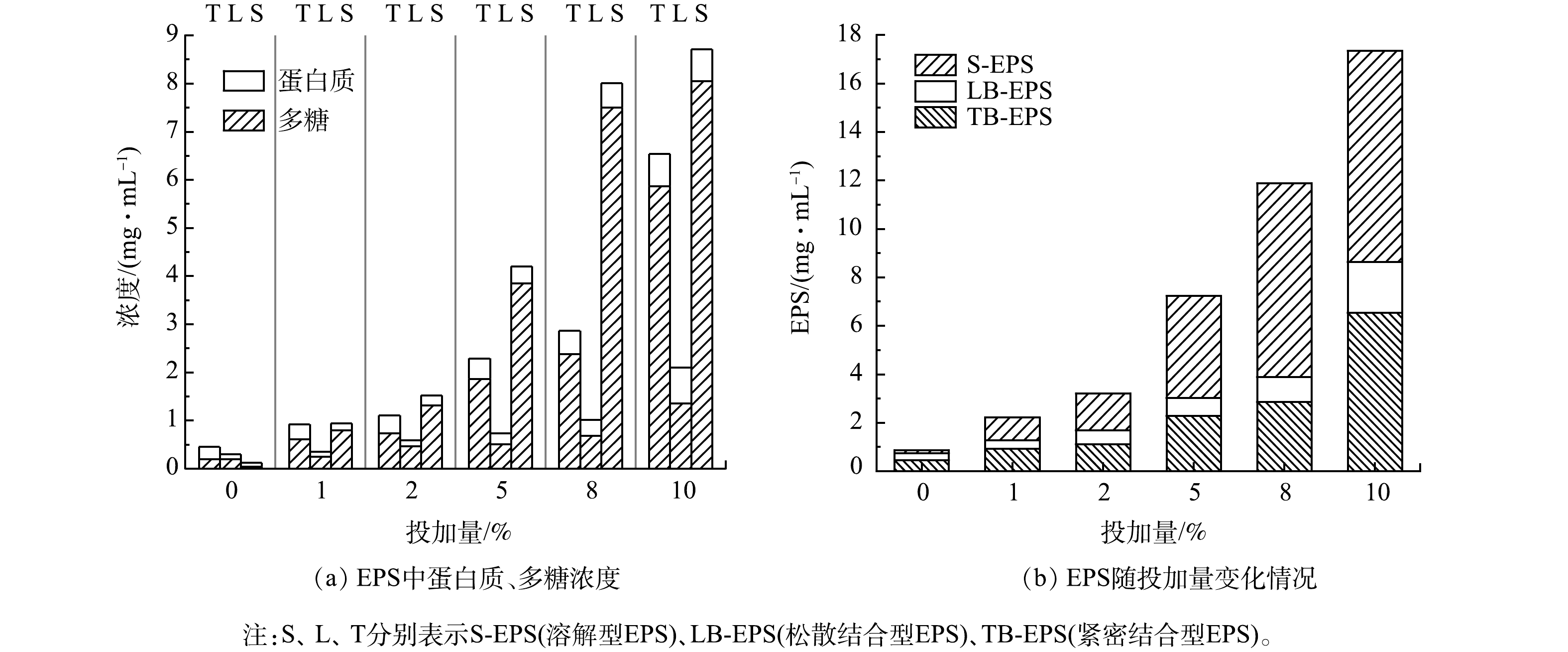
EPS可以由各种微生物产生,包括下水道生物膜中的细菌、真菌和古细菌等,而细菌占绝大多数。细菌在启动、发展和维持过程中,分泌大量的EPS,并实现大量繁殖[20]。EPS的增加提高了沉积物的粘附性[21],可吸附固定污水中的有机颗粒,不利于管网淤泥中有机或无机颗粒向液相的转化,从而促进管网淤泥的增厚。而中性蛋白酶可破坏蛋白质的肽键,进而破坏EPS结构,从而促进固相中有机质向液相转化与释放,减少管网有机质的沉积与增长。水解 3 h 后中性蛋白酶投加量对管网淤泥EPS中多糖与蛋白质的浓度与分布的影响结果见图6。
由图6 (a)可见,随中性蛋白酶投加量的增多,S-EPS、LB-EPS和TB-EPS中的蛋白质和多糖均有不同程度的增加,其中多糖增加的幅度远大于蛋白质,在投加量为10%时,多糖含量达到15.28 mg·mL−1。黄乃先等[1]研究表明,多糖在EPS中的占比为 40%~90% ,蛋白质占比为 1%~60%。因此,EPS中溶出的多糖占据主导地位。此外,中性蛋白酶可水解大分子蛋白质,有可能将溶出的部分蛋白质水解成小分子的二肽、多肽与氨基酸,导致体系中溶出的蛋白质含量较低。由图6(b)可见,EPS总量随投加量增加而增加,且S-EPS 、LB-EPS 、TB-EPS含量为 S-EPS>TB-EPS>LB-EPS 。这可能是由于EPS在中性蛋白酶的作用下结构被破坏,导致EPS被剥离进入液相,其中LB-EPS可能会在中性蛋白酶的作用下进一步被转化为S-EPS,从而使得LB-EPS的增加不如前两者明显。
-
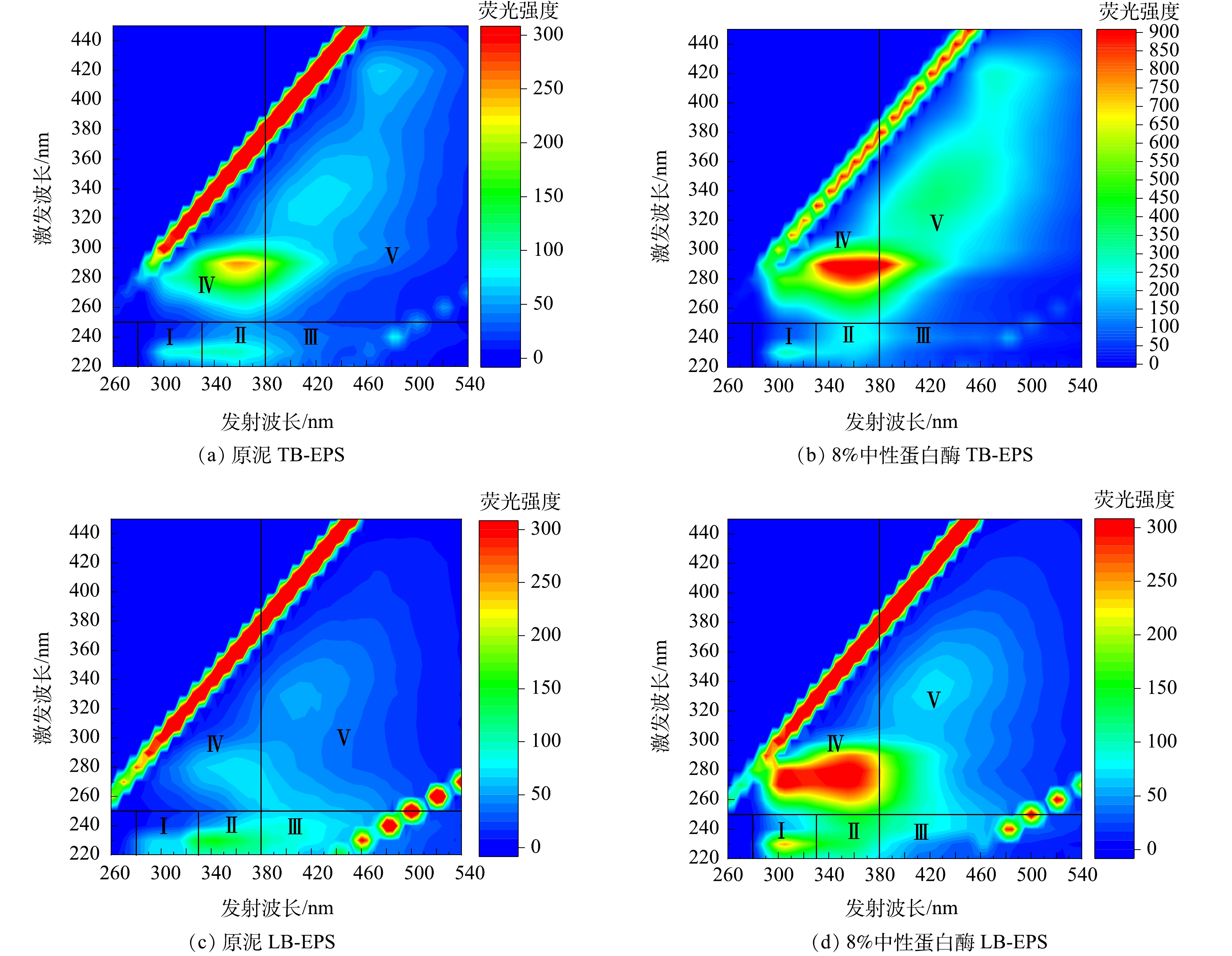
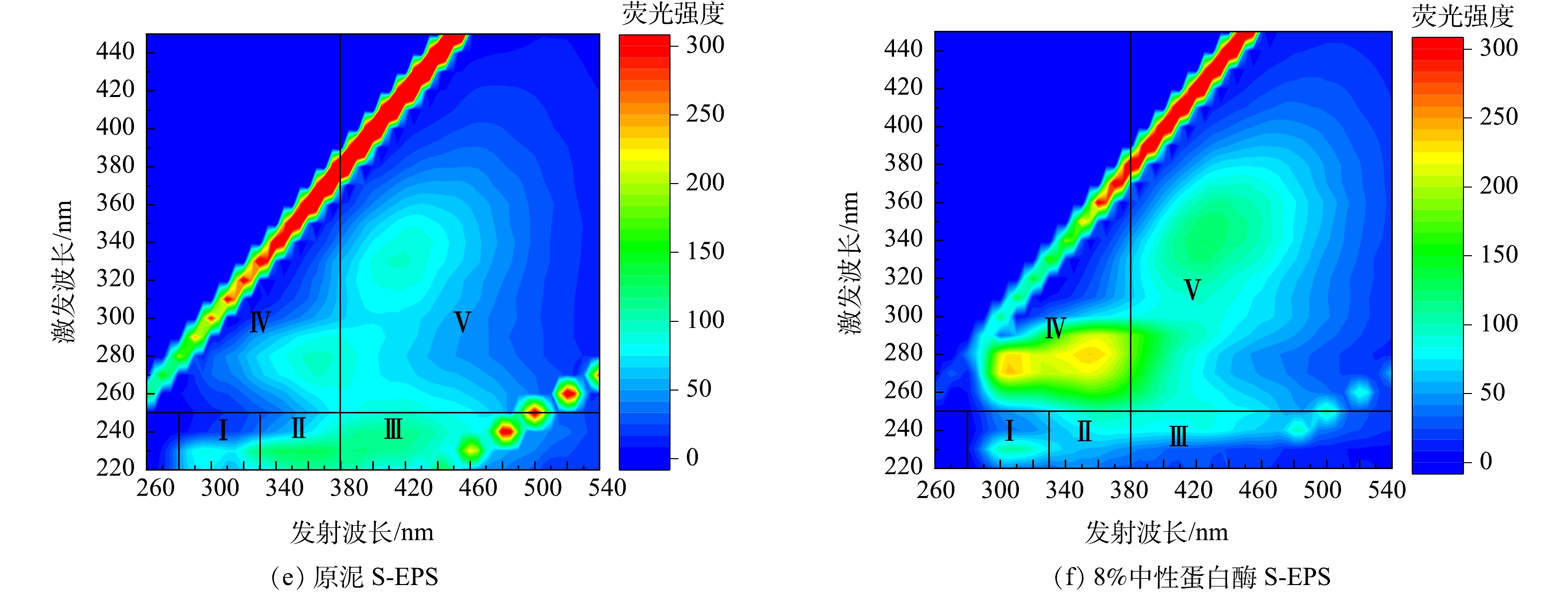
三维荧光光谱可以选择性地描述溶解性有机物,特别是荧光物质[21]。不同区域、荧光强度代表不同物质及相应的浓度。图7为投加8%中性蛋白酶处理前后管网沉积物上清液EPS的三维荧光光谱。由图7可见,沉积物上清液有5个主要荧光峰,I~V 区域分别代表酪氨酸(Ex/Em为220~250 n /280~300 nm)、色氨酸(Ex/Em为220~250 nm/330~380 nm)、富里酸(Ex/Em为220~250 nm/380~500 nm)、溶解型微生物副产物(Ex/Em为250~400 nm/280~380 nm)[22]以及腐殖酸(Ex>300 nm /Em>380 nm)[23]。
对比经中性蛋白酶处理前后沉积物上清液的TB-EPS可以观察到,经过中性蛋白酶处理后, IV(溶解型微生物副产物) 、V(腐殖酸)强度均有增加,其中 IV 荧光强度增加最为明显,并出现了新的荧光峰Ex/Em为 270/310 nm,且蛋白类物质(I、II)略有增加,这可能是EPS解体或微生物细胞破解产生的。 对比LB-EPS发现,I-V类物质的荧光强度变化和TB-EPS趋势相类似,经酶处理后,I、II、IV、V 物质浓度增加, IV 增强最为显著,而 III 荧光强度有所下降。对于S-EPS来说,经酶处理后溶出的酪氨酸(I)、溶解型微生物副产物(IV)、腐殖酸(V)略有增加,色氨酸(II)与富里酸(III)荧光强度减弱,甚至几近消失。富里酸消失表明EPS结构被破坏,这有利于酶制剂与底物接触,有机质从固相迁移到液相当中[24]。芳香族蛋白质类物质减少甚至消失,这可能意味着EPS在中性蛋白酶水解沉积物过程中由外向内瓦解,EPS结构破坏,这可能使排水管网中沉积物间的黏性下降,在同等水利条件下更易被冲刷,降低排水管网淤堵的可能性[25]。
-
采用环境扫描电镜来观察中性蛋白酶处理前后沉积物表面微观结构特性。从图8(a)可以看出,原淤泥表面光滑平整,结构细密紧实。经中性蛋白酶处理后的淤泥结构表面(图8(b))变得疏松,沉积物片层结构变得凸凹不平,且有孔洞,这也说明淤泥在水解过程中结构被破坏,部分有机质逐渐转变为可溶性物质,使得上清液中的有机物含量大大提升。中性蛋白酶处理后的淤泥表面结构的改变,可降低沉积物间的黏性,使管网沉积物更易被冲刷,从而减小城市管网淤堵的周期。
-
1)在中性蛋白酶投加量8%, pH 为 7,反应时间 3 h,反应温度 25 °C的条件下 ,SCOD由原泥的259.03 mg·L−1上升到 6 715.40 mg·L−1,多糖由14.21 mg·L−1升高到5 797.27 mg·L−1,氨氮由23.02 mg·L−1提升到47.89 mg·L−1,有机质含量由50.42%降至48.24% ,中性蛋白酶水解排水管网沉积物效果较优又相对经济。
2)经中性蛋白酶水解后,淤泥结构被破坏,表面由紧密平滑变为凸凹多孔;EPS结构被破坏,EPS各层含量变化趋势为S-EPS>TB-EPS>LB-EPS;处理后淤泥上清液中微生物代谢产物与腐殖质物质增多,蛋白类(酪氨酸、色氨酸)和富里酸类物质减少。淤泥结构及EPS的破坏便于沉积物冲刷,有利于延缓管网淤堵。
中性蛋白酶水解排水管网沉积物
Hydrolysis of drainage network sediment by neutral protease
-
摘要: 采用中性蛋白酶水解排水管网沉积物以缓解管网淤堵问题,考察了酶投加量、反应时间、pH、温度等对沉积物水解效果的影响,并通过EPS、三维荧光光谱以及SEM等表征分析方法探讨了可能的机理。结果表明,在酶投量为8%(质量百分数)、pH=7 、25 ℃条件下反应3 h,沉积物的水解效果较好,SCOD由原泥的259.03 mg·L−1升至 6 715.40 mg·L−1,多糖从14.21 mg·L−1升至5 797.27 mg·L−1,氨氮由23.02 mg·L−1升至47.89 mg·L−1,有机质含量由50.42%降至48.24%,促进了有机质从固相向液相的迁移。经中性蛋白酶水解后,沉积物的结构和EPS被破坏,内部物质溶出,溶出的多糖占主导地位,且EPS含量变化趋势为S-EPS>TB-EPS>LB-EPS。水解后上清液中微生物代谢产物与腐殖质物质增多,蛋白类(酪氨酸、色氨酸)和富里酸类物质减少。以上研究结果可为缓解管网沉积物淤堵提供参考。Abstract: Neutral protease was used to hydrolyze the sediment of drainage pipe network and alleviate the problem of blockage. The effects of enzyme dosage, reaction time, pH and temperature on sediment hydrolysis were investigated, and the mechanism was explored through EPS, 3D EEMs and SEM characterization.The results showed that at enzyme dosage of 8% (w/w), pH=7, 25 ℃ and 3h reaction, good sediment hydrolysis was achieved. The SCOD increased from 259.03 mg·L−1 to 6 715.40 mg·L−1, polysaccharide increased from 14.21 mg·L−1 to 5 797.27 mg·L−1, NH3-N increased from 23.02 mg·L−1 to 47.89 mg·L−1, and organic matter content decreased from 50.42% to 48.24%. This results promoted the migration of organic matters from the solid phase to the liquid phase. After hydrolyzed by neutral protease, the structure of sediment and EPS were destroyed, then the internal substances dissolved out, of which the dissolved amount of polysaccharide dominated, and the varying trend of EPS contents were S-EPS>TB-EPS>LB-EPS. After hydrolysis, the microbial metabolites and humic substances in the supernatant increased, and protein (tyrosine, tryptophan) and fulvic acid substances decreased. The results of this study provides a new method for alleviation of sediment blockage of pipe networks.
-
Key words:
- neutral protease /
- drainage network /
- sediment /
- hydrolysis
-
表 1 生物酶基本性质
Table 1. Basic properties of biological enzymes
生物酶种类 酶活性/(U·g−1) 适宜温度/ ℃ 适宜pH 酶来源 中性蛋白酶 2×105 50~55 6.0~7.0 合肥博美生物 α-淀粉酶 4 000 60~70 6.0~7.0 上海源叶生物 纤维素酶 3 000 30~60 4.5~6.5 北京索莱宝 溶菌酶 2×107 45~55 5.3~6.4 PHYGENE -
[1] 黄乃先, 齐一凡, 金伟. 排水管道沉积物控制的研究进展[J]. 环境工程技术学报, 2021, 11(3): 507-513. doi: 10.12153/j.issn.1674-991X.20210017 [2] 王嘉仪, 潘丽, 来志强. 郑州市排水管道沉积物现状及特性分析[C]. 中国水利学会、黄河水利委员会, 2020: 393-397. [3] 董梅, 胡晔, 杨洋, 等. 关于排水管道沉积物控制及水力清淤的思路[J]. 市政技术, 2018, 36(6): 113-115. [4] SHENG G P, YU H Q, LI X Y. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: A review[J]. Biotechnology Advances, 2010, 28(6): 882-894. doi: 10.1016/j.biotechadv.2010.08.001 [5] 徐友, 陈思思, 董滨, 等. 酶处理强化污泥厌氧消化效能及脱水性能的研究进展[J]. 工业水处理, 2018, 38(3): 6-11. [6] 赵春红, 王娟. 酶制剂在水环境保护方面的研究进展[J]. 山东化工, 2019, 48(8): 61-64. [7] 罗璐, 施周, 许仕荣, 等. 溶菌酶预处理对剩余污泥脱水性能的影响[J]. 中国给水排水, 2022, 38(3): 87-91. doi: 10.19853/j.zgjsps.1000-4602.2022.03.014 [8] 宋勇. 水解酶对活性污泥系统的污泥减量研究[D]. 长沙: 湖南大学, 2016. [9] ZOU X, HE J, ZHANG P, et al. Insights into carbon recovery from excess sludge through enzyme-catalyzing hydrolysis strategy: Environmental benefits and carbon-emission reduction[J]. Bioresource Technology, 2022, 351: 127006. doi: 10.1016/j.biortech.2022.127006 [10] 李玉龙, 曹海军, 纪豪, 等. 双酶协同水解剩余污泥条件优化[J]. 环境工程学报, 2016, 10(11): 6649-6654. [11] 薛飞, 陈钦, 许士洪, 等. 超声与溶菌酶协同强化印染污泥溶胞效果研究[J]. 应用化工, 2020, 49(8): 1933-1937. [12] 张帆, 程路峰, 曹红, 等. 基于酶反应动力学理论优化脂肪酶活力测定体系[J]. 中国油脂, 2022: 1-12. [13] 陈小粉, 李小明, 杨麒, 等. 淀粉酶促进剩余污泥热水解的研究[J]. 中国环境科学, 2011, 31(3): 396-401. [14] 李超, 高健磊, 闫怡新, 等. 中性蛋白酶催化水解污泥提取蛋白质的研究[J]. 能源环境保护, 2019, 33(6): 18-22. [15] 罗琨. 外加水解酶强化剩余污泥水解和酸化的研究[D]. 长沙: 湖南大学, 2013. [16] 史贺, 华飞果, 李鸿凯, 等. 纤维素酶预处理漂白针叶木浆的工艺优化研究[J]. 中国造纸学报, 2022, 37(S1): 1-12. [17] 韦新东, 刘丞轩, 崔玉波, 等. 超声与碱对污泥水解酸化效率的研究[J]. 吉林建筑大学学报, 2022, 39(3): 52-56. [18] 苏高强, 彭永臻, 汪传新, 等. 污泥类型对污泥碱性发酵的影响[J]. 化工学报, 2011, 62(12): 3492-3497. doi: 10.3969/j.issn.0438-1157.2011.12.028 [19] 张婧伟, 白周央, 杨树成. 超声-碱预处理以促进污泥水解效率的研究进展[J]. 工业水处理, 2020, 40(4): 12-17. [20] LI W, ZHENG T, MA Y, et al. Current status and future prospects of sewer biofilms: Their structure, influencing factors, and substance transformations[J]. Science of the Total Environment, 2019, 695: 133815. doi: 10.1016/j.scitotenv.2019.133815 [21] MENG D, WU J, CHEN K, et al. Effects of extracellular polymeric substances and microbial community on the anti-scouribility of sewer sediment[J]. Science of the Total Environment, 2019, 687: 494-504. doi: 10.1016/j.scitotenv.2019.05.387 [22] 陈翠忠, 李俊峰, 蓝明菊, 等. 碳氮比对SBR系统硝化过程及EPS三维荧光光谱特性的影响[J]. 化工进展, 2020, 39(12): 5275-5282. [23] MENG F, ZHAO Q, ZHENG Z, et al. Simultaneous sludge degradation, desalination and bioelectricity generation in two-phase microbial desalination cells[J]. Chemical Engineering Journal, 2019, 361: 180-188. doi: 10.1016/j.cej.2018.12.063 [24] XU H, SHEN K, DING T, et al. Dewatering of drinking water treatment sludge using the Fenton-like process induced by electro-osmosis[J]. Chemical Engineering Journal, 2016, 293: 207-215. doi: 10.1016/j.cej.2016.02.025 [25] GUO X, QIAN X, WANG Y, et al. Magnetic micro-particle conditioning–pressurized vertical electro-osmotic dewatering (MPEOD) of activated sludge: Role and behavior of moisture and organics[J]. Journal of Environmental Sciences, 2018, 74: 147-158. doi: 10.1016/j.jes.2018.02.020 期刊类型引用(2)
1. 唐文胜,张彦平,胡馨月,崔诺,张静,王庆坤,白珺. 复配酶水解化粪池底泥提高污水厂碳源. 环境工程学报. 2025(03): 727-736 .  本站查看
本站查看
2. 袁春波,齐伟,邱文韬,李一兵,张彦平,白珺. 复合酶强化水解排水管网沉积物. 环境科学学报. 2024(05): 243-252 .  百度学术
百度学术
其他类型引用(0)
-






 下载:
下载: