-
好氧颗粒污泥是多种功能微生物的聚集体[1]。与传统活性污泥相比,好氧颗粒污泥在污水处理系统中具有更优越的性能,如结构紧密、沉降性能良好、生物量高、功能微生物丰富、对有毒物质耐受性强、能有效去除污染物等[2]。因此,好氧颗粒污泥是目前关注最多的污水处理技术之一。已有研究[3-5]表明,好氧颗粒污泥往往需要在有选择压力的特定条件下形成,如水力调节、沉降时间、营养-饥饿更替、进水负荷调整等。这些特定条件会影响微生物群落的代谢机能[2],增加细菌胞外聚合物(extracellular polymeric substances,EPS)的分泌[6],进而促进颗粒化进程。
根据Monod方程,底物质量浓度对微生物的生长至关重要,高质量浓度底物在功能微生物的积累中起关键作用[7]。同时,底物质量浓度也会影响EPS的分泌[6]。因此,高有机负荷(organic loading rate,OLR)被认为是快速促进颗粒形成的方法之一[8]。ZHANG等[9]的研究表明,在OLR为24 kg·(m3·d)−1和12 kg·(m3·d)−1条件下,7 h和24 h出现颗粒污泥。然而,高OLR容易引起好氧颗粒污泥系统运行不稳定,出水水质变差,严重时甚至引起颗粒解体[8]。MOY等[10]报道,在OLR为6 kg·(m3·d)−1条件下培养颗粒污泥,发现颗粒表现出以丝状菌为主的蓬松形态,会对颗粒沉降性能造成影响。LIU等[11]的研究同样表明,高OLR会引发丝状菌生长,导致颗粒沉降性能变差和生物量减少,进而对颗粒的长期稳定性造成影响。SCHWARZENBECK等[12]的研究表明,在OLR为5.9 kg·(m3·d)−1条件下,培养出的颗粒中丝状菌过度生长,降低了颗粒的沉降速度。因此,高OLR条件下有效控制丝状菌的生长对于维持好氧颗粒污泥系统的稳定性至关重要。目前对于丝状菌生长的控制策略包括延长沉淀时间、降低C/N比、提高溶解氧、改变碳源等[13-14]。高景峰等[7]在底物中加入蛋白胨,能够抑制颗粒污泥中丝状菌的生长。陈希等[15]也发现,蛋白胨能够有效抑制丝状菌的生长并使颗粒密实光滑。因此,研究蛋白胨对于丝状菌生长的影响,有助于提高颗粒污泥在高OLR下运行的稳定性。高OLR作为促进好氧颗粒污泥快速形成的有效手段,在处理高质量浓度有机污水方面具有广泛的应用前景[16]。然而,目前有关高OLR条件下好氧颗粒污泥的形成和稳定性的报道较为缺乏,尤其是在高OLR条件下丝状菌的生长特性及其控制策略方面。此外,高OLR条件下微生物群落结构特征也少有报道,尚需开展更为广泛深入的研究。
本研究在实验室规模的序批式反应器(sequencing batch reactor,SBR)中,采用递增负荷4.8~14.4 kg·(m3·d)−1的启动方式,培养好氧颗粒污泥,考察高OLR条件对好氧颗粒污泥形成和稳定性能的影响,探究高OLR条件下丝状菌的生长规律及其控制策略,并进一步揭示微生物群落结构对于高OLR的响应,旨在为高负荷条件下控制系统内丝状菌生长并保持颗粒稳定性提供参考。
-
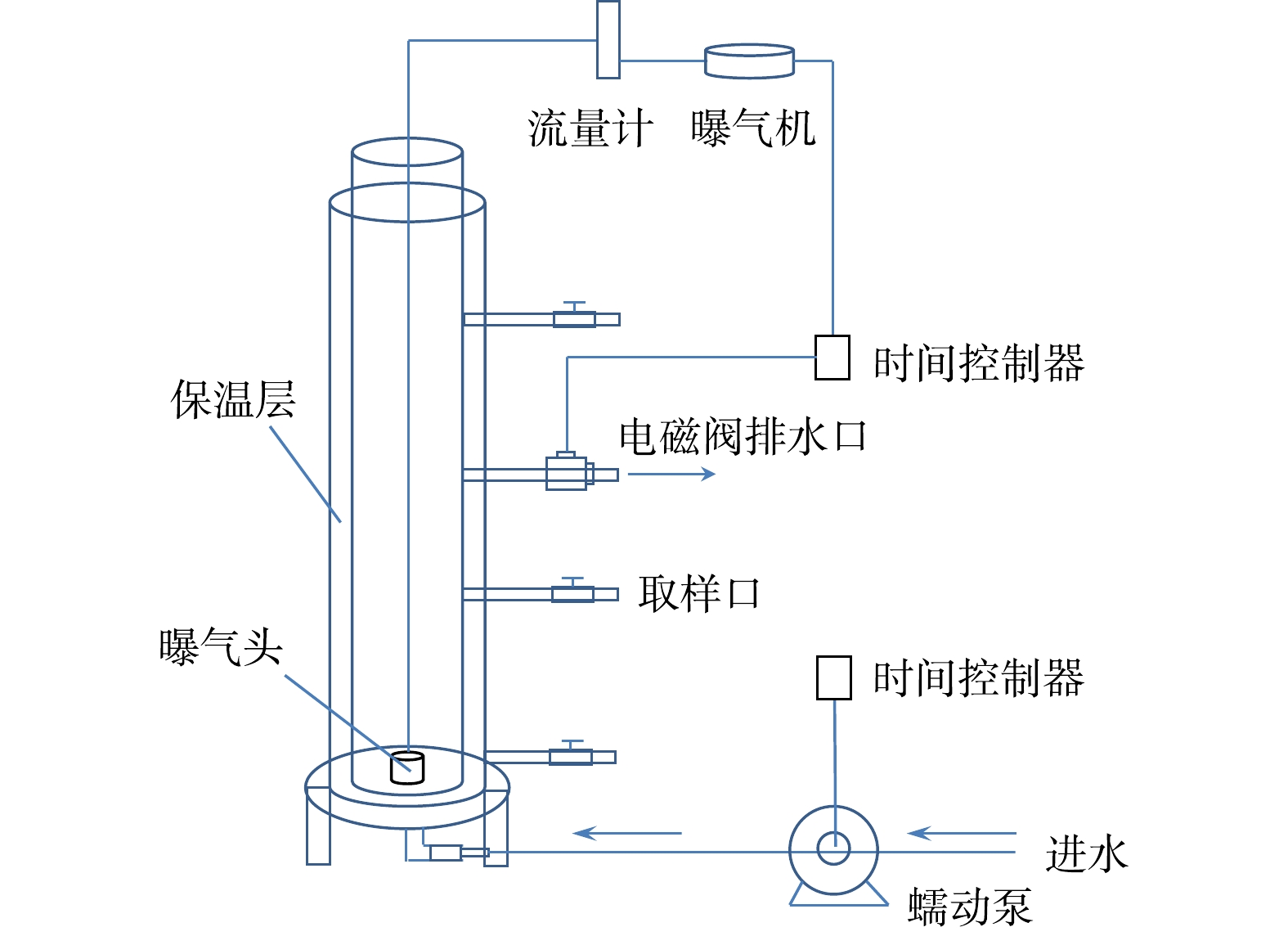
实验采用SBR进行好氧颗粒污泥的培养(图1)。反应器由有机玻璃制成,呈圆柱形,高为1 000 mm,高径比为15,有效容积为2.5 L。反应器侧面每隔200 mm设置4个取样口,出水口位于反应器1/2处,排水比为50%。反应器设置水浴套管,外加电加热棒以维持反应器温度。反应器进水口设置在底部,通过蠕动泵(BT-300 EA,重庆杰恒)控制进水速度为0.08 L·min−1。曝气由空压机(GSX100,中国国厦)通过微孔曝气头从反应器底部供气,曝气速率由转子气体流量计控制为2.5 L·min−1。反应器运行周期为4 h,每天运行6个周期。每个周期进水15 min,初始曝气213 min,沉淀时间10 min,排水2 min。随着颗粒沉降速率的增加,曝气时间逐渐从213 min增加到221 min,沉淀时间逐渐从10 min缩短到2 min。反应器的进水、排水及曝气均通过定时开关采用半自动化控制。
-
采用人工配水作为实验进水,根据有机碳源质量浓度和种类的不同,分为3个阶段,主要成分见表1。第Ⅰ阶段,OLR为4.8 kg·(m3·d)−1,NH4+-N为0.24 kg·(m3·d)−1。第Ⅱ、III阶段,OLR均为14.4 kg·(m3·d)−1;第Ⅱ阶段,NH4+-N为0.3~0.42 kg·(m3·d)−1;第III阶段,NH4+-N为0.42~0.6 kg·(m3·d)−1。以每阶段的OLR按照占比分配碳源,第Ⅰ阶段,采用无水乙酸钠(50%)和蔗糖(50%)作为混合碳源;第Ⅱ阶段,采用无水乙酸钠(45%)、蔗糖(45%)和蛋白胨(10%)作为混合碳源;第III阶段,采用无水乙酸钠(50%)和蛋白胨(50%)作为混合碳源,以氯化铵作为各阶段的氮源。实验用1 mg蛋白胨相当于约1.04 mg COD,氮的质量分数为12.7%。微量元素溶液组成如下:0.43 g·L−1 ZnSO4·7H2O,0.014 g·L−1 H3BO4,0.99 g·L−1 MnCl2·4H2O,0.25 g·L−1 CuSO4·5H2O,0.19 g·L−1 NiCl2·6H2O,0.24 g·L−1 CoCl2·6H2O。人工配水中微量元素溶液体积分数为3 mL·L−1。实验药品均采用化学纯。
本实验所采用的接种污泥来自重庆市鸡冠石污水厂曝气池,取原始污泥在反应器中闷曝24 h,调节混合液悬浮固体质量浓度(mixed liquid suspended solids,MLSS)至5 g·L−1左右后正常进水。
-
MLSS、混合液挥发性悬浮固体质量浓度(mixed liquid volatile suspended solids,MLVSS)采用标准重量法测定。
污泥沉降速率(sludge settling velocity, SV)的测定:量取1 000 mL曝气末期处于完全混合状态的泥水,静置沉降5 min后,记录污泥沉降层液位高度;根据沉淀污泥体积占原混合液体积的比值算得SV5;同样地,静置30 min,记录此时污泥沉降层高度,根据沉淀污泥体积占原混合液体积的比值算得SV30。
污泥容积指数 (sludge index,SVI)的计算方法见式(1)。
式中:Q为污泥容积指数(SVI),mL·g−1;S为30 min污泥沉降速率(SV30),mL·L−1;M为混合液悬浮固体质量浓度(MLSS),g·L−1。
-
EPS分为溶解型EPS(soluble EPS,S-EPS)、松散结合型EPS(loosely bound EPS,L-EPS)和紧密结合型EPS(tightly bound EPS,T-EPS)。S-EPS、L-EPS和T-EPS的提取参照LIANG等[17]使用的方法。取30 mL反应器中污泥于50 mL无菌离心管中,在4 000g、4 ℃条件下离心10 min。弃掉上清液,加入30 mL PBS溶液,重悬并清洗细胞2次,随后将重悬的污泥液体经超声波破碎机冰浴破碎(20 kHz,40 W),然后在2 000g、4 ℃条件下离心15 min,其上清液即为S-EPS。接着向离心管加入PBS再次将污泥重悬至30 mL,并向污泥悬液中加入0.06 mL(37%)的甲酰胺(为了增强L-EPS的提取效果),然后将离心管置于4 ℃恒温振荡器中振荡1 h。最后将重悬液在5 000g、4 ℃条件下离心15 min,收集上清液,即为L-EPS。再次用PBS重悬污泥至30 mL,每克挥发性悬浮固体污泥加入70 g的阳离子交换树脂,在4 ℃、600 r·min−1条件下搅拌1 h,然后在10 000g、4 ℃条件下离心15 min,所得上清液即为T-EPS。多糖(polysaccharides,PS)含量采用硫酸-蒽酮法进行测定。蛋白质(proteins,PN)含量采用Lowry试剂盒方法(Solarbio,日本)测定。总EPS含量为PS和PN的总和。
-
微生物群落结构基于MisSeq高通量测序及I-Sanger云平台由美吉生物医药科技有限公司(上海)测定。样品处理过程:取反应器中的颗粒污泥样品1 mL,使用E.Z.N.A. ® soil试剂盒(Omega Bio-tek, Norcross, GA, U.S.)抽提群落DNA,利用NanoDrop2000进行质量浓度和纯度检测,随后采用1%琼脂糖凝胶电泳检测DNA提取质量;纯化后的样品用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对对V3~V4可变区进行16S rRNA PCR扩增,然后用AxyPrep DNA Gel Extraction Kit进行纯化。利用QuantiFluor™-ST(Promega, USA)进行检测定量。利用Illumina MiSeq (Illumina,San Diego,USA)PE300平台进行测序。采用Usearch软件(Version 7.0 http://drive5.com/usearch/)进行聚类分析,在97%相似水平下进行生物信息统计。利用Excel 和Origin等软件,对上述基础数据进行整理和分析。
-
常规水质指标NH4+-N、NO3−-N、NO2−-N、总氮(TN)、COD的分析方法如下:NH4+-N采用水杨酸-次氯酸盐光度法,NO3−-N采用紫外分光光度法,NO2−-N采用N-(1-萘基)-乙二胺光度法,TN采用过硫酸钾氧化-紫外分光光度法,COD采用重铬酸钾氧化法。采用光学显微镜和扫描电镜(SEM)对颗粒形态及表面结构进行观察。采用标准筛法测量颗粒粒径分布。
-
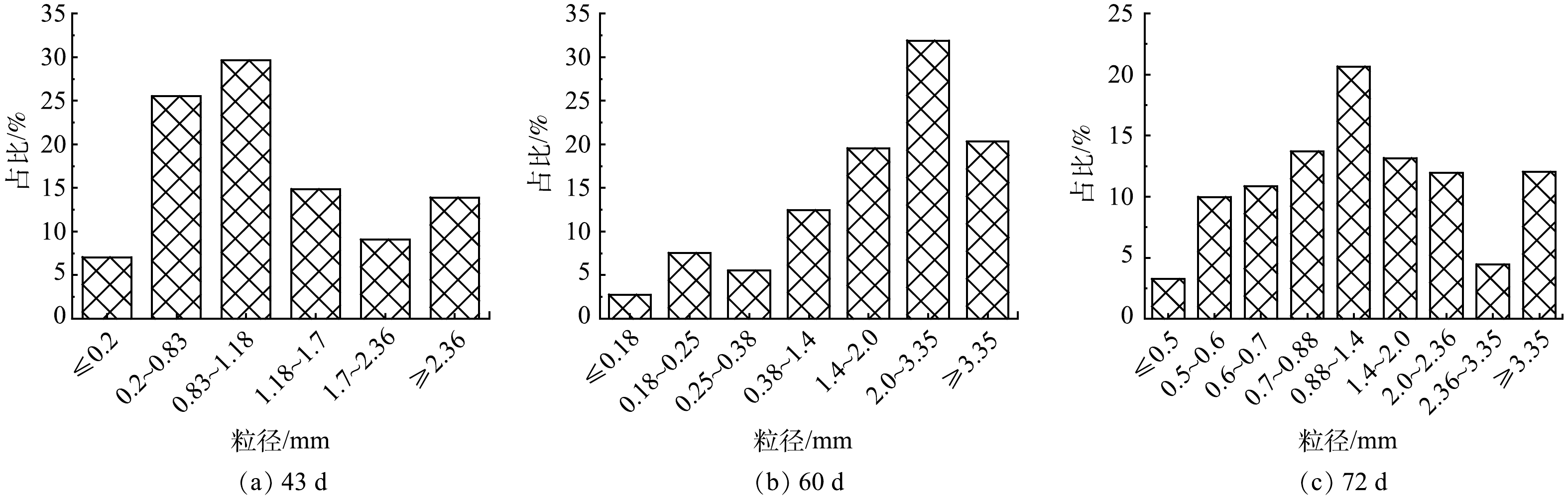
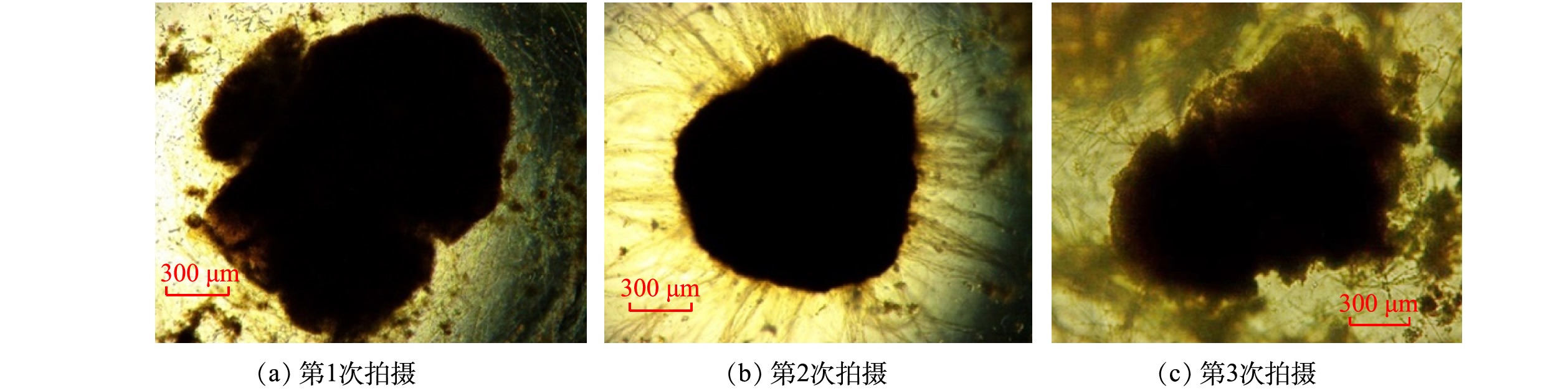
1) 好氧颗粒污泥的形态特性变化。将闷曝后的活性污泥以MLSS为5 g·L−1接种在SBR中。初接种的活性污泥呈深褐色絮体状,在光学显微镜下能观察到菌胶团以及钟虫、轮虫等原生动物和后生动物。第I阶段,反应器以OLR为4.8 kg·(m3·d)−1、NH4+-N为0.24 kg·(m3·d)−1启动。经过23 d的培养,反应器内污泥仍然以絮状体为主,仅有少量颗粒出现,且粒径较小。这一现象表明低OLR条件下造粒缓慢。有研究[18]表明,高OLR能够加速好氧颗粒污泥的形成,可作为一种快速启动策略。因此,为了探究高OLR对颗粒形成的影响,第II阶段,在OLR为14.4 kg·(m3·d)−1、NH4+-N为0.3~0.42 kg·(m3·d)−1条件下,继续培养颗粒污泥。当OLR提高后,反应器内出现较为明显的颗粒,颗粒颜色逐渐变浅,由褐色变为黄色,有较清晰的边界。已有研究[19]表明,当颗粒粒径大于0.2 mm的颗粒体积占比达到90%时,认为颗粒完成造粒。在反应器运行到43 d时,反应器内粒径大于0.2 mm的颗粒占比超过90%,表明好氧颗粒污泥形成。此条件下形成的颗粒粒径在0.83~1.18 mm的占比最多,为29.6%;粒径大于2.36 mm的占比为13.9%(图2(a))。这表明,高OLR下不仅能促进好氧颗粒污泥的形成,而且能够形成粒径更大的颗粒。NGUYEN等[20]也发现,当OLR从2.5 kg·(m3·d)−1增加到10 kg·(m3·d)−1时,好氧颗粒污泥粒径随着OLR的增加而增加,且较高的OLR可形成直径为3~4 mm的颗粒。然而,镜检表明,在高OLR条件下,虽然颗粒形态基本完好,但颗粒表面却有大量丝状菌呈放射状生长,部分颗粒结构松散、边缘疏松(图3(a)~图3(c))。这一结果表明,虽然高OLR能够加快颗粒化进程,但是容易引起丝状菌的附着生长,从而可能引发好氧颗粒污泥丝状菌膨胀,最后导致颗粒解体。
有研究[7]表明,在丝状菌膨胀的好氧颗粒污泥中加入蛋白胨,可达到控制丝状菌生长的目的。虽然在第II阶段也有蛋白胨的加入,但与无水乙酸钠和蔗糖的含量相比,蛋白胨的占比仅为10%,并没起到显著控制丝状菌生长的效果。因此,在第III阶段,从52 d开始,OLR同第II阶段保持一致,但将进水中蛋白胨的含量占比提高到了50%。在高OLR培养下,颗粒粒径进一步增加。在60 d,颗粒粒径在2~3.35 mm的占比达到31.9%,大于3.35 mm的颗粒占比为20.3%(图2(b))。此时颗粒表面丝状菌大量生长的现象仍较为明显。扫描电镜下观察到丝状菌附着在颗粒表面呈网状结构,颗粒结构松散(图4(a)~图4(c))。但随着培养时间的增加,丝状菌逐渐消失。在71 d,颗粒表面已观察不到丝状菌,以球菌和短杆菌为主,颗粒呈光滑密实状态(图4(d)~图4(f))。此时,颗粒粒径较之前有所减少,以粒径0.88~1.4 mm的颗粒为主,占比达到20.65%;而大于3.35 mm的颗粒,占比也从60 d时的20.3%下降到72 d时的12.03%(图2(c))。这一粒径的减少很可能是由于丝状菌脱落引起的。实验结果表明,蛋白胨能够抑制丝状菌的生长,使颗粒在高OLR下保持光滑密实的状态。这可能是因为丝状菌更容易利用简单的小分子有机物,所以当蛋白胨这类复杂有机物占比增多时,会导致丝状菌能利用的简单有机物减少,从而使得好氧颗粒污泥上的丝状菌逐渐脱落,颗粒稳定性得以提升[7,15]。综上可知:高OLR确实可以促进颗粒化进程,但容易引发丝状菌的大量生长;通过投加蛋白胨这类复杂有机物可控制丝状菌的生长,维持高OLR条件下好氧颗粒污泥的稳定性。
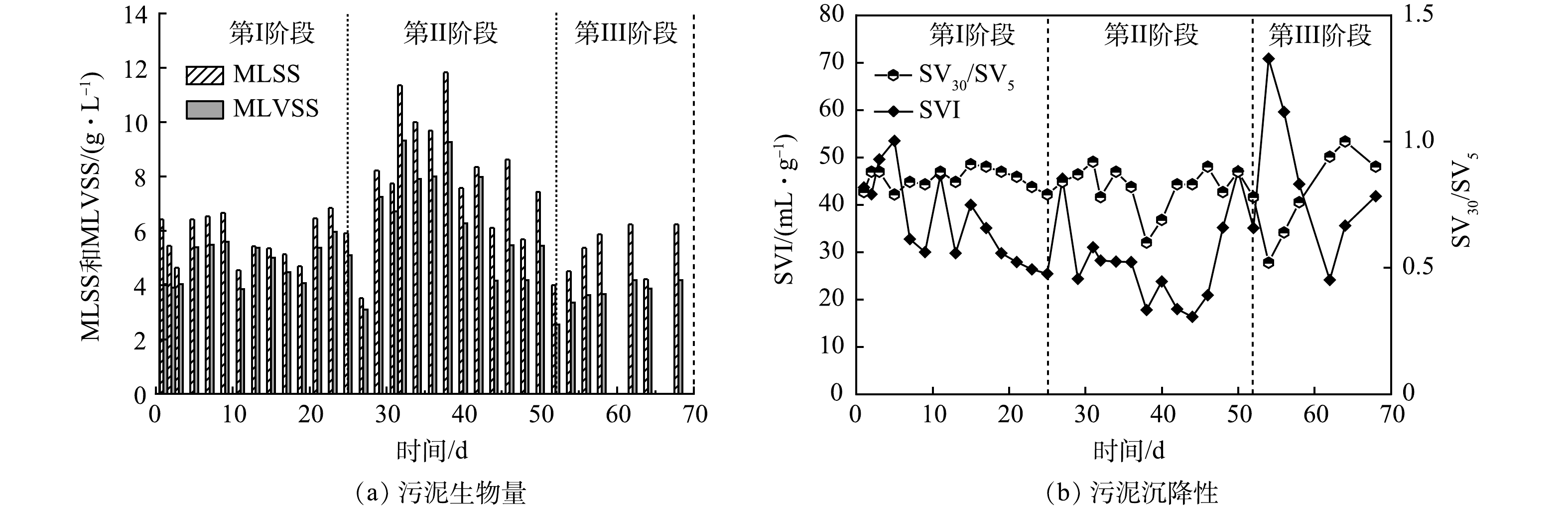
2) 好氧颗粒污泥生物量和沉降性能的变化。MLSS和MLVSS可以反映SBR内颗粒污泥的生物量。如图5(a)所示,第Ⅰ阶段,在OLR为4.8 kg·(m3·d)−1的条件下,平均MLSS为5 g·L−1。在此阶段,生物量没有显著增加,其原因可能是,此阶段正处于调节沉淀时间筛选颗粒污泥的阶段,排出的絮体污泥量与污泥生长量可能处于一个平衡状态。第II阶段,当OLR提高到14.4 kg·(m3·d)−1时,生物量显著提高到11.8 g·L−1,说明OLR的提高有助于微生物生长,同时有利于颗粒化进程。然而,在40 d, MLSS呈下降趋势,这可能是由于高OLR引起丝状菌过量生长所导致的。在第III阶段,当改变进水蛋白胨占比后,颗粒恢复正常,MLSS逐渐上升。
SVI是反映颗粒污泥沉降性能的指标,结果如图5(b)所示。活性污泥初始的SVI为43.6 mL·g−1。第Ⅰ阶段,SVI呈逐步下降的趋势,这说明污泥的沉降性能在不断提高。第II阶段,刚开始时,SVI有明显上升,这可能与OLR突然提高导致沉降性能变差有关。随后,SVI不断下降,第43天,污泥造粒完成后,SVI达到16.3 mL·g−1,说明颗粒沉降性能优良。然而,从48 d开始,SVI不断上升,这是由于丝状菌开始附着使得颗粒沉降性能下降。谢锴[21]的研究中也存在相同情况:丝状菌的过度生长使得系统沉降性能降低,部分松散颗粒随水排出,SVI由60 mL·g−1升高至115.6 mL·g−1。在第III阶段初期,SVI仍持续上升。在54 d,SVI升至70.8 mL·g−1,此时反应器内颗粒污泥仍处于丝状菌膨胀状态。随后SVI开始下降,68 d时,颗粒恢复正常形态,SVI在41.7 mL·g−1左右,说明蛋白胨能使颗粒恢复良好的沉降性能。SV30/SV5的比值也可以用于指示好氧颗粒污泥的沉降性能[22]。通常SV30/SV5=1是颗粒沉降性较好的标志。第I阶段,SV30/SV5稳定在0.8~0.9内。在第II阶段和第III阶段初期,即从颗粒形成到丝状菌大量生长期间,SV30/SV5波动较大。在第III阶段末期,SV30/SV5在1左右波动,由此表明颗粒沉降性能恢复良好。
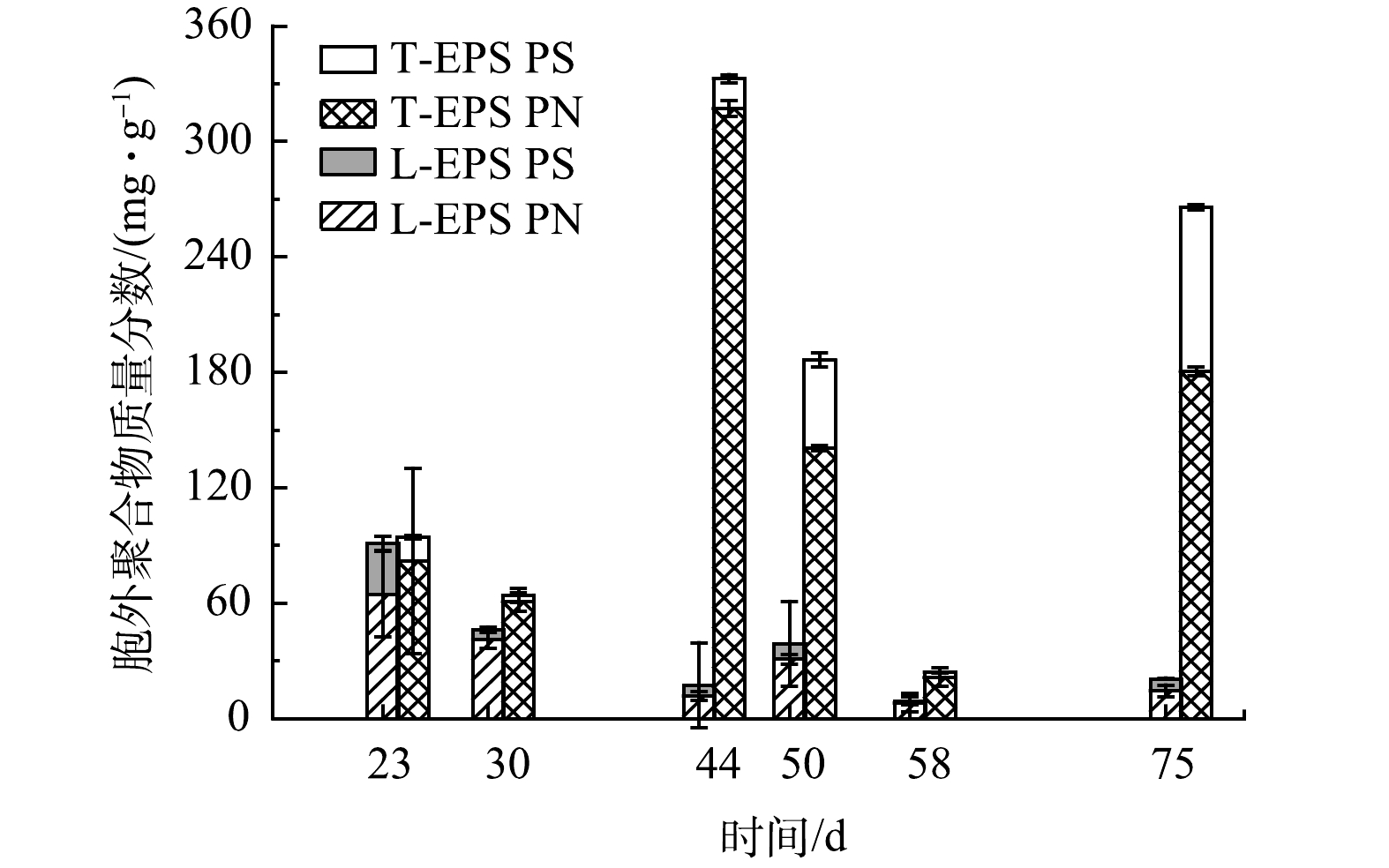
3) 好氧颗粒污泥胞外聚合物的变化。EPS被认为是促进好氧颗粒污泥形成和维持颗粒稳定性的重要组成部分[23]。如图6所示,第I阶段,第23天时颗粒EPS质量分数为199.1 mg·g−1,其中PN质量分数为157.7 mg·g−1,PS质量分数为41.4 mg·g−1。在第II阶段中,随着OLR提升至14.4 kg·(m3·d)−1,EPS质量分数也大幅度上升;第44天,颗粒的EPS质量分数高达359.2 mg·g−1,其中PN质量分数为317.0 mg·g−1,PS质量分数为15.7 mg·g−1。从EPS的构成来看,T-EPS中PN的增加量最为显著。已有研究[24]表明,T-EPS在好氧颗粒污泥的形成中起着重要作用,这主要是因为T-EPS中的PN有利于提高细胞表面Zeta电位和疏水性。然而,在50 d,EPS的质量分数减少至243.9 mg·g−1。这可能是由于此时丝状菌的快速增殖,丝状菌比非丝状菌具有更高的比表面积,能够更加快速地从进水中吸收营养物质,不利于颗粒内非丝状菌的生长,减少了EPS分泌。第III阶段,随着丝状菌的消失,颗粒的EPS质量分数逐渐恢复。在75 d,EPS质量分数升至290.3 mg·g−1。值得注意的是,此时EPS中PS有较大幅度增加,达到85.4 mg·g−1。多糖可作为微生物细胞聚集、黏附的骨架,维持好氧颗粒污泥的结构完整性[25]。EPS中PS的增加可能会有利于增加好氧颗粒污泥结构的稳定性。上述研究表明,高OLR可促进EPS,特别是T-EPS的快速增长,这很可能是促进颗粒化进程的关键原因之一。丝状菌的出现会降低EPS的质量分数,导致颗粒结构疏松。因此,有效控制丝状菌数量,维持EPS质量分数稳定,是保证好氧颗粒污泥稳定的关键。
-
图7为不同阶段SBR出水水质的变化。第I阶段,COD和NH4+-N出水质量浓度保持稳定。COD去除率在90%左右,NH4+-N去除率在92%左右。TN去除率最终在80%左右波动,这是由反应器中NO3−-N的积累引起的。在第II阶段前期,由于OLR提高使得出水水质有所波动,但随着颗粒的形成,污染物仍保持较好的去除效果。出水中没有明显的NO3−-N和NO2−-N积累,TN的去除率可达到90%以上。这可能是由于随着颗粒的逐步形成,具有反硝化能力的功能菌种丰度的增加强化了反应器内的反硝化作用。但在第II阶段后期,出水中污染物质量浓度却逐渐升高。第48天,COD去除率略有下降,降至81.7%,出水NH4+-N质量浓度升高,并有少量NO2−-N的积累,TN去除率显著下降至48.3%。已有研究[13,26]也报道了当丝状菌大量生长时NH4+-N去除效果变差和脱氮能力降低的现象。由图3和图4可知,丝状菌主要分布在颗粒表面。由此推测,丝状菌在颗粒表面的大量繁殖会阻碍营养物质向颗粒内部传递,降低颗粒对氨氮的吸收利用,导致反应器内硝化菌和反硝化菌的部分流失,使得脱氮能力降低。第III阶段,水质情况急剧恶化,NH4+-N出水质量浓度急剧增加,COD去除率降至71.5%,TN去除率降至17.4%。一方面,这是由于此时颗粒表面仍存在大量的丝状菌;另一方面,蛋白胨的加入提高了进水中有机碳和氮的含量。在第III阶段后期,随着丝状菌不断脱离颗粒表面,TN去除率逐渐上升至79.4%,COD去除率达到91.5%,NH4+-N去除率为92.5%,出水中间产物几乎为零,颗粒对污染物的去除能力逐渐恢复正常。
-
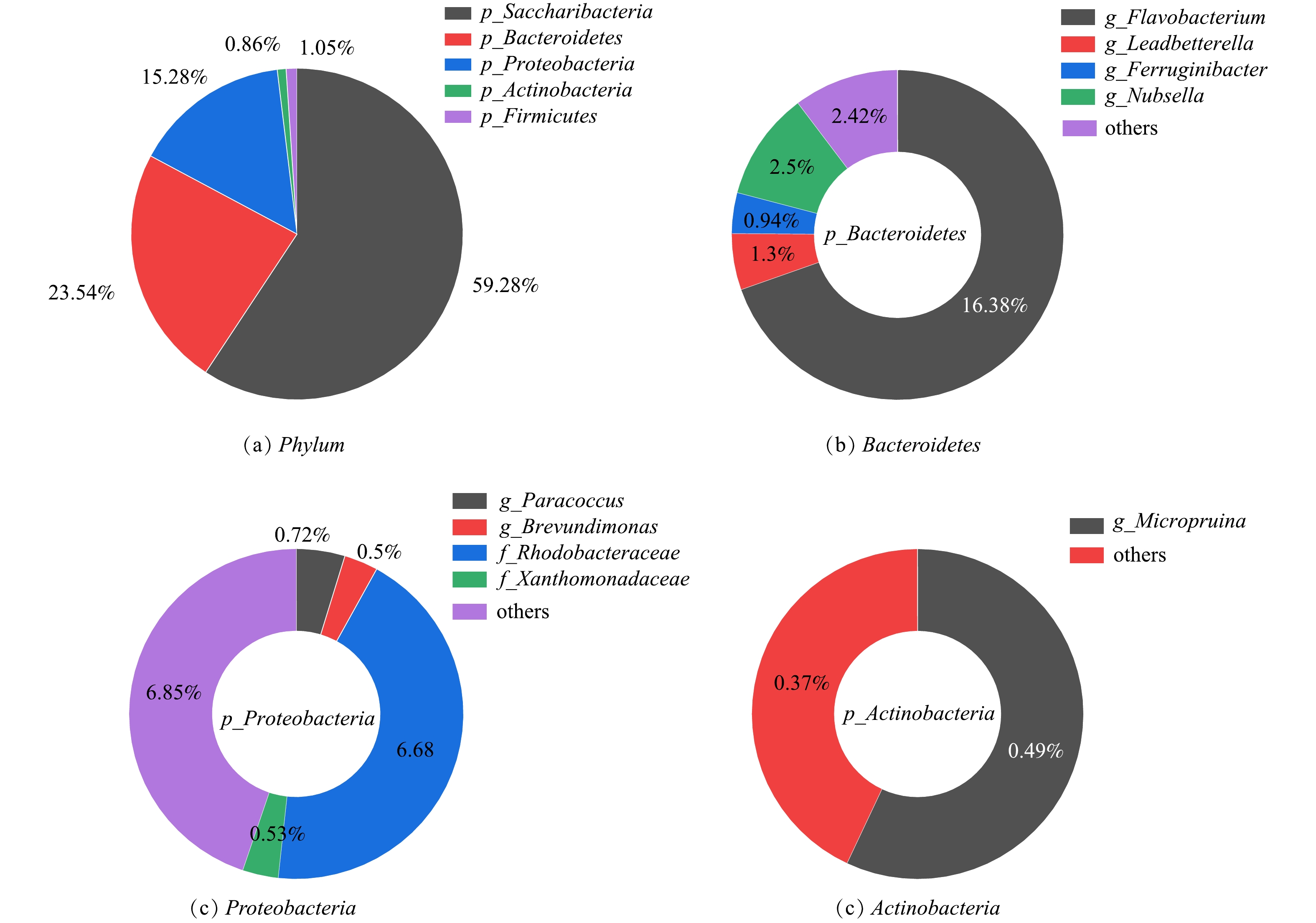
对培养75 d的好氧颗粒污泥进行高通量测序分析,按照可生物学分类的最小水平分类,获得总样本数66 692。样本文库覆盖率大于99.9%,表明测序深度能覆盖SBR内的绝大多数细菌信息。如图8(a)所示,颗粒污泥中门主要为Saccharibacteria(糖杆菌门)、Bacteroidetes(拟杆菌门)、Proteobacteria(变形菌门)、Firmicutes(厚壁菌门)和Actinobacteria(放线菌门),上述菌门的相对丰度分别为59.28%、23.54%、15.28%、1.05%和0.86%。Saccharibacteria是一个系统发育多样的群体,在有氧和缺氧条件下能参与各种有机化合物和糖化合物的降解[27]。已有研究[28]报道,蛋白胨作为碳源会促进Saccharibacteria门的生长,这可能是反应器中Saccharibacteria门丰度高的原因。Bacteroidetes门的菌种具有降解有机物和同步脱氮除磷的功能,也是好氧颗粒污泥内常见的菌门[29]。Proteobacteria门也是好氧颗粒污泥里的常见菌门,具有降解有机物的功能[18]。Firmicutes门能维持好氧颗粒污泥稳定性和实现有机物的去除[30]。Actinobacteria门被报道具有去除有机物和生物固氮作用[31]。由群落结构分析结果可知,Saccharibacteria、Bacteroidetes和Proteobacteria是能适应高有机负荷的优势菌门,负责实现反应器内有机物和氮的去除。
在属水平上,Saccharibacteria(59.28%)和Firmicutes(1.05%)下没有得到进一步的分类信息。Bacteroidetes门下(图8(b)),单一菌属相对丰度大于0.5%的依次是Flavobacterium(黄杆菌属,16.38%)、Nubsella(2.5%)、Leadbetterella(里德拜特氏菌,1.30%)和Ferruginibacter(0.94%)。Flavobacterium是好氧颗粒污泥内普遍存在的菌属,但通常丰度并不太高[32]。而反应器内Flavobacterium的丰度却高达16.38%,这说明Flavobacterium可能更适应高有机负荷的生长环境。据报道[33],Flavobacterium是一种EPS分泌菌属,有助于细胞粘附以及好氧颗粒污泥的稳定性。Flavobacterium菌属在系统中具有较高的丰度,由此可以说明,该菌属对于维持好氧颗粒污泥的稳定起着重要作用。此外,Flavobacterium菌属还被发现具有异养硝化-好氧反硝化的特性[34],说明其可能参与反应器的脱氮。Proteobacteria门下(图8(c)),单一菌属相对丰度大于0.5%的为Paracoccus(副球菌属,0.72%)和Brevundimonas(短波单胞菌,0.5%)。Paracoccus菌属在好氧颗粒污泥系统中可将有机物转化为PHA储存,显示出稳定的生物降解作用[35]。此外,Paracoccus还具有异养硝化-好氧反硝化功能[36]。Actinobacteria门下(图8(d)),单一菌属相对丰富接近0.5%的为Micropruina(微白霜菌属,0.49%)。Micropruina是一种糖原菌属,能保持处理系统良好的有机物去除能力。同时Micropruina能以硝酸盐作为氮源进行生长,并将其还原成亚硝酸盐[37]。
综上所述,蛋白胨的添加使得能够利用蛋白胨的Saccharibacteria成为了优势菌门,Flavobacterium、Paracoccus等具有异养硝化-好氧反硝化功能的菌属在反应器中富集,从而实现氮的去除。此外,在群落中并未发现有优势自养硝化菌的存在,可以推测,在高有机负荷环境下,异养硝化-好氧反硝化起主要脱氮作用。
-
1)采用人工配水运行SBR,第I阶段,以OLR为4.8 kg·(m3·d)−1培养颗粒,颗粒生长缓慢,反应器主要以絮体为主。将OLR提高至14.4 kg·(m3·d)−1,反应器经过43 d完成造粒,表明高OLR可促进颗粒化进程。
2)高OLR容易引起丝状菌过量生长,使得颗粒沉降性能和污染物处理能力恶化,EPS急剧减少。
3)提高蛋白胨的进水占比能够有效抑制丝状菌的生长,使颗粒恢复正常,胞外聚合物增加,沉降性能和水质处理能力重新恢复。
4)在高OLR环境下的优势菌门为Saccharibacteria(糖杆菌门)、Bacteroidetes(拟杆菌门)、Proteobacteria(变形菌门)。其中Flavobacterium菌属是一种EPS分泌菌属,能分泌EPS来维持颗粒稳定性。此外,Flavobacterium、Paracoccus以及Brevundimonas菌属能够通过异养硝化-好氧反硝化的方式进行脱氮。同时在颗粒优势菌种中未检测到优势自养硝化菌,可以推测,在高有机负荷环境下,异养硝化-好氧反硝化起主要脱氮作用。
高有机负荷对好氧颗粒污泥形成和稳定性能的影响
Effect of high organic loading rate on the formation and stability of aerobic granular sludge
-
摘要: 为探究高有机负荷(organic loading rate,OLR)对好氧颗粒污泥在序批式反应器(sequencing batch reactor,SBR)中的形成和稳定性能的影响及高OLR条件下微生物群落结构的特征,采用连续监测方法对运行过程中颗粒污泥形貌、水质、沉降性能以及EPS的变化进行探究。结果表明:在OLR为14.4 kg·(m3·d)−1的条件下,颗粒化进程较快,43 d完成颗粒造粒;并且高OLR引起丝状菌在颗粒表面大量附着,造成颗粒沉降性能和水质处理能力不稳定;通过改变进水中蛋白胨的占比来抑制丝状菌生长,使好氧颗粒污泥系统重新恢复稳定;在此过程中,混合液悬浮固体质量浓度(mixed liquid suspended solids,MLSS)、混合液挥发性悬浮固体质量浓度(mixed liquid volatile suspended solids,MLVSS)随OLR的增加而增加,但受丝状菌增加的影响会下降,而在丝状菌消除之后,MLSS和MLVSS恢复增长;SVI随OLR的增加不断下降,而受丝状菌增加的影响会呈现上升趋势,在丝状菌消除后,颗粒沉降性能恢复,SV30/SV5在1.0左右波动;胞外聚合物(extracellular polymeric substances,EPS)受OLR和丝状菌影响较大,尤其是紧密结合型的EPS;恢复正常的颗粒污泥可高效去除进水中的COD、NH4+-N和TN,去除率分别为91.5%、92.0%和79.4%;采用MiSeq高通量测序的方法发现高OLR下好氧颗粒污泥中去除有机物和氮的优势菌门为Saccharibacteria、Bacteroidetes和Proteobacteria;异养硝化、好氧反硝化菌丰度较高。由此可以看出,异养硝化-好氧反硝化可能是好氧颗粒污泥的主要脱氮方式。本研究结果可为SBR系统控制好氧颗粒污泥中丝状菌的生长,维持好氧颗粒污泥稳定性提供参考。Abstract: In order to study the effect of high organic loading rate (OLR) on the formation and stability of aerobic granular sludge in sequencing batch reactor (SBR) and the characteristics of microbial community structure under high OLR conditions, continuous monitoring method was used to explore the changes in granular sludge morphology, water quality, sedimentation performance and EPS during operation. The experimental results showed that under the high OLR condition of 14.4 kg·(m3·d)−1, the granulation process was fast and completed in 43 days. And high OLR stimulated the growth of filamentous bacteria attaching to the surface of granules, which resulted in the instability of sedimentation performance and effluent quality. Through changing the proportion of peptone in the influent, the growth of filamentous bacteria was inhibited and the aerobic granular sludge system recovered the stability. During this process, mixed liquid suspended solids (MLSS) and mixed liquid volatile suspended solids (MLVSS) increased with the increase of OLR, but decreased with the increase of filamentous bacteria. After filamentous bacteria were eliminated, both MLSS and MLVSS increased again. SVI decreased with the increase of OLR, while it showed an upward trend due to the effect of filamentous bacteria increasing. The sedimentation performance of granular sludge also recovered when filamentous bacteria were eliminated, and its SV30/SV5 fluctuated around 1.0. Extracellular polymeric substances (EPS) fluctuated greatly under the influence of OLR and filamentous bacteria, especially for tightly bound EPS. The recovered granular sludge could effectively remove COD, NH4+-N and TN, and the corresponding removal efficiencies were 91.5%, 92.0% and 79.4%, respectively. Through MiSeq high-throughput sequencing method, it was found that Saccharibacteria, Bacteroides and Proteobacteria were the dominant bacteria for removing organic matter and nitrogen in aerobic granular sludge at high OLR, and high abundance of heterotrophic nitrifying and aerobic denitrifying bacteria occurred. The main nitrogen removal mode of aerobic granular sludge was heterotrophic nitrification-aerobic denitrification. The results of this study can provide reference for SBR system to control the growth of filamentous bacteria in aerobic granular sludge and maintain the stability of aerobic granular sludge.
-
好氧颗粒污泥是多种功能微生物的聚集体[1]。与传统活性污泥相比,好氧颗粒污泥在污水处理系统中具有更优越的性能,如结构紧密、沉降性能良好、生物量高、功能微生物丰富、对有毒物质耐受性强、能有效去除污染物等[2]。因此,好氧颗粒污泥是目前关注最多的污水处理技术之一。已有研究[3-5]表明,好氧颗粒污泥往往需要在有选择压力的特定条件下形成,如水力调节、沉降时间、营养-饥饿更替、进水负荷调整等。这些特定条件会影响微生物群落的代谢机能[2],增加细菌胞外聚合物(extracellular polymeric substances,EPS)的分泌[6],进而促进颗粒化进程。
根据Monod方程,底物质量浓度对微生物的生长至关重要,高质量浓度底物在功能微生物的积累中起关键作用[7]。同时,底物质量浓度也会影响EPS的分泌[6]。因此,高有机负荷(organic loading rate,OLR)被认为是快速促进颗粒形成的方法之一[8]。ZHANG等[9]的研究表明,在OLR为24 kg·(m3·d)−1和12 kg·(m3·d)−1条件下,7 h和24 h出现颗粒污泥。然而,高OLR容易引起好氧颗粒污泥系统运行不稳定,出水水质变差,严重时甚至引起颗粒解体[8]。MOY等[10]报道,在OLR为6 kg·(m3·d)−1条件下培养颗粒污泥,发现颗粒表现出以丝状菌为主的蓬松形态,会对颗粒沉降性能造成影响。LIU等[11]的研究同样表明,高OLR会引发丝状菌生长,导致颗粒沉降性能变差和生物量减少,进而对颗粒的长期稳定性造成影响。SCHWARZENBECK等[12]的研究表明,在OLR为5.9 kg·(m3·d)−1条件下,培养出的颗粒中丝状菌过度生长,降低了颗粒的沉降速度。因此,高OLR条件下有效控制丝状菌的生长对于维持好氧颗粒污泥系统的稳定性至关重要。目前对于丝状菌生长的控制策略包括延长沉淀时间、降低C/N比、提高溶解氧、改变碳源等[13-14]。高景峰等[7]在底物中加入蛋白胨,能够抑制颗粒污泥中丝状菌的生长。陈希等[15]也发现,蛋白胨能够有效抑制丝状菌的生长并使颗粒密实光滑。因此,研究蛋白胨对于丝状菌生长的影响,有助于提高颗粒污泥在高OLR下运行的稳定性。高OLR作为促进好氧颗粒污泥快速形成的有效手段,在处理高质量浓度有机污水方面具有广泛的应用前景[16]。然而,目前有关高OLR条件下好氧颗粒污泥的形成和稳定性的报道较为缺乏,尤其是在高OLR条件下丝状菌的生长特性及其控制策略方面。此外,高OLR条件下微生物群落结构特征也少有报道,尚需开展更为广泛深入的研究。
本研究在实验室规模的序批式反应器(sequencing batch reactor,SBR)中,采用递增负荷4.8~14.4 kg·(m3·d)−1的启动方式,培养好氧颗粒污泥,考察高OLR条件对好氧颗粒污泥形成和稳定性能的影响,探究高OLR条件下丝状菌的生长规律及其控制策略,并进一步揭示微生物群落结构对于高OLR的响应,旨在为高负荷条件下控制系统内丝状菌生长并保持颗粒稳定性提供参考。
1. 材料与方法
1.1 实验装置及运行方式
实验采用SBR进行好氧颗粒污泥的培养(图1)。反应器由有机玻璃制成,呈圆柱形,高为1 000 mm,高径比为15,有效容积为2.5 L。反应器侧面每隔200 mm设置4个取样口,出水口位于反应器1/2处,排水比为50%。反应器设置水浴套管,外加电加热棒以维持反应器温度。反应器进水口设置在底部,通过蠕动泵(BT-300 EA,重庆杰恒)控制进水速度为0.08 L·min−1。曝气由空压机(GSX100,中国国厦)通过微孔曝气头从反应器底部供气,曝气速率由转子气体流量计控制为2.5 L·min−1。反应器运行周期为4 h,每天运行6个周期。每个周期进水15 min,初始曝气213 min,沉淀时间10 min,排水2 min。随着颗粒沉降速率的增加,曝气时间逐渐从213 min增加到221 min,沉淀时间逐渐从10 min缩短到2 min。反应器的进水、排水及曝气均通过定时开关采用半自动化控制。
1.2 实验进水和接种污泥
采用人工配水作为实验进水,根据有机碳源质量浓度和种类的不同,分为3个阶段,主要成分见表1。第Ⅰ阶段,OLR为4.8 kg·(m3·d)−1,NH4+-N为0.24 kg·(m3·d)−1。第Ⅱ、III阶段,OLR均为14.4 kg·(m3·d)−1;第Ⅱ阶段,NH4+-N为0.3~0.42 kg·(m3·d)−1;第III阶段,NH4+-N为0.42~0.6 kg·(m3·d)−1。以每阶段的OLR按照占比分配碳源,第Ⅰ阶段,采用无水乙酸钠(50%)和蔗糖(50%)作为混合碳源;第Ⅱ阶段,采用无水乙酸钠(45%)、蔗糖(45%)和蛋白胨(10%)作为混合碳源;第III阶段,采用无水乙酸钠(50%)和蛋白胨(50%)作为混合碳源,以氯化铵作为各阶段的氮源。实验用1 mg蛋白胨相当于约1.04 mg COD,氮的质量分数为12.7%。微量元素溶液组成如下:0.43 g·L−1 ZnSO4·7H2O,0.014 g·L−1 H3BO4,0.99 g·L−1 MnCl2·4H2O,0.25 g·L−1 CuSO4·5H2O,0.19 g·L−1 NiCl2·6H2O,0.24 g·L−1 CoCl2·6H2O。人工配水中微量元素溶液体积分数为3 mL·L−1。实验药品均采用化学纯。
表 1 人工配水组分Table 1. Components of synthetic wastewater配水组分 组分质量浓度/(g·L−1) 第Ⅰ阶段(1~26 d) 第Ⅱ阶段(27~51 d) 第III阶段(52~76 d) 乙酸钠CH3COONa 1.536±0.171 3.225±0.615 3.584±0.683 蔗糖C12H22O11 1.037±0.115 2.117±0.475 — 蛋白胨 — 0.21±0.04 1.25±0.2 NH4Cl 0.149±0.004 0.229±0.038 0.325±0.058 KH2PO4 15 15 15 K2HPO4 36 36 36 本实验所采用的接种污泥来自重庆市鸡冠石污水厂曝气池,取原始污泥在反应器中闷曝24 h,调节混合液悬浮固体质量浓度(mixed liquid suspended solids,MLSS)至5 g·L−1左右后正常进水。
1.3 污泥指标的测定
MLSS、混合液挥发性悬浮固体质量浓度(mixed liquid volatile suspended solids,MLVSS)采用标准重量法测定。
污泥沉降速率(sludge settling velocity, SV)的测定:量取1 000 mL曝气末期处于完全混合状态的泥水,静置沉降5 min后,记录污泥沉降层液位高度;根据沉淀污泥体积占原混合液体积的比值算得SV5;同样地,静置30 min,记录此时污泥沉降层高度,根据沉淀污泥体积占原混合液体积的比值算得SV30。
污泥容积指数 (sludge index,SVI)的计算方法见式(1)。
Q=SM (1) 式中:Q为污泥容积指数(SVI),mL·g−1;S为30 min污泥沉降速率(SV30),mL·L−1;M为混合液悬浮固体质量浓度(MLSS),g·L−1。
1.4 胞外聚合物的提取
EPS分为溶解型EPS(soluble EPS,S-EPS)、松散结合型EPS(loosely bound EPS,L-EPS)和紧密结合型EPS(tightly bound EPS,T-EPS)。S-EPS、L-EPS和T-EPS的提取参照LIANG等[17]使用的方法。取30 mL反应器中污泥于50 mL无菌离心管中,在4 000g、4 ℃条件下离心10 min。弃掉上清液,加入30 mL PBS溶液,重悬并清洗细胞2次,随后将重悬的污泥液体经超声波破碎机冰浴破碎(20 kHz,40 W),然后在2 000g、4 ℃条件下离心15 min,其上清液即为S-EPS。接着向离心管加入PBS再次将污泥重悬至30 mL,并向污泥悬液中加入0.06 mL(37%)的甲酰胺(为了增强L-EPS的提取效果),然后将离心管置于4 ℃恒温振荡器中振荡1 h。最后将重悬液在5 000g、4 ℃条件下离心15 min,收集上清液,即为L-EPS。再次用PBS重悬污泥至30 mL,每克挥发性悬浮固体污泥加入70 g的阳离子交换树脂,在4 ℃、600 r·min−1条件下搅拌1 h,然后在10 000g、4 ℃条件下离心15 min,所得上清液即为T-EPS。多糖(polysaccharides,PS)含量采用硫酸-蒽酮法进行测定。蛋白质(proteins,PN)含量采用Lowry试剂盒方法(Solarbio,日本)测定。总EPS含量为PS和PN的总和。
1.5 群落结构测定方法
微生物群落结构基于MisSeq高通量测序及I-Sanger云平台由美吉生物医药科技有限公司(上海)测定。样品处理过程:取反应器中的颗粒污泥样品1 mL,使用E.Z.N.A. ® soil试剂盒(Omega Bio-tek, Norcross, GA, U.S.)抽提群落DNA,利用NanoDrop2000进行质量浓度和纯度检测,随后采用1%琼脂糖凝胶电泳检测DNA提取质量;纯化后的样品用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对对V3~V4可变区进行16S rRNA PCR扩增,然后用AxyPrep DNA Gel Extraction Kit进行纯化。利用QuantiFluor™-ST(Promega, USA)进行检测定量。利用Illumina MiSeq (Illumina,San Diego,USA)PE300平台进行测序。采用Usearch软件(Version 7.0 http://drive5.com/usearch/)进行聚类分析,在97%相似水平下进行生物信息统计。利用Excel 和Origin等软件,对上述基础数据进行整理和分析。
1.6 分析方法
常规水质指标NH4+-N、NO3−-N、NO2−-N、总氮(TN)、COD的分析方法如下:NH4+-N采用水杨酸-次氯酸盐光度法,NO3−-N采用紫外分光光度法,NO2−-N采用N-(1-萘基)-乙二胺光度法,TN采用过硫酸钾氧化-紫外分光光度法,COD采用重铬酸钾氧化法。采用光学显微镜和扫描电镜(SEM)对颗粒形态及表面结构进行观察。采用标准筛法测量颗粒粒径分布。
2. 结果与分析
2.1 高有机负荷下好氧颗粒污泥的形成及稳定性能
1) 好氧颗粒污泥的形态特性变化。将闷曝后的活性污泥以MLSS为5 g·L−1接种在SBR中。初接种的活性污泥呈深褐色絮体状,在光学显微镜下能观察到菌胶团以及钟虫、轮虫等原生动物和后生动物。第I阶段,反应器以OLR为4.8 kg·(m3·d)−1、NH4+-N为0.24 kg·(m3·d)−1启动。经过23 d的培养,反应器内污泥仍然以絮状体为主,仅有少量颗粒出现,且粒径较小。这一现象表明低OLR条件下造粒缓慢。有研究[18]表明,高OLR能够加速好氧颗粒污泥的形成,可作为一种快速启动策略。因此,为了探究高OLR对颗粒形成的影响,第II阶段,在OLR为14.4 kg·(m3·d)−1、NH4+-N为0.3~0.42 kg·(m3·d)−1条件下,继续培养颗粒污泥。当OLR提高后,反应器内出现较为明显的颗粒,颗粒颜色逐渐变浅,由褐色变为黄色,有较清晰的边界。已有研究[19]表明,当颗粒粒径大于0.2 mm的颗粒体积占比达到90%时,认为颗粒完成造粒。在反应器运行到43 d时,反应器内粒径大于0.2 mm的颗粒占比超过90%,表明好氧颗粒污泥形成。此条件下形成的颗粒粒径在0.83~1.18 mm的占比最多,为29.6%;粒径大于2.36 mm的占比为13.9%(图2(a))。这表明,高OLR下不仅能促进好氧颗粒污泥的形成,而且能够形成粒径更大的颗粒。NGUYEN等[20]也发现,当OLR从2.5 kg·(m3·d)−1增加到10 kg·(m3·d)−1时,好氧颗粒污泥粒径随着OLR的增加而增加,且较高的OLR可形成直径为3~4 mm的颗粒。然而,镜检表明,在高OLR条件下,虽然颗粒形态基本完好,但颗粒表面却有大量丝状菌呈放射状生长,部分颗粒结构松散、边缘疏松(图3(a)~图3(c))。这一结果表明,虽然高OLR能够加快颗粒化进程,但是容易引起丝状菌的附着生长,从而可能引发好氧颗粒污泥丝状菌膨胀,最后导致颗粒解体。
有研究[7]表明,在丝状菌膨胀的好氧颗粒污泥中加入蛋白胨,可达到控制丝状菌生长的目的。虽然在第II阶段也有蛋白胨的加入,但与无水乙酸钠和蔗糖的含量相比,蛋白胨的占比仅为10%,并没起到显著控制丝状菌生长的效果。因此,在第III阶段,从52 d开始,OLR同第II阶段保持一致,但将进水中蛋白胨的含量占比提高到了50%。在高OLR培养下,颗粒粒径进一步增加。在60 d,颗粒粒径在2~3.35 mm的占比达到31.9%,大于3.35 mm的颗粒占比为20.3%(图2(b))。此时颗粒表面丝状菌大量生长的现象仍较为明显。扫描电镜下观察到丝状菌附着在颗粒表面呈网状结构,颗粒结构松散(图4(a)~图4(c))。但随着培养时间的增加,丝状菌逐渐消失。在71 d,颗粒表面已观察不到丝状菌,以球菌和短杆菌为主,颗粒呈光滑密实状态(图4(d)~图4(f))。此时,颗粒粒径较之前有所减少,以粒径0.88~1.4 mm的颗粒为主,占比达到20.65%;而大于3.35 mm的颗粒,占比也从60 d时的20.3%下降到72 d时的12.03%(图2(c))。这一粒径的减少很可能是由于丝状菌脱落引起的。实验结果表明,蛋白胨能够抑制丝状菌的生长,使颗粒在高OLR下保持光滑密实的状态。这可能是因为丝状菌更容易利用简单的小分子有机物,所以当蛋白胨这类复杂有机物占比增多时,会导致丝状菌能利用的简单有机物减少,从而使得好氧颗粒污泥上的丝状菌逐渐脱落,颗粒稳定性得以提升[7,15]。综上可知:高OLR确实可以促进颗粒化进程,但容易引发丝状菌的大量生长;通过投加蛋白胨这类复杂有机物可控制丝状菌的生长,维持高OLR条件下好氧颗粒污泥的稳定性。
2) 好氧颗粒污泥生物量和沉降性能的变化。MLSS和MLVSS可以反映SBR内颗粒污泥的生物量。如图5(a)所示,第Ⅰ阶段,在OLR为4.8 kg·(m3·d)−1的条件下,平均MLSS为5 g·L−1。在此阶段,生物量没有显著增加,其原因可能是,此阶段正处于调节沉淀时间筛选颗粒污泥的阶段,排出的絮体污泥量与污泥生长量可能处于一个平衡状态。第II阶段,当OLR提高到14.4 kg·(m3·d)−1时,生物量显著提高到11.8 g·L−1,说明OLR的提高有助于微生物生长,同时有利于颗粒化进程。然而,在40 d, MLSS呈下降趋势,这可能是由于高OLR引起丝状菌过量生长所导致的。在第III阶段,当改变进水蛋白胨占比后,颗粒恢复正常,MLSS逐渐上升。
SVI是反映颗粒污泥沉降性能的指标,结果如图5(b)所示。活性污泥初始的SVI为43.6 mL·g−1。第Ⅰ阶段,SVI呈逐步下降的趋势,这说明污泥的沉降性能在不断提高。第II阶段,刚开始时,SVI有明显上升,这可能与OLR突然提高导致沉降性能变差有关。随后,SVI不断下降,第43天,污泥造粒完成后,SVI达到16.3 mL·g−1,说明颗粒沉降性能优良。然而,从48 d开始,SVI不断上升,这是由于丝状菌开始附着使得颗粒沉降性能下降。谢锴[21]的研究中也存在相同情况:丝状菌的过度生长使得系统沉降性能降低,部分松散颗粒随水排出,SVI由60 mL·g−1升高至115.6 mL·g−1。在第III阶段初期,SVI仍持续上升。在54 d,SVI升至70.8 mL·g−1,此时反应器内颗粒污泥仍处于丝状菌膨胀状态。随后SVI开始下降,68 d时,颗粒恢复正常形态,SVI在41.7 mL·g−1左右,说明蛋白胨能使颗粒恢复良好的沉降性能。SV30/SV5的比值也可以用于指示好氧颗粒污泥的沉降性能[22]。通常SV30/SV5=1是颗粒沉降性较好的标志。第I阶段,SV30/SV5稳定在0.8~0.9内。在第II阶段和第III阶段初期,即从颗粒形成到丝状菌大量生长期间,SV30/SV5波动较大。在第III阶段末期,SV30/SV5在1左右波动,由此表明颗粒沉降性能恢复良好。
3) 好氧颗粒污泥胞外聚合物的变化。EPS被认为是促进好氧颗粒污泥形成和维持颗粒稳定性的重要组成部分[23]。如图6所示,第I阶段,第23天时颗粒EPS质量分数为199.1 mg·g−1,其中PN质量分数为157.7 mg·g−1,PS质量分数为41.4 mg·g−1。在第II阶段中,随着OLR提升至14.4 kg·(m3·d)−1,EPS质量分数也大幅度上升;第44天,颗粒的EPS质量分数高达359.2 mg·g−1,其中PN质量分数为317.0 mg·g−1,PS质量分数为15.7 mg·g−1。从EPS的构成来看,T-EPS中PN的增加量最为显著。已有研究[24]表明,T-EPS在好氧颗粒污泥的形成中起着重要作用,这主要是因为T-EPS中的PN有利于提高细胞表面Zeta电位和疏水性。然而,在50 d,EPS的质量分数减少至243.9 mg·g−1。这可能是由于此时丝状菌的快速增殖,丝状菌比非丝状菌具有更高的比表面积,能够更加快速地从进水中吸收营养物质,不利于颗粒内非丝状菌的生长,减少了EPS分泌。第III阶段,随着丝状菌的消失,颗粒的EPS质量分数逐渐恢复。在75 d,EPS质量分数升至290.3 mg·g−1。值得注意的是,此时EPS中PS有较大幅度增加,达到85.4 mg·g−1。多糖可作为微生物细胞聚集、黏附的骨架,维持好氧颗粒污泥的结构完整性[25]。EPS中PS的增加可能会有利于增加好氧颗粒污泥结构的稳定性。上述研究表明,高OLR可促进EPS,特别是T-EPS的快速增长,这很可能是促进颗粒化进程的关键原因之一。丝状菌的出现会降低EPS的质量分数,导致颗粒结构疏松。因此,有效控制丝状菌数量,维持EPS质量分数稳定,是保证好氧颗粒污泥稳定的关键。
2.2 高有机负荷下反应器出水水质变化
图7为不同阶段SBR出水水质的变化。第I阶段,COD和NH4+-N出水质量浓度保持稳定。COD去除率在90%左右,NH4+-N去除率在92%左右。TN去除率最终在80%左右波动,这是由反应器中NO3−-N的积累引起的。在第II阶段前期,由于OLR提高使得出水水质有所波动,但随着颗粒的形成,污染物仍保持较好的去除效果。出水中没有明显的NO3−-N和NO2−-N积累,TN的去除率可达到90%以上。这可能是由于随着颗粒的逐步形成,具有反硝化能力的功能菌种丰度的增加强化了反应器内的反硝化作用。但在第II阶段后期,出水中污染物质量浓度却逐渐升高。第48天,COD去除率略有下降,降至81.7%,出水NH4+-N质量浓度升高,并有少量NO2−-N的积累,TN去除率显著下降至48.3%。已有研究[13,26]也报道了当丝状菌大量生长时NH4+-N去除效果变差和脱氮能力降低的现象。由图3和图4可知,丝状菌主要分布在颗粒表面。由此推测,丝状菌在颗粒表面的大量繁殖会阻碍营养物质向颗粒内部传递,降低颗粒对氨氮的吸收利用,导致反应器内硝化菌和反硝化菌的部分流失,使得脱氮能力降低。第III阶段,水质情况急剧恶化,NH4+-N出水质量浓度急剧增加,COD去除率降至71.5%,TN去除率降至17.4%。一方面,这是由于此时颗粒表面仍存在大量的丝状菌;另一方面,蛋白胨的加入提高了进水中有机碳和氮的含量。在第III阶段后期,随着丝状菌不断脱离颗粒表面,TN去除率逐渐上升至79.4%,COD去除率达到91.5%,NH4+-N去除率为92.5%,出水中间产物几乎为零,颗粒对污染物的去除能力逐渐恢复正常。
2.3 高有机负荷下好氧颗粒污泥微生物群落结构分析
对培养75 d的好氧颗粒污泥进行高通量测序分析,按照可生物学分类的最小水平分类,获得总样本数66 692。样本文库覆盖率大于99.9%,表明测序深度能覆盖SBR内的绝大多数细菌信息。如图8(a)所示,颗粒污泥中门主要为Saccharibacteria(糖杆菌门)、Bacteroidetes(拟杆菌门)、Proteobacteria(变形菌门)、Firmicutes(厚壁菌门)和Actinobacteria(放线菌门),上述菌门的相对丰度分别为59.28%、23.54%、15.28%、1.05%和0.86%。Saccharibacteria是一个系统发育多样的群体,在有氧和缺氧条件下能参与各种有机化合物和糖化合物的降解[27]。已有研究[28]报道,蛋白胨作为碳源会促进Saccharibacteria门的生长,这可能是反应器中Saccharibacteria门丰度高的原因。Bacteroidetes门的菌种具有降解有机物和同步脱氮除磷的功能,也是好氧颗粒污泥内常见的菌门[29]。Proteobacteria门也是好氧颗粒污泥里的常见菌门,具有降解有机物的功能[18]。Firmicutes门能维持好氧颗粒污泥稳定性和实现有机物的去除[30]。Actinobacteria门被报道具有去除有机物和生物固氮作用[31]。由群落结构分析结果可知,Saccharibacteria、Bacteroidetes和Proteobacteria是能适应高有机负荷的优势菌门,负责实现反应器内有机物和氮的去除。
在属水平上,Saccharibacteria(59.28%)和Firmicutes(1.05%)下没有得到进一步的分类信息。Bacteroidetes门下(图8(b)),单一菌属相对丰度大于0.5%的依次是Flavobacterium(黄杆菌属,16.38%)、Nubsella(2.5%)、Leadbetterella(里德拜特氏菌,1.30%)和Ferruginibacter(0.94%)。Flavobacterium是好氧颗粒污泥内普遍存在的菌属,但通常丰度并不太高[32]。而反应器内Flavobacterium的丰度却高达16.38%,这说明Flavobacterium可能更适应高有机负荷的生长环境。据报道[33],Flavobacterium是一种EPS分泌菌属,有助于细胞粘附以及好氧颗粒污泥的稳定性。Flavobacterium菌属在系统中具有较高的丰度,由此可以说明,该菌属对于维持好氧颗粒污泥的稳定起着重要作用。此外,Flavobacterium菌属还被发现具有异养硝化-好氧反硝化的特性[34],说明其可能参与反应器的脱氮。Proteobacteria门下(图8(c)),单一菌属相对丰度大于0.5%的为Paracoccus(副球菌属,0.72%)和Brevundimonas(短波单胞菌,0.5%)。Paracoccus菌属在好氧颗粒污泥系统中可将有机物转化为PHA储存,显示出稳定的生物降解作用[35]。此外,Paracoccus还具有异养硝化-好氧反硝化功能[36]。Actinobacteria门下(图8(d)),单一菌属相对丰富接近0.5%的为Micropruina(微白霜菌属,0.49%)。Micropruina是一种糖原菌属,能保持处理系统良好的有机物去除能力。同时Micropruina能以硝酸盐作为氮源进行生长,并将其还原成亚硝酸盐[37]。
综上所述,蛋白胨的添加使得能够利用蛋白胨的Saccharibacteria成为了优势菌门,Flavobacterium、Paracoccus等具有异养硝化-好氧反硝化功能的菌属在反应器中富集,从而实现氮的去除。此外,在群落中并未发现有优势自养硝化菌的存在,可以推测,在高有机负荷环境下,异养硝化-好氧反硝化起主要脱氮作用。
3. 结论
1)采用人工配水运行SBR,第I阶段,以OLR为4.8 kg·(m3·d)−1培养颗粒,颗粒生长缓慢,反应器主要以絮体为主。将OLR提高至14.4 kg·(m3·d)−1,反应器经过43 d完成造粒,表明高OLR可促进颗粒化进程。
2)高OLR容易引起丝状菌过量生长,使得颗粒沉降性能和污染物处理能力恶化,EPS急剧减少。
3)提高蛋白胨的进水占比能够有效抑制丝状菌的生长,使颗粒恢复正常,胞外聚合物增加,沉降性能和水质处理能力重新恢复。
4)在高OLR环境下的优势菌门为Saccharibacteria(糖杆菌门)、Bacteroidetes(拟杆菌门)、Proteobacteria(变形菌门)。其中Flavobacterium菌属是一种EPS分泌菌属,能分泌EPS来维持颗粒稳定性。此外,Flavobacterium、Paracoccus以及Brevundimonas菌属能够通过异养硝化-好氧反硝化的方式进行脱氮。同时在颗粒优势菌种中未检测到优势自养硝化菌,可以推测,在高有机负荷环境下,异养硝化-好氧反硝化起主要脱氮作用。
-
表 1 人工配水组分
Table 1. Components of synthetic wastewater
配水组分 组分质量浓度/(g·L−1) 第Ⅰ阶段(1~26 d) 第Ⅱ阶段(27~51 d) 第III阶段(52~76 d) 乙酸钠CH3COONa 1.536±0.171 3.225±0.615 3.584±0.683 蔗糖C12H22O11 1.037±0.115 2.117±0.475 — 蛋白胨 — 0.21±0.04 1.25±0.2 NH4Cl 0.149±0.004 0.229±0.038 0.325±0.058 KH2PO4 15 15 15 K2HPO4 36 36 36 -
[1] PRONK M, DE KREUK M K, DE BRUIN B, et al. Full scale performance of the aerobic granular sludge process for sewage treatment[J]. Water Research, 2015, 84: 207-217. doi: 10.1016/j.watres.2015.07.011 [2] ROLLEMBERG S L D, BARROS A R M, FIRMINO P I M, et al. Aerobic granular sludge: Cultivation parameters and removal mechanisms[J]. Bioresource Technology, 2018, 270: 678-688. doi: 10.1016/j.biortech.2018.08.130 [3] 史晓慧, 刘芳, 刘虹, 等. 进料负荷调控培养好氧颗粒污泥的试验研究[J]. 环境科学, 2007, 28(5): 1026-1032. doi: 10.3321/j.issn:0250-3301.2007.05.018 [4] SUN Y W, GOMEIZ A T, VAN AKEN B, et al. Dynamic response of aerobic granular sludge to feast and famine conditions in plug flow reactors fed with real domestic wastewater[J]. Science of the Total Environment, 2021, 758: 144155. doi: 10.1016/j.scitotenv.2020.144155 [5] TAY J H, LIU Q S, LIU Y. The effects of shear force on the formation, structure and metabolism of aerobic granules[J]. Applied Microbiology and Biotechnology, 2001, 57(1/2): 227-233. [6] 王浩宇, 苏本生, 黄丹, 等. 好氧污泥颗粒化过程中Zeta电位与EPS的变化特性[J]. 环境科学, 2012, 33(5): 1614-1620. doi: 10.13227/j.hjkx.2012.05.039 [7] 高景峰, 苏凯, 张倩, 等. 底物种类和浓度对好氧颗粒污泥丝状菌膨胀的影响[J]. 北京工业大学学报, 2011, 37(7): 1027-1032. doi: 10.11936/bjutxb2011071027 [8] IORHEMEN O T, LIU Y. Effect of feeding strategy and organic loading rate on the formation and stability of aerobic granular sludge[J]. Journal of Water Process Engineering, 2021, 39: 101709. doi: 10.1016/j.jwpe.2020.101709 [9] ZHANG X, LIU Y Q, TAY J H, et al. Fast granulation under extreme selection pressures and its formation mechanism[J]. Fresenius Environmental Bulletin, 2013, 22(5): 1330-1338. [10] MOY B Y P, TAY J H, TOH S K, et al. High organic loading influences the physical characteristics of aerobic sludge granules[J]. Letters in Applied Microbiology, 2002, 34(6): 407-412. doi: 10.1046/j.1472-765X.2002.01108.x [11] LIU Y, LIU Q S. Causes and control of filamentous growth in aerobic granular sludge sequencing batch reactors[J]. Biotechnology Advances, 2006, 24(1): 115-127. doi: 10.1016/j.biotechadv.2005.08.001 [12] SCHWARZENBECK N, BORGES J M, WILDERER P A. Treatment of dairy effluents in an aerobic granular sludge sequencing batch reactor[J]. Applied Microbiology and Biotechnology, 2005, 66(6): 711-718. doi: 10.1007/s00253-004-1748-6 [13] 龙焙, 濮文虹, 杨昌柱, 等. 失稳好氧颗粒污泥在SBR中的修复研究[J]. 中国给水排水, 2015, 31(7): 29-33. doi: 10.19853/j.zgjsps.1000-4602.2015.07.008 [14] 李志华, 刘超, 赵静, 等. 丝状菌颗粒污泥形成过程及其对膨胀控制的启示[J]. 中国给水排水, 2013, 29(13): 23-27. doi: 10.3969/j.issn.1000-4602.2013.13.006 [15] 陈希, 袁乙卜, 张建民, 等. 大分子有机物对除磷颗粒污泥特性及菌群结构的影响[J]. 环境科学学报, 2021, 41(4): 1309-1322. doi: 10.13671/j.hjkxxb.2020.0425 [16] 白静, 王现丽, 李智, 等. 好氧颗粒污泥处理高浓度有机废水的研究进展[J]. 中国给水排水, 2020, 36(8): 38-43. [17] LIANG Z, LI W, YANG S, et al. Extraction and structural characteristics of extracellular polymeric substances (EPS), pellets in autotrophic nitrifying biofilm and activated sludge[J]. Chemosphere, 2010, 81(5): 626-632. doi: 10.1016/j.chemosphere.2010.03.043 [18] LIU Y Q, MOY B, KONG Y H, et al. Formation, physical characteristics and microbial community structure of aerobic granules in a pilot-scale sequencing batch reactor for real wastewater treatment[J]. Enzyme and Microbial Technology, 2010, 46(6): 520-525. doi: 10.1016/j.enzmictec.2010.02.001 [19] NANCHARAIAH Y V, REDDY G K K. Aerobic granular sludge technology: Mechanisms of granulation and biotechnological applications[J]. Bioresource Technology, 2018, 247: 1128-1143. doi: 10.1016/j.biortech.2017.09.131 [20] NGUYEN P T T, NGUYEN P V, TRUONG H T B, et al. The formation and stabilization of aerobic granular sludge in a sequencing batch airlift reactor for treating tapioca-processing wastewater[J]. Polish Journal of Environmental Studies, 2016, 25(5): 2077-2084. doi: 10.15244/pjoes/62736 [21] 谢锴. 原生动物和丝状菌对好氧颗粒污泥结构特性的影响 [D]. 杭州: 浙江工业大学, 2015. [22] HAMZA R A, ZAGHLOUL M S, LORHEMEN O T, et al. Optimization of organics to nutrients (COD∶N∶P) ratio for aerobic granular sludge treating high-strength organic wastewater[J]. Science of the Total Environment, 2019, 650: 3168-3179. doi: 10.1016/j.scitotenv.2018.10.026 [23] HE Q L, CHEN L, ZHANG S J, et al. Simultaneous nitrification, denitrification and phosphorus removal in aerobic granular sequencing batch reactors with high aeration intensity: Impact of aeration time[J]. Bioresource Technology, 2018, 263: 214-222. doi: 10.1016/j.biortech.2018.05.007 [24] WANG Y Y, WANG J Q, LIU Z P, et al. Effect of EPS and its forms of aerobic granular sludge on sludge aggregation performance during granulation process based on XDLVO theory[J]. Science of the Total Environment, 2021, 795: 148682. doi: 10.1016/j.scitotenv.2021.148682 [25] 刘丽娟. 胞外多糖对好氧颗粒污泥稳定性的影响研究 [D]. 重庆: 重庆大学, 2021. [26] 苏雪莹, 付昆明. 丝状菌在污水处理中的控制与应用[J]. 水处理技术, 2015, 41(9): 19-23. doi: 10.16796/j.cnki.1000-3770.2015.09.004 [27] ADLER A, HOLLIGER C. Multistability and reversibility of aerobic granular sludge microbial communities upon changes from simple to complex synthetic wastewater and back[J]. Frontiers in Microbiology, 2020, 11: 574361. doi: 10.3389/fmicb.2020.574361 [28] 马思佳, 顾卓江, 丁丽丽, 等. 碳源对活性污泥微生物细胞膜特性和群落结构影响[J]. 微生物学通报, 2017, 44(3): 561-573. doi: 10.13344/j.microbiol.china.160209 [29] 高景峰, 王时杰, 樊晓燕, 等. 同步脱氮除磷好氧颗粒污泥培养过程微生物群落变化[J]. 环境科学, 2017, 38(11): 4696-4705. doi: 10.13227/j.hjkx.201703275 [30] JIN Y, XIONG W, ZHOU N, et al. Role of initial bacterial community in the aerobic sludge granulation and performance[J]. Journal of Environmental Management, 2022, 309: 114706. doi: 10.1016/j.jenvman.2022.114706 [31] SU C Y, LIAO L M, ZHAO L J, et al. Impact cassava residue on ammonia emission and microbial communities during sewage sludge cocomposting process[J]. Environmental Progress & Sustainable Energy, 2018, 37(6): 1925-1931. [32] XIA J T, YE L, REN H Q, et al. Microbial community structure and function in aerobic granular sludge[J]. Applied Microbiology and Biotechnology, 2018, 102(9): 3967-3979. doi: 10.1007/s00253-018-8905-9 [33] ZHANG P, DING X S, ZHAO B, et al. Acceleration of biofilm formation in start-up of sequencing batch biofilm reactor using carriers immobilized with Pseudomonas stutzeri strain XL-2[J]. Bioresource Technology, 2020, 314: 123736. doi: 10.1016/j.biortech.2020.123736 [34] ŚWIĄTCZAK P, CYDZIK-KWIATKOWSKA A. Performance and microbial characteristics of biomass in a full-scale aerobic granular sludge wastewater treatment plant[J]. Environmental Science & Pollution Research, 2018, 25(2): 1655-1669. [35] FALL C, BARRON-HERNANDEZ L M, GONZAGA-GALEANA V E, et al. Ordinary heterotrophic organisms with aerobic storage capacity provide stable aerobic granular sludge for C and N removal[J]. Journal of Environmental Management, 2022, 308: 114662. doi: 10.1016/j.jenvman.2022.114662 [36] WANG L X, YU X J, XIONG W, et al. Enhancing robustness of aerobic granule sludge under low C/N ratios with addition of kitchen wastewater[J]. Journal of Environmental Management, 2020, 265: 110503. doi: 10.1016/j.jenvman.2020.110503 [37] SHINTANI T, LIU W T, HANADA S, et al. Micropruina glycogenica gen. nov., sp, nov., a new gram-positive glycogen-accumulating bacterium isolated from activated sludge[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50: 201-207. doi: 10.1099/00207713-50-1-201 -




 下载:
下载: