-
进入二十一世纪以来全球疫情不断暴发,如2002年的重症急性呼吸综合征 (SARS) 、2009年的甲型H1N1流感、2012年的中东呼吸综合征 (MERS) 以及2019年暴发后蔓延全球的新冠 (COVID-19) 疫情,严重威胁着人类健康和社会发展。抗疫过程中传统化学消毒剂 (如氯) 的大量使用,导致了残余消毒剂及消毒副产物引发的次生风险。紫外线 (UV) 作为一种气、水和物体表面的高效、绿色消毒技术,受到广泛关注。国际照明委员会 (Commission Internationale de l’Eclairage,CIE) 按波长将UV分为UV-A (波长315~400 nm) 、UV-B (波长280~315 nm) 和UV-C (波长100~280 nm) ,其中UV-C中又包含真空UV (波长100~200 nm) 、远UV-C (波长200~230 nm) 和灭活UV-C (波长250~280 nm) 。
灭活UV-C (如波长254 nm) 可破坏绝大多数病原微生物的复制过程,使其失去感染性,从而达到高效、低耗的消毒效果,是目前UV消毒领域应用最为广泛的波段。远UV-C可有效杀灭各类病原微生物,但却被长期忽视,尚未广泛应用于消毒领域。主要原因在于其较高的光子能量,较其它波段UV-C更易被介质吸收,从而影响消毒效果。其次,远UV-C光源的电光转化效率 (低于5%) 远低于传统低压汞灯 (约36%) ,故在应用中能耗较高,亦会限制其应用。然而,远UV-C对眼睛和皮肤的伤害较传统灭活UV-C更低,且未发现有效消毒剂量下的远UV-C辐照会对人体造成伤害。因此,基于远UV-C的特性,可开发人机共存条件下的原位UV消毒,以阻断病毒传播,保护人类健康。本文通过对比远UV-C的辐射光源的特点,分析典型病原微生物的灭活机理与效果,以及人体的远UV-C暴露风险,分析其在消毒应用中应解决的关键问题,以期为其应用研究提供参考。
-
1) 准分子灯。准分子灯是常用的远UV-C光源,其通过填充稀有气体和卤素的混合物,经电激发后可发射准单色光。通过填充物改变可调节准分子灯的输出波长,并通过灯设计 (气体压力或成分) 的优化在一定程度上调控激发态分子的电子跃迁,从而提高电光转化效率。辐射远UV-C的光源填充物为KrCl,其主峰位和半峰宽通常为222 nm和4 nm (图1) 。需要指出的是,由于设计、质量的差异,不同生产商的产品辐射出的远UV-C主峰位和半峰宽会有所差异。目前,对于空气和物体表面消毒,准分子灯是最为适合且技术成熟的远UV-C光源。准分子灯的主要优点在于其可在有效消毒的同时,保持较低的人体暴露风险。然而,KrCl准分子灯还存在少量其它发射波长[1],需安装光学滤光片对其进行滤除 (特别是灭活UV-C 250~280 nm) ,使UV输出集中于远UV-C。此外,KrCl准分子灯UV-C输出的电光转化效率远低于传统低压汞灯 (主要输出波长254 nm) ,导致其消毒能耗较高,需在应用中予以考虑。
2) 中压汞灯。中压汞灯可发射连续波段200~400 nm的UV,包含远UV-C。由于H2O2在远UV-C波段的吸光度远高于230~280 nm UV-C波段,因此中压汞灯常与H2O2结合,产生羟基自由基 (·OH) 高效去除水中难降解有机污染物,其工艺效能高于传统低压汞灯。然而,中压汞灯其余波段的UV输出量过大,很难采用滤光片技术将其滤除,即无法输出单一的远UV-C,造成眼睛和皮肤较大的暴露风险,不适宜作为远UV-C消毒的光源。
3) 固态UV光源。固态UV光源 (如UV发光二极管,UV-LED) 是光源领域的重要发展方向。目前可见光固态光源已被广泛应用,波长在265~285 nm的传统UV-LED发展迅猛,其功率、寿命和成本等指标快速突破,已被初步应用于空气、小规模供水、物体表面等的消毒。基于AlGaN薄层结构的远UV-C UV-LED已被研发[2],但其输出功率、寿命和成本等指标尚未达到实际应用级别。基于对可见光LED和传统UV-LED的研发积累,UV-LED将在未来成为重要的远UV-C消毒光源。
-
不同波长UV辐照下,病原微生物的吸光度不同,故相应的灭活原理亦不同,同时其消毒效果也有差异。病原微生物的核酸可吸收UV-C,吸收峰值在260 nm附近 (图1) 。被吸收的UV-C光子会干扰核酸复制,从而导致病原微生物丧失传染性,以达到消毒效果[3]。基于此原理,传统低压汞灯已被广泛应用于空气、水和物体表面的消毒。
蛋白质在远UV-C波段的吸光度很高 (图1) ,吸收光子后导致变性失活,达到病原微生物的灭活。然而,由于细胞内光程较短 (< 1 μm) ,病原微生物对远UV-C的吸光度低于0.02 cm−1 [4],使得病原微生物的外层蛋白质 (如细菌细胞膜上的蛋白质、病毒的外层蛋白) 无法大比例阻隔远UV-C辐照到内部核酸。因此,远UV-C消毒同时存在干扰核酸复制和蛋白质失活2种灭活机制[5-7]。目前,对远UV-C的研究主要集中于光源、消毒效果及安全性,其灭活的影响因素 (介质吸收和颗粒的影响) 、多波长协同灭活机制等尚需进一步研究。
-
远UV-C (222 nm) 和灭活UV-C (254 nm) 对不同病原微生物的灭活效果对比见表1。2种UV-C对SARS-CoV-2病毒的灭活都非常有效。其中MA等[8]采用无滤光片和含滤光片下KrCl准分子灯,测定SARS-CoV-2病毒灭活速率常数分别是1.52和1.42 cm2·mJ−1,高于ROBINSON等[9]的KrCl准分子灯 (含滤光片) 的实验结果 (0.64 cm2·mJ−1) ,其原因可能是ROBINSON等实验中测试溶液吸光度 (> 30 cm−1) 高于MA等的研究 (0.05 cm−1) 。MA等和STORM等测定出低压汞灯 (254 nm) 对SARS-CoV-2病毒的灭活速率常数分别为0.79[8]和0.59[10] cm2·mJ−1,低于远UV-C灭活速率常数。远UV-C能够高效灭活病原微生物的原因是蛋白质对于222 nm附近的UV波长有更高的吸收率,且蛋白质失活机制的消毒效能更高,同时也说明远UV-C较灭活UV-C拥有相似甚至更强的灭活能力。因此,在远UV-C消毒数据相对缺乏的情况下,可借助低压汞灯 (254 nm) 的数据保守预测远UV-C的灭活效果。
表1结果表明,相对于低压汞灯 (254 nm) ,远UV-C对包膜病毒 (HCoV 229E和MHV) 、包膜噬菌体 (Phi6) 、无包膜噬菌体 (MS2和T1UV) 具有更好的灭活效果,说明远UV-C消毒的高效性在不同类型病毒中普遍存在。包膜RNA病毒HCoV 229E和MHV,无包膜双链DNA病毒T1UV噬菌体,都具有较低的生物安全性要求,且与SARS-CoV-2病毒灭活速率常数相似,因此可被选为SARS-CoV-2病毒的替代受试微生物。而HCoV 229E和MHV病毒与SARS-CoV-2同为包膜RNA病毒,其结构相似性更有利于SARS-CoV-2病毒灭活机理的研究。Phi6噬菌体与SARS-CoV-2病毒相比更难灭活,可作为保守的替代受试微生物。此外,MS2噬菌体较SARS-CoV-2病毒对UV辐照敏感性差异较大。
-
传统灭活UV-C对不同介质 (如空气、水和物理表面) 的病原微生物均有较强的消毒能力,特别是多项研究已证明UV-C对空气及飘落物体表面的气溶胶飞沫 (高传染性病毒的重要传播途径) 具有明显的消毒效果[13-14]。远UV-C较灭活UV-C具有更短的波长和更高的光子能量,而空气中气溶胶飞沫本身通常含有较高浓度的蛋白质,会吸收远UV-C并减低其在气溶胶内的穿透。由于气溶胶的直径和组成差异会对消毒产生不同程度影响,因此,远UV-C对气溶胶飞沫病原微生物的灭活是一个复杂的过程。现有各介质灭活结果初步表明,介质对远UV-C灭活SARS-CoV-2病毒的影响并不显著[8,10-12,15]。目前,通过病原微生物悬浮液测定UV灭活曲线的方法已较为成熟,该方法测得的数据可用来代表不同介质中远UV-C的灭活效果。美国政府工业卫生师协会 (ACGIH) 和国际非电离辐射防护委员会 (ICNIRP) 规定远UV-C暴露安全阈值分别为23 mJ·cm−2[16] 与25 mJ·cm−2[17],远UV-C阈值剂量足以灭活大部分空气、水、物体表面的病原微生物 (包括SARS-CoV-2[8-10]) ,阻断高传染性疾病的传播途径。
-
UV-C辐照皮肤会诱导皮肤癌的发生[18-19]。目前针对UV辐照致癌的机理研究多集中于254 nm及UV-B和UV-A波段上[20]。此外,多数流行病学研究结果证明了环境太阳辐射中皮肤癌的主要诱因为UV-B[21]。而远UV-C机理研究和暴露案例较少,尚没有远UV-C致癌的研究结论。
当UV穿透皮肤表层 (角质层、颗粒层和棘层) 辐射到基底层时,可能会损伤DNA并引发皮肤癌。皮肤表层的角质层能够吸收UV辐射,在一定程度上保护皮肤。远UV-C光子能量更高,会被有机质分子 (如蛋白质) 强烈吸收。然而,其穿透能力远低于灭活UV-C,则意味着可被UV-B或灭活UV-C穿透的角质层,会强烈吸收远UV-C,再结合颗粒层和棘层的吸收,可基本阻隔远UV-C到达基底层。
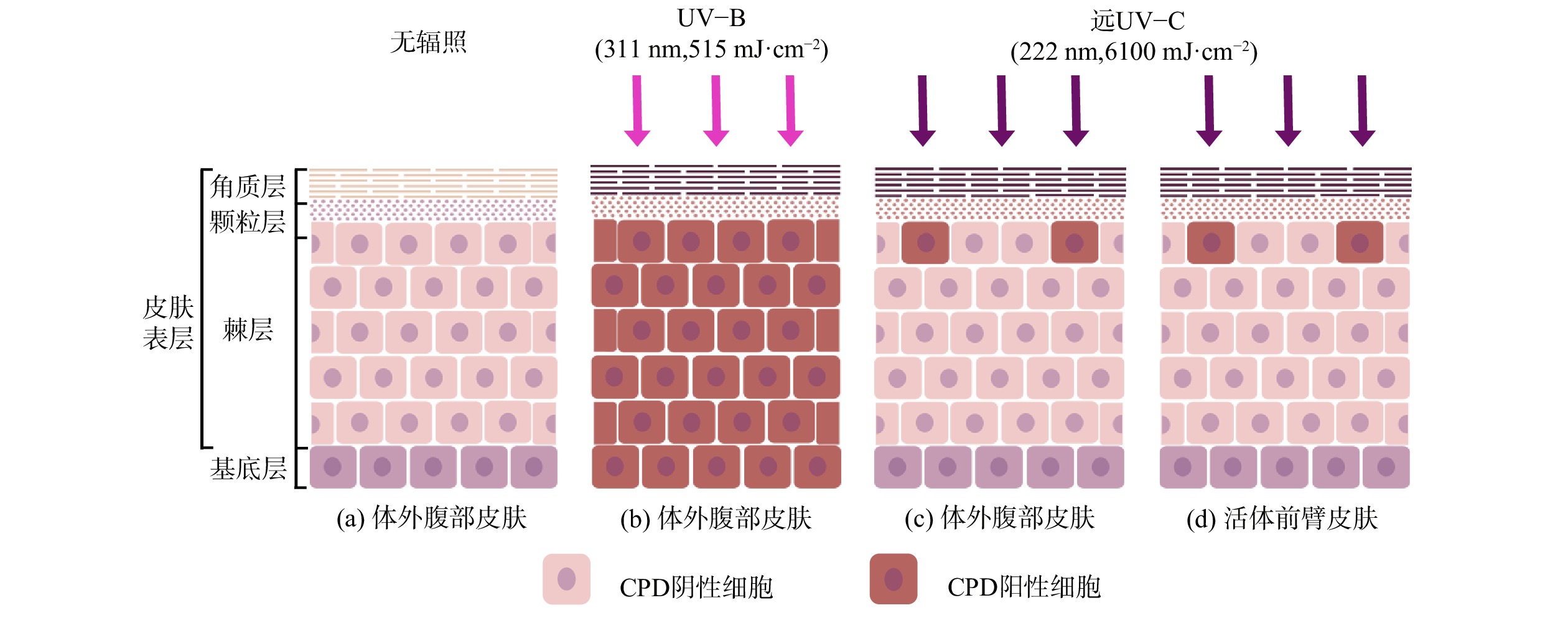
远UV-C辐射人体和无毛小鼠皮肤的研究结果表明[22-33],即使使用远超现有安全阈值的剂量辐照[16],也尚未观察到其对皮肤可量化的辐照损伤。WOODS等[22]使用远UV-C辐照人体背部,发现40 mJ·cm−2的辐照就会使皮肤出现红斑。这可能是由于实验使用未经过滤的KrCl准分子灯,同时产生了波长大于230 nm的UV-C。FUKUI等[23]在2020年重复此实验,改用滤光片过滤掉大于230 nm UV的KrCl准分子灯,在剂量相近甚至更高的情况下 (50~500 mJ·cm−2) ,也未观察到皮肤出现红斑或其他安全风险。研究人员在检测了远UV-C辐照的动物皮肤中DNA主要光照产物环丁烷嘧啶二聚体 (CPDs) 的分布,发现CPDs数量有限且仅出现于皮肤表层[26,29,31-33]。HICKERSON等[32]使用人类体外腹部皮肤 (图2 (a) ) 进行了相似实验,使用远UV-C (6 100 mJ·cm−2) 辐照后仅在表皮最上部出现了较少的CPDs (图2 (c) ) ,而使用UV-B (515 mJ·cm−2) 辐照后在表层和基底层均检测到CPDs (图2 (b) ) 。
2名研究人员自愿使用前臂皮肤进行了条件相同的远UV-C辐照 (图2 (d) ) ,实验结果与体外腹部皮肤相同。由于高剂量的UV-B对人体伤害较大,并未进行基于UV-B的对照实验[32]。可以看出远UV-C辐照皮肤后CPDs只出现在无增殖能力的表层细胞上,没有到达拥有增殖能力的基底层,因此研究人员认为其没有致癌风险[32,34]。远UV-C辐照安全性实验中,辐照剂量远高于远UV-C的安全阈值 (23 mJ·cm−2,ACGIH[16]) ,而安全阈值又高于消毒所需剂量,间接证明合理使用远UV-C消毒不会导致皮肤损伤。
-
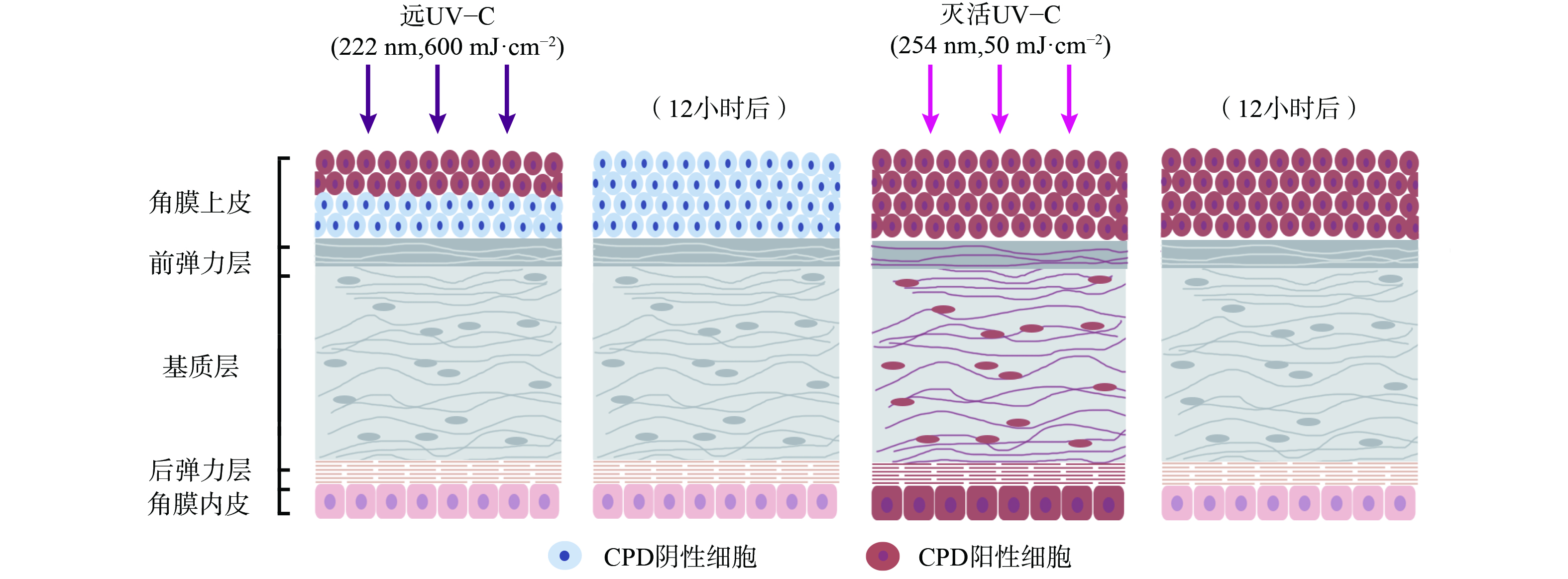
UV辐射会诱发光性角膜炎、翼状胬肉等眼部疾病[35],但目前实验表明远UV-C对眼睛的影响有限。其原理在于远UV-C会被角膜上皮强烈吸收,而角膜上皮细胞会不断地自我脱落,由底层细胞分化补充。KAIDZU等[36-37]通过动物实验评估,发现远UV-C在207 nm和222 nm引发角膜炎的安全阈值分别超过10 000 mJ·cm−2和3 500 mJ·cm−2,远高于目前ACGIH的远UV-C安全阈值。KAIDZU等[36-37]还进行了角膜组织学染色评估 (图3) ,使用CPDs作为DNA损伤的标记,在222 nm远UV-C辐照下,仅在大鼠角膜上皮最外层细胞中观察到CPDs。而这些细胞在几天内就会正常脱落,数据也表明12小时后角膜上皮最外层细胞检测不到CPDs。作为对照,在254 nm UV辐照下,CPDs在角膜各层 (包括角膜内皮) 均被发现,且12小时后角膜上皮中仍检测到CPDs。这表明222 nm波长的UV-C几乎不能穿透角膜上皮,而254 nm则能够穿透上皮细胞和基质层。此外,实验中同样使用222 nm远UV-C辐照小鼠、猪和兔子眼部,同样只有在角膜上皮最外层检测到CPDs,且角膜上皮会正常脱落[37]。与皮肤辐照实验类似,眼部辐照实验中远UV-C剂量远高于安全阈值,间接证明了远UV-C安全消毒剂量下不会对角膜产生危害。
-
1) 远UV-C的辐照安全性。尽管近年来已有很多研究表明远高于消毒所需剂量的远UV-C辐照对皮肤和眼睛不会造成伤害[23-33,36-37],满足人机共存原位消毒的安全性要求。但目前结论均源自各国科研人员分散的研究成果,而并非相关部门/组织给出的结论。国际紫外线协会 (IUVA) 发布远UV-C消毒的白皮书,其中提出远UV-C辐照安全性的结论仅为作者观点,并非IUVA的观点[38]。
辐照安全性关乎人类健康,需要在大量、长期的研究数据基础上,谨慎做出结论。因此,目前远UV-C消毒的应用 (特别是直接长期皮肤和眼睛暴露) 仍需谨慎,不应直接宣传其对人体辐照没有伤害,以防误导使用者。可在现有的实验证据基础上,逐步提高远UV-C安全使用的剂量阈值。目前已有最新研究呼吁将远UV-C (222 nm) 暴露安全阈值从23 mJ·cm−2提升至161 mJ·cm−2 (眼部) 和479 mJ·cm−2 (皮肤) [16,39],ACGIH也已多次讨论了远UV-C安全剂量阈值的提高。在实际消毒时,应基于安全剂量阈值,以及该阈值已远高于消毒所需剂量的研究结果,优化设计消毒装置,实现病原微生物原位有效灭活,同时避免皮肤和眼睛的高剂量辐照。
2) 应用过程中会生成少量臭氧及其控制。伴生臭氧导致的二次污染关系到远UV-C应用的安全性。臭氧会影响呼吸、心血管和中枢神经系统,很多负责公众健康的政府部门和非政府组织规定了气相臭氧的暴露限值,如世界卫生组织 (WHO) 规定8小时平均暴露臭氧浓度为0.1 mg·L−1[40],国标《室内空气中臭氧卫生标准》 (GB/T 18202-2000) 规定1h平均最高容许臭氧浓度为0.05 mg·L−1。与常见的真空UV低压汞灯 (即产臭氧低压汞灯) 类似,远UV-C光源辐照氧分子会生成臭氧,臭氧生成速率大于臭氧被UV分解的速率,使空气中臭氧浓度逐渐上升。但氧分子对远UV-C的吸收远低于真空UV (如氙气准分子灯和产臭氧低压汞灯) ,其臭氧生成量也较低;此外部分远UV-C光源会电晕放电产生臭氧,但只有远UV-装置功率较高 (2-10 kV) 时臭氧产生才会较为明显。因此,远UV-C在较小的封闭空间使用时,应注意与通风系统或臭氧淬灭系统 (如还原性物质及活性炭) 联合,将臭氧浓度维持在安全标准以下。此外,部分远UV-C光源采用滤光片,尽量滤除短波段 (低于222 nm) UV,降低臭氧生成。
目前市场上生产的远UV-C光源几何结构、输出功率不同,光源也存在使用时长和应用空间的差异,远UV-C光源的臭氧风险难以准确评估。因此,在设计合适的臭氧控制措施的同时,还需考虑远UV-C光源臭氧风险的监测与评估方法,为标准化应用提供依据。
3) 应用场景问题。远UV-C可在对人体皮肤和眼睛暴露相对安全的情况下,灭活空气中和物体表面的病原微生物,在不同介质 (特别是空气) 消毒中均具有宽广的应用领域和巨大的发展潜力。目前,国内外多个公司开发了可应用于不同领域的远UV-C消毒设施,如高风险人员密集空间和封闭空间内空气消毒的壁挂式和下射式灯具,物体表面、紧凑空间、贵重仪器等消毒的手持式灯具和消毒门等。此外,随着未来更多类型的远UV-C光源出现,其将对阻断高传染性疾病的传播起到重要作用。
远C波段紫外线消毒的原理及应用前景
Principles and application perspective of far UV-C disinfection
-
摘要: 紫外线 (UV) 是一种高效、绿色的消毒技术,广泛应用于气、水和物体表面的病原微生物灭活。远C波段UV (远UV-C,200~230 nm) 消毒所需剂量辐照对人体的伤害尚未被发现,表明远UV-C具备人机共存原位消毒的潜力,因此该技术近期受到关注。概述了远UV-C光源、灭活机制和辐照安全性方面的研究进展:输出主峰位和半峰宽分别为222 nm和4 nm的KrCl准分子灯是最为成熟的消毒用远UV-C光源;远UV-C通过蛋白质损伤和核酸干扰2种途径实现病原微生物灭活,灭活能力较传统UV-C (如254 nm) 更强;尚未发现消毒所需剂量的远UV-C辐照导致的健康危害,如红斑和角膜炎。而在实际应用中,应谨慎对待高剂量远UV-C辐照暴露,确保在现有实验证据基础上,逐步提高远UV-C安全使用的剂量阈值,并考虑与通风系统或臭氧淬灭系统协同使用以避免伴生臭氧造成的二次伤害。本文旨在为远UV-C在高效灭活病原微生物、阻断高传染性疾病传播领域的应用提供参考。Abstract: Ultraviolet (UV), as an efficient and green disinfection technology, has been widely applied to inactivate the pathogens in air, water, and surface. Recently, far UV-C radiation (200-230 nm) has drawn great attention, as it is harmless to human within the normal dose range for disinfection, which has great potential to conduct in situ disinfection with human presence.An overview on far UV-C light sources, inactivation mechanisms, and human health and safety to far UV-C exposure was provided in this article. It was found that krypton-chloride (KrCl) excimer lamps with a main peak at 222 nm and half-peak width at 4 nm were the most mature far UV-C light sources for disinfection, far UV-C inactivated pathogenic microorganisms through protein damage and nucleic acid interfere,and the inactivation ability of far UV-C was stronger than that of traditional UV-C (such as 254 nm). No adverse health effects such as erythema and photokeratitis had been reported for far UV-C irradiation within the dose range required by regular disinfection. However, high dose of far UV-C radiation should still be used with caution in practical applications, where the maximum safe dose should be determined based on experimental evidence and increased gradually. Meanwhile, the use of far-UV-C in collaboration with ventilation system or ozone quenching system should be considered to avoid secondary damage caused by associated ozone. Overall, this article will provide reference for efficient and secure application of far UV-C in disinfection and control of highly infectious epidemics.
-
Key words:
- far UV-C /
- krypton-chloride excimer lamps /
- disinfection /
- secutiry /
- human-machine coexistence
-
厌氧发酵是一种能够有效实现有机废物资源化和能源化的生物反应过程[1]。在我国,餐厨垃圾(FW)每年的产生量约为6×107 t,占城市固体废弃物总量的40%以上[2]。FW主要由易于降解的碳水化合物、蛋白质和脂质组成,具有较高的产甲烷潜力[3-4]。但是,单独发酵FW时,由于FW水解速度较快会积累挥发性脂肪酸(VFA),易发生系统抑制崩溃的后果[5]。已经有研究证明将剩余活性污泥(WAS)添加到FW厌氧发酵系统提高混合发酵运行性能的可行性[6]。与单独FW或WAS厌氧发酵相比,将2者进行厌氧混合发酵能够促使微生物发挥协同作用,稳定厌氧发酵性能。
目前,有关FW和WAS厌氧混合发酵系统的构型主要采用间歇进料的连续搅拌反应器(CSTR)[7-8]。然而,CSTR不能实现污泥停留时间(SRT)和水力停留时间(HRT)的有效分离,使得微生物难以持留,难以保障微生物的持续生长,而且CSTR的间歇式进料方式容易引起负荷冲击。动态膜生物反应器(DMBR)使用在膜基材表面上沉积/吸附形成的滤饼层作为过滤层,能有效防止生长缓慢的厌氧微生物尤其是产甲烷菌的流失,提供了较长SRT来维持大量微生物种群生长[9]。已有研究利用板框内置式膜组件,采用连续流运行模式,在2.8 g·L−1·d−1的负荷下,实现了基于DMBR进行玉米秸秆和FW的混合发酵[10]。连续流进料方式可以有效缓解间歇式进料方式引起的基质冲击,增加系统的缓冲能力。目前,有关连续流动态膜厌氧混合发酵系统的稳定运行的解析鲜见报道。
在厌氧混合发酵系统中,基质的混合比例是影响厌氧发酵的关键参数,李浩等[11]的研究结果表明,在FW和WAS厌氧混合发酵过程中,FW所占比例影响混合发酵的反应速率。同时,厌氧发酵系统的最优基质混合比也会随着系统的长期运行和菌群结构的驯化改变而变化[12]。食微比(F/M)是衡量有机负荷的重要参数[13],F/M与基质种类和接种物中微生物菌群密切相关,不同的F/M会影响系统的效能潜力。截至目前,很少有研究考虑基质混合比(FW/WAS)和F/M对厌氧混合发酵系统长期运行的影响。
本研究构建了FW和WAS的外置式动态膜厌氧混合发酵系统。在连续流条件下启动动态膜厌氧混合发酵系统,以实现系统的稳定运行;同时,对DMBR运行过程中动态膜的形成和固液分离的效果进行解析。通过FW/WAS的产甲烷潜能和动力学实验,优化连续流厌氧混合发酵系统的因素,结合F/M 动力学实验,评价FW/WAS与F/M对连续流厌氧混合发酵系统运行效能的影响。
1. 材料与方法
1.1 实验装置
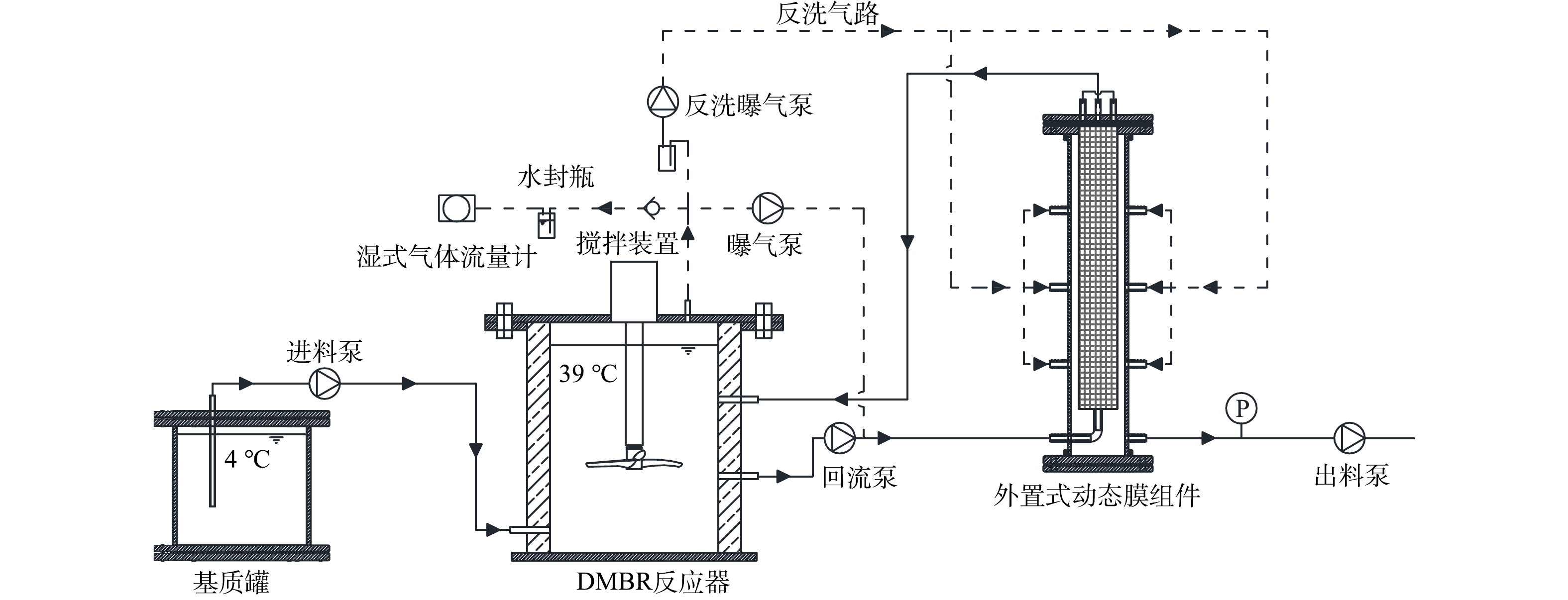
本研究使用的外置式动态膜生物反应器如图1所示。反应器的有效体积为9.0 L,外部使用水浴层和恒温槽来控制反应器的温度为 (39±1) ℃,基质罐连接4 ℃恒温冷水浴。外置式膜组件由300目不锈钢筛网定制加工而成,平均孔径为48 µm,有效过滤面积为0.047 m2。系统的运行模式为连续进出料,产生的生物气通过水封瓶后用湿式气体流量计计量产气量。通过曝气泵将系统内顶空生物气泵入膜组件腔体底部,对膜组件进行气擦洗后回流至系统内;同时,通过反洗曝气泵将系统内顶空生物气定期泵入膜组件腔体外侧,对膜组件进行气反洗后回流至系统内。当膜组件和出料泵间跨膜压差增加到40 kPa时,开启反洗曝气泵进行气反洗,反洗强度为10 L·min−1,气反洗时间为10 min。当进行气反洗不能提高膜通量时,通过增大曝气泵流量、回流量或气反洗频率进行调控。
1.2 基质和接种污泥
本研究所采用的FW依据学生食堂餐厨剩余物的主要成分进行人工模拟配制[14],WAS取自西安市第五污水处理厂,2者混合后添加微量元素作为最终混合基质[8]。启动阶段FW和WAS的混合比例为4∶1(基于湿重),该最优混合基质比是启动前期批次实验优化的结果[15]。研究所用接种污泥为FW和WAS中温厌氧CSTR的排泥[15],接种体积为9.0 L。本研究中使用的FW、WAS、混合基质和接种污泥的理化特性如表1所示。
表 1 基质和接种污泥的理化特性Table 1. Physicochemical properties of substrate and seed sludge供试对象 TS/(g·L−1) VS/(g·L−1) TCOD/(g·L−1) SCOD/(g·L−1) pH 乙酸/(g·L−1) 蛋白质/(g·L−1) 多糖/(g·L−1) NH4+-N/(g·L−1) FW 140.0±15.3 134.0±13.2 220.0±18.5 104.0±8.3 4.4 1.730 2.74±0.03 85.30±4.10 0.31±0.01 WAS 56.0±8.3 30.4±4.2 52.2±7.3 — — — — — — 混合基质 124.0±0.6 115.0±0.5 181.0±2.3 74.5±1.4 3.9 0.001±0.000 8.20±0.12 2.71±0.03 0.10±0.01 接种污泥 39.1±0.6 19.7±1.5 27.2±0.3 3.1±0.0 7.9 0.003±0.000 0.81±0.03 0.27±0.02 2.62±0.17 注:“—”表示未测定。 1.3 实验设置
设置DMBR系统的初始OLR和HRT分别为(1.84±0.45) g·L−1·d−1和62.5 d,启动运行72 d,测定系统的运行性能参数和动态膜截留性能。启动阶段运行结束后,采用批次实验进行FW/WAS和F/M参数优化,实验设置见表2。FW/WAS批次实验在F/M为0.145 (基于VS)时共设置7组,其中2组为FW和WAS单发酵。F/M批次实验在FW/WAS为4.4∶1时共设置8组。所有批次实验均在120 mL血清瓶中分批进行,同时设置空白组。其中,空白组与实验组均设置2组平行。当混合基质和接种污泥加入血清瓶摇晃均匀后,用氮气吹脱约3 min,橡皮塞封瓶后置于39 ℃恒温摇床内,摇床转速为120 r·min−1,2 min后血清瓶顶空放气,定时测定气组和气量。
表 2 批次实验的运行设置Table 2. Operating characteristics of the batch experiments实验项目 FW/WAS F/M 接种物/mL FW/mL WAS/mL 混合基质/mL 蒸馏水/mL FW单发酵 1∶0 0.206 30 0.905 0 — 3.095 WAS单发酵 0∶1 0.206 30 0 4.000 0 FW/WAS混合发酵 3∶1 0.206 30 0.680 1.000 — 2.320 FW/WAS混合发酵 4∶1 0.206 30 0.725 0.800 2.475 FW/WAS混合发酵 4.4∶1 0.206 30 0.740 0.740 2.520 FW/WAS混合发酵 5∶1 0.206 30 0.755 0.670 2.575 FW/WAS混合发酵 6∶1 0.206 30 0.775 0.575 2.650 F/M混合发酵 4.4∶1 0.090 30 — 0.960 14.040 F/M混合发酵 4.4∶1 0.176 30 1.865 13.135 F/M混合发酵 4.4∶1 0.354 30 3.750 11.250 F/M混合发酵 4.4∶14.4∶1 0.4720.567 3030 5.0006.000 10.0009.000 F/M混合发酵 F/M混合发酵 4.4∶1 0.708 30 7.500 7.500 F/M混合发酵 4.4∶1 0.944 30 10.000 5.000 F/M混合发酵 4.4∶1 1.417 30 15.000 0 注:“—”表示不适用。 1.4 测定项目和方法
TS、VS、COD、碱度和NH4+-N的测定采用标准方法[16]。pH采用便携式pH计进行测定(pHS-25型,上海精密科学仪器有限公司)。蛋白质和多糖分别采用Folin-酚试剂法[17]和硫酸-蒽酮法[18]。CH4、CO2、N2、H2和VFA均采用气相色谱法进行测定[8]。浊度采用便携式浊度仪 (Turb®355 IR,德国赛莱默公司) 测定。采用修正的Gompertz方程 (公式1) 拟合批次实验数据,以确定产甲烷潜力、最大产甲烷速率和延滞期[19-20]。采用一级动力学模型 (公式2) 进行数据拟合可得水解常数[21]。
P=P0⋅exp{−exp[Rmax⋅e⋅(t0−t)/P0+1] (1) P=P0⋅[1−exp(−kt)] (2) 式中:P为生物气产量,mL;P0为生物气潜能,mL;Rmax为最大生物气产生速率,mL·d−1;t0为延滞期,d;k为产甲烷速率常数,d−1。
2. 结果与讨论
2.1 反应装置的启动及运行性能
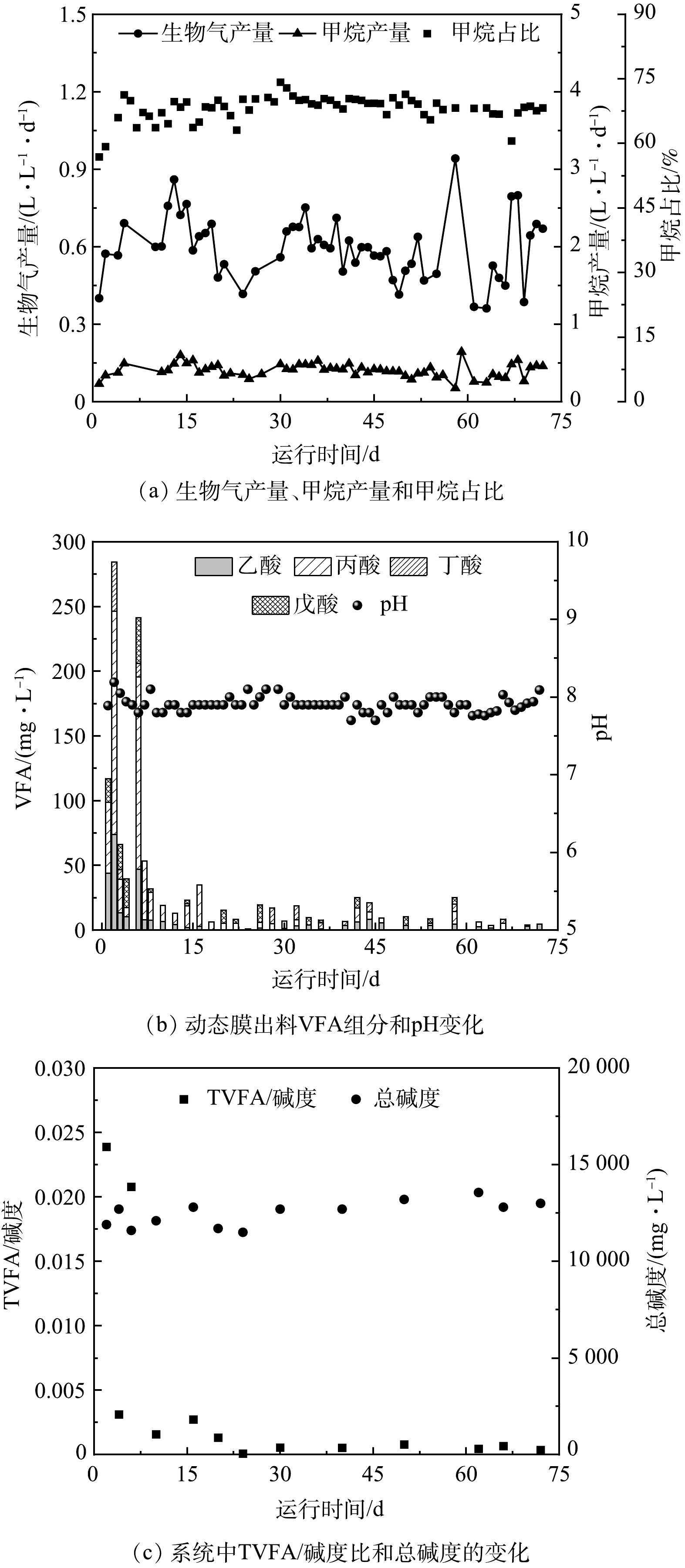
在HRT和OLR分别为62.5 d和(1.84±0.45) g·L−1·d−1的初始条件下,启动连续流FW和WAS厌氧混合发酵动态膜生物反应器。反应器启动运行过程中,系统的生物气产量、甲烷产量和甲烷占比如图2(a)所示。前5 d启动过程中,系统的生物气产量、甲烷产量和甲烷占比逐渐增加,然后趋于稳定。72 d的运行过程中,系统的平均生物气产量达到(0.60±0.11) L·L−1·d−1,平均甲烷产量达到(0.41±0.08) L·L−1·d−1,甲烷占比稳定在66%~71%,平均甲烷占比达到69.00%。pH和VFA的变化趋势能够直观的表明反应器的运行状况。如图2(b)所示,启动过程中,系统的pH始终稳定在7.6~8.0,在产甲烷菌最适pH(7.0~8.0)内[8]。本研究VFA最大质量浓度仅为284 mg·L−1,无VFA积累现象。这表明,连续流动态膜混合发酵系统启动成功[22]。如图2(c)所示,TVFA/碱度最大值仅为0.024,低于阈值0.4[23]。VFA和TVFA/碱度均未超过阈值,这表明厌氧发酵系统稳定性良好。厌氧发酵系统成功启动后,系统的平均TVFA质量浓度为(15.9±1.89) mg·L−1,低于产甲烷菌TVFA的抑制浓度5 000 mg·L−1,相应的总碱度为11 000~14 000 mg·L−1,也在稳定运行范围内[24]。上述结果表明,连续流FW和WAS厌氧混合发酵DMBR启动成功且能稳定运行。此外,对系统进行物料平衡分析可知,在该系统基质VSS的生物降解转化去除率为84%±3.8%,去除单位质量COD的基质甲烷产量为(294±13) mL。
2.2 动态膜的截留性能
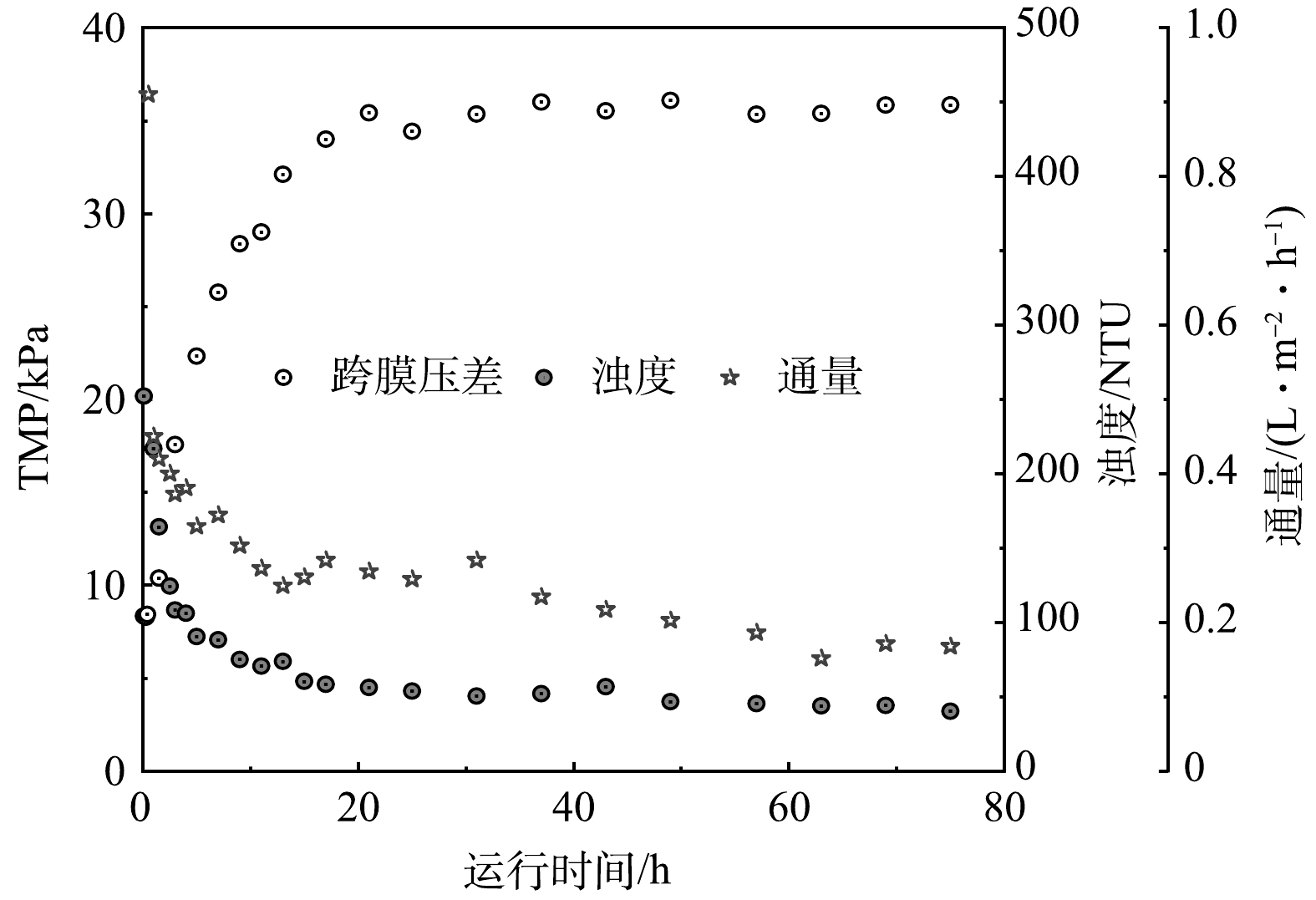
本实验的反应器装置为外置式的柱型动态膜组件,开启出料泵后,反应器内污泥先通过回流泵进入膜组件腔体内部,当回流污泥充满膜组件内部腔体后附着在动态膜基材上,逐渐形成过滤层。在第35 d膜组件清洗后,动态膜组件的跨膜压差、膜通量和浊度变化如图3所示。前4 h,动态膜组件的跨膜压差快速升高,由8.34 kPa增至22.3 kPa,相应的出料浊度由252 NTU降低至90.4 NTU,通量降低至0.42 L·m−2·h−1,2者均呈现快速下降的趋势。这是因为,动态膜组件腔体内充满了污泥,污泥开始附着在动态膜基材上,具有一定的截留效果。从4 h至21 h,通量降低了约40% (由0.42 L·m−2·h−1降至0.25 L·m−2·h−1) ,浊度也降至100 NTU以下,表明动态膜逐渐形成。随着过滤过程的进行,通量下降速度减缓,出料浊度趋于稳定。约40 h后,出料浊度稳定在50 NTU,通量在0.2 L·m−2·h−1左右。动态膜层逐渐增厚,进入稳定过滤阶段,具有稳定的截留效果。此外,当跨膜压差增至40 kPa时,进行动态膜气反洗后,能够快速形成动态膜,相应的压差逐渐增加 (如图3),长期运行过程中动态膜跨膜压差呈现周期性变化。袁宏林等[10]采用相同材质和孔径的动态膜基材,以玉米秸秆和FW为混合基质进行厌氧混合发酵,也获得了较优的固液分离效果,相应的有机物截留率达到95.9%,与本研究动态膜截留效果相当。通过借用在大孔径膜基材上形成的滤饼层作为过滤层,能够将传统膜生物反应器运行中存在的“膜污染”瓶颈问题转化为过滤层加以利用。本研究虽然对动态膜的过滤周期进行了表征,但仍需进一步解析动态膜滤饼层的过滤机理。此外,对接种物、运行末期动态膜滤饼层和系统排泥进行宏全基因组菌群分析可知:混合发酵系统以细菌为主,其中细菌主要包括Bacteroidetes (30.5%~44.6%) 、Chloroflexi (10.5%~24.5%) 和Firmicutes (23.1%~36.5%) ,古菌主要包括Methanosarcina (53.0%~97.9%) 和Methanobacterium (0.16%~18.7%) 。不同的微生物菌群结构组成及其变化,对于动态膜的形成和过滤效能均有一定程度的影响,但其作用机理仍需进一步研究。
为进一步揭示动态膜过滤截留效能的周期稳定性,在反应器运行的第7、15、21、28、41、53和60 d取样分析动态膜过滤液中TCOD、蛋白质及多糖质量浓度。如图4(a)所示,出料TCOD均低于3 g·L−1,且动态膜对TCOD的截留率可达到99.5%,最终可稳定在99%以上。这表明,该外置式动态膜组件可实现较好的出料质量,实现有机物和微生物的稳定截留。如图4(b)所示,经过动态膜出料的蛋白质和多糖质量浓度均低于300 mg·L−1,相应的蛋白质和多糖截留率均不低于95%。其中,出料蛋白质质量浓度始终高于多糖,主要由于混合基质中蛋白质质量浓度是多糖质量浓度的3倍以上 (表1) ;同时,出料蛋白质质量浓度逐渐下降,相应的去除率逐渐增加。分析其原因主要是,由于形成的动态膜对蛋白质的截留效果逐渐增强;相反,出料多糖质量浓度略有增加,相应的多糖截留率略有降低,但仍维持较高水平 (>95%) ,也与动态膜的过滤效能密切相关。动态膜滤饼层中蛋白质和多糖以及凝胶层对混合发酵系统中物质的截留作用是目前膜生物反应器探究的热点,相应的过滤截留机理有待进一步深入解析,以实现动态膜对蛋白质和多糖的截留调控。
2.3 运行参数的优化调控
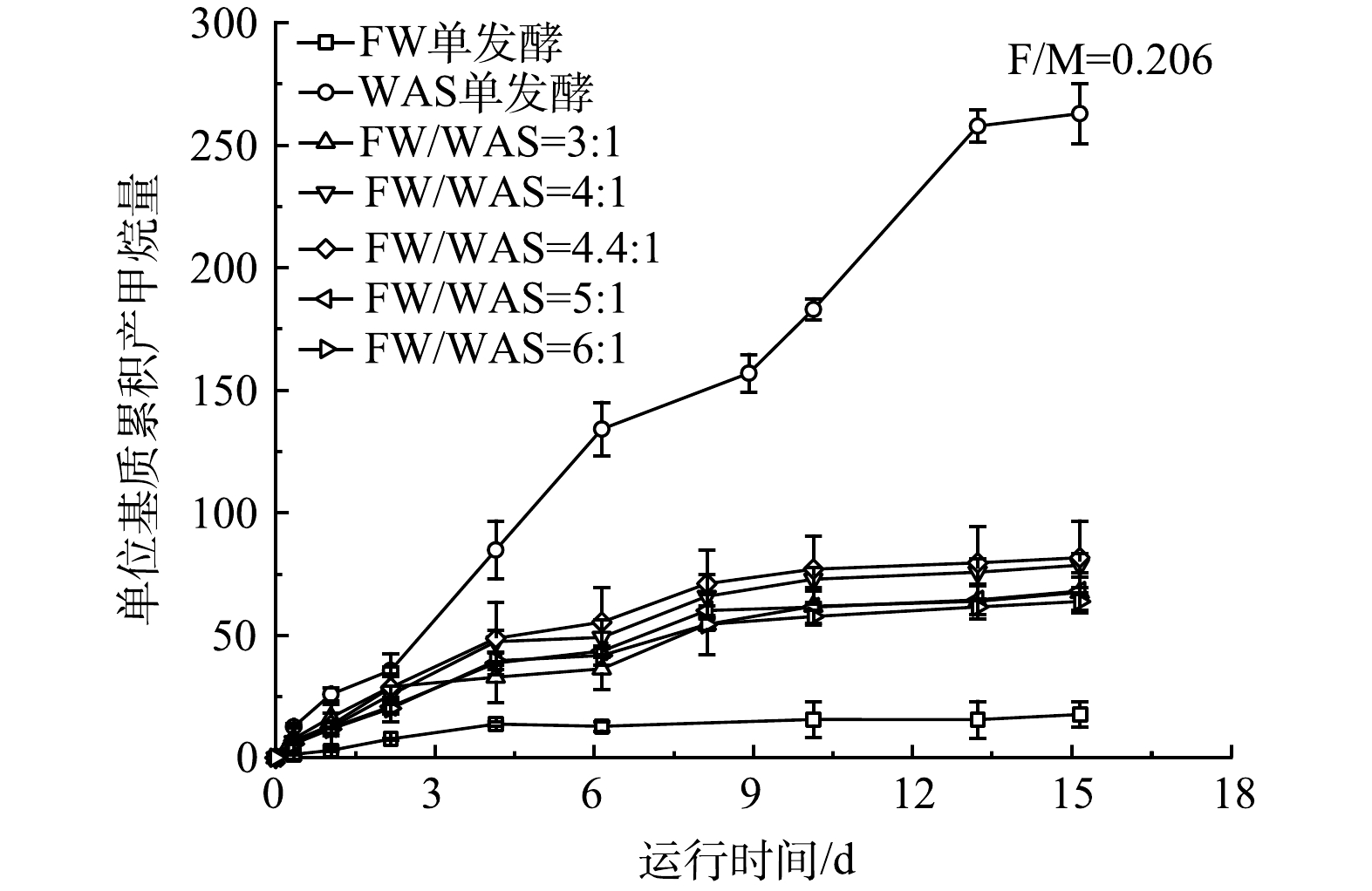
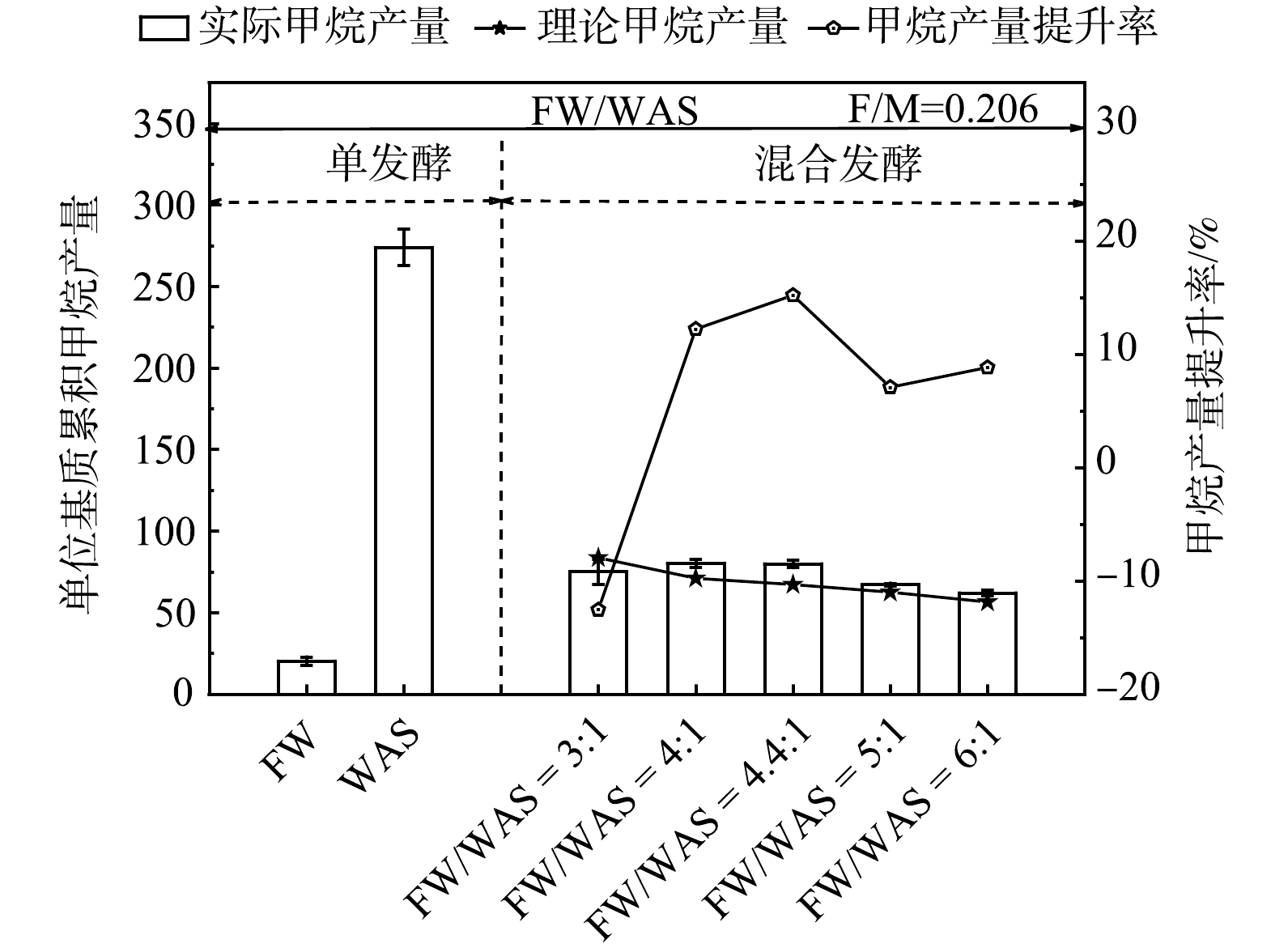
1) FW/WAS的优化。如表3所示,一级动力学模型和修正的Gompertz模型的拟合相关系数分别为0.971~0.991和0.975~0.987。这表明,2者均可较好地拟合FW和WAS厌氧发酵系统的累积产甲烷量。FW和WAS混合发酵的t0值趋近于0,表明FW和WAS混合发酵产甲烷基本无延滞期。在F/M为0.206条件下,不同FW/WAS的单位基质累积产甲烷量如图5所示。当厌氧发酵时间约为15 d时,FW/WAS等于4∶1和4.4∶1的单位基质累积产甲烷量明显高于3∶1、5∶1和6∶1时的单位基质累积产甲烷量。这表明,FW/WAS等于4∶1或4.4∶1时,FW和WAS混合发酵产甲烷的互促效果最佳。在FW/WAS为4∶1和4.4∶1时,运用Gompertz模型拟合分析可得P0和Rmax,如表3所示。可看出,在4.4∶1时,可获得更高的产甲烷潜能和最大生物气产率。如图6所示,当FW/WAS为4∶1和6∶1外,混合发酵的实际甲烷产率相对于单独发酵的加权平均值 (即理论甲烷产量) 均有不同程度的提升 (7.1%~15.2%)。其中,FW/WAS为4.4∶1时,相应的甲烷产量提升率最高。对比先前优化结果可发现[1],FW和WAS厌氧混合发酵系统经过长期驯化,最优基质混合比由初始最优值4∶1逐渐变为4.4∶1。因此,定期调整优化FW/WAS有利于厌氧混合发酵系统获得更高的产甲烷效能。
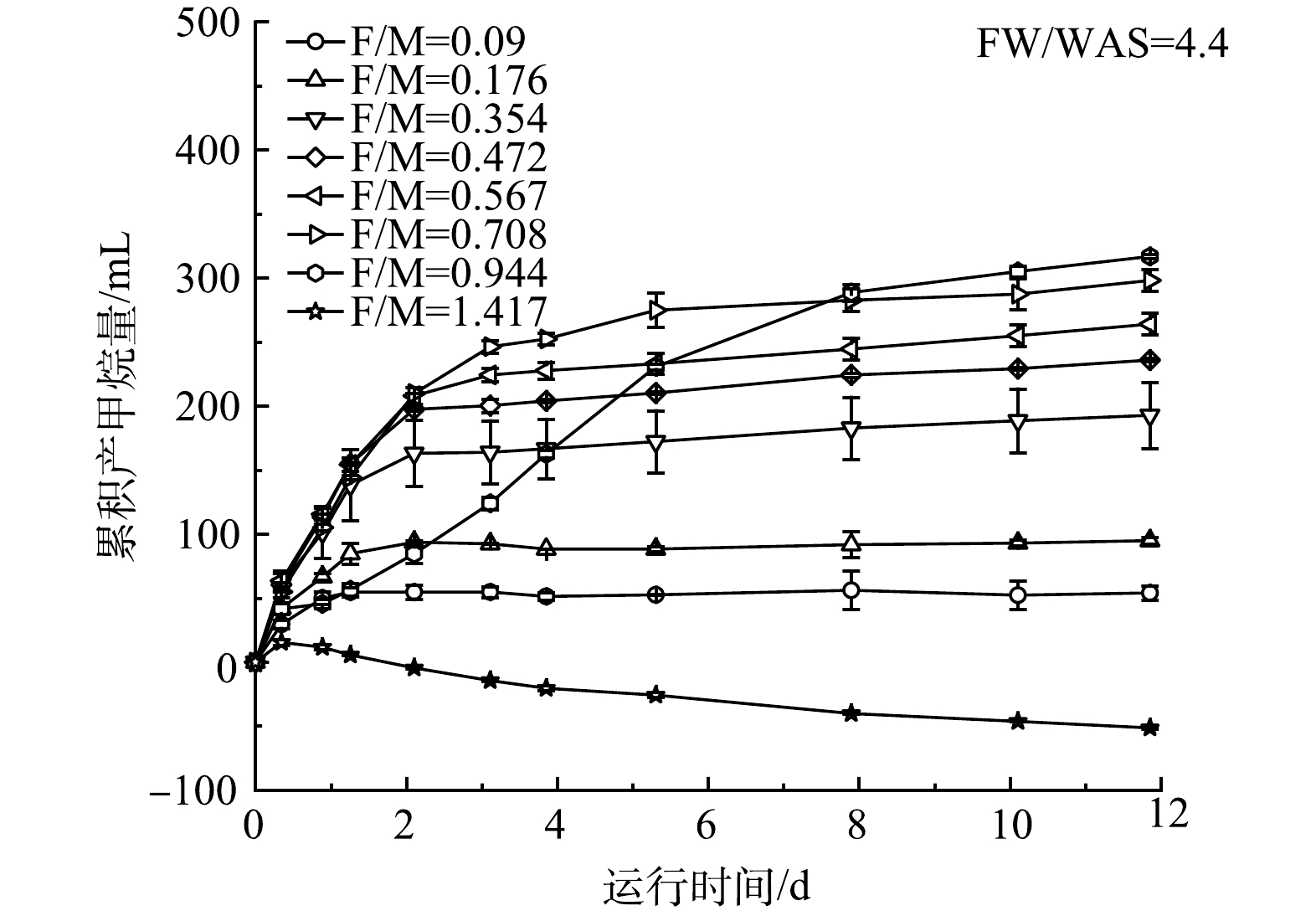
表 3 不同FW/WAS和F/M通过修正Gompertz模型和一级动力学模型拟合后产甲烷性能参数Table 3. Kinetic parameters of CH4 production with respect to different FW/WAS and F/M obtained from the modified Gompertz model and first-order model实验项目 FW/WAS F/M 修正的Gompertz模型 一级动力学模型 P0/mL Rmax/mL t0/d R2 P0/mL k/d-1 R2 FW单发酵 1∶0 0.206 16 4 0.2 0.975 17 0.287 0.971 WAS单发酵 0∶1 0.206 325 22 0.7 0.984 344 0.022 0.988 FW/WAS混合发酵 3∶1 0.206 70 6 0 0.984 74 0.160 0.993 FW/WAS混合发酵 4∶1 0.206 78 10 0 0.982 86 0.169 0.989 FW/WAS混合发酵 4.4∶1 0.206 82 11 0 0.985 88 0.172 0.994 FW/WAS混合发酵 5∶1 0.206 67 9 0 0.987 74 0.179 0.990 FW/WAS混合发酵 6∶1 0.206 63 8 0 0.985 68 0.181 0.991 F/M混合发酵 4.4∶1 0.090 51 105 0 0.985 51 2.610 0.977 F/M混合发酵 4.4∶1 0.176 91 85 0 0.979 91 1.610 0.989 F/M混合发酵 4.4∶1 0.354 166 99 0 0.969 169 0.968 0.981 F/M混合发酵 4.4∶1 0.472 219 126 0 0.980 223 0.874 0.987 F/M混合发酵 4.4∶1 0.567 240 118 0 0.982 246 0.751 0.990 F/M混合发酵 4.4∶1 0.708 277 106 0 0.989 286 0.575 0.996 F/M混合发酵 4.4∶1 0.944 325 43 0.02 0.994 402 0.135 0.984 F/M混合发酵 4.4∶1 1.417 0 0 2.0 0.902 0 0 0 2) F/M实验。将FW/WAS的最优值4.4∶1作为基质混合比,使用相同接种物评价F/M的影响。不同F/M下,FW和WAS厌氧发酵系统的累积产甲烷量如图7所示。当厌氧发酵时间约为12 d,F/M分别为0.09、0.176、0.354、0.472、0.567、0.708和0.944时,相应的甲烷产量对应为54.0、94.8、192、236、264、298和317 mL。如表3所示,运用Gompertz模型模拟分析可知相应的产甲烷潜能分别为51、91、166、219、240、277和325 mL,模型拟合相关系数为0.969~0.994,这表明拟合结果与实际吻合较好。此外,FW和WAS混合发酵的t0值也都趋于0,与前述结果一致。如图7和表3所示,当F/M为1.42时,累积产甲烷量和Rmax均为负值,这表明该结果无法用一级动力学模型和Gompertz模型拟合。其原因在于,在此负荷下,产甲烷菌的活性受到严重抑制。当F/M由0.090增至0.944时,累积产甲烷量和P0逐渐增加。当F/M为0.944时,与F/M为0.708相比,Rmax由106 mL降至43 mL,k由0.575 d−1降为0.135 d−1,分别降低了59.8%和76.5%。这表明,当F/M>0.708时,FW和WAS 混合发酵产甲烷的速率减缓。综上,FW和WAS厌氧混合发酵的最大耐受F/M为0.944,且当F/M>0.708时,相应的产甲烷速率减缓。
3. 结论
1) 在较低的有机负荷条件下能够实现连续流FW和WAS厌氧动态膜混合发酵系统的启动及其长期稳定运行,且系统碱度缓冲能力强、无酸累积,系统甲烷产量稳定。
2) 在连续流厌氧动态膜系统启动和长期运行过程中,能短时间形成动态膜,且对TCOD、蛋白质和多糖具有良好的截留率 (>95%) ,固液分离效果显著且能实现低浊度出料 (<50 NTU) 。
3) 厌氧动态膜混合发酵系统长期运行后,最优混合基质比为4.4∶1,同时,该系统的最大食微比为0.944,为该系统后续运行效能的优化提升提供了调控依据,以最大限度的快速实现连续流动态膜混合发酵系统的高效稳定运行。
-
表 1 远UV-C (222 nm) 和灭活UV-C (254 nm) 对致病微生物和受试微生物的剂量响应关系
Table 1. Dose-response data of pathogenic and challenge microorganisms radiated by far UV-C (222 nm) and UVGI (254 nm)
病毒种类 波长/nm 达到相应灭活率所需UV剂量/(mJ·cm−2) 灭活速率常数/ (cm2·mJ−1) 文献 1-lg 2-lg 3-lg 4-lg SARS-CoV-2 222a) (含滤光片) 1.6 3.1 4.7 6.3 0.64 [9] SARS-CoV-2 222 (含滤光片) 0.7 1.4 2.1 2.8 1.42 [8] SARS-CoV-2 222 0.7 1.3 2.0 2.6 1.52 [8] SARS-CoV-2 254b) 1.3 2.5 3.8 5.1 0.79 [8] SARS-CoV-2 254 1.7 4.2 5.1 6.8 0.59 [10] MHV 222 (含滤光片) 1.0 1.9 2.9 3.9 1.03 [11] MHV 222 0.8 1.6 2.5 3.3 1.22 [11] MHV 254 1.1 2.2 3.2 4.3 0.93 [11] HCoV 229E 222 (含滤光片) 1.2 2.4 3.6 4.8 0.84 [11] HCoV 229E 222 0.8 1.5 2.3 3.0 1.33 [11] HCoV 229E 254 1.7 3.4 5.1 6.8 0.59 [11] Phi 6 222 (含滤光片) 2.8 5.6 8.3 11.1 0.36 [11] Phi 6 222 3.7 7.4 11.1 14.8 0.27 [11] Phi 6 254 33.3 66.6 100.0 133.3 0.03 [11] T1UV 222c) 2.7 5.5 8.2 11.0 0.37 [12] T1UV 254c) 4.3 8.5 12.8 17.0 0.23 [12] MS2 222c) 8.9 17.7 26.6 35.5 0.11 [12] MS2 254c) 16.0 33.6 53.4 77.6 0.05 [12] 注:a) 222 nm如没有特殊标注均为KrCl准分子灯;b) 254 nm如没有特殊标注均为低压汞灯;c) NT242系列可调谐激光器 (NIST)。 -
[1] SOSNIN E A, OPPENLÄNDE R T, TARASENKO V F. Applications of capacitive and barrier discharge excilamps in photoscience[J]. Journal of Photochemistry and Photobiology C:Photochemistry Reviews, 2006, 7(4): 145-163. doi: 10.1016/j.jphotochemrev.2006.12.002 [2] KNEISSL M, RASS J. III-Nitride ultraviolet emitters [M]. Springer, 2016. [3] United States Environmental Protection Agency. Ultraviolet disinfection guidance manual for the final long term 2 enhanced surface water treatment rule [S]. Washington, DC, 2006. [4] BOLTON J R, COTTON C A. The ultraviolet disinfection handbook [M]. American Water Works Association, 2011. [5] BECK S E, HULL N M, POEPPING C, et al. Wavelength-dependent damage to adenoviral proteins across the germicidal UV spectrum[J]. Environmental Science & Technology, 2018, 52(1): 223-229. [6] BECK S E, RODRIGUEZ R A, LINDEN K G, et al. Wavelength dependent UV inactivation and DNA damage of adenovirus as measured by cell culture infectivity and long range quantitative PCR[J]. Environmental Science & Technology, 2014, 48(1): 591-598. [7] LINDEN K G, THURSTON J, SCHAEFER R, et al. Enhanced UV inactivation of adenoviruses under polychromatic UV lamps[J]. Applied and Environmental Microbiology, 2007, 73(23): 7571-7574. doi: 10.1128/AEM.01587-07 [8] MA B, GUNDY P M, GERBA C P, et al. UV inactivation of SARS-CoV-2 across the UVC spectrum: KrCl* excimer, mercury-vapor, and light-emitting-diode (LED) sources[J]. Applied and Environmental Microbiology, 2021, 87(22): e01532-21. [9] ROBINSON R T, MAHFOOZ N, ROSAS-MEJIA O, et al. SARS-CoV-2 disinfection in aqueous solution by UV222 from a krypton chlorine excilamp [J]. MedRxiv, 2021. [10] STORM N, MCKAY L G, DOWNS S N, et al. Rapid and complete inactivation of SARS-CoV-2 by ultraviolet-C irradiation[J]. Scientific Reports, 2020, 10(1): 1-5. doi: 10.1038/s41598-019-56847-4 [11] MA B, LINDEN Y S, GUNDY P M, et al. Inactivation of coronaviruses and phage Phi6 from irradiation across UVC wavelengths[J]. Environmental Science & Technology Letters, 2021, 8(5): 425-430. [12] BECK S E, WRIGHT H B, HARGY T M, et al. Action spectra for validation of pathogen disinfection in medium-pressure ultraviolet (UV) systems[J]. Water Research, 2015, 70: 27-37. doi: 10.1016/j.watres.2014.11.028 [13] TSENG C C, LI C S. Inactivation of viruses on surfaces by ultraviolet germicidal irradiation[J]. Journal of Occupational and Environmental Hygiene, 2007, 4(6): 400-405. doi: 10.1080/15459620701329012 [14] WALKER C M, KO G P. Effect of ultraviolet germicidal irradiation on viral aerosols[J]. Environmental Science & Technology, 2007, 41(15): 5460-5465. [15] KITAGAWA H, NOMURA T, NAZMUL T, et al. Effectiveness of 222-nm ultraviolet light on disinfecting SARS-CoV-2 surface contamination[J]. American Journal of Infection Control, 2021, 49(3): 299-301. doi: 10.1016/j.ajic.2020.08.022 [16] American Conference of Governmental Industrial Hygienists. 2021 threshold limit values (TLVs) and biological exposure indices (BEIs) [C]. Cincinnati, OH: American Conference of Governmental Industrial Hygienists, 2020. [17] International Commission on Non-Ionizing Radiation Protection. Guidelines on limits of exposure to ultraviolet radiation of wavelengths between 180 nm and 400 nm (incoherent optical radiation)[J]. Health Physics, 2004, 87(2): 171-186. doi: 10.1097/00004032-200408000-00006 [18] SLINEY D. Balancing the risk of eye irritation from UV-C with infection from bioaerosols[J]. Photochemistry and Photobiology, 2013, 89(4): 770-776. doi: 10.1111/php.12093 [19] CESARINI J P, COLE C A, GRUIJL F D. UV-C photocarcinogenesis risks from germicidal lamps[J]. Int Commission Illumination, 2010, 187: 1-14. [20] FORBES P D, COLE C A, DEGRUIJL F. Origins and evolution of photocarcinogenesis action spectra, including germicidal UVC[J]. Photochemistry and Photobiology, 2021, 97(3): 477-484. doi: 10.1111/php.13371 [21] MOAN J, GRIGALAVICIUS M, BATURAITE Z, et al. The relationship between UV exposure and incidence of skin cancer[J]. Photodermatology, Photoimmunology & Photomedicine, 2015, 31(1): 26-35. [22] WOODS J A, EVANS A, FORBES P D, et al. The effect of 222‐nm UVC phototesting on healthy volunteer skin: a pilot study[J]. Photodermatology, Photoimmunology & Photomedicine, 2015, 31(3): 159-166. [23] FUKUI T, NIIKURA T, ODA T, et al. Exploratory clinical trial on the safety and bactericidal effect of 222-nm ultraviolet C irradiation in healthy humans[J]. Plos One, 2020, 15(8): e0235948. doi: 10.1371/journal.pone.0235948 [24] PONNAIYA B, BUONANNO M, WELCH D, et al. Far-UVC light prevents MRSA infection of superficial wounds in vivo[J]. Plos One, 2018, 13(2): e0192053. doi: 10.1371/journal.pone.0192053 [25] GOH J C, FISHER D, HING E C H, et al. Disinfection capabilities of a 222 nm wavelength ultraviolet lighting device: a pilot study[J]. Journal of Wound Care, 2021, 30(2): 96-104. doi: 10.12968/jowc.2021.30.2.96 [26] BUONANNO M, PONNAIYA B, WELCH D, et al. Germicidal efficacy and mammalian skin safety of 222-nm UV light[J]. Radiation Research, 2017, 187(4): 493-501. doi: 10.1667/RR0010CC.1 [27] BUONANNO M, STANISLAUSKAS M, PONNAIYA B, et al. 207-nm UV light-A promising tool for safe low-cost reduction of surgical site infections. II: In-vivo safety studies[J]. Plos One, 2016, 11(6): e0138418. doi: 10.1371/journal.pone.0138418 [28] CADET J. Harmless effects of sterilizing 222‐nm far‐UV radiation on mouse skin and eye tissues[J]. Photochemistry and Photobiology, 2020, 96(4): 949-950. doi: 10.1111/php.13294 [29] BARNARD I R M, EADIE E, WOOD K. Further evidence that far-UVC for disinfection is unlikely to cause erythema or pre-mutagenic DNA lesions in skin[J]. Photodermatology, Photoimmunology & Photomedicine, 2020, 36(6): 476-477. [30] HANAMURA N, OHASHI H, MORIMOTO Y, et al. Viability evaluation of layered cell sheets after ultraviolet light irradiation of 222 nm[J]. Regenerative Therapy, 2020, 14: 344-351. doi: 10.1016/j.reth.2020.04.002 [31] YAMANO N, KUNISADA M, KAIDZU S, et al. Long‐term effects of 222‐nm ultraviolet radiation C sterilizing lamps on mice susceptible to ultraviolet radiation[J]. Photochemistry and Photobiology, 2020, 96(4): 853-862. doi: 10.1111/php.13269 [32] HICKERSON R P, CONNEELY M P, TSUTSUMI S K H, et al. Minimal, superficial DNA damage in human skin from filtered far-ultraviolet C[J]. British Journal of Dermatology, 2021, 184(6): 1197-1199. doi: 10.1111/bjd.19816 [33] BUONANNO M, WELCH D, BRENNER D J. Exposure of human skin models to KrCl excimer lamps: The impact of optical filtering[J]. Photochemistry and Photobiology, 2021, 97(3): 517-523. doi: 10.1111/php.13383 [34] YOUNG A R, HARRISON G I, CHADWICK C A, et al. The similarity of action spectra for thymine dimers in human epidermis and erythema suggests that DNA is the chromophore for erythema[J]. Journal of Investigative Dermatology, 1998, 111(6): 982-988. doi: 10.1046/j.1523-1747.1998.00436.x [35] DELIC N C, LYONS J G, GIROLAMO N D, et al. Damaging effects of ultraviolet radiation on the cornea[J]. Photochemistry and Photobiology, 2017, 93(4): 920-929. doi: 10.1111/php.12686 [36] KAIDZU S, SUGIHARA K, SASAKI M, et al. Evaluation of acute corneal damage induced by 222-nm and 254-nm ultraviolet light in Sprague–Dawley rats[J]. Free Radical Research, 2019, 53(6): 611-617. doi: 10.1080/10715762.2019.1603378 [37] KAIDZU S, SUGIHARA K, SASAKI M, et al. Re‐evaluation of rat corneal damage by short‐wavelength UV revealed extremely less hazardous property of Far‐UV‐C[J]. Photochemistry and Photobiology, 2021, 97(3): 505. doi: 10.1111/php.13419 [38] BLATCHLEY E R, BRENNER D, CLAUS H, et al. Far UV-C radiation: current state-of knowledge. IUVA White Paper. (2021-5-11). [39] SLINEY D H, STUCK B E. A need to revise human exposure limits for ultraviolet UV-C radiation[J]. Photochemistry and Photobiology, 2021, 97(3): 485-492. doi: 10.1111/php.13402 [40] World Health Organization. Ambient air pollution: A global assessment of exposure and burden of disease [R]. 2016. -




 下载:
下载: