-
进入二十一世纪以来全球疫情不断暴发,如2002年的重症急性呼吸综合征 (SARS) 、2009年的甲型H1N1流感、2012年的中东呼吸综合征 (MERS) 以及2019年暴发后蔓延全球的新冠 (COVID-19) 疫情,严重威胁着人类健康和社会发展。抗疫过程中传统化学消毒剂 (如氯) 的大量使用,导致了残余消毒剂及消毒副产物引发的次生风险。紫外线 (UV) 作为一种气、水和物体表面的高效、绿色消毒技术,受到广泛关注。国际照明委员会 (Commission Internationale de l’Eclairage,CIE) 按波长将UV分为UV-A (波长315~400 nm) 、UV-B (波长280~315 nm) 和UV-C (波长100~280 nm) ,其中UV-C中又包含真空UV (波长100~200 nm) 、远UV-C (波长200~230 nm) 和灭活UV-C (波长250~280 nm) 。
灭活UV-C (如波长254 nm) 可破坏绝大多数病原微生物的复制过程,使其失去感染性,从而达到高效、低耗的消毒效果,是目前UV消毒领域应用最为广泛的波段。远UV-C可有效杀灭各类病原微生物,但却被长期忽视,尚未广泛应用于消毒领域。主要原因在于其较高的光子能量,较其它波段UV-C更易被介质吸收,从而影响消毒效果。其次,远UV-C光源的电光转化效率 (低于5%) 远低于传统低压汞灯 (约36%) ,故在应用中能耗较高,亦会限制其应用。然而,远UV-C对眼睛和皮肤的伤害较传统灭活UV-C更低,且未发现有效消毒剂量下的远UV-C辐照会对人体造成伤害。因此,基于远UV-C的特性,可开发人机共存条件下的原位UV消毒,以阻断病毒传播,保护人类健康。本文通过对比远UV-C的辐射光源的特点,分析典型病原微生物的灭活机理与效果,以及人体的远UV-C暴露风险,分析其在消毒应用中应解决的关键问题,以期为其应用研究提供参考。
-
1) 准分子灯。准分子灯是常用的远UV-C光源,其通过填充稀有气体和卤素的混合物,经电激发后可发射准单色光。通过填充物改变可调节准分子灯的输出波长,并通过灯设计 (气体压力或成分) 的优化在一定程度上调控激发态分子的电子跃迁,从而提高电光转化效率。辐射远UV-C的光源填充物为KrCl,其主峰位和半峰宽通常为222 nm和4 nm (图1) 。需要指出的是,由于设计、质量的差异,不同生产商的产品辐射出的远UV-C主峰位和半峰宽会有所差异。目前,对于空气和物体表面消毒,准分子灯是最为适合且技术成熟的远UV-C光源。准分子灯的主要优点在于其可在有效消毒的同时,保持较低的人体暴露风险。然而,KrCl准分子灯还存在少量其它发射波长[1],需安装光学滤光片对其进行滤除 (特别是灭活UV-C 250~280 nm) ,使UV输出集中于远UV-C。此外,KrCl准分子灯UV-C输出的电光转化效率远低于传统低压汞灯 (主要输出波长254 nm) ,导致其消毒能耗较高,需在应用中予以考虑。
2) 中压汞灯。中压汞灯可发射连续波段200~400 nm的UV,包含远UV-C。由于H2O2在远UV-C波段的吸光度远高于230~280 nm UV-C波段,因此中压汞灯常与H2O2结合,产生羟基自由基 (·OH) 高效去除水中难降解有机污染物,其工艺效能高于传统低压汞灯。然而,中压汞灯其余波段的UV输出量过大,很难采用滤光片技术将其滤除,即无法输出单一的远UV-C,造成眼睛和皮肤较大的暴露风险,不适宜作为远UV-C消毒的光源。
3) 固态UV光源。固态UV光源 (如UV发光二极管,UV-LED) 是光源领域的重要发展方向。目前可见光固态光源已被广泛应用,波长在265~285 nm的传统UV-LED发展迅猛,其功率、寿命和成本等指标快速突破,已被初步应用于空气、小规模供水、物体表面等的消毒。基于AlGaN薄层结构的远UV-C UV-LED已被研发[2],但其输出功率、寿命和成本等指标尚未达到实际应用级别。基于对可见光LED和传统UV-LED的研发积累,UV-LED将在未来成为重要的远UV-C消毒光源。
-
不同波长UV辐照下,病原微生物的吸光度不同,故相应的灭活原理亦不同,同时其消毒效果也有差异。病原微生物的核酸可吸收UV-C,吸收峰值在260 nm附近 (图1) 。被吸收的UV-C光子会干扰核酸复制,从而导致病原微生物丧失传染性,以达到消毒效果[3]。基于此原理,传统低压汞灯已被广泛应用于空气、水和物体表面的消毒。
蛋白质在远UV-C波段的吸光度很高 (图1) ,吸收光子后导致变性失活,达到病原微生物的灭活。然而,由于细胞内光程较短 (< 1 μm) ,病原微生物对远UV-C的吸光度低于0.02 cm−1 [4],使得病原微生物的外层蛋白质 (如细菌细胞膜上的蛋白质、病毒的外层蛋白) 无法大比例阻隔远UV-C辐照到内部核酸。因此,远UV-C消毒同时存在干扰核酸复制和蛋白质失活2种灭活机制[5-7]。目前,对远UV-C的研究主要集中于光源、消毒效果及安全性,其灭活的影响因素 (介质吸收和颗粒的影响) 、多波长协同灭活机制等尚需进一步研究。
-
远UV-C (222 nm) 和灭活UV-C (254 nm) 对不同病原微生物的灭活效果对比见表1。2种UV-C对SARS-CoV-2病毒的灭活都非常有效。其中MA等[8]采用无滤光片和含滤光片下KrCl准分子灯,测定SARS-CoV-2病毒灭活速率常数分别是1.52和1.42 cm2·mJ−1,高于ROBINSON等[9]的KrCl准分子灯 (含滤光片) 的实验结果 (0.64 cm2·mJ−1) ,其原因可能是ROBINSON等实验中测试溶液吸光度 (> 30 cm−1) 高于MA等的研究 (0.05 cm−1) 。MA等和STORM等测定出低压汞灯 (254 nm) 对SARS-CoV-2病毒的灭活速率常数分别为0.79[8]和0.59[10] cm2·mJ−1,低于远UV-C灭活速率常数。远UV-C能够高效灭活病原微生物的原因是蛋白质对于222 nm附近的UV波长有更高的吸收率,且蛋白质失活机制的消毒效能更高,同时也说明远UV-C较灭活UV-C拥有相似甚至更强的灭活能力。因此,在远UV-C消毒数据相对缺乏的情况下,可借助低压汞灯 (254 nm) 的数据保守预测远UV-C的灭活效果。
表1结果表明,相对于低压汞灯 (254 nm) ,远UV-C对包膜病毒 (HCoV 229E和MHV) 、包膜噬菌体 (Phi6) 、无包膜噬菌体 (MS2和T1UV) 具有更好的灭活效果,说明远UV-C消毒的高效性在不同类型病毒中普遍存在。包膜RNA病毒HCoV 229E和MHV,无包膜双链DNA病毒T1UV噬菌体,都具有较低的生物安全性要求,且与SARS-CoV-2病毒灭活速率常数相似,因此可被选为SARS-CoV-2病毒的替代受试微生物。而HCoV 229E和MHV病毒与SARS-CoV-2同为包膜RNA病毒,其结构相似性更有利于SARS-CoV-2病毒灭活机理的研究。Phi6噬菌体与SARS-CoV-2病毒相比更难灭活,可作为保守的替代受试微生物。此外,MS2噬菌体较SARS-CoV-2病毒对UV辐照敏感性差异较大。
-
传统灭活UV-C对不同介质 (如空气、水和物理表面) 的病原微生物均有较强的消毒能力,特别是多项研究已证明UV-C对空气及飘落物体表面的气溶胶飞沫 (高传染性病毒的重要传播途径) 具有明显的消毒效果[13-14]。远UV-C较灭活UV-C具有更短的波长和更高的光子能量,而空气中气溶胶飞沫本身通常含有较高浓度的蛋白质,会吸收远UV-C并减低其在气溶胶内的穿透。由于气溶胶的直径和组成差异会对消毒产生不同程度影响,因此,远UV-C对气溶胶飞沫病原微生物的灭活是一个复杂的过程。现有各介质灭活结果初步表明,介质对远UV-C灭活SARS-CoV-2病毒的影响并不显著[8,10-12,15]。目前,通过病原微生物悬浮液测定UV灭活曲线的方法已较为成熟,该方法测得的数据可用来代表不同介质中远UV-C的灭活效果。美国政府工业卫生师协会 (ACGIH) 和国际非电离辐射防护委员会 (ICNIRP) 规定远UV-C暴露安全阈值分别为23 mJ·cm−2[16] 与25 mJ·cm−2[17],远UV-C阈值剂量足以灭活大部分空气、水、物体表面的病原微生物 (包括SARS-CoV-2[8-10]) ,阻断高传染性疾病的传播途径。
-
UV-C辐照皮肤会诱导皮肤癌的发生[18-19]。目前针对UV辐照致癌的机理研究多集中于254 nm及UV-B和UV-A波段上[20]。此外,多数流行病学研究结果证明了环境太阳辐射中皮肤癌的主要诱因为UV-B[21]。而远UV-C机理研究和暴露案例较少,尚没有远UV-C致癌的研究结论。
当UV穿透皮肤表层 (角质层、颗粒层和棘层) 辐射到基底层时,可能会损伤DNA并引发皮肤癌。皮肤表层的角质层能够吸收UV辐射,在一定程度上保护皮肤。远UV-C光子能量更高,会被有机质分子 (如蛋白质) 强烈吸收。然而,其穿透能力远低于灭活UV-C,则意味着可被UV-B或灭活UV-C穿透的角质层,会强烈吸收远UV-C,再结合颗粒层和棘层的吸收,可基本阻隔远UV-C到达基底层。
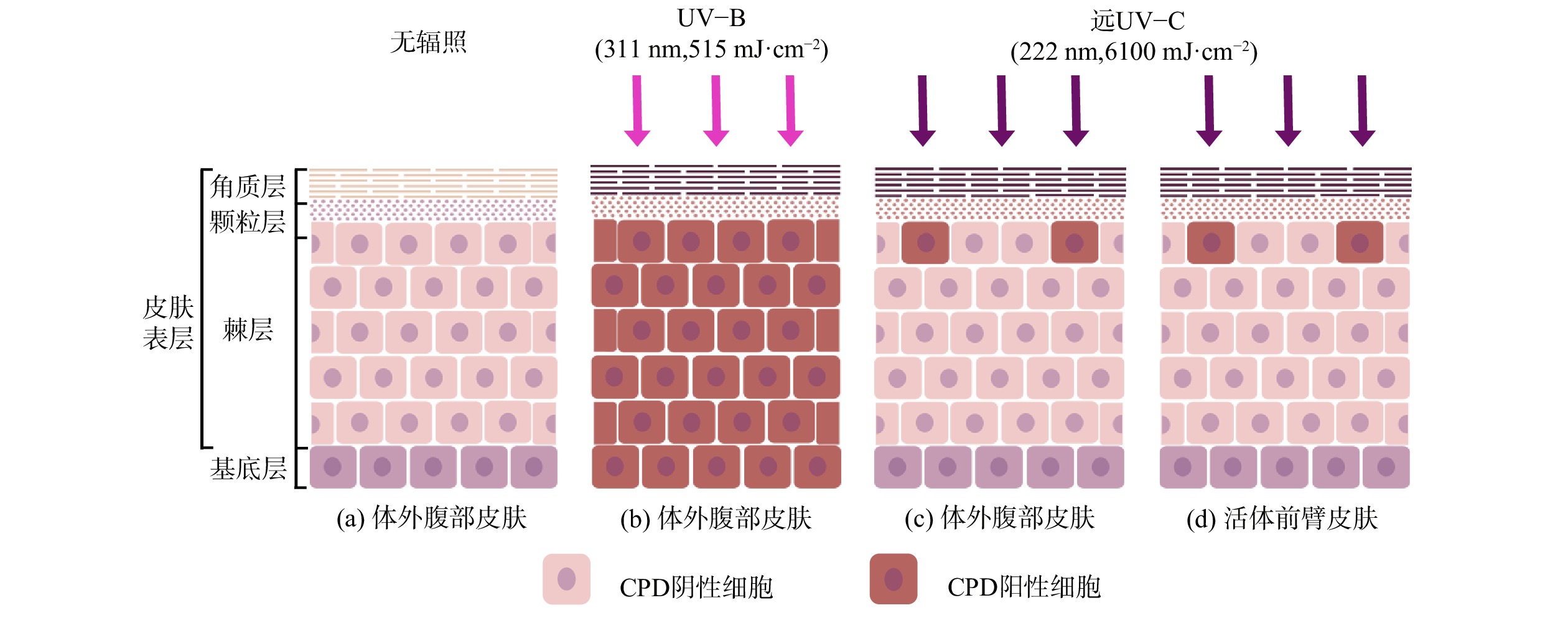
远UV-C辐射人体和无毛小鼠皮肤的研究结果表明[22-33],即使使用远超现有安全阈值的剂量辐照[16],也尚未观察到其对皮肤可量化的辐照损伤。WOODS等[22]使用远UV-C辐照人体背部,发现40 mJ·cm−2的辐照就会使皮肤出现红斑。这可能是由于实验使用未经过滤的KrCl准分子灯,同时产生了波长大于230 nm的UV-C。FUKUI等[23]在2020年重复此实验,改用滤光片过滤掉大于230 nm UV的KrCl准分子灯,在剂量相近甚至更高的情况下 (50~500 mJ·cm−2) ,也未观察到皮肤出现红斑或其他安全风险。研究人员在检测了远UV-C辐照的动物皮肤中DNA主要光照产物环丁烷嘧啶二聚体 (CPDs) 的分布,发现CPDs数量有限且仅出现于皮肤表层[26,29,31-33]。HICKERSON等[32]使用人类体外腹部皮肤 (图2 (a) ) 进行了相似实验,使用远UV-C (6 100 mJ·cm−2) 辐照后仅在表皮最上部出现了较少的CPDs (图2 (c) ) ,而使用UV-B (515 mJ·cm−2) 辐照后在表层和基底层均检测到CPDs (图2 (b) ) 。
2名研究人员自愿使用前臂皮肤进行了条件相同的远UV-C辐照 (图2 (d) ) ,实验结果与体外腹部皮肤相同。由于高剂量的UV-B对人体伤害较大,并未进行基于UV-B的对照实验[32]。可以看出远UV-C辐照皮肤后CPDs只出现在无增殖能力的表层细胞上,没有到达拥有增殖能力的基底层,因此研究人员认为其没有致癌风险[32,34]。远UV-C辐照安全性实验中,辐照剂量远高于远UV-C的安全阈值 (23 mJ·cm−2,ACGIH[16]) ,而安全阈值又高于消毒所需剂量,间接证明合理使用远UV-C消毒不会导致皮肤损伤。
-
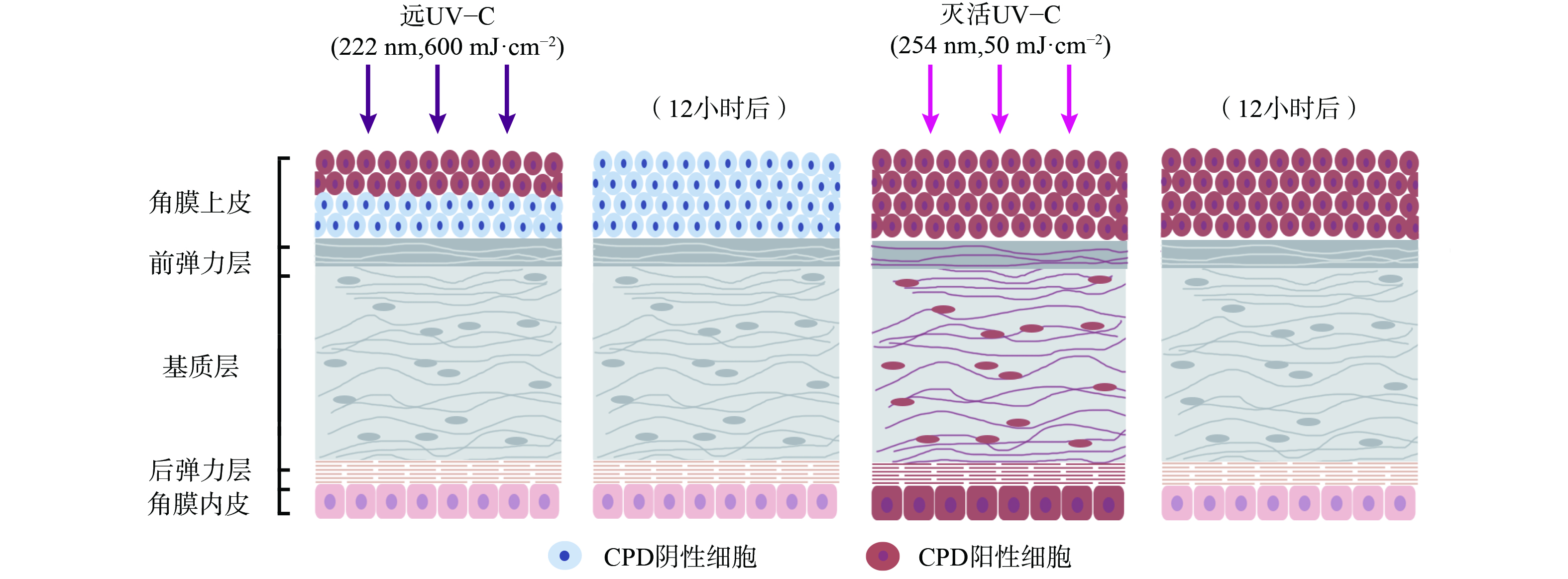
UV辐射会诱发光性角膜炎、翼状胬肉等眼部疾病[35],但目前实验表明远UV-C对眼睛的影响有限。其原理在于远UV-C会被角膜上皮强烈吸收,而角膜上皮细胞会不断地自我脱落,由底层细胞分化补充。KAIDZU等[36-37]通过动物实验评估,发现远UV-C在207 nm和222 nm引发角膜炎的安全阈值分别超过10 000 mJ·cm−2和3 500 mJ·cm−2,远高于目前ACGIH的远UV-C安全阈值。KAIDZU等[36-37]还进行了角膜组织学染色评估 (图3) ,使用CPDs作为DNA损伤的标记,在222 nm远UV-C辐照下,仅在大鼠角膜上皮最外层细胞中观察到CPDs。而这些细胞在几天内就会正常脱落,数据也表明12小时后角膜上皮最外层细胞检测不到CPDs。作为对照,在254 nm UV辐照下,CPDs在角膜各层 (包括角膜内皮) 均被发现,且12小时后角膜上皮中仍检测到CPDs。这表明222 nm波长的UV-C几乎不能穿透角膜上皮,而254 nm则能够穿透上皮细胞和基质层。此外,实验中同样使用222 nm远UV-C辐照小鼠、猪和兔子眼部,同样只有在角膜上皮最外层检测到CPDs,且角膜上皮会正常脱落[37]。与皮肤辐照实验类似,眼部辐照实验中远UV-C剂量远高于安全阈值,间接证明了远UV-C安全消毒剂量下不会对角膜产生危害。
-
1) 远UV-C的辐照安全性。尽管近年来已有很多研究表明远高于消毒所需剂量的远UV-C辐照对皮肤和眼睛不会造成伤害[23-33,36-37],满足人机共存原位消毒的安全性要求。但目前结论均源自各国科研人员分散的研究成果,而并非相关部门/组织给出的结论。国际紫外线协会 (IUVA) 发布远UV-C消毒的白皮书,其中提出远UV-C辐照安全性的结论仅为作者观点,并非IUVA的观点[38]。
辐照安全性关乎人类健康,需要在大量、长期的研究数据基础上,谨慎做出结论。因此,目前远UV-C消毒的应用 (特别是直接长期皮肤和眼睛暴露) 仍需谨慎,不应直接宣传其对人体辐照没有伤害,以防误导使用者。可在现有的实验证据基础上,逐步提高远UV-C安全使用的剂量阈值。目前已有最新研究呼吁将远UV-C (222 nm) 暴露安全阈值从23 mJ·cm−2提升至161 mJ·cm−2 (眼部) 和479 mJ·cm−2 (皮肤) [16,39],ACGIH也已多次讨论了远UV-C安全剂量阈值的提高。在实际消毒时,应基于安全剂量阈值,以及该阈值已远高于消毒所需剂量的研究结果,优化设计消毒装置,实现病原微生物原位有效灭活,同时避免皮肤和眼睛的高剂量辐照。
2) 应用过程中会生成少量臭氧及其控制。伴生臭氧导致的二次污染关系到远UV-C应用的安全性。臭氧会影响呼吸、心血管和中枢神经系统,很多负责公众健康的政府部门和非政府组织规定了气相臭氧的暴露限值,如世界卫生组织 (WHO) 规定8小时平均暴露臭氧浓度为0.1 mg·L−1[40],国标《室内空气中臭氧卫生标准》 (GB/T 18202-2000) 规定1h平均最高容许臭氧浓度为0.05 mg·L−1。与常见的真空UV低压汞灯 (即产臭氧低压汞灯) 类似,远UV-C光源辐照氧分子会生成臭氧,臭氧生成速率大于臭氧被UV分解的速率,使空气中臭氧浓度逐渐上升。但氧分子对远UV-C的吸收远低于真空UV (如氙气准分子灯和产臭氧低压汞灯) ,其臭氧生成量也较低;此外部分远UV-C光源会电晕放电产生臭氧,但只有远UV-装置功率较高 (2-10 kV) 时臭氧产生才会较为明显。因此,远UV-C在较小的封闭空间使用时,应注意与通风系统或臭氧淬灭系统 (如还原性物质及活性炭) 联合,将臭氧浓度维持在安全标准以下。此外,部分远UV-C光源采用滤光片,尽量滤除短波段 (低于222 nm) UV,降低臭氧生成。
目前市场上生产的远UV-C光源几何结构、输出功率不同,光源也存在使用时长和应用空间的差异,远UV-C光源的臭氧风险难以准确评估。因此,在设计合适的臭氧控制措施的同时,还需考虑远UV-C光源臭氧风险的监测与评估方法,为标准化应用提供依据。
3) 应用场景问题。远UV-C可在对人体皮肤和眼睛暴露相对安全的情况下,灭活空气中和物体表面的病原微生物,在不同介质 (特别是空气) 消毒中均具有宽广的应用领域和巨大的发展潜力。目前,国内外多个公司开发了可应用于不同领域的远UV-C消毒设施,如高风险人员密集空间和封闭空间内空气消毒的壁挂式和下射式灯具,物体表面、紧凑空间、贵重仪器等消毒的手持式灯具和消毒门等。此外,随着未来更多类型的远UV-C光源出现,其将对阻断高传染性疾病的传播起到重要作用。
远C波段紫外线消毒的原理及应用前景
Principles and application perspective of far UV-C disinfection
-
摘要: 紫外线 (UV) 是一种高效、绿色的消毒技术,广泛应用于气、水和物体表面的病原微生物灭活。远C波段UV (远UV-C,200~230 nm) 消毒所需剂量辐照对人体的伤害尚未被发现,表明远UV-C具备人机共存原位消毒的潜力,因此该技术近期受到关注。概述了远UV-C光源、灭活机制和辐照安全性方面的研究进展:输出主峰位和半峰宽分别为222 nm和4 nm的KrCl准分子灯是最为成熟的消毒用远UV-C光源;远UV-C通过蛋白质损伤和核酸干扰2种途径实现病原微生物灭活,灭活能力较传统UV-C (如254 nm) 更强;尚未发现消毒所需剂量的远UV-C辐照导致的健康危害,如红斑和角膜炎。而在实际应用中,应谨慎对待高剂量远UV-C辐照暴露,确保在现有实验证据基础上,逐步提高远UV-C安全使用的剂量阈值,并考虑与通风系统或臭氧淬灭系统协同使用以避免伴生臭氧造成的二次伤害。本文旨在为远UV-C在高效灭活病原微生物、阻断高传染性疾病传播领域的应用提供参考。Abstract: Ultraviolet (UV), as an efficient and green disinfection technology, has been widely applied to inactivate the pathogens in air, water, and surface. Recently, far UV-C radiation (200-230 nm) has drawn great attention, as it is harmless to human within the normal dose range for disinfection, which has great potential to conduct in situ disinfection with human presence.An overview on far UV-C light sources, inactivation mechanisms, and human health and safety to far UV-C exposure was provided in this article. It was found that krypton-chloride (KrCl) excimer lamps with a main peak at 222 nm and half-peak width at 4 nm were the most mature far UV-C light sources for disinfection, far UV-C inactivated pathogenic microorganisms through protein damage and nucleic acid interfere,and the inactivation ability of far UV-C was stronger than that of traditional UV-C (such as 254 nm). No adverse health effects such as erythema and photokeratitis had been reported for far UV-C irradiation within the dose range required by regular disinfection. However, high dose of far UV-C radiation should still be used with caution in practical applications, where the maximum safe dose should be determined based on experimental evidence and increased gradually. Meanwhile, the use of far-UV-C in collaboration with ventilation system or ozone quenching system should be considered to avoid secondary damage caused by associated ozone. Overall, this article will provide reference for efficient and secure application of far UV-C in disinfection and control of highly infectious epidemics.
-
Key words:
- far UV-C /
- krypton-chloride excimer lamps /
- disinfection /
- secutiry /
- human-machine coexistence
-
人类社会快速发展的同时也带来了严重的环境污染,特别是印染造成的水污染,如何消除这些污染物是行业可持续发展面临的一个关键问题[1]。光催化降解过程是非均相的高级氧化过程,它吸收自然光产生的光能发生催化作用,将周围的氧分子和水分子激发成具有强氧化性的游离阴离子,而不会产生有害的物质[2-3]。然而诸如二氧化钛( TiO2 )锐钛矿型的Eg>3.2eV,只能吸收紫外光,这严重限制了其在催化领域的应用。相对于 TiO2,硫化镉( CdS )则具有较窄的带隙( Eg=2.4 eV ),因此更容易被可见光所激发,常作为可见光催化剂应用于降解水和空气中的污染物[4-5]。然而,CdS 纳米粒子 (CdS-NPs) 相对不稳定,易发生团簇,这将导致其表面积减少,引起光致电子-空穴对复合率的增高,因此阻碍了其光催化的应用。
金属有机骨架(MOFs) 是一类由无机金属中心(金属离子或金属簇)和悬索连接的有机配体构成的多孔晶体材料,在吸附[6]、催化[7]、传感[8]、储气[9]等领域引起了广泛关注。作为 MOFs 的一种,ZIF-8 具有类沸石的高度多孔拓扑结构以及开放的大通道,这使得该材料容易产生较多的活性位点,并且作为传统催化剂的有效替代品也一直受到很大关注[10-11]。值得注意的是,MOFs 的金属中心和有机配体在光催化反应中起着至关重要的作用,在光的照射下,有机配体吸收光子,过量的电子被激发并通过有机配体运输到金属中心,这样金属中心作为电子受体,具有还原性,而有机配体作为电子给体具有氧化性,进而在表面发生氧化还原反应[12-14]。如今,许多半导体/MOF 复合材料已经开发并应用于增强半导体可见光催化[15-16]。目前常见的有半导体在 MOF 上的原位生长[17];MOFs 在半导体上的异质沉积[18];半导体@MOF核壳复合材料的合成等策略[19]。使用 MOFs 作为半导体载体的优越性体现在 MOFs 的高比表面积非常有利于半导体颗粒的分散防止其发生团聚;MOFs 的高比表面积可以产生更多的催化位点,这将大大增强光激发电子-空穴对的分离;MOFs 的多孔性质也可以为光激发电子的迁移提供额外的途径,从而促进电荷载流子的分离[20]。
本次研究通过在 CdS-NPs 上原位异质沉积 ZIF-8 以获得 ZIF-8 包裹的 ZIF-8/CdS 纳米复合材料用来除去亚甲基蓝( MB ),首先利用溶剂热法制备出分散性较好的 CdS-NPs,之后采用原位异质沉积法在 CdS-NPs 表面生成 ZIF-8,并探究 ZIF-8 的引入对 CdS 的光催化性能带来的影响。
1. 实验部分(Experimental section)
1.1 实验材料
在本次研究中,所有化学品和试剂均采购自国药集团化学试剂有限公司(中国上海),未经进一步处理。四水乙酸镉 Cd(CH3COO)2·4H2O、硫脲 (CH4N2S)、六水硝酸锌 (Zn(NO3)2·6H2O) 2-甲基咪唑 (HMeIM) 和聚乙烯吡咯烷酮 (PVP,K-30) (C6H9NO, K = 30) 从阿拉丁(中国上海)获得。 甲醇 (AR)、乙醇 (AR) 和丙酮 (AR) 购自 Macklin(中国上海)。
1.2 催化剂的制备
1.2.1 CdS-NPs 的合成
和现有报道的类似,在传统的溶剂热法中加入表面活性剂 PVP-K30 制备了相对分散的 CdS-NPs [21]。将 1.066 g (4 mmol) Cd(CH3COO)2·4H2O、0.3045 g (4 mmol) 硫脲、0.050 g (0.449 mmol) PVP-K30 和乙二醇 (60 mL) 混合并超声处理 40 min直至完全溶解,将溶液在 100 mL 衬有 PTFE 的不锈钢高压釜中加热至 140 ℃,并保持该温度 8 h。黄色产物用一定量的丙酮提纯并用甲醇和乙醇充分洗涤,最后在60 ℃的真空烘箱中干燥。
1.2.2 ZIF-8/CdS 光催化剂的合成
通过原位异质沉积在 CdS-NPs 表面合成 ZIF-8。0.2974 g (1 mmol) Zn(NO3)2·6H2O 和 0.3284 g (4 mmol) HMeIM 分别溶解在 25 mL 甲醇中并超声处理以获得均匀的溶液。将预先分散在 2 mL 甲醇中的 CdS-NPs 溶液缓慢加入到 HMeIM 溶液中,同时磁力搅拌 2 h 得到均匀的淡黄色溶液。之后将盛有 Zn(NO3)2 的甲醇溶液加入到该混合溶液中,磁力搅拌 1 h。将最终的溶液以 8000 r·min−1 离心收集,并用甲醇和去离子水各洗涤3次,再真空冷冻干燥 24 h获得最终产物记为ZC-X。通过改变 CdS-NPs 用量 40、80 mg 制得不同的 ZIF-8/CdS 复合材料记为 ZC-40、ZC-80,同时保持其他条件不变,制得纯的 ZIF-8。
1.3 实验的表征
采用日本理学 Rigaku Ultima IV X 射线粉末衍射仪对样品的晶体结构进行表征,工作电压和工作电流分别是 45kv,40mA,扫描范围是 5°—80°。采用 Zeiss Sigma 300 扫描电镜(SEM)和蔡司 libra 200透射电镜( TEM )观察样品的形貌与表面组成,采用Thermo Scientific X 射线光电子分析仪确定用于确定复合材料的结晶相,采用全自动比表面及孔隙度分析仪(BET,Quantachrome Autosorb iQ-MP)来确定样品的比表面积和孔隙度,CHI660E 电化学工作站进行电化学性能测试,光电流相应的测试时间为 390 s,每次光照 30 s,避光 30 s,使用配有 420 nm 截止滤光片的 300 W氙灯作为光源,电解质均为 0.5 mol·L−1 的 Na2SO4 溶液,电阻抗则全程在暗环境下进行。同时采用用日立 F-4700 荧光分光光度计和岛津 UV-3600荧光光谱仪测定样品的 UV-vis 漫反射光谱 (DRS)和荧光发射光谱(PL)。
1.4 光催化降解实验
选用 500W 的氙灯作为可见光源,将 50 mg 的 ZIF-8/CdS 复合材料加入 100 mL 初始浓度为 15 mg·L−1 的 MB 溶液中,在黑暗条件下匀速搅拌吸附 30 min 后,在打开光源下进行降解测试.并在同等条件下将所有的样品进行对照实验和空白对照,采用日本岛津UV-2600 紫外可见分光光度计测定不同降解时间的 MB 溶液吸光度,分析各个样品的降解率和降解速率,确定出最佳的样品。
2. 结果与讨论 (Results and discussion)
2.1 XRD 分析
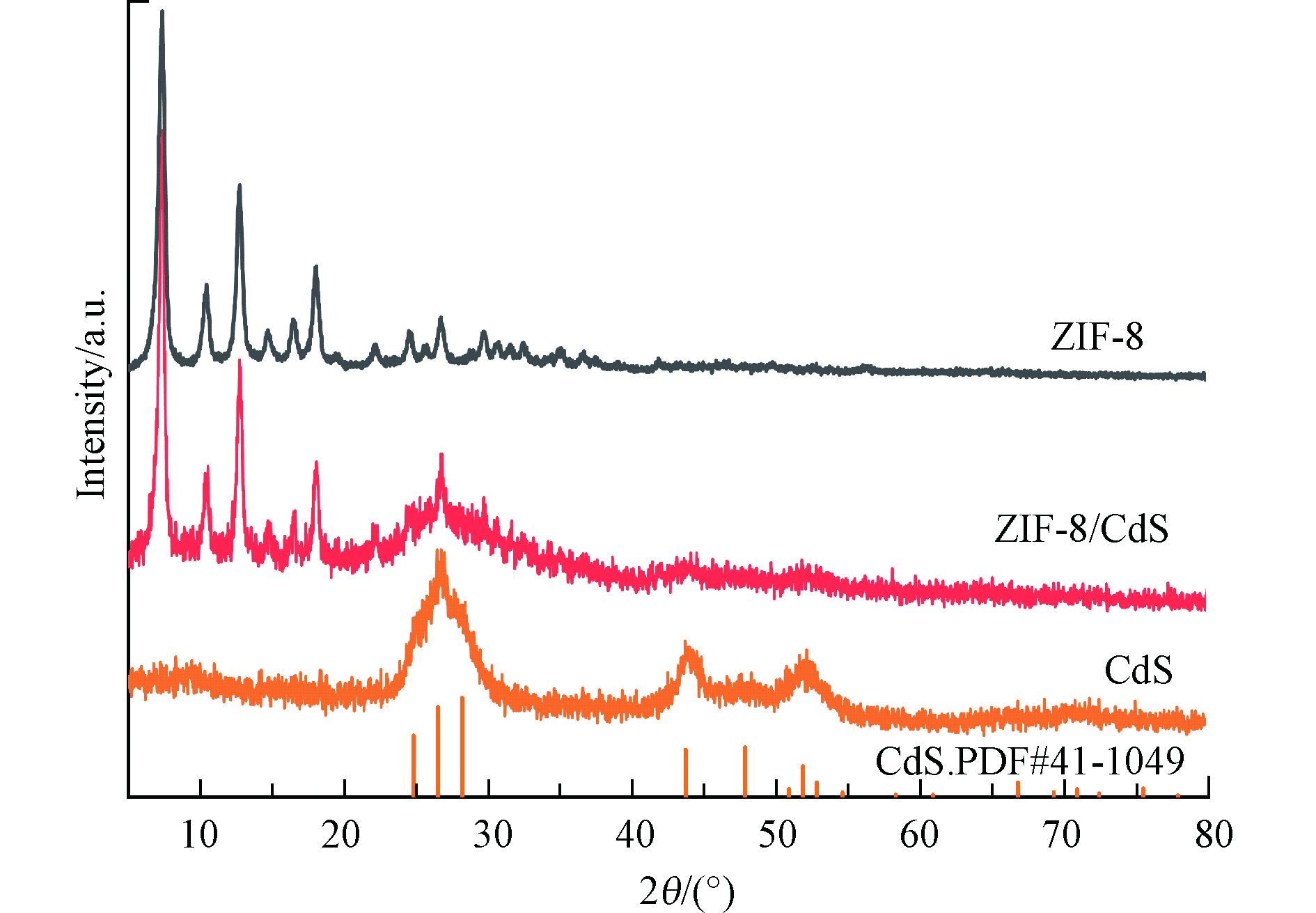
通过粉末 X 射线衍射 (XRD) 分析所制备样品的晶体结构。如图1所示, ZIF-8/CdS光催化剂的 XRD 图谱在2 θ =26.5°、43.8°、51.9°处显示出多个衍射峰,分别对应 CdS的不同晶面,这和CdS的标准卡一致。此外,2 θ= 7.4°、10.4°、12.8°、14.7°、16.5°和18.1°处的衍射峰对应的是具有高结晶度的 ZIF-8 的晶面。这与现有文献的记录相符合[22],证明 ZIF-8/CdS 复合材料的成功合成。
2.2 SEM 与 TEM 分析
通过 SEM 和 TEM 测量 CdS-NPs 和 ZIF-8/CdS 复合材料的形态和结构。图2(a、b)反映了 CdS-NPs 与 ZIF-8 晶体的形貌特征,图2(a)表明单个的 CdS-NPs 平均粒径为 60 nm 左右,但是由于比表面能等因素,这些颗粒仍表现出局部聚集的形态,由于 PVP 的加入,这种现象得到了一定程度的缓解。图2(b)中均匀分布着 100 nm 左右的ZIF-8晶体,颗粒成长良好,呈十二面体结构。图2(c、d)可以直观的看出, CdS 颗粒的周围充满了规则的 ZIF-8 小颗粒,表明 ZIF-8 纳米晶体在 CdS 表面成功生长。同时,本次研究还表征了 CdS-NPs 在甲醇溶液中的Zeta电位用于辅助实验分析,纯 CdS-NPs 在甲醇溶液中带负电荷(−12.5 mV),因此,在 ZIF-8/CdS 复合材料的制备过程中,Zn2+首先在 CdS 悬浮液中混合并吸引在 CdS 表面,这可以促进 ZIF-8 纳米晶体在 CdS 表面的快速生长。通过比较可以看出 CdS-NPs 的引入缩小了 ZIF-8 的平均粒径,晶粒尺寸在 20—40 nm 之间。图2e显示了单个 ZIF-8/CdS 颗粒的元素映射图像并表明 Cd、S、Zn元素均匀分布在纳米粒子上,Zn 元素的轮廓要更大,进一步验证了 ZIF-8/CdS 复合材料的结构。
2.3 XPS分析
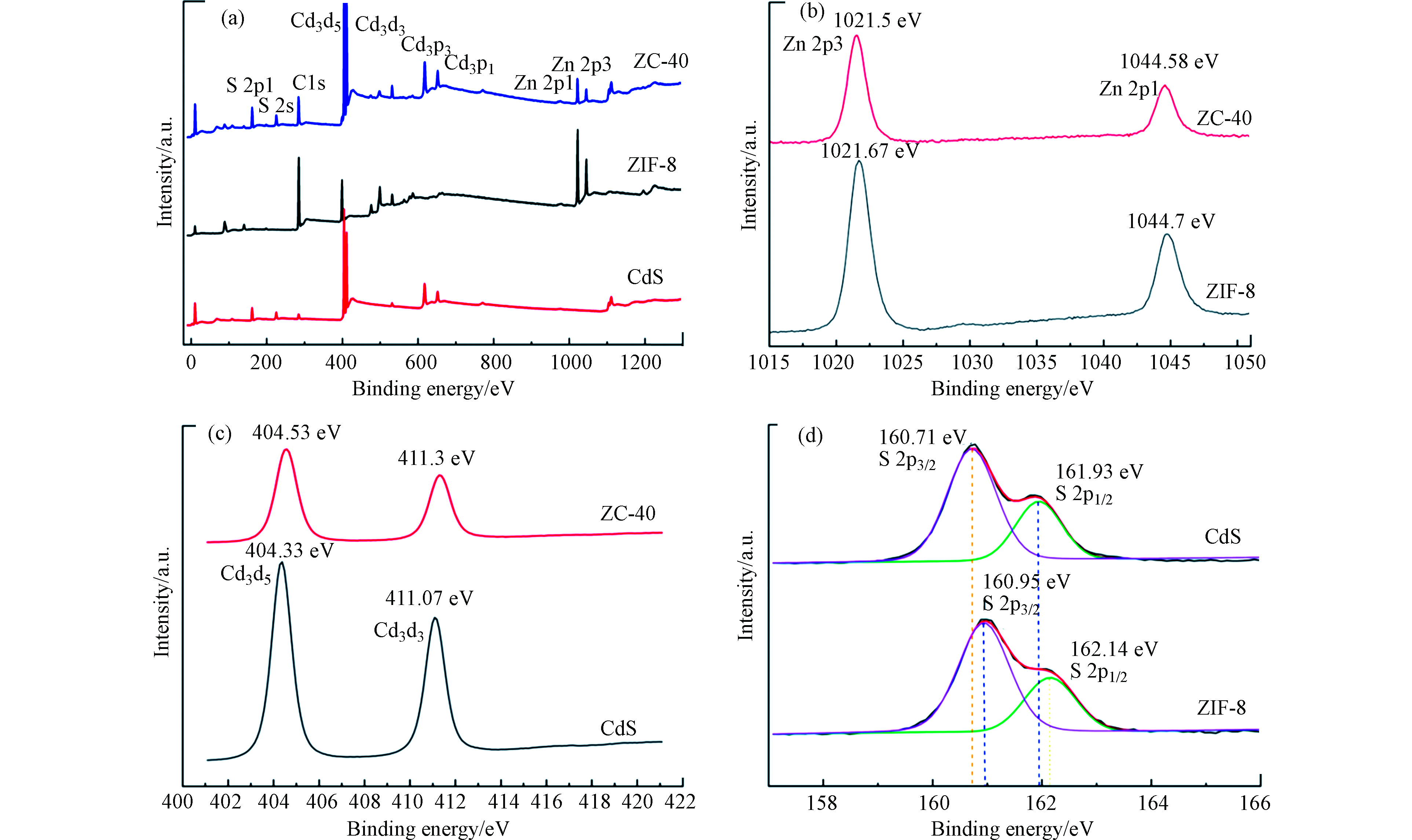
通过 XPS 分析样品的表面化学状态。图3(a)显示了 ZIF-8、CdS、ZIF-8/CdS 完整的 XPS电子能谱,这表明复合物中有 Zn、N、O、C、S和Cd 元素的存在。尽管大多数CdS-NPs都被包裹,但不可避免地存在一些暴露的 CdS-NPs,导致复合材料的 XPS中出现 S 和 Cd 的信号。比较图3(a)中3个XPS特征峰后表明, ZIF-8/CdS 复合材料的峰是 CdS 和 ZIF-8 的组合。图3(b—d)分别反映了 Zn 2p 、Cd 3d 与 S 2p 的XPS 能谱,Zn 2p 的XPS 能谱显示出两个以1021.67 eV 和 1044.7 eV 为中心的峰,分别表示Zn 2p3/2和 Zn 2p1/2的结合能。结合能为 404.33 eV 和 411.07 eV 的两个特征峰分别对应于 Cd 3d5/2和 Cd 3d3/2。这两个峰的出现归因于Cd 3d 轨道的自旋轨道分裂,其自旋轨道间距为6.74 eV,从而能表明 Cd 的化学状态为Cd2+[22-23]。S 2p 的XPS能谱可以拟合成结合能为 160.95 eV 和 162.14 eV 的两个峰,它们分别归属于S 2p3/2 和 S 2p1/2,表明 S2− 的存在。同时观察发现ZIF-8/CdS 中Cd 3d 与S 2p 的结合能要高于 CdS,同时Zn 2p 的结合能相比于ZIF-8要稍低一些,这可能是由于 CdS 和 ZIF-8 之间形成了Zn-S的影响,这种电子的相互作用通常被认为有利于光催化过程中的电子-空穴的分离[23]。
2.4 BET分析
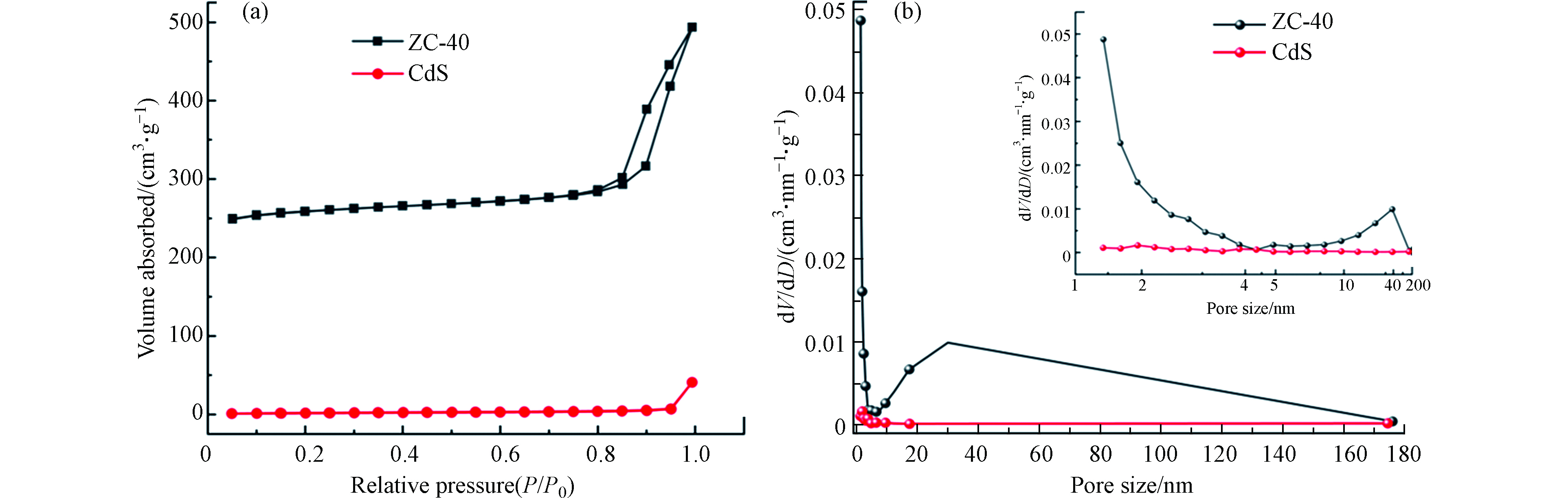
通过 N2 吸附/解吸测量来研究3个样品的比表面积。ZIF-8 是一种典型的 MOFs 材料,具有高孔隙率、低密度和高比表面积的特点。N2吸附/解吸通常用于探索孔隙特征和性质,包括比表面积和孔径分布。图4(a)显示了纯 CdS-NPs 和 ZIF-8/CdS 的 N2 吸附/解吸等温线。在整个范围内,ZIF-8/CdS 复合材料的 N2 吸附比纯 CdS 高得多,这主要是因为 ZIF-8 晶体孔隙率高。BET结果表明,纯CdSNPs的BET比表面积为5.675 m2·g−1,而 ZIF-8/CdS 的BET比表面积高达 784.79 m2·g−1。此外,根据 BDDT(Brunauer-Deming-Demin-Teller) 分类,还可以从图4(b)的ZIF-8/CdS的 N2 吸附/解吸等温线中看出其属于 Ⅳ 型等温线,表明存在丰富的介孔框架,孔径分布主要集中在 3.9 nm以内。此外,ZIF-8 还具有协同捕光能力,大表面积和丰富的大通道不仅有利于反应物与 ZIF-8/CdS 复合光催化剂之间的充分接触,而且还可以为目标污染物的降解提供更多的活性位点。
2.5 光电性能分析
2.5.1 电化学分析
光生电子-空穴对的有效分离直接影响催化剂的光催化能力,可以通过可见光照射下的瞬态光电流响应来进行研究。三电极系统用于测量 CdS 和 ZIF-8/CdS 复合材料的瞬态光电流响应,将样品浸涂到氧化氟锡 (FTO) 玻璃上制成工作电极,配100 mL 0.5 mol·L−1 Na2SO4 水溶液作为电解质溶液,使用配有 420 nm 截止滤光片的 300 W氙灯作为光源。图5(a)显示了 ZIF-8/CdS 与纯 CdS 修饰的电极的光电流响应,显然,虽然存在光腐蚀现象,但是稳定时的 ZIF-8/CdS 仍表现出比纯 CdS(10 μA·cm−2) 更高的光电流密度 (50 μA·cm−2)。并且还可以看出,ZIF-8/CdS 的光电流在开灯期间显著增加,而在关灯时光电流急剧下降,并在开关循环中重复响应。该现象反映了 ZIF-8/CdS 光催化剂具有极强的活性,在可见光照射下可以产生连续高效的光电流。电化学阻抗谱 (EIS) 反映了电子或电荷转移电阻,可以用来研究光电极的各个样品的电荷分离过程和转移电子的特性,以进一步了解光电效率。图5(b)显示了不同光电极的 EIS,其中 ZIF-8/CdS 的曲线显然要低于纯 CdS 和 ZIF-8,这说明 ZIF-8/CdS 在可见光照射下具有较小的电子转移阻力和快速的电子转移能力。以上的光电化学结果可以反映出 ZIF-8/CdS 强烈的可见光吸收和优异的光诱导电荷转移性能,这表明 CdS-NPs 表面沉积的 ZIF-8 可以有效的改善光催化剂中光生电子-空穴对的分离。
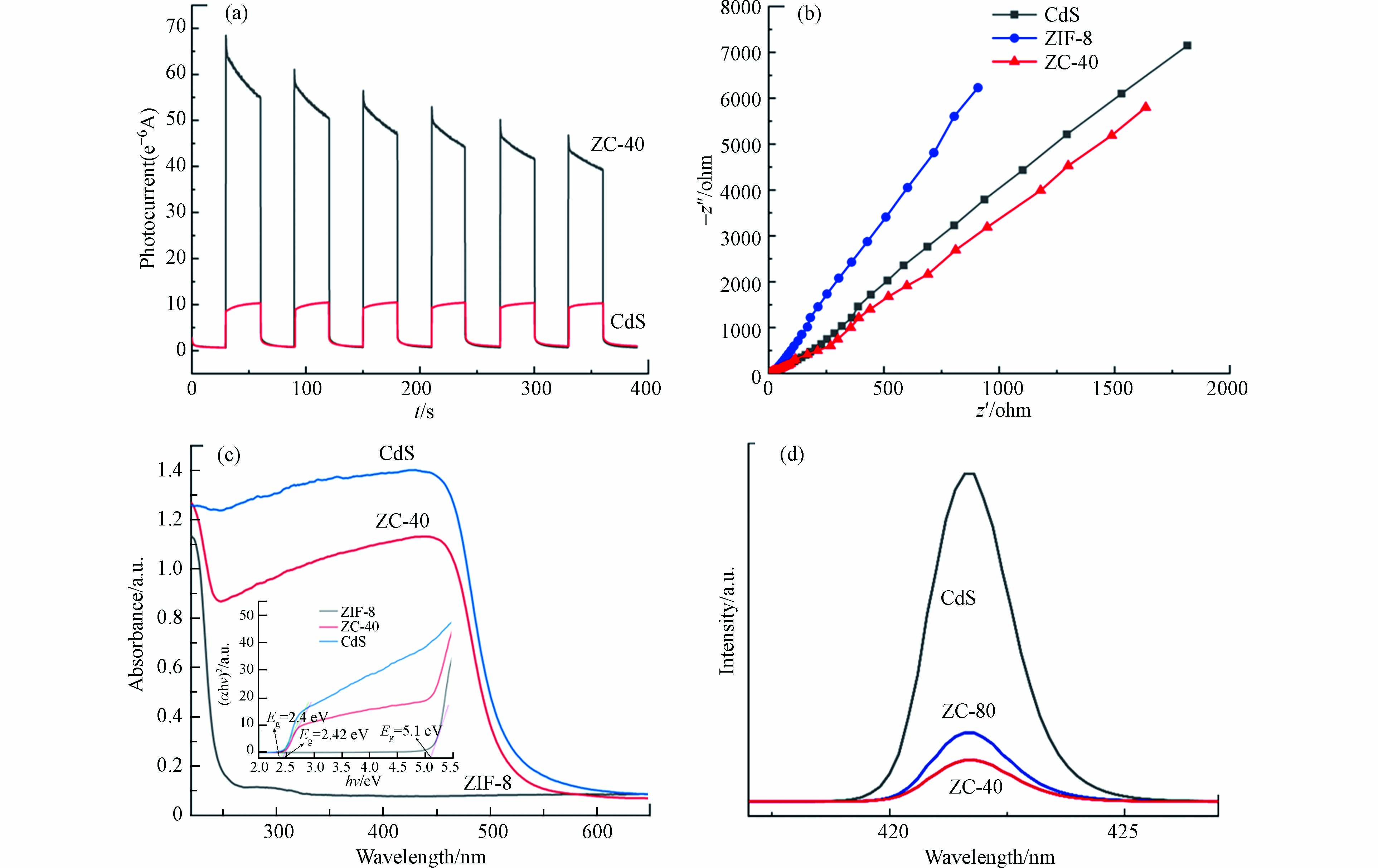 图 5 (a) CdS和 ZIF-8/CdS 复合材料在可见光照射下 (λ > 420 nm) 的瞬态光电流响应,(b)不同修饰电极的电化学阻抗谱,(c) 各组分的UV-vis DRS曲线,(d) 各组分的PL强度曲线Figure 5. (a) Photocurrent responses of CdS and ZIF-8/CdS composite under visible light irradiation (λ > 420 nm), (b) the electrochemical impedance spectra of different-modified electrodes, (c) UV-vis DRS curves for each component, (d) PL strength curves of each component.
图 5 (a) CdS和 ZIF-8/CdS 复合材料在可见光照射下 (λ > 420 nm) 的瞬态光电流响应,(b)不同修饰电极的电化学阻抗谱,(c) 各组分的UV-vis DRS曲线,(d) 各组分的PL强度曲线Figure 5. (a) Photocurrent responses of CdS and ZIF-8/CdS composite under visible light irradiation (λ > 420 nm), (b) the electrochemical impedance spectra of different-modified electrodes, (c) UV-vis DRS curves for each component, (d) PL strength curves of each component.2.5.2 紫外-可见漫反射光谱与荧光发射光谱分析
半导体材料的带宽和光生电荷的有效分离反映了光催化剂的催化效率。图5(c、d)采用紫外-可见漫反射光谱 (UV-vis DRS) 和荧光发射光谱 (PL)来研究 ZIF-8/CdS 光催化剂的光学性质,并分析 ZIF-8 对 CdS-NPs 表面的影响。UV-vis DRS 用于反映合成催化剂的光吸收特性。纯 CdS 在 UV-vis 区域有很强的吸收,主要吸收波长小于 550 nm 的光,这与相关文献的表述一致[18]。ZIF-8晶体的吸收边缘约为250 nm,主要吸收紫外区的光,由X轴上的截距得到的Tauc 图的切线确定其带隙为5.1 eV,因此没有明显的可见光吸收。尽管 ZIF-8/CdS 比纯 CdS 表现出较短的吸收带,从较短波长的一侧出现到约 530 nm,光捕获能力只有轻微的下降,而且 ZIF-8/CdS 呈现出稍宽的吸收带隙值为 2.42 eV,大于纯 CdS-NPs (2.4 eV),可以降低光生电子-空穴对的复合概率,增强光催化效率。因此,ZIF-8 和 CdS-NPs 之间异质结的形成为其提供了良好的界面接触,可协同提高光催化剂在可见光区的吸光能力。为了进一步分析光生电子-空穴对的分离和转移,图5(d)测量了光催化剂样品的荧光发射光谱(PL),PL反映了光催化剂的电荷分离能力。显然,ZIF-8 显著降低了 CdS-NPs 的荧光强度,而且,在 CdS 的添加量在40 mg时其峰值最低,说明在本次实验的各组分浓度下,ZC-40 的电荷分离能力最好。PL分析表明由于 CdS-NPs 和 ZIF-8 之间的强相互作用,光生电子可以通过半导体 ZIF-8 到达外层,ZIF-8 可以促进异质结中的电荷转移,从而限制电子-空穴对的复合。
2.6 光催化性能研究
MB是一种常见的阳离子染料,在此次实验中被用作催化降解的目标污染物,以评估光催化剂的催化效率。将 50 mg 的 ZIF-8、CdS-NPs、ZC-40、ZC-80 分别放入盛有 15 mg·L−1 的 100 mL MB 溶液中,首先在光反应发生器中进行暗反应,如图6(b)所示,样品在暗反应的过程中对 MB 有很明显的吸附效果,而 ZIF-8/CdS 表现出比 ZIF-8 和CdS 更好的吸附能力,这是由于 ZIF-8 的高孔隙率造成的影响,而单纯的 ZIF-8 疏水性较强,在水中容易聚集成团进而降低了与染液的接触,使得吸附量比复合物的吸附量低[24]。各组分的光催化过程是在550 W的氙灯照射下进行的,如图6(b)所示,装有 ZIF-8 的样品染液浓度几乎没有再降低,说明在可见光照射下,达到吸附平衡的 ZIF-8 几乎不对 MB 染料有降解效果。在持续 90 min 的光照下 ZIF-8/CdS 显示出较高的催化活性,如图6(a、b)所示, ZC-40 的催化活性最强,几乎完全的去除了 MB,远高于纯 CdS (37.2%),催化速率也明显快于 ZC-80。由Langmuir-Hinshelwood(L-H)一级动力学反应方程算得光催化表观速率常数为 0.0481 min−1,是纯 CdS(0.00489 min−1)的9.836倍。同时对光催化剂的适用性和稳定性进行了探究,图6(c)显示了在不同的pH环境下 ZC-40 的催化降解能力,初始MB溶液的pH为6.24,使用醋酸和氨水调整pH,可以看出在pH=3.56的溶液环境下,ZC-40 的降解速度最快。当溶液的pH较低时,ZC-40 的降解能力明显降低,这或许是因为CdS 在强酸性条件下不稳定导致的。而碱性条件下对 ZC-40 的性能影响并不明显。图6(d)显示了3个重复循环中,除了吸附平衡值略有降低外,其催化降解能力几乎没有损失。结合TEM图像可以认为是ZIF-8的涂层可以通过稳定核内的硫化物和 Cd2+ 有效保护 CdS 免受光腐蚀, 其稳定性得到有效的维持。
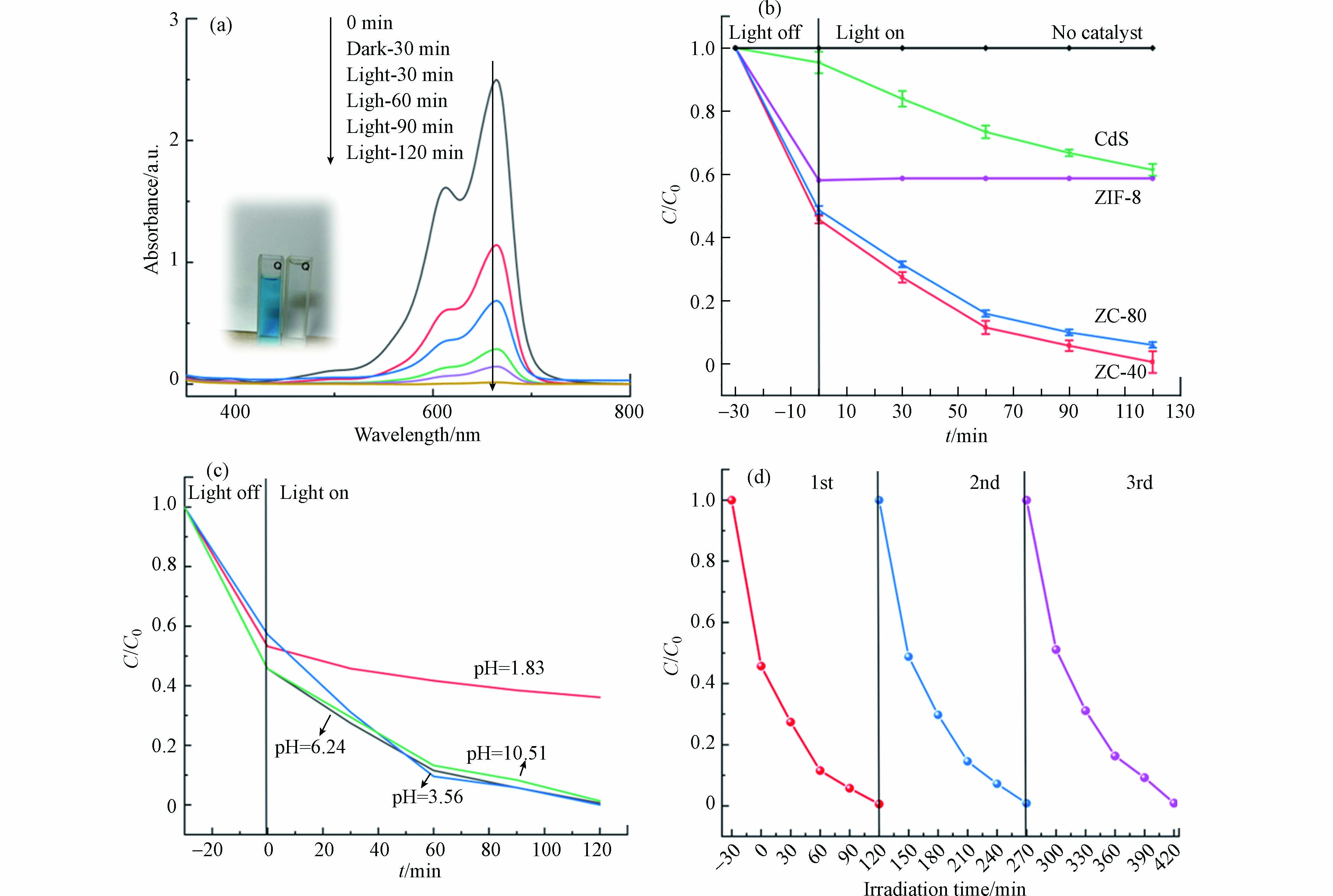 图 6 (a) 存在 ZC-40 (50 mg)的 MB 溶液 (15 mg L−1) 的 UV-vis 吸收光谱图,(b) CdS、ZIF-8、ZC-80、和 ZC-40 的降解曲线(所有样品质量:50 mg;MB 溶液浓度:15 mg L−1),(c)MB溶液的pH 环境对ZC-40降解能力的影响,(d) ZC-40在3次循环中的可回收能力Figure 6. (a) UV-vis absorption spectra of ZC-40 (50 mg) in MB solution (15 mg L−1), (b) Degradation curves of CdS, ZIF-8, ZC-80 and ZC-40 (All samples quality: 50 mg; MB solution concentration: 15 mg L−1), (c)Effect of pH environment of MB solution on ZC-40 degradation ability,(d) The recyclability ability of ZC-40 in three cycles.
图 6 (a) 存在 ZC-40 (50 mg)的 MB 溶液 (15 mg L−1) 的 UV-vis 吸收光谱图,(b) CdS、ZIF-8、ZC-80、和 ZC-40 的降解曲线(所有样品质量:50 mg;MB 溶液浓度:15 mg L−1),(c)MB溶液的pH 环境对ZC-40降解能力的影响,(d) ZC-40在3次循环中的可回收能力Figure 6. (a) UV-vis absorption spectra of ZC-40 (50 mg) in MB solution (15 mg L−1), (b) Degradation curves of CdS, ZIF-8, ZC-80 and ZC-40 (All samples quality: 50 mg; MB solution concentration: 15 mg L−1), (c)Effect of pH environment of MB solution on ZC-40 degradation ability,(d) The recyclability ability of ZC-40 in three cycles.2.7 光催化机理研究
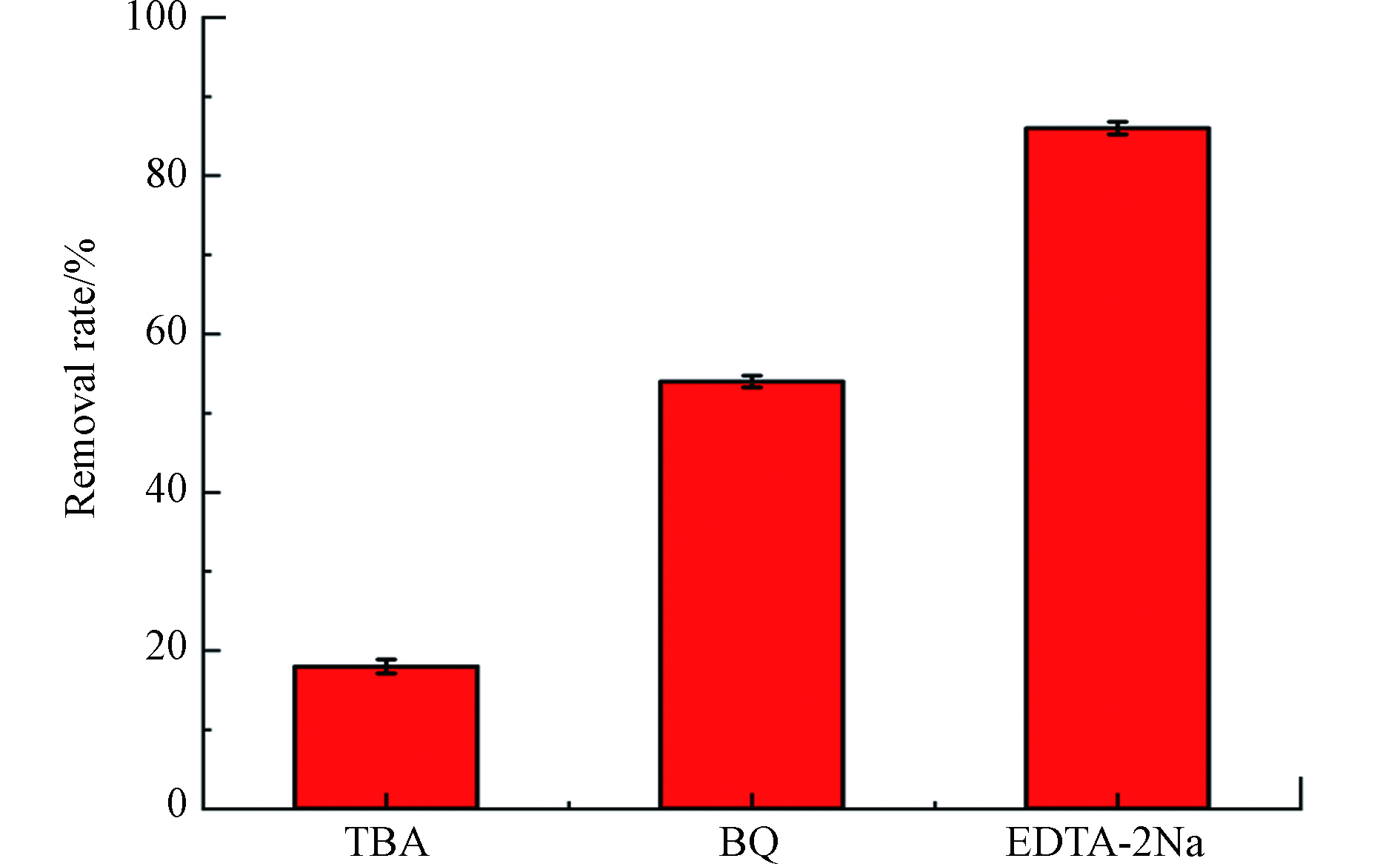
CdS 因为它的带隙在可见光区,所以被认为是一种具有可见光驱动的半导体光催化剂。因此,电子在可见光的照射下被激发跃迁,导致其解离为导带(CB)中的自由电子和价带(VB)中的空穴。电子将氧分子 (O2) 还原为超氧化物 (O2·−),而附着在催化剂表面的水分子或羟基被超氧化物 (O2·−) 氧化成高活性羟基自由基 (·OH),具有很强的将有机污染物催化为无毒无害的无机分子的能力[25]。为了进一步了解 ZIF-8/CdS 的光催化机理,进行了反应性自由基猝灭研究,通过添加不同的清除剂进行了一系列活性自由基的清除实验。在反应混合物中加入叔丁醇 (TBA)、对苯醌 (BQ) 和乙二胺四乙酸二钠 (EDTA-2Na) 以淬灭羟基自由基 (·OH)、超氧自由基 (O2·−) 和空穴 ( h+)。结果如图7所示,在加入TBA时,MB的降解得到了显著的降低,仅为18%左右,因此 ·OH 对MB的降解起主导作用。在加入BQ与EDTA-2Na时,其对MB的降解都起一定的抑制作用,其中EDTA-2Na的引入MB仍有88%左右的降解率,而BQ的引入则让MB的降解率降到了56%左右。这些结果表明3个反应性自由基(·OH、h+ 和 O2·−)的产生都证明了光催化过程中发生了有效的电荷分离。在反应性自由基中,h+是在 ZIF-8/CdS 催化降解 MB 中最不占优势的物种。
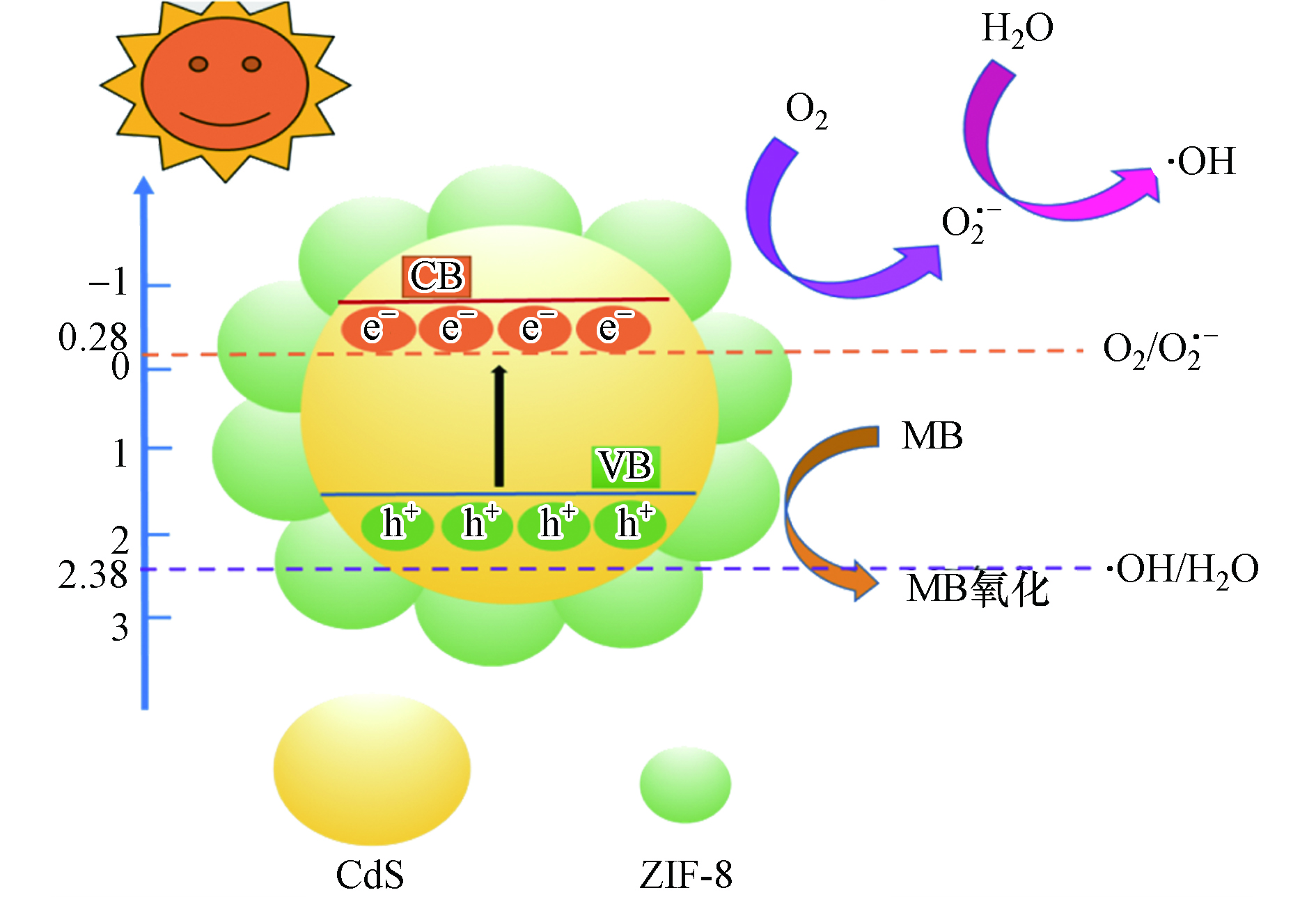
基于 PL 和 UV-vis DRS 等以上研究结果,提出可能的光催化过程,如图8所示.首先,ZIF-8/CdS 的带隙相对较窄 (2.42eV),在可见光的激励下,ZIF-8/CdS 的电子从价带 (VB) 跃迁到导带 (CB),在在价带中留下空穴(h+)。
ZIF-8/CdS+hv→h++e− 其次,ZIF-8/CdS 的导带电位负于标准氧化还原电位 O2/ O2·− (-0.28V,vs. NHE),说明光致电子具有较强的还原能力,理论上可以将ZIF-8表面的 O2 还原成 O2·−,同时形成其他的光催化基团:
e−+O2→O⋅−2 O⋅−2+H2O→HO⋅2+OH− 2HO⋅2→H2O2+O2 H2O2+e−→⋅OH+OH− 然而,CdS 的价带电位大约为1.6V[20],这明显高于 ·OH/OH- (2.38 V, vs. NHE),因此可以氧化 OH- 而产生 ·OH 自由基,同时h+也能直接氧化吸附在 ZIF-8/CdS 表面的 MB 分子,从而使得在可见光激励下使 MB 分子被有效降解:
O⋅−2,⋅OH,h++MB→其他产物 从单一的半导体来看,ZIF-8 的价带电位要低于 CdS 的价带电位,这就使得ZIF-8能更有效地接受来自 CdS 导带的光致电子,从而提高电子的转移效率,降低光致电子的复合率。除此之外,由于 ZIF-8 的大的比较面积和孔隙结构的存在,能够为 MB 分子的吸附和催化降解提供更多的活性位点,从而增强了整个体系去除污染物的能力。
3. 结论(Conclusion)
本文制备了 ZIF-8/CdS 复合材料并应用于光催化降解 MB。ZIF-8 的引入在防止小尺寸 CdS-NPs 聚集方面起重要作用, ZIF-8生长在 CdS-NPs 周围,提高 MB 的降解效率,增强了系统的光电转换效率和材料的抗光腐蚀性能。除颗粒的分散性提高和比表面积的增加这些因素外,ZIF-8 和 CdS-NPs 在界面上还形成了异质结,这使得光生电子-空穴对有效的分离。与 CdS 相比,ZIF-8/CdS 在光催化 MB 方面表现出更高的效率和更好的选择性,通过光电流测量和循环稳定性实验验证了 ZIF-8/CdS 的光稳定性,ZIF-8 的包裹可以提高对 MB 的吸附能力和光稳定性,同时不影响其光收集能力。本次研究提供了一种MOFs/半导体复合材料的构建方法,可能为光催化降解 MB 提供更多思路和解决方案,该复合材料可以结合两者的优点,提高半导体在催化、能量转换的效率和稳定性。
-
表 1 远UV-C (222 nm) 和灭活UV-C (254 nm) 对致病微生物和受试微生物的剂量响应关系
Table 1. Dose-response data of pathogenic and challenge microorganisms radiated by far UV-C (222 nm) and UVGI (254 nm)
病毒种类 波长/nm 达到相应灭活率所需UV剂量/(mJ·cm−2) 灭活速率常数/ (cm2·mJ−1) 文献 1-lg 2-lg 3-lg 4-lg SARS-CoV-2 222a) (含滤光片) 1.6 3.1 4.7 6.3 0.64 [9] SARS-CoV-2 222 (含滤光片) 0.7 1.4 2.1 2.8 1.42 [8] SARS-CoV-2 222 0.7 1.3 2.0 2.6 1.52 [8] SARS-CoV-2 254b) 1.3 2.5 3.8 5.1 0.79 [8] SARS-CoV-2 254 1.7 4.2 5.1 6.8 0.59 [10] MHV 222 (含滤光片) 1.0 1.9 2.9 3.9 1.03 [11] MHV 222 0.8 1.6 2.5 3.3 1.22 [11] MHV 254 1.1 2.2 3.2 4.3 0.93 [11] HCoV 229E 222 (含滤光片) 1.2 2.4 3.6 4.8 0.84 [11] HCoV 229E 222 0.8 1.5 2.3 3.0 1.33 [11] HCoV 229E 254 1.7 3.4 5.1 6.8 0.59 [11] Phi 6 222 (含滤光片) 2.8 5.6 8.3 11.1 0.36 [11] Phi 6 222 3.7 7.4 11.1 14.8 0.27 [11] Phi 6 254 33.3 66.6 100.0 133.3 0.03 [11] T1UV 222c) 2.7 5.5 8.2 11.0 0.37 [12] T1UV 254c) 4.3 8.5 12.8 17.0 0.23 [12] MS2 222c) 8.9 17.7 26.6 35.5 0.11 [12] MS2 254c) 16.0 33.6 53.4 77.6 0.05 [12] 注:a) 222 nm如没有特殊标注均为KrCl准分子灯;b) 254 nm如没有特殊标注均为低压汞灯;c) NT242系列可调谐激光器 (NIST)。 -
[1] SOSNIN E A, OPPENLÄNDE R T, TARASENKO V F. Applications of capacitive and barrier discharge excilamps in photoscience[J]. Journal of Photochemistry and Photobiology C:Photochemistry Reviews, 2006, 7(4): 145-163. doi: 10.1016/j.jphotochemrev.2006.12.002 [2] KNEISSL M, RASS J. III-Nitride ultraviolet emitters [M]. Springer, 2016. [3] United States Environmental Protection Agency. Ultraviolet disinfection guidance manual for the final long term 2 enhanced surface water treatment rule [S]. Washington, DC, 2006. [4] BOLTON J R, COTTON C A. The ultraviolet disinfection handbook [M]. American Water Works Association, 2011. [5] BECK S E, HULL N M, POEPPING C, et al. Wavelength-dependent damage to adenoviral proteins across the germicidal UV spectrum[J]. Environmental Science & Technology, 2018, 52(1): 223-229. [6] BECK S E, RODRIGUEZ R A, LINDEN K G, et al. Wavelength dependent UV inactivation and DNA damage of adenovirus as measured by cell culture infectivity and long range quantitative PCR[J]. Environmental Science & Technology, 2014, 48(1): 591-598. [7] LINDEN K G, THURSTON J, SCHAEFER R, et al. Enhanced UV inactivation of adenoviruses under polychromatic UV lamps[J]. Applied and Environmental Microbiology, 2007, 73(23): 7571-7574. doi: 10.1128/AEM.01587-07 [8] MA B, GUNDY P M, GERBA C P, et al. UV inactivation of SARS-CoV-2 across the UVC spectrum: KrCl* excimer, mercury-vapor, and light-emitting-diode (LED) sources[J]. Applied and Environmental Microbiology, 2021, 87(22): e01532-21. [9] ROBINSON R T, MAHFOOZ N, ROSAS-MEJIA O, et al. SARS-CoV-2 disinfection in aqueous solution by UV222 from a krypton chlorine excilamp [J]. MedRxiv, 2021. [10] STORM N, MCKAY L G, DOWNS S N, et al. Rapid and complete inactivation of SARS-CoV-2 by ultraviolet-C irradiation[J]. Scientific Reports, 2020, 10(1): 1-5. doi: 10.1038/s41598-019-56847-4 [11] MA B, LINDEN Y S, GUNDY P M, et al. Inactivation of coronaviruses and phage Phi6 from irradiation across UVC wavelengths[J]. Environmental Science & Technology Letters, 2021, 8(5): 425-430. [12] BECK S E, WRIGHT H B, HARGY T M, et al. Action spectra for validation of pathogen disinfection in medium-pressure ultraviolet (UV) systems[J]. Water Research, 2015, 70: 27-37. doi: 10.1016/j.watres.2014.11.028 [13] TSENG C C, LI C S. Inactivation of viruses on surfaces by ultraviolet germicidal irradiation[J]. Journal of Occupational and Environmental Hygiene, 2007, 4(6): 400-405. doi: 10.1080/15459620701329012 [14] WALKER C M, KO G P. Effect of ultraviolet germicidal irradiation on viral aerosols[J]. Environmental Science & Technology, 2007, 41(15): 5460-5465. [15] KITAGAWA H, NOMURA T, NAZMUL T, et al. Effectiveness of 222-nm ultraviolet light on disinfecting SARS-CoV-2 surface contamination[J]. American Journal of Infection Control, 2021, 49(3): 299-301. doi: 10.1016/j.ajic.2020.08.022 [16] American Conference of Governmental Industrial Hygienists. 2021 threshold limit values (TLVs) and biological exposure indices (BEIs) [C]. Cincinnati, OH: American Conference of Governmental Industrial Hygienists, 2020. [17] International Commission on Non-Ionizing Radiation Protection. Guidelines on limits of exposure to ultraviolet radiation of wavelengths between 180 nm and 400 nm (incoherent optical radiation)[J]. Health Physics, 2004, 87(2): 171-186. doi: 10.1097/00004032-200408000-00006 [18] SLINEY D. Balancing the risk of eye irritation from UV-C with infection from bioaerosols[J]. Photochemistry and Photobiology, 2013, 89(4): 770-776. doi: 10.1111/php.12093 [19] CESARINI J P, COLE C A, GRUIJL F D. UV-C photocarcinogenesis risks from germicidal lamps[J]. Int Commission Illumination, 2010, 187: 1-14. [20] FORBES P D, COLE C A, DEGRUIJL F. Origins and evolution of photocarcinogenesis action spectra, including germicidal UVC[J]. Photochemistry and Photobiology, 2021, 97(3): 477-484. doi: 10.1111/php.13371 [21] MOAN J, GRIGALAVICIUS M, BATURAITE Z, et al. The relationship between UV exposure and incidence of skin cancer[J]. Photodermatology, Photoimmunology & Photomedicine, 2015, 31(1): 26-35. [22] WOODS J A, EVANS A, FORBES P D, et al. The effect of 222‐nm UVC phototesting on healthy volunteer skin: a pilot study[J]. Photodermatology, Photoimmunology & Photomedicine, 2015, 31(3): 159-166. [23] FUKUI T, NIIKURA T, ODA T, et al. Exploratory clinical trial on the safety and bactericidal effect of 222-nm ultraviolet C irradiation in healthy humans[J]. Plos One, 2020, 15(8): e0235948. doi: 10.1371/journal.pone.0235948 [24] PONNAIYA B, BUONANNO M, WELCH D, et al. Far-UVC light prevents MRSA infection of superficial wounds in vivo[J]. Plos One, 2018, 13(2): e0192053. doi: 10.1371/journal.pone.0192053 [25] GOH J C, FISHER D, HING E C H, et al. Disinfection capabilities of a 222 nm wavelength ultraviolet lighting device: a pilot study[J]. Journal of Wound Care, 2021, 30(2): 96-104. doi: 10.12968/jowc.2021.30.2.96 [26] BUONANNO M, PONNAIYA B, WELCH D, et al. Germicidal efficacy and mammalian skin safety of 222-nm UV light[J]. Radiation Research, 2017, 187(4): 493-501. doi: 10.1667/RR0010CC.1 [27] BUONANNO M, STANISLAUSKAS M, PONNAIYA B, et al. 207-nm UV light-A promising tool for safe low-cost reduction of surgical site infections. II: In-vivo safety studies[J]. Plos One, 2016, 11(6): e0138418. doi: 10.1371/journal.pone.0138418 [28] CADET J. Harmless effects of sterilizing 222‐nm far‐UV radiation on mouse skin and eye tissues[J]. Photochemistry and Photobiology, 2020, 96(4): 949-950. doi: 10.1111/php.13294 [29] BARNARD I R M, EADIE E, WOOD K. Further evidence that far-UVC for disinfection is unlikely to cause erythema or pre-mutagenic DNA lesions in skin[J]. Photodermatology, Photoimmunology & Photomedicine, 2020, 36(6): 476-477. [30] HANAMURA N, OHASHI H, MORIMOTO Y, et al. Viability evaluation of layered cell sheets after ultraviolet light irradiation of 222 nm[J]. Regenerative Therapy, 2020, 14: 344-351. doi: 10.1016/j.reth.2020.04.002 [31] YAMANO N, KUNISADA M, KAIDZU S, et al. Long‐term effects of 222‐nm ultraviolet radiation C sterilizing lamps on mice susceptible to ultraviolet radiation[J]. Photochemistry and Photobiology, 2020, 96(4): 853-862. doi: 10.1111/php.13269 [32] HICKERSON R P, CONNEELY M P, TSUTSUMI S K H, et al. Minimal, superficial DNA damage in human skin from filtered far-ultraviolet C[J]. British Journal of Dermatology, 2021, 184(6): 1197-1199. doi: 10.1111/bjd.19816 [33] BUONANNO M, WELCH D, BRENNER D J. Exposure of human skin models to KrCl excimer lamps: The impact of optical filtering[J]. Photochemistry and Photobiology, 2021, 97(3): 517-523. doi: 10.1111/php.13383 [34] YOUNG A R, HARRISON G I, CHADWICK C A, et al. The similarity of action spectra for thymine dimers in human epidermis and erythema suggests that DNA is the chromophore for erythema[J]. Journal of Investigative Dermatology, 1998, 111(6): 982-988. doi: 10.1046/j.1523-1747.1998.00436.x [35] DELIC N C, LYONS J G, GIROLAMO N D, et al. Damaging effects of ultraviolet radiation on the cornea[J]. Photochemistry and Photobiology, 2017, 93(4): 920-929. doi: 10.1111/php.12686 [36] KAIDZU S, SUGIHARA K, SASAKI M, et al. Evaluation of acute corneal damage induced by 222-nm and 254-nm ultraviolet light in Sprague–Dawley rats[J]. Free Radical Research, 2019, 53(6): 611-617. doi: 10.1080/10715762.2019.1603378 [37] KAIDZU S, SUGIHARA K, SASAKI M, et al. Re‐evaluation of rat corneal damage by short‐wavelength UV revealed extremely less hazardous property of Far‐UV‐C[J]. Photochemistry and Photobiology, 2021, 97(3): 505. doi: 10.1111/php.13419 [38] BLATCHLEY E R, BRENNER D, CLAUS H, et al. Far UV-C radiation: current state-of knowledge. IUVA White Paper. (2021-5-11). [39] SLINEY D H, STUCK B E. A need to revise human exposure limits for ultraviolet UV-C radiation[J]. Photochemistry and Photobiology, 2021, 97(3): 485-492. doi: 10.1111/php.13402 [40] World Health Organization. Ambient air pollution: A global assessment of exposure and burden of disease [R]. 2016. -




 下载:
下载: