-
我国是抗生素生产大国,每年产生的抗生素菌渣量达到1.3×106 t以上[1]。菌渣在自然环境下易腐败变质,任意堆放极易造成环境污染。此外,菌渣不合理处置会导致其中的残留抗生素在环境介质中扩散和传播,从而对人群健康和生态环境造成巨大威胁。而另一方面,菌渣中含有大量的微生物菌丝体及未代谢利用完的有机物,营养物质含量丰富,可对其进行资源化利用。因此,如何将抗生素菌渣无害化处理及资源化利用已成为当今急需解决的难题。
好氧堆肥被广泛应用于固体有机废物处理,研究表明畜禽粪便或抗生素菌渣中的残留抗生素可以通过好氧堆肥降解[2-3]。菌渣经好氧堆肥后可被制成有机肥料,其不仅可提高土壤肥力,还保证了农产品品质安全[4]。堆肥中的微生物除了参与有机物料的分解外,其也对抗生素降解有重要作用。赵军超[5]发现,红霉素菌渣经好氧堆肥处理后降解率可达99%以上。这表明,好氧堆肥可实现抗生素菌渣无害化处理。
由于传统好氧堆肥温度不够高,限制了其对抗生素的降解[6]。因此,目前关于应用好氧堆肥法处理抗生素菌渣的研究都是在外源添加物的条件下进行的。一般外源添加物主要分为生物炭、氯化铁、天然沸石和生物菌剂等,而在好氧堆肥处理中添加生物菌剂效果显著[7]。研究发现,在堆肥中添加微生物菌剂,可提高堆肥温度,增加堆肥中微生物的种类和活性,延长高温分解周期,加快堆肥腐殖化进程,提高其中抗生素去除率,降低其环境风险,使堆肥成品达到无害化要求[8-12]。
本研究选取土霉素菌渣为研究对象,探究添加复合菌剂后土霉素菌渣和玉米秸秆混合堆肥的基本理化参数、堆肥中土霉素降解和微生物群落结构变化情况,并优化好氧堆肥对土霉素菌渣中残留土霉素的处理,为抗生素菌渣的无害化处理和资源化利用提供参考。
-
土霉素菌渣取自石家庄市某制药厂。玉米秸秆取自石家庄周边农户农田中,将其在105 ℃条件下烘干处理后破碎,长度约为1~2 cm。堆肥原料初始基本理化性质如表1所示。
-
堆肥试验在河北科技大学堆肥实验场进行。堆肥容器容积70 L,底部连接曝气泵以调节气量,并装有气体流量计。装置中连有3个温度探头,对其上、中、下温度进行实时监控。本实验设计分为2组,一组添加自制菌剂A(制备方法见专利:申请号CN 202111337864.9,编号C);另一组不添加菌剂(编号CK)作为对照组。C组为15 kg菌渣+15 kg玉米秸秆+菌剂A(0.3%);CK组为15 kg菌渣+15 kg玉米秸秆。
通过调节气体流量计,控制曝气速度为7 L·min−1。采样天数设定为第0、4、8、15、22、28、34、38 d,每次取样前进行翻堆,每次取样在罐体的上、中、下3个平面取样,遵循5点取样原则。每次取200 g样品,分为2份保存,一份用真空冷冻干燥机(FD-1A 50,博医康(北京)仪器有限公司)冷冻干燥,然后在20 ℃下保存,用于土霉素质量浓度的测定,另一份在4 ℃下保存用于理化性质分析。
-
堆肥温度采用自制堆肥装置内PT100温度探头对温度进行实时监测,每天选取0、4、8、12、16、20 h进行数据记录;含水率的测定运用失重法,参照GB/T 1931-2009中检测方法[13];堆肥样品中pH采用雷磁ZD-2自动电位滴定仪测定(PHS-2F,上海仪电科学仪器股份有限公司);EC采用多参数在线测定仪(哈纳HI993302,上海耀壮检测仪器设备有限公司);全碳、全氮、全磷和全钾含量采用流动分析仪测定(AA3,英国希尔公司)。
种子发芽指数(GI)测定:首先取10 g样品与蒸馏水按比例1∶10放入250 mL锥形瓶中,然后置于150 r·min−1摇床振荡30 min;再取其上清液过滤后吸取5 mL滤液于铺有滤纸的培养皿中,在其中放置20颗白菜种子,置于25 ℃下避光培养48 h后;最后,测定种子的根长,同时用去离子水做空白对照。
细菌群落结构通过宏全基因组法进行测定。残留土霉素采用高效液相色谱法测定(岛津LCM S8050,色谱柱为C18,1.9 μm×2.1 mm×50 mm;初始流动相为20%乙腈:80%甲酸水),土霉素降解率(D)如式(1)。
式中:D为土霉素降解率;C0为第0 d堆肥中土霉素质量分数,mg·g−1;Cn为第n 天堆肥中土霉素质量分数,mg·g−1。
-
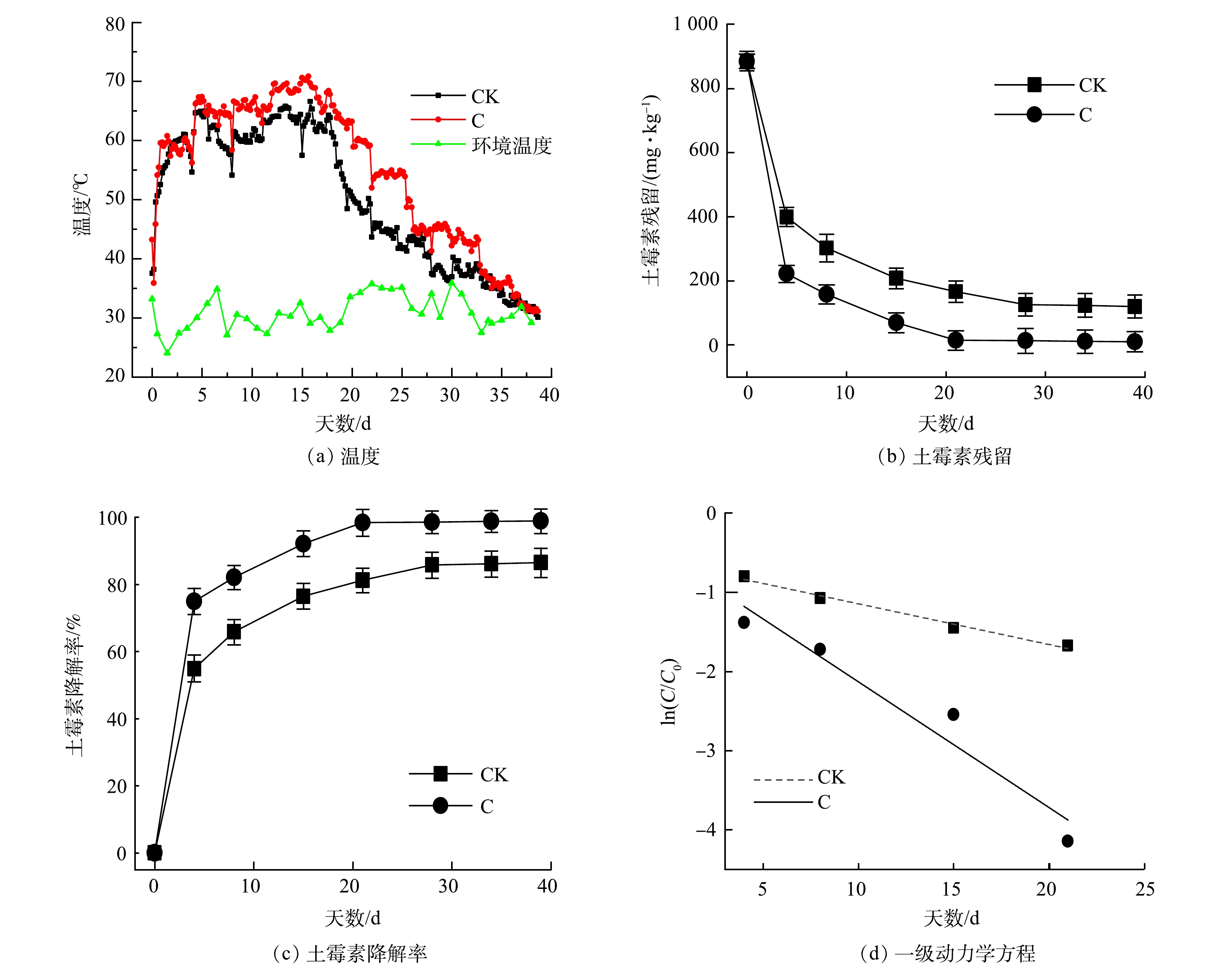
图1为堆肥过程中理化性质变化。含水率是堆肥过程中重要影响因素之一,其变化如图1(a)。C组和CK组的初始含水率分别为66.42%和64.05%。在堆肥初期,2组反应的含水率均小幅上升,然后开始下降。这可能是因为,微生物大量繁殖生长,产生了水分,后由于微生物分解有机质并散发较多热量,使堆体保持较长时间的高温,水分随热量挥发,故经翻堆后堆体含水率明显下降。堆肥结束后C组和CK组的含水率分别下降至41.08%和43.04%,由此表明,添加菌剂有利于堆体水分挥发。
由图1(b)可看出,2组堆体pH变化趋势相似。投加菌剂对堆体pH的影响不大,均出现先上升,再降低,翻堆后又升高的趋势。pH上升可能是由于堆肥前期大量排放的氨气的累积。随后氨气的产生速率小于其随曝气带出堆肥体系中的速率,pH开始下降[14]。堆肥第21 d后进入降温期,堆肥过程中的营养消耗减少,大量N元素以NH3的形式释放,并且在该阶段硝化细菌增多,其进行硝化反应产生大量H+,从而导致堆体的pH有轻微下降[15]。
堆体中铵态氮(NH4+-N)的转化过程如图1(c)所示。C组和CK组在堆肥第2 d后NH4+-N均呈上升状态,第21 d分别达到284.14和347.68 mg·kg−1。这可能是因为,堆体的C/N较低,物料中有机氮源被微生物矿化分解,使硝化反应在高温环境下受阻,导致NH4+-N大量积累[16-17]。此趋势与红霉素和青霉素菌渣堆肥研究中NH4+-N的转化过程相似[5,18]。NH4+-N的浓度达到峰值后开始下降,且C组下降速率大于CK组,最终C组NH4+-N质量浓度略低于CK组。这表明,添加菌剂有利于保留堆体中的氮源。
EC是反映堆肥中的可溶性盐含量的指标。一般情况下,堆体的EC>4 mS·cm−1,对植物种子发芽有强烈的抑制作用。因此,对堆肥过程中EC的变化过程进行了研究,结果如图1(d)所示。堆体的EC变化趋势为先上升后下降,可能是前期随着物料的消耗,释放出矿物盐和铵根离子而上升。高温期后,有机质降解速率下降,由于CO2和NH3的挥发,导致EC下降,这与以往的研究结果相似[19]。2组堆肥中的EC峰值达到3.0和2.85 mS·cm−1,均未超过其应用限值,故不会对植物种子发芽产生较强的抑制。C组初始EC值高于CK组,但最终EC值分别为2.57和2.21 ms·cm−1,低于CK组,处于安全水平。这表明,添加菌剂有利于降低堆肥中的可溶性盐的含量。
-
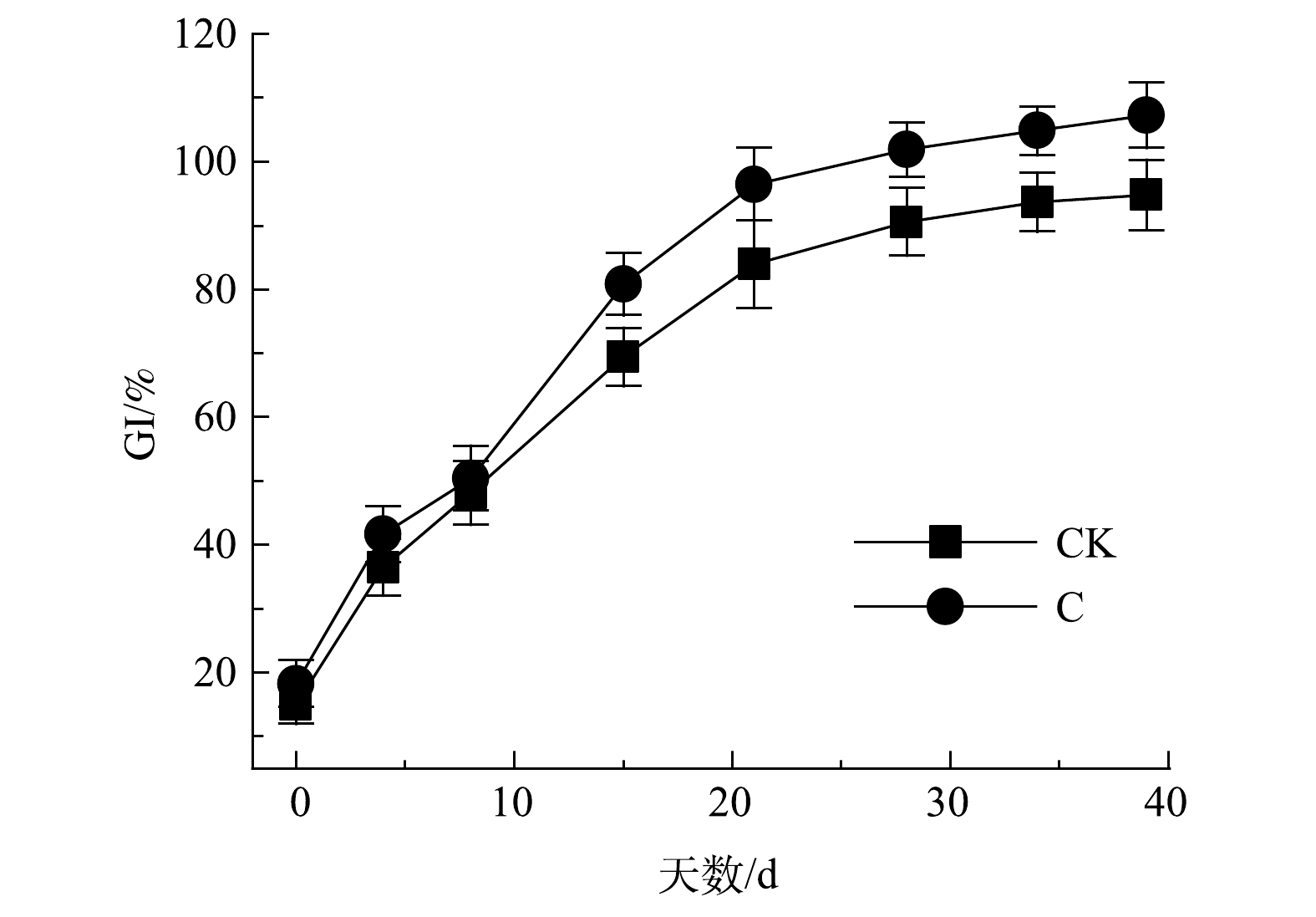
堆肥过程中种子发芽率指数(GI)可在一定程度上代表堆肥产品对植物毒性的强弱。其变化如图2所示,2组堆肥初期GI均低于20%。这表明,土霉素菌渣有较强的植物毒性,在农田应用中可能会存在较大的环境风险[20]。由于堆肥初期物料中的有机酸和铵根离子浓度较高,故导致了堆体初期的GI偏低。随着堆肥的进行,在微生物的作用下,物料GI逐渐升高,逐步实现脱毒。当GI>80%时,认定堆肥产品对植物基本无毒,2组堆肥产品均达到安全水平。添加菌剂使C组比CK组处理时间提前了7 d。这表明,复合菌剂在一定程度上加强了堆肥对植物毒性的削减。最终产品的GI分别为94.8%和107.3%。添加菌剂后,在提高微生物的种类和活性的作用下,缩减了堆肥周期,加快了堆肥物料的脱毒。马骏[21]研究表明,牛粪堆肥产品的GI高达124%,远高于本研究结果。由此可推测,土霉素残留不仅对GI有抑制作用,且质量浓度越高其抑制效应越强。
-
随着堆肥的进行,微生物的生长发育消耗了一定的碳源,导致有机质质量分数下降。堆肥结束后C组中有机物质的降解率为14.80%,而CK组仅为9.24%。因此,投加复合菌剂可增加堆体中微生物的数量和活性,加快了对碳源的消耗,提高了堆肥过程的最高温度,可间接增强对有机质的降解。
对堆肥成品进行检测,检测指标参照《有机肥料标准》(NY/T525-2021)[22]中对肥料的要求,将检测结果同标准中要求值进行对比,其结果见表2。堆肥成品指标除水分的质量分数偏高外,其余指标均满足《有机肥料标准》(NY/T 525-2021)[22]中标准,在后续晾干过程中可降低其水分的质量分数。本研究结果可为抗生素菌渣及其衍生物的工程化好氧堆肥资源化利用提供数据支持和技术参考。
-
1)菌剂对堆肥中土霉素降解影响。堆体温度是堆肥过程中最重要的参数之一,与有机物降解程度和堆肥产物的腐熟程度密切相关。堆肥温度变化和土霉素降解变化间的关系如图3所示。堆肥期间,温度变化经历了升温期、高温期和降温腐熟期3个阶段。在堆肥第2天,2组温度分别达到54.56和52.66 ℃。其中,C组比CK组提前1 d达到最高温度,最高温度分别为70.55和66.57 ℃,且高温期延长了5 d。这可能是因为,堆肥初期CK组含有的土著微生物较少,微生物活性较差,难以迅速降解堆体中的有机物。堆肥38 d时,堆体温度与环境温度接近,堆肥发酵结束,有机质降解完全,实现了土霉素菌渣的无害化和资源化。马骏[21]研究发现,菌剂能提高堆肥温度,使最高温度达到80 ℃以上,高于本次堆肥温度。这可能是因为,制药菌渣中高浓度的重金属对高温期优势微生物菌群的抑制作用。ZHANG等[23]在泰乐菌素菌渣与污泥堆肥的研究中也表明,高浓度Cu能致使高温期温度不高,与本研究结果一致。
由图3(b)可知,土霉素降解趋势为先迅速下降,最后趋于稳定。CK组在堆肥21 d降解率为81.23%。这表明,堆肥处理可以降低土霉素残留。堆肥结束时,CK组土霉素质量分数为119.67 mg·kg−1,降解率达86.47%;C组土霉素质量分数为10 mg·kg−1,降解率高达98.87%(图3(c))。C组优于CK组,这与REN等[24]、ZHU等[25]、EZZARIAI等[26]、SARDAR等[27]和SARDAR等[28]的研究结果结果相似。土霉素降解主要发生在升温期及高温期。这一方面可能是,升温中键能较弱的四环素类分子中的C—N易断裂,导致羧基及哌嗪环断裂并脱去;另一方面可能是,温度升高增强了嗜温菌和嗜热菌的生物活性,进而提高了土霉素的降解。因此,高温是抗生素降解的重要影响因素,有利于将抗生素菌渣无害化和资源化[29]。
图3(d)是对2组降解曲线的一级动力学模拟图,CK组和C组R2分别为0.986和0.941。表3列出了堆肥过程中几种抗生素的半衰期,C组和CK组的半衰期分别为13.59和4.38。对比发现,CK组的半衰期最大。这表明,土霉素为难降解抗生素[30-31]。但是,C组的半衰期小于CK组。这说明,复合菌剂的添加有利于土霉素的降解。
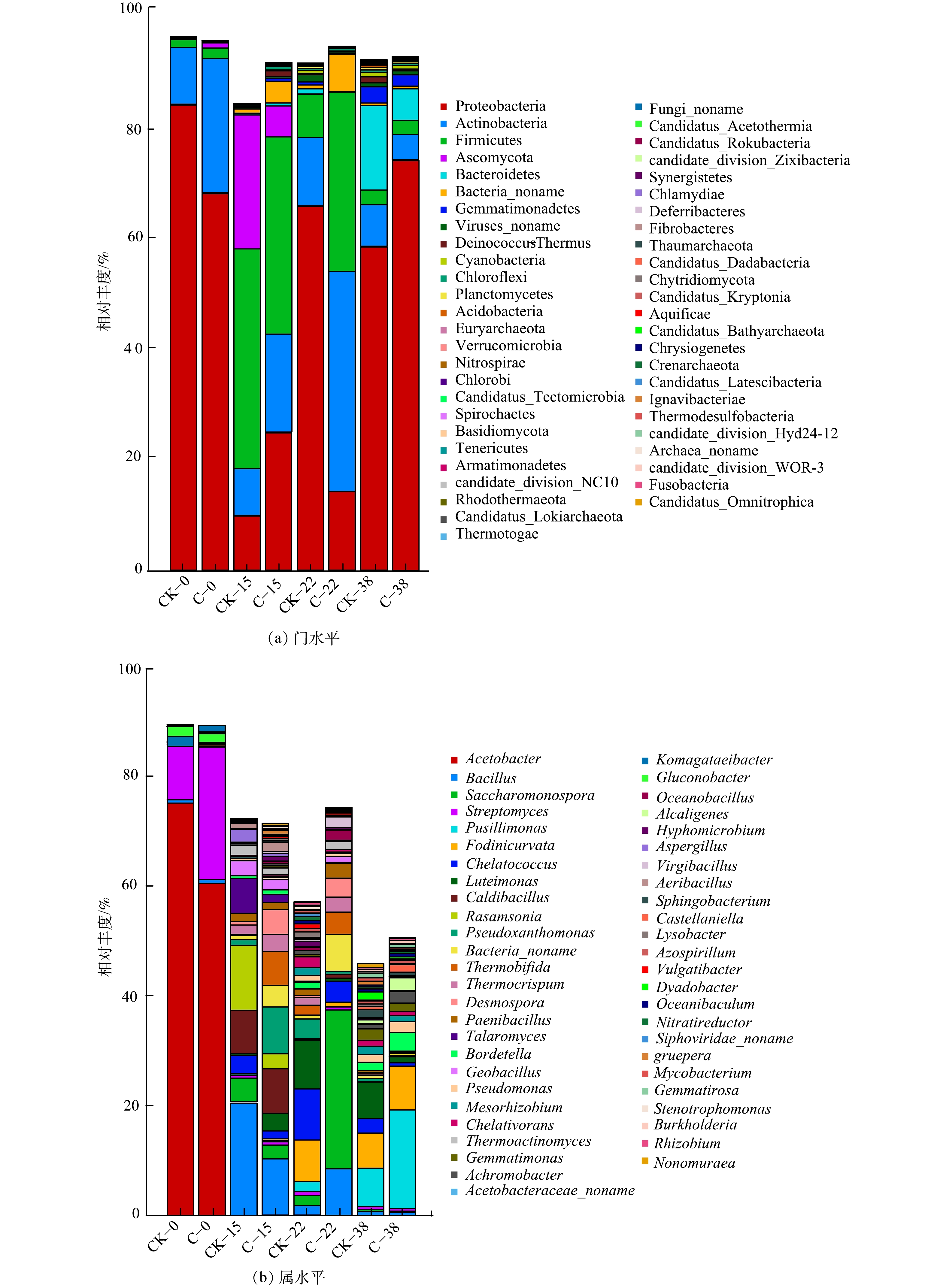
2)菌剂对堆肥中微生物群落结构影响。2组堆肥处理中细菌群落组成在门水平和属水平的相对丰度见图4。C组堆肥样品细菌、真菌和病毒所占的比例分别为94.86%、0.21%和0.97%。细菌主要由放线菌门Actinobacteria、变形菌门Proteobacteria、厚壁菌门Firmicutes和拟杆菌门Bacteroidetes组成。细菌群落在高温期变化较大,而土霉素降解也主要发生在高温期。这表明,土霉素降解可能与其微生物群落变化有密切关系。在堆肥初期,C组中Firmicutes增加到40.03%,Proteobacteria从68.45%降低到9.55%。此时优势菌群为Firmicutes和Actinobacteria,其耐受力强,释放热量促使堆体升温。在升温期,C组中Firmicutes和Bacteroidetes相对丰度分别增加了10.1%和2.5%,Actinobacteria减少了15%。在高温期后,Firmicutes和Bacteroidetes相对丰度分别增加了12.27%和5.7%。堆肥结束时,细菌中Actinobacteria数量下降到4.49%,真菌数量下降到0.16%,病毒降低到0.72%。这说明,土霉素菌渣对细菌、放线菌和真菌生长均有不同程度的抑制。此外,在堆肥过程中,子囊菌门Ascomycota只出现在高温期,随堆肥的进行其相对丰度降低,Ascomycota可能为致病菌,故堆肥有利于致病菌的去除。此结果与PENG等[32]的研究结果相似。
从属水平上分析细菌相对丰度,堆肥升温期,以Acetobacter为代表的1类好氧或兼性厌氧的杆状菌群能够分解堆料,提高堆体温度。在堆肥第22 d,堆体中优势菌群以Saccharomonospora和Bacillus为代表,Saccharomonospora具有较强的蛋白酶、淀粉酶和脂肪酶活性,有较强的有机质分解能力;Bacillus为木质纤维素降解菌。因此,C组堆肥产物中纤维素和半纤维素含量的下降可能与Bacillus菌群数量的增加有关。堆肥高温期,C组的优势菌属无论在功能还是数量上都比CK组能更好的加速堆肥进程。而且,CK组中反硝化细菌存在较多,降低了堆体中氮的含量,导致氮元素缺少,不利于菌渣堆肥产品向有机肥方向发展。在堆肥第38 d,由于复合菌剂中存在Geobacillusthermodenitrificans,因此堆体中优势菌群以Geobacillus为代表,其可分解菌渣中的蛋白质,进而提高抗生素降解率。
3)环境因子和细菌群落之间的相关性分析。环境因素(pH、残留土霉素、温度、C/N)与细菌群落(基于门的丰度)的RDA分析结果如图5所示。RDA1和RDA2分别解释了细菌群落和环境因子总变异的72.85%和42.09%。这表明,残留土霉素的变化主要受细菌群落变化的影响。随着堆肥的进行,Firmicutes减少,而其他菌群在升温期和高温期增加,促进了土霉素的降解。这表明,Firmicutes和Actinobacteria是降解土霉素的优势菌群。在堆肥初期,残留土霉素和C/N是影响堆肥进程的主要因素。然而,在高温和降温阶段,pH和温度成为影响堆肥效果的主要因素。且RAMASWAMY等[33]和BAO等[34]的研究也表明,pH、温度以及微生物的活性在降解抗生素过程中起重要作用。因此,在堆肥过程中,土霉素残留的变化和温度、微生物群落的变化有着密不可分的关系。堆肥结束时,C组土霉素质量浓度小于CK组。这表明,添加菌剂可提高微生物种类和活性以及堆体温度,促进了土霉素的降解。
综上所述,细菌群落的演替和环境因素的变化都会影响土霉素的降解。因温度变化而引起的不同细菌丰度在不同堆肥阶段的差异,可能是残留抗生素随堆肥过程变化的内在机制。接种菌剂既改变了堆肥土著细菌群落的互作模式,降低了细菌群落的复杂度,又为优化建立新的和更健康的堆肥细菌群落奠定了基础。
-
1) C组的NH4+-N浓度比CK组提前7 d降至腐熟堆肥的安全浓度范围内。堆肥后的成品基本可以满足《有机肥料标准》(NY/T525-2021),复合菌剂在促进堆肥腐熟和氮磷保留中具有良好的效果。
2)复合菌剂增加了堆体中微生物活性,延长了高温期5 d;C组的土霉素降解率高达98.41%,比CK组高12.39 %。这表明,菌剂堆肥化处理在提高堆体温度的同时提高了土霉素降解率。
3)在堆肥中,优势门为Firmicutes和Actinobacteria,土霉素残留的变化与其密切相关。因温度变化而造成的不同细菌丰度在不同堆肥阶段的差异可能是引起残留抗生素随堆肥过程变化的原因。
复合菌剂对土霉素菌渣好氧堆肥腐熟及微生物群落结构影响
Effect of compound bacterial agent on maturity and microbial community structure of oxytetracycline residue aerobic composting
-
摘要: 针对抗生素菌渣中抗生素残留难处理的问题,采用好氧堆肥法将其制成有机肥料,以实现其无害化处理及资源化利用。通过将复合菌剂添加到好氧堆肥体系中,研究其对堆体理化性质、肥效、毒性和微生物群落的影响。结果表明,添加复合菌剂最高温度可达70.55 ℃,比对照组高温期延长了5 d,减少了氮源流失,有机质降解率提高了5.56%,土霉素降解率高达98.86%,使堆肥产品达到安全水平。此外,复合菌剂提高了堆肥中放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)的相对丰度,与堆体升温正相关的嗜热菌属(Thermophilic bacteria genera)丰度显著增加(P<0.01),而致病细菌相对丰度下降。细菌群落相关性分析结果表明,接种菌剂既增加了微生物活性,降低了细菌群落的复杂度,又为优化建立新的和更加健康的堆肥细菌群落奠定了基础。本研究可为抗生素降解菌渣在堆肥中的应用提供参考。Abstract: In order to solve the problem that it is difficult to deal with antibiotic residue, aerobic composting method is used to make it into organic fertilizer to realize its harmless treatment and resource utilization. The effects of compound bacteria on physical and chemical properties, fertilizer efficiency, toxicity and microbial community of aerobic composting system were studied by adding compound bacterial agent to aerobic composting system in this study. The results showed that the highest temperature of adding compound bacteria was 70.55 ℃, which was 5 days longer than that of CK group, the loss of nitrogen source was reduced, the degradation rate of organic matter was increased by 5.56%, and the degradation rate of oxytetracycline was as high as 98.86%, which made the composting products reach the safe level. In addition, the relative abundance of actinomycetes (Actinobacteria) and thick-walled bacteria (Firmicutes) in composting was increased, and the abundance of thermophilic bacteria (Thermophilic bacteria genera) positively related to the temperature of compost was significantly increased, while the relative abundance of pathogenic bacteria decreased. The results of correlation analysis of bacterial community showed that inoculation not only increased microbial activity and reduced the complexity of bacterial community, but also laid a foundation for optimizing the establishment of new and healthier composting bacterial community. This study can provide a reference for the application of antibiotic-degrading bacterial residue in composting.
-
我国是抗生素生产大国,每年产生的抗生素菌渣量达到1.3×106 t以上[1]。菌渣在自然环境下易腐败变质,任意堆放极易造成环境污染。此外,菌渣不合理处置会导致其中的残留抗生素在环境介质中扩散和传播,从而对人群健康和生态环境造成巨大威胁。而另一方面,菌渣中含有大量的微生物菌丝体及未代谢利用完的有机物,营养物质含量丰富,可对其进行资源化利用。因此,如何将抗生素菌渣无害化处理及资源化利用已成为当今急需解决的难题。
好氧堆肥被广泛应用于固体有机废物处理,研究表明畜禽粪便或抗生素菌渣中的残留抗生素可以通过好氧堆肥降解[2-3]。菌渣经好氧堆肥后可被制成有机肥料,其不仅可提高土壤肥力,还保证了农产品品质安全[4]。堆肥中的微生物除了参与有机物料的分解外,其也对抗生素降解有重要作用。赵军超[5]发现,红霉素菌渣经好氧堆肥处理后降解率可达99%以上。这表明,好氧堆肥可实现抗生素菌渣无害化处理。
由于传统好氧堆肥温度不够高,限制了其对抗生素的降解[6]。因此,目前关于应用好氧堆肥法处理抗生素菌渣的研究都是在外源添加物的条件下进行的。一般外源添加物主要分为生物炭、氯化铁、天然沸石和生物菌剂等,而在好氧堆肥处理中添加生物菌剂效果显著[7]。研究发现,在堆肥中添加微生物菌剂,可提高堆肥温度,增加堆肥中微生物的种类和活性,延长高温分解周期,加快堆肥腐殖化进程,提高其中抗生素去除率,降低其环境风险,使堆肥成品达到无害化要求[8-12]。
本研究选取土霉素菌渣为研究对象,探究添加复合菌剂后土霉素菌渣和玉米秸秆混合堆肥的基本理化参数、堆肥中土霉素降解和微生物群落结构变化情况,并优化好氧堆肥对土霉素菌渣中残留土霉素的处理,为抗生素菌渣的无害化处理和资源化利用提供参考。
1. 材料与方法
1.1 堆肥原料
土霉素菌渣取自石家庄市某制药厂。玉米秸秆取自石家庄周边农户农田中,将其在105 ℃条件下烘干处理后破碎,长度约为1~2 cm。堆肥原料初始基本理化性质如表1所示。
表 1 堆肥原料基本理化性质Table 1. Basic physical and chemical property of compost raw materials供试样品 含水率/% pH 电导率EC/(mS·cm−1) C/N 玉米秸秆 9.89 5.32 2.67 50.89 土霉素菌渣 78.04 4.47 — 5.73 1.2 实验装置和设计
堆肥试验在河北科技大学堆肥实验场进行。堆肥容器容积70 L,底部连接曝气泵以调节气量,并装有气体流量计。装置中连有3个温度探头,对其上、中、下温度进行实时监控。本实验设计分为2组,一组添加自制菌剂A(制备方法见专利:申请号CN 202111337864.9,编号C);另一组不添加菌剂(编号CK)作为对照组。C组为15 kg菌渣+15 kg玉米秸秆+菌剂A(0.3%);CK组为15 kg菌渣+15 kg玉米秸秆。
通过调节气体流量计,控制曝气速度为7 L·min−1。采样天数设定为第0、4、8、15、22、28、34、38 d,每次取样前进行翻堆,每次取样在罐体的上、中、下3个平面取样,遵循5点取样原则。每次取200 g样品,分为2份保存,一份用真空冷冻干燥机(FD-1A 50,博医康(北京)仪器有限公司)冷冻干燥,然后在20 ℃下保存,用于土霉素质量浓度的测定,另一份在4 ℃下保存用于理化性质分析。
1.3 实验测定指标及分析方法
堆肥温度采用自制堆肥装置内PT100温度探头对温度进行实时监测,每天选取0、4、8、12、16、20 h进行数据记录;含水率的测定运用失重法,参照GB/T 1931-2009中检测方法[13];堆肥样品中pH采用雷磁ZD-2自动电位滴定仪测定(PHS-2F,上海仪电科学仪器股份有限公司);EC采用多参数在线测定仪(哈纳HI993302,上海耀壮检测仪器设备有限公司);全碳、全氮、全磷和全钾含量采用流动分析仪测定(AA3,英国希尔公司)。
种子发芽指数(GI)测定:首先取10 g样品与蒸馏水按比例1∶10放入250 mL锥形瓶中,然后置于150 r·min−1摇床振荡30 min;再取其上清液过滤后吸取5 mL滤液于铺有滤纸的培养皿中,在其中放置20颗白菜种子,置于25 ℃下避光培养48 h后;最后,测定种子的根长,同时用去离子水做空白对照。
细菌群落结构通过宏全基因组法进行测定。残留土霉素采用高效液相色谱法测定(岛津LCM S8050,色谱柱为C18,1.9 μm×2.1 mm×50 mm;初始流动相为20%乙腈:80%甲酸水),土霉素降解率(D)如式(1)。
stringUtils.convertMath(!{formula.content}) (1) 式中:D为土霉素降解率;C0为第0 d堆肥中土霉素质量分数,mg·g−1;Cn为第n 天堆肥中土霉素质量分数,mg·g−1。
2. 结果与讨论
2.1 堆肥过程的理化性质
图1为堆肥过程中理化性质变化。含水率是堆肥过程中重要影响因素之一,其变化如图1(a)。C组和CK组的初始含水率分别为66.42%和64.05%。在堆肥初期,2组反应的含水率均小幅上升,然后开始下降。这可能是因为,微生物大量繁殖生长,产生了水分,后由于微生物分解有机质并散发较多热量,使堆体保持较长时间的高温,水分随热量挥发,故经翻堆后堆体含水率明显下降。堆肥结束后C组和CK组的含水率分别下降至41.08%和43.04%,由此表明,添加菌剂有利于堆体水分挥发。
由图1(b)可看出,2组堆体pH变化趋势相似。投加菌剂对堆体pH的影响不大,均出现先上升,再降低,翻堆后又升高的趋势。pH上升可能是由于堆肥前期大量排放的氨气的累积。随后氨气的产生速率小于其随曝气带出堆肥体系中的速率,pH开始下降[14]。堆肥第21 d后进入降温期,堆肥过程中的营养消耗减少,大量N元素以NH3的形式释放,并且在该阶段硝化细菌增多,其进行硝化反应产生大量H+,从而导致堆体的pH有轻微下降[15]。
堆体中铵态氮(NH4+-N)的转化过程如图1(c)所示。C组和CK组在堆肥第2 d后NH4+-N均呈上升状态,第21 d分别达到284.14和347.68 mg·kg−1。这可能是因为,堆体的C/N较低,物料中有机氮源被微生物矿化分解,使硝化反应在高温环境下受阻,导致NH4+-N大量积累[16-17]。此趋势与红霉素和青霉素菌渣堆肥研究中NH4+-N的转化过程相似[5,18]。NH4+-N的浓度达到峰值后开始下降,且C组下降速率大于CK组,最终C组NH4+-N质量浓度略低于CK组。这表明,添加菌剂有利于保留堆体中的氮源。
EC是反映堆肥中的可溶性盐含量的指标。一般情况下,堆体的EC>4 mS·cm−1,对植物种子发芽有强烈的抑制作用。因此,对堆肥过程中EC的变化过程进行了研究,结果如图1(d)所示。堆体的EC变化趋势为先上升后下降,可能是前期随着物料的消耗,释放出矿物盐和铵根离子而上升。高温期后,有机质降解速率下降,由于CO2和NH3的挥发,导致EC下降,这与以往的研究结果相似[19]。2组堆肥中的EC峰值达到3.0和2.85 mS·cm−1,均未超过其应用限值,故不会对植物种子发芽产生较强的抑制。C组初始EC值高于CK组,但最终EC值分别为2.57和2.21 ms·cm−1,低于CK组,处于安全水平。这表明,添加菌剂有利于降低堆肥中的可溶性盐的含量。
2.2 堆肥毒性
堆肥过程中种子发芽率指数(GI)可在一定程度上代表堆肥产品对植物毒性的强弱。其变化如图2所示,2组堆肥初期GI均低于20%。这表明,土霉素菌渣有较强的植物毒性,在农田应用中可能会存在较大的环境风险[20]。由于堆肥初期物料中的有机酸和铵根离子浓度较高,故导致了堆体初期的GI偏低。随着堆肥的进行,在微生物的作用下,物料GI逐渐升高,逐步实现脱毒。当GI>80%时,认定堆肥产品对植物基本无毒,2组堆肥产品均达到安全水平。添加菌剂使C组比CK组处理时间提前了7 d。这表明,复合菌剂在一定程度上加强了堆肥对植物毒性的削减。最终产品的GI分别为94.8%和107.3%。添加菌剂后,在提高微生物的种类和活性的作用下,缩减了堆肥周期,加快了堆肥物料的脱毒。马骏[21]研究表明,牛粪堆肥产品的GI高达124%,远高于本研究结果。由此可推测,土霉素残留不仅对GI有抑制作用,且质量浓度越高其抑制效应越强。
2.3 堆肥肥效
随着堆肥的进行,微生物的生长发育消耗了一定的碳源,导致有机质质量分数下降。堆肥结束后C组中有机物质的降解率为14.80%,而CK组仅为9.24%。因此,投加复合菌剂可增加堆体中微生物的数量和活性,加快了对碳源的消耗,提高了堆肥过程的最高温度,可间接增强对有机质的降解。
对堆肥成品进行检测,检测指标参照《有机肥料标准》(NY/T525-2021)[22]中对肥料的要求,将检测结果同标准中要求值进行对比,其结果见表2。堆肥成品指标除水分的质量分数偏高外,其余指标均满足《有机肥料标准》(NY/T 525-2021)[22]中标准,在后续晾干过程中可降低其水分的质量分数。本研究结果可为抗生素菌渣及其衍生物的工程化好氧堆肥资源化利用提供数据支持和技术参考。
表 2 堆肥成品指标Table 2. Composting product index对照指标 本实验检测值 NY/T 525-2021指标值[22] 有机质的质量分数(以烘干基计) 57.3%~58.1% ≥30% 总养分(N+P2O5+K2O)的质量分数(以烘干基计) 5.7%~6.7% ≥4.0% 水分(鲜样)的质量分数 41.08%~43.04% ≤30% 种子发芽率指数(GI) 99.8%~107.3% ≥70% 机械杂质的质量分数 <0.3% ≤0.5% 2.4 菌剂对堆肥中土霉素降解及微生物群落结构变化影响
1)菌剂对堆肥中土霉素降解影响。堆体温度是堆肥过程中最重要的参数之一,与有机物降解程度和堆肥产物的腐熟程度密切相关。堆肥温度变化和土霉素降解变化间的关系如图3所示。堆肥期间,温度变化经历了升温期、高温期和降温腐熟期3个阶段。在堆肥第2天,2组温度分别达到54.56和52.66 ℃。其中,C组比CK组提前1 d达到最高温度,最高温度分别为70.55和66.57 ℃,且高温期延长了5 d。这可能是因为,堆肥初期CK组含有的土著微生物较少,微生物活性较差,难以迅速降解堆体中的有机物。堆肥38 d时,堆体温度与环境温度接近,堆肥发酵结束,有机质降解完全,实现了土霉素菌渣的无害化和资源化。马骏[21]研究发现,菌剂能提高堆肥温度,使最高温度达到80 ℃以上,高于本次堆肥温度。这可能是因为,制药菌渣中高浓度的重金属对高温期优势微生物菌群的抑制作用。ZHANG等[23]在泰乐菌素菌渣与污泥堆肥的研究中也表明,高浓度Cu能致使高温期温度不高,与本研究结果一致。
由图3(b)可知,土霉素降解趋势为先迅速下降,最后趋于稳定。CK组在堆肥21 d降解率为81.23%。这表明,堆肥处理可以降低土霉素残留。堆肥结束时,CK组土霉素质量分数为119.67 mg·kg−1,降解率达86.47%;C组土霉素质量分数为10 mg·kg−1,降解率高达98.87%(图3(c))。C组优于CK组,这与REN等[24]、ZHU等[25]、EZZARIAI等[26]、SARDAR等[27]和SARDAR等[28]的研究结果结果相似。土霉素降解主要发生在升温期及高温期。这一方面可能是,升温中键能较弱的四环素类分子中的C—N易断裂,导致羧基及哌嗪环断裂并脱去;另一方面可能是,温度升高增强了嗜温菌和嗜热菌的生物活性,进而提高了土霉素的降解。因此,高温是抗生素降解的重要影响因素,有利于将抗生素菌渣无害化和资源化[29]。
图3(d)是对2组降解曲线的一级动力学模拟图,CK组和C组R2分别为0.986和0.941。表3列出了堆肥过程中几种抗生素的半衰期,C组和CK组的半衰期分别为13.59和4.38。对比发现,CK组的半衰期最大。这表明,土霉素为难降解抗生素[30-31]。但是,C组的半衰期小于CK组。这说明,复合菌剂的添加有利于土霉素的降解。
表 3 土霉素降解的线性拟合方程、半衰期和R2Table 3. Linear fitting equation for oxytetracycline degradation, half-life, and R2组别 方程 斜率 R2 半衰期 数据来源 CK ln(C/C0)=−0.051x−0.632 −0.051 0.986 13.59 本研究 C ln(C/C0)=−0.158x−0.544 −0.158 0.941 4.38 本研究 红霉素 ln(C/C0)=−0.500x−0.604 −0.500 0.801 1.40 [26] 多环西素 ln(C/C0)=−0.183x−0.638 −0.183 0.765 3.80 [26] 诺氟沙星 ln(C/C0)=−0.328x−0.689 −0.328 0.894 2.10 [26] 青霉素 ln(C/C0)=−0.798x−0.697 −0.798 0.962 1.72 [30] 庆大霉素 ln(C/C0)=−0.116x−0.087 −0.116 0.985 6.70 [31] 2)菌剂对堆肥中微生物群落结构影响。2组堆肥处理中细菌群落组成在门水平和属水平的相对丰度见图4。C组堆肥样品细菌、真菌和病毒所占的比例分别为94.86%、0.21%和0.97%。细菌主要由放线菌门Actinobacteria、变形菌门Proteobacteria、厚壁菌门Firmicutes和拟杆菌门Bacteroidetes组成。细菌群落在高温期变化较大,而土霉素降解也主要发生在高温期。这表明,土霉素降解可能与其微生物群落变化有密切关系。在堆肥初期,C组中Firmicutes增加到40.03%,Proteobacteria从68.45%降低到9.55%。此时优势菌群为Firmicutes和Actinobacteria,其耐受力强,释放热量促使堆体升温。在升温期,C组中Firmicutes和Bacteroidetes相对丰度分别增加了10.1%和2.5%,Actinobacteria减少了15%。在高温期后,Firmicutes和Bacteroidetes相对丰度分别增加了12.27%和5.7%。堆肥结束时,细菌中Actinobacteria数量下降到4.49%,真菌数量下降到0.16%,病毒降低到0.72%。这说明,土霉素菌渣对细菌、放线菌和真菌生长均有不同程度的抑制。此外,在堆肥过程中,子囊菌门Ascomycota只出现在高温期,随堆肥的进行其相对丰度降低,Ascomycota可能为致病菌,故堆肥有利于致病菌的去除。此结果与PENG等[32]的研究结果相似。
从属水平上分析细菌相对丰度,堆肥升温期,以Acetobacter为代表的1类好氧或兼性厌氧的杆状菌群能够分解堆料,提高堆体温度。在堆肥第22 d,堆体中优势菌群以Saccharomonospora和Bacillus为代表,Saccharomonospora具有较强的蛋白酶、淀粉酶和脂肪酶活性,有较强的有机质分解能力;Bacillus为木质纤维素降解菌。因此,C组堆肥产物中纤维素和半纤维素含量的下降可能与Bacillus菌群数量的增加有关。堆肥高温期,C组的优势菌属无论在功能还是数量上都比CK组能更好的加速堆肥进程。而且,CK组中反硝化细菌存在较多,降低了堆体中氮的含量,导致氮元素缺少,不利于菌渣堆肥产品向有机肥方向发展。在堆肥第38 d,由于复合菌剂中存在Geobacillusthermodenitrificans,因此堆体中优势菌群以Geobacillus为代表,其可分解菌渣中的蛋白质,进而提高抗生素降解率。
3)环境因子和细菌群落之间的相关性分析。环境因素(pH、残留土霉素、温度、C/N)与细菌群落(基于门的丰度)的RDA分析结果如图5所示。RDA1和RDA2分别解释了细菌群落和环境因子总变异的72.85%和42.09%。这表明,残留土霉素的变化主要受细菌群落变化的影响。随着堆肥的进行,Firmicutes减少,而其他菌群在升温期和高温期增加,促进了土霉素的降解。这表明,Firmicutes和Actinobacteria是降解土霉素的优势菌群。在堆肥初期,残留土霉素和C/N是影响堆肥进程的主要因素。然而,在高温和降温阶段,pH和温度成为影响堆肥效果的主要因素。且RAMASWAMY等[33]和BAO等[34]的研究也表明,pH、温度以及微生物的活性在降解抗生素过程中起重要作用。因此,在堆肥过程中,土霉素残留的变化和温度、微生物群落的变化有着密不可分的关系。堆肥结束时,C组土霉素质量浓度小于CK组。这表明,添加菌剂可提高微生物种类和活性以及堆体温度,促进了土霉素的降解。
综上所述,细菌群落的演替和环境因素的变化都会影响土霉素的降解。因温度变化而引起的不同细菌丰度在不同堆肥阶段的差异,可能是残留抗生素随堆肥过程变化的内在机制。接种菌剂既改变了堆肥土著细菌群落的互作模式,降低了细菌群落的复杂度,又为优化建立新的和更健康的堆肥细菌群落奠定了基础。
3. 结论
1) C组的NH4+-N浓度比CK组提前7 d降至腐熟堆肥的安全浓度范围内。堆肥后的成品基本可以满足《有机肥料标准》(NY/T525-2021),复合菌剂在促进堆肥腐熟和氮磷保留中具有良好的效果。
2)复合菌剂增加了堆体中微生物活性,延长了高温期5 d;C组的土霉素降解率高达98.41%,比CK组高12.39 %。这表明,菌剂堆肥化处理在提高堆体温度的同时提高了土霉素降解率。
3)在堆肥中,优势门为Firmicutes和Actinobacteria,土霉素残留的变化与其密切相关。因温度变化而造成的不同细菌丰度在不同堆肥阶段的差异可能是引起残留抗生素随堆肥过程变化的原因。
-
表 1 堆肥原料基本理化性质
Table 1. Basic physical and chemical property of compost raw materials
供试样品 含水率/% pH 电导率EC/(mS·cm−1) C/N 玉米秸秆 9.89 5.32 2.67 50.89 土霉素菌渣 78.04 4.47 — 5.73 表 2 堆肥成品指标
Table 2. Composting product index
对照指标 本实验检测值 NY/T 525-2021指标值[22] 有机质的质量分数(以烘干基计) 57.3%~58.1% ≥30% 总养分(N+P2O5+K2O)的质量分数(以烘干基计) 5.7%~6.7% ≥4.0% 水分(鲜样)的质量分数 41.08%~43.04% ≤30% 种子发芽率指数(GI) 99.8%~107.3% ≥70% 机械杂质的质量分数 <0.3% ≤0.5% 表 3 土霉素降解的线性拟合方程、半衰期和R2
Table 3. Linear fitting equation for oxytetracycline degradation, half-life, and R2
组别 方程 斜率 R2 半衰期 数据来源 CK ln(C/C0)=−0.051x−0.632 −0.051 0.986 13.59 本研究 C ln(C/C0)=−0.158x−0.544 −0.158 0.941 4.38 本研究 红霉素 ln(C/C0)=−0.500x−0.604 −0.500 0.801 1.40 [26] 多环西素 ln(C/C0)=−0.183x−0.638 −0.183 0.765 3.80 [26] 诺氟沙星 ln(C/C0)=−0.328x−0.689 −0.328 0.894 2.10 [26] 青霉素 ln(C/C0)=−0.798x−0.697 −0.798 0.962 1.72 [30] 庆大霉素 ln(C/C0)=−0.116x−0.087 −0.116 0.985 6.70 [31] -
[1] WANG M, CAI C, ZHANG B, et al. Characterization and mechanism analysis of lincomycin biodegradation with Clostridium sp. strain LCM-B isolated from lincomycin mycelial residue (LMR)[J]. Chemosphere, 2018, 193: 611-617. doi: 10.1016/j.chemosphere.2017.11.055 [2] WANG R, ZHANG J, SUI Q, et al. Effect of red mud addition on tetracycline and copper resistance genes and microbial community during the full scale swine manure composting[J]. Bioresource Technology, 2016, 216: 1049-1057. doi: 10.1016/j.biortech.2016.06.012 [3] ZHANG J, LIN H, MA J, et al. Compost-bulking agents reduce the reservoir of antibiotics and antibiotic resistance genes in manures by modifying bacterial microbiota[J]. Science of the Total Environment, 2019, 649: 396-404. doi: 10.1016/j.scitotenv.2018.08.212 [4] 栾润宇, 高珊, 徐应明, 等. 不同钝化剂对鸡粪堆肥重金属钝化效果及其腐熟度指标的影响[J]. 环境科学, 2020, 41(1): 469-478. [5] 赵军超. 红霉素菌渣与猪粪好氧堆肥处理研究[D]. 杨凌: 西北农林科技大学, 2019. [6] 曹云, 黄红英, 孙金金, 等. 超高温预处理对猪粪堆肥过程碳氮素转化与损失的影响[J]. 中国环境科学, 2018, 38(5): 1792-1800. doi: 10.3969/j.issn.1000-6923.2018.05.024 [7] 勾长龙, 王雨琼, 张喜庆, 等. 高温堆肥对猪粪中四环素类抗生素及抗性基因的影响[J]. 环境科学学报, 2017, 37(4): 1454-1460. [8] YANG L, JIE G, ZHANG S Q, et al. Effects of adding compound microbial inoculum on microbial community diversity and enzymatic activity during co-composting[J]. Environmental Engineering Science, 2018, 35(4): 270-278. doi: 10.1089/ees.2016.0423 [9] 李玮琳, 张昕, 马军伟, 等. 抗生素降解菌剂对猪粪堆肥腐熟和细菌群落演替的影响[J]. 环境科学, 2022: 1-13. [10] 刘艳婷, 郑莉, 宁寻安, 等. 微生物菌剂对畜禽粪便好氧堆肥过程中重金属钝化与氮转化的影响[J]. 环境科学学报, 2020, 40(6): 2157-2167. [11] 周营, 朱能武, 刘博文, 等. 微生物菌剂复配及强化厨余垃圾好氧堆肥效果分析[J]. 环境工程学报, 2018, 12(1): 294-303. doi: 10.12030/j.cjee.201703044 [12] GUO H H, GU J, WANG X J, et al. Elucidating the effect of microbial inoculum and ferric chloride as additives on the removal of antibiotic resistance genes from chicken manure during aerobic composting[J]. Bioresource Technology, 2020, 309: 122802. doi: 10.1016/j.biortech.2020.122802 [13] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 木材含水率测定方法: GB/T 1931-2009[S]. 北京: 人民出版社, 2009. [14] AWASTHI M K, WANG Q, HUANG H, et al. Influence of zeolite and lime as additives on greenhouse gas emissions and maturity evolution during sewage sludge composting[J]. Bioresource Technology, 2016, 216: 172-181. doi: 10.1016/j.biortech.2016.05.065 [15] JIANG T, MA X, YANG J, et al. Effect of different struvite crystallization methods on gaseous emission and the comprehensive comparison during the composting[J]. Bioresource Technology, 2016, 217: 219-226. doi: 10.1016/j.biortech.2016.02.046 [16] YUAN J, CHADWICK D, ZHANG D, et al. Effects of aeration rate on maturity and gaseous emissions during sewage sludge composting[J]. Waste Management, 2016, 56: 403-410. doi: 10.1016/j.wasman.2016.07.017 [17] WU S, SHEN Z, YANG C, et al. Effects of C/N ratio and bulking agent on speciation of Zn and Cu and enzymatic activity during pig manure composting[J]. International Biodeterioration & Biodegradation, 2017, 119: 429-436. [18] ZHANG S, CHEN Z, WEN Q, et al. Effectiveness of bulking agents for co-composting penicillin mycelial dreg (PMD) and sewage sludge in pilot-scale system[J]. Environmental Science & Pollution Research, 2016, 23: 1362-1370. [19] 李赟, 袁京, 李国学, 等. 辅料添加对厨余垃圾快速堆肥腐熟度和臭气排放的影响[J]. 中国环境科学, 2017, 37(3): 1031-1039. [20] 张红娟, 郭夏丽, 王岩. 林可霉素菌渣与牛粪联合堆肥实验研究[J]. 环境工程学报, 2011, 5(1): 231-234. [21] 马骏. 畜禽养殖废弃物超高温堆肥技术研究[D]. 石家庄: 河北科技大学, 2021. [22] 中华人民共和国农业农村部. 有机肥料标准: NY/T 525-2021[S]. 北京: 中国农业出版社, 2021. [23] ZHANG B, WANG M M, WANG B, et al. The effects of bio-available copper on macrolide antibiotic resistance genes and mobile elements during tylosin fermentation dregs co-composting[J]. Bioresource Technology, 2018, 251: 230-237. doi: 10.1016/j.biortech.2017.12.051 [24] REN S T, LU A, GUO X Y, et al. Effects of co-composting of lincomycin mycelia dregs with furfural slag on lincomycin degradation, degradation products, antibiotic resistance genes and bacterial community[J]. Bioresource Technology, 2019, 272: 83-91. doi: 10.1016/j.biortech.2018.10.014 [25] ZHU N, GAO J, LIANG D, et al. Thermal pretreatment enhances the degradation and humification of lignocellulose by stimulating thermophilic bacteria during dairy manure composting[J]. Bioresource Technology, 2021, 319: 124149. doi: 10.1016/j.biortech.2020.124149 [26] EZZARIAI A, BARRET M, MERLINA G, et al. Evaluation of the antibiotics effects on the physical and chemical parameters during the co-composting of sewage sludge with palm wastes in a bioreactor[J]. Waste Management, 2017, 68: 388-397. doi: 10.1016/j.wasman.2017.06.036 [27] SARDAR M F, ZHU C X, GENG B, et al. Enhanced control of sulfonamide resistance genes and host bacteria during thermophilic aerobic composting of cow manure[J]. Environmental Pollution, 2021, 275: 124403. [28] SARDAR M F, ZHU C X, GENG B, et al. The fate of antibiotic resistance genes in cow manure composting: shaped by temperature-controlled composting stages[J]. Bioresource Technology, 2021, 320: 124403. doi: 10.1016/j.biortech.2020.124403 [29] 郭夏丽, 席晓黎, 张红娟, 等. 抗生素菌渣堆肥进程中微生物群落的变化[J]. 环境工程学报, 2012, 6(12): 4671-4675. [30] LIU Y, FENG Y, CHENG D, et al. Gentamicin degradation and changes in fungal diversity and physicochemical properties during composting of gentamicin production residue[J]. Bioresource Technology, 2017, 244: 905-912. doi: 10.1016/j.biortech.2017.08.057 [31] CHEN Z, ZHANG S, WEN Q, et al. Effect of aeration rate on composting of penicillin mycelia dreg[J]. Journal of Environmental Science, 2015, 37: 172-178. doi: 10.1016/j.jes.2015.03.020 [32] PENG S, LI H, SONG D, et al. Influence of zeolite and superphosphate as additives on antibiotic resistance genes and bacterial communities during factory-scale chicken manure composting[J]. Bioresource Technology, 2018, 263: 393-401. doi: 10.1016/j.biortech.2018.04.107 [33] RAMASWAMY J, PRASHER S O, PATEL R M, et al. The effect composting on the degradation of a veterinary pharmaceutical[J]. Bioresource Technology, 2010, 101(7): 2294-2299. doi: 10.1016/j.biortech.2009.10.089 [34] BAO Y Y, ZHOU Q X, GUAN L Z, et al. Depletion of chlortetracycline during composting of aged and spiked manures[J]. Waste Management, 2009, 29(4): 1416-1423. doi: 10.1016/j.wasman.2008.08.022 -




 DownLoad:
DownLoad: