-
高氮磷废水的过量排放会导致水体富营养化和生态破坏[1]。微藻是一种光合微生物,能够吸收氮、磷和有机物等,被用处理各种废水[2]。另一方面,微藻细胞脂类含量高是生物柴油生产的主要原料[3-9],因此,将废水处理与微藻生物量生产相结合可以降低二者生产成本。由于微藻对废水中氮/磷的去除是藻细胞生长代谢的结果即平均去除速率和去除率与藻细胞生长速率和生物量呈正相关,而部分细菌和真菌能够促进微藻的生长(如地衣中的细菌和真菌促进其共生绿藻的生长),因此,将微藻与细菌[10-16]或者真菌[17-26]混合培养,利用微藻和细菌或者真菌之间的协同效应促进微藻生长进而提高氮/磷的去除率成为研究热点。
雨生红球藻能够在适宜的条件下快速吸收氮和磷进行自养/混合营养生长,而在不利条件下大量合成脂类和高附加值的虾青素(一种红色类胡萝卜素)[27-28],目前已被用于处理不同的废水,并取得了良好的效果[29-33]。然而,与其他藻类相比,雨生红球藻对有害细菌更敏感,这些细菌严重抑制藻细胞生长,限制了其在废水处理中的应用。实际上,有害细菌对所有微藻的生长均构成严重威胁[34]。为了控制微藻培养过程中的有害细菌,通常采用的方法为添加抗生素、高温处理、强光照射[35-36],以及使用次氯酸钠对废水进行预处理[37]。因此,有效控制有害细菌是利用微藻尤其是雨生红球藻处理废水的关键问题。
在此前的研究[37-38]中我们分离到一种蓝藻共生真菌Simplicillium lanosoniveum(DT06)。DT06能够合成一种新抗生素[39]并且能促进衣藻(Chlamydomonas reinhardtii)生长和脂类合成[40]。因此,本研究将雨生红球藻与真菌DT06在高含氮磷废水中混合培养,以期提高雨生红球藻类生长速率和产量以及废水氮/磷的去除速率和去除率。
-
1)废水样本。废水来自天津市的某污水处理厂。废水通过0.45 µm滤膜去除不溶性大分子物质,并在4 ℃保存。废水主要性质如下:pH为6.5±0.4;总氮(TN)质量浓度为(553.8±17) mg·L–1;总磷(TP)质量浓度为(90.7±8) mg·L–1,化学需氧量(COD)为(750±22) mg·L–1。
2)微生物菌株。雨生红球藻购自中国武汉水生生物研究所;真菌Simplicillium lanosoniveum DT06由河北工业大学代谢工程与生物合成实验室分离获得,并保藏于中国科学院微生物学研究所菌物标本馆(编号HMAS 242045)。
-
1)微藻接种液:5 mL雨生红球藻培养液接种到装有60 mL BBM培养基[27]的100 mL锥形瓶中,置于光照摇床中培养7 d(115 r·min–1、25 °C恒温、60 μmoL·(m2·s)–1持续光照)。雨生红球藻接种液最终的细胞浓度为1.5×105 细胞·mL–1。
2)真菌孢子悬浮液:将真菌DT06划线于PDA培养基平板上,于培养箱(28 ℃)中恒温培养7 d后,从菌落表面轻轻刮取收集DT06孢子,并悬浮于50 mL无菌水中。真菌孢子悬浮液最终细胞浓度为5×106 细胞·mL–1。雨生红球藻细胞和真菌DT06孢子的数量均通显微镜进行计数。
-
雨生红球藻与真菌DT06混合培养(简称M组):按10%接种量将雨生红球藻接种到含有200 mL废水的500 mL锥形瓶中,并分别接种对应体积的DT06孢子悬浮液,以达到5∶1、10∶1、30∶1、50∶1的细胞数量接种比例(雨生红球藻:DT06)。以雨生红球藻单独培养(1∶0,雨生红球藻:DT06)作为对照(CK)。
雨生红球藻-DT06混合添加NaHCO3培养(简称MC组):在每组含有200 mL废水的500 mL锥形瓶中分别添加不同体积的NaHCO3母液(10 g·L–1),使NaHCO3质量浓度达到0(对照,MCK)、0.2、0.4、0.6和0.8 g·L–1,以最佳细胞接种比例分别接种雨生红球藻和DT06孢子悬浮液。
所有实验均置于光照培养箱中培养12 d(25 °C恒温、60 μmoL·(m2·s)–1持续光照),每天手摇2次,每组实验设置3个重复。
-
1)雨生红球藻生物量。雨生红球藻生物量以细胞干重表示,每隔2 d取培养液并采用显微镜计数法计数,根据式(1)计算雨生红球藻生物量,根据式(2)计算雨生红球藻比生长速率。
式中:X为细胞干质量,g·L–1;N为细胞浓度, 细胞·mL–1;μ为比生长速率,d−1;X0和Xn分别为第t0天和第tn天的雨生红球藻生物量,g·L–1。
2)细菌总数。根据实验室之前的方法[40-42]对废水中细菌总数做了部分修改。灭菌的LB琼脂板接种1 mL稀释105倍的废水样品,并在培养实验相同的条件下培养3 d。总细菌数表示为每毫升菌落形成单位(CFU·mL−1)。
3)废水水质。每隔两天取废水样本进行分析。总氮使用过硫酸钾氧化紫外分光光度法;总磷使用钼锑抗分光光度法;COD 使用重铬酸盐法测定;氮、磷的去除率和去除速率根据式(3)和式(4)进行计算。
式中:N为COD和氮、磷的去除率,%;R为COD和氮、磷的去除速率,mg·(L·d)–1;N0和Nt分别为第t0天和第tn天的COD和氮、磷质量浓度,mg·L–1。
4)脂类和虾青素含量。 雨生红球藻脂类和虾青素含量参照我们此前的方法[43]测定。
-
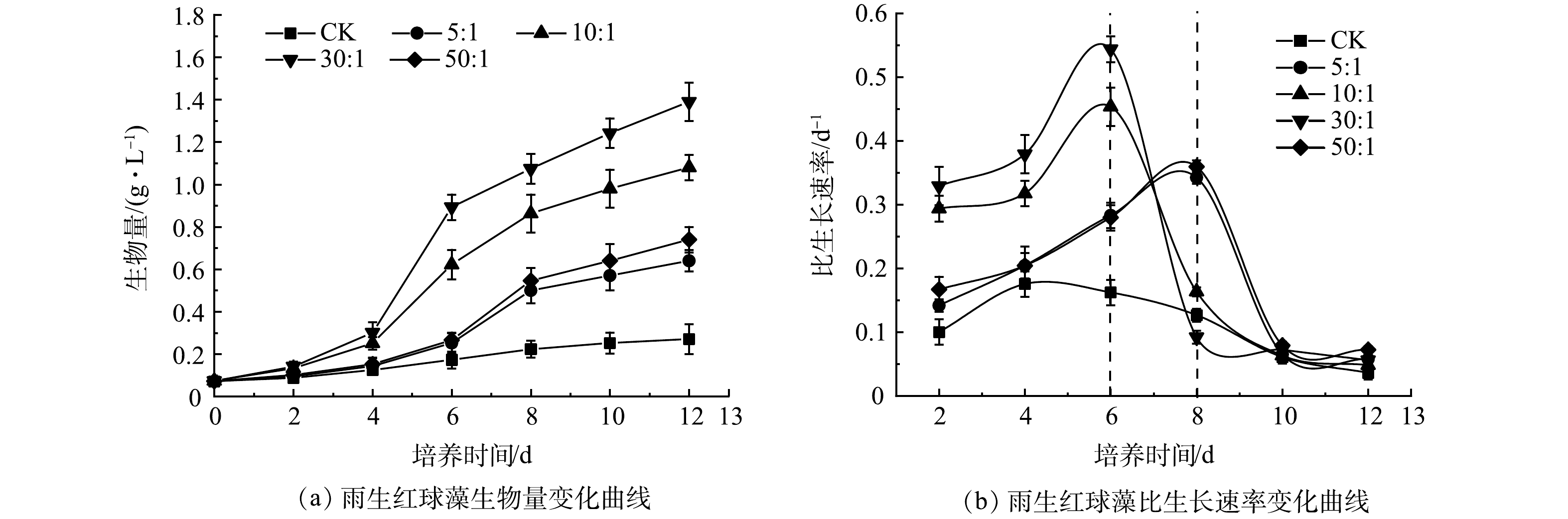
1)混合培养对微藻生长的影响。如图1(a)所示,CK中雨生红球藻的生物量在前8 d内缓慢上升,第10天后趋于平稳,最终达到0.27 g·L–1;而雨生红球藻与DT06混合培养过程中雨生红球藻的生物量在前4 d缓慢上升(适应期),在第6天(10:1、30:1)和第8天(5:1、50:1)快速上升,第8天后趋于平稳。最终,雨生红球藻的生物量在5:1、10:1、30:1和50:1下分别为0.64、1.08、 1.39 和 0.74 g·L–1。
生长动力学分析结果(图1(b))显示, CK中雨生红球藻的比生长速率在第4天达到最大值(0.18 d–1),第6天后逐渐降低至0。雨生红球藻与DT06混合培养过程中雨生红球藻的比生长速率均高于CK。比生长速率在10∶1和30∶1时在第6天达到最大值,分别为0.45 d−1和0.54 d−1;在5∶1和50∶1时在第8天达到最大值,分别为0.34 d−1和0.36 d−1。比生长速率此后逐渐降低至0。雨生红球藻与DT06混合培养过程中30∶1表现出最高的生长速率和最高平均比生长速率(0.25 d−1),因此,后续实验以最佳藻菌细胞比30∶1进行实验。
混合培养中藻类生物量的增加是由于比生长速率的提高,这可归因于2个方面:1)藻类(雨生红球藻)和真菌DT06的共生作用。DT06释放CO2促进雨生红球藻光合作用,并吸收雨生红球藻释放的O2进行有氧代谢,从而解除O2对藻类生长的抑制作用,这与其他菌藻混合培养类似[27,44-47];2)抑制有害细菌的生长。与混合培养相比,对照的生物量异常低,比生长速率过早地下降,表明废水中有害细菌对藻类的生长有显著的抑制作用,混合培养中的生物量持续增加表明DT06释放的抗生素表现出对有害细菌显著的抑制作用。
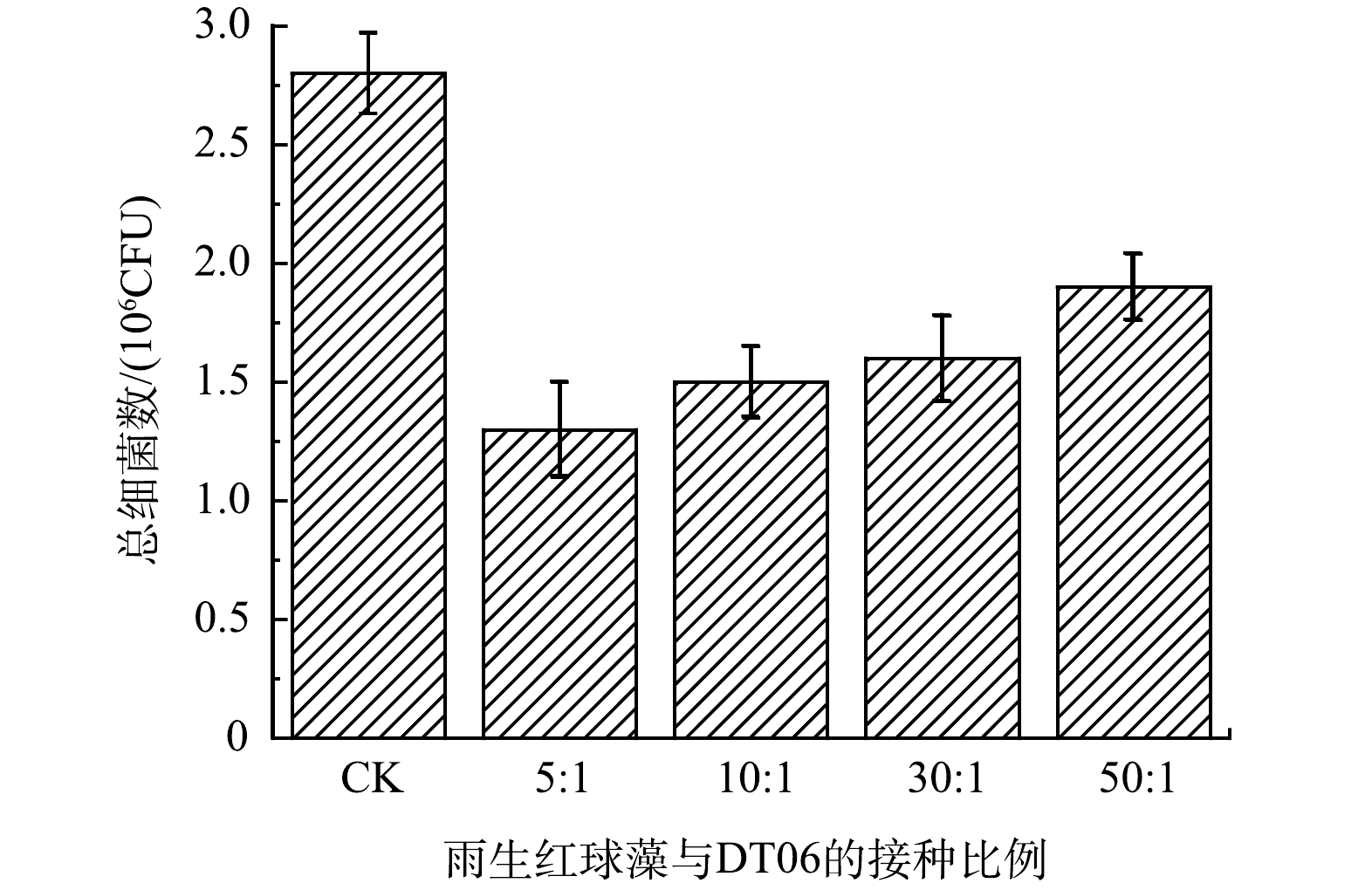
2)总细菌数。如图2所示,实验结束时5∶1、10∶1、30∶1和50∶1中细菌总数分别为1.3、1.5、1.6、1.9×106 CFU。雨生红球藻与DT06混合培养过程中的细菌总数与CK(2.8×106 CFU)相比分别下降了54.8%、46.4%、42.9%和30.4%。这表明DT06能够抑制废水中细菌的增长。
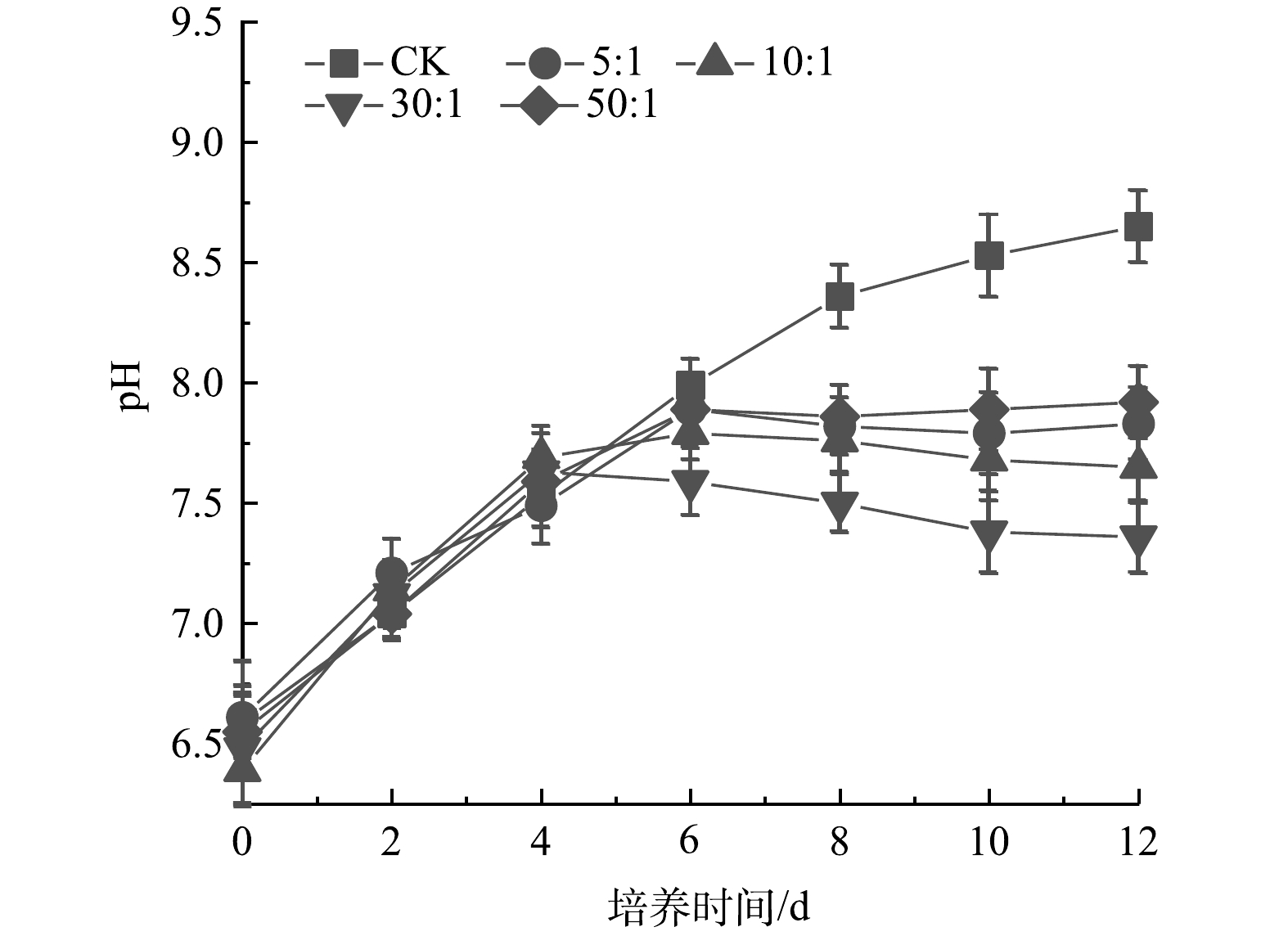
3)如图3所示,CK中pH持续上升,在实验结束时达到8.65。雨生红球藻与DT06混合培养过程中pH在前4 d持续升高,之后保持相对稳定且显著低于CK。实验结束时5: 1、10: 1、30: 1和50: 1的pH分别稳定在7.83、7.65、7.36和7.92。pH快速升高主要原因是雨生红球藻吸收了生理碱性盐(如硝酸盐)。混合培养中pH保持相对稳定,原因是真菌DT06释放的CO2中和培养液的碱性以及雨生红球藻吸收废水中的NH4+降低了培养液的pH。
4)混合培养对COD去除的影响。如图4(a)所示,CK中COD下降缓慢,最终的去除率仅为28.5%,平均去除速率为18.4 mg·(L·d)–1(图4(b))。这表明雨生红球藻和原有的微生物对耗氧有机物(以COD计)的降解能力有限。而在30∶1、10∶1、5∶1和50∶1中,COD分别在第4、6和8天内降至0(去除率100 %)(图4(a)),平均去除率分为183.9、127. 4、96. 8、93.1 mg·(L·d)–1 (图4(b))。结果表明,废水中的难降解耗氧有机化合物(以COD计)可被DT06完全降解为小分子物质和CO2,这些小分子物质被雨生红球藻利用进行混合营养生长。因此,在难降解有机化合物完全降解前后,雨生红球藻的比生长速率快速上升,之后迅速下降(图1(b))。
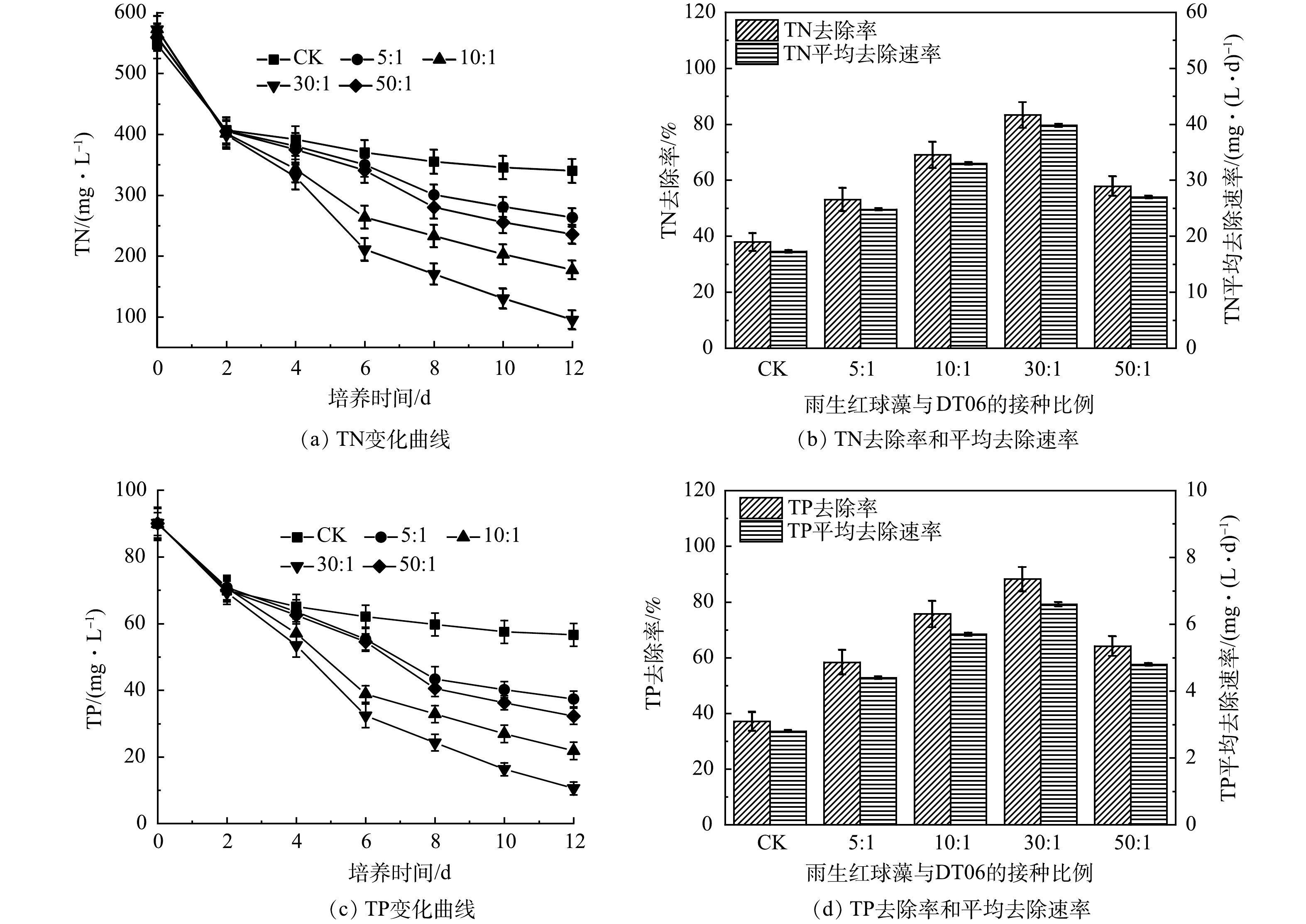
5)混合培养对氮磷去除的影响。如图5(a)所示,CK中TN质量浓度在前2 d迅速下降,之后缓慢下降,最终达到340 mg·L–1,去除率为37.9 %,平均去速除率为17.3 mg·(L·d)–1 (图5(b))。相比之下,雨生红球藻与DT006混合培养过程中TN质量浓度持续下降,下降速度均高于CK(图5(a))。其中, 30∶1中TN去除率最高为83.33%,平均去除速率为39.8 mg·(L·d)–1。而5∶1、10∶1、50∶1中TN的平均去除速率分别为24.8、33.0、27.0 mg·(L·d)–1;去除率分别为53.1%、69.1 %、57.9 % (图5(b))。
TP变化与TN变化规律相似(图5(c)),TP在CK中下降最慢,最终为56.6 mg·L–1;在 30:1中下降最快,最终为10.6 mg·L–1。最低和最高的TP去除率分别为37.1%和88.2%,平均TP去除率分别为2.8 mg·(L·d)–1和6.6 mg·(L·d)–1 (图5(d))。
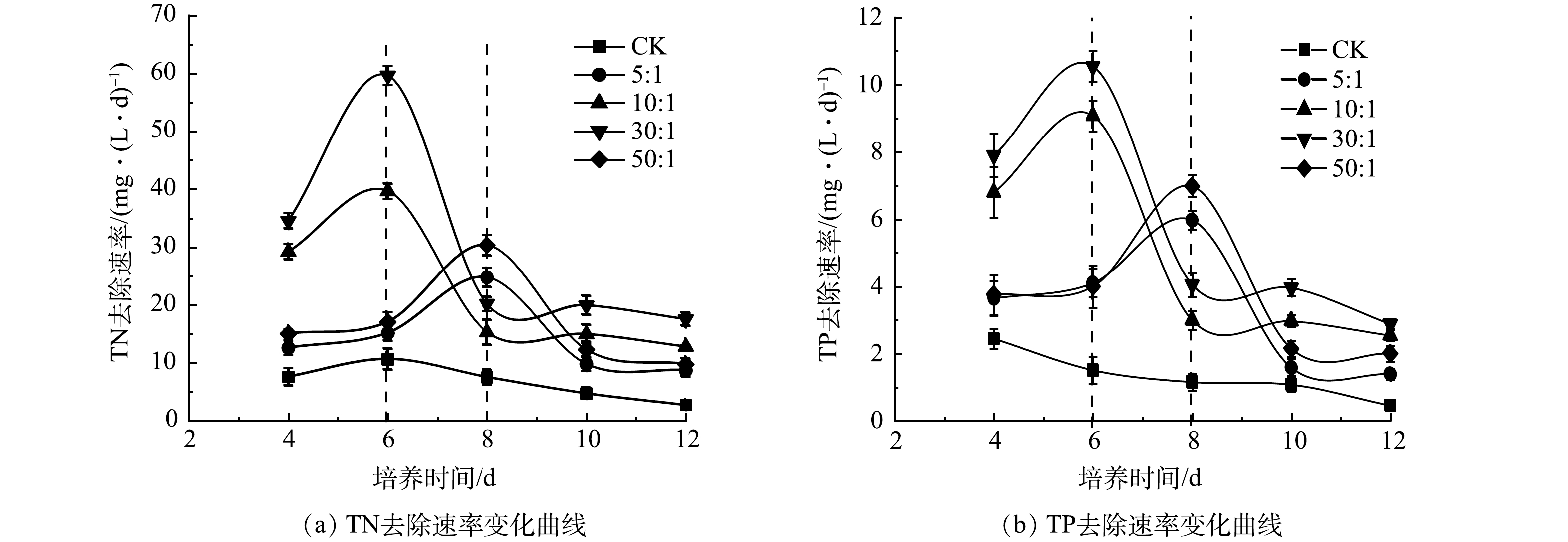
混合培养氮、磷去除率的提高归因于藻类生长速率的提高。如图6所示,在第6天和第8天之前,所有混合培养中的TN和TP去除速率持续增加,随后骤然下降,这与雨生红球藻比生长速率在初始升高和随后下降一致(图1(b))。而如上所述,雨生红球藻比生长速率的骤然下降主要是由于雨生红球藻进行快速异养生长对作为碳源的COD的快速消耗。也就是说,混合培养中有机碳源(如COD)的存在促进了雨生红球藻的生长,进而提高氮、磷的去除率。然而,在实验结束时,雨生红球藻与DT06混合培养组中残余的氮、磷含量仍然很高(图5(a)和5(c))。因此,在混合培养中需要添加额外的碳源来进一步提高氮、磷的去除率。
有研究表明,添加有机碳源会造成不可避免的二次污染[47],并提高废水处理成本。廉价的无机碳源,例如碳酸氢盐(NaHCO3),是产生HCO3−促进雨生红球藻光合营养生长的最佳替代物。因此,为了进一步提高氮磷去除率,本研究在最佳细胞接种比例30∶1的基础上添加NaHCO3进行后续的实验。
-
1)添加NaHCO3混合培养对微藻生长的影响。如图7(a)所示,MCK中雨生红球藻生物量在第4天后快速上升,第6天后缓慢上升,最终达到1.36 g·L–1。而添加NaHCO3混合培养过程中雨生红球藻的生物量在第2天后快速上升,第8天后达到稳定期,最终添加0.2、0.4、0.6、0.8 g·L–1 NaHCO3中雨生红球藻的生物量分别为1.58、1.71、1.95、1.44 g·L–1。生长动力学分析结果表明(图7(b)),添加NaHCO3混合培养组中雨生红球藻的比生长速率在第2天上升,并在第4天达到最大值,随后快速下降。添加0.6 g·L–1 NaHCO3中雨生红球藻的比生长速率最高,为0.85 d–1,比MCK(0.51 d–1)高1.66倍。以上结果表明混合培养中添加0.6 g·L–1 的NaHCO3最适合雨生红球藻的生长。
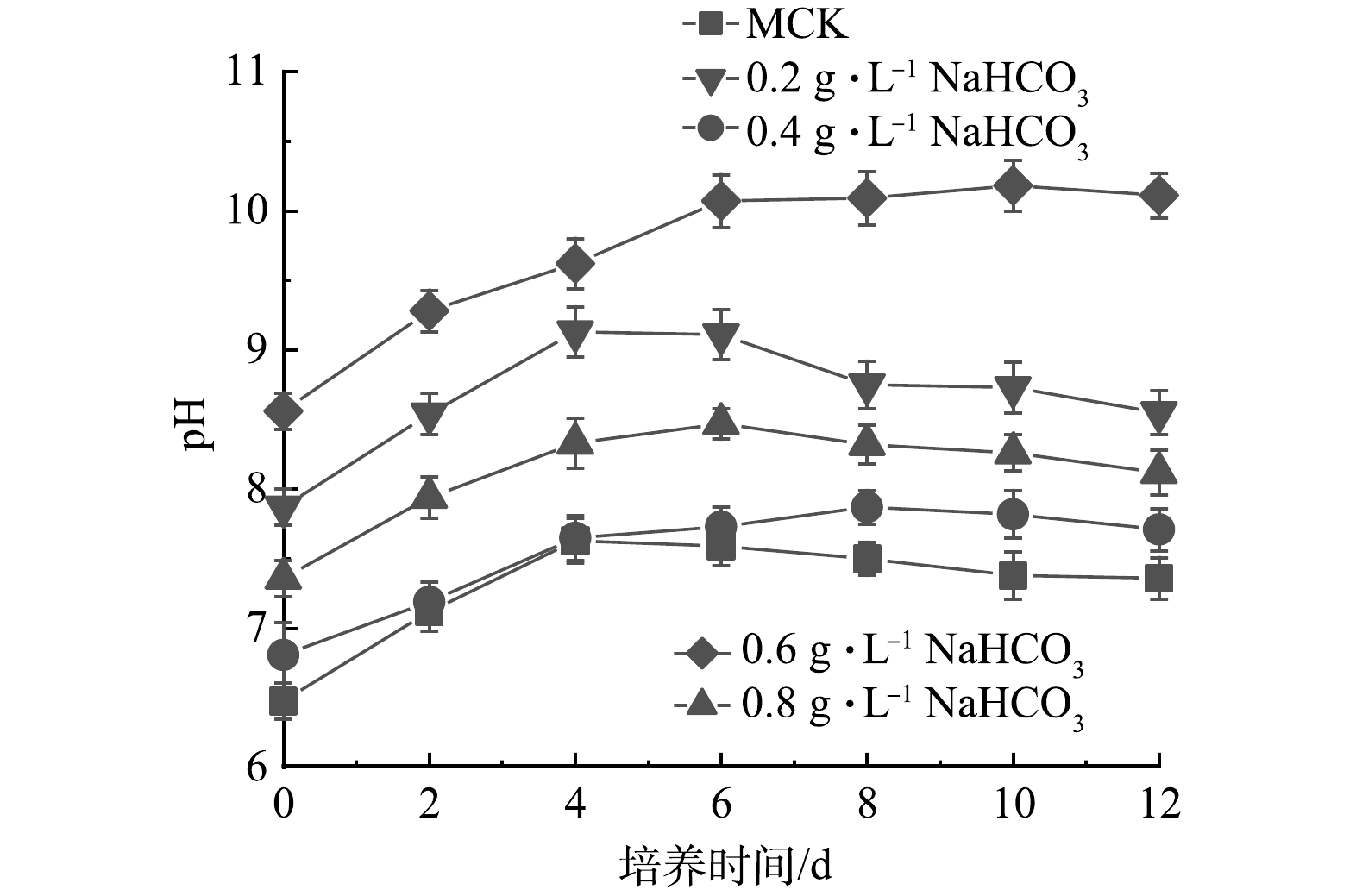
与MCK相比,添加NaHCO3混合培养过程中雨生红球藻的适应期缩短,比生长速率有所升高。这表明NaHCO3产生的HCO3−被雨生红球藻同化为光合底物,从而促进微藻的光合作用。而延长的指数期和比生长速率的下降是由于以下2点:HCO3−的吸收导致pH升高限制了雨生红球藻细胞的生长, 这也是添加0.8 g·L–1 NaHCO3中雨生红球藻的生物量低于添加0.6 g·L–1 NaHCO3的原因(图8);废水中氮、磷质量浓度的下降(图9)导致雨生红球藻细胞生长停止以及孢子的形成(图7)。
2)如图8所示,MCK 中pH在前4 d持续升高,之后稳定在7.3~7.5直到实验结束。由于添加了NaHCO3,添加NaHCO3混合培养过程中初始pH均高于MCK。添加0.2、0.4和0.6 g·L–1 NaHCO3的pH在前4 d逐渐升高,之后保持相对稳定,实验结束时pH分别7.71、8.12和8.55。而添加0.8 g·L–1 NaHCO3的pH持续升高,最终达到10.11。
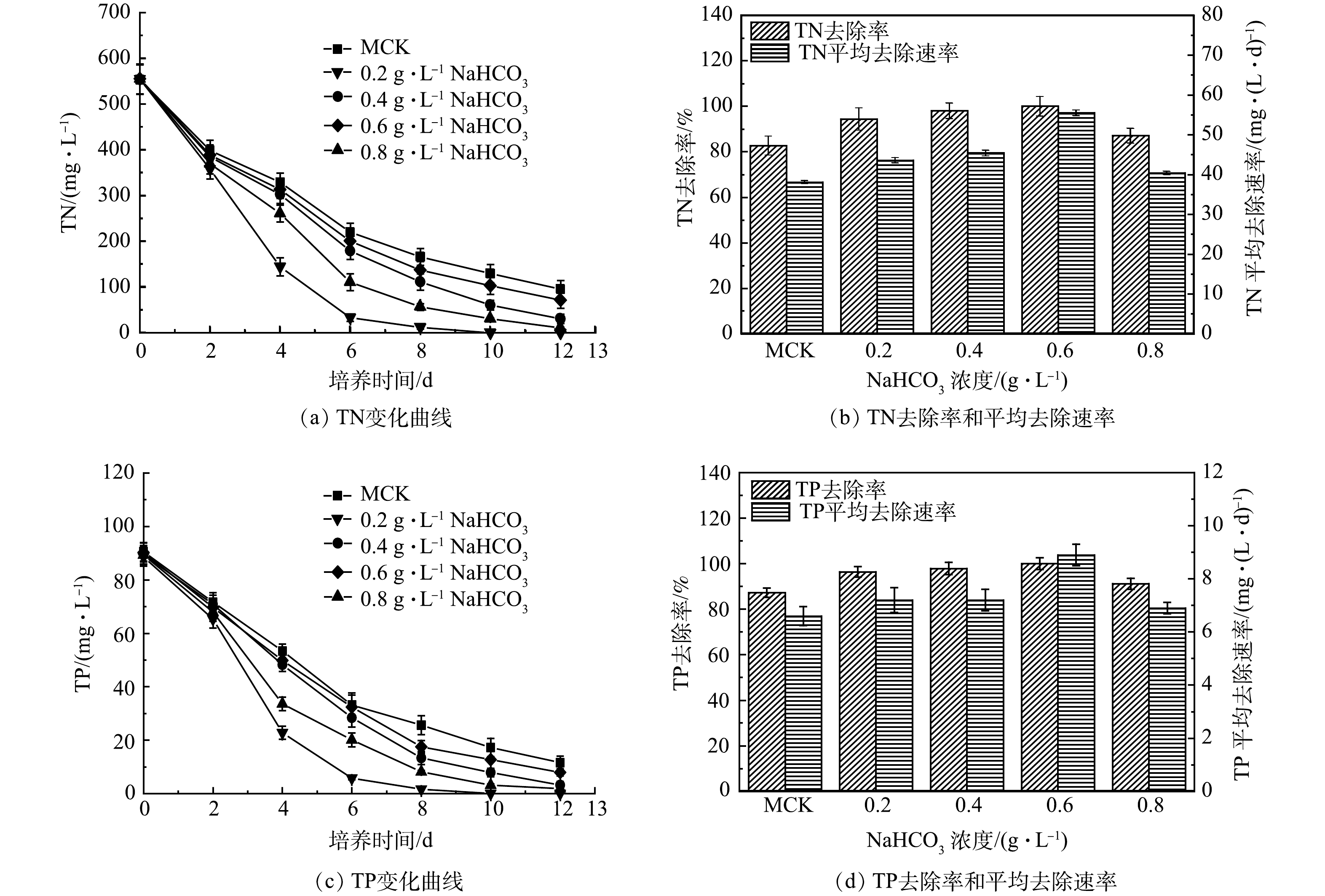
3)添加NaHCO3混合培养过程中混合培养对氮磷去除的影响。如图9(a)所示,添加NaHCO3混合培养过程中TN质量浓度急剧下降。其中添加0.6 g·L–1 NaHCO3中TN质量浓度下降最快,在第10天达到检出限,达到最高去除率(100%),平均去除速率为55.5 mg·(L·d)–1 (图9(b))。相比之下,添加0.2、0.4、0.8 g·L–1 NaHCO3和MCK中TN质量浓度下降缓慢,最终分别为30.8、10.9、71.5和95.7 mg·L–1。添加0.2、0.4、0.8 g·L–1 NaHCO3和MCK中TN平均去除速率分别为 43.6、45.4、40.4、38.1 mg·(L·d)–1,去除率分别为94.4%、98%、87.1%、82.7%。
TP变化与TN变化规律相似,TP质量浓度在添加0.6 g·L–1 NaHCO3中的第8天便达到检出限,达到最高去除率100%,平均去除速率为8.9 mg·(L·d)–1。而添加0.2、0.4、0.8 g·L–1 NaHCO3和MCK中TP质量浓度在实验结束时分别为3.2、1.9、7.9和11.6 mg·L–1(图9(c))。添加0.2、0.4、0.8 g·L–1 NaHCO3和MCK中TP平均去除速率分别为7.2、7.2、6.9、6.6 mg·(L·d)–1;去除率分别为96.4%、97.9%、91.2%、87.9% (图9(d))。
添加NaHCO3混合培养过程和MCK中TN/TP的变化表明,混合培养中添加NaHCO3促进藻类生长,可提高氮、磷去除率。添加NaHCO3混合培养过程中的TN/TP去除率和平均去除速率(图9(b)和图9(d))与细胞比生长速率和生物量(图7)变化同步,在MC0.6中达到最大值。
-
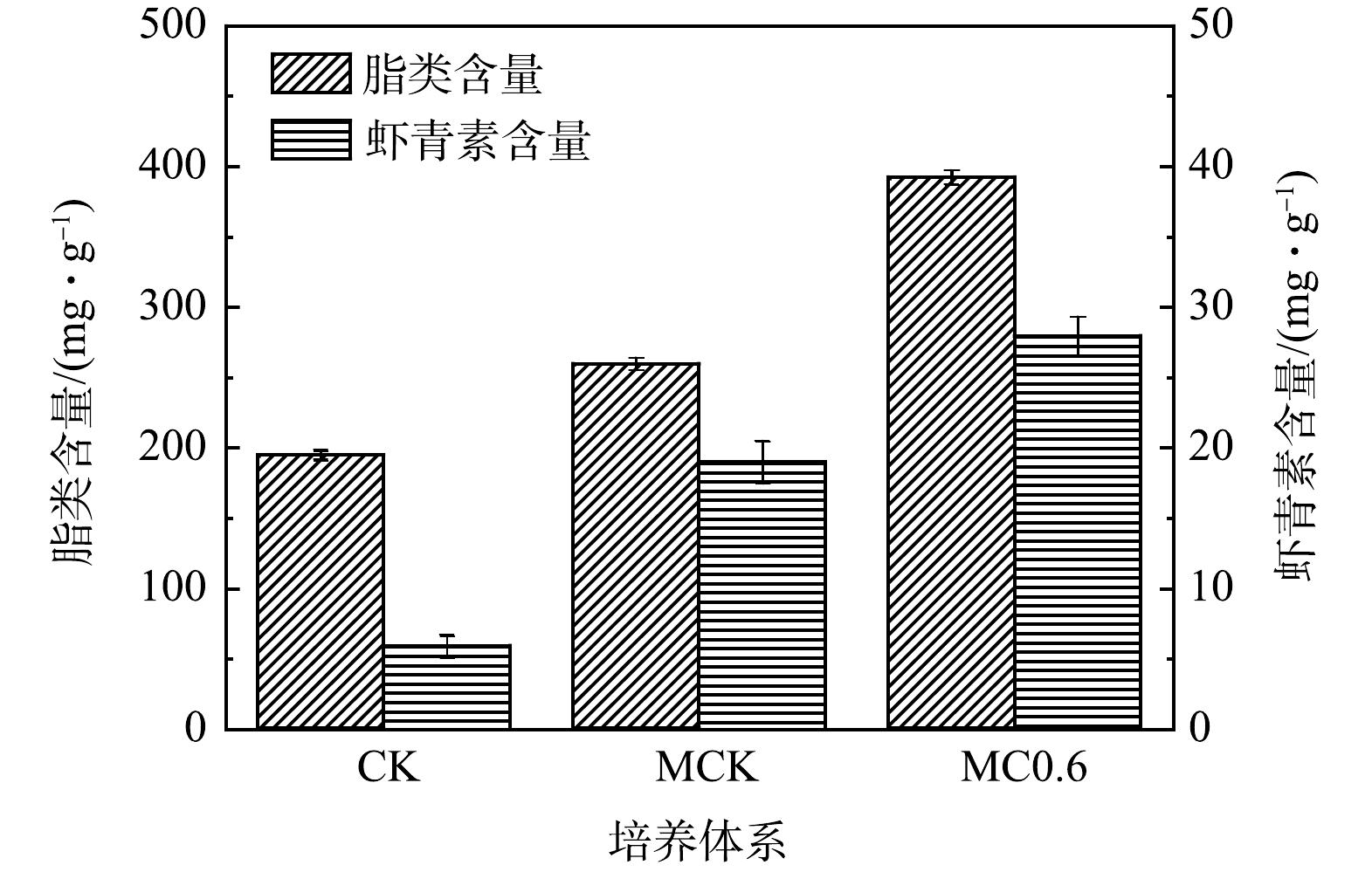
为了评估不同培养体系对雨生红球藻脂类和虾青素合成的影响,分析比较了雨生红球藻添加0.6 g·L–1 NaHCO3、 30:1(MCK)和CK中的脂类和虾青素含量。如图10所示,添加0.6 g·L–1 NaHCO3中脂类含量最高(392.2 mg·g–1),分别比MCK(259.6 mg·g–1)和CK(194.7 mg·g–1)提高了51.1%和101.4%。添加0.6 g·L–1 NaHCO3中雨生红球藻的虾青素含量达到最高(27.9 mg·g–1),分别是MCK(19.0 mg·g–1)和CK(5.9 mg·g–1)的1.5倍和4.7倍。脂类和虾青素的变化规律相似,主要是由于呈脂溶性虾青素分散在藻类细胞的脂滴中[48],因此,与脂类的合成呈相同的变化趋势(图10)。
与CK和MCK相比,添加0.6 g·L–1 NaHCO3中雨生红球藻的脂类和虾青素含量逐渐增加。主要原因是氮、磷质量浓度的快速下降,尤其是氮(图7(a))。添加0.6 g·L–1 NaHCO3对总氮的快速去除导致早期氮的含量相对不足/缺乏(氮饥饿),使得藻细胞将碳通量引导至脂类合成路径,从而促进脂类和虾青素的合成[48-49]。
-
1)与雨生红球藻的单独培养(CK)相比,雨生红球藻与DT06混合培养促进了雨生红球藻生长。雨生红球藻与DT06混合培养过程的COD先后均被完全去除,氮、磷的去除效果也得到显著提升。
2)添加NaHCO3的混合培养可进一步促进藻类生长和对氮、磷的去除。在NaHCO3质量浓度为0.6 g·L–1时,雨生红球藻比生长速率达到最高,氮和磷几乎被完全去除,其平均去除速率分别达到55.5 mg·(L·d)–1和8.9 mg·(L·d)–1。
3)在CK、M和MC体系中,MC中雨生红球藻的脂类和虾青素含量最高,分别达到259.6 mg·L–1和27.9 mg·L–1。
雨生红球藻与真菌Simplicillium lanosoniveum混合培养并添加NaHCO3处理高含氮磷废水
Treatment of wastewater with high nitrogen/phosphorous content by mix-cultivation of Haematococcus pluvialis and Simplicillium lanosoniveum supplemented with NaHCO3
-
摘要: 为有效地去除废水中氮磷,使用未灭菌的废水混合培养雨生红球藻和抗生素合成真菌Simplicillium lanosoniveum DT06 (DT06) 。结果表明:最佳藻菌细胞比为30:1。在此条件下:COD、总氮、总磷的去除率分别为100%、83.3%和88.2%;添加0.6 g·L–1NaHCO3后,氮磷去除率进一步提高至100%,同时微藻生物量、脂类和虾青素含量分别增加至1.95 g·L–1、0.39 g·g–1和27.9 mg·g–1。因此,雨生红球藻-真菌DT06添加NaHCO3的培养模式为废水处理和生物柴油/虾青素生产提供了一种经济高效的策略。Abstract: In order to efficiently remove nitrogen/phosphorus, the astaxanthin-producing green alga Haematococcus pluvialis and antibiotic-synthesizing fungus Simplicillium lanosoniveum DT06 (DT06) was mix-cultivated in the unsterilized wastewater without/with addition of NaHCO3. Experimental results showed that the removal rates of COD, nitrogen and phosphorus were 100%, 83.3% and 88.2% when the optimal cell ratio of algae-bacteria was 30:1, respectively; the removal rates of nitrogen and phosphorus increased further to 100 % after addition of 0.6 g·L–1 NaHCO3 to mixed culture, and the contents of algal biomass, lipid and astaxanthin increased to 1.95 g·L–1, 0.39 g·g–1 and 27.9 mg·g–1, respectively. Hence, mix-cultivation of H. pluvialis and DT06 supplemented with NaHCO3 provides a cost-effective strategy for wastewater treatment and biodiesel/astaxanthin production.
-
-
[1] DALU T, WASSERMAN R J, MAGORO M L, et al. River nutrient water and sediment measurements inform on nutrient retention, with implications for eutrophication[J]. Science of the Total Environment, 2019, 684(9): 296-302. [2] MOHSENPOUR S F, HENNIGE S, N WILLOUGHBY, et al. Integrating micro-algae into wastewater treatment: A review[J]. Science of the Total Environment, 2021, 752: 142168. doi: 10.1016/j.scitotenv.2020.142168 [3] ABOU-SHANAB R A I, JI M K, KIM H C, et al. Microalgal species growing on piggery wastewater as a valuable candidate for nutrient removal and biodiesel production[J]. Journal of Environmental Management, 2013, 115(1): 257-264. [4] CHINNASAMY S, BHATNAGAR A, CLAXTON R, et al. Biomass and bioenergy production potential of microalgae consortium in open and closed bioreactors using untreated carpet industry effluent as growth medium[J]. Bioresource Technology, 2010, 101(17): 6751-6760. doi: 10.1016/j.biortech.2010.03.094 [5] CHRISTENSON L, SIMS R. Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts[J]. Biotechnology Advances, 2011, 29(6): 686-702. doi: 10.1016/j.biotechadv.2011.05.015 [6] SUTHERLAND D L, RALPH P J. Microalgal bioremediation of emerging contaminants Opportunities and challenges[J]. Water Research, 2019, 164(11): 114921. [7] LI X, HU H Y, GAN K, et al. Effects of different nitrogen and phosphorus concentrations on the growth, nutrient uptake, and lipid accumulation of a freshwater microalga Scenedesmus sp.[J]. Bioresource Technology, 2010, 101(14): 5494-5500. doi: 10.1016/j.biortech.2010.02.016 [8] ZAMBRANO J, KRUSTOK I, NEHRENHEIM E, et al. A simple model for algae-bacteria interaction in photo-bioreactors[J]. Algal Research, 2016, 19: 155-161. doi: 10.1016/j.algal.2016.07.022 [9] ZHU L, WANG Z, SHU Q, et al. Nutrient removal and biodiesel production by integration of freshwater algae cultivation with piggery wastewater treatment[J]. Water Research, 2013, 47(13): 4294-4302. doi: 10.1016/j.watres.2013.05.004 [10] CHO D H, RAMANAN R, HEO J, et al. Enhancing microalgal biomass productivity by engineering a microalgal-bacterial community[J]. Bioresource Technology, 2015, 175: 578-585. doi: 10.1016/j.biortech.2014.10.159 [11] DE-BASHAN L E, HERNANDEZ J P, MOREY T, et al. Microalgae growth-promoting bacteria as "helpers" for microalgae: A novel approach for removing ammonium and phosphorus from municipal wastewater[J]. Water Research, 2004, 38(2): 466-474. doi: 10.1016/j.watres.2003.09.022 [12] HERNANDEZ D, RIANO B, COCA M, et al. Treatment of agro-industrial wastewater using microalgae–bacteria consortium combined with anaerobic digestion of the produced biomass[J]. Bioresource Technology, 2013, 135: 598-603. doi: 10.1016/j.biortech.2012.09.029 [13] HIGGINS B T, INGRID G, FITZGERALD P S, et al. Algal–bacterial synergy in treatment of winery wastewater[J]. NPJ Clean Water, 2018, 1(1): 6-10. doi: 10.1038/s41545-018-0005-y [14] NGUYEN T, NGUYEN T T, BINH Q A, et al. Co-culture of microalgae-activated sludge for wastewater treatment and biomass production: Exploring their role under different inoculation ratios[J]. Bioresource Technology, 2020, 314: 123754. doi: 10.1016/j.biortech.2020.123754 [15] POSADAS E, PA G, SOLTAU A, et al. Carbon and nutrient removal from centrates and domestic wastewater using algal–bacterial biofilm bioreactors[J]. Bioresource Technology, 2013, 139: 50-58. doi: 10.1016/j.biortech.2013.04.008 [16] SU Y, MENNERICH A, URBAN B. Municipal wastewater treatment and biomass accumulation with a wastewater-born and settleable algal-bacterial culture[J]. Water Research, 2011, 45(11): 3351-3358. doi: 10.1016/j.watres.2011.03.046 [17] CAO W X, WANG X, SUN S Q, et al. Simultaneously upgrading biogas and purifying biogas slurry using cocultivation of Chlorella vulgaris and three different fungi under various mixed light wavelength and photoperiods[J]. Bioresource Technology, 2017, 241(10): 701-709. [18] CHEN J, DING L, LIU R, et al. Hydrothermal carbonization of microalgae-fungal pellets: Removal of nutrients from the aqueous phase fungi and microalgae cultivation[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(45): 16823-16832. [19] DASH A, BANERJEE R. Enhanced biodiesel production through phyco-myco co-cultivation of Chlorella minutissima and Aspergillus awamori: An integrated approach[J]. Bioresource Technology, 2017, 238(8): 502-509. [20] GUO G, CAO W, SUN S, et al. Nutrient removal and biogas upgrading by integrating fungal–microalgal cultivation with anaerobically digested swine wastewater treatment[J]. Journal of Applied Phycology, 2017, 29(6): 2857-2866. doi: 10.1007/s10811-017-1207-2 [21] NAIM, RASHID, WON-KUN, et al. Binary culture of microalgae as an integrated approach for enhanced biomass and metabolites productivity, wastewater treatment, and bioflocculation[J]. Chemosphere, 2018, 194(5): 67-75. [22] SIRASIT S, ARUNOTHAI C, SUPAVADEE C, et al. A rapid method for harvesting and immobilization of oleaginous microalgae using pellet-forming filamentous fungi and the application in phytoremediation of secondary effluent[J]. International Journal of Phytoremediation, 2018, 20(10): 1017-1024. doi: 10.1080/15226514.2018.1452187 [23] YANG L, LI H, WANG Q. A novel one-step method for oil-rich biomass production and harvesting by co-cultivating microalgae with filamentous fungi in molasses wastewater[J]. Bioresource Technology, 2019, 275: 35-43. doi: 10.1016/j.biortech.2018.12.036 [24] ZHAO Y, GUO G, SUN S, et al. Co-pelletization of microalgae and fungi for efficient nutrient purification and biogas upgrading[J]. Bioresource Technology, 2019, 289: 121656. doi: 10.1016/j.biortech.2019.121656 [25] ZHOU K, ZHANG Y, JIA X. Co-cultivation of fungal-microalgal strains in biogas slurry and biogas purification under different initial CO2 concentrations[J]. Scientific Reports, 2018, 8(1): 7786. doi: 10.1038/s41598-018-26141-w [26] ZHOU W, CHENG Y, YUN L, et al. Novel fungal pelletization-assisted technology for algae harvesting and wastewater treatment[J]. Appllied Biochemistry and Biotechnology, 2012, 167(2): 214-228. doi: 10.1007/s12010-012-9667-y [27] DONG Q L, ZHAO X M. In situ carbon dioxide fixation in the process of natural astaxanthin production by a mixed culture of Haematococcus pluvialis and Phaffia rhodozyma[J]. Catalysis Today, 2004, 98(4): 537-544. doi: 10.1016/j.cattod.2004.09.052 [28] REN Y, DENG J, HUANG J, et al. Using green alga Haematococcus pluvialis for astaxanthin and lipid co-production: Advances and outlook[J]. Bioresource Technology, 2021, 340: 125736. doi: 10.1016/j.biortech.2021.125736 [29] HAGUE, F, DUTTA A, THIMMANAGARI M, et al. Integrated Haematococcus pluvialis biomass production and nutrient removal using bioethanol plant waste effluent[J]. Process Safety and Environmental Protection, 2017, 111(10): 128-137. [30] LEDDA C, TAMIAZZO J, BORIN M, et al. A simplified process of swine slurry treatment by primary filtration and Haematococcus pluvialis culture to produce low cost astaxanthin[J]. Ecological Engineering, 2016, 90: 244-250. doi: 10.1016/j.ecoleng.2016.01.033 [31] PAN M, ZHU X, PAN G, et al. Integrated valorization system for simultaneous high strength organic wastewater treatment and astaxanthin production from Haematococcus pluvialis[J]. Bioresource Technology, 2021, 326: 124761. doi: 10.1016/j.biortech.2021.124761 [32] WU Y H, YANG J, HU H Y, et al. Lipid-rich microalgal biomass production and nutrient removal by Haematococcus pluvialis in domestic secondary effluent[J]. Ecological Engineering, 2013, 60(11): 155-159. [33] SHAHID A, MALIK S, ZHU H, et al. Cultivating microalgae in wastewater for biomass production, pollutant removal, and atmospheric carbon mitigation; a review[J]. Science of the Total Environment, 2020, 704: 135303. doi: 10.1016/j.scitotenv.2019.135303 [34] FERGOLA P, CERASUOLO M, POLLIO A, et al. Allelopathy and competition between Chlorella vulgaris and Pseudokirchneriella subcapitata: Experiments and mathematical model-ScienceDirect[J]. Ecological Modelling, 2007, 208(2): 205-214. [35] JEMLI M, ALOUINI Z, SABBAHI S, et al. Destruction of fecal bacteria in wastewater by three photosensitizers[J]. Journal of Environmental Monitoring, 2002, 4(4): 511-516. doi: 10.1039/b204637g [36] LU Q, ZHOU W, MIN M, et al. Growing Chlorella sp. on meat processing wastewater for nutrient removal and biomass production[J]. Bioresource Technology, 2015, 198(12): 189-197. [37] XH A, YEMA B, AAHC D. Integration of sodium hypochlorite pretreatment with co-immobilized microalgae/bacteria treatment of meat processing wastewater[J]. Bioresource Technology, 2020, 304(5): 122953. [38] DONG Q L, LIN T Y, XING X Y, et al. Identification of a symbiotic fungus from blue–green alga and its extracellular polysaccharide[J]. Letters in Applied Microbiology, 2014, 58(4): 303-310. doi: 10.1111/lam.12192 [39] DONG Q, DONG R, XING X, et al. A new antibiotic produced by the cyanobacterium-symbiotic fungus Simplicillium lanosoniveum[J]. Natural Product Research, 2017, 32(1): 1348-1352. [40] 董庆霖, 王瑜琴, 邢向英, 等. 共生真菌Simplicillium lanosoniveum促进衣藻生长和脂类合成[J]. 微生物学通报, 2018, 45(12): 2639-2647. [41] 董庆霖, 陈博, 邢向英, 等. 一株蓝藻内生真菌的鉴定及其产物抑菌活性[J]. 化工学报, 2011, 62(6): 1656-1661. doi: 10.3969/j.issn.0438-1157.2011.06.027 [42] DONG Q S, WANG H, XING X Y, et al. Identification and characterization of a special species of Paecilomyces[J]. Annals of Microbiology, 2012, 62(4): 1587-1592. doi: 10.1007/s13213-011-0414-3 [43] 董庆霖, 王瑶, 邢向英, 等. 淡紫拟青霉TD16促进雨生红球藻生长和油脂合成的研究[J]. 中国油脂, 2019, 44(8): 102-108. [44] HOLMES B, PADDOCK M B, VANDERGHEYNST J S, et al. Algal photosynthetic aeration increases the capacity of bacteria to degrade organics in wastewater[J]. Biotechnology and Bioengineering, 2019, 117(1): 62-72. [45] MAKUT B B, DAS D, GOSWAMI G. Production of microbial biomass feedstock via co-cultivation of microalgae-bacteria consortium coupled with effective wastewater treatment: A sustainable approach[J]. Algal Research, 2019, 37: 228-239. doi: 10.1016/j.algal.2018.11.020 [46] MOUGET J L, DAKHAMA A, LAVOIE M C, et al. Algal growth enhancement by bacteria: Is consumption of photosynthetic oxygen involved?[J]. FEMS Microbiology Ecology, 1995, 18(9): 35-43. [47] ZAMALLOA C, VULSTEKE E, ALBRECHT J, et al. The techno-economic potential of renewable energy through the anaerobic digestion of microalgae[J]. Bioresource Technology, 2010, 102(2): 1149-1158. [48] HIGUERA-CIAPARA I, FELIX-VALENZUELA L, GOYCCOLEA F M. Astaxanthin: A review of its chemistry and applications[J]. Critical Reviews in Food Science and Nutrition, 2006, 46(2): 185-196. doi: 10.1080/10408690590957188 [49] DONG Q L, ZHAO X M, MA H W, et al. Metabolic flux analysis of the two astaxanthin-producing microorganisms Haematococcus pluvialis and Phaffia rhodozyma in the pure and mixed cultures[J]. Biotechnology Journal:Healthcare Nutrition Technology, 2006, 1(11): 1283-1292. -






 下载:
下载: