-
人工湿地是一种运行费用低、管理维护简便的污水生态处理工艺,被广泛应用于生活、农业和工业废水的二级处理[1]。然而,在传统人工湿地系统中,有限的溶解氧(DO)使硝化过程不能顺利进行,从而导致脱氮效率不高[2],限制其进一步推广应用。此外,湿地系统被认为是全球N2O排放的重要来源[3-4],N2O全球变暖潜势为CO2的300倍,且其排放会造成严重的环境问题,如臭氧层破坏等[5]。生物炭作为一种环保材料,因其孔隙多、比表面积大等特点,常被应用于提升人工湿地脱氮性能,并实现温室气体减排[6-7]。现有研究表明,将生物炭添加至潜流人工湿地,能显著提升脱氮效率。当生物炭投加比为30%时,NH4+-N去除率为 (98.18±1.47) %[8],且在潜流人工湿地中,投加40%生物炭后可实现N2O减排70.13%[9]。
然而,现有研究并未明确湿地生物脱氮过程中,生物炭实现N2O减排的具体途径。由于人工湿地系统内同时具有好氧、厌氧、缺氧的环境,通过直接测定很难明确硝化、反硝化作用对N2O释放的具体贡献[10]。通过加入化学抑制剂阻断特定的N2O转化途径,从而实现量化N2O排放途径[11]。目前,已有研究指出,丙烯硫脲(Allylthiourea, ATU)+NaClO3作为化学阻断剂可用于研究污水生物处理中N2O的排放特征[12],而利用乙炔抑制剂法亦可用于量化N2O的排放途径[13]。
基于此,本研究通过在温室内构建生物炭曝气潜流人工湿地,以曝气潜流湿地作为对照,探究生物炭对曝气潜流湿地污染物去除及N2O释放的影响,同时采用化学抑制剂法量化N2O排放途径,分析湿地中生物炭对N2O排放途径的影响,以期为生物炭在人工湿地中进一步的应用提供参考。
-
装置采用圆形聚乙烯容器。容器的表面积为0.1 m2,高为35 cm。系统分别命名为BW和CK(生物炭投加比为30%和0)。每个实验系统分别设置2个平行,共计4个湿地反应器。参照王宁等[14]的方式构建反应器。生物炭原料为芦竹秸秆,按照HUANG等[15]的制备方法制得生物炭,其比表面积为345.92 m2·g‒1、孔径为1.95 nm、孔容为0.2467 cm3·g‒1。所得生物炭经反复冲洗后添加至反应器中。湿地污泥取自某城市生活污水处理厂,在经过人工配水驯化后一次性接种至湿地系统。栽种的植物为美人蕉(Canna indica L.),经驯化后选取长势相同且根系发达程度相当的植株,以10 株·m−2的种植密度栽入湿地系统中。所有实验均置于温室中进行,温度为(25±2) ℃,光照强度为(3 000±300) lx,光暗比12 h∶12 h。实验装置如图1所示。
-
1)人工湿地反应器的运行。人工湿地进水采用自来水配置的模拟废水,配方参考文献[14]。进水水质:COD为(410.81±11.14) mg·L−1;NH4+-N为(39.90±2.08) mg·L−1;TN为(43.45±2.89) mg·L−1;TP为(5.08±0.57) mg·L−1;pH为(7.64±0.08);DO为(8.12±0.15) mg·L−1。利用恒温控制器(XH-W3002,深圳市正方形电子科技)控制加热线圈的方式将湿地系统的温度维持在(26±1) °C。湿地反应器采用间歇一次性进水,停留24 h后排水,其有效进水量为10 L。曝气方式采用间歇曝气:曝气3 h(曝气段),再停曝3 h(停曝段)。曝气段通过气体质量流量控制器(AST10-DX,阿斯尔特仪表(北京)有限公司)控制,进气量为0.4 L·min−1。
2)运行方案的分组设计。实验分为3组。A组无抑制剂添加;B组添加NaClO3;C组添加ATU和NaClO3。ATU和NaClO3的质量浓度分别为10 mg·L−1和1 g·L−1[16]。待3个月后,装置运行稳定,可开始实验,随之进行取样并测定气体的体积分数。
-
1)水样采集与测定。在湿地系统稳定运行的6个月,每2~3 d进行1次水质测定。同时,在稳定运行期间,选取典型周期,分别在第0.5、1、2、3、3.5、4、5、7、9、10、12、15、18、21、24小时取样,并测定水质。其中,COD、NH4+-N、NO3−-N、NO2−-N、TN和TP均按照标准方法进行测定[17];DO采用便携式溶氧仪(YSI 550A,美国YSI公司)测定;pH采用台式酸度计(PB-10,德国Sartorius公司)进行测定。
2)气体采集与测定。采用静态箱-气相色谱法测定湿地系统N2O的释放量。参考文献[18],在停曝段保证反应器的完全封闭,曝气段采样口开放平衡气压,共设定12个采样时间点。N2O气体采用气相色谱仪(Agilent 7890A,美国Agilent公司)测定。
-
1)N2O释放量的计算参考公式 (1)~(3) 。
式中:W为N2O释放速率,g·(m2·min)−1;m为周期内N2O的释放量,g·m−2;P为大气压强,Pa;R为气体常数,8 308.65 L·Pa·(K·mol)−1;Vair为反应器内上部空间体积,L;T为气体温度,K;M为N2O相对分子质量,44.02 g·mol−1;△t为第n 次和第 (n−1) 次采样的时间间隔,min;C为气样中N2O的体积分数;As为湿地床表面积,m2;Q为曝气流量,L·min−1;Wn为第n次采样相应的释放速率,g·(m2·min)−1。
2)不同途径N2O释放量的计算参考公式 (4)~(8) 。实验A无抑制剂添加,所测为硝化过程、反硝化过程和其他过程N2O的释放量。实验B添加NaClO3,所测为硝化过程和其他过程N2O释放量。实验C添加ATU和NaClO3,所测为其他过程N2O释放量[19-20]。
式中:
CN2O 表示N2O释放量;NF和DD分别表示硝化过程和反硝化过程;other表示其他过程。3)实验作图与数据分析。实验数据通过Origin 2018整理作图,并由SPSS 23.0进行数据分析,数据表达采用平均值±标准差。对象之间相互关系采用相关性分析,并经Pearson检验(水平包括显著p<0.05和极显著p<0.01)。
-
在湿地稳定运行期间,监测分析出水水质,湿地系统水质各指标如表1所示。
CK系统和BW系统平均出水COD均低于50 mg·L−1。COD去除率均大于80%以上,添加生物炭对COD去除有一定促进作用,但影响不显著(p>0.05)。CK和BW系统NH4+-N平均去除率分别为(79.92±6.85)%和(89.08±4.80)%,TN平均去除率分别为(75.63±4.87)%和(85.61±5.18)%。生物炭湿地系统的NH4+-N和TN去除率显著高于对照湿地(p<0.05),这与GUPTA等[21]的结果一致。分析其原因可能是由于生物炭的多孔结构不仅会改善系统的通气性,还会促进气水充分接触,改善系统DO水平,从而促进微生物的生长,实现强化脱氮[22]。另一方面,生物炭具有很高的NH4+-N结合能力和TN去除能力[23]。由于曝气潜流湿地中良好的好氧和厌氧交替环境,两组湿地系统中出水均未检出NO3−-N和NO2−-N。
-
典型周期内污染物及N2O通量变化如图2所示。在CK和BW湿地系统水体中,DO在曝气段稳定在(3.14±0.09)和(3.40±0.20) mg·L−1,在停曝段分别为(0.60±0.18)和(0.50±0.15) mg·L−1。在投加生物炭后,曝气段的DO比对照组增加了约0.26 mg·L−1,在停曝段降低约0.1 mg·L−1。生物炭的多孔结构增大了系统的通气性,可改善DO水平,同时也促进了微生物的活动。两组湿地中,COD在进水0.5 h时就被大量去除。由于污染物在去除过程中会消耗大量氧气,故COD和DO的初期变化规律类似。同样的,NH4+-N在进水初期迅速下降,可能是由于初期充足的碳源和DO为微生物硝化作用提供了良好条件,使NH4+-N快速被转化[24]。通过前期对碳源的快速消耗,系统中的反硝化作用受到限制,积累了NO3−-N。但在周期内,通过间歇曝气,系统交替出现好氧厌氧环境会使硝化反硝化作用得以顺利进行。
湿地N2O的排放主要集中在曝气段。曝气段N2O的平均排放通量是停曝段的4.84~18.86倍。在曝气初期,N2O通量达到峰值。这可能是由于在反应初期,DO迅速被消耗,而后限制了硝化过程,导致N2O的大量排放[25]。观察两组湿地中N2O通量的变化,生物炭对N2O排放的抑制作用也集中在反应的初期。
随着反应进行,曝气段N2O通量在降低。氮素在前期的转化导致后期氮素质量浓度下降,限制了N2O的产生。在脱氮过程中,反应初期的曝气段没有NO3−-N和NO2−-N的积累,发生了同步硝化和反硝化。而在反应后期,由于碳源的限制,曝气段硝化过程产生的NO3−-N因碳源匮乏,不能及时通过反硝化作用消耗掉,而导致其积累。然而,间歇曝气形成的好氧和厌氧环境的交替,推动了反硝化作用的进行,最终在出水中未检测出NO3−-N和NO2−-N。
-
在各反应周期内,NO3−-N和NO2−-N在曝气段没有过多累积。这说明在此阶段存在同步硝化反硝化,消耗了NO3−-N,进而在停曝段反硝化菌无法利用NO3−-N作为电子受体进行反应。同时,停曝段的DO低,且初期尚有碳源,使中间产物N2O在氧化亚氮还原酶作用下快速还原成N2,不被累积。而在曝气段,由于DO较高,抑制了氧化亚氮还原酶的活性,并导致了N2O累积[26]。因此,N2O主要产生于曝气段,这与LIANG等[27]研究结果一致。
BW和CK系统的N2O累积释放量分别为10.45 mg·m−2和17.62 mg·m−2。生物炭湿地的N2O释放量明显低于对照组湿地,而生物炭投加30%即可实现40.69%的减排效果(图3)。微氧条件所造成的不完全硝化反硝化是湿地系统释放N2O的主要途径。在硝化过程中,不充足的氧促使NO2−-N不断积累,并释放大量N2O;而在反硝化过程中,低浓度氧也会抑制氧化亚氮还原酶活性,使反硝化作用进行不完全,亦会导致N2O的释放[28]。然而,在本研究中,添加生物炭成功实现了曝气湿地N2O的减排。一方面,生物炭的添加会增加曝气段的DO,从而抑制了硝化菌的反硝化作用、减少了N2O释放量[29];另一方面,在反硝化过程中,生物炭促进了湿地中反硝化菌的生长,有利于减少N2O的排放[26]。同时,生物炭的碱性诱导会产生更多的N2而不是N2O[30]。生物炭作为一种潜在碳源,可帮助提高氧化亚氮还原酶的活性,从而促进N2O转化为N2[31]。
-
两组湿地周期内硝化作用和反硝化作用N2O释放量及其对比如图4和图5所示。在反应初期,湿地中N2O主要来源于硝化反应,但在CK系统中后期,反硝化作用成为主要来源。一方面,两组湿地反硝化作用产生的N2O大于硝化作用产生的N2O;另一方面,对比CK和BW系统,在曝气段和停曝段硝化作用N2O释放量分别为0.33~1.83 mg·m−2和0.05~0.87 mg·m−2,而反硝化作用N2O释放量分别为-0.22~2.68 mg·m−2和-0.36~1.17 mg·m−2。因此,CK系统反硝化作用产生的N2O明显多于BW系统。两组湿地N2O排放特点均为反硝化作用大于硝化作用。且不论是硝化还是反硝化,BW的N2O释放量均小于CK。这表明生物炭可通过影响硝化和反硝化来实现N2O减排。
图4(a)表明,在反应初期,对照湿地中停曝段反硝化作用表现为N2O的“弱汇”。这是由于在停曝段,部分N2O以溶解态存在发生缺氧反硝化而消耗了N2O所致[12]。然而,在生物炭湿地中,反应初期硝化作用程度更高,使系统有部分NO3−-N累积(图2(b))。在停曝段,NO3−-N作为电子受体发生反硝化作用,导致反应3~6 h段在反硝化作用下释放少量N2O (图4(b)) 。在反应中期,由于有机物被大量去除、C/N下降,碳源不足使得反硝化作用进行不完全,最终导致中期CK湿地中发生反硝化作用、释放出大量N2O。而在BW系统反应中期,反硝化作用对N2O释放的贡献较低:一方面生物炭作为一种潜在碳源,促进了反硝化作用顺利进行、减少了N2O的释放;另一方面生物炭通过拦截吸附等作用,固定了部分有机物,进而在反应中期被消耗利用。在反应后期,间歇曝气改善了好氧-厌氧环境,有利于硝化和反硝化的进行,而生物炭的添加为湿地系统运行后期提供部分碳源,有利于提高氧化亚氮还原酶活性,使中间产物N2O转化为N2而被消耗。因此,BW系统末期与CK系统相比呈现出较强的“汇”。
当NH4+作为唯一进水氮源时,N2O主要通过自养硝化和反硝化作用产生[11]。因此,通过不同抑制剂的抑制原理开展批量实验,可量化N2O的排放途径。在CK和BW系统中,硝化作用产生N2O的释放量分别为(7.66±1.38) mg·m−2和(4.35±0.88) mg·m−2,而反硝化作用的N2O释放量分别为(6.13±1.22) mg·m−2和(1.72±0.58) mg·m−2。这表明生物炭湿地系统通过影响硝化反硝化过程,可实现N2O减排。对照组湿地中硝化反硝化作用对N2O释放量的贡献率,分别为43.48%和34.81%。在生物炭添加后,硝化和反硝化过程的N2O排放量分别减少43.20%和71.93%。吕婉琳[32]研究了人工湿地中硝化反硝化作用对N2O释放量的贡献,发现添加生物炭可显著减少反硝化作用的N2O释放量。JI等[33]研究生物炭、曝气等对温室气体排放的影响后发现,添加生物炭可提高反硝化相关基因的丰度和活性,进而实现N2O的减排。由此可推断,投加生物炭会不同程度地影响硝化反硝化作用,尤其是会显著减少反硝化作用N2O的释放量。
-
1) 在曝气人工湿地中,投加生物炭对有机物去除效果无显著影响(p>0.05),但可显著提高湿地系统中脱氮效果(p<0.05)。投加30%的生物炭可使湿地NH4+-N和TN去除率提高9.16%和9.98%。
2) 投加生物炭可实现湿地系统N2O减排。30%生物炭投加量可实现N2O减排40.69%。在曝气人工湿地中,不完全的硝化和反硝化作用是产生N2O的主要途径,贡献率分别为43.48%和34.81%。在添加30%的生物炭后,硝化和反硝化过程的N2O排放量分别减少43.20%、71.93%。
生物炭的投加对曝气人工湿地中N2O主要产排途径的影响
Influences of biochar on the main production and discharge pathways of N2O in aerated constructed wetlands
-
摘要: 生物炭由于具有良好的微孔结构,较大的比表面积,被用于改善人工湿地内部环境,可实现强化脱氮和氧化亚氮(N2O)减排,但生物炭对N2O减排的途径尚不明晰。通过在温室内构建生物炭曝气潜流湿地(BW),以曝气潜流湿地(CK)作为对照,采用化学抑制剂法,量化湿地中N2O的排放途径,探究生物炭对N2O的减排效应。结果表明,生物炭投加可以显著提高湿地脱氮效率(p<0.05)。CK和BW系统N2O的平均释放量分别为17.62 mg·(m2·d)−1和10.45 mg·(m2·d)−1,30%的生物炭投加可实现N2O减排40.69%。化学抑制剂实验表明,湿地系统中硝化和反硝化作用对N2O释放的贡献率分别为43.48%和34.81%。生物炭的添加可使上述2个主要脱氮过程的N2O减排43.20%和71.93%。本研究可为污水处理流程的碳减排提供参考。Abstract: Biochar is used to improve the internal environment of constructed wetlands, achieving nitrogen removal enhancement and nitrous oxide (N2O) emission reduction, due to the microporous structure and huge specific surface area. However, the way of N2O emission reduction by biochar is not clear yet. In this experiment, the aeration subsurface flow constructed wetland with biochar (BW) was built in the greenhouse, using the one without biochar (CK) as control. The chemical inhibitor method was used to quantify the N2O emission pathway and explore the reduction effects of biochar on N2O. The results revealed that biochar addition could significantly improve the nitrogen removal efficiency (p <0.05). The average release of N2O in CK and BW were 17.62 mg·(m2·d)−1 and 10.45 mg·(m2·d)−1, respectively, and 30% biochar addition would reduce N2O emissions by 40.69%. Chemical inhibitor tests showed that the contribution of nitrification and denitrification to N2O release were 43.48% and 34.81%, and the addition of biochar could reduce the N2O emission by 43.20% and 71.93%, respectively, in these two major nitrogen removal processes.
-
Key words:
- constructed wetland /
- biochar /
- nitrogen removal /
- nitrous oxide /
- chemical inhibition
-
环境持久性自由基(EPFRs)是一类新型污染物,具有稳定性、持久性、迁移性及高反应活性等特征,能产生一定环境风险[1]。此类污染物能损伤生物DNA、引发肺部和心血管疾病,威胁人体健康,因此,成为近年来环境领域研究关注的热点[2]。EPFRs不仅存在于机体代谢过程中,也广泛存在于各种环境介质中,目前土壤、大气颗粒物、生物质炭、飞灰等介质中均含有一定量的EPFRs[3-6]。城市道路灰尘所处环境界面特殊,受人类活动影响是多种污染物的汇集场所。道路灰尘作为多种污染物载体,其中细颗粒物可能会因交通和风力的扰动作用,重新扬起再次进入大气,影响环境空气质量[7-8]。道路灰尘也常表现出对大气颗粒物的“源”效应,据报道,空气中有10%—50%的PM2.5来自地面扬尘[9]。因此,研究道路灰尘中EPFRs的污染特征及其环境风险,对城市环境评估和治理有重要的基础和实践意义。
近些年国内外学者对常见环境介质中EPFRs的污染、产生机理和环境风险等方面的研究取得了一定进展。例如,对目前研究分析的结果表明,大气颗粒物中EPFRs的含量在1.60 × 1016 spins·g−1到5.35 × 1018 spins·g−1之间[10],也有结果显示北京2016年冬季雾霾期间PM2.5中EPFRs的含量可达1.60 × 1020 spins·g−1[10]。大气颗粒物中EPFRs的检测得到的g值在2.0027至2.0048之间,根据一般判定规律可知大气颗粒物中的EPFRs为与氧原子相邻的以碳原子为中心的自由基[11]。环境介质中的EPFRs一般由前驱有机物和过渡性金属氧化物在多种环境条件共同作用下产生[12-13]。有研究显示芳香族化合物中的苯环结构可为过渡性金属提供电子,促进了以碳为中心的EPFRs的形成[14]。多环芳烃类有机污染物也会被氧化为酚类和醌类化合物,进而形成半醌自由基和苯氧自由基[14-15]。由于香烟烟雾中自由基类型与PM2.5接近,目前EPFRs的人体健康风险评价采用的方法多为当量香烟数法,即根据空气PM2.5的浓度、人体呼吸速率、PM2.5中自由基含量、香烟焦油中自由基含量和香烟焦油量等主要参数计算当量香烟数[1, 16]。当量香烟数的意义为每天从PM2.5中吸入的自由基相当于吸食香烟的数量,这种评价方法便于人们直观认识EPFRs对健康的危害,因此被广泛采用。
目前,关于EPFRs的研究仍存在不足,尤其缺少道路灰尘中EPFRs关于污染特征及健康风险评估方面的研究,致使人们对道路灰尘EPFRs的污染分布规律、形成及其对人体健康影响的认识并不清楚。因此,本研究选择中原城市群快速城镇化的周口市作为研究区域,对典型城市区域道路灰尘进行采样,并采用电子顺磁共振波谱法(EPR)检测,分析不同功能区道路灰尘中EPFRs的含量特征,根据g因子大小判定道路灰尘中的EPFRs种类。采用当量香烟数法对因吸入道路灰尘产生的健康风险进行评估。研究结果将促进人们对城市道路灰尘中EPFRs污染特征及健康风险的认识,也进一步研究城市道路灰尘中EPFRs的形成机制提供理论依据。
1. 材料与方法(Materials and methods)
1.1 道路灰尘样品的采集
以中原城市群核心区快速城镇化的周口市为研究区域,选择公园、居民区和道路3种不同类型功能区道路,设置44个采样点,并采集道路灰尘样品。3种功能区采样点设置数量分别为公园6个、居民区10个、道路28个。根据道路分级将城市道路安机动车道数分为主干道(双向8车道)和次干道(双向6车道),设置采样点数分别为12个和16个。采样点分布见图1。道路灰尘采样依据环境保护标准《防治城市扬尘污染技术规范》(HJ/T 393—2007)的积尘监测方法进行。为避免特殊天气的影响,采样时间须选择天气连续晴朗1周后进行,研究最终确定的采样日期为2020年11月14日。研究采用无线手持式真空吸尘器(300 W,V101 Pro型,苏州艾维诺有限公司)采集灰尘样品,在每个取样点分别采集3个次级样品,混合成一个样品。样品用锡纸包好,放入铝箔袋中[17],标记采样时间、地点后贴在相应样品袋上,并记录功能区类型和道路情况等信息,在各采样点用便携式GPS定位系统定位,记录样点坐标。灰尘样品放入−20 ℃冰箱中保存,备用[17]。
1.2 灰尘中EPFRs测定
研究采用EPR光谱仪(MS5000,布鲁克,德国)测定灰尘样品中的EPFRs。综合前人研究大气颗粒物中EPFRs测定技术的参数[18]。通过设置不同仪器参数寻求测定EPFRs的最优参数,最终确定仪器最优参数为:磁场强度,328—348 mT;检测时间,60 s;微波强度,3 mW;调制频率,100 kHz;调制幅度,0.1 mT;接收增益,15.2 dB。
EPR测试采用由Cr3+和MgO组成的标准物质。通过使用EPR程序WinEPR处理获得g值、信号强度和Hpp,该程序可以提供用户熟悉的界面,同时能保证数据采集和处理所需的可靠性。该方法可以模拟校准样品中EPFRs的自旋绝对值和g因子[1]。通过下式计算各灰尘样品中EPFRs的含量(Cx)[19]:
Cx=C0×Hppx×(ΔHppx)2Hpp0×(ΔHpp0)2 (1) 式中,C0为标准参考物质单位质量的总自旋数,spins·g−1;Hppx、Hpp0分别为灰尘样品和标准样品一次微分的EPR波谱的峰-峰高度;∆Hppx、∆Hpp0分别为灰尘样品和标准样品一次微分的EPR波谱的峰-峰宽度;(∆Hpp)2乘以Hpp可以计算出信号峰值面积。
1.3 暴露风险评估
研究结合美国环保局推荐的健康风险评估模型和当量香烟数评估模型作为评估方法,估计通过口腔和鼻腔呼吸吸入再悬浮灰尘携带EPFRs的当量香烟数量。评价经口、鼻日平均吸入道路灰尘EPFRs的量(Dinh)采用下式计算[20]:
Dinh=C×InhR×EF×EDDEF×AT (2) 式中,C为道路灰尘中EPFRs的含量,spins·g−1;InhR为吸入含有道路灰尘的空气的速率,m3·d−1;ED是暴露持续时间,a;EF是暴露频率,d·a−1;AT是平均作用时间,d;DEF为粉尘排放因子,m3·kg−1;每日因吸入粉尘而吸入的EPFRs的当量香烟数计算公式为[1]:
Ncig=DinhRCcig×Ctar (3) 式中,RCcig为香烟焦油中EPFRs的含量,取4.75 × 1016 spins·g−1[21];Ctar为每支香烟的焦油含量,取0.013 g[1]。模型计算所需参数取值如表1所示。
表 1 暴露评估参数的取值Table 1. The value of parameter of exposure assessment2. 结果与讨论 (Results and discussion)
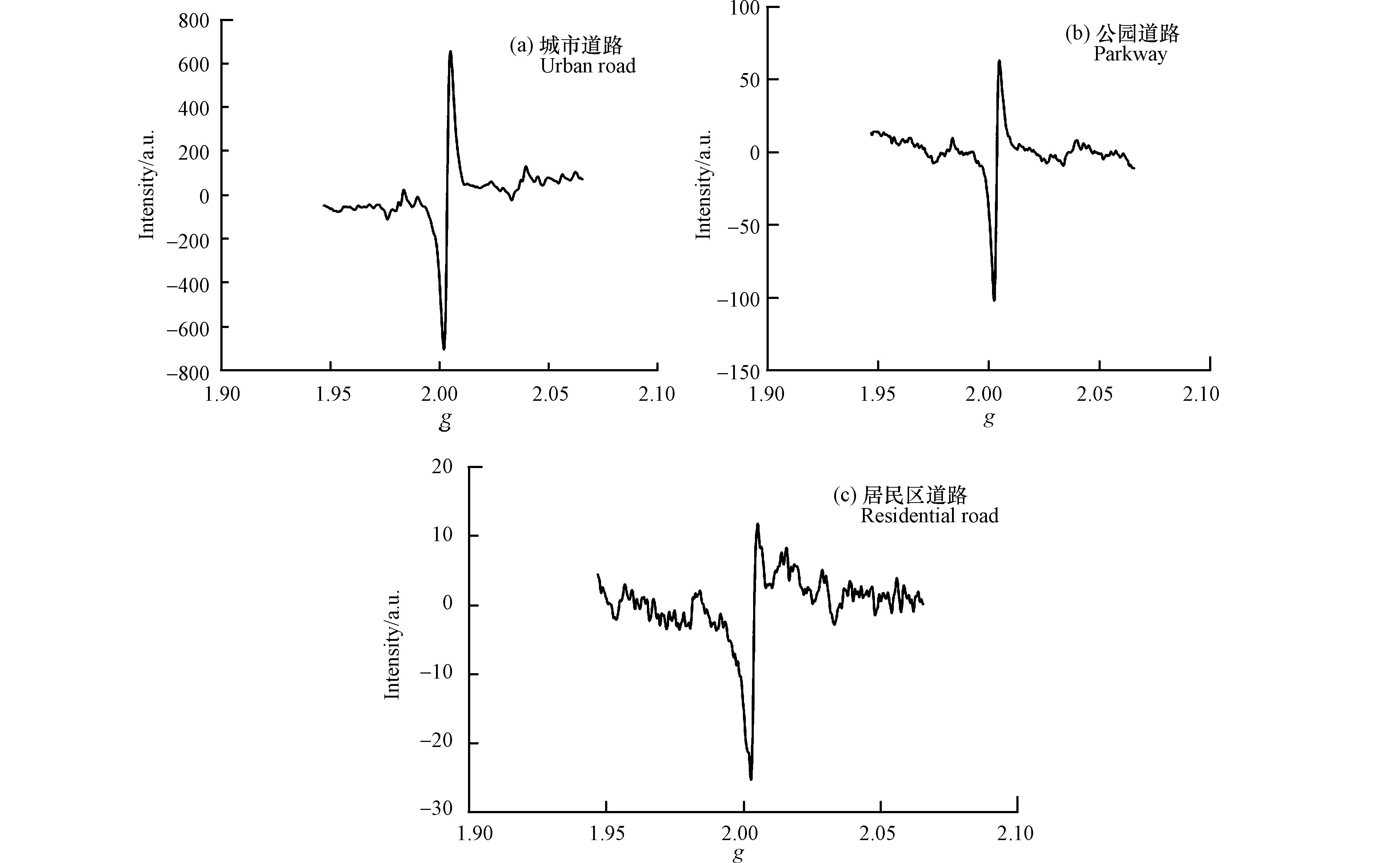
2.1 灰尘中EPFRs种类特征
图2为不同功能区道路灰尘EPFRs的EPR信号谱图,结果显示,测定结果谱图的g值范围为1.9465—2.0657,在此g值范围内,不同类型道路灰尘样品中EPFRs信号强度各不相同。道路灰尘中EPFRs信号变化范围较大为−700—700 A.U.(图2a),其次为公园,其灰尘中EPFRs信号变化范围−110—80 A.U.(图2b),居民区地面EPFRs的信号变化范围最小为−25—15 A.U.(图2c)。由于g值范围一定时,信号强度与波谱曲线下的面积,即自旋含量,存在正比关系[19]。说明不同类型功能区地面灰尘中EPFRs的污染可能表现出不同特征。
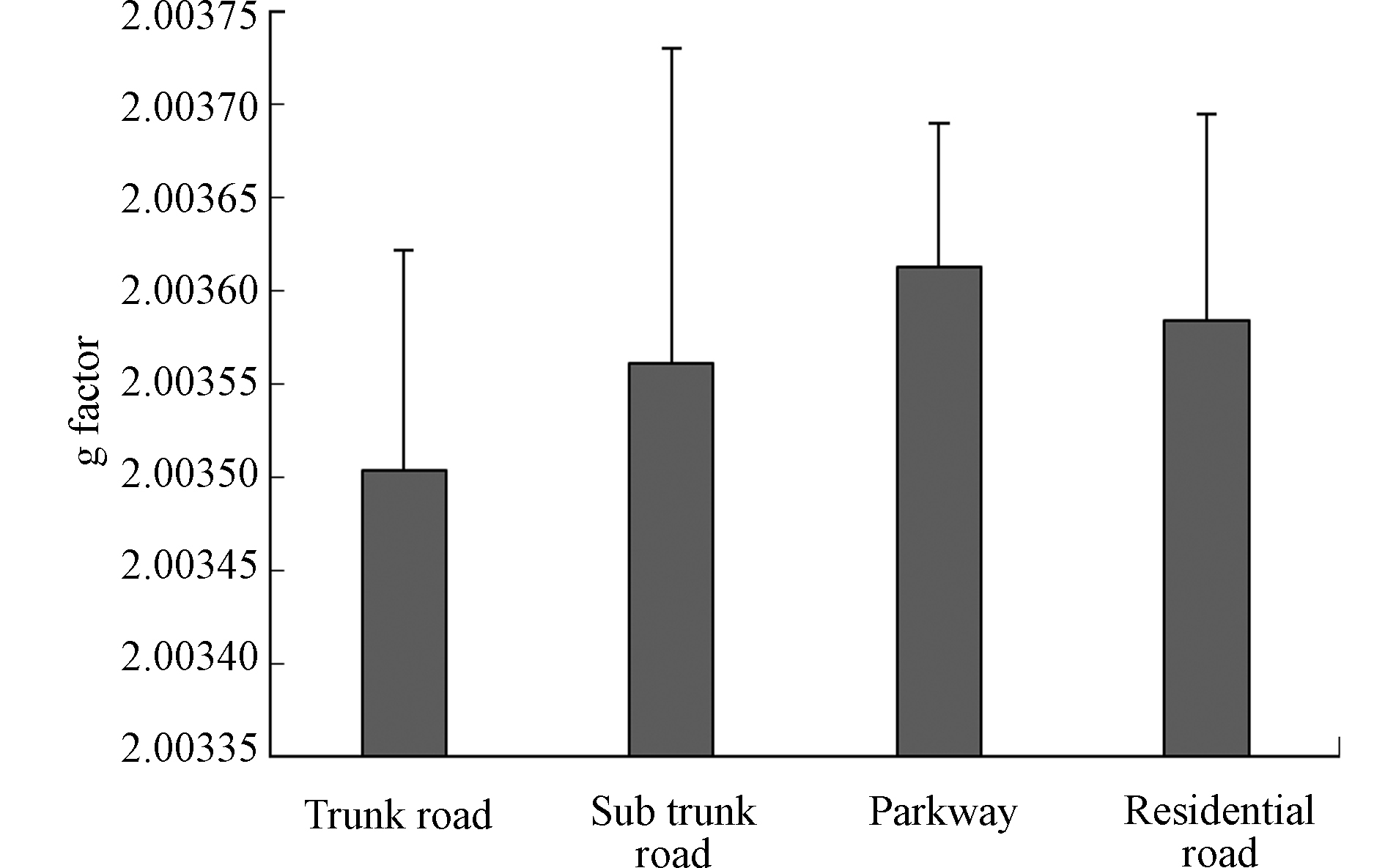
统计分析表明,道路灰尘中EPFRs的g因子范围为2.0032—2.0037,其均值为2.0036,其峰-峰线宽∆Hppx的范围为3.6—8.0 G,均值为5.1 G,说明灰尘样品中主要是以碳原子为中心及其邻近有含氧官能团的多种类混合型持久性自由基。图3为不同功能区类型道路灰尘中EPFRs的g因子分布特征。结果表明,不同类型的道路灰尘中EPFRs的g因子值差异较小。公园道路灰尘中EPFRs的g因子的范围为2.0035—2.0037,居民区和主干道灰尘中EPFRs的g因子范围均为2.0034—2.0037,次干道灰尘中EPFRs的g因子范围为2.0032—2.0037。这也说明不同城市功能区道路灰尘中EPFRs的类型较为相近。
g因子值与线宽值都可以用来判断自由基的类型,目前主要以g因子值来初步判断自由基类型的归属[10]。若要对自由基分类进行精确判定,还需要基于密度泛函理论的分子优化和模拟计算,才能得到原子核的精细分裂常数值,通过波谱曲线拟合,得到理论谱图,再将测定曲线与理论曲线对比验证自由基分类[25]。有研究将自由基分为30个类别,给出了精细分裂常数值和g因子值,可供分析判断[26]。最新研究显示,道路沥青中EPFRs的g因子值为2.0032—2.0038,与本研究g因子值结果非常接近,归属也为以碳原子为中心和以氧原子为中心的混合自由基,即主要为芳烃自由基和半醌自由基[27],进一步暗示沥青和城市道路灰尘EPFRs的形成可能有内在的关系。北京和西安市PM2.5中EPFRs谱线图的g因子值为2.0030—2.0048,∆Hppx值为4.7—7.9 G,均被判断为以氧为中心或以碳为中心邻近含有杂原子的混合型自由基[18, 28]。这也从另一方面说明了大气颗粒物与道路灰尘之间可能存在一定的联系,即大气中悬浮颗粒物可能与道路灰尘之间有一定的相互迁移和交换。
2.2 灰尘中EPFRs污染特征
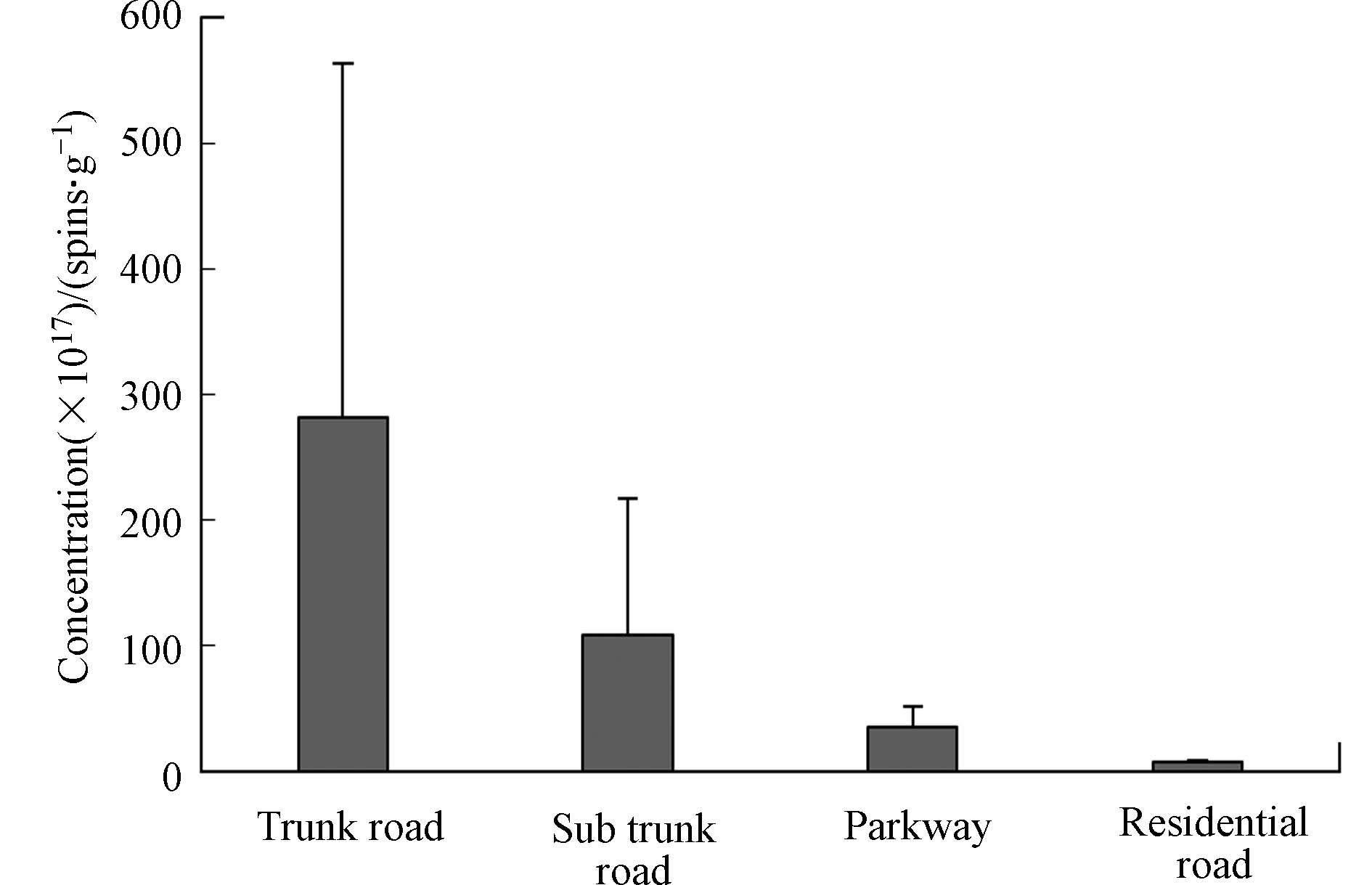
采用EPR检测获取EPFRs的信号及特征数据,代入公式(1)计算得到样品中EPFRs的含量。图4所示为不同类型城市功能区道路灰尘EPFRs含量。研究结果表明,道路灰尘中EPFRs平均含量为1.26 × 1019 spins·g−1,含量范围为4.63 × 1017—6.72 × 1019 spins·g−1。公园、居民区、主干道及次干道灰尘中EPFRs的平均含量分别为3.51 × 1018、7.16 × 1017、2.82 × 1019、1.09 × 1019 spins·g−1。对比不同类型城市功能区道路灰尘EPFRs含量,呈现出主干道>次干道>公园>居民区的一般规律,城市道路道路灰尘中EPFRs含量显著高于公园和居民区,且主干道灰尘中EPFRs的平均含量显著高于次干道,公园道路灰尘中EPFRs含量显著高于居民区。
不同城市功能区的服务功能不同,人类活动干扰类型也不相同,可能是造成不同功能区灰尘EPFRs分布产生差异的原因之一。已有研究表明EPFRs的形成通常是在前驱有机物与过渡金属(如Fe、Cu或Mn等)与环境条件相互作用下产生并逐步稳定化的过程[26, 29]。城市道路灰尘中EPFRs的含量高于公园和居民区,主干道EPFRs含量大于次干道,其主要原因可能是道路灰尘中含有机动车排放的大量尾气颗粒物,其中包含重金属、有机污染物以及其它固态污染物杂质,尾气颗粒有很强的吸附性,会吸附空气中的其他有机污染物,为EPFRs在道路灰尘中的形成提供了条件[30]。相关研究表明,住宅区和公园道路灰尘中金属和有机污染物的含量均低于道路[31],灰尘中多环芳烃类有机污染物受动车排放影响较大[32],因此,在前驱物含量较低的影响下,两类功能区道路灰尘能够产生的EPFRs的量也少于一般城市道路。另外,相对于住宅区,公园区域场地一般比较开阔,且周围分布有密集的交通路网,当车流量较大时,机动车运行扰动地面灰尘,使之再悬浮进入空气中,加之机动车本身产生的尾气颗粒物都具有一定的流动性,可能会通过气流传输再沉降到公园地表中,使公园道路灰尘的EPFRs含量增加。反言之,居民区相比公园更封闭,其受到机动车扰动及尾气排放的影响相对较小,因此,居民区道路灰尘中EPFRs的含量更小些。
2.3 暴露风险评估
研究采用健康风险模型评估每人每天通过吸入道路灰尘EPFRs的暴露量,再采用当量香烟数来估算暴露风险。研究分别对不同城市功能区情景下成人和儿童的暴露风险进行了计算(表2),结果显示,对于儿童,EPFRs暴露量在公园约为0.01—0.06支香烟,居民区约为0.004—0.008支香烟,一般道路中约为0.01—0.58支香烟,其中主干道约为0.03—0.58支香烟,次干道约为0.01—0.53支香烟。对于成人,EPFRs暴露量在公园约为0.03—0.16支香烟,居民区约为0.01—0.02支香烟,道路中约0.03—1.53支香烟,其中主干道约为0.09—1.53支香烟,次干道约为0.03—1.40支香烟。按照EPFRs平均含量计算出儿童每人每天通过吸入道路灰尘进入体内的EPFRs量相当于0.1支香烟,成人每人每天吸入体内的EPFRs量相当于0.3支香烟。
表 2 每天吸入道路灰尘EPFRs的当量香烟数(支)Table 2. Number of equivalent cigarettes smoked from inhaling road dust类型Types 儿童 Children 成人 Adults 范围 Range 均值 Mean 范围 Range 均值 Mean 主干道 Trunk road 0.03—0.58 0.24 0.09—1.53 0.64 次干道 Sub trunk road 0.01—0.53 0.09 0.03—1.40 0.25 公园道路 Parkway 0.01—0.06 0.03 0.03—0.16 0.08 居民区道路 Residential road 0.004—0.008 0.006 0.01—0.02 0.016 总体而言,无论在何种功能区情境下,儿童的吸入灰尘EPFRs暴露量均低于成人。无论儿童还是成人,在城市道路情境下人体吸入灰尘EPFRs暴露量均大于公园和居民区,而公园中EPFRs暴露量均大于居民区。这与前文研究不同城市区域EPFRs含量的结果对应一致。成人在城市道路情境下吸入来自道路灰尘的EPFRs暴露量与美国一些地区吸入PM2.5的EPFRs暴露量的研究结果较为接近[1]。西安市PM2.5中EPFRs来源解析相关研究结果显示,机动车尾气排放是大气颗粒物中EPFRs首要来源,其贡献率为32.1%[33]。尾气颗粒在空气中结合其它污染物沉降至地面成为地面灰尘,受交通状况和环境因素影响会再次浮起进入大气中,进而通过人体呼吸进入体内对人体健康造成一定风险[34-35]。目前,道路灰尘与大气颗粒物的交换传输及灰尘中EPFRs的形成机制等问题还尚不清楚,需进一步开展相关研究。
3. 结论(Conclusion)
(1)城市道路灰尘中EPFRs含量范围为4.63×1017—6.72×1019 spins·g−1,平均含量为1.26×1019 spins·g−1。
(2)一般城市道路灰尘中EPFRs含量高于其它功能区道路灰尘,其分布呈现出主干道>次干道>公园>居民区的规律。
(3)城市道路灰尘中EPFRs的g因子范围为2.0032—2.0037,其主要是以碳原子为中心及其邻近有含氧官能团的多种类混合型持久性自由基。
(4)城市道路条件下,人体吸入灰尘EPFRs暴露量均高于其它功能区。儿童每人每天通过吸入灰尘进入体内的EPFRs量约相当于0.01—0.58支香烟(均值为0.1支),而成人每人每天吸入体内的EPFRs量约相当于0.03—1.53支香烟(均值为0.3支)。
-
表 1 不同湿地的进出水水质
Table 1. Characteristics of influents and effluents of different CWs
水质指标 进水值 出水值 CK BW COD (410.81±11.14) mg·L−1 (45.92±12.54) mg·L−1 (36.92±13.63) mg·L−1 NH4+-N (39.90±2.08) mg·L−1 (8.00±2.77) mg·L−1 (4.31±1.78) mg·L−1 TN (43.45±2.89) mg·L−1 (10.56±2.04) mg·L−1 (6.21±2.15) mg·L−1 TP (5.08±0.57) mg·L−1 (1.85±0.97) mg·L−1 (1.70±0.63) mg·L−1 DO (8.12±0.15) mg·L−1 (0.53±0.12) mg·L−1 (0.48±0.08) mg·L−1 pH 7.64±0.08 7.43±0.06 7.36±0.08 注:NO3−-N和NO2−-N未检出。 -
[1] ZHANG X W, HU Z, NGO H H, et al. Simultaneous improvement of waste gas purification and nitrogen removal using a novel aerated vertical flow constructed wetland[J]. Water Research, 2018, 130: 79-87. doi: 10.1016/j.watres.2017.11.061 [2] FU G P, HUANGSHEN L K, GUO Z P, et al. Effect of plant-based carbon sources on denitrifying microorganisms in a vertical flow constructed wetland[J]. Bioresource Technology, 2017, 224: 214-221. doi: 10.1016/j.biortech.2016.11.007 [3] MANDER Ü, TOURNEBIZE J, KASAK K, et al. Climate regulation by free water surface constructed wetlands for wastewater treatment and created riverine wetlands[J]. Ecological Engineering, 2014, 72: 103-115. doi: 10.1016/j.ecoleng.2013.05.004 [4] JIANG X Y, TIAN Y F, JI X Y, et al. Influences of plant species and radial oxygen loss on nitrous oxide fluxes in constructed wetlands[J]. Ecological Engineering, 2020, 142(C): 105644-105644. [5] RAVISHANKARA A R, DANIEL J S, PORTMANN R W. Nitrous Oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century[J]. Science, 2009, 326(5949): 123-125. doi: 10.1126/science.1176985 [6] ZHOU X, CHEN Z H, LI Z R, et al. Impacts of aeration and biochar addition on extracellular polymeric substances and microbial communities in constructed wetlands for low C/N wastewater treatment: Implications for clogging[J]. Chemical Engineering Journal, 2020, 396: 125349. doi: 10.1016/j.cej.2020.125349 [7] LU S B, ZHANG X L, WANG J H, et al. Impacts of different media on constructed wetlands for rural household sewage treatment[J]. Journal of Cleaner Production, 2016, 127: 325-330. doi: 10.1016/j.jclepro.2016.03.166 [8] 侯洁. 生物炭对潜流人工湿地生物脱氮影响机理研究[D]. 重庆: 西南大学, 2017. [9] 邓朝仁, 梁银坤, 黄磊, 等. 生物炭对潜流人工湿地污染物去除及N2O排放影响[J]. 环境科学, 2019, 40(6): 2840-2846. [10] 赵联芳, 梅才华, 丁小燕, 等. 人工湿地污水脱氮中N2O的产生机理和影响因素[J]. 科学技术与工程, 2013, 13(29): 8705-8714. doi: 10.3969/j.issn.1671-1815.2013.29.029 [11] ZHAO W, WANG Y Y, LIN X M, et al. Identification of the salinity effect on N2O production pathway during nitrification: Using stepwise inhibition and 15 N isotope labeling methods[J]. Chemical Engineering Journal, 2014, 253: 418-426. doi: 10.1016/j.cej.2014.05.052 [12] 李一冉, 张建, 胡振, 等. 以化学抑制法研究污水生物处理过程中N2O的释放源[J]. 中国环境科学, 2011, 31(9): 1438-1443. [13] 高雪梅, 佘冬立, 颜晓元, 等. 不同量碳源输入梯度下果园排水沟底泥氮素反硝化与N2O排放研究[J]. 环境科学, 2016, 37(7): 2731-2737. [14] 王宁, 黄磊, 罗星, 等. 生物炭添加对曝气人工湿地脱氮及氧化亚氮释放的影响[J]. 环境科学, 2018, 39(10): 4505-4511. doi: 10.13227/j.hjkx.201801302 [15] HUANG L, CHEN Y C, LIU G, et al. Non-isothermal pyrolysis characteristics of giant reed (Arundo donax L. ) using thermogravimetric analysis[J]. Energy, 2015, 87: 31-40. doi: 10.1016/j.energy.2015.04.089 [16] 蒋甫阳, 李凯, 方芳, 等. C/N对单级脱氮系统N2O排放量及其途径的影响[J]. 环境工程学报, 2016, 10(7): 3483-3490. doi: 10.12030/j.cjee.201502033 [17] 张苗苗, 沈菊培, 贺纪正, 等. 硝化抑制剂的微生物抑制机理及其应用[J]. 农业环境科学学报, 2014, 33(11): 2077-2083. [18] 张曼. 氮肥用量与硝化抑制剂对菜地N2O排放的影响研究[D]. 南京: 南京农业大学, 2015. [19] 国家环境保护总局. 水和废水监测分析方法[M]. (第4版). 北京: 中国环境科学出版社, 2002. [20] 姜丽秀. 好氧亚硝化颗粒污泥工艺及其N2O释放的研究[D]. 济南: 山东大学, 2012. [21] GUPTA P, ANN T W, LEE S M. Use of biochar to enhance constructed wetland performance in wastewater reclamation[J]. Environmental Engineering Research, 2016, 21(1): 36-44. doi: 10.4491/eer.2015.067 [22] BRASSARD P, GODBOUT S, RAGHAVAN V. Soil biochar amendment as a climate change mitigation tool: Key parameters and mechanisms involved[J]. Journal of Environmental Management, 2016, 181: 484-497. [23] KIZITO S, LV T, WU S B, et al. Treatment of anaerobic digested effluent in biochar-packed verticalflow constructed wetland columns: role of media and tidal operation[J]. Science of the Total Environment, 2017, 592: 197-205. doi: 10.1016/j.scitotenv.2017.03.125 [24] FAN J L, ZHANG B, ZHANG J, et al. Intermittent aeration strategy to enhance organics and nitrogen removal in subsurface flow constructed wetlands[J]. Bioresource Technology, 2013, 141: 117-122. doi: 10.1016/j.biortech.2013.03.077 [25] ZHOU X, LIANG C L, JIA L X, et al. An innovative biochar-amended substrate vertical flow constructed wetland for low C/N wastewater treatment: Impact of influent strengths[J]. Bioresource Technology, 2018, 247: 844-850. doi: 10.1016/j.biortech.2017.09.044 [26] 陈炜. 序批式人工湿地污水处理氧化亚氮减排实验研究[D]. 重庆: 重庆大学, 2014. [27] MAMPAEY K E, DE KREUK M K, VAN DONGEN U, et al. Identifying N2O formation and emissions from a full-scale partial nitritation reactor[J]. Water Research, 2016, 88: 575-585. doi: 10.1016/j.watres.2015.10.047 [28] KAMPSCHREUR M J, TEMMINK H, KLEEREBEZEM R, et al. Nitrous oxide emission during wastewater treatment[J]. Water Research, 2009, 43(17): 4093-4103. doi: 10.1016/j.watres.2009.03.001 [29] LIU X. , MAO P N, LI L H, et al. Impact of biochar application on yield-scaled greenhouse gas intensity: a meta-analysis[J]. Science of the Total Environment, 2019, 656: 969-976. doi: 10.1016/j.scitotenv.2018.11.396 [30] FENG Z J, ZHU L Z. Impact of biochar on soil N2O emissions under different biochar-carbon/fertilizer-nitrogen ratios at a constant moisture condition on a silt loam soil[J]. Science of the Total Environment, 2017, 584-585: 776-782. doi: 10.1016/j.scitotenv.2017.01.115 [31] LIANG Y K, WANG Q H, HUANG L, et al. Insight into the mechanisms of biochar addition on pollutant removal enhancement and nitrous oxide emission reduction in subsurface flow constructed wetlands: Microbial community structure, functional genes and enzyme activity[J]. Bioresource Technology, 2020, 307: 123249. [32] 吕婉琳. 生物炭对潜流人工湿地N2O排放的影响机理研究[D]. 重庆: 西南大学, 2018. [33] JI B H, CHEN J Q, LI W, et al. Greenhouse gas emissions from constructed wetlands are mitigated by biochar substrates and distinctly affected by tidal flow and intermittent aeration modes[J]. Environmental Pollution, 2020, 271: 116328. -





 下载:
下载: