-
污水处理行业的臭气主要产生于污水处理厂和污水收集管网泵站等环节,相关治理技术主要有吸收法、吸附法、燃烧法和生物法等[1]。其中,生物除臭技术因其环保、高效、低成本等优点在污水处理厂臭气处理领域得以应用[2]。生物滤柱与生物洗涤塔、生物滤池和生物滴滤塔等生物除臭技术相比,具有占地面积小、运行费用低、处理效率高和管理方便等特点[3-5],但在冬季低温条件下微生物代谢活性受到抑制,极易出现处理效果差、运行不稳定等问题。通过填料投加以增大滤柱有效生物量来提高处理效果是生物滤柱研究中较为重要的强化策略之一[6]。
生物除臭技术中的填料通常具备较好的持水性、良好的透气性和优异的比表面积,有利于微生物膜的形成和微生物的新陈代谢[7]。屈艳芬等[8]采用混合肥料、聚苯乙烯胶球体、活性炭、沸石为混合填料进行除臭实验,取得了良好的处理效果。端艳等[9]采用陶粒作为生物滤池中的填料,发现其对COD和氨氮有良好的去除效果。肖作义等[10]将树皮、活性炭和多孔空心球按照6:2:1的比例混合填充,对NH3和H2S的去除效果较好。刘桂臣等[11]考察了沸石-无烟煤双层滤料生物滤池处理污水的效果,结果表明,可获得良好的出水水质。单一填料生物除臭工艺的运行时间较长时会出现堵塞、透气性变差等问题[12],因此,开发高效、稳定的复合填料以提高生物滤柱的微生物量,成为强化低温环境下滤柱除臭运行效能的重要方式。
本研究通过搭建模拟喷淋-生物滤柱臭气处理工艺,以蜂窝煤渣、活性炭、蜂窝沸石和陶粒构建复合填料强化生物滤柱处理效能,选择污水处理厂主要恶臭气体硫化氢(H2S)和氨气(NH3)作为目标污染物,分析闽南地区(以厦门为例)冬季低温条件下混合填料生物滤柱对2种恶臭气体的去除效果,探究系统成功运行后,复合填料表面生物膜微生物的群落结构变化,并进行物料衡算以综合评估复合填料-生物滤柱的臭气处理效能,为冬季气候条件下闽南地区污水处理厂的臭气高效快速处理提供技术参考。
-
1)接种污泥。实验采用厦门某污水处理厂曝气池活性污泥。接种污泥的TSS为12.29 g·L−1,VSS为7.68 g·L−1,pH为7.68。
2) H2S气体。在密闭瓶中加入硫化亚铁固体,再将一定含量的10%稀硫酸溶液通过蠕动泵以一定流速通入瓶中,使之发生化学反应产生H2S;通过调节蠕动泵控制产气量,使产生的气体质量浓度保持在(5.0 ± 0.6) mg·L−1。
3) NH3气体。通过投加25%氨水模拟NH3的产生,通过流量计调节投加氨水的量,使生物滤柱反应器进水中氨氮质量浓度保持在(35.0 ± 1.5) mg·L−1。
4)喷淋水。以模拟生活污水作为喷淋水源,其组分及质量浓度如下。氯化铵,14.28 mg·L−1;磷酸二氢钾,28.15 mg·L−1;尿素,19.20 mg·L−1;无水氯化钙,8.31 mg·L−1;硫酸镁,33.91 mg·L−1;无水乙酸钠,21.11 mg·L−1;葡萄糖,192.00 mg·L−1;(NH4)6Mo7O2,0.18 mg·L−1;FeSO4·7H2O,1.50 mg·L−1;ZnSO4·7H2O:0.12 mg·L−1;MnCl2·2H2O:0.12 mg·L−1;CoCl2·6H2O:0.15 mg·L−1;CuSO4·5H2O:0.03 mg·L−1。
5)复合填料。该实验选用的复合填料是蜂窝煤渣、活性炭、蜂窝沸石和陶粒。参考已报道文献[10, 12-13],将生物滤柱复合填料的体积投配比设置为4∶4∶1∶1,混合后构建复合填料。蜂窝煤渣取用学校食堂废弃的蜂窝煤渣,干燥、粉碎,过80目标准筛;活性炭的粒径为2~4 mm,蜂窝沸石的粒径为2~4 mm,陶粒粒径为4~6 mm。
-
本次实验地点位于华侨大学厦门校区,实验装置如图1所示。环境温度维持在8~14 ℃。取用厦门某污水处理厂曝气池的活性污泥为生物滤柱提供所需微生物。为准确判断混合填料挂膜情况,每3 d检测1次生物滤池反应器出水COD,确定微生物对营养物质的吸收与利用情况[14]。实验装置主要由H2S发生装置、喷淋装置和生物滤柱组成。生物滤柱为圆柱形,尺寸为φ70 mm×1 700 mm,滤柱有效容积为6.50 L。复合填料置入生物滤柱中,填料区填充高度约为700 mm,体积填充比为0.4。生物滤柱底部连接微曝气装置,反应器启动时开始进行曝气。
-
阶段1是驯化挂膜阶段,运行时间为15 d。本实验采用直接驯化挂膜法[15-16],往生物滤柱中填入活性污泥直至将填料区完全浸没,48 h后再将泥浆排出,然后将模拟生活污水通入反应器中,此过程不通入臭气。每隔3 d在反应器的进水、出水口取样以测定COD含量。
阶段2是H2S气体处理阶段(运行路径①),运行时间为30 d。H2S气体从H2S发生装置由空气泵抽至喷淋装置底部的进气口,再经喷淋后输送至生物滤柱底部的进水口;经过填料区后,残余气体由顶部出气口排出。其中,H2S进气量由空气流量计调节控制;在此阶段中,每隔3 d测定1次进出H2S质量浓度和进出水中SO42−的质量浓度。
阶段3是H2S和NH3混合臭气处理阶段,运行时间为30 d。在第2阶段的基础上,开启氨水释放装置(路径①与路径②同时开启),NH3经喷淋后进入生物滤柱,每隔3 d测定1次进出H2S质量浓度和进出水中NH3-N质量浓度。
-
采用重铬酸钾法测定COD[17];采用纳氏试剂分光光度法测定氨氮(NH3-N)质量浓度[18];采用硫化氢气体检测仪测定H2S质量浓度;采用铬酸钡分光光度法测定SO42−的质量浓度[19]。
-
为探究处理臭气对复合填料生物膜上微生物群落组成多样性和变化情况的影响,分别取接种污泥、运行阶段1、运行阶段2、运行阶段3结束运行后的复合填料上生物膜污泥样品进行分析。每个样品平行取样3次,混合均匀后分别标记为In0、Bio1、Bio2、Bio3。从生物滤柱中取得复合填料层的填料,从其表层提取生物膜污泥样品,在10 000 r·min−1下离心10 min,使得污泥固液分离。然后,使用快速DNA试剂盒(MoBio Laboratories)从污泥沉积物中提取基因组DNA,操作步骤按照试剂盒中提供的使用说明书进行。利用Qubit3.0 DNA检测试剂盒对基因组DNA精确定量,以确定聚合酶链反应(PCR)应加入的DNA量。使用引物(515F和806R)对污泥细菌16S DNA的V3-V4区域进行PCR扩增。利用Gene Tools Analysis Software (Version4.03.05.0, SynGene)对PCR产物进行浓度对比后,按照等质量原则计算各样品所需体积,将各PCR产物进行混合。使用E.Z.N.A.®GelExtractionKit凝胶回收试剂盒回收PCR混合产物,TE缓冲液洗脱回收目标DNA片段。后续建库按照NEBNext®UltraTM DNA Library Prep Kit for Illumina®标准流程进行建库操作,完成后在高通量测序平台Hiseq或Miseq进行上机测序,并通过广东美格基因科技有限公司分析平台(www.magichand.online)对扩增产物进行高通量测序分析。根据MiSeq测序结果检测到的OTU,使用RDP数据库(http://rdp.cme.msu.edu/misc/resources.jsp)进行微生物分类分析,包括科和属级别。每个样本的微生物多样性由Mothur软件计算(http://www.mothur. org/wiki/Schloss_SOP#Alpha_diversity),包括Chao1指数,richness指数;通过Matlab软件实现PCA主成分分析。最后,通过STAMP软件评估微生物群落相对丰度(科、属级别的比较分析)。
-
进出水中溶解性有机物(COD)的变化有助于明确微生物对反应器中有机物质的吸收和降解特性[20]。复合填料-生物滤柱在启动运行阶段(阶段1)15 d的COD变化见表1。在启动运行的前9 d内,生物滤柱对COD的去除率较低(57%~64%);从第12天开始,生物滤柱对COD的去除率逐渐稳定在80%以上,说明生物滤柱内微生物可充分利用进水营养液中的碳源作为自身营养物质。在生物膜上微生物代谢达到平衡后,挂膜成功。这与现有报道[20]情况相符。
-
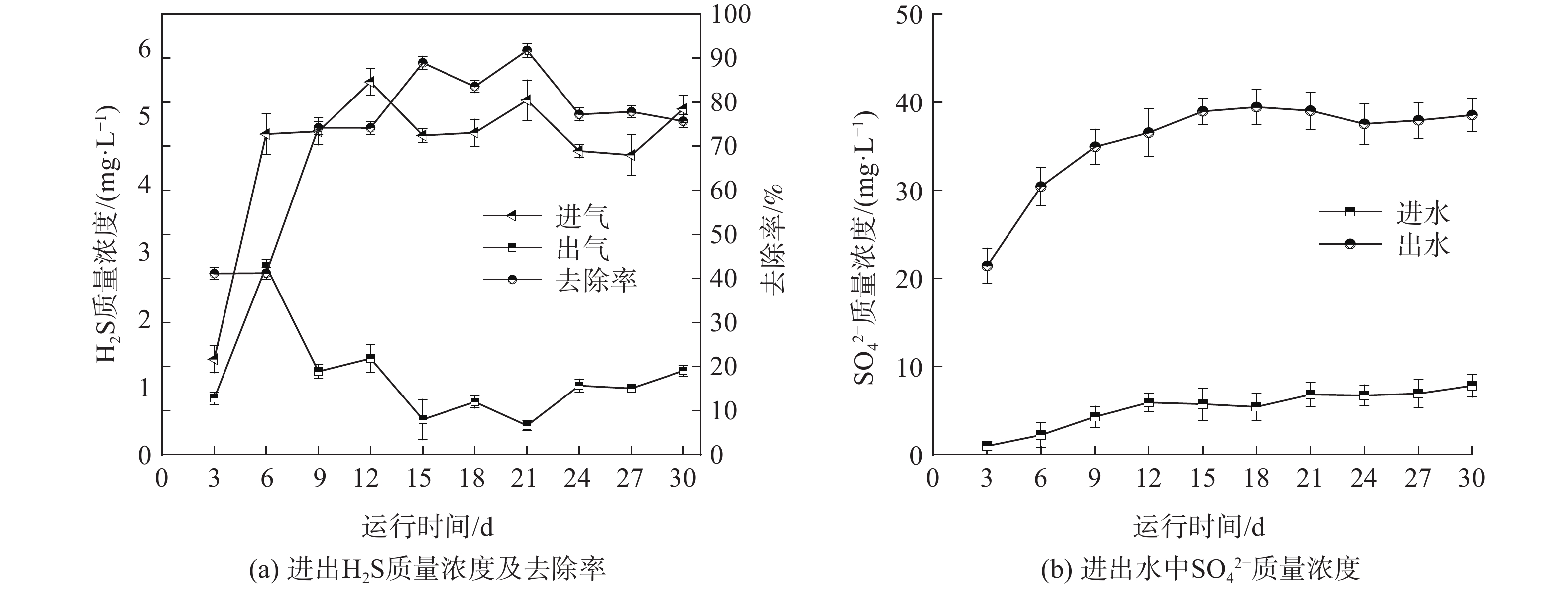
复合填料-生物滤柱反应器对H2S的降解效果如图2所示(运行阶段2)。图2(a)为复合填料-生物滤柱反应器对H2S气体的去除效果。在运行6 d后,H2S的进气质量浓度为4.42~5.51 mg·L−1,出气质量浓度降至0.99~1.66 mg·L−1。在此过程中,H2S的去除率仅为约40%。从第9天开始,H2S的去除率逐渐升高至70%以上,并保持稳定,最大去除率可达91.77%。图2(b)为运行阶段2进出水中SO42−的质量浓度变化(已扣除进水组分中SO42−的质量浓度)。其中,出水SO42−的质量浓度达到21.44~49.44 mg·L−1,远高于进水SO42−的质量浓度,这说明复合填料-生物滤柱硫氧化菌(sulfur-oxidizing bacteria,SOB)得到富集,将H2S转化为SO42−[21]。SO42−的质量浓度可间接反映去除H2S功能菌的富集程度,即随着运行时间的增长,硫氧化菌的富集程度提高,这是H2S对硫氧化菌培养驯化的结果。
-
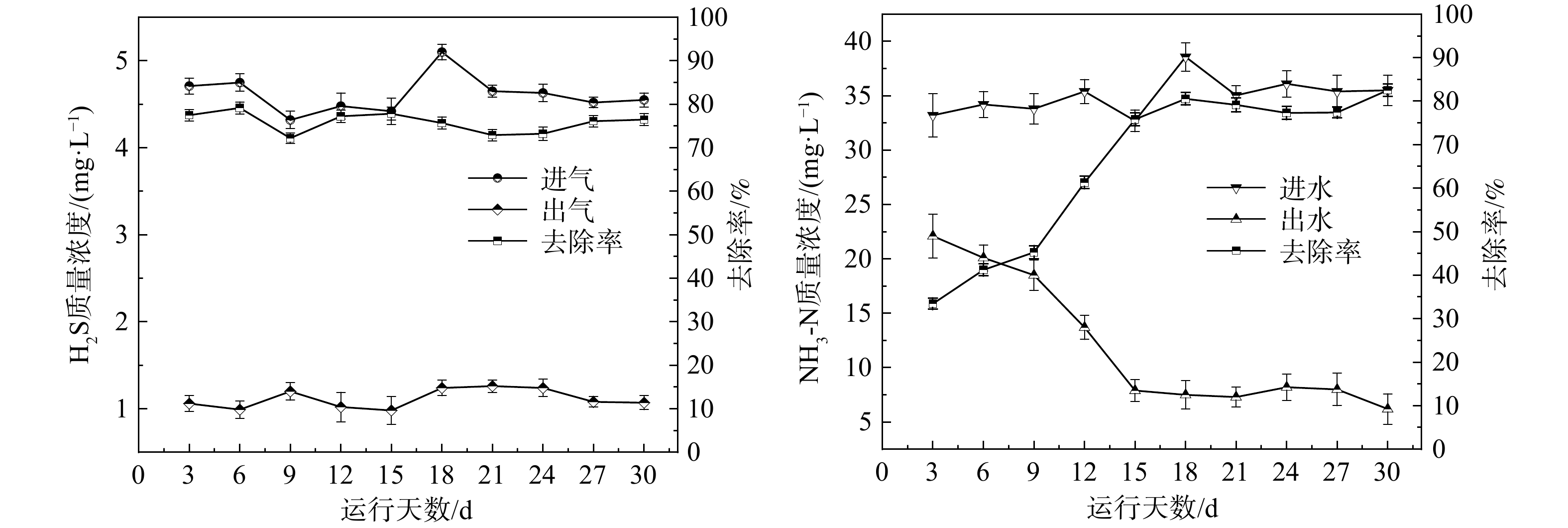
运行阶段3是复合填料-生物滤柱同步去除H2S和NH3的运行阶段。在阶段2的基础上向生物滤柱通入氨水模拟NH3的进入,运行时间为30 d。图3(a)为此运行阶段生物滤柱反应器进出H2S质量浓度的变化及其去除率。在阶段3运行的30 d里,H2S的去除率一直稳定在70%以上,说明生物滤柱对H2S的去除效果良好且运行稳定。图3(b)为进出水NH3-N质量浓度及其去除率。在前15 d内,NH3-N的去除率逐步上升。从第15 d开始,去除率一直稳定在70%以上,其中最大去除率达到82.53%。这与殷峻等[22]研究结果相符,说明生物滤柱可实现对H2S和NH3-N的同步去除,且去除效果良好、运行稳定。
-
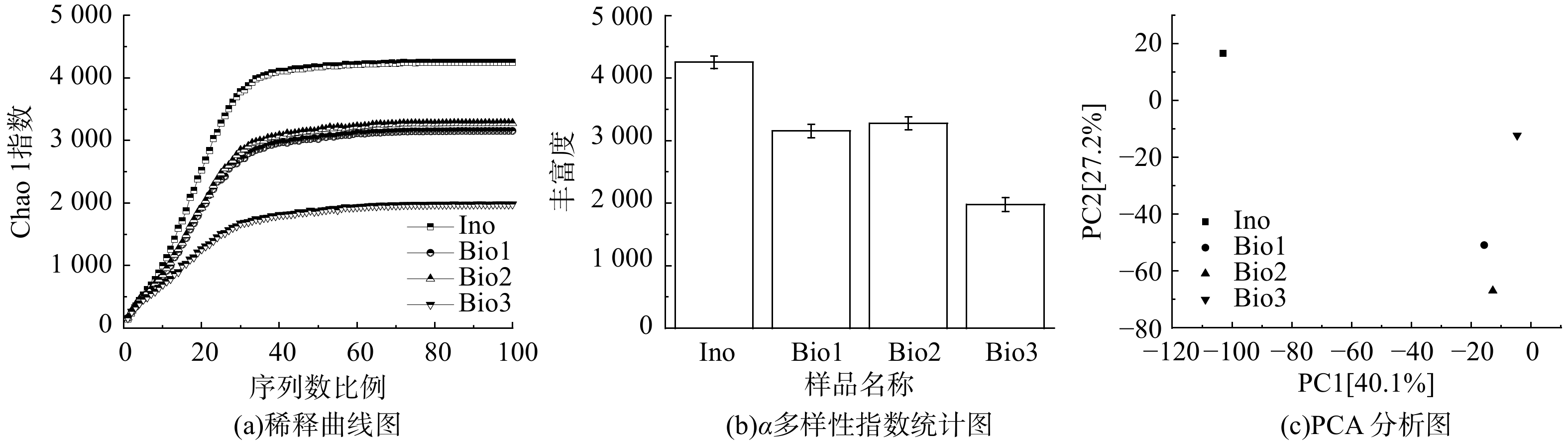
图4(a)为4个样本的稀释曲线。随着样本量的增加,样本稀释曲线趋于平缓,即说明本次实验取样合理,样本测序数据量能反应污泥样品中的总体微生物[23]。
复合填料-生物滤柱内生物膜的微生物群落组成多样性指数如图4(b)所示。样本的物种丰富度随运行天数的增加整体呈下降趋势。这可能是由于驯化与挂膜培养过程中微生物生存环境和营养源的改变所致。样本Bio2的物种丰富度与样本Bio1相差不大,说明通入H2S对微生物物种丰富度的影响较小;而样本Bio3的物种丰富度小于样本Bio2,这可能由于高负荷H2S和NH3环境会对微生物群落产生抑制作用,降低了微生物丰富度[24]。
主成分分析(principal component analysis,PCA)主要用于考察样本间最主要的差异特征,样本在坐标系中的距离远近可最大程度地还原样本间的实际差异。图4(c)为4个样本的PCA分析图,可观察到接种污泥样本In0与其他3个样本在坐标系中距离较远,微生物物种差异性较大。这说明通入臭气后,生物滤柱反应器中的微生物种群有较大变化,即臭气(H2S、NH3)的进入对复合填料生物膜菌群结构起到重要的重塑作用,进而改变微生物群落功能,使之具备脱硫除氮能力。而样本Bio1和样本Bio2在坐标系中距离相近,样本Bio3相比较下较远,说明通入H2S并运行30 d后的反应器内微生物种群变化不明显。在进入氨气后,反应器内微生物种群变化较为明显,说明单一臭气(H2S)对复合载体生物膜菌群结构的影响小于混合臭气,加入氨气后反应器内微生物种群的变化更为明显。这表明混合臭气(H2S+NH3)对微生物菌群具有更显著的筛选与驯化作用。这也是Bio3样品丰富度降低(图2)的主因,亦与前述报道[24]相符。
-
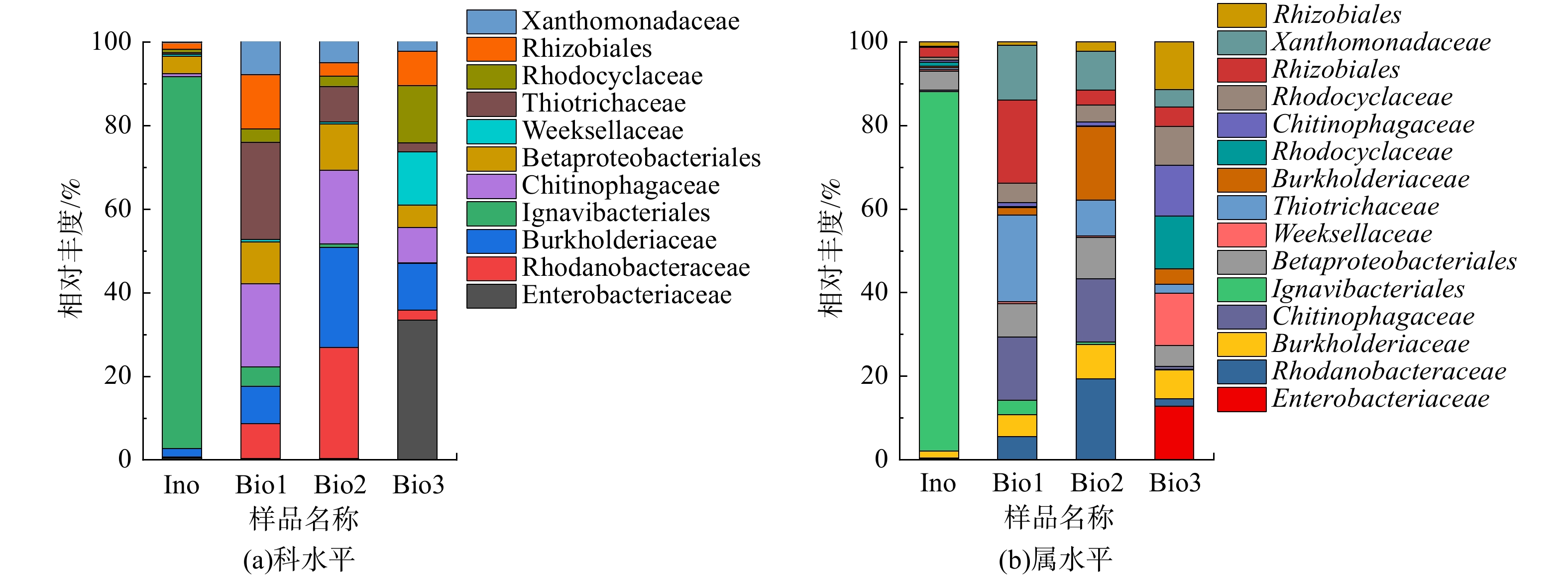
对4个样本在科水平的微生物群落组成(相对丰度>0.01%)进行了分析,其结果见图5(a)。由图5(a)可见,4个样本的物种组成相似,但相对丰度占比存在明显区别。Ignavibacteriales的相对丰度在通入H2S后呈现明显下降趋势,Ignavibacteriales科属于绿硫细菌 (green sulfur bacteria,GSB),但是没有硫氧化能力[22],故通入H2S后,其丰度下降,并逐渐被具有硫氧化能力的硫氧化菌及其他硫氧化菌取代。而Rhizobiales、Thiotrichaceae和Chiitinophagaceae在通入H2S后相对丰度上升,是除H2S优势功能菌和有机物降解菌。通入H2S运行30 d后,Burkholderiaceae和Rhodanobacteraceae的相对丰度升高,为除H2S优势功能菌。加入NH3进入反应器至运行结束,Rhodocyclaceae、Weeksellaceae和Enterobacteriaceae的相对丰度上升,而Xanthomonadceae、Thiotrichaceae和Rhodanobacteraceae的相对丰度下降。NH3的加入,使脱氮优势菌丰度上升,与除H2S优势菌竞争营养物质,从而导致部分除H2S优势菌的丰度下降,NH3的存在会对部分脱硫微生物产生抑制作用,亦是污泥样品Bio3与Bio2产生菌群差异性的主因(图4(c))。综上所述,Rhodocyclaceae、Weeksellaceae和Enterobac是H2S与NH3混合臭气处理阶段的优势微生物。
图5(b)为4个样本在属水平的微生物群落组成(相对丰度>0.01%)。接种污泥样本In0中Ignavibacteriales(88.90%)的相对丰度最高,通入臭气后呈现明显下降趋势。这说明H2S对Ignavibacteriales
有抑制作用,通入H2S会导致其丰度下降,逐渐被其他除臭优势菌取代,这与图5(a)呈现的分析结果一致。在通入H2S后,Thiothrix的相对丰度从0.38%上升至23.22%,Ferruginibacter的相对丰度从0.40%上升至19.16%,菌属Thiothrix和Ferruginibacter与H2S降解相关[25-26]。在通入H2S运行30 d后,Burkholderiaceae、Tahibacter相对丰度从1.57%、8.38%分别上升至13.75%和26.61%,这说明Burkholderiaceae、Tahibacter对H2S的生物降解/转化有积极的贡献作用,与已有报道[27-28]结果一致。从加入NH3至反应器运行结束,Dinghuibacter、Cloacibacterium和Kosakonia的相对丰度显著上升,分别从0.61%、0.48%和0.32%上升至7.65%、12.8%和33.42%,而Burkholderiaceae、Tahibacter和Ferruginibacter的相对丰度显著下降。这说明Dinghuibacter、Cloacibacterium和Kosakonia为氨氮去除相关功能菌[29-31]。 -
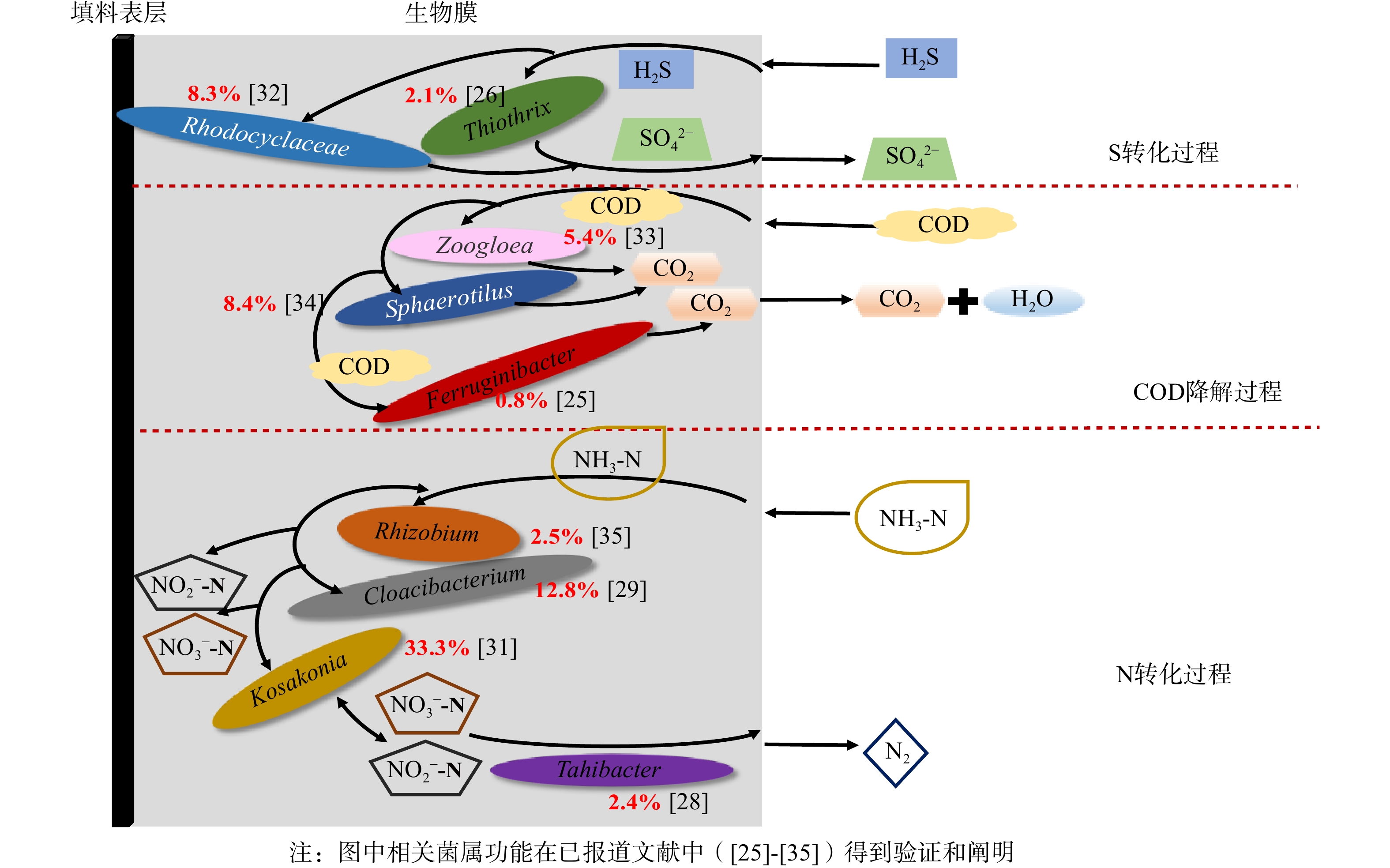
复合填料表层生物膜内除臭微生物群落中的核心菌属成员及其对H2S、NH3的转化作用见图6。Thiothrix是硫化物氧化丝状菌属,以H2S为能源,可将H2S氧化为硫粒积累在菌体内,在缺乏营养时又将硫粒氧化为SO42−,从而获得能量。Rhodocyclaceae属于紫色非硫细菌 (purple nonsulfur bacteria,PNSB),可将硫化物氧化成SO42−。H2S喷淋后生成氢硫酸(H2S),扩散进入生物膜后被Thiothrix[26]和Rhodocyclaceae[32]氧化为SO42−,从而将H2S从水中去除。Thiothrix在Bio1的相对丰度(图5(b))为23.22%(高于In0中的0.38%),这可能是由于H2S的存在造成Thiothrix在生物膜中的富集,从而加快去除H2S。而Bio3中Rhodocyclaceae的相对丰度从接种污泥的0.50%上升至8.30%,是运行阶段3中去除H2S的优势功能菌。水中的有机物质被有机物降解菌Zoogloea、Sphaerotilus和Ferruginibacter降解为CO2和H2O。Zoogloea和Sphaerotilus属在接种污泥In0中的相对丰度仅为0.31%和1.75%,在Bio3中上升到5.36%和8.38%,对COD的降解具有积极贡献[33-34]。Ferruginibacter属的相对丰度从In0的0.40%上升至19.16%,这与COD降解密切相关[25]。生物膜中的Rhizobium[35]和Kosakonia[31]是具有固氮作用的菌属;Cloacibacterium[29]可促进硝酸盐还原酶和亚硝酸盐还原酶的产生,并将水中的氨氮转化为硝酸盐和亚硝酸盐,再通过Tahibacter在有氧条件下将硝酸盐和亚硝酸盐还原为N2[28],从而达到脱氮的效果。Cloacibacterium在In0中的相对丰度为0.40%,在Bio3中因NH3的加入而上升至12.81%;Kosakonia的相对丰度从0.48%上升至33.43%,是运行阶段3中去除氨氮的重要贡献者。
填料的选择与复合填料-生物滤柱的除臭效能密切相关。蜂窝煤渣含有Ca、Al、Fe、Mg等多种成分,结构疏松、微孔多、比表面积大,因而具有较好的吸附性能,同时对磷和氨氮也有一定的去除效果[36-37]。活性炭对有机物的吸附能力强、过滤速度快,同时具有较大的比表面积,有利于生物膜的生长[38-39]。沸石具有发达的孔隙结构、巨大的比表面积及稳定的物理和化学性质,是优良的吸附剂和生物载体,同时还兼具较强的氨氮吸附能力,可强化对氨氮的去除效果[39-40]。陶粒具有生物附着性强、挂膜性能良好、水流流态佳、大孔隙结构发达、表面粗糙等优点,微生物不仅可在其表面生长,还可在其孔隙内附着生长,为自养和异养菌提供良好的生长环境,是较好的生物挂膜载体[41-42]。
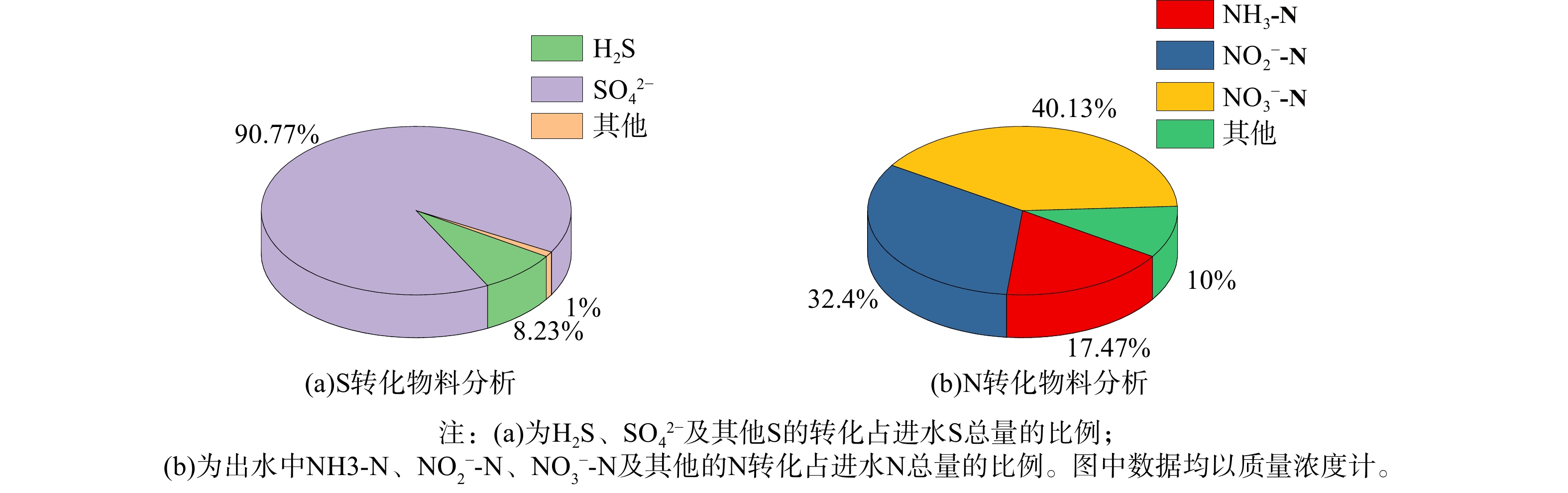
复合填料-生物滤柱反应器中的硫和氮物料衡算分析见图7。在硫素转化方面,90.77%的H2S被转化为SO42−,表明生物滤柱中S转化功能菌的富集对H2S的去除具有重要作用;在氮素转化方面,72.53 %的NH3-N被转化为硝酸盐和亚硝酸盐,,表明此时复合填料生物膜兼具N素去除的重要功能。
与已报道相似文献对比,方媛媛等[13]采用陶粒、火山岩、沸石和轮胎颗粒4种材料以体积比1∶1∶1∶1混合的填料,在23℃下对氨氮的去除率可达到92.6%;聂中林等[43]以沸石-陶粒为填料在曝气生物滤池中对氨氮的去除率达到94.6%;肖作义等[10]在实验温度为21~35 ℃时,发现以树皮、活性炭和多孔空心球(体积比为6∶2∶1)为填料的生物滤池对H2S和NH3的最大去除率为99.24%和97.53%。本研究采用蜂窝煤渣、活性炭、蜂窝沸石和陶粒体积比为4∶4∶1∶1的组合填料-生物滤柱,在实验温度为8 ℃~14 ℃时,对H2S和NH3的最大去除率可达91.77%和82.53%。相比于其他研究,本研究中组合填料-生物滤柱的去除效果可能稍显不足,鉴于低温条件下微生物活性受到抑制,本研究已达到预期处理效果。
-
1)在厦门市冬季低温条件下,通过蜂窝煤渣、活性炭、蜂窝沸石和陶粒4种填料构建了复合填料-生物滤柱生物除臭工艺,运行15 d即可实现成功挂膜,且对H2S和NH3的最大去除率为91.77%和82.53%,工艺运行高效稳定。
2)在低温条件下,复合填料生物膜中菌属Thiothrix、Rhodocyclaceae、Zoogloea、Sphaerotilus、Ferruginibacter、Rhizobium、Cloacibacterium、Kosakonia、Tahibacter对物质降解协作密切,是生物除臭的优势功能微生物。其中,Thiothrix和Rhodocyclaceae属与H2S去除相关;Rhizobium、Cloacibacterium、Kosakonia与Tahibacter属对NH3的去除与转化具有重要贡献作用;有机物降解菌Zoogloea、Sphaerotilus和Ferruginibacter是水相溶解态COD去除的主要贡献者。
闽南地区低温下复合填料强化生物滤柱除臭及微生物分析
Efficiency and microbial analysis of deodorization process of biofilter enhanced by composite filler under low temperature in Southern Fujian
-
摘要: 通过搭建复合填料-生物滤柱反应装置,在厦门冬季低温环境下开展复合填料(蜂窝煤渣、活性炭、蜂窝沸石和陶粒)强化生物滤柱除臭研究,分析了除臭微生物群落组成特性。复合填料-生物滤柱装置在启动运行15 d时其COD去除率达到85%以上且保持稳定,对H2S和NH3的最大去除率可分别达到91.77%和82.53%,表明挂膜成功。菌群分析结果表明:以H2S、NH3等臭气喷淋液为基质的生物滤柱驯化挂膜过程会降低微生物的丰度和多样性;菌属Thiothrix、Ferruginibacter、Burkholderiaceae、Tahibacter、Dinghuibacter、Cloacibacterium和Kosakonia是除臭过程的优势功能微生物和臭气成分降解的贡献者。本研究阐明了复合填料生物膜内功能菌属对H2S、NH3等臭气喷淋液有机质的生物降解/转化机制,并进行了物料平衡分析;复合填料-生物滤柱装置对H2S与NH3的平均去除率分别达到90.77%和72.53%,具有良好的生物除臭效果与运行稳定性。本研究可为南方低温季节的污水臭气治理提供技术参考和理论支撑。Abstract: The deodorization performance of the composite filler (honeycomb cinder, activated carbon, honeycomb zeolite and ceramsite) enhanced biological filter was studied under low temperature environment in Xiamen in winter, through the establishment of a compound filler-biological filter reaction device. After 15 days of operation, the chemical oxygen demand (COD) removal efficiency of the composite packing biological filter column device reached more than 85% and remained stable. The maximum removal efficiencies of H2S and NH3 could reached 91.77% and 82.53%, respectively, indicating that the film was successfully attached. The results of bacterial community analysis showed that the domestication and membrane hanging process of biofilter column based on odor spray liquid such as H2S and NH3 would reduce the abundance and diversity of microorganisms. The genera of thiothrix, ferraginibacter, burkholderiaceae, tahibacter, dinghuibacter, cloacibacterium and kosakonia were the dominant functional microorganisms in the deodorization process and contributed to the degradation of odor components. In this study, the biodegradation / transformation mechanism of organic matter in odor spray liquid such as H2S and NH3 by functional bacteria in composite filler biofilm was clarified, and the material balance analysis was carried out. During operation, the average removal efficiencies of H2S and NH3 by the system reached 90.77% and 72.53%, respectively, indicating that the process had good biological deodorization effect and operation stability. This study can provide reference for the application of biological waste gas / odor treatment process in low-temperature season or cold area.
-
随着工农业的迅速发展,氯代烃类有机物作为生产原料和溶剂被人类广泛地应用在工业生产、农药、干洗和医疗等行业[1],造成了一系列环境问题。氯代烃类在环境中随着雨水、径流等渗滤到土壤中[2],被土壤吸附一部分后渗漏到地下含水层,导致地下水污染[3],其中地下水中四氯乙烯、三氯乙烯及四氯化碳等污染尤为普遍[4-6]。本研究中选取一种典型氯代烃PCE作为研究对象,该物质是在常温下易挥发、非易燃的重质非水溶相液体(dense non-aqueous phase liquids,DNAPLs),化学性质稳定,且有很强的生物毒性和潜在的生物累积性,并具有刺激性、致敏性、致突变性、致畸性、致癌性等特性,已被较多国家列为优先控制污染物[7]。一旦PCE通过各种途径进入地下环境,会下渗到地下水深层,严重污染地下水资源,对生态环境和人体健康产生极大的危害[8]。1999年北京市地下水有机污染调查结果表明,北京地区有2处氯代烃污染区域面积超过10 km2,主要污染物为TCE和PCE,最高浓度分别为487.6 μg∙L−1和63.74 μg∙L−1,其中PCE的检出率较高[9]。为了保护生态环境及促进可持续发展,地下水中氯代烃污染问题亟待解决,地下水水质保护和污染修复刻不容缓[10]。
考虑到微生物修复技术具有易于原位修复、处理成本低、无二次污染且可以实现无害化等优点,故进一步研究微生物群落对PCE的降解非常必要[11]。近年来,国内外研究人员对氯代烃的生物降解进行了大量探索和研究[12-19]。在厌氧条件下,氯代烯烃可以作为某些细菌的终端电子受体,通过厌氧微生物作用发生还原脱氯,生成次级产物,最终达到无害化的修复目的,而加入一些有机质进行共代谢可以提高其降解速率[12-14]。有研究[15]发现,将厌氧细菌Y51株和好氧性混合株P. pseudocalcaligenes KF707-D3株综合运用可以将难生物降解的PCE完全分解。实际上,单一的厌氧菌或好氧菌很难彻底快速降解PCE[16]。迄今为止,仅发现Dehalococcoides mccartyi属的菌株能使PCE完全脱氯[17],且该属菌株对碳源要求较高,一般需要醋酸盐作为碳源[18],生长条件较为苛刻。然而,多种常见微生物如脱硫单胞菌,硫磺菌等可以协同合作将PCE还原脱氯[19]。
目前,对微生物修复氯代烃的研究主要集中在单一好氧菌株以及厌氧菌株的运用。因此,有必要研究地下水环境中微生物群落降解氯代烃的特性,从而进一步探索提高氯代烃生物降解速率的可行方法。尽管有很多学者研究某类共代谢基质条件下微生物菌株是否能够成功脱氯,但很少有学者针对微生物群落在不同共代谢基质条件下的脱氯能力开展相关研究[20]。因此,根据现阶段氯代烃修复的研究经验,本研究选取一种典型氯代烃PCE,旨在评估模拟地下水环境下降解菌群的共代谢脱氯能力。本研究采用振荡培养法[21]来筛选并鉴定出PCE优势降解菌群,对环境因素开展实验并对其进行了条件优化,探索了不同共代谢基质条件下PCE降解的规律,建立了反应动力学模型,比较了不同共代谢基质条件下微生物的脱氯能力。
1. 材料与方法
1.1 实验原料
四氯乙烯(C2Cl4)和甲醇(CH3OH)为色谱纯,酵母浸膏和维生素B12为生物试剂,乙醇(CH3CH2OH)、三水合磷酸氢二钾(K2HPO4∙3H2O)、七水合硫酸亚铁(FeSO4∙7H2O)、一水合磷酸二氢钠(NaH2PO4∙H2O)、氯化铵(NH4Cl)、七水合硫酸镁(MgSO4∙7H2O)、七水合硫酸锰(MnSO4∙7H2O)、七水合硫酸锌(ZnSO4∙7H2O)、乳酸钠(dl-C3H5O3Na)、葡萄糖(C6H12O6)、六水合氯化钴(CoCl2∙6H2O)、一水合次氮基三乙酸三钠(N(CH2CO2Na)3∙H2O)均为分析纯。
1.2 实验装置
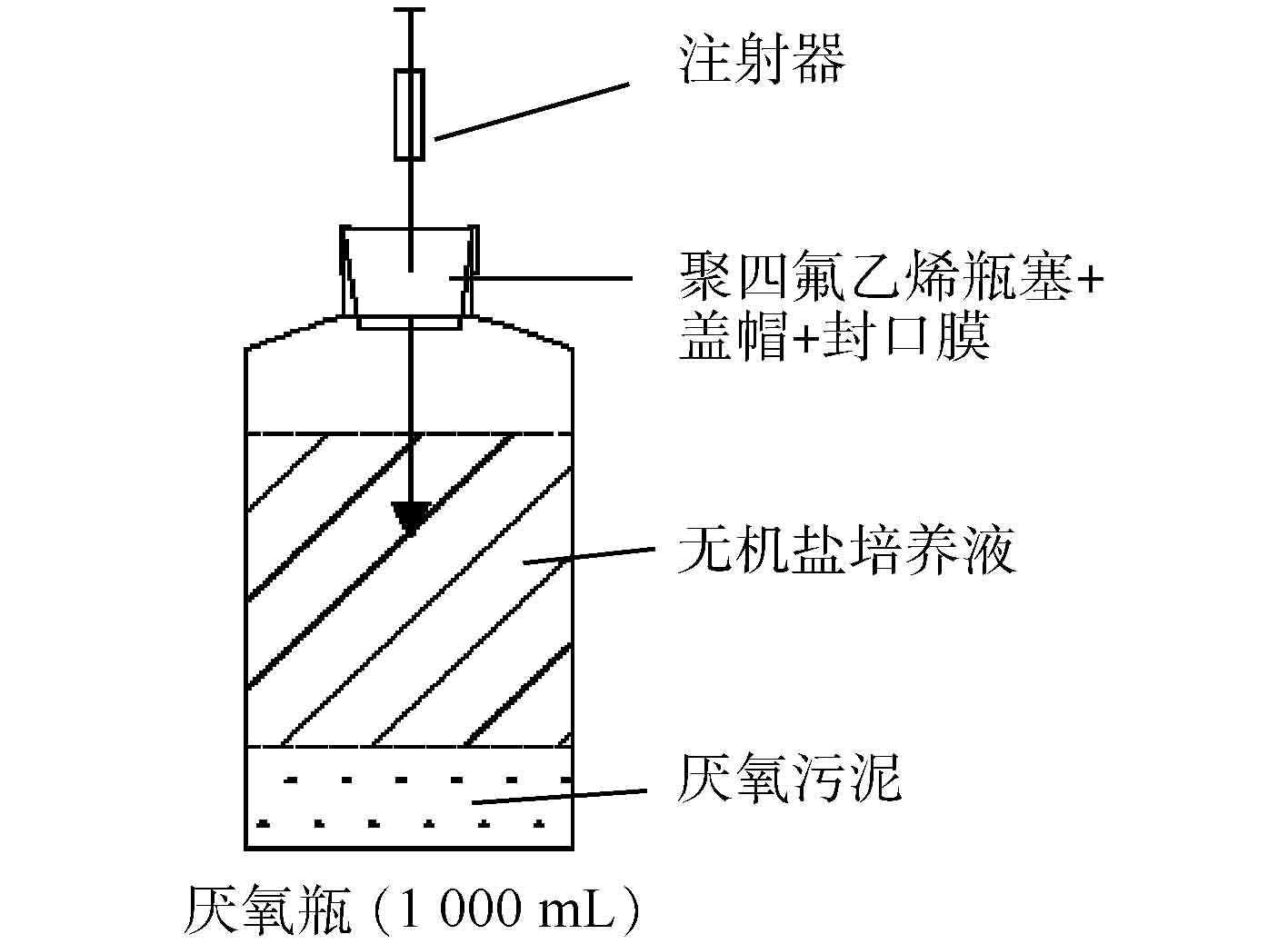
实验过程中使用的仪器设备:恒温振荡箱(MQL-621R,上海旻泉仪器有限公司)、厌氧培养箱(YQX-Ⅱ型,上海新苗医疗器械制造有限公司)、立式压力蒸汽灭菌锅(YM30型,上海三申医疗器械有限公司)、紫外可见分光光度计(TU-1810,北京普析通用仪器有限责任公司)、氮吹仪器(ANPEL DC12,上海安谱实验科技股份有限公司)、气相色谱仪(Agilent7820A,安捷伦科技有限公司)、Illumina Mi Seq平台(微基生物科技(上海)有限公司)。驯化实验采用厌氧瓶密封操作,实验装置见图1,可定期使用注射器采样。
1.3 实验方法
PCE降解菌群的驯化筛选。以南京某污水处理厂的厌氧活性污泥为菌种来源,采用图1的实验装置对厌氧活性污泥进行驯化培养,整个实验操作过程在厌氧培养箱中完成。实验配制无机盐培养基来模拟地下水[22],其组成成分为:K2HPO4∙3H2O 1.05 g∙L−1、NaH2PO4∙H2O 0.25 g∙L−1、NH4Cl 0.49 g∙L−1、N(CH2CO2Na)3∙H2O 0.03 g∙L−1、dl-C3H5O3Na 0.112 g∙L−1、MgSO4∙7H2O 0.05 g∙L−1、FeSO4∙7H2O 3 mg∙L−1、MnSO4∙7H2O 0.74 mg∙L−1、ZnSO4∙7H2O 0.74 mg∙L−1、CoCl2∙6H2O 0.25 mg∙L−1、维生素B12 0.05 mg∙L−1[23]。PCE降解菌群的驯化采用梯度驯化法[24],按PCE浓度由低到高进行,先将200 mL活性污泥接种到700 mL除氧灭菌后的无机盐培养基中(除非特殊说明,pH均在6.80~7.25),随后采用聚四氟乙烯瓶塞和铝卷曲盖密封血清瓶,并采用无菌注射器加入PCE溶液。PCE溶液浓度初次设定为0.5 mg∙L−1,然后放置于30 ℃、转速为30 r∙min−1的恒温振荡培养箱中进行培养驯化7 d,之后更新培养基并将浓度依次递增为1、2、3、4、5 mg∙L−1[22],每个阶段均培养7 d。
PCE降解特性研究。将100 mL无机盐培养基置于血清瓶中,所有培养基在使用前均利用氮气吹扫30 min,然后用高压灭菌锅在121 ℃下灭菌30 min,最后放入厌氧培养箱中冷却备用。将经过梯度驯化后获得的菌液按5%投加量接入含有100 mL无机盐培养基的血清瓶中,随后采用特氟隆表面橡胶隔膜(美国安捷伦公司)和铝卷曲盖密封血清瓶,PCE初始投加量设定为1 mg∙L−1,随后置于30 ℃、30 r∙min−1条件下恒温振荡器中培养。实验过程中每隔24 h采样1次,测定培养基中残留PCE的浓度以及吸光度,分析驯化所得菌群的PCE降解特性及菌群生长曲线。
环境因素对微生物群落降解PCE的影响。在保持与降解特性实验相应条件不变的前提下,分别研究不同温度(10、20、30 ℃)、不同pH(6、7、8)、不同PCE初始浓度(0.5、1、1.5、2、2.5 mg∙L−1)等条件对菌群降解PCE的影响。在相同的实验条件下,不接种菌液作对照,每组实验重复做3个平行样,取平均值。每隔24 h采样1次,测定培养基中残留PCE的浓度,采样结束后使用硅胶填缝密封盖上留下的针孔以防止PCE挥发。
不同共代谢基质对微生物群落降解PCE的影响。为了探索各种共代谢基质对降解菌群性能的影响,将培养所得菌液按5%接种量加入100 mL的无机盐培养液,PCE初始投加量设定为1 mg∙L−1,再分别加入甲醇、乙醇、葡萄糖、酵母浸膏、乳酸钠[25]。其中,葡萄糖以及酵母浸膏浓度为1 g∙L−1、甲醇浓度为0.6 g∙L−1、乙醇浓度为20 mg∙L−1、乳酸钠浓度为0.77 g∙L-1[26]。在30 ℃、30 r∙min−1条件下振荡培养,每24 h采样检测,并利用实验结果建立动力学模型。
1.4 分析方法
实验中PCE浓度采用顶空气相色谱仪[27](Agilent 7820A,美国Agilent公司)及DB-624色谱柱测量。
实验中菌群浓度采用分光光度法[25]测定,取适量实验样品放入1 cm的比色皿中,利用紫外分光光度计测量其在600 nm处的吸光度(A600)。
实验中PCE降解菌群群落结构分析采用16S rDNA[28]来分析,按照柱式细菌基因组抽提试剂盒的使用操作说明,对混合培养体的菌液中的DNA进行提取[29],将纯化后的样品利用Illumina Mi Seq平台进行高通量测序。
2. 结果与讨论
2.1 菌群对PCE降解特性研究
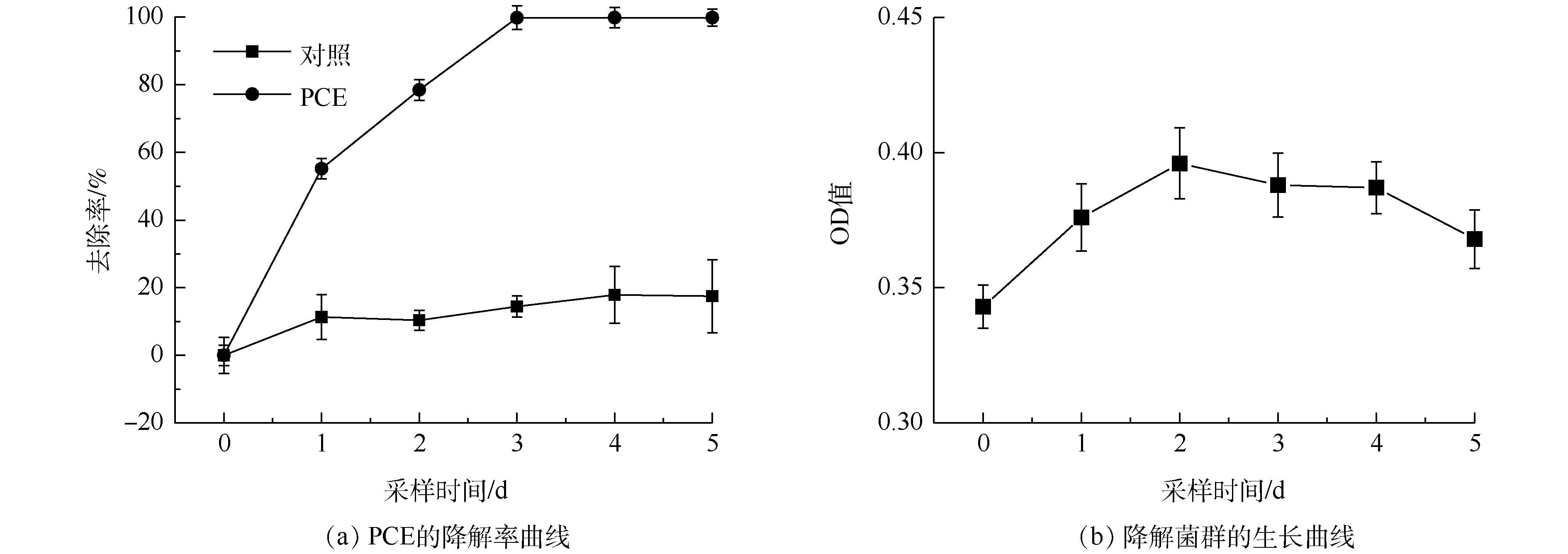
驯化期后PCE降解曲线及菌群生长曲线见图2。由图2(a)可知,PCE能得到高效降解并且去除率已明显高于90%。由图2(b)可知:降解初期(0~2 d),菌群在PCE存在条件下能以较快速度生长;随着采样时间的推移,中期(2~4 d)达到静止期,OD值缓慢下降;后期(4~5 d),由于PCE含量不足,菌群活性被抑制,OD值下降较快。筛选得到的菌群能够高效降解PCE,可以进行菌种鉴定以及环境因素影响实验。
2.2 PCE降解菌群的结构组成
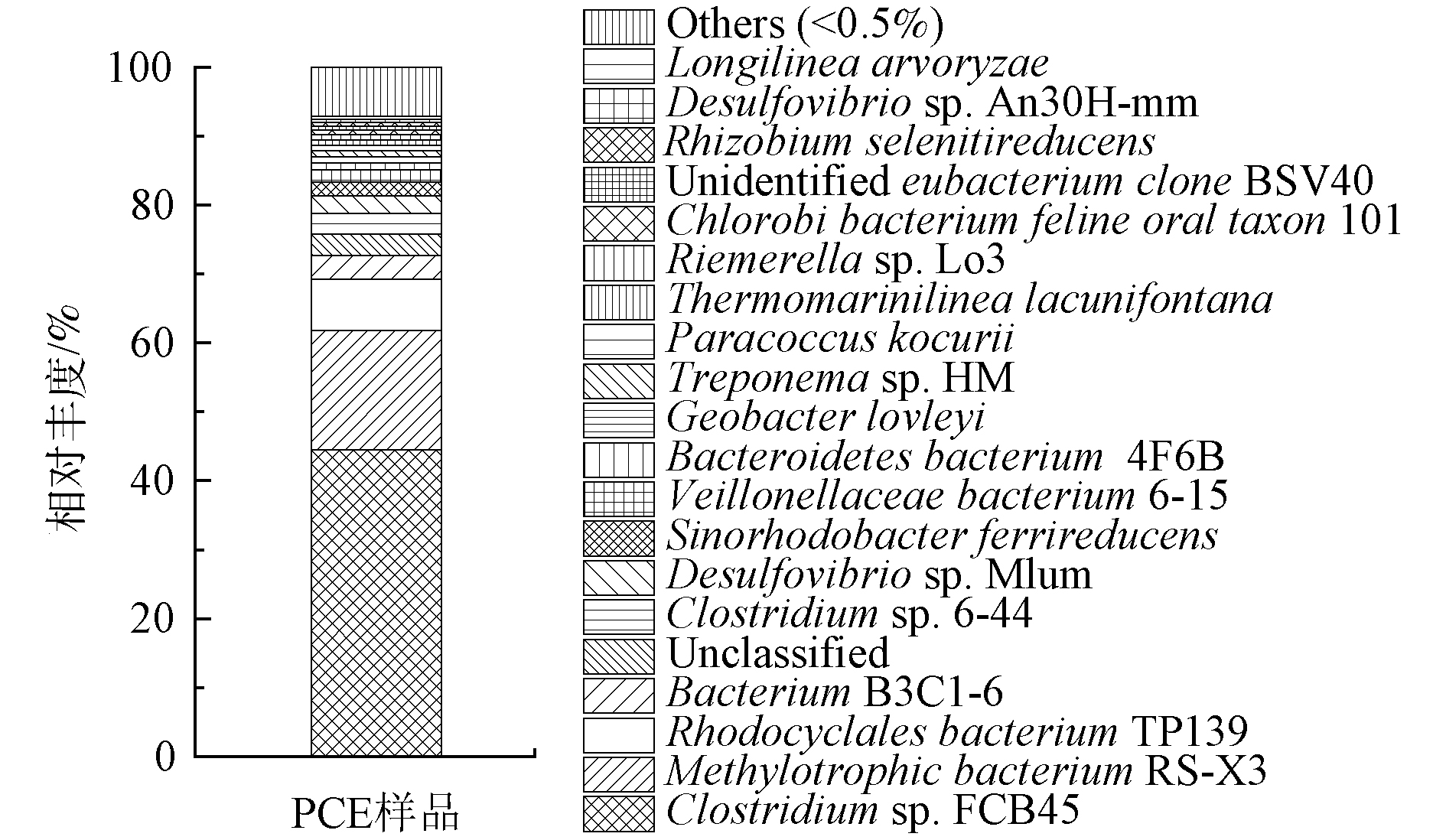
种水平下的样本群落结构组成分布见图3,菌种鉴定结果表明PCE的降解菌群群落结构复杂多样。该菌群中共有16个高于0.50%的种,分别为Clostridium sp. FCB45、Methylotrophic bacterium RS-X3、Rhodocyclales bacterium TP139、Bacterium B3C1-6、Clostridium sp. 6-44、Desulfovibrio sp. Mlhm、Sinorhodobacter ferrireducens、Veillonellaceae bacterium 6-15、Bacteroidetes bacterium 4F6B、Geobacter lovleyi、Treponema sp. HM、Paracoccus kocurii、Thermomarinilinea lacunifontana、Riemerella sp. Lo3、Chlorobi bacterium feline oral taxon 101及Rhizobium selenitireducens。其中,梭状芽孢杆菌(Clostridium sp. FCB45)含量最高,占总量的44.49%,成为优势菌种。这一结果证实了DAVID[12]在微生态研究中推测Clostridium属这种活性较高的梭状菌可以成为降解PCE的潜在微生物的结论。然而,因为这是由普通污水厂的厌氧污泥驯化而来的,故与LOFFLER等[30]在被PCE长期污染的沉积物中所观察到的Desulfuromonas和Dehalococcoides是PCE的优势降解菌有所不同。Methylotrophic bacterium RS-X3含量为17.34%,作为甲基营养菌不仅可以在氯化甲烷上生长[31],并且其被证实含有脱氯酶基因[32],因此,可推测在本研究中Methylotrophic bacterium RS-X3可以促进PCE的生物降解。而占总量7.39%的Rhodocyclales bacterium TP139作为能够利用多种有机化合物生长的多功能细菌的代表[33],首次在PCE降解菌群中被发现并检测到。
有研究表明,脱硫弧菌属(Desulfovibrio sp. Mlhm)可以参与几种氯代污染物的脱氯和硫酸盐还原,包括1, 2-二氯乙烷[34]、1-三氯乙烷[35]和氯仿[36],Treponema属(Treponema sp. HM)能够通过添加醋酸盐将五氯苯酚脱氯成氢气、二氧化碳和甲酸盐[37],Bacteroides属(Bacteroidetes bacterium 4F6B)可降解甲基叔丁基醚[38],Sinorhodobacter ferrireducens能利用肌醇、L-丙氨酸、4-羟基苯甲酸和L-脯氨酸作为碳源[39],Thermomarinilinea属(Thermomarinilinea lacunifontana)能在多种有机物存在时生长(包括明胶、甲壳素、谷氨酸等)[40]。这些菌株也在该菌群中被检测到,其含量分别为2.61%、0.85%、0.97%、1.99%和0.80%,其中Desulfovibrio、Treponema属为潜在PCE降解菌。
2.3 环境因素对降解的影响
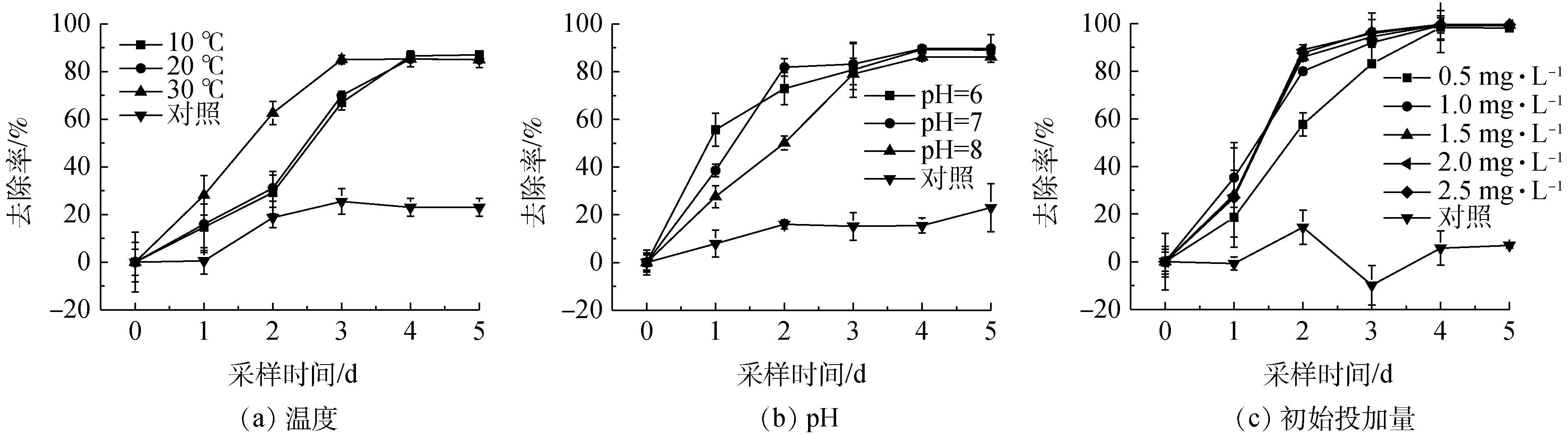
环境因素对PCE降解效果的影响见图4。由图4(a)可知温度对PCE降解率的影响不显著。数据显示3个温度梯度下去除率均高于80%,表明该菌群整体代谢活性较高,具有较宽的温度生态幅,适应不同温度的环境能力较强。在实验初期(0~3 d),菌群在10 ℃以及 20 ℃下对PCE的降解速率相比30 ℃较慢;在后期(4 d后),菌群在10 ℃和20 ℃时对PCE的降解率与其在30 ℃下的降解率相当。ZHANG等[41]也得出TCE去除率随温度的升高(从20 ℃上升到30 ℃)而增加的类似结论。SHARMA等[42]认为,低温下微生物需要更多的时间来矿化疏水性物质。因此,生物反应与化学反应都会减慢速率,而较高的温度会导致生物降解增加。一般地下水的平均温度约为15 ℃(我国西北地区冬季地下水水温仍处于10 ℃左右)[43-45],可以达到该菌群生长的适宜温度范围。
由图4(b)可知:菌群在降解PCE的过程中受非极端pH的影响不显著。在初始pH 6~8时,PCE的降解速率随着初始pH的变化呈现出一定的波动性,但在总体上体系中的微生物群落均能够实现PCE的有效降解。初始pH 7.0为PCE降解的最适值,因为弱酸以及弱碱性的条件不会对降解菌群活性产生抑制,所以在非极端pH的地下水环境中,此菌群也可以发挥作用。
由图4(c)可知:菌群在降解PCE的过程中受PCE初始浓度的影响不显著,但其降解速率存在一定波动性。在此PCE初始投加范围内,该菌群活性没有受到明显抑制,此浓度下的PCE毒性没有破坏菌群体内的酶、核酸以及DNA等的结构,所以菌群能正常进行新陈代谢,但当PCE初始浓度过低时,与酶结合的底物浓度偏低,会使微生物的活性降低,从而导致PCE降解速率下降[46]。
2.4 不同共代谢基质对降解的影响
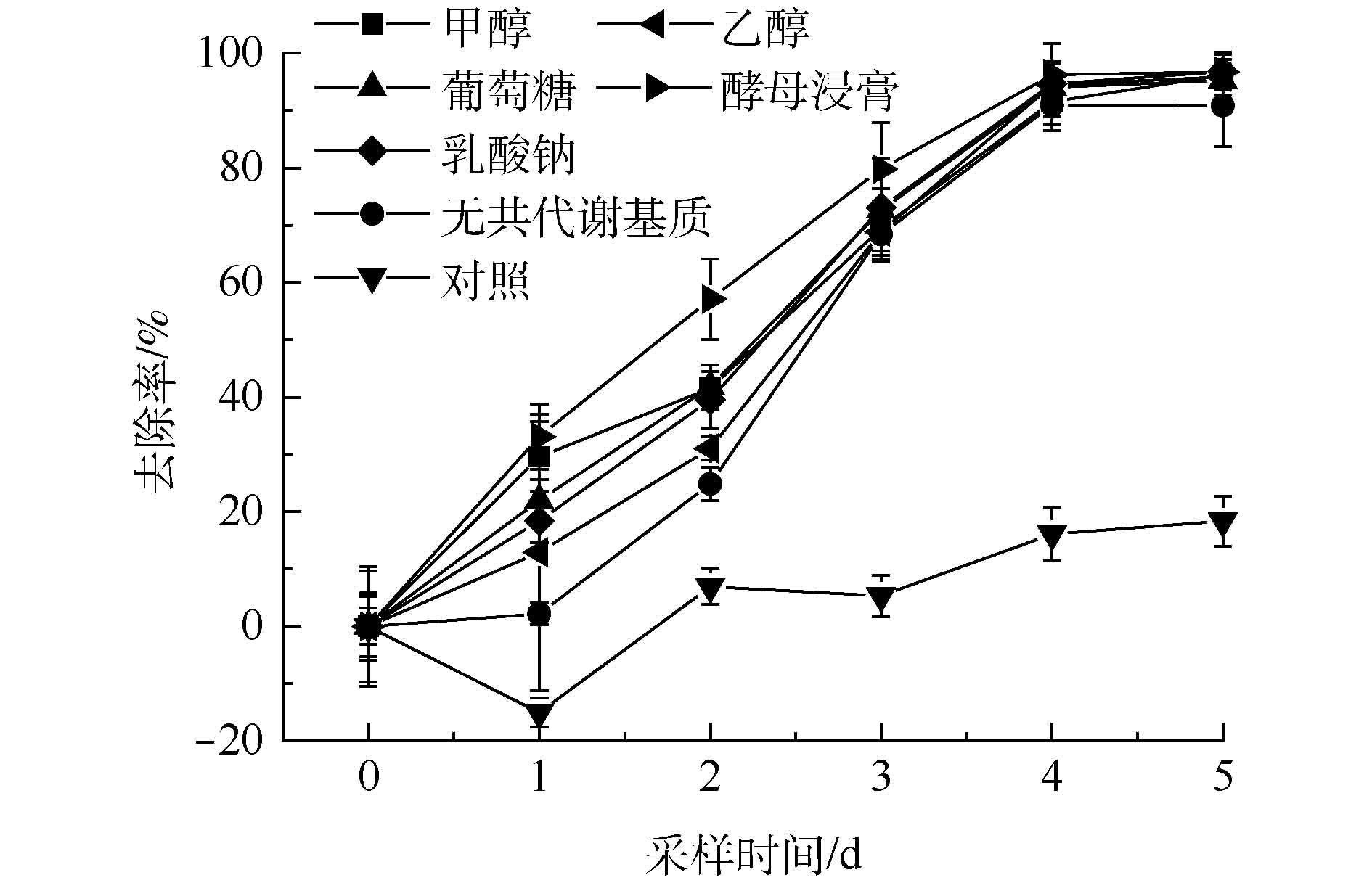
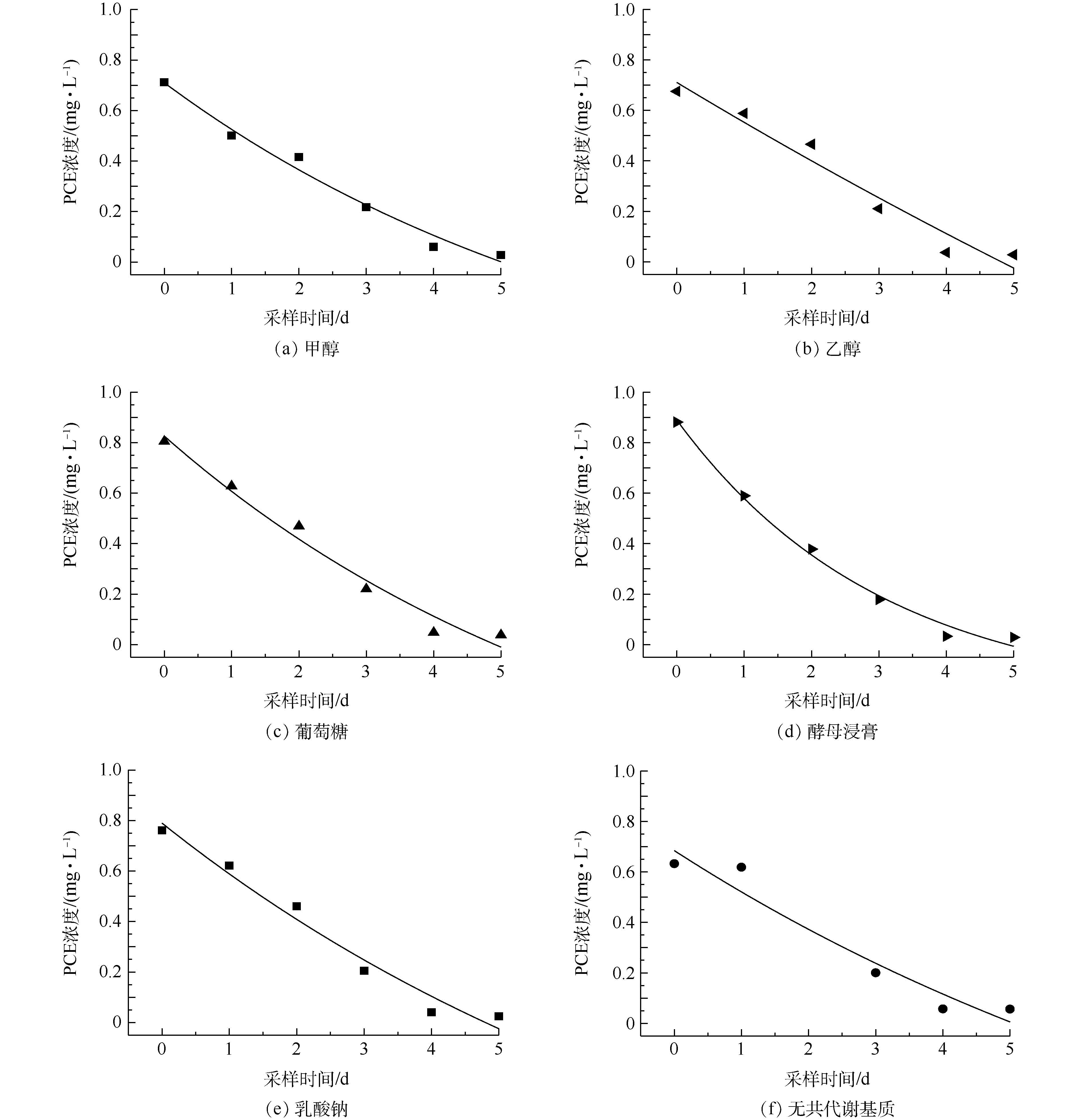
不同共代谢基质对PCE降解效果的影响见图5,其中,酵母浸膏作为共代谢基质时降解效果最好。为了比较不同共代谢基质对微生物脱氯能力的影响,需要建立动力学模型进行比较。一般情况下,反应的动力学方程见式(1),对应一级动力学模型[47]见式(2)。
dc/dt=−kcp(1) c=c0e−k(t−t0)(2) 式中:c为PCE浓度,mg·L−1;p为反应级数;k为反应速率常数,d−1;t为反应时间,d;c0为初始PCE浓度,mg·L−1;t0为初始反应时间,d。
PCE反应动力学模型见图6,根据一级反应动力学拟合方程得到的相关参数见表1。由图6和表1可知,共代谢基质强化的微生物降解过程全部符合一级反应动力学,R2均在0.928以上,除无共代谢对照组只有0.884外,整体拟合效果较好。根据表1进一步可得出,添加了酵母浸膏后实验的半衰期比不添加共代谢基质时减少了0.838 d,并且降解反应速率常数由0.327 d−1降至0.098 d−1,其他共代谢基质(除乙醇外)添加后降解反应速率常数均有提高。上述结果表明,这些共代谢基质的添加均提高了菌群的降解速率。添加不同共代谢基质后的PCE降解反应速率常数有以下关系:酵母浸膏>葡萄糖≈甲醇>乳酸钠>无共代谢基质>乙醇。以酵母浸膏为共代谢基质时,降解反应速率常数最大为0.327 d−1,半衰期为1.571 d,大于其他共代谢基质,所以在此实验条件下,酵母浸膏为最佳的共代谢基质。这可能是因为酵母浸膏含有丰富的维生素、各种氨基酸及核酸降解物等,可以作为促进微生物生长的氮素营养源[22]。乙醇作为共代谢基质时四氯乙烯的降解反应速率常数最小,还小于没有共代谢条件下的降解速率,这可能是因为乙醇对该菌群产生了活性抑制。乙醇因为其特殊的理化性质,会对简单节杆菌中的细胞色素酶等产生抑制作用,使降解菌的降解效率降低[48],乙醇还会改变乳酸杆菌细胞膜的通透性从而影响菌体的代谢活力[49]。因此,可推断同为革兰氏阳性[50]菌的Clostridium sp. FCB45(优势菌种)会出现相似的活性抑制,从而影响PCE降解速率。
表 1 不同共代谢基质对应的PCE的反应动力学模型方程及相关参数Table 1. Reaction kinetics equations and parameters of PCE degradation using different co-substrates共代谢基质 动力学模型 R2 反应速率常数k/d−1 半衰期t1/2/d 甲醇 c=1.39e−t7.02−0.682 
0.972 0.142 1.665 乙醇 c=4.38e−t27.23−3.67 
0.928 0.037 2.296 葡萄糖 c=1.62e−t6.875−0.792 
0.963 0.145 2.095 酵母浸膏 c=1.11e−t3.055−0.223 
0.988 0.327 1.571 乳酸钠 c=1.895e−t8.906−1.106 
0.955 0.112 2.161 无共代谢基质 c=1.746e−t10.155−1.061 
0.884 0.098 2.409 3. 结论
1)利用梯度驯化法获得可将PCE高效降解的菌群,此菌群可以在PCE长期选择压力下生存繁殖。菌种鉴定结果显示:在种水平上,梭状芽孢杆菌Clostridium sp. FCB45含量最高,成为群落中的优势菌种。该群落多样性高,组成复杂,群落稳定性高,易于管理。
2)当温度为30 ℃、pH为中性、PCE初始浓度为1 mg∙L−1和共代谢基质为酵母浸膏时,PCE降解效率最高可达96.75%。此群落可以在不同环境条件下(pH、温度等)表现出较高的降解率,该微生物群落有较宽的生态幅,在非极端环境条件下该群落均能发挥作用。
3)添加共代谢基质强化的微生物实验结果表明,反应模型均符合一级反应动力学,拟合度良好,降解反应速率常数由大到小顺序依次是:酵母浸膏>葡萄糖≈甲醇>乳酸钠>无共代谢基质>乙醇。该菌群在利用酵母浸膏作为共代谢基质时,降解速率常数最大可达0.327 d−1。本研究中酵母浸膏最大程度地提高了四氯乙烯的降解速率。
-
表 1 运行阶段1(启动阶段)复合填料-生物滤柱对COD去除效率的变化
Table 1. Change of COD removal efficiency of composite packing biological filter column in operation stage 1 (start-up stage)
运行天数/d 进水COD/(mg·L−1) 出水COD/(mg·L−1) COD去除率/% 3 160 68 57.50 6 168 60 64.29 9 180 64 64.44 12 250 28 88.80 15 228 28 87.72 -
[1] 付小娟. 污水处理和固废处理行业的臭气治理技术分析[J]. 山西化工, 2021, 41(6): 241-242. [2] 余鹏举, 曹先贺, 王宏志, 等. 微生物在恶臭污染治理中的研究及应用[J]. 微生物学通报, 2021, 48(1): 165-179. [3] 张玉生, 程磊. 污水处理系统除臭技术应用进展[J]. 能源与环境, 2021(6): 72-74. doi: 10.3969/j.issn.1672-9064.2021.06.026 [4] 马军, 邱立平. 曝气生物滤池及其研究进展[J]. 环境工程, 2002, 20(3): 7-11. doi: 10.3969/j.issn.1000-8942.2002.03.001 [5] WANG C R, LI J, WANG B Z, et al. Development of an empirical model for domestic wastewater treatment by biological aerated filter[J]. Process Biochemistry, 2006, 41(4): 778-782. doi: 10.1016/j.procbio.2005.09.015 [6] 王硕, 时文歆, 王燕, 等. 低温污水生物处理技术研究现状与展望[J]. 生物技术通报, 2015, 31(5): 48-53. [7] 邢家乐, 耿荣海, 张丹迟, 等. 影响生物除臭法性能的主要因素分析及工程解决方案[C]//天津: 中国环境科学学会2021年科学技术年会——环境工程技术创新与应用分会场. 2021: 433-437. [8] 屈艳芬, 叶锦韶, 尹华. 城市污水厂恶臭的生物过滤处理系统设计和运行[J]. 中国给水排水, 2007, 23(4): 35-38. doi: 10.3321/j.issn:1000-4602.2007.04.010 [9] 端艳, 陆少鸣, 江荻. 悬浮陶粒曝气生物滤池在城镇污水处理中的挂膜启动[J]. 水处理技术, 2018, 44(2): 88-92. [10] 肖作义, 段耀庭, 赵鑫, 等. 混合填料在生物滤池中除臭效果研究[J]. 安全与环境工程, 2020, 27(6): 88-94. [11] 刘桂臣, 蒋白懿, 徐箴. 沸石-无烟煤生物滤池联合处理微污染水试验研究[J]. 供水技术, 2008, 2(5): 8-10. doi: 10.3969/j.issn.1673-9353.2008.05.003 [12] 刘宝玉, 张欣, 杨华军, 等. 不同填料组合对生物滤池去除H2S的影响[J]. 天津建设科技, 2020, 30(1): 31-33. doi: 10.3969/j.issn.1008-3197.2020.01.009 [13] 方媛瑗, 戴国飞, 杨平, 等. 不同填料组合对污水中氮磷去除效果的研究[J]. 应用化工, 2020, 49(10): 2475-2477. doi: 10.3969/j.issn.1671-3206.2020.10.016 [14] DORADO A D, LAFUENTE J, GABRIEL D, et al. Interaction between sorption and biodegradation in a biofilter packed with activated carbon[J]. Water Science and Technology, 2012, 66(8): 1743-1750. doi: 10.2166/wst.2012.384 [15] 郭兵兵, 何凤友, 牟桂芝, 等. 生物填料塔工艺净化恶臭废气的研究[J]. 石油炼制与化工, 2004, 35(10): 45-50. doi: 10.3969/j.issn.1005-2399.2004.10.011 [16] STRIKAUSKA S Z D, BERZINS A, et al. Biodegradation of ammonia by two stage biofiltration system[J]. Emviromental Engineering & Policy, 1998, 1(3): 175-179. [17] 娄红杰, 张先松, 姜兴剑, 等. 烘箱消解-重铬酸钾滴定法测定水质中化学需氧量[J]. 化学分析计量, 2020, 29(6): 42-46. doi: 10.3969/j.issn.1008-6145.2020.06.010 [18] 张改亲. 纳氏试剂分光光度法测试水中氨氮要点分析[J]. 山西化工, 2021, 41(3): 45-46. [19] 周琴, 周良. 铬酸钡分光光度法测定水中硫酸盐含量[J]. 四川环境, 2019, 38(6): 125-127. [20] 武福平, 齐海英, 丁俊宏, 等. 活性炭-石英砂生物过滤处理微污染窖水的挂膜试验研究[J]. 水处理技术, 2011, 37(7): 70-72. [21] 刘国新, 吴海珍, 孙胜利, 等. 市政污泥接种焦化废水好氧降解能力及微生物群落演替的响应分析[J]. 环境科学, 2017, 38(9): 3807-3815. [22] 殷峻, 方士, 陈英旭. 生物滤塔处理低浓度H2S和NH3混合气体[J]. 中国给水排水, 2003, 19(13): 114-116. [23] 徐瑛, 孙永明, 郑涛, 等. 高通量测序技术辅助筛选脱硫菌[J]. 化工学报, 2014, 65(5): 1808-1814. doi: 10.3969/j.issn.0438-1157.2014.05.035 [24] TU X, LI J, FENG R, et al. Comparison of removal behavior of two biotrickling filters under transient condition and effect of ph on the bacterial communities[J]. Plos One, 2016, 11(5): e0155593. doi: 10.1371/journal.pone.0155593 [25] WEN Y, JIN Y, WANG J, et al. MiSeq sequencing analysis of bacterial community structures in wastewater treatment plants[J]. Polish Journal of Environmental Studies, 2015, 24(4): 1809-1815. [26] BRIGMON R L, MARTIN H W, ALDRICH H C. Biofouling of groundwater systems by Thiothrix spp[J]. Current Microbiology, 1997, 35(3): 169-174. doi: 10.1007/s002849900233 [27] MOTL N, SKIBA M A, KABIL O, et al. Structural and biochemical analyses indicate that a bacterial persulfide dioxygenase-rhodanese fusion protein functions in sulfur assimilation[J]. Journal of Biological Chemistry, 2017, 292(34): 14026-14038. doi: 10.1074/jbc.M117.790170 [28] MAKK J, HOMONNAY Z G, KEKI Z, et al. Tahibacter aquaticus gen. nov., sp nov., a new gammaproteobacterium isolated from the drinking water supply system of Budapest (Hungary)[J]. Systematic and Applied Microbiology, 2011, 34(2): 110-115. doi: 10.1016/j.syapm.2010.11.001 [29] SHAHID M, AMEEN F, MAHESHWARI H S, et al. Colonization of Vigna radiata by a halotolerant bacterium Kosakonia sacchari improves the ionic balance, stressor metabolites, antioxidant status and yield under NaCl stress[J]. Applied Soil Ecology, 2021, 158: 103809. doi: 10.1016/j.apsoil.2020.103809 [30] LV Y Y, WANG J, CHEN M H, et al. Dinghuibacter silviterrae gen. nov., sp. nov., isolated from forest soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(4): 1785-1791. doi: 10.1099/ijsem.0.000940 [31] CHO D H, RAMANAN R, HEO J, et al. Enhancing microalgal biomass productivity by engineering a microalgal-bacterial community[J]. Bioresource Technology, 2015, 175: 578-585. doi: 10.1016/j.biortech.2014.10.159 [32] CHUNG J, SHIN S, OH J. Characterization of a microbial community capable of reducing perchlorate and nitrate in high salinity[J]. Biotechnology Letters, 2009, 31(7): 959-966. doi: 10.1007/s10529-009-9960-1 [33] LV Y, WAN C, LEE D-J, et al. Microbial communities of aerobic granules: Granulation mechanisms[J]. Bioresource Technology, 2014, 169: 344-351. doi: 10.1016/j.biortech.2014.07.005 [34] EPRINTSEV A T, WU T L, SELIVANOVA N V, et al. Obtaining homogenous preparations of succinate dehydrogenase isoforms from the D-507 strain of Sphaerotilus natans[J]. Applied Biochemistry and Microbiology, 2012, 48(6): 541-545. doi: 10.1134/S0003683812060038 [35] WANG F, WANG H, SUN C, et al. Conventional bioretention column with Fe-hydrochar for stormwater treatment: Nitrogen removal, nitrogen behaviour and microbial community analysis[J]. Bioresource Technology, 2021, 334: 125252. doi: 10.1016/j.biortech.2021.125252 [36] 吴秋仙, 刘学伟. 蜂窝煤渣对磷吸附特性探讨[J]. 水产养殖, 2019, 40(4): 41-44. doi: 10.3969/j.issn.1004-2091.2019.04.009 [37] 吴秋仙. 蜂窝煤渣对氨氮吸附特性探讨[J]. 水产养殖, 2014, 35(1): 21-24. doi: 10.3969/j.issn.1004-2091.2014.01.005 [38] 张尊举, 董春艳. 陶粒-沸石-活性炭组合填料生物滤池的研究[J]. 中国环境管理干部学院学报, 2013, 23(5): 63-66. doi: 10.3969/j.issn.1008-813X.2013.05.018 [39] 叶治安, 周娜, 郭长红, 等. 沸石活性炭复合滤料串级生物滤池处理厂矿企业生活区污水的实验研究[J]. 水处理技术, 2017, 43(12): 111-114. [40] 郭文东. 煤砂滤料用于降浊除蚤的可行性试验研究[J]. 辽宁化工, 2018, 47(11): 1092-1094. doi: 10.3969/j.issn.1004-0935.2018.11.007 [41] 丁绍兰, 杨倩, 谢林花, 等. 核桃壳-陶粒填料曝气生物滤池去除氨氮的研究[J]. 环境污染与防治, 2018, 40(1): 1-5. [42] BARBER A, LALONDE K, MUCCI A, et al. The role of iron in the diagenesis of organic carbon and nitrogen in sediments: A long-term incubation experiment[J]. Marine Chemistry, 2014, 162: 1-9. doi: 10.1016/j.marchem.2014.02.007 [43] 聂中林, 马赫, 梁鹏, 等. 不同填料曝气生物滤池处理微污染河水的效果[J]. 中国给水排水, 2020, 36(17): 41-48. -




 下载:
下载: