-
场地包括土壤和地下水两大环境介质,因此,地下水与土壤环境质量关系密切,相关管理工作应协同推进。准确掌握地下水污染状况并对受污染的地下水体进行修复治理是污染场地环境管理的关键任务和核心目标之一。然而,我国污染场地修复行业长期存在“重土轻水”的问题,并在我国场地管理工作的不同阶段均有体现[1]。具体如下。
1)在场地调查阶段,一些调查单位为降低调查成本倾向于回避地下水采样监测。
2)在风险评估阶段,个别从业者认为地下水不作饮用水源就不存在人体暴露途径,在暴露评估和风险表征过程中可忽视地下水中的超标污染物。然而,除了“饮用地下水途径”外,地下水中的挥发性污染物(volatile organic compounds,VOCs)还会挥发进入室内或室外空气,最终产生人群暴露。国外诸多污染场地案例证明了挥发性有机物蒸气入侵暴露途径(vapor intrusion)的潜在危害,因此,欧美等地区和国家的监管部门在2000年前后开始将蒸气入侵暴露途径作为污染场地的重点监管目标[2-4]。2018年9月,美国环保署(US EPA)第一次因蒸气入侵风险而将2个场地(密西西比州Rockwell International Wheel & Trim场地和得克萨斯州Delfasco Forge场地)增补进联邦政府的超级基金场地名单[2]。
3)在修复方案编制阶段,一些方案编制单位以“地下水不饮用”或其他理由回避本应进行的地下水修复工作。
4)在修复效果评估阶段,由于《污染场地地下水修复和风险管控技术导则》(HJ 25.6-2019)规定了地下水修复效果评估周期为2 a[5],而部分业主出于让地块尽快上市开发的考虑倾向于缩短修复效果评估周期或降低监测频率,这可能会影响修复效果评估结论的质量与可靠性,导致问题地块进入土地开发环节。
上述不合理现象会给场地环境管理工作埋下潜在隐患,为污染地块未来的安全利用带来不可预知的风险。
-
土壤和地下水2种介质间存在频繁密切的物质交换,土壤和地下水是密不可分的有机统一体,共同构成与人类活动密切相关的浅层地下环境(subsurface environment)。污染物在土壤和地下水2种介质间存在界面分配、物理迁移、化学反应、生物降解等多种相互作用机制[2]。因此,在污染场地修复中不应将土壤和地下水割裂开来。
污染物泄漏后在重力作用下通过包气带向下迁移。在迁移过程中,污染物会通过吸附作用进入土壤固体颗粒表面或土壤天然有机质内部(固相),还会通过溶解作用进入土壤孔隙水中(水相),部分挥发性有机物甚至会通过挥发进入土壤气中(气相),最终同时分布于固、水、气三相中[2]。若泄漏量足够大,污染物会在重力作用下迁移,最终抵达饱水带,并通过溶解作用进入地下水,从而导致饱水带地下水的污染。溶解于地下水的污染物会随着地下水不断向污染源的下游迁移,导致污染范围进一步扩大,并最终形成一定面积的地下水污染羽(groundwater contaminant plume)。在随地下水迁移过程中,污染物会被饱水带沉积物(aquifer sediment)吸附进入沉积物固相进而导致新的饱水带污染。若地下水中的污染物属于挥发性有机物,随地下水迁移至下游的挥发性有机物还会重新挥发进入污染羽上方的包气带,进而导致新的包气带污染。另外,地下水位的波动会使问题更复杂。一方面,地下水位波动使得溶解于地下水的污染物接触并污染更多的土壤或沉积物;另一方面,地下水位上升使得滞留在包气带中的污染物接触并污染更多的地下水。降雨的渗入也会不断将滞留在包气带中的污染物重新溶解或解吸出来,并随着入渗的雨水最终汇入地下水中,导致饱水带被污染。
-
1)地下水监测更容易揭示地层中的污染状况。 污染物在土壤中的分布呈现高度非均相性,垂直或水平方向间隔几米的2个土壤样品中污染物的质量浓度可能相差几个数量级。在复杂的污染场地中,污染物可能随机分布在几个离散区域,而并非连续整体。因此,有限土壤监测点位的空间代表性存在较大不确定性[1]。对于地质状况复杂或污染严重的场地,仅依靠土壤监测可能会遗漏重污染区[1]。与土壤不同,地下水是一种流体,故地下水系统是一个不断循环流动的动态开放系统。进入地下水系统中的污染物会经由扩散、弥散、对流等作用机制源源不断地从污染源向周边环境迁移。在水动力机制作用下,溶解在地下水中的污染物会扩散迁移并形成一个连续的地下水污染羽,其边界往往呈现一定规律性和可预测性。在大型复杂污染场地中,可能存在多个污染源和多个地下水污染羽,但每个污染羽的分布范围和边界一般也会呈现一定规律。一般来说,单个地下水监测点的空间代表性远高于单个土壤监测点,而单个地下水监测点能捕获的污染范围也远高于单个土壤监测点[1]。因此,地下水监测更容易获取地层中的污染状况,为污染场地调查中不可或缺的监测指标[1]。另外,若污染物被包气带截留而未进入地下水,则可通过土壤监测进行污染调查;当污染物为挥发性有机物时,则通过土壤气监测进行污染调查[6]。
2)地下水监测是检验场地修复效果的重要标准。 我国污染场地修复效果评估主要参照生态环境部发布的2项技术指南《污染场地风险管控与土壤修复效果评估技术导则》(HJ 25.5-2018)[7]和《污染场地地下水修复和风险管控技术导则》(HJ 25.6-2019)[5]来进行。由于可能出现地下水修复后污染物浓度反弹或拖尾的现象,《污染场地地下水修复和风险管控技术导则》将修复达标初判期和修复效果评估期均定为1 a。某些污染场地的业主急于进行修复后土地的开发利用,常常回避地下水修复或压缩地下水修复效果评估的时间周期,为修复后地块的安全利用带来隐患。由于土壤和地下水间存在紧密的污染物质量交换关系,地下水中检出的高浓度污染物通常反映了地层中可能还存在未清理完全的污染物,如残留相非水相有机液体(residual NAPL)或吸附在沉积物内的污染物。高浓度的污染物,尤其是挥发性有机物(VOCs)仅分布在地下水中的概率很低,其同时存在于饱水带沉积物中甚至潜水面附近包气带土壤中的可能性很高。由于污染物在土壤中空间分布的高度非均质性,对于地质状况复杂或污染严重的场地,依靠土壤钻孔监测的传统场地调查方法很难准确找到所有的污染区域。在我国很多污染场地修复项目中,修复公司进场后往往先要进行自主补充调查,以便进一步查明地下的污染状况。实际情况是在补充调查、清挖修复,甚至在修复效果评估阶段还能发现新的超标区域。这些实践经验充分反映了土壤非均质性给场地修复治理和后续安全利用带来的不确定性,也充分说明了基于土壤监测的传统场地调查方法的局限性。
相对于土壤的高度非均质性,地下水监测数据的空间代表性更强,更容易揭示地层中残余的污染物状况,特别是挥发性有机物的污染场地。因此,建议监管部门和从业者充分重视修复过程评估阶段及修复效果验收评估阶段的地下水监测工作,尤其需要重视存在挥发性有机物的场地。
3)地下水监测可直接指示污染物的越界迁移风险。由于地下水的流动性,污染物会随着地下水流持续不断地向下游迁移。这可能导致污染物随地下水流出原场地边界而影响到周边区域。这一现象被称为污染物越界迁移(以下简称“污染越界”)。防范污染越界是污染场地管理的一项核心任务。按照污染者治理的原则,污染场地周边受影响区域的土地所有权人可通过诉讼等方式要求污染责任人对受到影响的土壤地下水进行修复或给予经济赔偿。这类环境诉讼在欧美等发达国家比较常见。在国内,污染越界问题对于在产企业尤为重要。实际上,国内部分在产企业也存在因污染越界而影响周边环境的问题。目前,监管部门尚未对在产企业的污染越界问题出台专门的管理办法,但是按照《土壤污染防治法》的要求,这类场地应当采取一定的风险管控措施。在产企业无法按照关闭搬迁场地的方式进行大开挖式修复治理,只能采取“重污染源消除+长期风险管控”的模式进行管理。对在产企业厂区边界的地下水进行定期监测并评估是否存在污染越界问题,应当作为在产企业土壤地下水环境管理工作的重点之一。建议环境管理部门将这部分工作纳入在产企业自行监测和隐患排查的常规工作。
4)地下水监测可实现长期多次监测且更容易反映污染物的动态变化规律。地下水采样监测通常需要建设长期监测井。虽然地下水监测井的建设成本比土壤钻孔高,但监测井一旦建成后便可进行长期多次采样,而土壤监测则每次都要钻取新的土孔(除非只监测表层土)。若要进行多次采样调查,地下水监测的成本远低于土壤。因此,地下水监测更适用于在产企业自行监测等长期多次的监测工作。另外,同一口地下水监测井的长期监测数据可直接反映地层污染状况的时间变化规律,而土壤监测却很难实现这一目标。土壤中的污染物分布具有高度空间非均质性,也无法在同一个土孔中反复多次采样,故土壤污染状况的时间变化规律往往需要通过多个点位采样监测数据的统计分析来获得。但这种方法需要大量的监测数据且不确定性很高,因此,宜采用地下水监测来反映污染物的动态变化。
-
1 )地下水常规监测指标与污染场地常见污染物种类不匹配。 不少调查单位开展场地初步调查仅以《地下水质量标准》(GB/T 14848-2017)中的39项常规指标作为地下水监测因子(有时还会排除2项放射性指标和/或2项微生物指标)[8]。实际上,这39项常规指标中的大部分都与工业场地常见污染物无关,如浑浊度、肉眼可见物、总硬度、溶解性总固体、阴离子表面活性剂、耗氧量、铁、钠、硫酸盐、氯化物、总大肠杆菌群、菌落总数、硝酸盐、总α放射性、总β放射性等。对上述指标的监测增加了不必要的经济和时间成本,且无益于揭示目标场地的污染状况和环境风险。另一方面,39项常规指标中仅包含4项挥发性有机物(三氯甲烷、四氯化碳、苯、甲苯)和6项有毒重金属(汞、砷、硒、镉、六价铬、铅)[8],而工业污染场地常见的挥发性有机物和重金属污染物种类远多于这4+6种。因此,若仅监测这39项很可能会遗漏地下水中实际存在的污染物。
综上所述,以《地下水质量标准》(GB/T 14848 -2017)中的39项常规指标作为场地初步调查中的地下水监测因子,既会遗漏很多工业场地常见的污染物,又会额外检测很多与污染场地不相关的指标。因此,建议生态环境管理部门尽快出台针对污染场地的地下水监测因子清单,以期涵盖工业场地的主要污染物,且排除非必要的监测因子,从而以较低的成本实现对于工业场地地下水环境质量的科学调查和精准评估。
2)《地下水质量标准》(GB/T 14848-2017)中的标准值不完全适用于污染场地管理。《地下水质量标准》(GB/T 14848-2017)是由原国土资源部联合水利部共同制定,用于评价地下水本身质量,而并非用于衡量人类活动对地下水质量的影响。地下水质量的影响因素复杂,包含天然成因和人为成因。地下水在自然循环过程中与岩土介质发生水-岩相互作用,在自然状态下经过漫长的地质和地球化学作用会形成有害物超标的天然劣质地下水(天然成因)[9]。人类的工农业生产活动排放的污染物也会导致地下水中有害物质超标(人为成因)。污染场地管理则主要关注人为成因导致的场地尺度地下水污染,而该标准更多关注综合了天然成因和人为成因的区域大尺度地下水质量。因此,标准中每项指标的标准值并不完全适用于污染场地环境管理工作。
《地下水质量标准》(GB/T 14848-2017)提出的5种类型地下水的划分主要依据地下水的水质和使用功能,而并非以环境风险(人体健康风险)为主要出发点。以目前我国场地调查和评估主要参照的Ⅲ类和Ⅳ类地下水标准为例:该标准对Ⅲ类地下水的描述是“地下水化学组分含量中等,以GB 5749-2006为依据,主要适用于集中式生活饮用水水源及工农业用水”;Ⅳ类地下水是“地下水化学组分含量中等,以GB 5749-2006为依据,主要适用于集中式生活饮用水水源及工农业用水”[8]。这些功能与污染场地的环境风险(人体健康风险)并无直接关联,以此作为污染场地环境管理的依据并不科学,存在部分指标偏宽松、另一部分指标过于严格的可能。
另外,《地下水质量标准》(GB/T 14848-2017)中的93项指标(包括39项常规指标和54项非常规指标)遗漏了一些工业场地应重点关注的污染物。如未给出总石油烃、甲基叔丁基醚、苯胺类、1,2-二氯乙烷、氯乙烷、1,2,3-三氯丙烷、苊、菲、芘、芴、2-甲基萘、苯并(a)蒽、苯并(b)荧蒽、苯并(a)芘等指标的标准值,在调查评估时只能参考国内地方标准或国外标准,不利于全国污染场地环境管理工作的标准统一。
因此,建议生态环境管理部门针对污染场地来制定地下水环境质量标准,指标项目的选取及各指标标准值的制定应借鉴国内外相关环境质量标准的制定思路,并结合我国污染场地地下水特征污染物类型,以及全国土壤污染状况详查工作的成果来进行。
3)地下水采样监测的规范性仍需加强。
2020年,生态环境部发布了新版《地下水环境监测技术规范》(HJ 164-2020)。该技术指南对地下水环境监测的点位布设、监测井建设与管理、样品采集与保存、监测项目和分析方法、监测数据处理、质量保证和质量控制、资料整理等方面提出了明确要求[10]。另外,生态环境部制定的《建设用地土壤污染风险管控和修复监测技术导则》(HJ 25.2-2019)[11]和《场地土壤和地下水中挥发性有机物采样技术导则》(HJ 1019-2019)[12]也对污染场地地下水监测提出了相应的技术要求。 然而,在开展实际监测时,部分单位并不能严格遵守这些指南的技术要求。常见问题包括:监测井数量不足;监测井位置选取不合理;监测井建设不够规范;监测井建设信息和记录表缺失;洗井操作不规范或未进行洗井操作;洗井记录缺失;采样操作不规范;缺少现场参数的测试和记录等。监测点位的布设会显著影响监测数据和调查报告的质量。调查单位应严格按照HJ 164-2020、HJ 25.2-2019、HJ 1019-2019等技术规范的要求并结合场地实际的水文地质状况合理选取监测点位。地下水垂向的采样位置会显著影响监测结果,这一点国内的从业单位关注较少。国外学者研究发现,若含水层较厚,则饱水带中不同深度的地下水污染物浓度可能差别很大,即采样点的纵向垂直相差5~10 m,其污染物浓度可能会差2~3个数量级[13]。因此,对于进入详细调查阶段的场地,若第一层含水层厚度较大(如大于10 m),应考虑进行多层次的地下水采样,至少在重污染区域的点位上应考虑多层次采样,以探明污染物在饱水带中的垂向分布。
地下水监测在污染场地管理中的重要作用、存在问题与对策建议
Significance, problems and countermeasures of groundwater monitoring for contaminated site management
-
摘要: 我国污染场地修复行业长期存在“重土轻水”的现象。然而,由于土壤与地下水共同构成了有机统一的地下环境,污染物在土壤和地下水之间存在密切的物质交换,因此,充分掌握目标场地的地下水污染状况对于场地环境管理及修复后地块的安全利用起着举足轻重的作用。对地下水监测在整个污染场地环境管理工作中的四方面作用进行了剖析,阐明了我国污染场地地下水监测中存在的问题,并针对性地提出了解决思路和政策建议,以期为我国的污染场地管理提供参考。Abstract: The phenomenon of "heavy soil and light water" has long existed in polluted site remediation industry in China However, soil and groundwater constitute the organic and unified underground environment together, and there is a close material exchange between soil and groundwater. Therefore, a full understanding of groundwater contamination condition is critical for contaminated site management and safe redevelopment of post-remediation land. Based on the four functions of groundwater monitoring in the whole environmental management of contaminated sites, in this paper, the problems existing in groundwater monitoring of contaminated sites in China were analyzed, and the solutions and policy suggestions were put forward in order to provide reference for groundwater control in contaminated site remediation industry in China
-
Key words:
- contaminated site /
- site investigation /
- risk assessment /
- soil /
- groundwater /
- aquifer /
- saturated zone
-
人工湿地技术是通过过滤、吸附、沉淀、植物吸收和生物降解等过程,实现对城市生活污水的高效处理,其建设成本和能耗较低,环境美化效果好[1]。人工湿地中所含大量的养分负荷会刺激微生物生长代谢。与天然湿地相比,温室气体CH4[2]、N2O和CO2[3]的排放通量更高,因此,亟需探究如何规模化实现该工艺的温室气体减排。
人工湿地实现污染物去除的主要部分为基质填料。填料材料通过物理、化学和生物的作用完成对污染物的去除。由于单一基质类型的人工湿地无法同时达到高效脱氮、除碳的目的[4]。组合填料所发挥的协同作用可高效去除污水中的多种污染物质[5],已被越来越多地运用到人工湿地中。然而,在实际运用中,组合填料的种类、填充方式、孔径和含碳量等条件均会影响湿地系统的复氧能力及微生物的代谢活动,从而间接影响系统污染物的去除能力[5]。
SHEN等[6]研究铁碳微电解填料时发现,以铁为阳极、碳为阴极会形成大量微观原电池,可将NO3−/NO2−直接还原为N2,因此,铁碳含量改变会影响NO3−/NO2−还原为N2过程的进行,进而影响N2O的排放。 WANG[7]等发现沸石具备良好的吸附功能,具有与普通材料相似的均一孔隙,故其性质与分子筛类物质相似,选择吸附性能优异。该材料可有效吸附系统产生的CH4,当沸石占比增大时,可能更加有利于减少CH4的减排。赵仲婧等[1]发现,采用铁碳和沸石作为基质组合填料的间歇曝气人工湿地系统可明显提高污水处理效率和温室气体减排效果。铁碳微电解材料与沸石的粒径、孔隙度均不相同,因此,当二者间填充顺序不同时,可通过影响溶解氧 (dissolved oxygen,DO) 环境来构成不同微生物群落结构,优化硝化、反硝化过程,以降低温室气体排放量。
基于此,本研究以铁碳和沸石组合填料为研究对象,通过改变二者的填充顺序和填充配比,探究基质填充方式对人工湿地对污染物去除过程中温室气体减排效果的影响,以期为实现人工湿地技术的减污降碳目标提供参考。
1. 材料与方法
1.1 装置构建
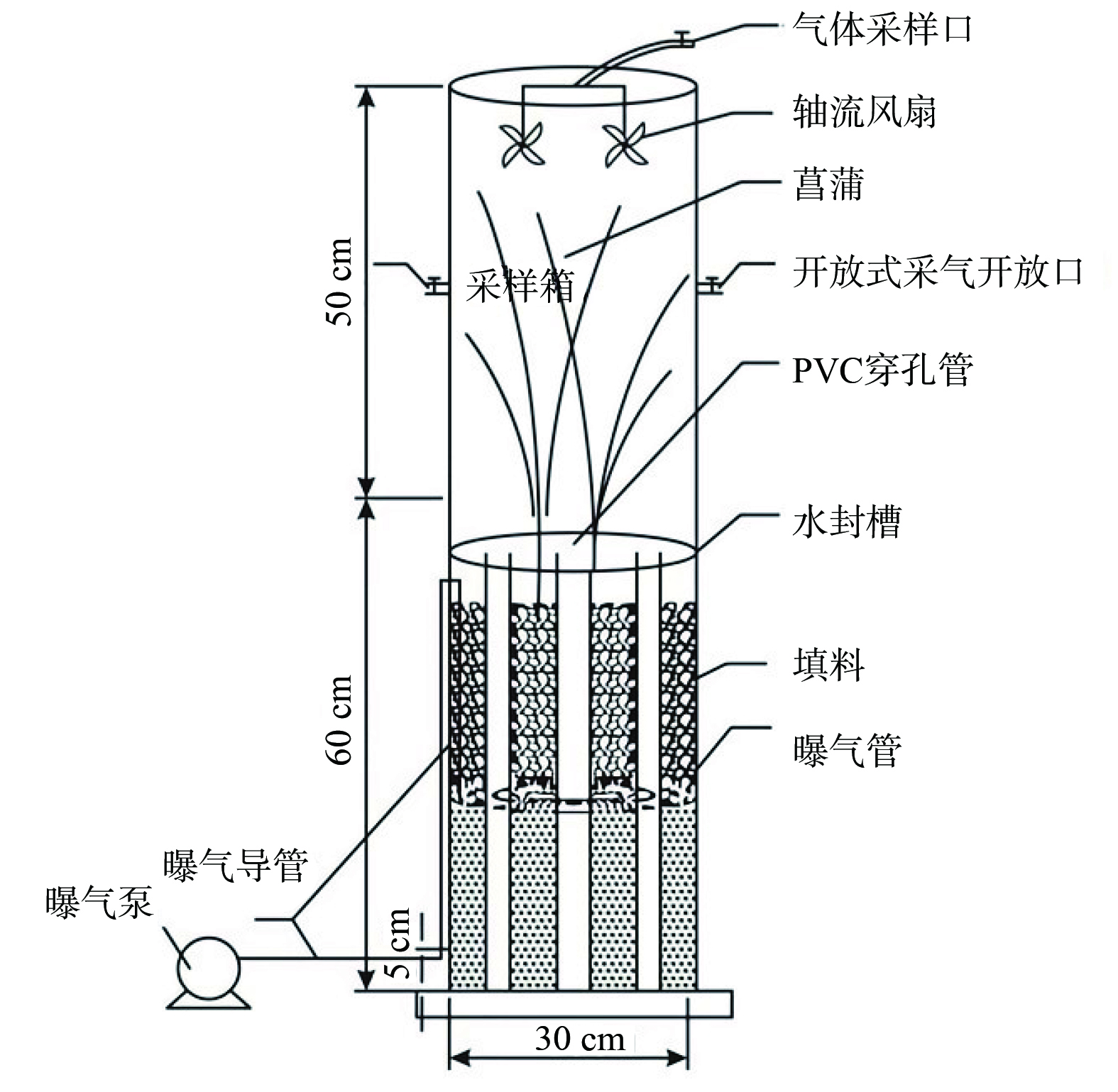
实实验装置位于西南大学某玻璃温室大棚。该装置具备良好的通风性,且自然照射充足。图1 为实验用到的仿真垂直潜流式人工湿地系统,采用 PVC材质制作的筒状容器,其底部直径30 cm,高60 cm,上部边缘设有3 cm的矩形水密封凹槽。中心有3个4 cm宽,60 cm长的 PVC穿孔管,最中间一根用于进水、虹吸排水和收集水样本,两侧2根内部装有和人工湿地系统相同且等高的填料,用于提取湿地基质及微生物。距装置底部5 cm处设置微孔曝气管。
装置中种植的植物为野生菖蒲 (Acorus calamus L.) ,取自北碚区某水库。菖蒲采回后,先将其根部清洗干净,放入有培养液的装置中,置于光照培养箱中进行驯化培养。培养温度为 (25±2) ℃,光照强度为 (3 000±300) lux,光暗时间比为12 h:12 h,每隔2 d更换一次进水,经过30 d的人工培育,将生长状况好、体形相似的植物移植到人工湿地设备中,栽种密度为每平方米30株。
实验所选用的沸石是从河南景盈建材有限责任公司采购的斜发沸石,沸石颗粒的直径为5~10 mm。使用纯水清洗干净,经风干、称重后填入湿地装置之中。铁碳微电解填料主要由废铁屑和活性炭制成,粒径为10~30 mm,均由郑州众邦水处理有限公司提供。
培养微生物所需接种的活性污泥取自北碚区污水处理厂二沉池,采用人工配制的污水进行驯化。驯化3周后将活性污泥接种到人工湿地系统中,接种污泥的质量浓度为1 000 mg·L−1。
1.2 运行方式
实验装置按铁碳和沸石的填充方式分为2组。湿地组1铁碳填充在表层,沸石在底层;湿地组2沸石填充在表层,铁碳在底层。以添加100%沸石的人工湿地作为对照组。沸石、铁碳分别用F、T表示,且用x、y表示沸石和铁碳的占比。每组设置3个装置,组1分别添加20%铁碳+80%沸石 (T2F8) 、40%铁碳+60%沸石 (T4F6) 、60%铁碳+40%沸石 (T6F4) ;组2分别添加20%沸石+80%铁碳 (F2T8) 、40%沸石+60%铁碳 (F4T6) 、60%沸石+40%铁碳 (T6F4) 。
实验人工湿地系统设置水力停留时间 (hydraulic retention time,HRT) 为2 d,进水采用人工配置的模拟污水,固定进水的碳氮比 (COD/N) 为5:1,具体成分参照文献[7]。向模拟污水中投入蔗糖、NH4Cl 和KNO3提供碳源和氮源。模拟污水的 COD、NH4+-N和NO3−-N分别为300、40和20 mg·L−1。其他盐类或物质(每升水中添加的量)为 :KH2PO4 (22.50 mg) 、MgSO4·7H2O (97.56 mg) 、CaCl2 (58.28 mg) 、蛋白胨 (10.00 mg) ,以及微量元素溶液1 mL。其中,微量元素溶液(每升中添加的量)中又包含盐类有:H3BO3 (0.17 mg) 、MnCl2·4H2O (0.11 mg) 、ZnSO4·7H2O (0.13 mg) 、CuSO4·5H2O (0.04 mg) 和H2MoO4·4H2O (0.004 9 mg) 。微量元素溶液的pH为 (7.09±0.01) 。
该系统每天曝气2 h,采用机械式间歇曝气方式进行。时间段为每天00:00—01:00及12:00—13:00[8]进行。该系统中的DO控制为约3 mg·L−1。 湿地系统于2021年5月开始运行,并在5月进行第一次气体测定,运行180 d,在2021年11月停止运行。本研究选取5月、6月、7月这3个月的数据进行计算分析。
1.3 测定方法
(1) 水样的采集与测定。在系统正常运行后,每2 d进行一次常规水样收集并检测。取样时间为09:00—10:00。根据饮用水及污水的国家标准分析方法,对COD、NH4+-N、NO3−-N、NO2−-N和TN等指标进行测定。水样的原位指标包括DO、氧化还原电位 (oxidation-reduction potential,ORP) Eh、水温和pH,均利用多参数测定仪 (SG98型梅特勒-托利多,瑞士) 进行测定。
(2) 气样的采集与测定。本研究中主要对CH4和N2O这两种气体进行采集分析。气体采样箱 (见图1上半部分) 是PVC材质的圆柱体,由顶箱 (直径30 cm,高50 cm) 和延长箱 (直径30 cm,高70 cm) 组成,延长箱可在植物生长高度超过50 cm时使用。采样箱内有2个轴流风扇。在人工湿地系统稳定运行期间,每月采气3~4次,采样时间为上午9:00—11:00。在每个周期内进行温室气体的采样,并分析其排放规律。在1个典型周期中,设定13个不同停留时间,分别为0、2、6、12、14、18、24、26、3、36、38、42和48 h。其中,在典型水力停留期间,对人工湿地的排放进行了模拟,并对其进行了采集与分析。
气体样品的采集方式分3种:非曝气段采样、曝气段采样和溶解态CH4和 N2O的采集3种情况。其中,非曝气段的气体排放通量计算式[9]为式 (1) 。该公式是以气体样品中温室气体质量浓度随时间变化的速率计。
F=H×273273+T×PP0×ρ×dcdt (1) 曝气段的气体排放通量计算式[10]为式 (2) 。
F=Q×ϕ⋅M⋅PR⋅T⋅S (2) 利用计算所得的气体排放通量根据内插累加法求得CH4和 N2O的累积排放量,计算式见式 (3)。
A=∑n−1i=1(Fi+Fi+12×d×24+Fj×24)+Fn×24 (3) 溶解态温室气体的浓度计算式见式 (4) 。
cdis=(K0RT+β)⋅ω⋅W⋅PR⋅T (4) 式中:F为气体 (CH4和N2O) 排放通量,μg·(m2h)−1;H为箱内高度,m;T为采样箱内平均气温,K;P即采样时的大气压力,Pa;P0是校准条件下的大气压力,Pa;
ρ ϕ cdis β ω 基于全球增温潜能值 (Global Warming Potential,GWP) 的概念,通过比较各种人工湿地的温室气体排放情况,将CH4和N2O的排放量换算成CO2当量 (CO2-eq) 。各组人工湿地的综合GWP计算式[11]见 (5) 。
GWP=28×CH4累积排放量+298×N2O累积排放量 (5) 1.4 数据处理
利用 Origin 8.5绘制数据图;显著性检验分析及相关性分析采用SPSS19.0软件;显著性检验采用One-way ANOVA方法 (P<0.05、P<0.01表示达到显著水平) 。
2. 结果与分析
2.1 不同人工湿地中CH4的月排放通量
每月对不同人造湿地的CH4排放情况进行统计,结果见表1。在系统稳定的工作状态下,对照组中F的CH4平均排放通量为 (0.33±0.02) g·(m2·h)−1。湿地组1中,T4F6和T6F4的CH4排放通量在添加铁碳后增加,仅有T2F8有减排效果,其CH4的排放通量相较于F减少了5.16% (P<0.05) 。湿地组2中,相较于对照组,F8T2、F6T4的CH4排放量分别减少了22.59%~42.86%、0~40% (P<0.05),而F4T6并无CH4减排效果。通过比较两组湿地的CH4月排放通量发现,沸石在上、铁碳在下填充基质的湿地组2更有利于CH4减排;且适当添加铁碳有利于CH4的减排作用,但铁碳的占比不宜超过沸石,沸石/铁碳为8:2的湿地对CH4减排效果会更加明显。
表 1 不同湿地组各月份的CH4平均排放通量Table 1. Average CH4 emission fluxes of constructed wetlands in different treatments by monthmg·(m2·h)−1 湿地组别 填充方式 5月 6月 7月 月平均值 1 T2F8 0.362±0.028 0.298±0.031 0.277±0.042 0.31±0.03 1 T4F6 0.647±0.015 0.454±0.028 0.203±0.041 0.44±0.03 1 T6F4 0.917±0.015 0.873±0.024 0.570±0.018 0.79±0.02 2 F8T2 0.154±0.014 0.257±0.021 0.251±0.035 0.22±0.02 2 F6T4 0.242±0.116 0.366±0.025 0.181±0.013 0.26±0.05 2 F4T6 0.613±0.021 0.537±0.051 0.396±0.045 0.52±0.04 对照组 F 0.407±0.018 0.260±0.024 0.320±0.016 0.33±0.02 以上现象表明,表面分子筛的孔隙结构可以对CH4进行吸收和储存,从而提高了装置内的氧气浓度,促使CH4氧化[12-13]。当系统中添加铁碳填料时,铁屑和活性炭颗粒充当电极材料,产生明显微电场,使系统更易形成微电解系统[14]。而这个铁碳微电解系统置于底部时,更加接近植物根系。在电解过程中,阳极产生的Fe2+、Fe3+会参与微生物生命活动的电子传递过程,从而提升根系微生物活力,进而使根系微生物与产甲烷菌竞争加剧,产甲烷菌将无法获得足够碳源与电子[15],从而活性受到抑制。另外,铁氧化物在根部厌氧体系中可能存在异化铁还原过程[16],异化铁还原菌和产甲烷菌之间存在底物竞争与热力学反应的优先顺序[17],当Fe3+质量浓度上升时,有利于体系中异化铁还原过程的进行,使产甲烷菌活性被抑制。
2.2 不同人工湿地中N2O 的月排放通量
两组人工湿地中N2O平均排放通量如表2所示。在系统稳定运行期间,对照组F的N2O平均排放通量为 (651.51±88.53) μg·(m2h)−1。在湿地组1中,,与F相比,湿地组1中的T2F8、T4F6的N2O排放量分别减少了26.22%~70.62%、26.32%~56.62%、8.49%~42.30% (P<0.05) 。在湿地组2中,湿地组2中的F8T2、F6T4和F4T6相较于F分别减少了61.33%~84.29%、52.98%~75.61%、0~16.87% (P<0.05) 。以上结果表明,添加铁碳有利于N2O的减排。两组湿地的N2O月排放通量均随着铁碳占比的降低而明显减少;当铁碳-沸石体积比为2:8时减排效果最佳。通过进一步对湿地组1和2的N2O月平均排放通量进行比较,湿地组2的N2O减排效果优于湿地组1。
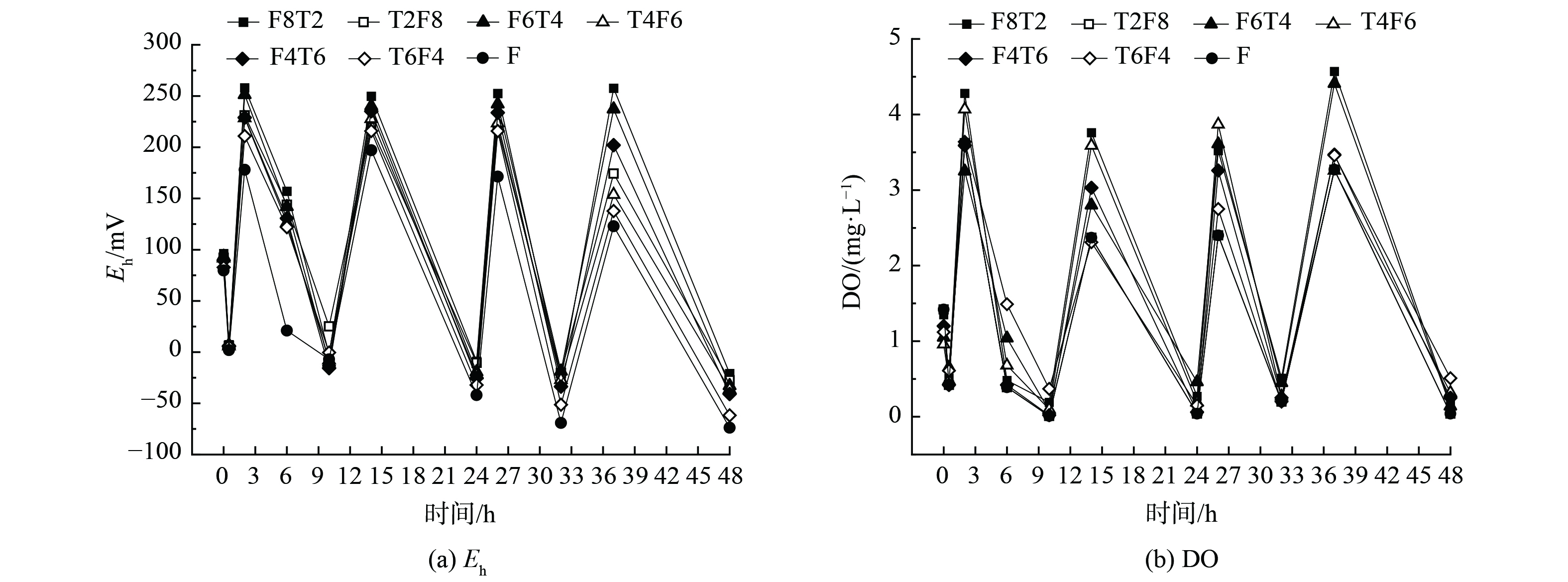
表 2 不同湿地组各月份的NO2平均排放通量Table 2. Average NO2 emission fluxes of artificial wetlands in different treatments for each month μg·(m2·h)−1湿地组别 填充方式 5月 6月 7月 月平均值 1 T2F8 467.26±66.43 216.95±104.5 264.67±126.3 316.29±99.08 1 T4F6 73.41±13.2 226.10±53.2 154.18±74.2 367.90±46.87 1 T6F4 931.50±65.7 293.18±53.2 365.01±95.2 529.90±71.37 2 F8T2 215.69±105 187.03±32.4 98.08±14.6 166.93±50.67 2 F6T4 412.80±65.4 133.12±33.4 121.67±27.3 222.53±42.03 2 F4T6 898.87±47.3 265.36±125.4 355.37±153.2 506.53±108.63 对照组 F 1047.48±68.2 508.14±107.9 398.91±89.5 651.51±88.53 分析其原因可能是,N2O既是硝化反应副产物,亦为反硝化反应的中间体[18]。随着铁碳填料增多,铁碳微电解填料中存在的高水平Fe3+可能会抑制N2O还原酶的活性,使得N2O 作为中间产物逸出。另外,铁碳的存在会改变系统溶解氧环境,铁碳占比更少的湿地系统DO更高,氨氧化细菌 (ammonia-oxidizing bacteria,AOB) 的好氧反硝化过程被抑制,会进一步减少N2O的释放[1],且有利于N2O还原为N2;铁碳的加入会导致环境中氧化还原电位Eh升高,且随着铁碳占比减少Eh升高 (如图6) ,可能会降低硝酸还原酶的活性,从而减弱反硝化作用[19],减少N2O释放。当把铁碳填料置于底部时,能有效改善底层微生物的反应环境、促进其对碳源的利用,进而强化异养脱氮反应的效果,使得反硝化反应更顺利地进行;且将铁碳填料置于底层,会更加接近植物根系,能有效促进植物根系泌氧[20],为N2O还原酶提供好氧环境,使得一些细菌在一定氧浓度下能还原N2O[21]。此外,铁作为电子供体实现了微生物的自养反硝化[22],能减少N2O产生。
2.3 不同人工湿地典型周期内CH4的排放规律及溶解态CH4的变化
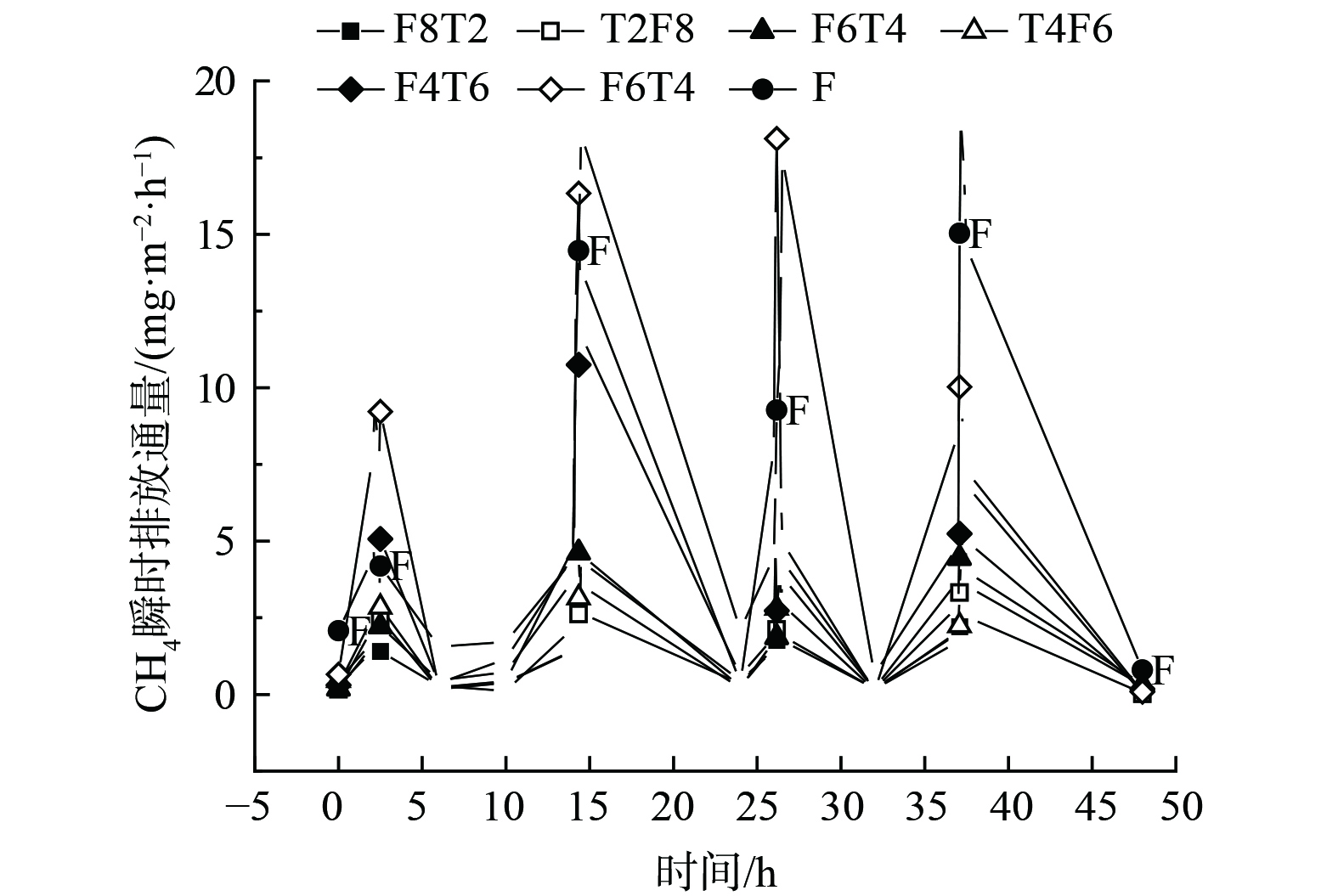
图2展现了典型周期内两组人工湿地CH4瞬时排放通量。以48 h为一个典型周期,各湿地中的CH4排放通量在曝气阶段迅速升高,曝气结束后又迅速下降,且每一曝气时段CH4最低瞬时排放通量都出现在铁碳-沸石体积比为2:8的实验组。另外,当沸石/铁碳体积比相同、而沸石、铁碳的填充顺序不同时,湿地组2的CH4瞬时排放量明显低于湿地组1。
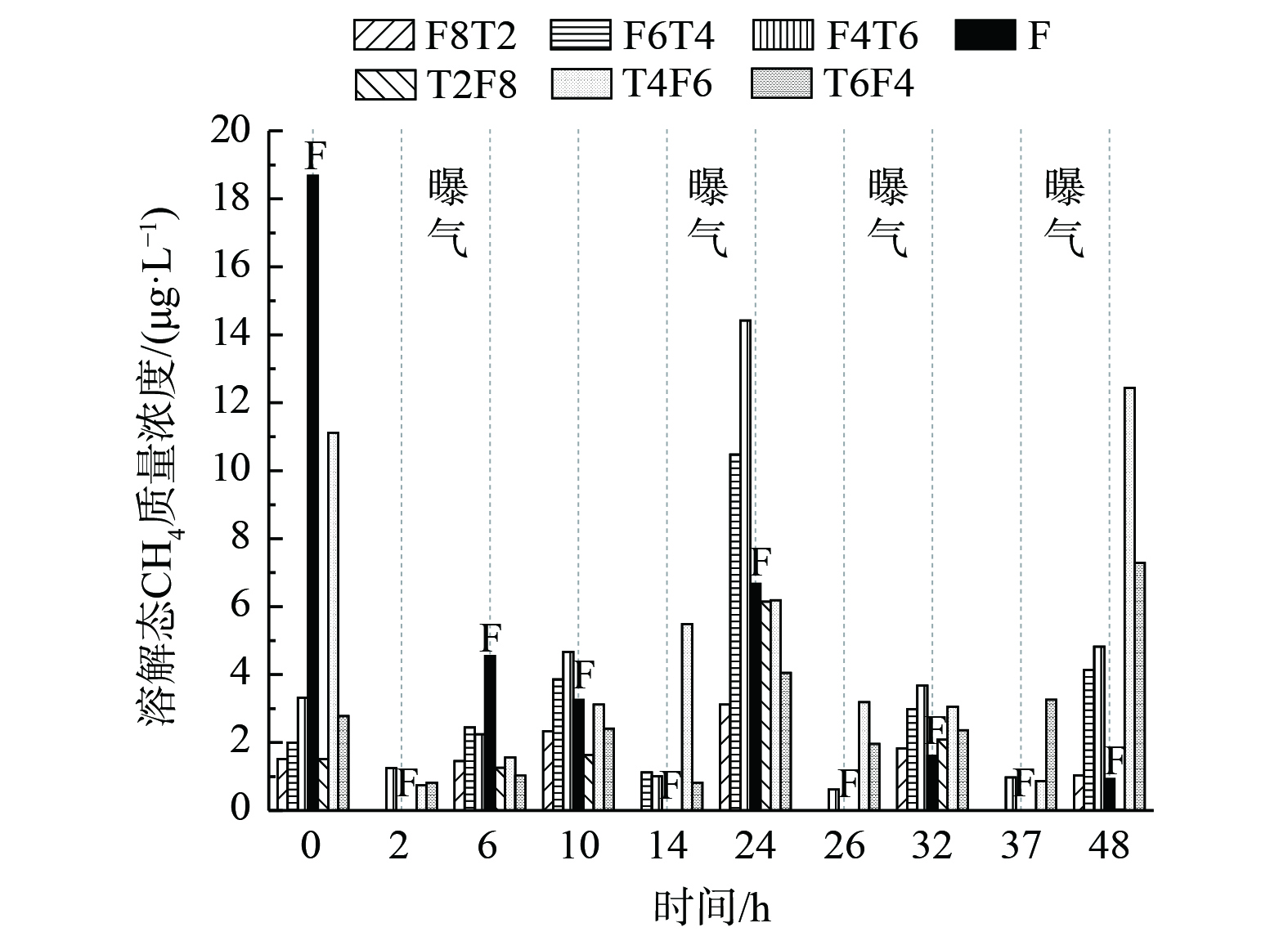
图3为典型周期内曝气段和非曝气段末端溶解态CH4的质量浓度,不同于CH4的排放通量,溶解态CH4质量浓度在非曝气条件下,要明显高于曝气段。在曝气阶段,CH4的质量浓度分别为14.53、23.26、30.68 μg·L−1,而在非曝气阶段,CH4的质量浓度分别达到了40.96、59.51、30.68 μg·L−1。然而,CH4的生成大多发生在厌氧段,该反应段的Eh通常低于−150 mV。此时,产甲烷菌的活力会显著提升,进而使得CH4的生成量增加。当湿地的Eh高于50 mV时,会停止产生CH4[23]。结合图4可知,两组湿地非曝气段最低Eh均低于−20 mV,曝气段Eh峰值均超过100 mV,在非曝气阶段时,随着湿地Eh降低,平均CH4排放通量会升高。湿地组1中的非曝气段最低Eh分别为−27.5、−36.3、−61.7 mV,曝气段Eh均超过100 mV;湿地组2中的非曝气段最低Eh分别为−26.5、−32.81、−40.9 mV,曝气段Eh均超过100 mV。
上述结果表明,CH4的生成多发生在曝气段以外,曝气段会以曝气方式将CH4吹出[24]。在曝气段,湿地系统本身是不会产生CH4的,而是将之前积累的CH4排入大气,从而使系统出现CH4排放通量迅速增大,并达到高峰,最后在曝气段结束后又出现显著下降的现象。另外,使用不同孔隙率的人工湿地填料可改变其溶解氧供应,从而改善湿地溶解氧条件。铁碳微电解填充物主要对CH4的生成和CH4催化起主要作用。随着Fe3+的加入,系统中原有的大量铁氧体,即铁还原菌,会参与产甲烷菌的反应,从而会与其共同竞争有机酸或氢气等底物,最终对CH4产生起到阻碍的作用。沸石的添加则直接减少了产甲烷古菌的数量,阻碍了CH4产生[25-26]。此外,极高的氧化还原电位,使CH4更易实现厌氧氧化,做为唯一的电子供体且有合适的电子受体,CH4被氧化为CO2[27-29]。但铁碳/沸石比例过高时,过量铁屑可能会将Fe3+还原为Fe2+。CH4的电子受体减少使CH4转化为CO2过程受阻,导致CH4减排效果变差。
2.4 不同人工湿地周期内N2O排放规律及溶解态N2O变化
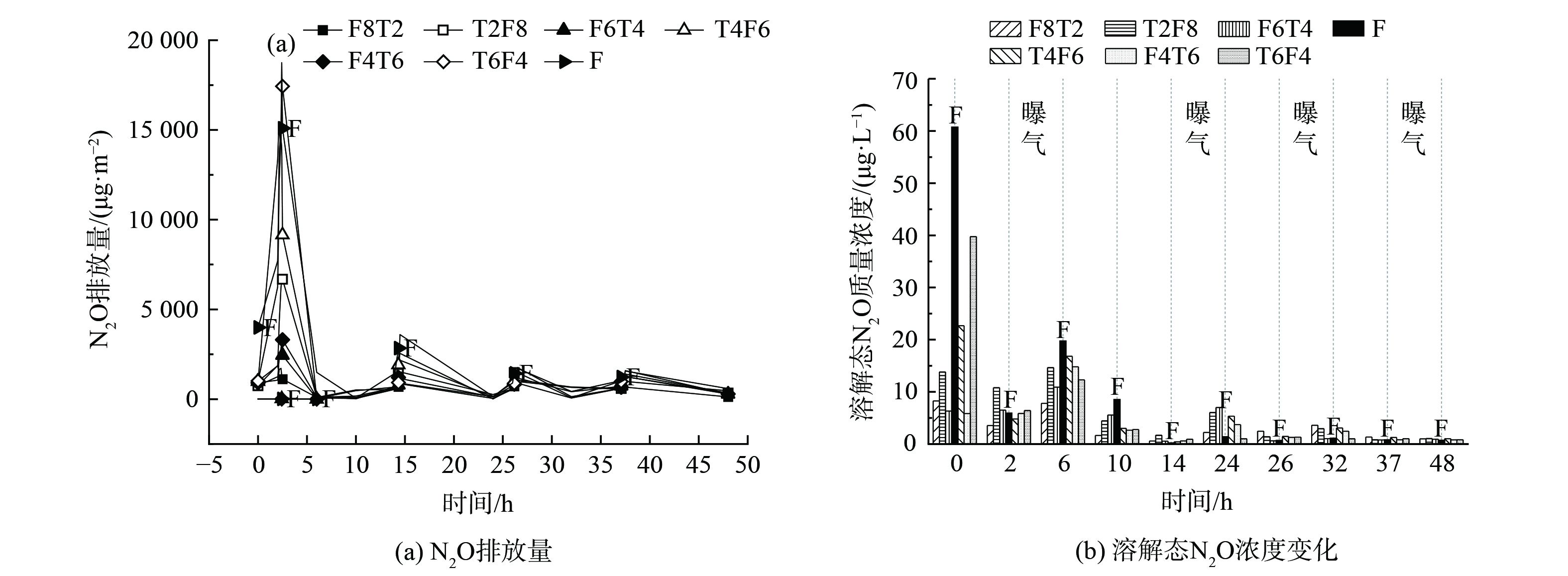
图5 (a) 为典型周期内不同人工湿地N2O瞬时排放通量。以48 h为一个典型周期,湿地F在此周期内的N2O的累积排放量为 (100.04±18.84) μg·m−2。由表3可知与湿地F相比,湿地组1和湿地组2的N2O累积排放量均有下降,且湿地组2的N2O累计排放量低于湿地组1。当沸石/铁碳体积比相同但二者填充顺序不同时,铁碳在底层湿地组2比湿地组1的N2O减排效果更为明显。从铁碳-沸石填充体积比来看,铁碳占比越少,N2O减排效果越好。曝气段N2O排放通量明显高于非曝气段,各人工湿地系统中N2O排放通量和溶解态N2O均随着曝气次数的增加而逐渐降低。一方面,由于曝气吹脱作用把溶解态N2O排入大气环境中[1];同时,曝气段DO迅速上升会影响氧化亚氮还原酶(Nos)的活力,进而促使N2O生成并大量排放[30]。
表 3 典型周期内不同湿地组 累计排放量Table 3. Cumulative NO2 emissions from different wetland groups in a typical cycle μg·m−2湿地组别 填充方式 NO2累计排放量 1 T2F8 57.70±5.38 1 T4F6 59.89±7.55 1 T6F4 67.39±12.17 2 F8T2 32.45±2.71 2 F6T4 40.22±3.69 2 F4T6 38.85±4.31 对照组 F 100.04±18.84 图5 (b) 为一个典型周期内的曝气和非曝气两阶段中N2O 的最终浓度变化。在循环初期和非曝气段,N2O的质量浓度均很高,但在反应进行8 h后,N2O的质量浓度出现明显降低。在4个人工湿地系统中,每个周期的前24 h,其溶解态N2O质量浓度均为(4.01-3.27)~(16.11-22.96)μg·L−1。而反应进行24 h后,N2O质量浓度则出现明显降低,仅为(0.84+0.18) ~(2.10+1.18)μg·L−1。总体来说,在曝气段N2O的质量浓度比非曝气段要低。这是因为在反应前期,微生物会发生好氧降解有机质的反应,该过程使系统内DO迅速降低,而NO3−在此时被还原,从而导致NO2−的累积,促进了溶解态N2O生成。由于系统内硝化与反硝化反应不断进行,从而使得底物的TN指标降低,曝气段N2O最高值和溶解态N2O质量浓度也不断降低。[1]。
2.5 综合GWP
全球增温潜能值 (GWP) 可反映温室气体对温室效应的强化能力[27]。如表4所示,从铁碳-沸石不同填充顺序来看,铁碳填充在底层湿地组2的GWP均明显低于铁碳填充在表层湿地1;从铁碳-沸石不同填充体积比来看,铁碳占比越少GWP越低。其中,GWP最低的是F8T2,比起对照组F的综合GWP降低了79.51% (P<0.05) ;而GWP最高的T6F4相较于F也下降了13.86% (P<0.05) 。N2O对综合GWP贡献显著大于CH4,达到了69.71%~88.92%,而CH4贡献率仅为11.08%~30.29%。由此可见,典型周期内铁碳在底层的湿地F8T2所排放的CH4和N2O均最少 (P<0.05) ,且综合GWP仅为 (16.94±1.45) g·m−2 (以CO2-eq计) ,其综合减排效果最好。
表 4 典型周期内人工湿地CH4及N2O的排放量及综合GWPTable 4. CH4 and N2O emissions and integrated GWP in the typical cycle湿地组名称 填充方式 CH4/(mg·m−2) GWP-CH4/(g·m−2) N2O/(mg·m−2) GWP-N2O/(g·m−2) GWP (CH4+N2O) /(g·m−2) 1 T2F8 155.44±0.76d 5.28±0.03 99.05±3.27d 29.52±0.09 34.80±2.71 2 F8T2 101.95±0.53f 3.47±0.02 45.21±1.35f 13.47±0.04 16.94±1.45f 1 T4F6 164.73±0.87d 5.60±0.03 150.88±3.68c 44.96±0.11 50.56±3.04c 2 F6T4 150.06±0.85ed 5.10±0.03 67.11±2.93e 20.00±0.08 25.10±2.14ed 1 T6F4 440.05±0.97b 14.96±0.04 188.81±6.37b 55.87±0.19 71.23±2.46b 2 F4T6 271.25±0.75c 9.22±0.02 71.20±4.83e 21.22±0.14 30.44±2.95d 对照 F 559.41±1.09a 19.02±0.04 213.66±7.21a 63.67±0.21 82.69±3.17a 注:各种温室气体的GWP以CO2当量 (CO2−eq) 计。 3. 结论
在铁碳-沸石为基质的人工湿地中,铁碳在底层,沸石在顶层的填充顺序下,CH4和N2O减排效果均优于铁碳在表层,沸石在底层的湿地系统。在填充顺序一定的情况下,基质中沸石/铁碳的填充体积比对CH4和N2O减排有一定影响。当沸石与铁碳体积比为8:2时,综合GWP最低,湿地在水质净化与温室气体减排方面均有明显效果,为本实验中最佳组合人工湿地。
-
[1] 马杰. 我国挥发性有机污染地块调查评估中存在的问题及对策建议[J]. 环境工程学报, 2021, 15(1): 3-7. doi: 10.12030/j.cjee.202007080 [2] 马杰. 污染场地VOCs蒸气入侵风险评估与管控 [M]. 北京: 科学出版社, 2020. [3] MA J, MCHUGH T, BECKLEY L, et al. Vapor intrusion investigations and decision-making: A critical review[J]. Environmental Science & Technology, 2020, 54(12): 7050-7069. [4] VERGINELLI I, YAO Y. A review of recent vapor intrusion modeling work[J]. Groundwater Monitoring & Remediation, 2021, 41(2): 138-144. [5] 中华人民共和国生态环境部. 污染地块地下水修复和风险管控技术导则(HJ 25.6-2019)[S] [M]. 北京: 中国标准出版社, 2019. [6] 马杰. 土壤气监测在污染地块调查评估中的优势、局限及解决思路[J]. 环境工程学报, 2021, 15(8): 2531-2535. doi: 10.12030/j.cjee.202011091 [7] 中华人民共和国生态环境部. 污染地块风险管控与土壤修复效果评估技术导则(HJ 25.5-2018) [S]. 北京: 中国标准出版社, 2018. [8] 中华人民共和国国土资源部. GB/T 14848-2017地下水质量标准 [S]. 北京: 中国标准出版社, 2004. [9] WANG Y X, LI J X, MA T, et al. Genesis of geogenic contaminated groundwater: As, F and I[J]. Critical Reviews in Environmental Science and Technology, 2020, 51(24): 2895-2933. [10] 中华人民共和国生态环境部. HJ/T 164-2020 地下水环境监测技术规范 [S]. 北京: 中国标准出版社, 2020. [11] 中华人民共和国生态环境部. 建设用地土壤污染风险管控和修复监测技术导则(HJ 25.2-2019)[S]. 北京: 中国标准出版社. 2019. [12] 中华人民共和国生态环境部. 地块土壤和地下水中挥发性有机物采样技术导则(HJ 1019-2019) [S]. 北京: 中国标准出版社. 2019. [13] MACKAY D, HATHAWAY E, DE SIEYES N, et al. Comparing natural source zone depletion pathways at a fuel release site[J]. Ground Water Monitoring and Remediation, 2018, 38(2): 24-39. doi: 10.1111/gwmr.12278 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 6267
- HTML全文浏览数: 6267
- PDF下载数: 296
- 施引文献: 0





 下载:
下载: