-
全球纺织业每年的染料总消耗量超过10 000 t,并且每年约有100 t的染料被排放到自然水体中[1]。染料废水具有色度高、毒性大、成分复杂且难生物降解的特点,对环境和人体都有危害。罗丹明B(RhB)是一种在轻工业中广泛使用的阳离子型染料,具有致癌性。
处理染料废水的常用方法包括物理法、化学法和生物法[2]。近年来,随着新能源的开发与利用,具有绿色环保特征的光催化技术备受人们的关注[3]。光催化降解有机染料被认为是一种清洁高效的染料废水处理方法,该方法能够高效地将多种污染物转化为毒性较小的中间产物,或是将其彻底降解为CO2和H2O,达到无害化处理的要求。
近年来,金属有机框架(MOF)材料在光催化领域受到越来越多的关注[4-7]。MOF材料是一类由金属离子(簇)和有机配体配位而成的杂化材料[8],具有稳定性高[9]、比表面积大、孔隙度高以及结构灵活可调的典型特征[10-12]。MOF材料在异相催化等领域均有优异的表现[13-14],其出众的吸附性能[15]与异相催化潜力为传统的染料废水处理提供了新的解决方案[16]。但是,大多数 MOF材料的宽带隙只能吸收紫外光,而对可见光吸收率低[17],并且纯MOF材料存在光生电子-空穴对复合快的问题[18],导致其光催化活性并不理想。因此,许多研究致力于采用配体修饰[19-20]、掺杂金属[21-22]等方法对MOF材料进行改性,以提升其光催化活性。目前,氨基修饰是增强MOF材料可见光吸收的一种常用方法[23-25]。
本研究评估了氨基修饰Fe/Cu-MOF对RhB的光催化降解性能,考察了非氨基配体/氨基配体的配比、初始条件对催化效果的影响,并基于以上结果提出了氨基修饰Fe/Cu-MOF光催化降解RhB的反应机制,包括光捕获和电子转移路径,以及主要活性物种的生成过程。
-
氯化铁(FeCl3·6H2O)、对苯二甲酸(H2BDC)、2-氨基对苯二甲酸(NH2-BDC)、对苯醌(BQ)购于上海安耐吉化学有限公司,乙二胺四乙酸二钠(EDTA-2Na)购于上海易恩化学技术有限公司,氯化铜(CuCl2 ·2H2O)、N,N-二甲基甲酰胺(DMF)、异丙醇(IPA)、无水甲醇、无水乙醇、盐酸购于国药集团化学试剂有限公司,氢氧化铵购于天津市百世化工有限公司,罗丹明B购于天津市北联精细化学品公司,纳米磁性氧化铁购于阿拉丁试剂,以上试剂均为分析纯。
-
1) Fe-MOF的合成[26-27]。称取10 mmol的FeCl3·6H2O和5 mmol的H2BDC混合溶解于60 mL DMF溶剂,转移至100 mL聚四氟乙烯内衬反应釜中,在110 ℃下反应24 h。反应完成后待自然冷却至室温,产物用DMF和无水甲醇分别洗涤3次,在80 ℃下真空干燥24 h,得到产物Fe-MOF。
2) Fe/Cu-MOF的合成。称取9.5 mmol的FeCl3·6H2O,0.5 mmol的CuCl2 ·2H2O和5 mmol的H2BDC混合溶解于60 mL DMF溶剂,其余步骤同1),得到产物为Fe/Cu-MOF。
3)不同H2BDC/NH2-BDC配比的Fe/Cu-MOF-NH2的合成。采用NH2-BDC部分代替上述H2BDC,其余步骤同2)。控制NH2-BDC的加入量可制得不同摩尔比(0∶1、1∶1、2∶1、3∶1、4∶1)的混合配体Fe/Cu-MOF-NH2。
-
通过X射线衍射(XRD,X/Pert PRO MPD,帕纳科分析仪器有限公司,荷兰)对催化剂的晶体结构进行表征;采用扫描电子显微镜(SEM,MIRA 3 LMH,泰思肯有限公司,美国)对催化剂的微观形貌进行分析;光学吸收性质采用紫外可见漫反射光谱仪(DRS,SolidSpec-3700DUV,岛津公司,日本)进行测试;采用精微高博JW-BK100全自动比表面积及孔径分析仪测定目标材料的N2等温吸脱附曲线;使用单点BET和BJH方法计算材料的比表面积、孔体积以及孔径分布;通过元素分析仪(EA, elementar vario EL cube, 德国)对催化剂的元素组成进行分析。
-
取50 mg催化剂,将其分散于50 mL初始质量浓度为300 mg·L−1的RhB溶液中,在暗吸附30 min后开启氙灯,控制电流I为15 A。每隔1 h取样进行离心分离,然后使用紫外-可见分光光度计对离心分离后的上清液进行吸光度测定和光谱扫描。本文中的所有实验均为3次平行实验结果,误差均在5%以内。
-
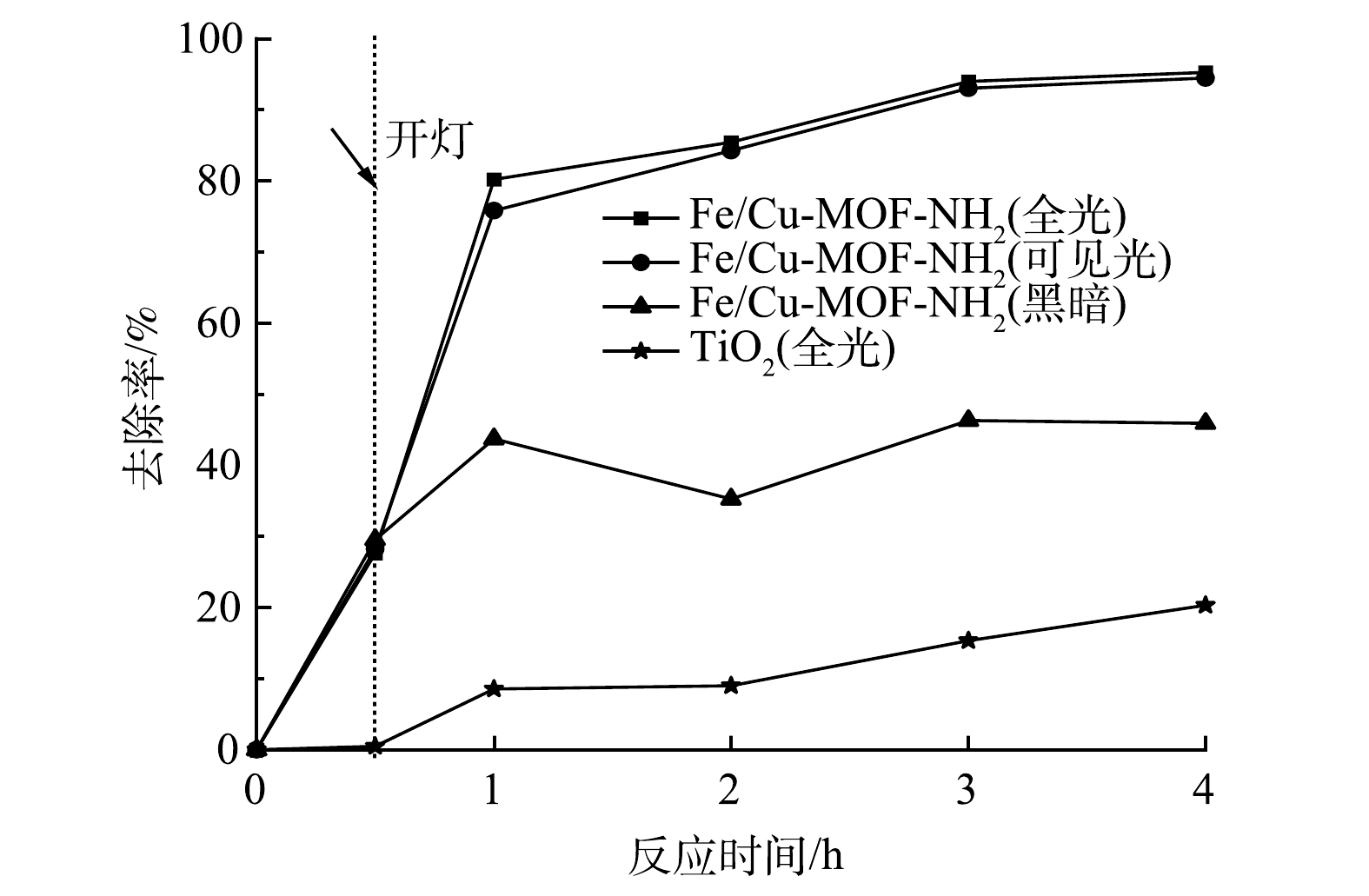
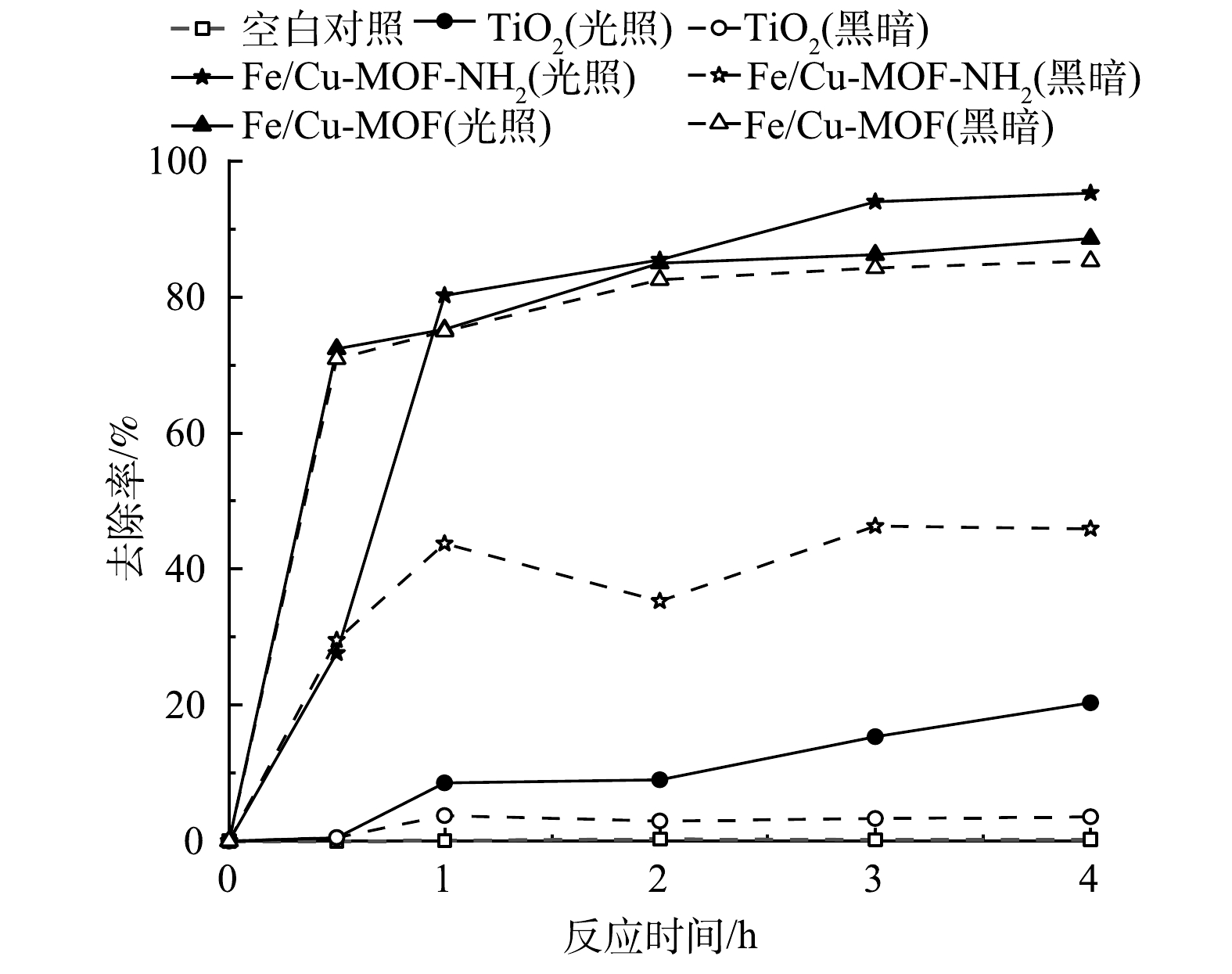
在RhB初始质量浓度为300 mg·L−1,催化剂质量浓度为1 mg·mL−1的条件下,Fe/Cu-MOF和Fe/Cu-MOF-NH2的光催化降解RhB以及暗吸附反应的性能如图1所示。其中,入射光波长采用UV-vis全波段。当RhB的初始质量浓度为300 mg·L−1时,Fe/Cu-MOF 对RhB的吸附去除率仍可达到85%以上,但光照下的去除率无明显提升。这说明Fe/Cu-MOF的光催化活性较弱。而在光照条件下,Fe/Cu-MOF-NH2对RhB的去除率较暗反应条件下有明显提升。在同等光照条件下,商用TiO2对RhB的去除率仅为20.32%,而本研究中制备的Fe/Cu-MOF-NH2对RhB的去除率约为商用TiO2的4.7倍,Fe/Cu-MOF-NH2具有更高的反应速率;在同等条件下,不添加催化剂而仅使用氙灯光源照射并不能引起RhB的降解。Fe/Cu-MOF-NH2对RhB的去除率比Fe/Cu-MOF更高,性能更优良。这表明,氨基的引入能显著提升Fe/Cu-MOF的光催化效率。
-
1)N2吸附-脱附分析。为探究Fe/Cu-MOF-NH2在暗反应下对RhB吸附性能比Fe/Cu-MOF弱的原因,在−196 ℃下测试了2种材料的N2等温吸脱附曲线(图2),比表面积与孔容孔径的数据见表1。表1 的数据说明,Fe/Cu-MOF和Fe/Cu-MOF-NH2均属于介孔材料,引入氨基后BET比表面积大幅降低,孔容积也相对减小,而对应的平均孔径增大。已有研究[28-29]表明,氨基的引入可能会造成材料比表面积和孔容的减小。大孔径孔结构的增加必然会牺牲一部分较小孔径所占的空间,由于含氨基配体的材料在合成过程中可能存在穿插结构或因小分子团簇造成的孔道堵塞,导致孔容明显减小;而BET比表面积的减小则是因为孔隙度的降低或者由于孔道堵塞造成的孔径内比表面积的降低。最明显的影响就是Fe/Cu-MOF- NH2在暗反应下对RhB的吸附效果明显低于Fe/Cu-MOF。
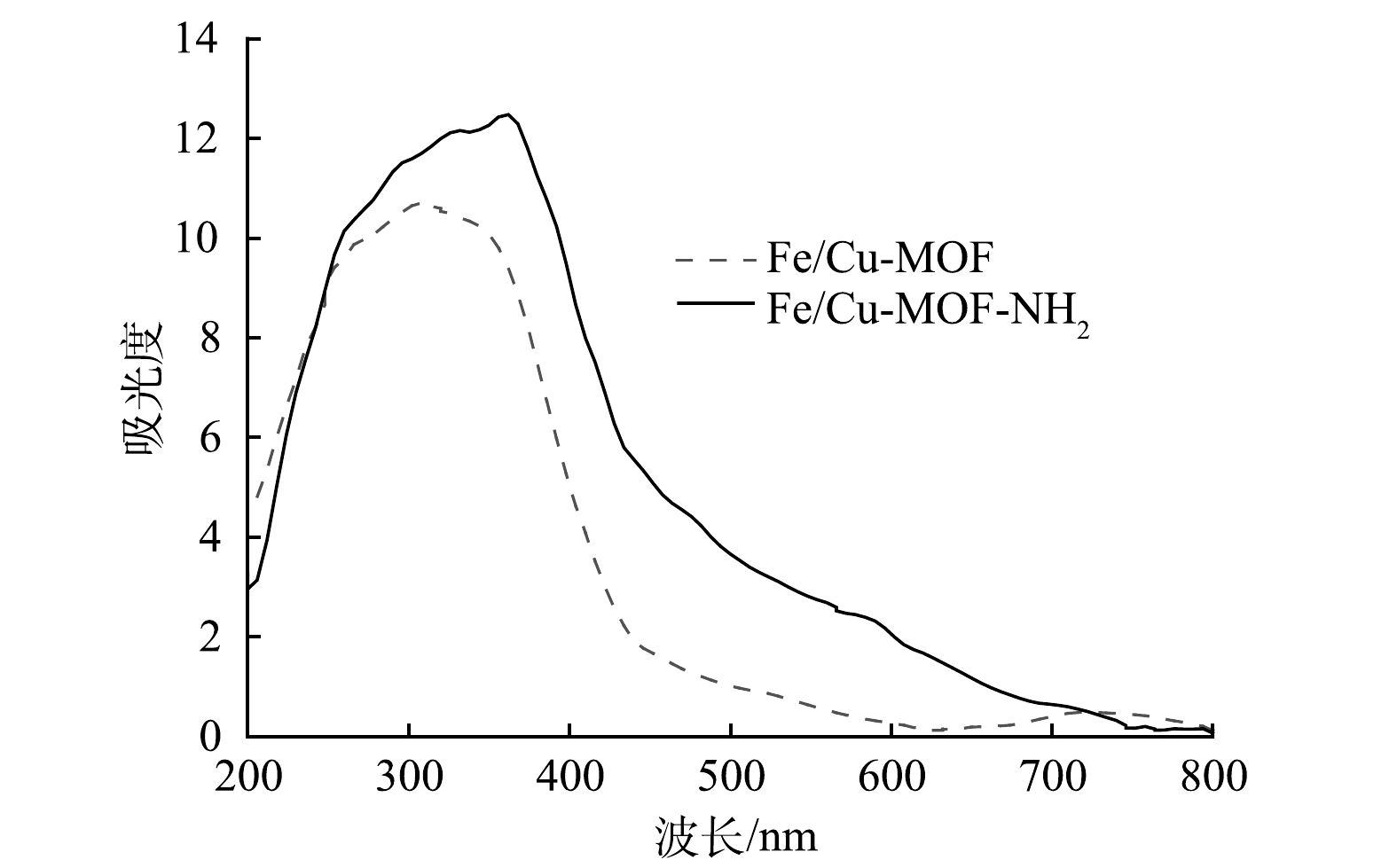
2) UV-vis分析。图3表明,Fe/Cu-MOF-NH2具有良好的可见光响应活性,在采用全光谱照射或可见光波段照射时,Fe/Cu-MOF-NH2所表现出的光催化活性相近。图4也说明Fe/Cu-MOF-NH2比Fe/Cu-MOF在可见光区域具有更强的吸收能力。
3)SEM分析。图5反映了Fe/Cu-MOF-NH2光催化反应前后的微观形貌。可以看出,材料在反应后微观形貌几乎没有变化,说明其具有良好的稳定性。
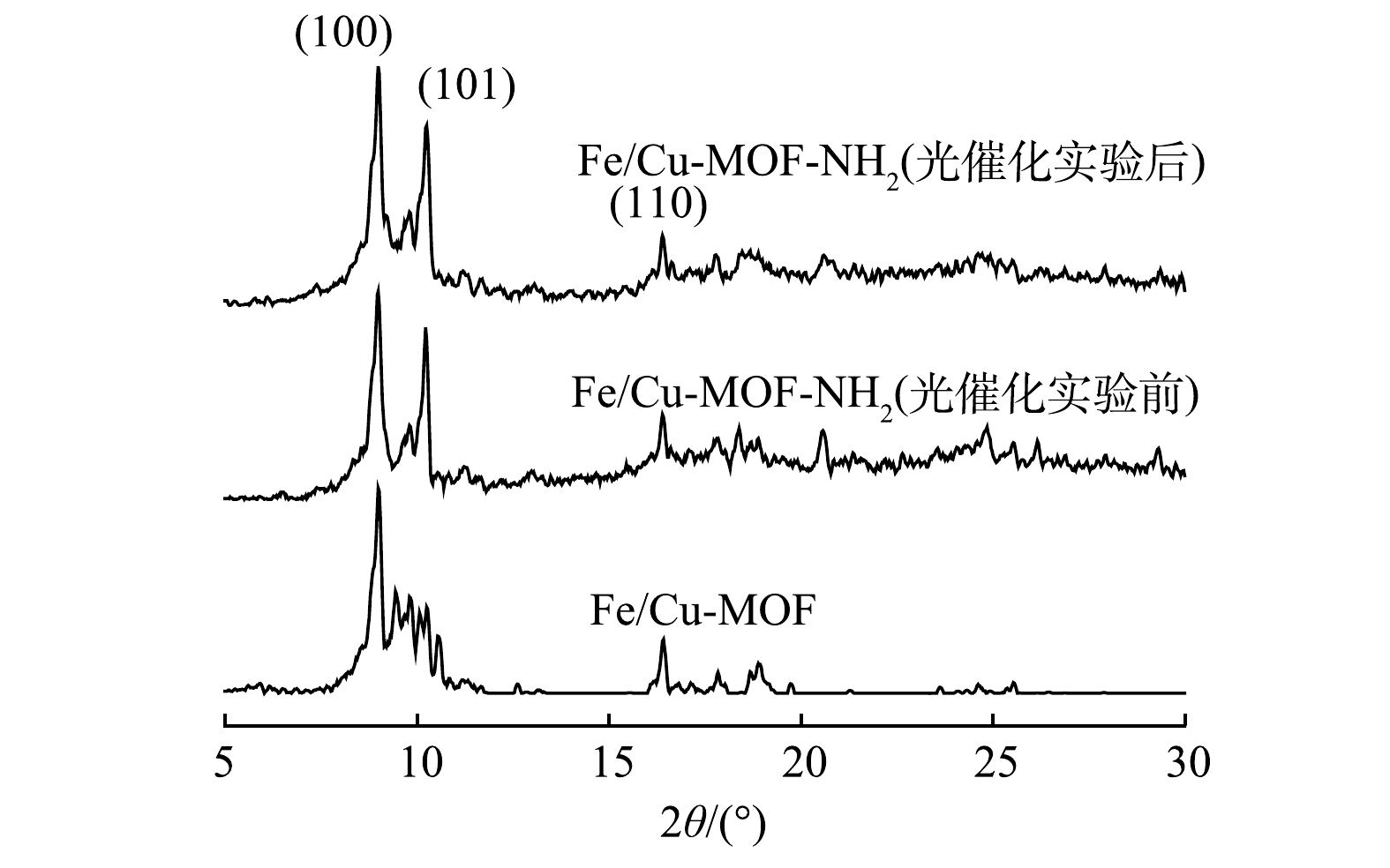
4)XRD分析。图6为Fe/Cu-MOF光催化前及Fe/Cu-MOF-NH2光催化反应前后的XRD图谱。其中Fe/Cu-MOF-NH2的主要衍射峰出现的位置在9.0°、10.2°、16.4°,分别对应(100)、(101)、(110)晶面,与文献报道结果[26]一致。此外,Fe/Cu-MOF-NH2光催化反应前后的衍射图谱结构相似,表明其具有良好的稳定性。
5)元素分析。使用元素分析仪测试Fe/Cu-MOF和Fe/Cu-MOF-NH2中各元素的含量(表2)。Fe/Cu-MOF中不含N元素,检测出的微量N元素可能是由于纯化过程中使用DMF进行洗涤时带入的;而Fe/Cu-MOF-NH2中N元素含量明显增加,说明成功引入了氨基。根据已有研究[26]可推测,氨基以自由的非缔合形式存在。
-
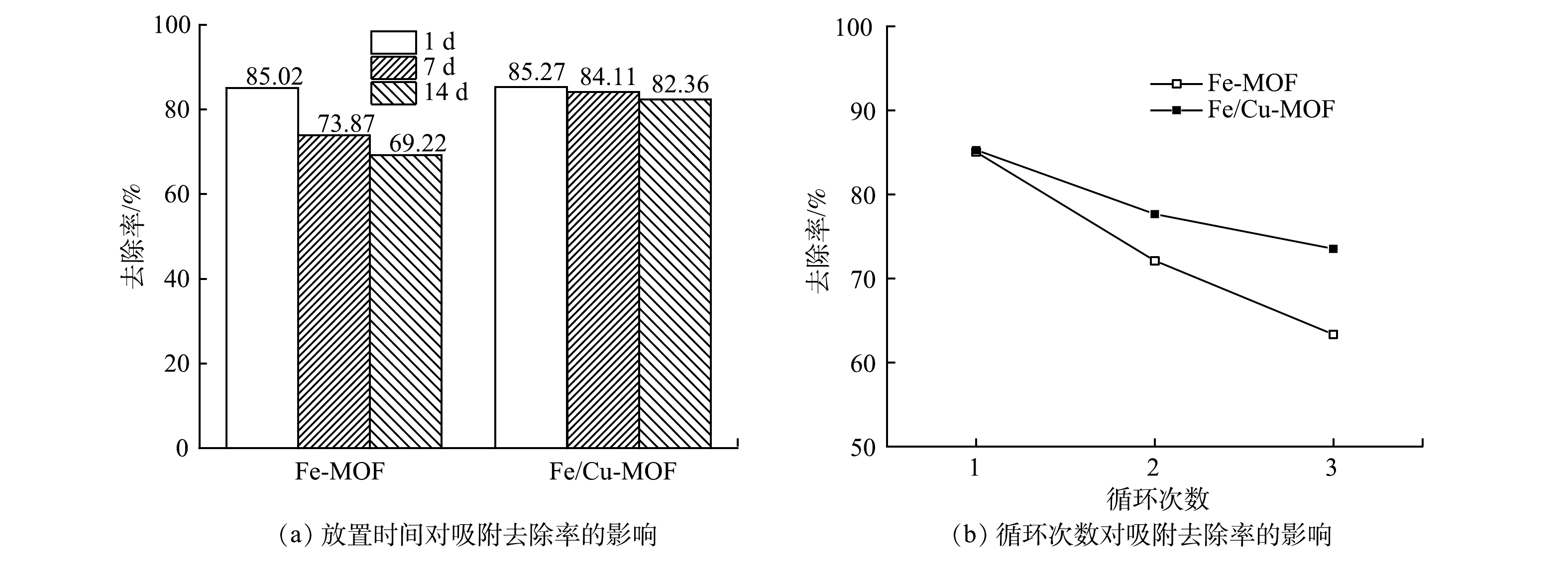
图7(a)反映了放置不同时间后的Fe-MOF和Fe/Cu-MOF对RhB的吸附去除效果。可以看出,Fe/Cu-MOF在自然放置条件下依然保持较好的吸附性能,14 d后对RhB的去除率为82.36%,能达到新制备Fe/Cu-MOF同等条件下对RhB去除率(85.27%)的96%以上。铜离子掺杂后的材料在不采取特殊存放措施(真空密闭环境)下虽然仍存在吸附性能衰减的情况,但可缓解其衰减的进程,Fe/Cu-MOF自身结构的稳定性较Fe-MOF有所增强。图7(b)反映了Fe-MOF和Fe/Cu-MOF多次循环使用过程中吸附性能的变化情况。相较于Fe-MOF,3次循环之后Fe/Cu-MOF对RhB的去除率仍达70%以上,说明其具有良好的稳定性。这是因为:相对于Fe(Ⅲ),金属铜离子的惰性取代[30]增强了Fe/Cu-MOF的稳定性;同时,金属离子的掺杂对MOF表面产生扰动,阻碍了孔隙表面水簇的形成,从而提高MOF的水稳定性[31]。
-
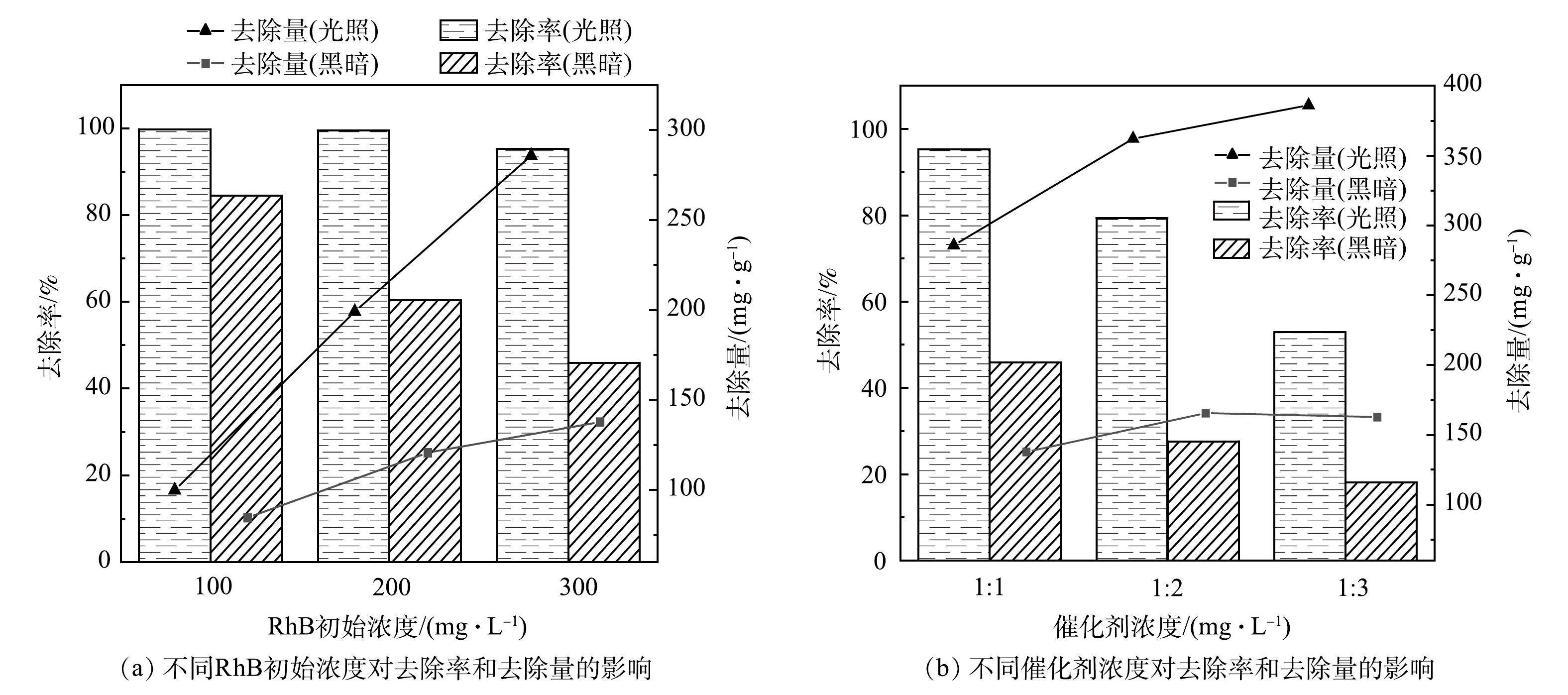
图8(a)和图8(b)分别反映了RhB初始质量浓度和催化剂浓度在Fe/Cu-MOF-NH2光/暗反应4 h后对RhB去除效果的影响。在催化剂质量浓度为1 mg·mL−1时,RhB的初始质量浓度越大,Fe/Cu-MOF-NH2在暗反应下对RhB的去除效果越差,而光反应下的去除效果未受到明显影响。这说明Fe/Cu-MOF-NH2的光催化活性较强。保持RhB初始质量浓度为300 mg·mL−1,当催化剂质量浓度分别为1/3、1/2、1 mg·mL−1时,催化剂质量浓度越高,反应的位点越丰富,同时染料分子与催化剂表面的有效碰撞次数也会增加,因而对RhB的降解率也越高。当RhB初始质量浓度较高时,催化剂质量浓度的降低会使Fe/Cu-MOF-NH2的光反应和暗反应下对RhB的去除率均迅速降低,但单位质量的催化剂对RhB的去除量仍呈上升趋势。这也表明Fe/Cu-MOF-NH2具有较好的催化性能。
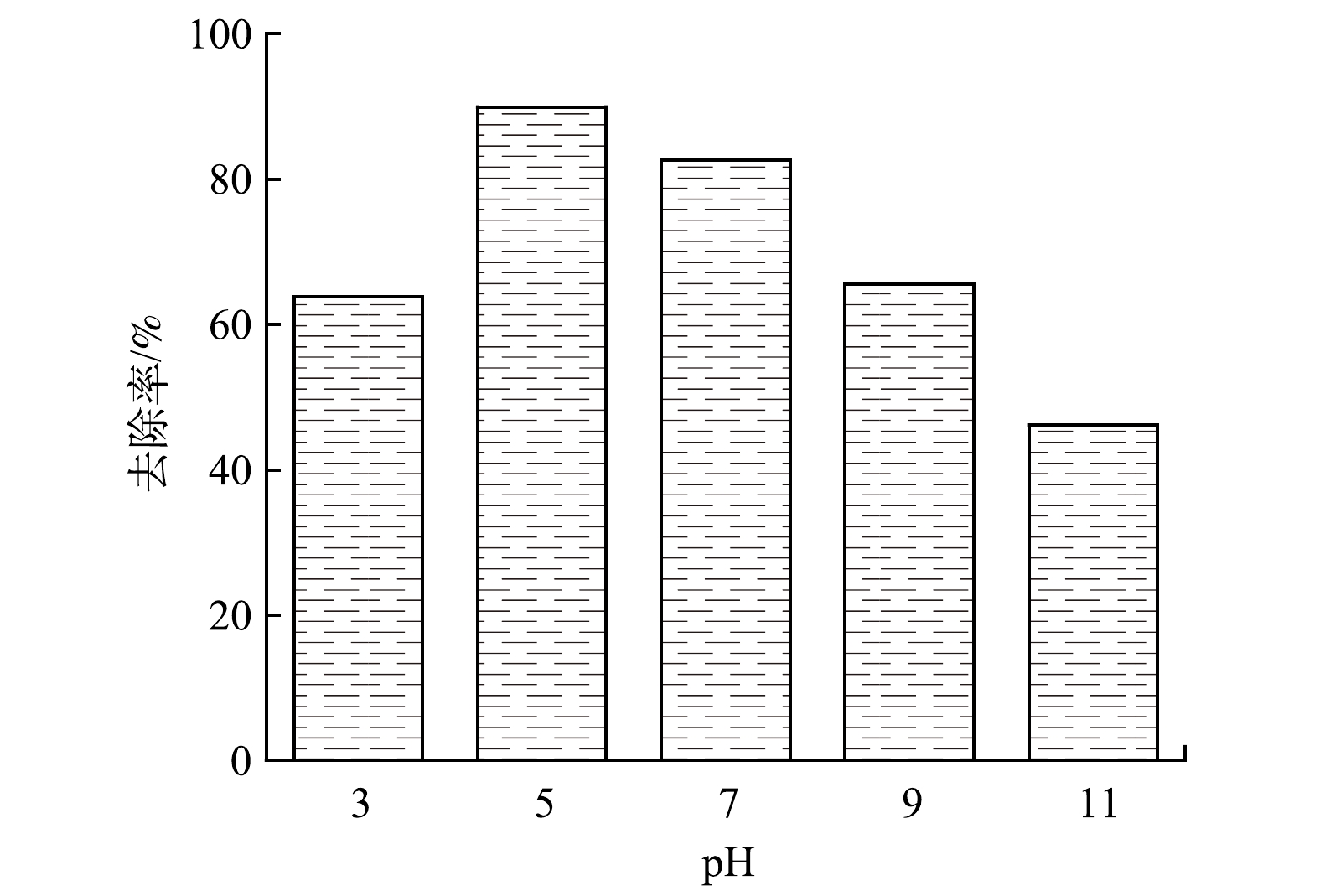
图9反映了光照条件下在pH为3.0~11.0内测定的Fe/Cu-MOF-NH2对RhB的去除率(RhB初始质量浓度为300 mg·L−1,催化剂质量浓度为1 mg·mL−1,反应4 h)。结果表明,当pH为5~7时,Fe/Cu-MOF-NH2能保持较好的光催化性能;而当pH为3和11时,Fe/Cu-MOF-NH2对RhB去除效果下降。这是因为:较强的酸性和碱性环境均不利于MOF的稳定存在,并且随着pH的增大,溶液中OH−浓度不断增加,与脱落的金属离子形成沉淀,覆盖于催化剂表面并阻碍了反应的进行[32]。由于RhB溶液的pH稳定在4.2±0.1,且Fe/Cu-MOF-NH2在该pH条件下对RhB具有较高的去除率。因此,后续实验不再调整溶液的pH。
-
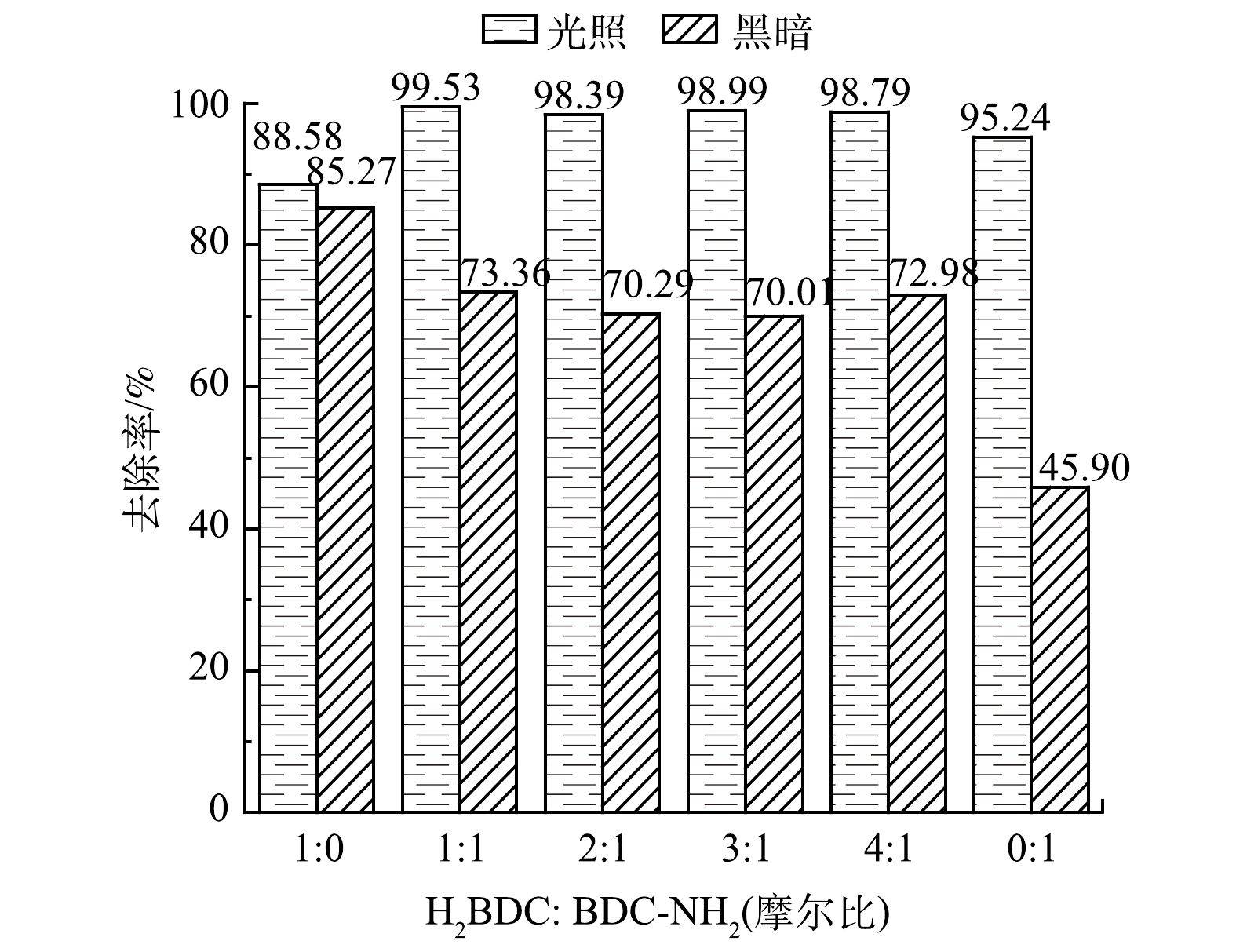
有研究[33-35]表明,氨基的引入可以实现带隙的灵活控制,混合配体(H2BDC与NH2-BDC共同参与催化剂的合成)与金属中心联接得到的MOF材料会比其中任何一种单一配体参与合成的MOF材料具备更好的光催化性能。因此,可通过改变合成材料时H2BDC与NH2-BDC的摩尔比制备得到含有不同配比混合有机配体的MOF材料,并用以探究非氨基配体/氨基配体的配比对光催化效果的影响。在RhB初始质量浓度为300 mg·L−1、催化剂质量浓度为1 mg·mL−1、pH为4.2的条件下,催化剂光催化降解RhB的结果如图10所示。配体修饰前的Fe/Cu-MOF也具备光催化降解RhB的能力,但活性较弱。氨基的引入能够提升光催化性能,在吸附效果弱于Fe/Cu-MOF的前提下,Fe/Cu-MOF-NH2光催化降解RhB的去除率仍然明显高于Fe/Cu-MOF。当H2BDC∶NH2-BDC的摩尔比为1∶1时催化剂对RhB的去除率更高。
此外,引入氨基后的所有样品在暗反应下的吸附性能均有不同程度的降低,其中纯NH2-BDC配体合成的样品吸附效果最弱。导致此结果的可能原因是,由于形成了更大孔径的孔,从而牺牲了部分小孔和整体孔隙度,在材料合成过程中出现的穿插结构或者小分子团簇造成的孔道堵塞均会使孔容积减小,因此,导致Fe/Cu-MOF-NH2在暗反应下对RhB的吸附效果明显低于Fe/Cu-MOF。
-
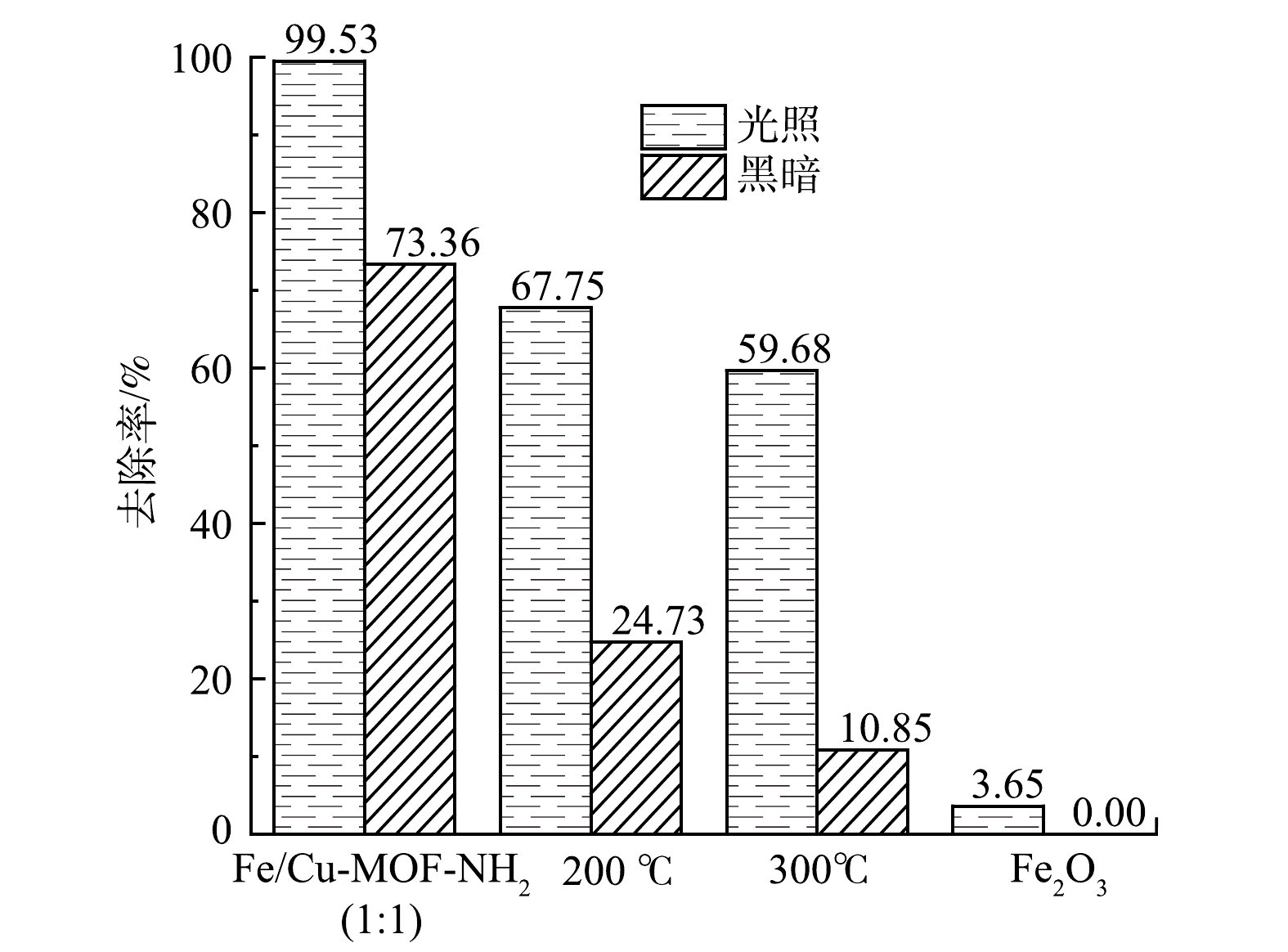
1)煅烧温度的影响。以H2BDC∶BDC-NH2=1∶1(摩尔比)的混合配体材料为原始材料,在空气氛下对材料在200 ℃或300 ℃下煅烧后,测试其光催化降解性能。如表3所示,N2吸脱附等温线测试结果表明BET比表面积显著降低。图11也表明,材料在暗反应下的吸附性能显著降低,而光催化活性受到的影响相对较小。这是因为:框架结构坍塌对材料的光响应活性中心Fe-O簇的破坏较小,高温煅烧后,材料生成金属氧化物Fe2O3,仍存在部分Fe-O中心。配体改变了Fe-O簇与连接体形成网状结构的孔径大小以及比表面积大小,从而影响了材料在暗反应下对RhB的吸附性能。另外,相比于同等剂量的商用磁性氧化铁,MOF材料表现出更好的光催化活性。这说明配体发挥了良好的传递电子的作用。
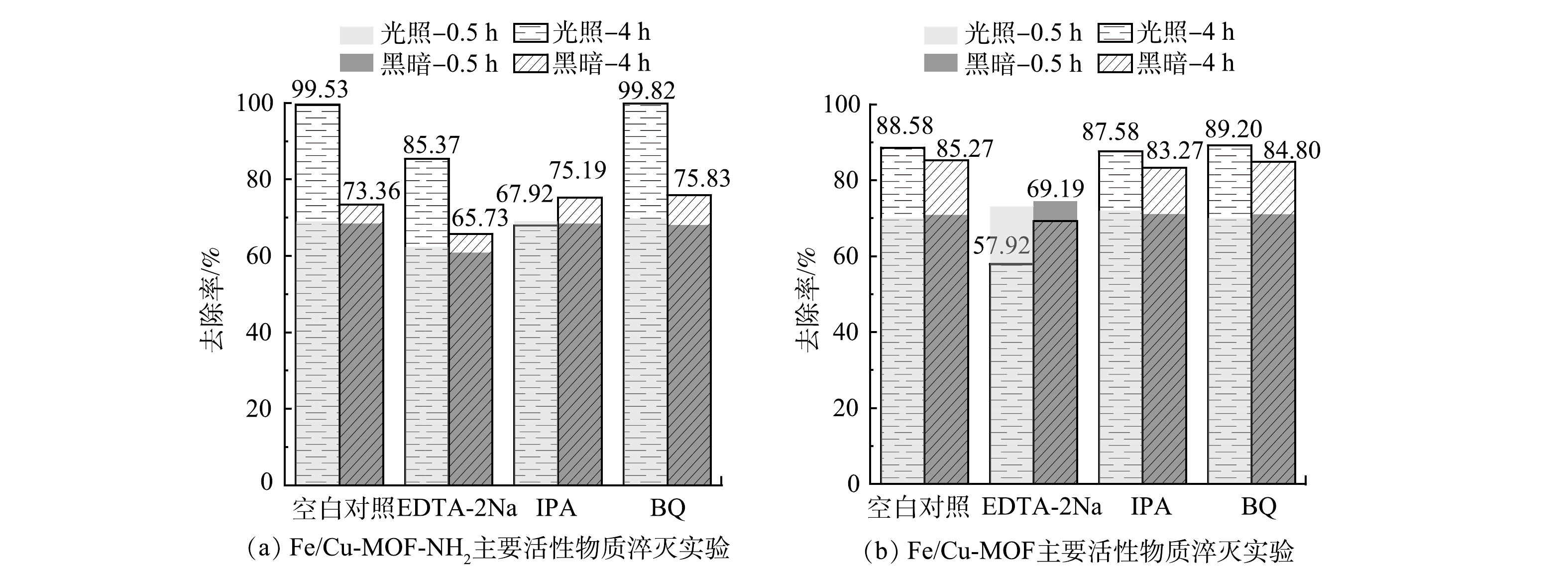
2)活性物种检测。在光催化反应中,半导体受到入射光子激发产生的e-和h+通常并不直接参与反应,而是先与吸附在催化剂表面的基态分子结合,形成新的中间活性物种(·O2-、·OH等),此类高活性物种更易与目标污染物发生氧化或还原反应,从而降解去除目标污染物。为探究光催化降解RhB反应过程中的作用机制,本研究进行了Fe/Cu-MOF和 Fe/Cu-MOF-NH2在光催化反应过程中主要活性物质的淬灭实验,采用EDTA、异丙醇(IPA)、对苯醌(BQ)分别作为h+、·OH、·O2-的淬灭剂,结果如图12所示。
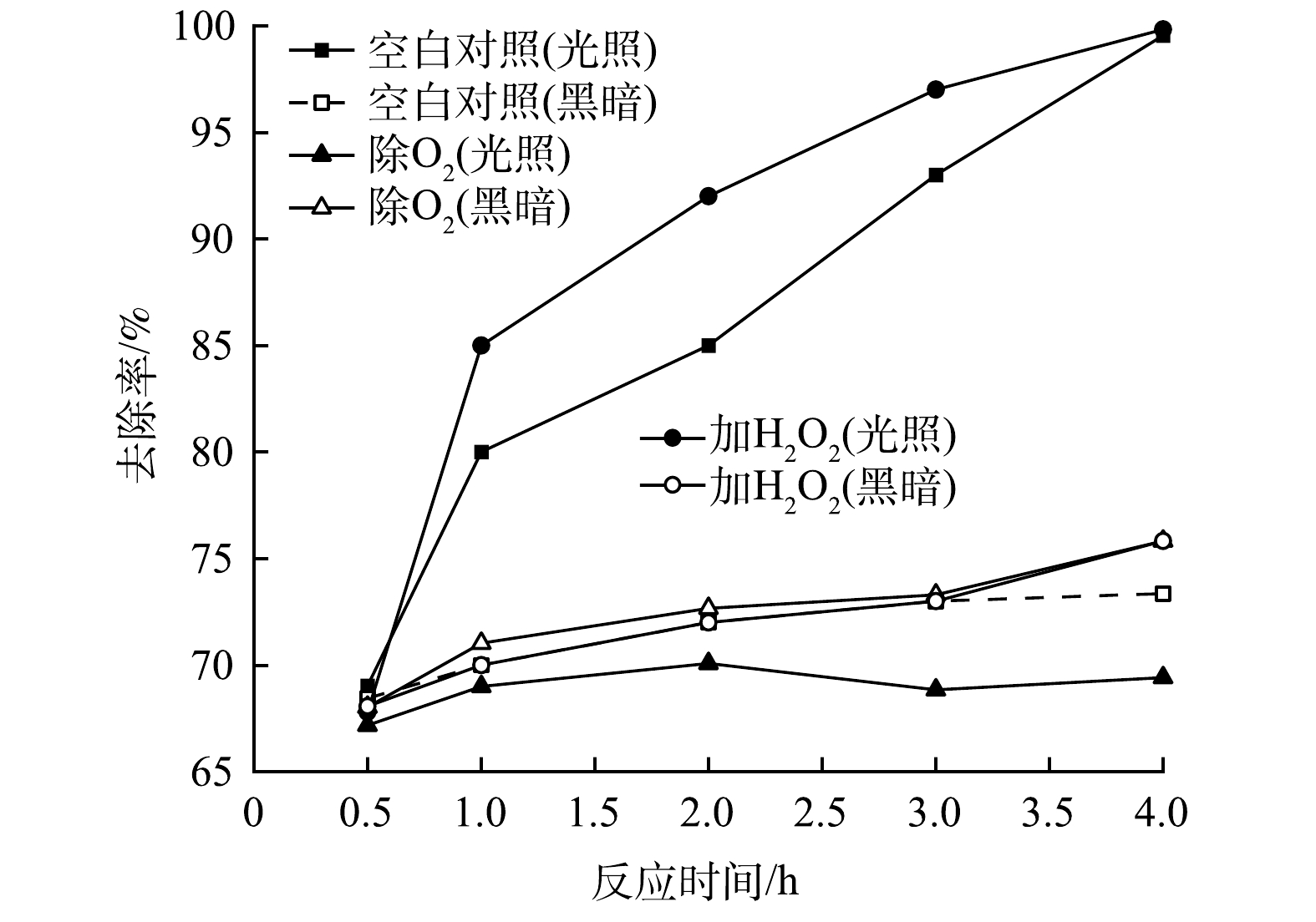
图12反映了添加EDTA-2Na、IPA、BQ以及空白对照组在0.5 h暗吸附和4 h光反应后对RhB的去除效果。可以看出,对于Fe/Cu-MOF,淬灭剂IPA和BQ的添加对Fe/Cu-MOF在光反应下的活性几乎没有影响。这说明对应的·O2-、·OH不是Fe/Cu-MOF光催化降解RhB的主要活性物种。而EDTA-2Na的添加虽然对前期暗吸附没有造成显著影响,但后期RhB的去除率反而呈现下降的趋势,EDTA-2Na在光反应中起到了明显的抑制和破坏作用,导致先前吸附在Fe/Cu-MOF表面的染料分子脱附下来。这说明h+是Fe/Cu-MOF光催化降解RhB的主要活性物种。相比之下,RhB的氧化还原电位(1.3 V)低于Fe-MOF的VB电位[36],因此,h+氧化RhB在热力学上是完全可行的。而对于Fe/Cu-MOF- NH2,添加EDTA-2Na与IPA后光催化效果均降低,其中添加IPA对光反应的抑制更明显,说明·OH是主要活性物种。光催化反应中·OH一般来源于水中的吸附氧与水分子在氧化性物质下的共同作用。配位不饱和的铁离子作为极强的路易斯酸则很可能成为该催化反应过程的活性位点[37-38]。进一步进行除O2与添加H2O2的试验结果如图13所示。
通过抽除反应体系的溶解氧之后,Fe/Cu-MOF- NH2在光反应下对RhB的去除率明显降低;另外,H2O2的加入加快了RhB的光催化降解,对反应过程起到促进作用。在一种常见的催化氧化反应体系——芬顿反应中,H2O2通过与Fe(Ⅱ)发生一系列氧化还原反应生成具有高氧化性的·OH,进而完成目标物质的氧化转化。从本实验结果来看,H2O2促进了·OH的产生从而加速RhB的降解,而O2参与了·OH的生成。
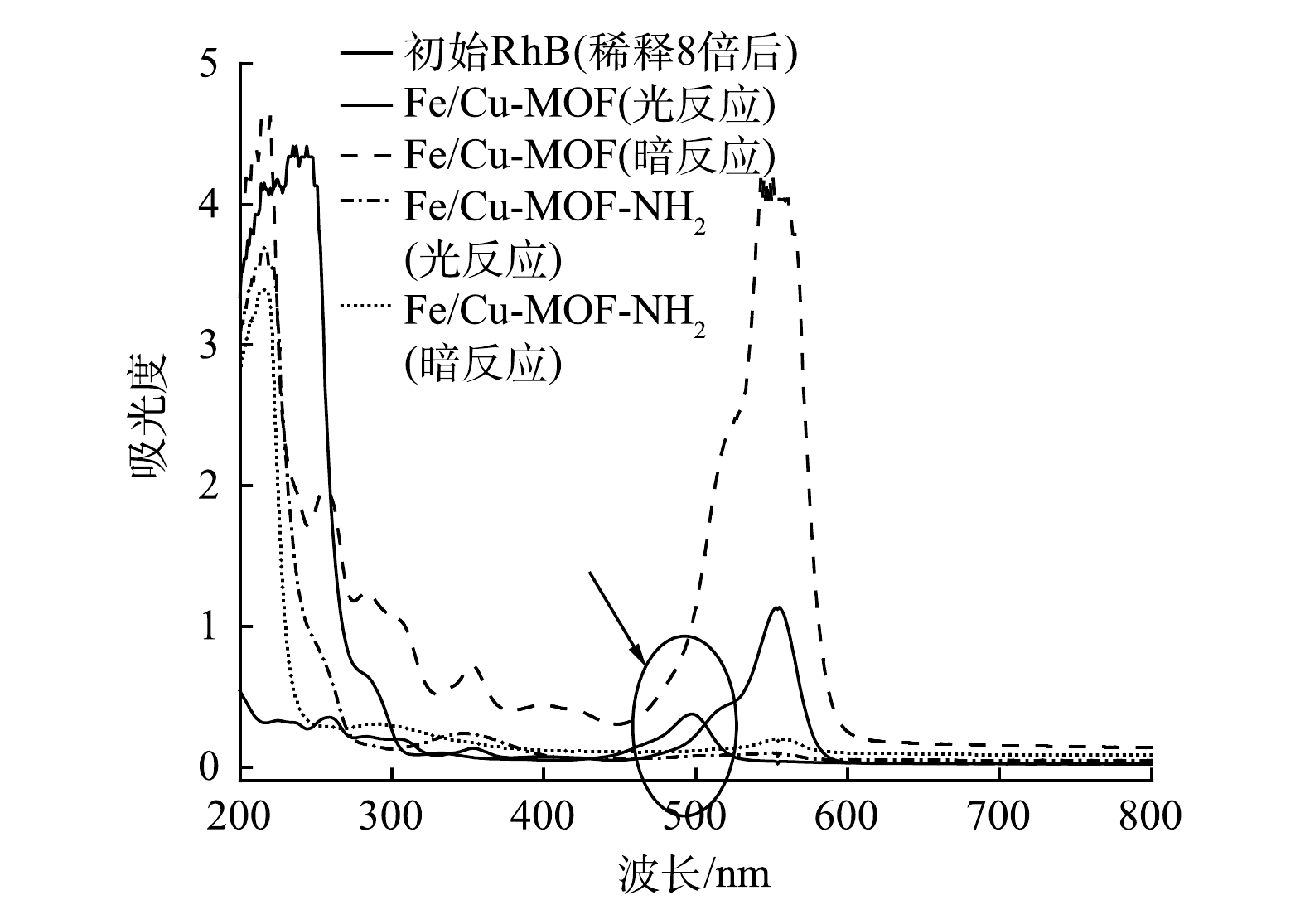
图14反映了Fe/Cu-MOF与Fe/Cu-MOF- NH2在RhB初始质量浓度为300 mg·L−1,催化剂质量浓度为1 mg·mL−1,pH为4.2的条件下进行光催化降解RhB实验后剩余溶液的紫外-可见吸收光谱。RhB的特征吸收波长在554 nm,是由助色团中的孤对电子向反键轨道发生的n-π*跃迁引起的;另一个主要的吸收峰则为共轭结构中电子跃迁所致的350 nm处[39]。Fe/Cu-MOF的暗吸附反应以及Fe/Cu-MOF-NH2的光、暗反应的扫描曲线形状均与未参与反应的初始RhB溶液一致,仅有Fe/Cu-MOF的光催化反应后的溶液中出现了新的吸收峰。无氨基修饰的样品加入异丙醇后光催化活性没有受到明显抑制,说明主要活性物种不是·OH。降解后的溶液呈现淡黄色,说明单纯BDC配体合成的Fe/Cu-MOF不能实现RhB的完全氧化,而是产生了某种中间产物。
-
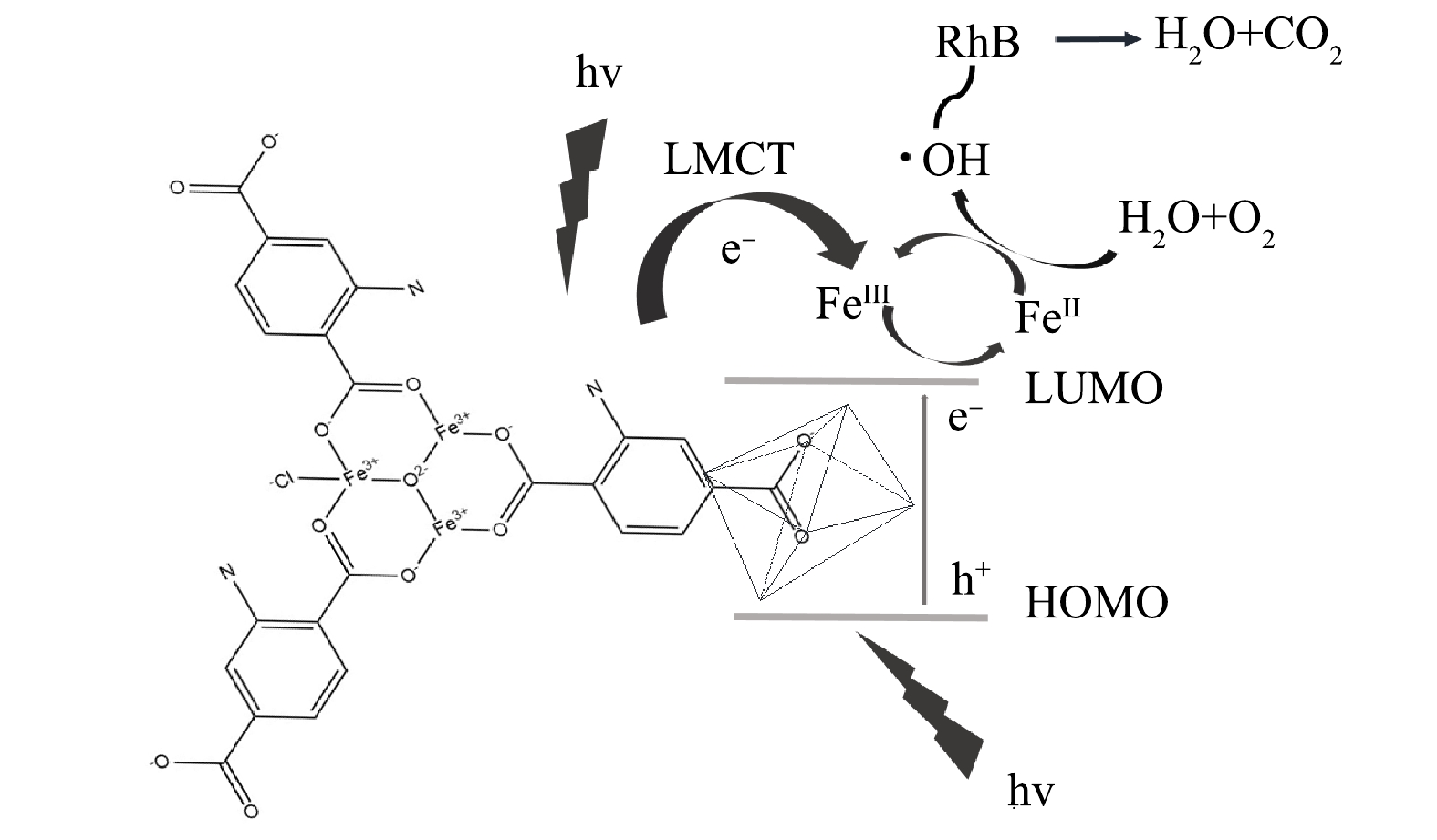
Fe金属中心的MOF材料还有一个重要的特性在于Fe的变价性,类似的还有Ti,可以在Ti3+与Ti4+之间进行转换,这一性质非常有利于光电子的传输与转移。基于上述结果,提出Fe/Cu-MOF-NH2光催化降解RhB的机理模型,如图15所示。RhB与MOF中的路易斯酸位结合,即使在没有氨基的情况下也具有一定的光催化活性。在Fe/Cu-MOF-NH2中存在2种光响应中心,Fe-O簇构成的结构单元具有类金属氧化物半导体的性质,主要由O2p轨道构成的价带中的电子受光子能量激发,跃迁至导带,电子由O2-向Fe3+发生转移(FeⅢ→FeⅡ),生成的二价铁在水分子与水中溶解氧的共同作用下产生·OH。·OH具有的超高氧化还原电位可以破坏染料的生色基团,进而彻底降解染料分子。Fe-O中心是Fe/Cu-MOF-NH2光催化氧化RhB的主要活性中心。同时,氨基的引入也能提供一种新的电子转移通道。氨基受激发产生电子由配体转移至金属中心。氨基基团一旦引入配位体,其提供的孤对电子与苯环π*轨道相互作用,增加反键轨道电子密度[25],这种相互作用可以形成更高的最高占据分子轨道(HOMO)能级,使吸收边拓展至可见光区域。因此,氨基的引入加速了催化过程。
-
1)氨基的引入显著提升了催化剂的光催化性能。当前驱体中H2BDC∶BDC-NH2(摩尔比)为1∶1时,材料能够在保持较好吸附性能的同时达到最佳光催化活性,并在RhB初始质量浓度为300 mg·L−1,催化剂质量浓度为1 mg·L−1,pH为4.2时,反应4 h内对RhB的去除率达到99.53%。
2)氨基的引入一方面使得光吸收发生红移,另一方面促进了电子由配体转向金属中心的电荷转移机制(LMCT),从而提升了Fe/Cu-MOF-NH2的可见光催化性能。
3) Fe-O簇是Fe/Cu-MOF-NH2光催化降解RhB的主要活性中心,·OH与h+分别是 Fe/Cu-MOF-NH2与Fe/Cu-MOF在光催化过程中主要活性物种。
4) Fe/Cu-MOF-NH2光催化降解RhB的可能机制为:当受到光激发时,氨基向Fe-O簇注入电子,同时Fe-O簇中电子也会由O2p轨道跃迁至Fe的3d电子轨道;Fe(Ⅲ)接受电子转变为Fe(Ⅱ),活化氧气产生具有超高氧化还原电位的·OH,从而达到降解染料分子的目的。
氨基修饰增强的Fe/Cu-MOF对罗丹明B的光催化降解性能及相关机理
Performance and mechanism of amino modification enhanced photocatalytic degradation of Rhodamine B by Fe/Cu-MOF
-
摘要: 利用溶剂热合成法合成了氨基修饰的Fe/Cu-MOF-NH2,分别采用XRD、SEM、N2吸附-脱附、UV-vis、EA等检测方法进行了表征分析,并将其用于RhB的光催化降解,考察了RhB的初始质量浓度、催化剂质量浓度和pH对光催化降解的影响。结果表明,氨基的引入显著提升了催化剂的可见光响应性能;在合成Fe/Cu-MOF-NH2时,当含氨基配体与不含氨基配体的摩尔比为1∶1、RhB初始质量浓度为300 mg·L−1、催化剂质量浓度为1 mg·mL−1、pH为4.2时,光照4 h后,催化剂对RhB的去除率达到99.53%。活性物种淬灭实验结果表明,·OH、h+分别是Fe/Cu-MOF-NH2和Fe/Cu-MOF在催化降解过程中的主要活性物种。以上结果可为探究Fe/Cu-MOF-NH2光催化降解RhB的机制提供参考。Abstract: An amino-modified Fe/Cu-MOF-NH2 was synthesized by solvothermal method for photocatalytic degradation of RhB. And this composite was characterized by XRD, SEM, N2 adsorption-desorption, UV-vis and EA. The effects of RhB initial concentration, catalyst concentration and pH on the photocatalytic degradation of RhB were investigated. The result showed that the visible light response of the catalyst increased greatly after amino modification. When the molar ratio of the amino ligand to the non-amino ligand was 1∶1 during Fe/Cu-MOF-NH2 synthesis, the removal rate of RhB reached 99.53% for 300 mg·L−1 RhB after 4 hours of irradiation at Fe/Cu-MOF-NH2 dosage of 1 mg·mL−1 and pH=4.2. The quenching experiments of active species showed that ·OH and h+ were the main active species in the catalytic degradation of Fe/Cu-MOF-NH2 and Fe/Cu-MOF, respectively. The above results can provide a reference for exploring the mechanism of photocatalytic degradation of RhB by Fe/Cu-MOF-NH2.
-
全球纺织业每年的染料总消耗量超过10 000 t,并且每年约有100 t的染料被排放到自然水体中[1]。染料废水具有色度高、毒性大、成分复杂且难生物降解的特点,对环境和人体都有危害。罗丹明B(RhB)是一种在轻工业中广泛使用的阳离子型染料,具有致癌性。
处理染料废水的常用方法包括物理法、化学法和生物法[2]。近年来,随着新能源的开发与利用,具有绿色环保特征的光催化技术备受人们的关注[3]。光催化降解有机染料被认为是一种清洁高效的染料废水处理方法,该方法能够高效地将多种污染物转化为毒性较小的中间产物,或是将其彻底降解为CO2和H2O,达到无害化处理的要求。
近年来,金属有机框架(MOF)材料在光催化领域受到越来越多的关注[4-7]。MOF材料是一类由金属离子(簇)和有机配体配位而成的杂化材料[8],具有稳定性高[9]、比表面积大、孔隙度高以及结构灵活可调的典型特征[10-12]。MOF材料在异相催化等领域均有优异的表现[13-14],其出众的吸附性能[15]与异相催化潜力为传统的染料废水处理提供了新的解决方案[16]。但是,大多数 MOF材料的宽带隙只能吸收紫外光,而对可见光吸收率低[17],并且纯MOF材料存在光生电子-空穴对复合快的问题[18],导致其光催化活性并不理想。因此,许多研究致力于采用配体修饰[19-20]、掺杂金属[21-22]等方法对MOF材料进行改性,以提升其光催化活性。目前,氨基修饰是增强MOF材料可见光吸收的一种常用方法[23-25]。
本研究评估了氨基修饰Fe/Cu-MOF对RhB的光催化降解性能,考察了非氨基配体/氨基配体的配比、初始条件对催化效果的影响,并基于以上结果提出了氨基修饰Fe/Cu-MOF光催化降解RhB的反应机制,包括光捕获和电子转移路径,以及主要活性物种的生成过程。
1. 材料与方法
1.1 实验原料
氯化铁(FeCl3·6H2O)、对苯二甲酸(H2BDC)、2-氨基对苯二甲酸(NH2-BDC)、对苯醌(BQ)购于上海安耐吉化学有限公司,乙二胺四乙酸二钠(EDTA-2Na)购于上海易恩化学技术有限公司,氯化铜(CuCl2 ·2H2O)、N,N-二甲基甲酰胺(DMF)、异丙醇(IPA)、无水甲醇、无水乙醇、盐酸购于国药集团化学试剂有限公司,氢氧化铵购于天津市百世化工有限公司,罗丹明B购于天津市北联精细化学品公司,纳米磁性氧化铁购于阿拉丁试剂,以上试剂均为分析纯。
1.2 催化剂制备方法
1) Fe-MOF的合成[26-27]。称取10 mmol的FeCl3·6H2O和5 mmol的H2BDC混合溶解于60 mL DMF溶剂,转移至100 mL聚四氟乙烯内衬反应釜中,在110 ℃下反应24 h。反应完成后待自然冷却至室温,产物用DMF和无水甲醇分别洗涤3次,在80 ℃下真空干燥24 h,得到产物Fe-MOF。
2) Fe/Cu-MOF的合成。称取9.5 mmol的FeCl3·6H2O,0.5 mmol的CuCl2 ·2H2O和5 mmol的H2BDC混合溶解于60 mL DMF溶剂,其余步骤同1),得到产物为Fe/Cu-MOF。
3)不同H2BDC/NH2-BDC配比的Fe/Cu-MOF-NH2的合成。采用NH2-BDC部分代替上述H2BDC,其余步骤同2)。控制NH2-BDC的加入量可制得不同摩尔比(0∶1、1∶1、2∶1、3∶1、4∶1)的混合配体Fe/Cu-MOF-NH2。
1.3 催化剂表征方法
通过X射线衍射(XRD,X/Pert PRO MPD,帕纳科分析仪器有限公司,荷兰)对催化剂的晶体结构进行表征;采用扫描电子显微镜(SEM,MIRA 3 LMH,泰思肯有限公司,美国)对催化剂的微观形貌进行分析;光学吸收性质采用紫外可见漫反射光谱仪(DRS,SolidSpec-3700DUV,岛津公司,日本)进行测试;采用精微高博JW-BK100全自动比表面积及孔径分析仪测定目标材料的N2等温吸脱附曲线;使用单点BET和BJH方法计算材料的比表面积、孔体积以及孔径分布;通过元素分析仪(EA, elementar vario EL cube, 德国)对催化剂的元素组成进行分析。
1.4 光催化降解实验方法
取50 mg催化剂,将其分散于50 mL初始质量浓度为300 mg·L−1的RhB溶液中,在暗吸附30 min后开启氙灯,控制电流I为15 A。每隔1 h取样进行离心分离,然后使用紫外-可见分光光度计对离心分离后的上清液进行吸光度测定和光谱扫描。本文中的所有实验均为3次平行实验结果,误差均在5%以内。
2. 结果与讨论
2.1 氨基修饰前后Fe/Cu-MOF的吸附和光催化性能对比
在RhB初始质量浓度为300 mg·L−1,催化剂质量浓度为1 mg·mL−1的条件下,Fe/Cu-MOF和Fe/Cu-MOF-NH2的光催化降解RhB以及暗吸附反应的性能如图1所示。其中,入射光波长采用UV-vis全波段。当RhB的初始质量浓度为300 mg·L−1时,Fe/Cu-MOF 对RhB的吸附去除率仍可达到85%以上,但光照下的去除率无明显提升。这说明Fe/Cu-MOF的光催化活性较弱。而在光照条件下,Fe/Cu-MOF-NH2对RhB的去除率较暗反应条件下有明显提升。在同等光照条件下,商用TiO2对RhB的去除率仅为20.32%,而本研究中制备的Fe/Cu-MOF-NH2对RhB的去除率约为商用TiO2的4.7倍,Fe/Cu-MOF-NH2具有更高的反应速率;在同等条件下,不添加催化剂而仅使用氙灯光源照射并不能引起RhB的降解。Fe/Cu-MOF-NH2对RhB的去除率比Fe/Cu-MOF更高,性能更优良。这表明,氨基的引入能显著提升Fe/Cu-MOF的光催化效率。
2.2 催化剂表征
1)N2吸附-脱附分析。为探究Fe/Cu-MOF-NH2在暗反应下对RhB吸附性能比Fe/Cu-MOF弱的原因,在−196 ℃下测试了2种材料的N2等温吸脱附曲线(图2),比表面积与孔容孔径的数据见表1。表1 的数据说明,Fe/Cu-MOF和Fe/Cu-MOF-NH2均属于介孔材料,引入氨基后BET比表面积大幅降低,孔容积也相对减小,而对应的平均孔径增大。已有研究[28-29]表明,氨基的引入可能会造成材料比表面积和孔容的减小。大孔径孔结构的增加必然会牺牲一部分较小孔径所占的空间,由于含氨基配体的材料在合成过程中可能存在穿插结构或因小分子团簇造成的孔道堵塞,导致孔容明显减小;而BET比表面积的减小则是因为孔隙度的降低或者由于孔道堵塞造成的孔径内比表面积的降低。最明显的影响就是Fe/Cu-MOF- NH2在暗反应下对RhB的吸附效果明显低于Fe/Cu-MOF。
表 1 Fe/Cu-MOF与Fe/Cu-MOF- NH2的比表面积、孔容与孔径Table 1. Specific surface area, pore volume and average pore size of Fe/Cu-MOF and Fe/Cu-MOF-NH2样品 比表面积/(m2·g−1) 孔容/(cm3·g−1) 平均孔径/nm Fe/Cu-MOF 248.3 0.211 3.401 Fe/Cu-MOF-NH2 21.11 0.120 22.805 2) UV-vis分析。图3表明,Fe/Cu-MOF-NH2具有良好的可见光响应活性,在采用全光谱照射或可见光波段照射时,Fe/Cu-MOF-NH2所表现出的光催化活性相近。图4也说明Fe/Cu-MOF-NH2比Fe/Cu-MOF在可见光区域具有更强的吸收能力。
3)SEM分析。图5反映了Fe/Cu-MOF-NH2光催化反应前后的微观形貌。可以看出,材料在反应后微观形貌几乎没有变化,说明其具有良好的稳定性。
4)XRD分析。图6为Fe/Cu-MOF光催化前及Fe/Cu-MOF-NH2光催化反应前后的XRD图谱。其中Fe/Cu-MOF-NH2的主要衍射峰出现的位置在9.0°、10.2°、16.4°,分别对应(100)、(101)、(110)晶面,与文献报道结果[26]一致。此外,Fe/Cu-MOF-NH2光催化反应前后的衍射图谱结构相似,表明其具有良好的稳定性。
5)元素分析。使用元素分析仪测试Fe/Cu-MOF和Fe/Cu-MOF-NH2中各元素的含量(表2)。Fe/Cu-MOF中不含N元素,检测出的微量N元素可能是由于纯化过程中使用DMF进行洗涤时带入的;而Fe/Cu-MOF-NH2中N元素含量明显增加,说明成功引入了氨基。根据已有研究[26]可推测,氨基以自由的非缔合形式存在。
表 2 Fe/Cu-MOF和Fe/Cu-MOF-NH2的元素含量分析Table 2. Elemental analysis of Fe/Cu-MOF and Fe/Cu-MOF-NH2% 样品 N C H Fe/Cu-MOF 1.21 30.67 4.696 Fe/Cu-MOF-NH2 4.02 31.59 5.511 2.3 Cu掺杂对铁基MOF材料稳定性的增强效果
图7(a)反映了放置不同时间后的Fe-MOF和Fe/Cu-MOF对RhB的吸附去除效果。可以看出,Fe/Cu-MOF在自然放置条件下依然保持较好的吸附性能,14 d后对RhB的去除率为82.36%,能达到新制备Fe/Cu-MOF同等条件下对RhB去除率(85.27%)的96%以上。铜离子掺杂后的材料在不采取特殊存放措施(真空密闭环境)下虽然仍存在吸附性能衰减的情况,但可缓解其衰减的进程,Fe/Cu-MOF自身结构的稳定性较Fe-MOF有所增强。图7(b)反映了Fe-MOF和Fe/Cu-MOF多次循环使用过程中吸附性能的变化情况。相较于Fe-MOF,3次循环之后Fe/Cu-MOF对RhB的去除率仍达70%以上,说明其具有良好的稳定性。这是因为:相对于Fe(Ⅲ),金属铜离子的惰性取代[30]增强了Fe/Cu-MOF的稳定性;同时,金属离子的掺杂对MOF表面产生扰动,阻碍了孔隙表面水簇的形成,从而提高MOF的水稳定性[31]。
2.4 初始条件对光催化降解RhB效果的影响
图8(a)和图8(b)分别反映了RhB初始质量浓度和催化剂浓度在Fe/Cu-MOF-NH2光/暗反应4 h后对RhB去除效果的影响。在催化剂质量浓度为1 mg·mL−1时,RhB的初始质量浓度越大,Fe/Cu-MOF-NH2在暗反应下对RhB的去除效果越差,而光反应下的去除效果未受到明显影响。这说明Fe/Cu-MOF-NH2的光催化活性较强。保持RhB初始质量浓度为300 mg·mL−1,当催化剂质量浓度分别为1/3、1/2、1 mg·mL−1时,催化剂质量浓度越高,反应的位点越丰富,同时染料分子与催化剂表面的有效碰撞次数也会增加,因而对RhB的降解率也越高。当RhB初始质量浓度较高时,催化剂质量浓度的降低会使Fe/Cu-MOF-NH2的光反应和暗反应下对RhB的去除率均迅速降低,但单位质量的催化剂对RhB的去除量仍呈上升趋势。这也表明Fe/Cu-MOF-NH2具有较好的催化性能。
图9反映了光照条件下在pH为3.0~11.0内测定的Fe/Cu-MOF-NH2对RhB的去除率(RhB初始质量浓度为300 mg·L−1,催化剂质量浓度为1 mg·mL−1,反应4 h)。结果表明,当pH为5~7时,Fe/Cu-MOF-NH2能保持较好的光催化性能;而当pH为3和11时,Fe/Cu-MOF-NH2对RhB去除效果下降。这是因为:较强的酸性和碱性环境均不利于MOF的稳定存在,并且随着pH的增大,溶液中OH−浓度不断增加,与脱落的金属离子形成沉淀,覆盖于催化剂表面并阻碍了反应的进行[32]。由于RhB溶液的pH稳定在4.2±0.1,且Fe/Cu-MOF-NH2在该pH条件下对RhB具有较高的去除率。因此,后续实验不再调整溶液的pH。
2.5 氨基引入量对去除RhB效果的影响
有研究[33-35]表明,氨基的引入可以实现带隙的灵活控制,混合配体(H2BDC与NH2-BDC共同参与催化剂的合成)与金属中心联接得到的MOF材料会比其中任何一种单一配体参与合成的MOF材料具备更好的光催化性能。因此,可通过改变合成材料时H2BDC与NH2-BDC的摩尔比制备得到含有不同配比混合有机配体的MOF材料,并用以探究非氨基配体/氨基配体的配比对光催化效果的影响。在RhB初始质量浓度为300 mg·L−1、催化剂质量浓度为1 mg·mL−1、pH为4.2的条件下,催化剂光催化降解RhB的结果如图10所示。配体修饰前的Fe/Cu-MOF也具备光催化降解RhB的能力,但活性较弱。氨基的引入能够提升光催化性能,在吸附效果弱于Fe/Cu-MOF的前提下,Fe/Cu-MOF-NH2光催化降解RhB的去除率仍然明显高于Fe/Cu-MOF。当H2BDC∶NH2-BDC的摩尔比为1∶1时催化剂对RhB的去除率更高。
此外,引入氨基后的所有样品在暗反应下的吸附性能均有不同程度的降低,其中纯NH2-BDC配体合成的样品吸附效果最弱。导致此结果的可能原因是,由于形成了更大孔径的孔,从而牺牲了部分小孔和整体孔隙度,在材料合成过程中出现的穿插结构或者小分子团簇造成的孔道堵塞均会使孔容积减小,因此,导致Fe/Cu-MOF-NH2在暗反应下对RhB的吸附效果明显低于Fe/Cu-MOF。
2.6 光催化活性机理
1)煅烧温度的影响。以H2BDC∶BDC-NH2=1∶1(摩尔比)的混合配体材料为原始材料,在空气氛下对材料在200 ℃或300 ℃下煅烧后,测试其光催化降解性能。如表3所示,N2吸脱附等温线测试结果表明BET比表面积显著降低。图11也表明,材料在暗反应下的吸附性能显著降低,而光催化活性受到的影响相对较小。这是因为:框架结构坍塌对材料的光响应活性中心Fe-O簇的破坏较小,高温煅烧后,材料生成金属氧化物Fe2O3,仍存在部分Fe-O中心。配体改变了Fe-O簇与连接体形成网状结构的孔径大小以及比表面积大小,从而影响了材料在暗反应下对RhB的吸附性能。另外,相比于同等剂量的商用磁性氧化铁,MOF材料表现出更好的光催化活性。这说明配体发挥了良好的传递电子的作用。
表 3 不同温度下煅烧的Fe/Cu-MOF-NH2的比表面积、孔容与孔径Table 3. Specific surface area, pore volume and average pore size of Fe/Cu-MOF-NH2 calcined at different temperatures样品 比表面积/(m2·g−1) 孔容/(cm3·g−1) 孔径/nm Fe/Cu-MOF-NH2 21.11 0.120 22.805 Fe/Cu-MOF-NH2-200 ℃ 18.369 0.091 23.373 Fe/Cu-MOF-NH2-300 ℃ 15.626 0.114 24.898 2)活性物种检测。在光催化反应中,半导体受到入射光子激发产生的e-和h+通常并不直接参与反应,而是先与吸附在催化剂表面的基态分子结合,形成新的中间活性物种(·O2-、·OH等),此类高活性物种更易与目标污染物发生氧化或还原反应,从而降解去除目标污染物。为探究光催化降解RhB反应过程中的作用机制,本研究进行了Fe/Cu-MOF和 Fe/Cu-MOF-NH2在光催化反应过程中主要活性物质的淬灭实验,采用EDTA、异丙醇(IPA)、对苯醌(BQ)分别作为h+、·OH、·O2-的淬灭剂,结果如图12所示。
图12反映了添加EDTA-2Na、IPA、BQ以及空白对照组在0.5 h暗吸附和4 h光反应后对RhB的去除效果。可以看出,对于Fe/Cu-MOF,淬灭剂IPA和BQ的添加对Fe/Cu-MOF在光反应下的活性几乎没有影响。这说明对应的·O2-、·OH不是Fe/Cu-MOF光催化降解RhB的主要活性物种。而EDTA-2Na的添加虽然对前期暗吸附没有造成显著影响,但后期RhB的去除率反而呈现下降的趋势,EDTA-2Na在光反应中起到了明显的抑制和破坏作用,导致先前吸附在Fe/Cu-MOF表面的染料分子脱附下来。这说明h+是Fe/Cu-MOF光催化降解RhB的主要活性物种。相比之下,RhB的氧化还原电位(1.3 V)低于Fe-MOF的VB电位[36],因此,h+氧化RhB在热力学上是完全可行的。而对于Fe/Cu-MOF- NH2,添加EDTA-2Na与IPA后光催化效果均降低,其中添加IPA对光反应的抑制更明显,说明·OH是主要活性物种。光催化反应中·OH一般来源于水中的吸附氧与水分子在氧化性物质下的共同作用。配位不饱和的铁离子作为极强的路易斯酸则很可能成为该催化反应过程的活性位点[37-38]。进一步进行除O2与添加H2O2的试验结果如图13所示。
通过抽除反应体系的溶解氧之后,Fe/Cu-MOF- NH2在光反应下对RhB的去除率明显降低;另外,H2O2的加入加快了RhB的光催化降解,对反应过程起到促进作用。在一种常见的催化氧化反应体系——芬顿反应中,H2O2通过与Fe(Ⅱ)发生一系列氧化还原反应生成具有高氧化性的·OH,进而完成目标物质的氧化转化。从本实验结果来看,H2O2促进了·OH的产生从而加速RhB的降解,而O2参与了·OH的生成。
图14反映了Fe/Cu-MOF与Fe/Cu-MOF- NH2在RhB初始质量浓度为300 mg·L−1,催化剂质量浓度为1 mg·mL−1,pH为4.2的条件下进行光催化降解RhB实验后剩余溶液的紫外-可见吸收光谱。RhB的特征吸收波长在554 nm,是由助色团中的孤对电子向反键轨道发生的n-π*跃迁引起的;另一个主要的吸收峰则为共轭结构中电子跃迁所致的350 nm处[39]。Fe/Cu-MOF的暗吸附反应以及Fe/Cu-MOF-NH2的光、暗反应的扫描曲线形状均与未参与反应的初始RhB溶液一致,仅有Fe/Cu-MOF的光催化反应后的溶液中出现了新的吸收峰。无氨基修饰的样品加入异丙醇后光催化活性没有受到明显抑制,说明主要活性物种不是·OH。降解后的溶液呈现淡黄色,说明单纯BDC配体合成的Fe/Cu-MOF不能实现RhB的完全氧化,而是产生了某种中间产物。
2.7 Fe/Cu-MOF- NH2光催化氧化RhB的机理模型
Fe金属中心的MOF材料还有一个重要的特性在于Fe的变价性,类似的还有Ti,可以在Ti3+与Ti4+之间进行转换,这一性质非常有利于光电子的传输与转移。基于上述结果,提出Fe/Cu-MOF-NH2光催化降解RhB的机理模型,如图15所示。RhB与MOF中的路易斯酸位结合,即使在没有氨基的情况下也具有一定的光催化活性。在Fe/Cu-MOF-NH2中存在2种光响应中心,Fe-O簇构成的结构单元具有类金属氧化物半导体的性质,主要由O2p轨道构成的价带中的电子受光子能量激发,跃迁至导带,电子由O2-向Fe3+发生转移(FeⅢ→FeⅡ),生成的二价铁在水分子与水中溶解氧的共同作用下产生·OH。·OH具有的超高氧化还原电位可以破坏染料的生色基团,进而彻底降解染料分子。Fe-O中心是Fe/Cu-MOF-NH2光催化氧化RhB的主要活性中心。同时,氨基的引入也能提供一种新的电子转移通道。氨基受激发产生电子由配体转移至金属中心。氨基基团一旦引入配位体,其提供的孤对电子与苯环π*轨道相互作用,增加反键轨道电子密度[25],这种相互作用可以形成更高的最高占据分子轨道(HOMO)能级,使吸收边拓展至可见光区域。因此,氨基的引入加速了催化过程。
3. 结论
1)氨基的引入显著提升了催化剂的光催化性能。当前驱体中H2BDC∶BDC-NH2(摩尔比)为1∶1时,材料能够在保持较好吸附性能的同时达到最佳光催化活性,并在RhB初始质量浓度为300 mg·L−1,催化剂质量浓度为1 mg·L−1,pH为4.2时,反应4 h内对RhB的去除率达到99.53%。
2)氨基的引入一方面使得光吸收发生红移,另一方面促进了电子由配体转向金属中心的电荷转移机制(LMCT),从而提升了Fe/Cu-MOF-NH2的可见光催化性能。
3) Fe-O簇是Fe/Cu-MOF-NH2光催化降解RhB的主要活性中心,·OH与h+分别是 Fe/Cu-MOF-NH2与Fe/Cu-MOF在光催化过程中主要活性物种。
4) Fe/Cu-MOF-NH2光催化降解RhB的可能机制为:当受到光激发时,氨基向Fe-O簇注入电子,同时Fe-O簇中电子也会由O2p轨道跃迁至Fe的3d电子轨道;Fe(Ⅲ)接受电子转变为Fe(Ⅱ),活化氧气产生具有超高氧化还原电位的·OH,从而达到降解染料分子的目的。
-
表 1 Fe/Cu-MOF与Fe/Cu-MOF- NH2的比表面积、孔容与孔径
Table 1. Specific surface area, pore volume and average pore size of Fe/Cu-MOF and Fe/Cu-MOF-NH2
样品 比表面积/(m2·g−1) 孔容/(cm3·g−1) 平均孔径/nm Fe/Cu-MOF 248.3 0.211 3.401 Fe/Cu-MOF-NH2 21.11 0.120 22.805 表 2 Fe/Cu-MOF和Fe/Cu-MOF-NH2的元素含量分析
Table 2. Elemental analysis of Fe/Cu-MOF and Fe/Cu-MOF-NH2
% 样品 N C H Fe/Cu-MOF 1.21 30.67 4.696 Fe/Cu-MOF-NH2 4.02 31.59 5.511 表 3 不同温度下煅烧的Fe/Cu-MOF-NH2的比表面积、孔容与孔径
Table 3. Specific surface area, pore volume and average pore size of Fe/Cu-MOF-NH2 calcined at different temperatures
样品 比表面积/(m2·g−1) 孔容/(cm3·g−1) 孔径/nm Fe/Cu-MOF-NH2 21.11 0.120 22.805 Fe/Cu-MOF-NH2-200 ℃ 18.369 0.091 23.373 Fe/Cu-MOF-NH2-300 ℃ 15.626 0.114 24.898 -
[1] YAGUB M T, SEN T K, ANG H M. Equilibrium, kinetics, and thermodynamics of methylene blue adsorption by pine tree leaves[J]. Water, Air, & Soil Pollution, 2012, 223(8): 5267-5282. [2] 任南琪, 周显娇, 郭婉茜, 等. 染料废水处理技术研究进展[J]. 化工学报, 2013, 64(1): 84-94. doi: 10.3969/j.issn.0438-1157.2013.01.011 [3] WU T, LIU X, LIU Y, et al. Application of QD-MOF composites for photocatalysis: Energy production and environmental remediation[J]. Coordination Chemistry Reviews, 2020, 403: 213097. doi: 10.1016/j.ccr.2019.213097 [4] YAN D Y, HU H, GAO N Y, et al. Fabrication of carbon nanotube functionalized MIL-101(Fe) for enhanced visible-light photocatalysis of ciprofloxacin in aqueous solution[J]. Applied Surface Science, 2019, 498: 143836. doi: 10.1016/j.apsusc.2019.143836 [5] MEI W D, SONG H, TIAN Z Y, et al. Efficient photo-Fenton like activity in modified MIL-53(Fe) for removal of pesticides: Regulation of photogenerated electron migration[J]. Materials Research Bulletin, 2019, 119: 110570. doi: 10.1016/j.materresbull.2019.110570 [6] WANG Q, GAO Q, AL-ENIZI A M, et al. Recent advances in MOF-based photocatalysis: Environmental remediation under visible light[J]. Inorganic Chemistry Frontiers, 2020: 7. [7] CVR A, KRR B, VVNH A, et al. Metal-organic frameworks (MOFs)-based efficient heterogeneous photocatalysts: Synthesis, properties and its applications in photocatalytic hydrogen generation, CO2 reduction and photodegradation of organic dyes[J]. International Journal of Hydrogen Energy, 2020, 45(13): 7656-7679. doi: 10.1016/j.ijhydene.2019.02.144 [8] LI B, MA J G, CHENG P. Integration of metal nanoparticles into metal-organic frameworks for composite catalysts: Design and synthetic strategy[J]. Small, 2019, 15(32): 1804849. doi: 10.1002/smll.201804849 [9] YUAN S, FENG L, WANG K, et al. Stable metal-organic frameworks: Design, synthesis, and applications[J]. Advanced Materials, 2018, 30(37): 1704303. doi: 10.1002/adma.201704303 [10] LI Y, XIA Y, LIU K L, et al. Constructing Fe-MOF-Derived Z-Scheme photocatalysts with enhanced charge transport: Nanointerface and carbon sheath synergistic effect[J]. ACS Applied Materials And Interfaces, 2020, 12(22): 25494-25502. doi: 10.1021/acsami.0c06601 [11] HUANG C W, NGUYEN V H, ZHOU S R, et al. Metal–organic frameworks: Preparation and applications in highly efficient heterogeneous photocatalysis[J]. Sustainable Energy & Fuels, 2020: 4. [12] WANG Y C, LIU X Y, WANG X X, et al. Metal-organic frameworks based photocatalysts: Architecture strategies for efficient solar energy conversion[J]. Chemical Engineering Journal, 2021, 419(16): 129459. [13] DING M, CAI X, JIANG H L. Improving MOF stability: Approaches and applications[J]. Chemical Science, 2019, 10(44): 10209-10230. doi: 10.1039/C9SC03916C [14] 周锋, 任向红, 刘建友, 等. 光催化降解水体有机污染物的研究进展[J]. 材料工程, 2018, 46(10): 9-19. doi: 10.11868/j.issn.1001-4381.2017.000972 [15] ZHANG W, ZHANG R Z, HUANG Y Q, et al. Effect of the synergetic interplay between the electrostatic interactions, size of the dye molecules, and adsorption sites of MIL-101(Cr) on the adsorption of organic dyes from aqueous solutions[J]. Crystal Growth & Design, 2018, 18(12): 7533-7540. [16] GAUTAM S, ARAWAL H, THAKUR M, et al. Metal oxides and metal organic frameworks for the photocatalytic degradation: A review[J]. Journal of Environmental Chemical Engineering, 2020, 8(3): 103726. doi: 10.1016/j.jece.2020.103726 [17] GUO J, WAN Y, ZHU Y, et al. Advanced photocatalysts based on metal nanoparticle/metalorganic framework composites[J]. 纳米研究:英文版, 2021, 14(7): 16. [18] JIANG H L, SUN K, LIU M, et al. Incorporating transition metal phosphides into Metal‐organic frameworks for enhanced photocatalysis[J]. Angewandte Chemie International Edition, 2020, 132(50):22937-22943. [19] LIANG R W, HUANG R K, WANG X X, et al. Functionalized MIL-68(In) for the photocatalytic treatment of Cr(VI)-containing simulation wastewater: Electronic effects of ligand substitution[J]. Applied Surface Science, 2019, 464(15):396-403. [20] HUANG H, WANG X S, PHILO D, et al. Toward visible-light-assisted photocatalytic nitrogen fixation: A titanium metal organic framework with functionalized ligands[J]. Applied Catalysis B:Environmental, 2020, 267: 118686. doi: 10.1016/j.apcatb.2020.118686 [21] WU X P, GAGLIARDI L, TRUHLAR D G. Metal doping in cerium metal-organic frameworks for visible-response water splitting photocatalysts[J]. Journal of Chemical Physics, 2019, 150(4): 041701. doi: 10.1063/1.5043538 [22] XUE D, YLA B, GR A, et al. Catalytic degradation of methylene blue by Fenton-like oxidation of Ce-doped MOF - ScienceDirect[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2020: 608. [23] WANG D K, HUANG R K, LIU W J, et al. Fe-based MOFs for photocatalytic CO2 reduction: Role of coordination unsaturated sites and dual excitation pathways[J]. ACS Catalysis, 2014, 4(12): 4254-4260. doi: 10.1021/cs501169t [24] XIONG L S, LI S S, ZHEN W H, et al. Effects of electron-donating groups on the photocatalytic reaction of MOFs[J]. Catalysis Science & Technology, 2018, 8: 1696-1703. [25] NASALEVICH M A, VAN DER VEEN M, KAPTEIJN F, et al. Metal-organic frameworks as heterogeneous photocatalysts: Advantages and challenges[J]. CrystEngComm, 2014, 16(23): 4919. doi: 10.1039/C4CE00032C [26] BARBOSA A D S, JULIÃO D, FERNANDES D M, et al. Catalytic performance and electrochemical behaviour of metal-organic frameworks: MIL-101(Fe) versus NH2-MIL-101(Fe)[J]. Polyhedron, 2017, 127: 464-470. doi: 10.1016/j.poly.2016.10.032 [27] ČENDAK T, ŽUNKOVIČ E, GODEC T U, et al. Indomethacin embedded into MIL-101 frameworks: A solid-state NMR study[J]. Journal of Physical Chemistry C, 2014, 118(12): 6140-6150. doi: 10.1021/jp412566p [28] 王茀学, 王崇臣, 王鹏, 等. UiO系列金属-有机骨架的合成方法与应用[J]. 无机化学学报, 2017, 33(5): 713-737. doi: 10.11862/CJIC.2017.105 [29] NASALEVICH M A, GOESTEN M G, SAVENIJE T J, et al. Enhancing optical absorption of metal-organic frameworks for improved visible light photocatalysis[J]. Chemistry Communication, 2013, 49(90): 10575-10577. doi: 10.1039/C3CC46398B [30] DEVIC T, SERRE C. High valence 3p and transition metal based MOFs[J]. Chemical Society Reviews, 2014, 43(16): 6097-6115. doi: 10.1039/C4CS00081A [31] Zhu X W, Zhou X P, Li D. Exceptionally water stable heterometallic gyroidal MOFs: Tuning the porosity and hydrophobicity by doping metal ions[J]. Chemical Communications, 2016, 52(39): 6513-6516. doi: 10.1039/C6CC02116F [32] KHATAEE A, GHOLAMI P, SHAYDAEI M, et al. Preparation of nanostructured pyrite with N2 glow discharge plasma and the study of its catalytic performance in the heterogeneous Fenton process[J]. New Journal of Chemistry, 2016: 10.1039. C5NJ03594E. [33] HENDON C H, TIANA D, FONTECAVE M, et al. Engineering the optical response of the titanium-MIL-125 metal-organic framework through ligand functionalization[J]. Journal of the American Chemical Society, 2013, 135(30): 10942-10945. doi: 10.1021/ja405350u [34] GOMES SILVA C, LUZ I, LLABRÉS I XAMENA F X, et al. Water stable Zr-benzenedicarboxylate metal-organic frameworks as photocatalysts for hydrogen generation[J]. Chemistry, 2010, 16(36): 11133-11138. doi: 10.1002/chem.200903526 [35] GOESTEN M G, KAPTEIJN F, GASCON J. Fascinating chemistry or frustrating unpredictability: Observations in crystal engineering of metal–organic frameworks[J]. CrystEngComm, 2013, 15(45): 9249. doi: 10.1039/c3ce41241e [36] ARAYA T, CHEN C C, JIA M K, et al. Selective degradation of organic dyes by a resin modified Fe-based metal-organic framework under visible light irradiation[J]. Optical Materials, 2017, 64: 512-523. doi: 10.1016/j.optmat.2016.11.047 [37] 谢雯静, 袁松虎. 二价铁形态对沉积物活化氧气产生羟自由基氧化效应的影响[C] . 中国矿物岩石地球化学学会学术年会, 2019: 761. [38] PAN S, WANG S, ZHANG Y, et al. Surface Fe3+-decorated pristine SnO2 nanoparticles with enhanced ·OH radical generation performance[J]. Catalysis Communications, 2012, 24: 96-99. doi: 10.1016/j.catcom.2012.03.034 [39] HOU M F, LIAO L, ZHANG W D, et al. Degradation of rhodamine B by Fe(0)-based fenton process with H2O2[J]. Chemosphere, 2011, 83(9): 1279-1283. doi: 10.1016/j.chemosphere.2011.03.005 -






 下载:
下载: