-
已有研究[1-2]表明,生活污水中包含一定量的潜在致病微生物(大肠埃希氏菌、沙门氏菌、志贺氏菌等)。因此,在污水处理系统末端需增加消毒,处理达标之后方可排放。近2年,随着新冠疫情的全球肆虐,不同层面的生物安全问题受到了广泛关注。我国于2021年4月15日起全面实施《生物安全法》,标志着我国生物安全问题进入了依法治理的新阶段[3]。目前,我国现行城市污水生物处理过程中已全部覆盖消毒工艺。但是,对于卫生设施相对薄弱的农村地区,污水中潜在致病微生物的分布、相应污水处理设施的消毒效果等仍存在认识不清、运维不稳等问题,从而对农村地区居民身体健康及区域生态安全造成了极大的潜在风险。
截至2020年,全国共有约5.1亿农村人口,占全国总人口的36%,生活污水排放量很大,而目前针对已有农村污水处理设施的监测重点仍然为COD、NH3-N、TP等基础水质排放控制指标[4-5]。农村生活污水主要来源于厨房污水、生活洗涤污水和冲厕水等,其具有分散性强、水质水量变化大等特点;同时,我国农村区域相对城市而言,经济水平比较低。因此,成本低廉、高度集成、占地面积较小、施工工程量小、运行维护简便的小型化、装备化污水处理设施在农村地区得到广泛应用,净化槽即是其中一种[6-10]。基于其在单户或联用处理中的优势,目前净化槽已经在上海、江苏、云南、山东、黑龙江等地多数农村投入实际使用[11]。调研发现,目前市场上销售的净化槽在工艺单元是配有消毒设施的。但在实际运用中,由于消毒工艺投入成本高,投入的化学消毒试剂如次氯酸钠等在维护不当时可能会造成泄露而引起二次污染,因此,大部分农村地区一体化污水处理设备的消毒设施处于闲置状态,农村污水处理后,未经消毒就直接排放[10]。基于以上研究现状,本研究选取江苏省常熟市虞山街道(N 120°40′48″,E 31°40′48″)处理量为1 m3·d−1的一体化污水处理设施,解析不同工段潜在致病微生物的分布特征,为后续村镇小型污水处理设施运行过程中的健康风险评估研究提供参考。
-
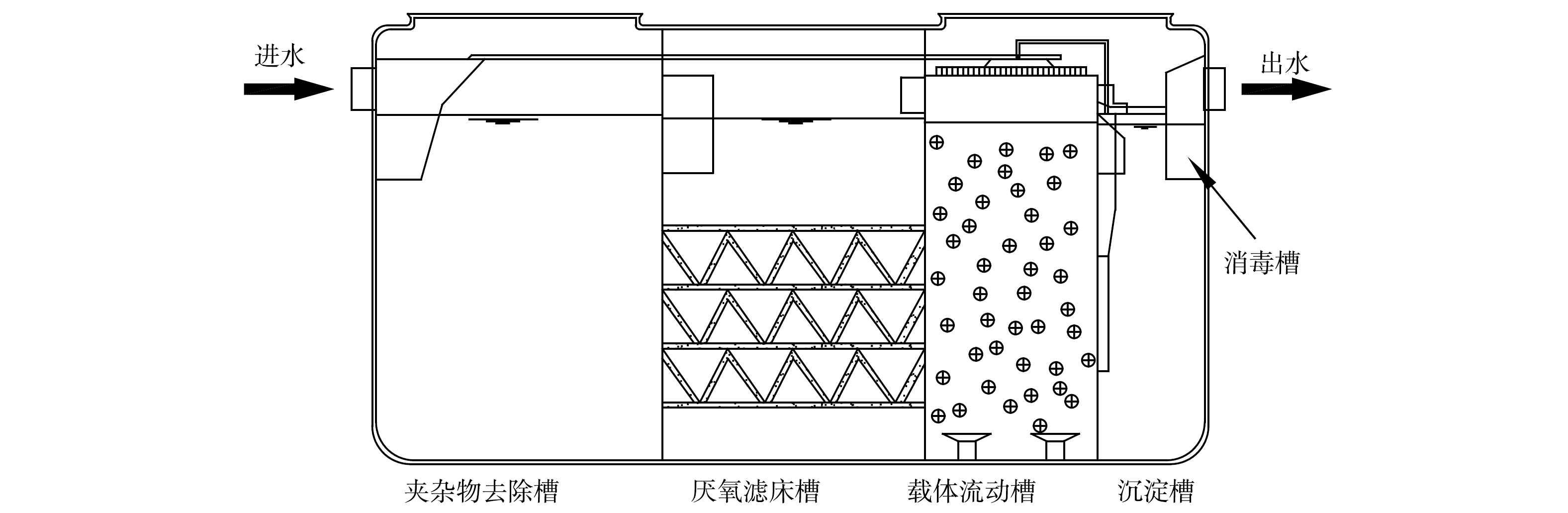
本研究选择江苏省常熟市虞山街道(N 120°4′48″,E 31°40′48″)处理量为1 m3·d−1的一体化污水净化槽(HJA-10,江苏中车环保设备有限公司;长×宽×高=2 190 mm×1 120 mm×1 550 mm)进行研究。净化槽采用A/O处理工艺,主要由夹杂物去除槽-厌氧滤床槽-载体流动槽-沉淀槽-消毒槽处理单元组成(图1)。其中厌氧滤床槽采用PE滤料,载体流动槽即为加有曝气设施和圆球状填料的生物处理单元,消毒槽设定为添加三氯异氰尿酸消毒剂消毒。该村现有农户370多户,共计1 500余人,其中青年人(非假期外出务工、上学等)和老年人(长期在当地居住)的占比分别为60%和40%。净化槽主要收集处理村民家中排放的生活污水(厨房洗涤废水、洗漱用水、马桶废水等),实际运行时,槽中污水依次经过夹杂物去除槽、厌氧滤床槽、载体流动槽和沉淀槽,载体流动槽出水处设有回流管,向夹杂物去除槽回流。
-
样品按照《水质采样技术指导》( HJ 494-2009 ) 和《水质采样样品的保存和管理技术规定》( HJ 493-2009 ) 要求[12-13],分别从净化槽进水口(A1)、夹杂物去除槽(A2)、厌氧滤床槽(A3)、载体流动槽(A4)、沉淀槽(A5)、出水口处(A6)、出水受纳水体(A7),各采集1 L水样。采样容器材质为聚乙烯,容器采样前均进行灭菌处理,以满足采样需要。水样分别采集于夹杂物去除槽液面下0.8 m,厌氧滤床槽、载体流动槽、沉淀槽液面下0.3 m。各处理单元所采样品分成2份:1份于4 ℃保存,用于理化指标测定;另1份存于−20 ℃,用于微生物多样性分析。
-
采用重铬酸钾法(HJ 828-2017)测定COD值[14];采用纳氏试剂分光光度法(HJ 535-2009)测定NH3-N浓度[15];采用哈希法测定TN浓度;采用重量法(GB 11901-1989)测定SS浓度[16]。
-
利用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对 16S rRNA基因V3~V4 可变区进行 PCR 扩增[17-18],产物纯化定量后通过Illumina Miseq平台进行测序。使用UPARSE软件,根据97%的相似度对序列进行聚类并剔除嵌合体,然后利用RDP classifier对每条序列进行物种分类注释,比对数据库,设置比对阈值为70%,最终生成操作分类单元(operational taxonomic unit,OTU) [19-21]。利用mothur进行微生物群落的α多样性分析,计算参数分别为Ace、Chao1、Shannon和Simpson指数。Ace和Chao1指数反映微生物种群丰度,其值越高表明微生物丰度越高;Shannon和Simpson指数反映微生物种群多样性,高Shannon指数和低Simpson指数代表高多样性,其数值受样品群落中丰度和物种均匀度的影响[22]。多样性指数根据式(1)~式(3)计算[23]。
式中:SChao1表示估计的OTU数;Sobs表示实际测得OTU数;n1表示只含1条序列的OTU数;n2表示只含2条序列的OTU数。
式中:Sobs表示实际测得OTU数;ni表示第i个OTU所含序列数;N表示所有序列数。
式中:Sobs表示实际测得OTU数;ni表示第i个OTU所含序列数;N表示所有序列数。
-
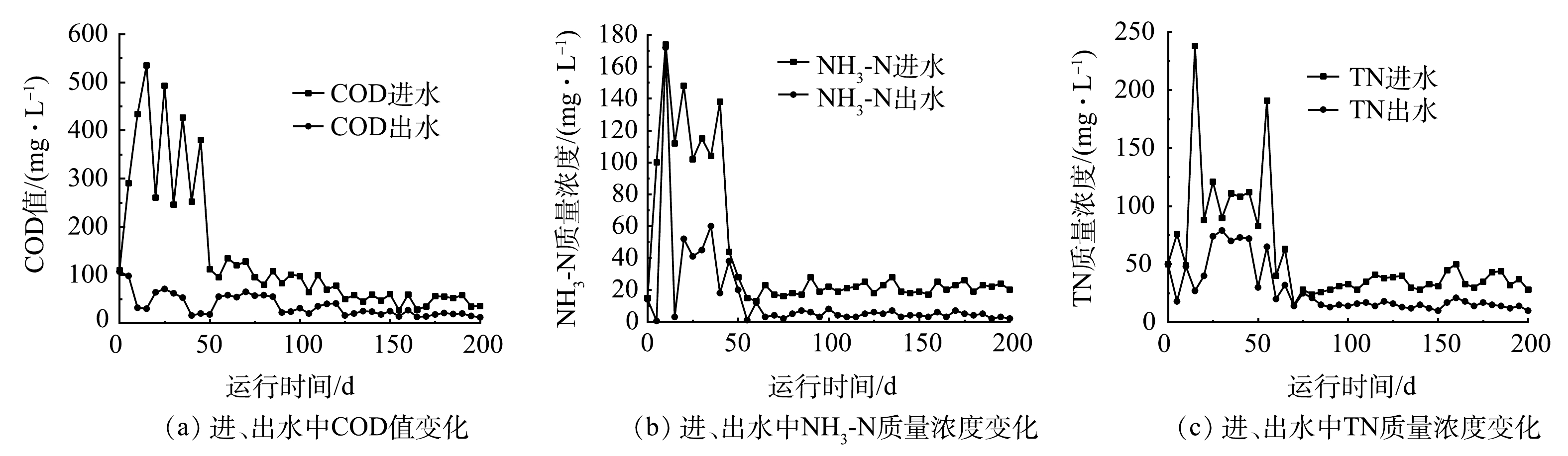
对首次投入使用的一体化污水净化槽进行长期连续进出水水质监测,时间为200 d。结果如图2所示。运行期内,设备进水中COD值为27~537 mg·L−1,NH3-N和TN的质量浓度分别为13~174 mg·L−1和15~238 mg·L−1。50 d内,设备运行处于启动状态,COD去除效果较好, NH3-N和TN去除波动较大。随着设备的运行,在50 d后,其出水COD值稳定在(35.5±22.5) mg·L−1,NH3-N和TN的质量浓度稳定在(5±3) mg·L−1和(22±10) mg·L−1,表明该设备出水水质达到了《农村生活污水处理设施水污染物排放标准》(DB 32/ 3462-2020)[24]。
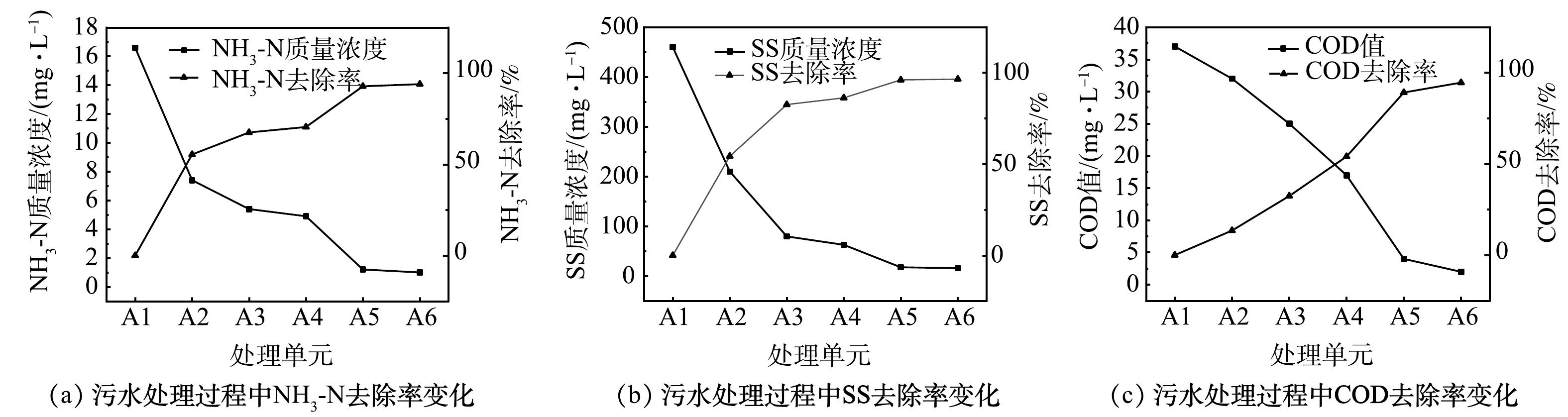
在装置运行约100 d后,考察不同工段污水中NH3-N、SS质量浓度和COD值的沿程变化,结果如图3所示。沿设备运行工段流程,NH3-N、SS质量浓度和COD值均呈逐步下降趋势,NH3-N在A2、A3、A4、A5、A6单元的去除率分别为55.42%、67.47%、70.48%、92.77%、93.98%;SS在A2、A3、A4、A5、A6单元的去除率分别为54.35%、82.61%、86.30%、96.09%、96.52%;COD在A2、A3、A4、A5、A6单元的去除率分别为13.50%、32.43%、54.46%、89.19%、94.59%。以上结果表明,该设备处于长期稳定运行状态,并且不同处理单元对污染物的去除率有所不同。
-
采用高通量测序分别对不同处理单元中样本进行了细菌多样性分析,其中Ace和Chao1指数用来表征不同处理单元微生物种群丰度,Shannon和Simpson指数用来表征微生物种群多样性,具体结果如表1所示。由表1可以看出,A3单元Chao1和Ace值最高,分别为2 404.32和2 396.72;Shannon指数最高、Simpson指数最低,分别为5.49和0.01。在该设备中,A3单元中细菌不仅丰度最高,而且多样性也是最高的。这可能与本设备中污水的流程有密切的关系,污水经夹杂物去除槽后,首先进入厌氧滤床槽。因此,该单元有机物更为丰富,异养微生物快速繁殖,从而导致该单元细菌种类及丰度均相对较高。这一结果与前人研究结果存在一定的差异。黄潇等[22]发现,当采用多级A/O工艺处理城市污水时,最高的Shannon和Simpson指数出现在第2好氧区,这可能与工艺流程和污水来源的差异有关。
-
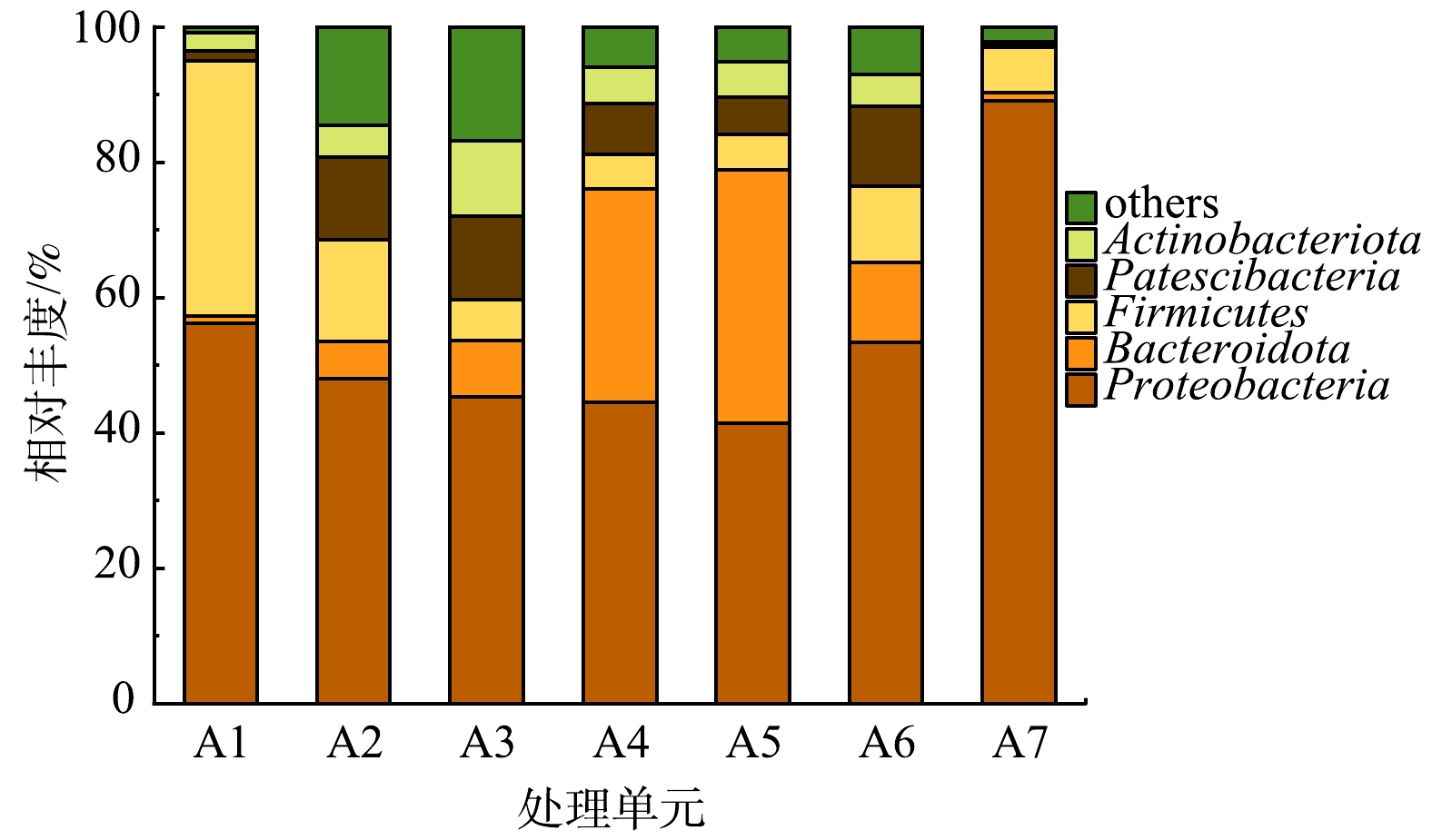
进一步分析受纳水体和设备运行稳定状态下不同单元中细菌种群结构特征,其差异如图4所示。在门水平上,进水中Proteobacteria和Firmicutes是优势菌门,其相对丰度分别为56.21%和37.65%。随着污水流经各处理单元,这2个菌门虽然仍然处于优势地位,但其相对丰度却逐步下降。由图4可见,由A2到A5,Proteobacteria相对丰度分别为48.00%、45.33%、44.58%和41.47%。Proteobacteria在各单元中检测片段数基本不变,在A2~A5单元相对丰度降低是由于各单元其他菌门种类和丰度的增加。由A2到A5,Firmicutes相对丰度分别为15.04%、6.14%、5.21%和5.27%。A2单元Firmicutes相对丰度下降主要是由其门下Chryseomicrobium属相对丰度急降所导致;在A3~A5单元,Firmicutes所测片段数基本不变,其相对丰度变小是由各单元其他菌门种类和丰度的增加所导致。在出水中,检测到的细菌总片段变少,导致Proteobacteria相对丰度增高,此时Firmicutes门下梭菌纲丰度上升是导致Firmicutes相对丰度上升的主要原因,梭菌纲适合在氧气浓度相对较低的出水中繁殖。同时,图4中的结果也表明,进水中Bacteroidota相对丰度较低,为1.08%,但在各单元中Bacteroidota相对丰度呈现逐步升高趋势,尤其是在A4和A5单元,其相对丰度分别可达31.43%和37.42%,这与已有研究结果基本一致 [25-26]。Bacteroidota相对丰度变化主要由其门下Flavobacterium属相对丰度变化引起,Flavobacterium是一种好氧反硝化细菌,适合在含氮物质和氧气含量充足的环境中生存。 本研究中,净化槽消毒单元处于关闭状态,因此,出水中检出的细菌多样性也较高,Proteobacteria仍是优势菌门,其相对丰度为53.41%,Firmicutes、Bacteroidota、Patescibacteria、Actinobacteriota的相对丰度也分别达到了11.31%、11.73%、11.86%、4.68%。与净化槽出水相似,排水口处受纳水体中Proteobacteria也是优势菌门,相对丰度为89.09%,且Patescibacteria、Actinobacteriota相对丰度则显著降低,这可能是由受纳水体中微生物相互作用导致的。
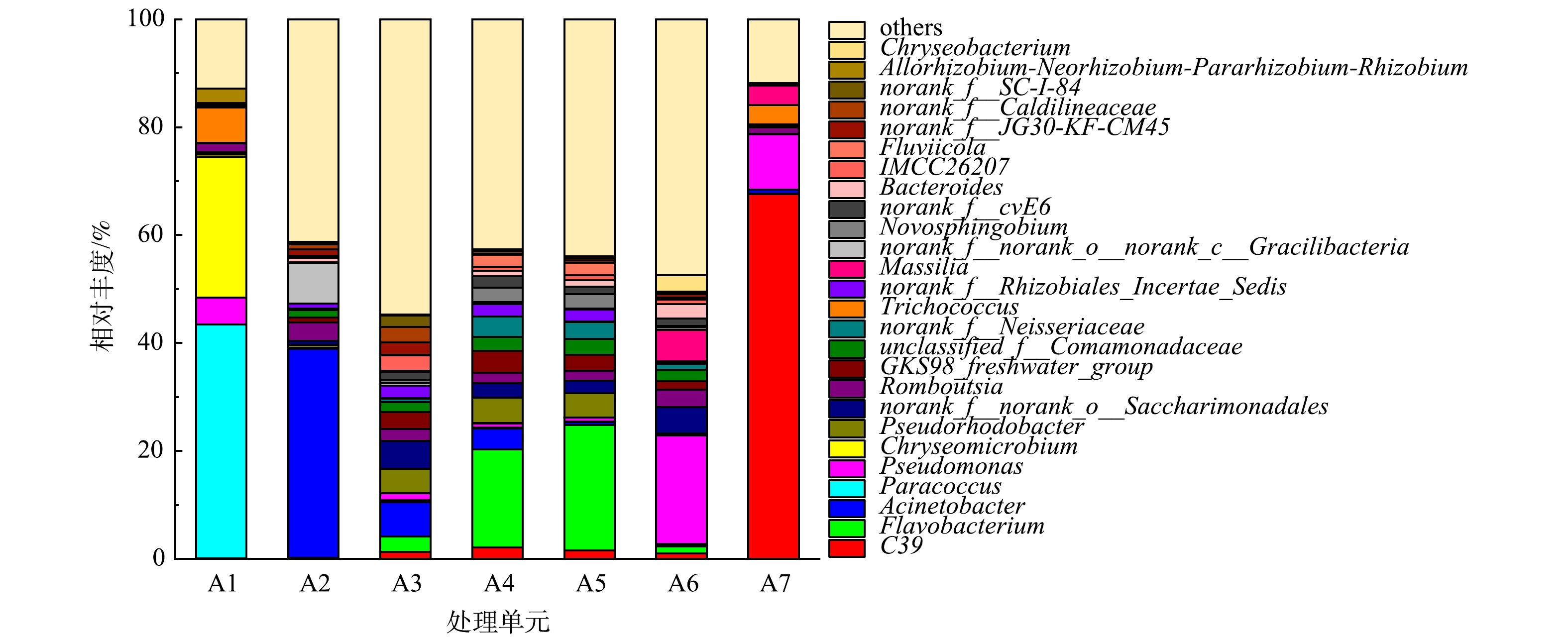
为了更加准确地反映净化槽不同单元和受纳水体中细菌的组成,对所选样本中细菌种群特征进行了属水平上的分析。结果如图5所示,进水中细菌种群相对简单,其中优势菌属为Paracoccus(43.31%)、Chryseomicrobium(26.00%)、Trichococcus(6.60%)和Pseudomonas(5.00%)。同样在有夹杂物的去除槽内,其细菌种群相对也较为简单,不同之处在于其优势菌属发生了明显变化,分别为Acinetobacter(38.70%)、norank_f__norank_o__norank_c__Gracilibacteria(7.54%)和Romboutsia(3.48%)。其原因可能是,在物理去除污水中较大颗粒物的同时,附着在颗粒物上的细菌也一并被去除,从而导致其优势菌属种类发生了变化。与其形成明显对比的是,A3、A4、A5单元中细菌菌属多样性明显增加,并且该3个单元中细菌相似性明显升高。除无法鉴定种类的others之外,A3单元中主要细菌菌属分别为Acinetobacter(6.38%)、norank_f__norank_o__Saccharimonadales(5.11%)、Pseudorhodobacter(4.52%)、Flavobacterium(2.85%)、Pseudomonas(1.29%)等。在A4、A5单元里,这些细菌菌属种类并未发生明显变化,但其相对丰度呈现一定差异。在A3、A4、A5单元中,Flavobacterium相对丰度呈现逐步上升趋势,分别为2.85%、18.12%、23.19%。Flavobacterium是活性污泥工艺的常见的好氧反硝化菌[27],适合在含氮物质和氧气含量充足的A4、A5单元中生存,A3单元的厌氧环境并不适合其生存。在A3、A4、A5单元中,Acinetobacter相对丰度呈现逐步下降趋势,分别为6.38%、3.95%、0.57%。Acinetobacter是水处理过程中常见的异养硝化-好氧反硝化细菌[28],所以在有机物质量浓度相对较低的A4、A5单元中并不利于其生长,导致其相对丰度下降。在A3、A4、A5单元中,Pseudomonas相对丰度呈现逐步下降趋势,分别为1.29%、0.83%、0.72%。有研究[29]表明,在人工湿地等脱氮除磷工艺中发现了参与有机物去除的Pseudomonas,因此,对于有机物质量浓度相对较低的A4、A5单元,Pseudomonas相对丰度可能会有所下降。与出水相比,受纳水体细菌组成出现显著变化,其中C39和Pseudomonas为主要的优势菌属,相对丰度分别为67.61%、10.21%,二者总相对丰度超过75%。
-
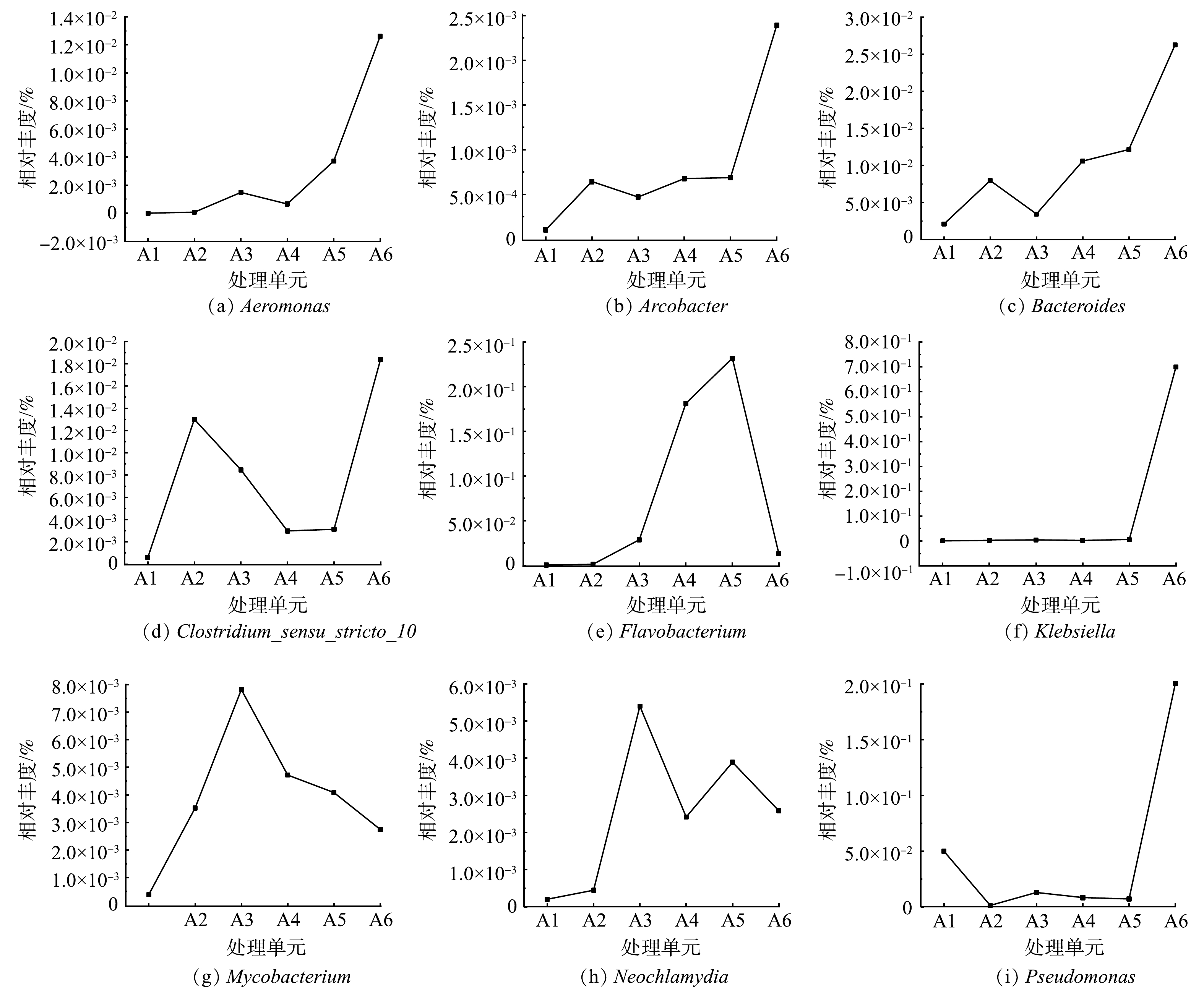
进一步深入分析本研究中一体化污水净化槽各处理单元的细菌特征,结果发现,其检出的潜在人致病性细菌种类丰富,并且各个单元的种类及含量也存在一定差异。进水中共检测到16种潜在致病细菌属, 而出水中则检出了20种潜在致病细菌属。有研究[30-39]表明,出水中检出的相对丰度较高的Klebsiella、Aeromonas、Arcobacter、Neochlamydia、Clostridium_sensu_stricto_10、Mycobacterium、Pseudomonas、Bacteroides、Acinetobacter和Flavobacterium均对人体存在潜在危害。Aeromonas hydrophila普遍存在于淡水、污水、淤泥、土壤和人类粪便中,可引起多种水产动物的败血症和人类腹泻[30];Klebsiella pneumoniae是人类呼吸道和肠道的常居菌,可引起下呼吸道、血液、泌尿道、消化道、手术切口、颅内、皮肤软组织等多个部位感染[31];Arcobacter skirrowii与人类和动物的腹泻、菌血症等疾病密切相关[32];属于易引起疾病衣原体目的Neochlamydia,对人体健康也存在潜在威胁[33];Mycobacterium tuberculosis可引起人体结核病,一种传染性疾病,主要是通过呼吸道传播,以肺结核为最多见[34];Pseudomonas aeruginosa为假单胞菌属中最为常见的一种机会致病菌,常可引起尿路感染、烧伤创面及褥疮感染、败血症和肺部感染等[35];Bacteroides fragilis系革兰阴性厌氧菌,由于其具有黏附性、血细胞凝集素、多糖胶囊、菌毛等多种毒力因素,在拟杆菌属中致病性最强,其可引起腹腔感染、术后伤口感染、糖尿病足感染、菌血症等[36];Acinetobacter bamnannii是我国医院感染最主要的致病菌之一,该菌最常引起的感染为下呼吸道感染,尤其为呼吸机相关性肺炎,其次为血流感染[37];Clostridium perfringens广泛存在于自然界及人和动物的肠道中,是近年来我国家畜“猝死症”的主要病因,可引起气性坏疽和食物中毒的主要病原菌坏死性肠炎[38];Flavobacterium可引起肺炎,也可招致脑膜炎、败血症等感染,该菌会在机体免疫力下降时引起感染[39]。以上结果表明,当污水生物处理设施末端出水不经消毒处理时,其出水中潜在致病微生物的危害可能存在升高趋势。本研究选取了9种对人体危害性较大的致病细菌,对其在不同单元中的相对丰度变化进行了分析,结果如图6所示。不同致病细菌的变化趋势各有差异,总体可分为以下3类。
第1种为进水中相对丰度较低,但在设备不同单元随着污水流向相对丰度逐步呈升高趋势。Aeromonas和 Klebsiella在进水中几乎未检出,但在A2、A3、A4、A5、A6的相对丰度则分别升高至0.007 4%和0.002 5%、0.15%和0.004 5%、0.066%和0.001 9%、0.37%和0.005 9%、1.26%和0.70%。Arcobacter (0.01%)和Bacteroides(0.21%)在进水中有少量检出,但在不同单元中也均呈现上升趋势,A2、A3、A4、A5、A6的相对丰度分别为0.064%和0.80%、0.047%和0.34%、0.068%和1.06%、0.069%和1.22%、0.24%和2.63%。这可能是因为Aeromonas、Klebsiella、Arcobacter、Bacteroides、Pseudomonas等菌属细菌是活性污泥中大量存在且具有降解有机污染物功能的菌属[24,29,40]。因此,相对进水而言,后续各处理单元中这些细菌的相对丰度呈现出上升趋势。
第2种为进水中相对丰度较低,但在整个水处理过程中其相对丰度呈现先上升后下降趋势。Mycobacterium(0.04%)和Neochlamydia(0.02%)在A2、A3、A4、A5、A6的相对丰度分别为0.35%和0.045%、0.78%和0.54%、0.47%和0.24%、0.41%和0.39%、0.27%和0.26%。这2种致病细菌丰度的最大值均在A3单元,可能是由于这2种细菌均属于厌氧菌,当溶解氧浓度较高时会抑制其活性,甚至会影响其生存。同样,Flavobacterium (0.04%)在A2、A3、A4、A5、A6的相对丰度也呈现出先上升后下降趋势,分别为0.10%、2.85%、18.12%、23.18%、1.32%,但下降点在A5单元,这可能因为Flavobacterium同时是一种好氧反硝化细菌[24],在氮物质、有机物含量相对较低环境中会影响其繁殖,导致其相对丰度下降。
第3种为进水中相对丰度较低,但在整个水处理过程中呈现先上升后下降再上升趋势。Clostridium_sensu_stricto_10在进水中的相对丰度为0.06%,而在设备其他处理单元的相对丰度分别为A2(1.30%)、A3(0.85%)、A4(0.30%)、A5(0.31%)、A6(1.84%),其相对丰度的峰值分别在A2和A6中。高通量测序结果显示,各单元检测总片段分别为38 979、40 364、44 672、51 735、50 945、36 408。分析高通量测序结果表明,A1、A2、A3、A4、A5和A6单元中Clostridium_sensu_stricto_10的核酸检出片段量分别为23、525、378、154、159、669。造成这种现象的原因可能是:在功能单元中功能菌种类和相对含量增大,而Clostridium_sensu_stricto_10较功能菌对营养物质的竞争力较小,导致相对丰度下降,但具体原因需要进一步开展研究。以上分析结果表明,无论那种类型变化趋势,其设备出水中均包含一定量的潜在致病性细菌。
-
1)所研究的一体化污水净化槽设施处理农村生活污水时,不同处理单元细菌中群结构呈现一定差异,尤其是进水、夹杂物去除槽和后续生化处理单元之间。出水中也包含多样性丰富的细菌。
2)本研究在一体化污水净化槽中共检出21种潜在致病细菌,以Flavobacterium、Pseudomonas等为主。值得注意的是,在其出水中存在20种潜在致病细菌,并且有9种优势潜在致病细菌的相对丰度较进水存在明显升高现象。
农村分散式污水处理设施潜在致病细菌分布特征
Characterization of the potential pathogenic bacteria distribution in rural decentralized wastewater treatment facilities
-
摘要: 污水是病原微生物传播的重要介质之一。目前我国大多数农村地区生活污水经生化处理后,极少进行消毒就直接排放至自然水体,这是否会造成农村地区污水中病原微生物的传播尚不明确。为此,以未开消毒设施的一体化污水净化槽为研究对象,在其稳定运行阶段,分析了不同处理单元、尤其是出水中细菌种群及潜在致病性细菌种类的特征。结果表明,与进水相比,净化槽各单元均包含一定量的潜在致病细菌,尤其是出水中,检出了20种潜在致病细菌,以Flavobacterium、Pseudomonas等为主。其中部分潜在致病菌随着污水处理流程其丰度呈现上升趋势。例如,Aeromonas、Klebsiella、Arcobacter和Bacteroides在进水中几乎未检出,其相对丰度分别为0%、0%、0.01%和0.21%,但其在出水中检出的相对丰度则为1.26%、0.70%、0.24%和2.63%。以上研究结果初步表明,在农村地区生活污水生物处理设施各工段中,均存在一定的潜在致病性微生物;尤其值得注意的是,在不进行消毒的状态下,出水中也包含多种潜在致病性微生物,其排放对周边环境及人体健康可能存在一定影响。本研究结果可为后续村镇小型污水处理设施的健康风险评估提供参考。Abstract: Wastewater is considered as one of the important transmission media of pathogenic microorganisms. At present, most domestic wastewater in rural areas of China is discharged directly to natural water after biochemical treatment with rare disinfection, and it is not clear whether this causes the transmission of pathogenic microorganisms in wastewater in rural areas. In this study, the characteristics of bacterial populations and potentially pathogenic bacterial species in different treatment units, especially in effluent, were analyzed at the stable operation stage of integrated Johkasou without running disinfection facility. The results showed that compared with the influent, each unit of the Johkasou contained a certain amount of potential pathogenic bacteria. Especially in the effluent, 20 species of potential pathogenic bacteria were detected, mainly were Flavobacterium and Pseudomonas. The relative contents of some potential pathogens showed an increasing trend along the wastewater treatment process. For example, Aeromonas, Klebsiella, Arcobacter and Bacteroides were almost not detected in the influent, and their relative abundances were 0%, 0%, 0.01% and 0.21%, respectively, but their relative abundances detected in the effluent were 1.26%, 0.70%, 0.24% and 2.63%, respectively. The preliminary results of this study show that there are certain potential pathogenic microorganisms in all sections of domestic wastewater biological treatment facilities in rural areas. And it is especially noteworthy that the effluent also contained a variety of potential pathogenic microorganisms without disinfection, and its discharge may have certain effects on the surrounding environment and human health. The results of this study will provide a basis for the health risk assessment of subsequent small-scale wastewater treatment facilities in rural areas.
-
表 1 不同处理单元微生物群落丰度和多样性
Table 1. Microbial community abundance and diversity in different treatment units
处理单元 Ace Chao1 覆盖率/% Shannon Simpson A1 1 252.21 1 025.01 99.30 2.25 0.26 A2 1 986.92 1 965.48 98.93 4.13 0.15 A3 2 396.72 2 404.32 98.75 5.49 0.01 A4 2 260.19 2 221.75 98.95 5.01 0.02 A5 1 910.35 1 841.82 99.16 4.92 0.02 A6 2 029.49 1 981.27 98.68 5.06 0.03 -
[1] SYMONDS E M, NGUYEN K H, HARWOOD V J, et al. Pepper mild mottle virus: A plant pathogen with a greater purpose in (waste) water treatment development and public health management[J]. Water Research, 2018, 144: 1-12. doi: 10.1016/j.watres.2018.06.066 [2] 程艳艳, 张崇淼, 王晓昌, 等. 城市污水处理工艺对宿主特异性标记物和肠道病原菌的去除效果[J]. 环境工程学报, 2014, 8(3): 887-890. [3] 中华人民共和国生物安全法[J]. 中国人大, 2021(8): 15-21. [4] 国家统计局. 第七次全国人口普查主要数据情况 [EB/OL]. [2021-05-11]. http://www.stats.gov.cn/tjsj/zxfb/202105/t20210510_1817176.html. [5] FAN Z Y, LIANG Z W, LUO A C, et al. Effect on simultaneous removal of ammonia, nitrate, and phosphorus via advanced stacked assembly biological filter for rural domestic sewage treatment[J]. Biodegradation, 2021, 32: 403-418. doi: 10.1007/s10532-021-09928-z [6] 李昀婷, 石玉敏, 王俭. 农村生活污水一体化处理技术研究进展[J]. 环境工程技术学报, 2021, 11(3): 499-506. doi: 10.12153/j.issn.1674-991X.20200146 [7] 张天益, 王琬. 农村分散生活污水一体化处理工程实例[J]. 水处理技术, 2020, 46(11): 129-132. [8] 林明. 人工快渗一体化设备在农村污水处理中的应用[J]. 环境工程, 2017, 35(5): 44-47. [9] 张婷, 王孟珍, 曹仲. 农村一体化生活污水处理设备应用现状与发展趋势[J]. 净水技术, 2021, 40(S1): 1-5. [10] 李云, 夏训峰, 陈盛, 等. 我国农村生活污水处理地方标准现状、问题及对策建议[J/OL]. 环境工程技术学报: 1-12[2021-08-25]. http://kns.cnki.net/kcms/detail/11.5972.X.20210708.1449.006.html. [11] 王珏. 净化槽处理农村分散式生活污水的效能研究[D]. 上海: 上海师范大学, 2021. [12] 中华人民共和国环境保护部. 水质 采样技术指导: HJ 494-2009[S]. 北京: 中国环境科学出版社, 2009. [13] 中华人民共和国环境保护部. 水质 采样样品的保存和管理技术规定: HJ 493-2009[S]. 北京: 中国环境科学出版社, 2009. [14] 中华人民共和国环境保护部. 水质 化学需氧量的测定-重铬酸钾法: HJ 828-2017[S]. 北京: 中国环境出版集团, 2017. [15] 中华人民共和国环境保护部. 水质 氨氮的测定-纳氏试剂分光光度法: HJ 535-2009[S]. 北京: 中国环境科学出版社, 2009. [16] 国家环境保护局. 水质 悬浮物的测定 重量法: GB 11901-1989[S]. 北京: 中国环境监测总站, 1990. [17] ZHENG T L, LI W K, MA Y Q, et al. Sewers induce changes in the chemical characteristics, bacterial communities, and pathogen distribution of sewage and greywater[J]. Environmental Research, 2020, 187: 109628. doi: 10.1016/j.envres.2020.109628 [18] JIA L X, SUN H M, ZHOU Q, et al. Pilot-scale two-stage constructed wetlands based on novel solid carbon for rural wastewater treatment in southern China: Enhanced nitrogen removal and mechanism[J]. Journal of Environmental Management, 2021, 292: 112750. doi: 10.1016/j.jenvman.2021.112750 [19] EDGAR R C. Uparse: Highly accurate otu sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998. [20] STACKEBRANDT E, GOEBEL B M. Taxonomic note: A place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J]. International Journal of Systematic Bacteriology, 1994, 44(4): 846-849. [21] WANG Q, GARRITY G M, TIEDJE J M, et al. Naive bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. doi: 10.1128/AEM.00062-07 [22] 黄潇. 多级AO-深床滤池工艺深度处理城市污水效能及微生物特征[D]. 哈尔滨: 哈尔滨工业大学, 2019. [23] 蔡涵冰, 冯雯雯, 董永华, 等. 畜禽粪便和桃树枝工业化堆肥过程中微生物群演替及其与环境因子的关系[J]. 环境科学, 2020, 41(2): 997-1004. [24] 江苏省生态环境厅, 江苏省市场监督管理局. 农村生活污水处理设施水污染物排放标准: DB32/ 3642-2020[S]. 南京: 江苏省市场监督管理局, 2020. [25] CHU H Q, LIU X Q, MA J Y, et al. Two-stage anoxic-oxic (A/O) system for the treatment of coking wastewater: Full-scale performance and microbial community analysis[J]. Chemical Engineering Journal, 2021, 417: 129204. doi: 10.1016/j.cej.2021.129204 [26] CHENG Y, CHON K M, REN X H, et al. The role of beneficial microorganisms in an anoxic-oxic (AO) process for treatment of ammonium-rich landfill leachates: Nitrogen removal and excess sludge reduction[J]. Journal of Environmental Chemical Engineering, 2021, 9: 105188. doi: 10.1016/j.jece.2021.105188 [27] ZHANG T, SHAO M F, LIN Y. 454 Pyrosequencing reveals bacterial diversity of activated sludge from 14 sewage treatment plants[J]. The ISME Journal, 2012, 6(6): 1137-1147. doi: 10.1038/ismej.2011.188 [28] 谭俊杰, 李立君, 李雪洁, 等. 异养硝化-好氧反硝化菌株GNR选育及对猪场废水脱氮实验[J]. 环境工程, 2021, 39(2): 21-26. [29] ZHENG X, SU Y, LI X, et al. Pyrosequencing reveals the key microorganisms involved in sludge alkaline fermentation for efficient short-chain fatty acids production[J]. Environmental Science & Technology, 2013, 47(9): 4262-4268. [30] 张翠娟, 于宙亮, 赵宝华, 等. 嗜水气单胞菌研究进展[J]. 中国兽药杂志, 2008(7): 46-50. doi: 10.3969/j.issn.1002-1280.2008.03.014 [31] 王林峰, 王选锭. 肺炎克雷伯氏菌耐药机制研究进展[J]. 中国抗生素杂志, 2004(6): 324-328. doi: 10.3969/j.issn.1001-8689.2004.06.002 [32] 毕水莲, 孟赫诚. 致病性弓形杆菌属生物学特性及诊断研究进展[J]. 现代食品科技, 2013, 29(1): 211-214. [33] COLLINGRO A, KOSTLBACHER S, HORN M. Chlamydiae in the environment[J]. Trends in Microbiology, 2020, 28(11): 877-888. doi: 10.1016/j.tim.2020.05.020 [34] 李兴芳. 结核分枝杆菌的生物学特性与致病机制研究[J]. 甘肃医药, 2010, 29(5): 496-499. doi: 10.3969/j.issn.1004-2725.2010.05.006 [35] 吴明权, 魏士长, 黄银秋, 等. 绿脓杆菌耐药机制及其治疗对策研究[J]. 中国医院用药评价与分析, 2016, 16(11): 1460-1461. [36] 曹钰然, 胡佳丽, 张菁. 脆弱拟杆菌耐药性及耐药机制研究进展[J]. 中国感染与化疗杂志, 2020, 20(2): 226-231. [37] 张银维. 鲍曼不动杆菌血流感染临床特征和死亡危险因素研究[D]. 杭州: 浙江大学, 2016. [38] MONMA C, HATAKEYAMA K, OBATA H, et al. Four foodborne disease outbreaks caused by a new type of enterotoxin-producing Clostridium perfringens[J]. Journal of Clinical Microbiology, 2015, 53(3): 859-867. doi: 10.1128/JCM.02859-14 [39] 环境保护部. 国家污染物环境健康风险名录-生物分册[M]. 北京: 中国环境科学出版集团, 2013. [40] 陈燕, 刘国华, 范强, 等. 活性污泥法中细菌多样性综述[J]. 环境保护科学, 2015, 41(4): 70-78. doi: 10.3969/j.issn.1004-6216.2015.04.015 -




 下载:
下载: