-
亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)在生物硝化反应中驱动
NO−2 -N氧化为NO−3 -N的过程,对于工业、养殖业水体净化修复至关重要。NOB严格好氧,是一类以CO2为唯一碳源、NO−2 -N为能源的自养细菌,生长代时普遍在10 h以上[1],生长率低,对环境因素极为敏感,这些特点限制了NOB菌株的分离纯化和机理研究[2]。随着工农业废水中重金属和抗生素累积的问题日益突出,过高的重金属、抗生素影响微生物群落结构和代谢功能,进而影响生态系统的净化修复特别是硝化细菌生物脱氮能力,故有必要对其进行进一步探讨。由于NOB分离和纯培养较为困难,目前其菌种资源并不多,国内外研究多集中于以硝化活性污泥为材料的资源开发及其种群生态分布的研究上,且大多为基于氨氧化细菌(ammonia-oxidizing bacteria,AOB)的研究。王勤[3]的研究表明,在生物脱氮系统中,应控制重金属Cu2+、Zn2+、Cr6+、Cd2+的质量浓度分别不高于0.5、30、0.5、5 mg·L−1;TIAN等[4]的研究表明,50 mg·L−1的链霉素可以完全抑制生物膜废水处理系统中的硝化反应;KATIPOGLU等[5]的研究表明,对活性污泥系统连续供给50 mg·L−1的盐酸四环素,硝化细菌活性丧失,NOB在系统中相对丰度降低了10倍。在实际应用上,NOB菌株世代时间长、数量少、对环境敏感,导致硝化效果欠佳,对比探究NOB和硝化菌群在环境胁迫下的活性变化对废水脱氮应用有一定理论意义,而基于不同重金属、抗生素胁迫下比较NOB和硝化菌群脱
NO−2 -N效果的研究尚未见报道。本研究采集珠江水样富集硝化菌群,并分离纯化一株NOB,考察了不同浓度重金属离子和抗生素对菌株亚硝酸盐氧化能力的影响,探究了菌株在环境胁迫下的一般规律,再对比NOB和硝化菌群富集物(初始NOB数量相等情况下)在不同种重金属和抗生素胁迫下的亚硝酸盐氧化活性的变化,以期为NOB的研究及其在工业、养殖业水体净化的实际应用提供参考。
-
所用化学试剂均为分析纯;琼脂糖凝胶DNA回收试剂盒(DP209,北京天根生化科技有限公司);零背景pTOPO-TA克隆载体试剂盒(北京艾德莱生物科技有限公司);TransStart® Tip Green qPCR SuperMix(AQ142-11,北京全式金生物技术公司)。富集硝化菌群的水样取自珠江穗石码头。
紫外-可见光分光光度计(UV-2800A,上海尤尼柯仪器有限公司);立式压力蒸汽灭菌锅(GI80DP,美国致微仪器有限公司);振荡培养箱(ZQLY-180G,上海知楚仪器有限公司);pH测量仪(HQ40d,美国Hach公司);超微量紫外可见光分光光度计(Nano Drop 1000,美国Thermo Fisher公司);实时荧光定量PCR仪(ABI 7500,美国Thermo Fisher公司)。
-
NOB液体培养基:0.5 g·L−1 KCl,0.485 g·L−1 MgSO4·7H2O,1 g·L−1 NaCl,0.3 g·L−1 KH2PO4,0.1 g·L−1 CaCl2·2H2O。以上成分高压蒸汽灭菌冷却后,加入过0.22 μm滤膜除菌的NaHCO3、NaNO2、微量元素母液,使其在培养基中的含量最终分别为2.5 mmol·L−1、10 mmol·L−1、体积分数1‰。在NOB液体培养基中加入质量分数为1.6%的琼脂。硝化菌群富集培养基:NOB液体培养基中NaNO2替换为等浓度NH4Cl。微量元素母液[6]:10 mL 浓HCl,2.1 g·L−1 FeSO4·7H2O,0.062 g·L−1 H3BO3,0.017 g·L−1 CuCl2·2H2O,0.100 g·L−1 MnC12·4H2O,0.036 g·L−1 Na2MoO4·2H2O,0.070 g·L−1 ZnCl2,0.190 g·L−1 CoCl2·6H2O,0.024 g·L−1 NiCl2·6H2O。
-
1)硝化菌群的富集和NOB的分离纯化。将10 mL珠江穗石码头水样接入装有90 mL富集培养基的锥形瓶中,在30 ℃、150 r·min−1条件下振荡培养,每隔2 d取样检测
NH+4 -N、NO−2 -N、NO−3 -N的含量,初始NH+4 -N被AOB氧化为NO−2 -N,接着NO−2 -N被NOB氧化为NO−3 -N,完成硝化过程。当硝化率达90%以上时,以10%体积比接种到新鲜富集培养基继续培养,以此获得稳定硝化菌群富集物,提取富集物DNA送至金唯智生物公司高通量测序。将富集液稀释涂布于NOB固体培养基平板上,在30 ℃恒温培养箱倒置培养28 d以上,挑取NOB单菌落至液体培养基进一步纯化,通过光学显微镜、扫描电镜观察NOB形态。2) NOB的鉴定。以NOB菌液作为模板,用细菌16S rDNA通用引物[7]27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′)进行PCR。PCR反应体系(25 μL):2 μL NOB菌液,27F和1492R(10 μmol·L−1)各0.5 μL,12.5 μL 2×Master Mix,9.5 μL ddH2O。PCR反应条件:94 ℃ 10 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃ 10 min。使用胶回收试剂盒回收纯化16S rDNA,采用零背景pTOPO-TA克隆载体试剂盒进行T-A克隆,经菌落PCR检测出阳性转化子并送至金唯智生物科技有限公司测序。将16S rDNA完整序列通过BLAST与Genebank数据库比对后,选择相似度较高的序列,用MEGA 7.0软件采用邻接法构建系统进化树并分析同源性。
3)重金属、抗生素对NOB亚硝酸盐氧化活性的影响。将NOB种子液以10%体积比接种至液体培养基中(初始
NO−2 -N为80 mg·L−1),添加不同重金属、抗生素设置单一变量,在30 ℃、150 r·min−1的条件下振荡培养,每12 h取样检测NO−2 -N含量。通过参考文献[3-5,8]及预实验设定重金属实验组质量浓度梯度为Cu2+(0、1、5、10、20 mg·L−1)、Zn2+(0、1、2、3、5 mg·L−1)、Cd2+(0、1、5、10、20 mg·L−1)、Mn2+(0、5、20、50、70 mg·L−1)、Cr6+(0、0.4、0.6、0.8、1.0 mg·L−1);抗生素实验组质量浓度梯度为卡那霉素(0、1、5、10 mg·L−1)、氨苄青霉素(0、1、2、3 mg·L−1)、链霉素(0、1、3、5 mg·L−1)、盐酸四环素(0、10、20、50 mg·L−1)。4)重金属、抗生素胁迫对NOB及硝化菌群活性的影响。通过绝对定量qPCR检测NOB种子液和硝化菌群富集物中NOB的绝对数量(以nxrA基因拷贝数计):nxrA引物[9]F1370F1(5′-CAGACCGACGTGTGCGAAAG-3′)和F2843F2(5′-TCCACAAGGAACGGAAGGTC-3′)。使用nxrA的胶回收产物作为标准品。采用改良CTAB法提取DNA[10]。绝对定量qPCR体系与程序参考TransStart® Tip Green qPCR SuperMix试剂盒(全式金,北京)说明书。
选择一组合适的重金属离子、抗生素质量浓度(显著影响NOB氧化活性但不完全抑制活性,NOB完全耗完底物时间为无添加组的1.5倍以上),比较NOB初始接种量相等情况下NOB和硝化菌群富集物对重金属、抗生素单一因素胁迫的亚硝酸盐氧化响应。其中重金属组:5 mg·L−1 Cu2+、1 mg·L−1 Zn2+、10 mg·L−1 Cd2+、20 mg·L−1 Mn2+、0.8 mg·L−1 Cr6+;抗生素组:0.5 mg·L−1 卡那霉素、0.5 mg·L−1氨苄青霉素、1 mg·L−1 链霉素、30 mg·L−1 盐酸四环素。NOB和硝化菌群富集物种子液接种量依据qPCR结果设定(见表1),使NOB和硝化菌群实验组中初始NOB数量相等;摇床条件设为30 ℃、150 r·min−1,每12 h取样检测
NO−2 -N含量。 -
NH+4 -N采用靛酚蓝法测定[11];NO−2 -N采用N-(1-萘基)-乙二铵光度法测定[11];NO−3 -N采用离子色谱法测定[12];pH通过pH计(HQ40d,美国Hach公司)测量;NOB nxrA质量浓度通过超微量紫外可见光分光光度计(Nano Drop 1000,美国)测定,标准品拷贝数按照式(1)计算;NOB nxrA基因绝对拷贝数量使用实时荧光定量PCR仪(ABI 7500,美国)和7500 Software v2.3检测分析。式中:c为NOB nxrA质量浓度,ng·μL−1;L为nxrA片段长度,320 bp。
-
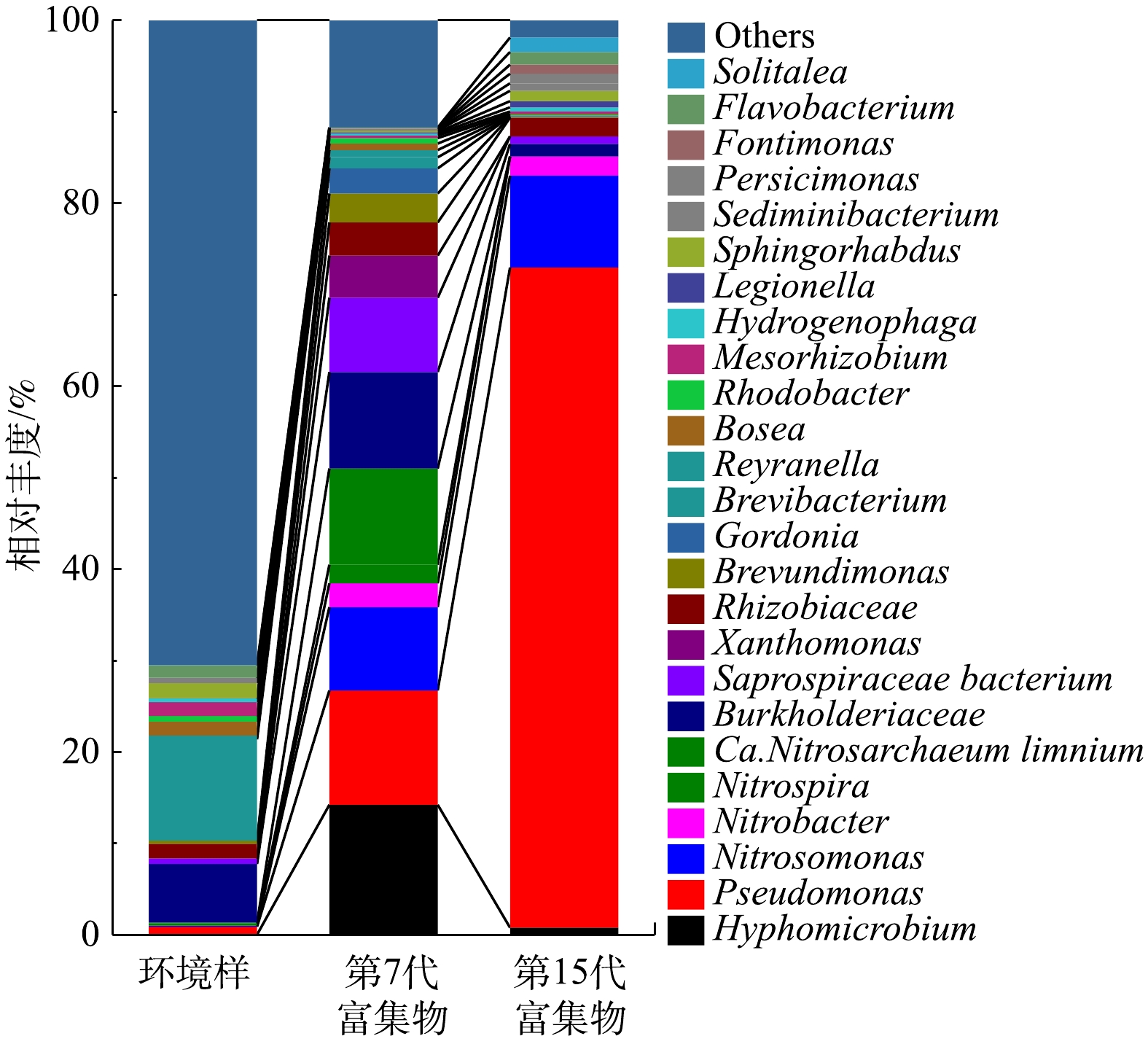
在属水平统计珠江水环境样、富集物群落组成情况如图1所示。在富集培养过程中,AOB、NOB以及Pseudomonas逐渐成为优势菌群。在15代硝化菌群富集培养中,Pseudomonas由环境样0.88%增长到第15代的72.18%,成为富集物的主要优势菌种之一;Nitrosomonas丰度由0.11%升高至10.04%;Nitrobacter的丰度由0.014%上升到2.10%;环境样中Nitrospira、Candidatus Nitrotoga、Nitrospina等属的NOB在第15代富集物中检测不到。有研究表明,Nitrobacter的亚硝酸盐半饱和常数(Km,NO2-)为40~1 380 μmol·L−1,Nitrospira的亚硝酸盐半饱和常数为9~27 μmol·L−1,Nitrospira具有更高
NO−2 -N亲和力,生长速率低,适合在低浓度NO−2 -N下缓慢生长[13-14];Nitrososphaera与Nitrosomonas同样具有这种关系。这解释了10 mmol·L−1NH+4 -N和NO−2 -N的选择压力下Nitrosomonas和Nitrobacter分别成为优势AOB、NOB且丰度升高的现象。 -
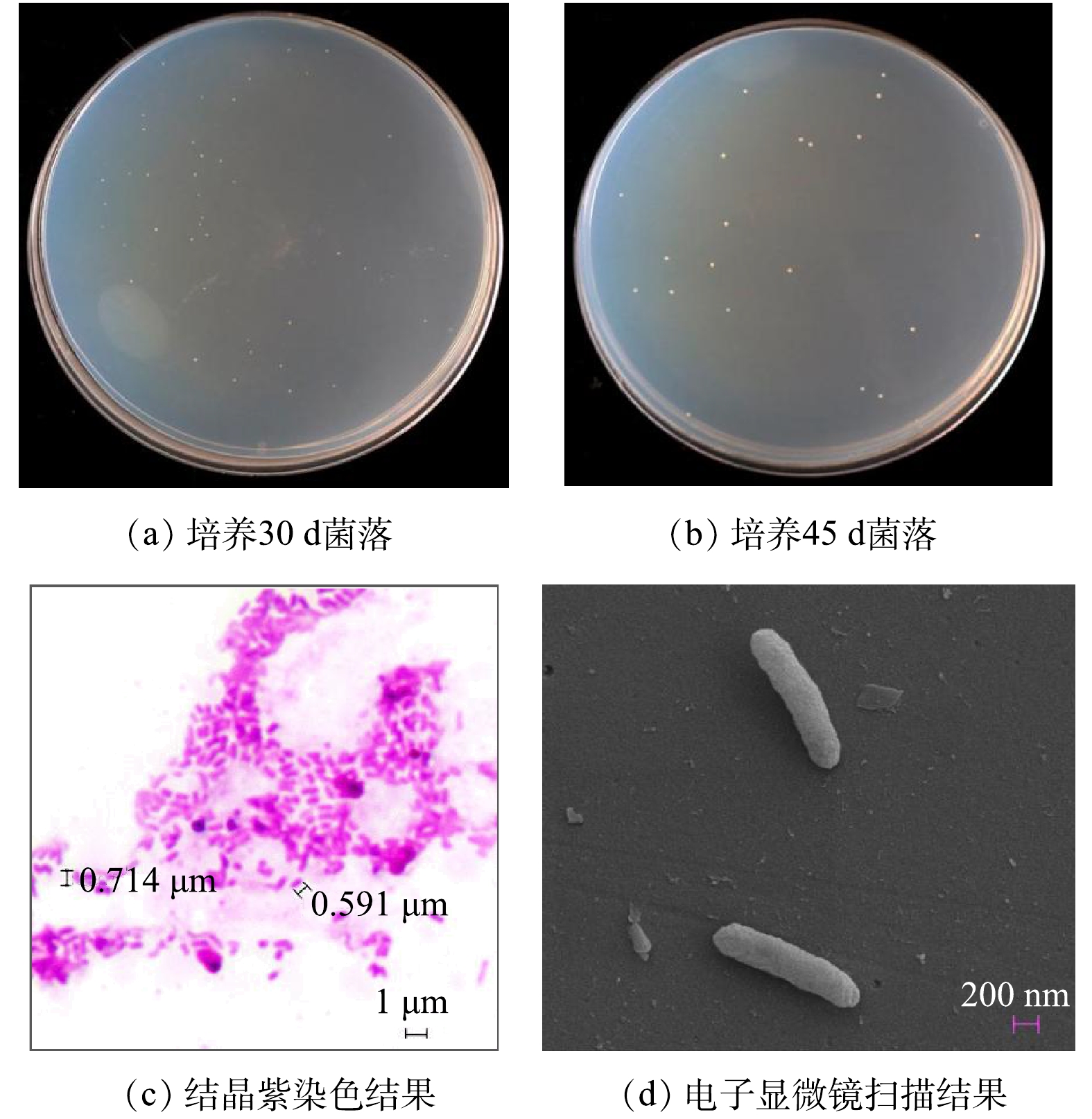
NOB的菌落形态和细胞形态如图2所示。培养30 d,长出来NOB菌落呈针尖大小,色泽淡黄,平实不透明,边缘及表面光滑,直径0.2~0.3 mm,直径随培养时间的延长而增大(图2(a)和图2(b));培养45 d,直径约0.5 mm。结晶紫染色结果显示:NOB为分散排列、无芽孢、两端钝圆的短杆状细菌,细胞大小为0.5~1.0 μm(图2(c))。扫描电镜成像显示:NOB呈杆状,细胞表面完整、光滑(图2(d))。
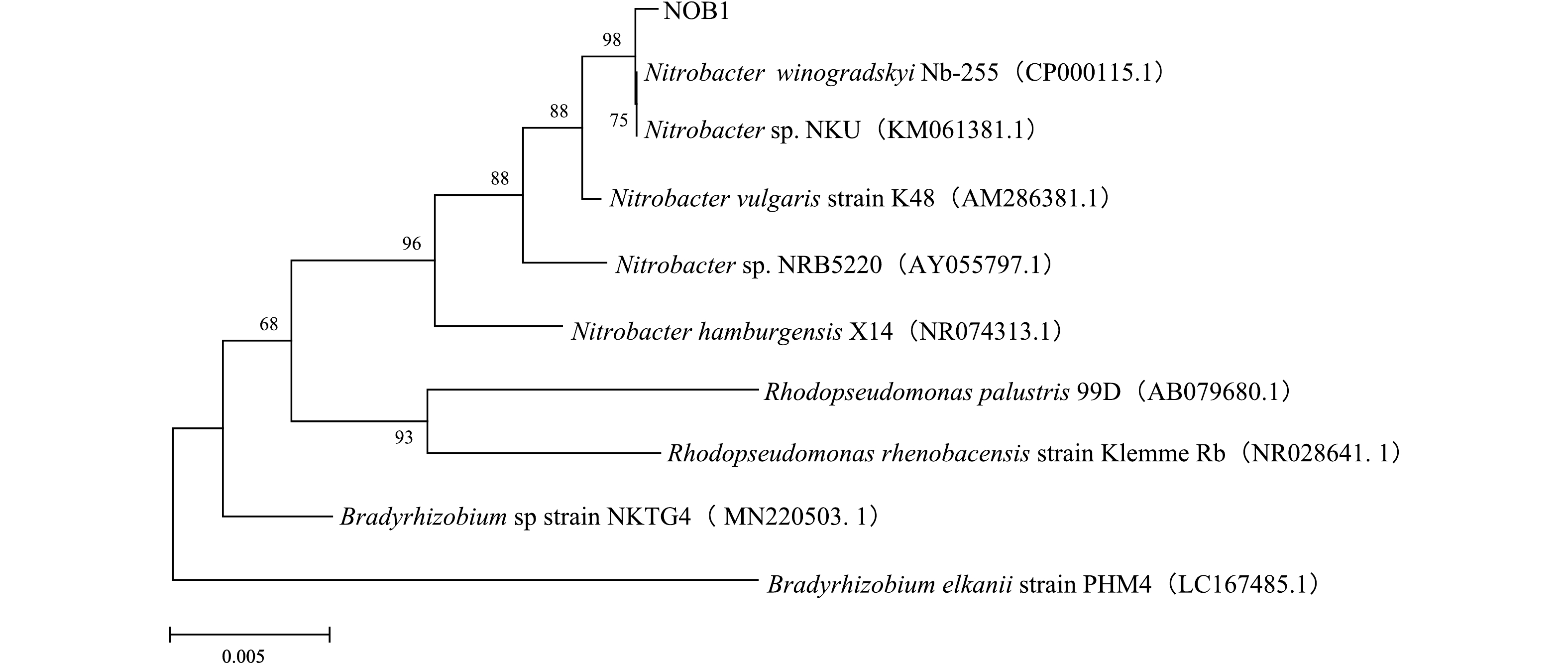
菌株NOB1的16S rDNA序列在GenBank数据库通过BLAST检索对比,结果表明,NOB1与Nitrobacter winogradskyi Nb-255模式菌株相似度最高,达到99.58%。基于16S rDNA序列构建系统发育树,如图3所示,NOB1与Nitrobacter winogradskyi Nb-255同源性最高,且与各Nitrobacter处于同一聚类。
-
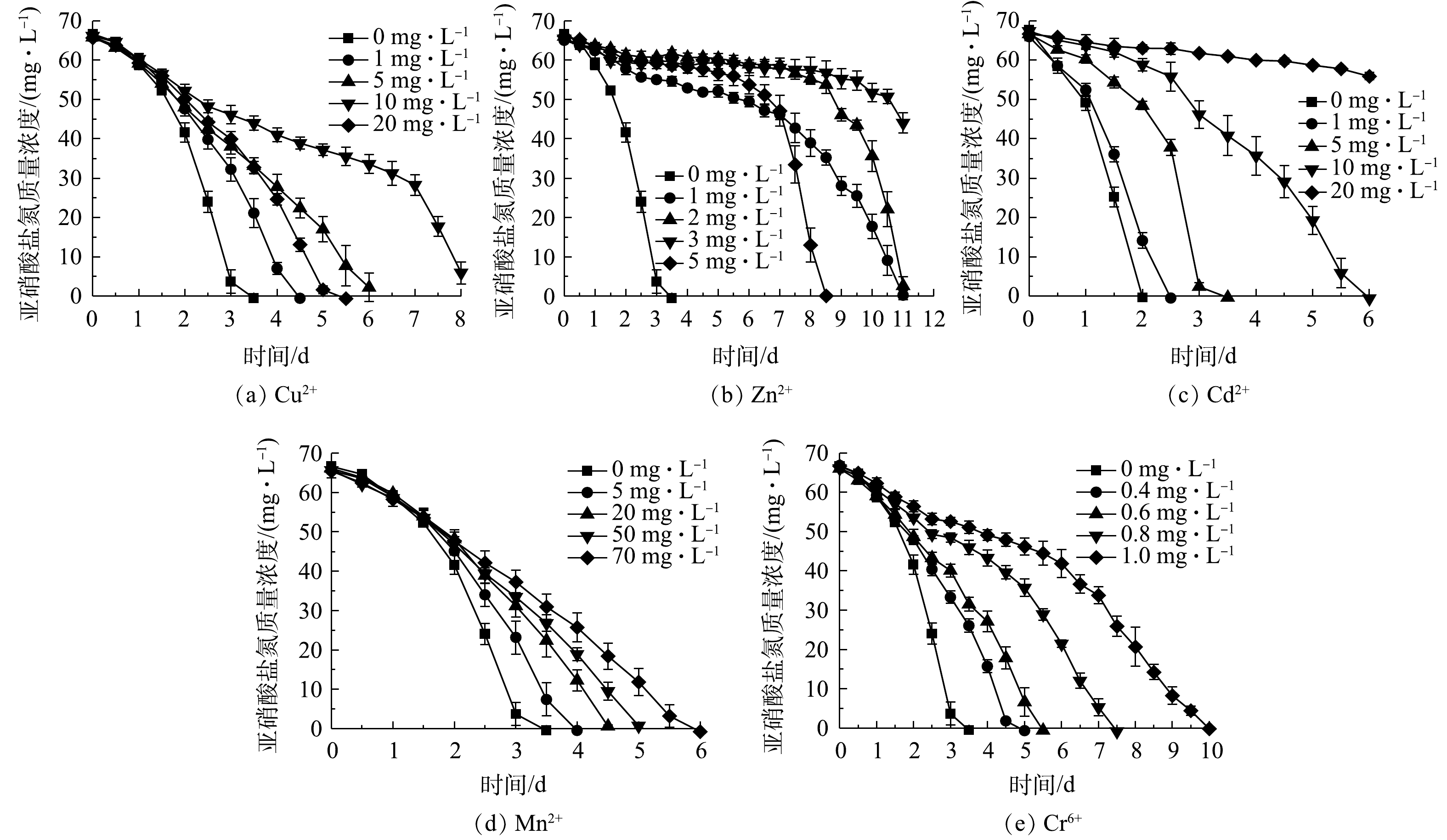
1)重金属对NOB亚硝酸盐氧化活性的影响。不同浓度的Cu2+、Zn2+、Cd2+、Mn2+、Cr6+对NOB亚硝酸盐氧化活性的影响情况如图4所示。可以看出,在5种重金属组中,亚硝酸盐氧化活性随重金属浓度的变化规律基本一致,均随重金属离子浓度升高而其活性抑制作用增强。以Cu2+组为例,Cu2+添加量为0 mg·L−1时亚硝酸盐氧化速率最快,在第3 天基本消耗完底物,脱
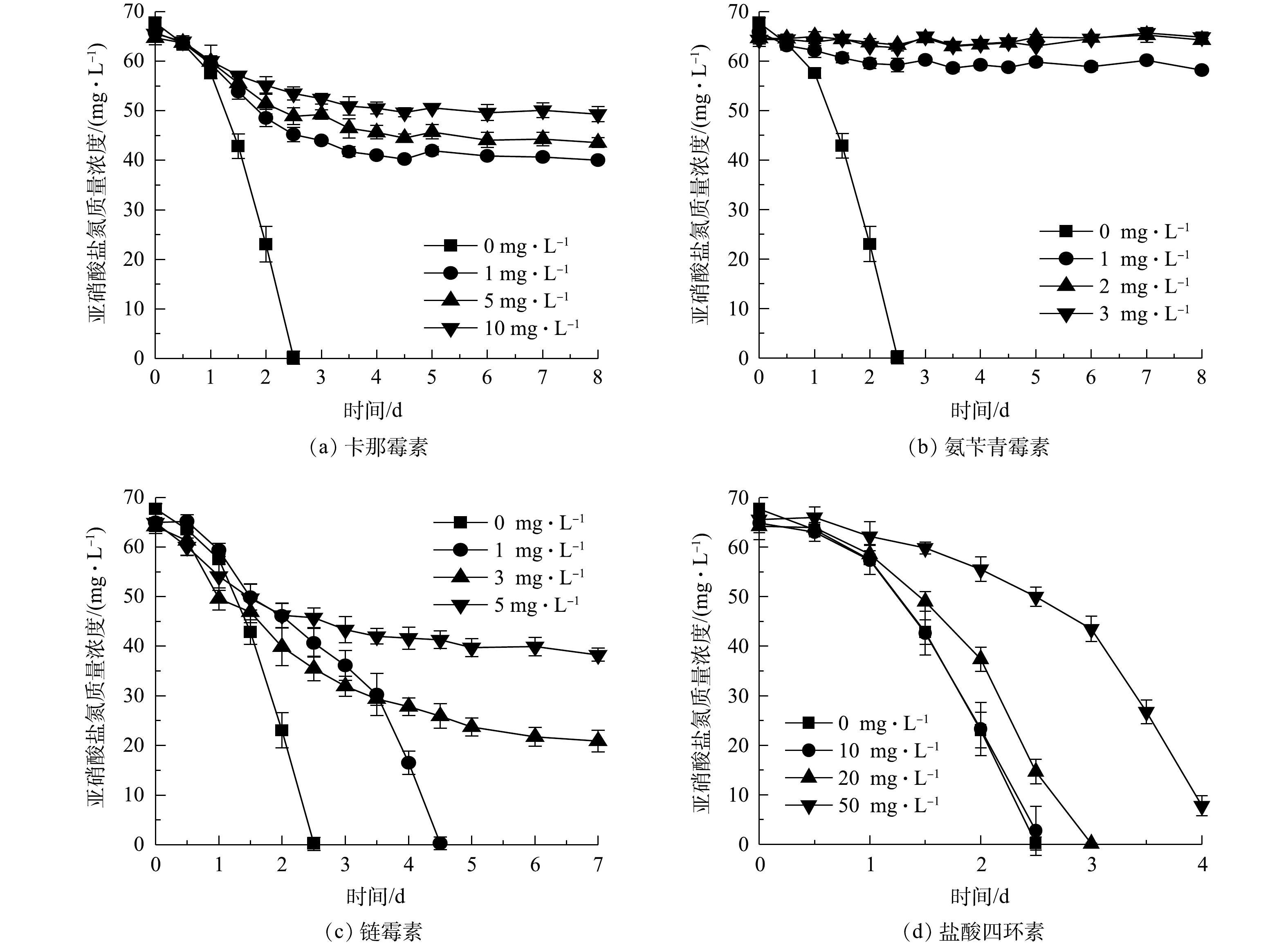
NO−2 -N率达到97.58%;在Cu2+添加量为1、5、10 mg·L−1组中,分别在第4.5、6.5、8 天基本消耗完初始添加的NO−2 -N,表明NOB亚硝酸盐氧化速率随Cu2+浓度升高而降低;Cu2+质量浓度为20 mg·L−1时的亚硝酸盐氧化速率介于1 mg·L−1与5 mg·L−1组之间,其原因是Cu2+添加量较高(根据Ksp(Cu(OH)2)=2.2×10−20计算出20 mg·L−1 Cu2+开始沉淀pH为5.92),形成可见的Cu(OH)2沉淀,毒害性随之减小,同样的现象亦存在于5 mg·L−1的Zn2+实验组。从5种重金属离子对NOB亚硝酸盐氧化速率的影响来看,对NOB亚硝酸盐氧化活性抑制作用为Cr6+>Zn2+>Cu2+>Cd2+>Mn2+。重金属对微生物的损害主要体现为破坏细胞膜、抑制生物大分子合成[15]。有学者研究[16-18]表明,当添加Cu2+≥30 mg·L−1、Cd2+≥10 mg·L−1、Cr6+≥5 mg·L−1时对硝化脱氮过程有显著影响,这些研究是以硝化活性污泥作为材料,活性污泥可能通过沉淀、吸附或吸收重金属而降低毒性,相比于单一菌株,活性污泥可能对重金属胁迫有更好的抗性[19],所以这些研究中的结果略高于本研究中的单一NOB菌株。2)抗生素对NOB亚硝酸盐氧化活性的影响。不同浓度卡那霉素、氨苄青霉素、链霉素、盐酸四环素对NOB亚硝酸盐氧化活性的影响如图5所示。可以看出,除盐酸四环素外,其他3种抗生素对NOB亚硝酸盐氧化活性起到显著的抑制作用。空白对照组在第2.5 天氧化完
NO−2 -N;卡那霉素或氨苄青霉素≥1 mg·L−1时,NOB在培养前期表现较弱的亚硝酸盐氧化活性,随着培养时间的延长,NOB受抗生素毒害作用加深,活性逐渐殆尽;NOB对盐酸四环素的耐受性较强,添加盐酸四环素≤10 mg·L−1时NOB亚硝酸盐氧化活性几乎不受影响,盐酸四环素为20 mg·L−1时NOB活性略有降低,在高达50 mg·L−1时,盐酸四环素才对NOB表现出较明显的抑制效果,但脱NO−2 -N率仍能在第4 天达到90.02%。以质量浓度1 mg·L−1抗生素的脱NO−2 -N率为依据判断4种抗生素对NOB亚硝酸盐氧化速率的影响,对NOB亚硝酸盐氧化活性抑制作用强弱顺序为氨苄青霉素>卡那霉素>链霉素>盐酸四环素。 -
1) NOB和硝化菌群绝对定量。NOB和硝化菌群富集物中nxrA绝对定量结果见表1,可以看出NOB纯培养种子液中NOB的绝对拷贝数要高于硝化菌群富集物的,前者数量约为后者的3倍。为使两者初始接种NOB量相等,NOB种子液和硝化菌群种子液的接种量分别为2.000%和6.056%。
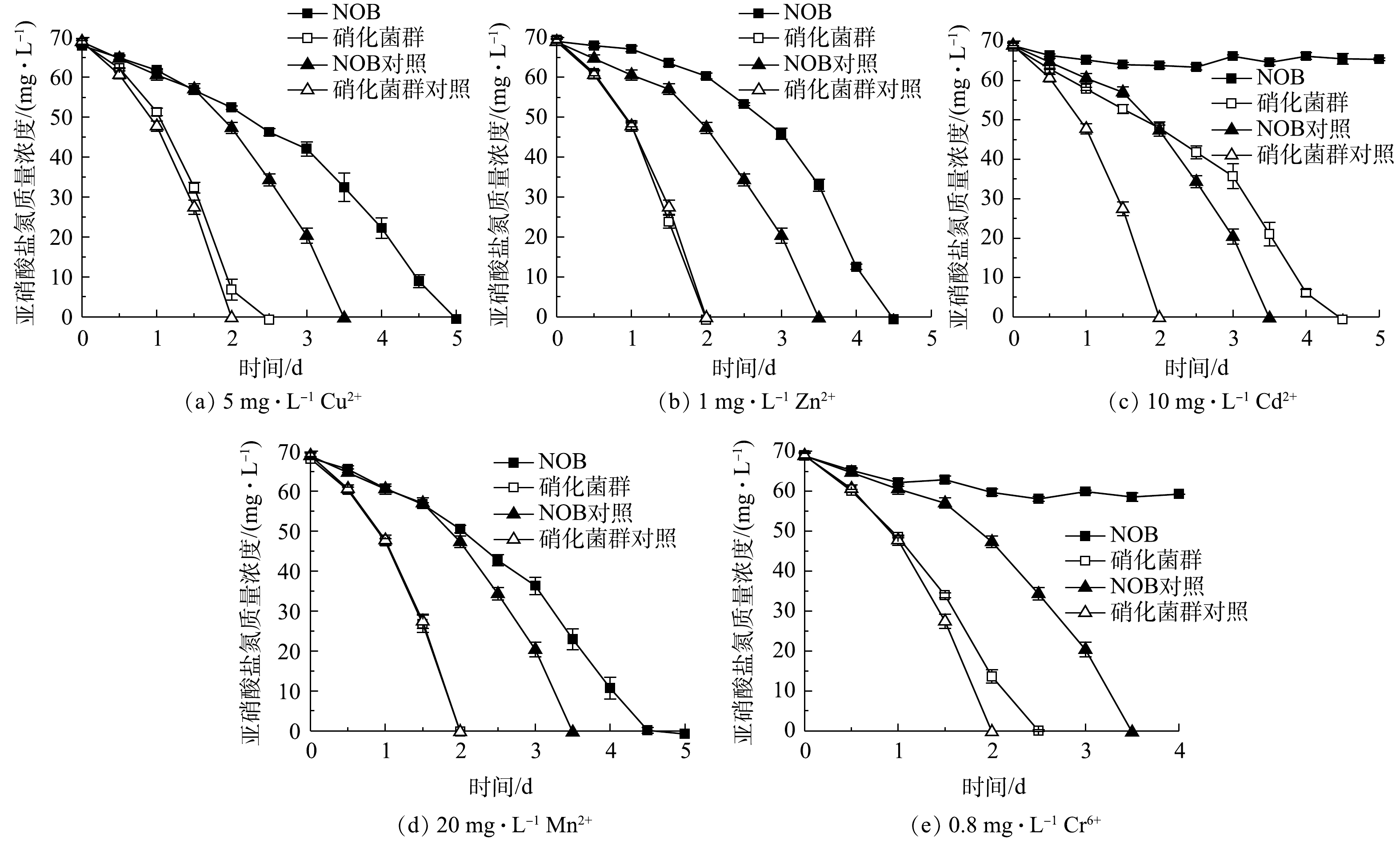
2)重金属胁迫对NOB及硝化菌群活性的影响。重金属胁迫对NOB及硝化菌群活性的影响结果如图6所示。可以看出,在重金属离子胁迫作用下,硝化菌群富集物的亚硝酸盐氧化速率均高于NOB组。以5 mg·L−1 Cu2+组为例,NOB对照和实验组分别于第3.5和5 天氧化完底物,硝化菌群对照和实验组的亚硝酸盐氧化速率更快,在第2 天的脱
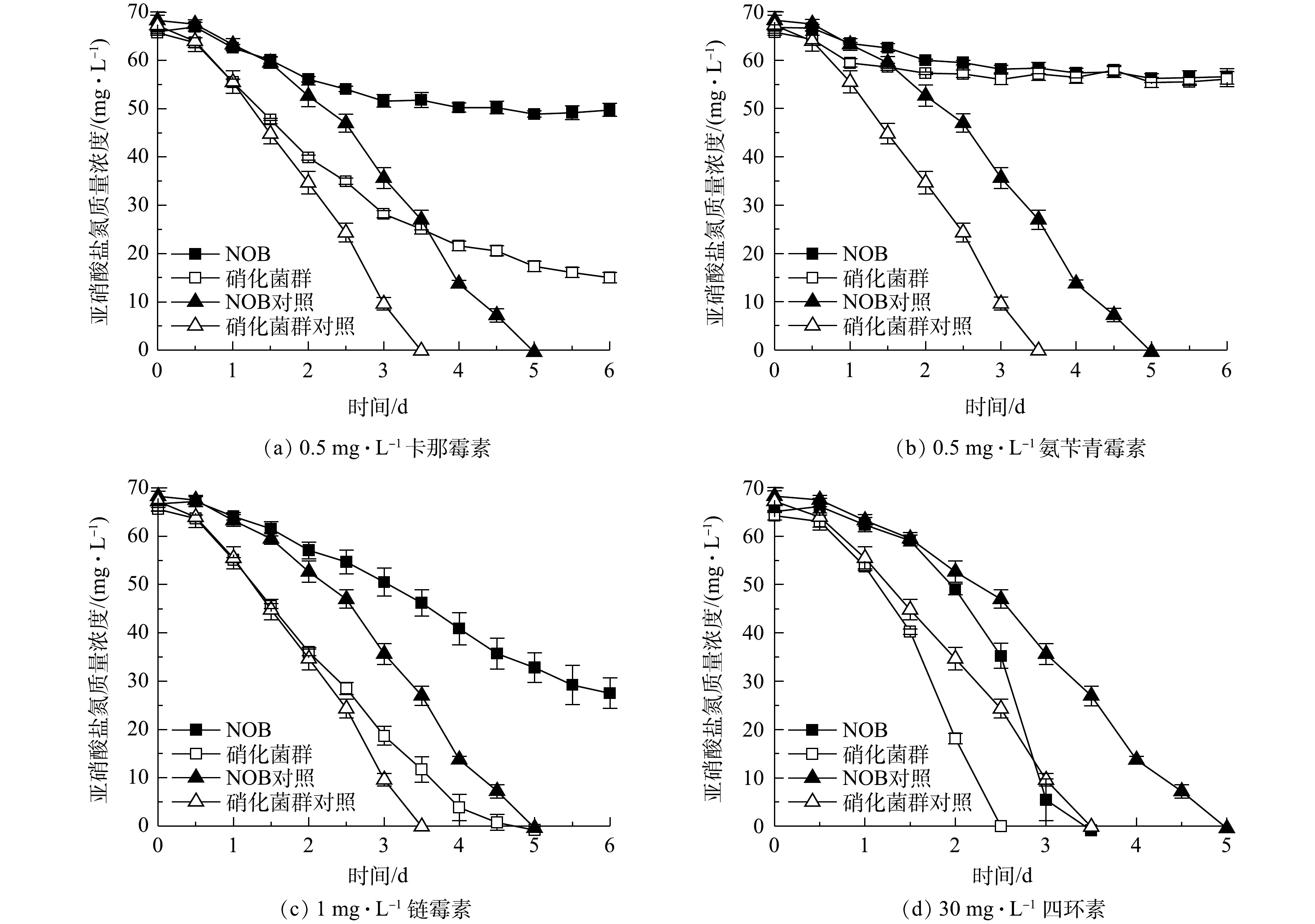
NO−2 -N率分别达到100%和90.08%。同时,值得注意的是,硝化菌群对照组和实验组的亚硝酸盐氧化速率几乎一致,而NOB对照组和实验组的亚硝酸盐氧化速率差异显著。这表明NOB组在5 mg·L−1 Cu2+胁迫作用下活性受到显著影响,而硝化菌群组则几乎不受到5 mg·L−1 Cu2+的抑制作用。同样的现象发生也在1 mg·L−1 Zn2+和20 mg·L−1 Mn2+实验组。由此可见,在初始NOB数量相等情况下,NOB纯培养物在铜、锌、镉、锰、铬等重金属胁迫下的抗逆性和稳定性略显不足,而硝化菌群富集物亚硝酸盐氧化活性和稳定性更高,抗重金属胁迫能力更强,实际应用潜力更大。硝化菌群富集物中除了NOB、AOB,还有丰富的微生物群落,其中Pseudomonas、Rhizobiaceae、Burkholderiaceae等占比较大,分别达到72.18%、2.04%、1.39%。有研究[20-22]表明,这些微生物有较强分泌胞外聚合物(extracellular polymeric substances,EPS)能力。EPS上的羧基、羟基、磷酰基等阴离子基团是吸附Cu2+、Zn2+、Cd2+等重金属离子的主要位点[23-24]。此外,有的微生物还有离子通道、重金属外排、氧化还原等复杂的胞内解毒机制,如Cr6+可以竞争SO2−4 转运蛋白结合位点,细菌相关蛋白表达水平升高从而解毒[25]。这些研究结论与本研究中观察到的硝化菌群富集物稳定性更高、亚硝酸盐氧化速率更快等现象一致。3)抗生素胁迫对NOB及硝化菌群活性的影响。4种抗生素胁迫对NOB及硝化菌群活性的影响结果如图7所示。对比NOB与硝化菌群富集物组可以看出,在不同抗生素胁迫下,后者的亚硝酸盐氧化速率均高于前者。以0.5 mg·L−1卡那霉素组为例,在无添加卡那霉素的情况下,NOB和硝化菌群分别在第5、3.5 天消耗完底物。NOB对抗生素敏感,在0.5 mg·L−1卡那霉素胁迫下,NOB和硝化菌群组的亚硝酸盐氧化活性均受到显著抑制作用,培养前期氧化速率较缓慢,随着培养时间的延长受毒害作用加深,亚硝酸盐氧化活性逐步降低,第6 天NOB和硝化菌群组的脱
NO−2 -N率分别为24.60%和77.18%,在抗生素的抑制作用下,硝化菌群的亚硝酸盐氧化能力仍高于NOB。在硝化系统中,微生物主要通过外排泵、核糖体保护机制、以及破坏活性位点等方式抵抗抗生素;ZHANG等[26]的研究表明,Pseudomonas、Flavobacterium和Nocardiopsis的菌群数量与抗生素抗性基因呈正相关。本研究的高通量测序结果(图1)表明,Pseudomonas和Flavobacterium在富集物菌群中占比为73.55%。这可能是硝化菌群富集物在抗生素胁迫下亚硝酸盐氧化活性、稳定性以及抗逆性都比NOB单一菌株更高的原因之一,说明硝化菌群在应对抗生素污染的环境问题具有更大的潜力。同时,值得注意的是,在30 mg·L−1 盐酸四环素条件下,不管是NOB还是硝化菌群富集物,实验组都比对照组先消耗完底物,即30 mg·L−1 盐酸四环素在实验中在一定程度上促进亚硝酸盐氧化而非抑制作用,表明适量浓度的四环素可能对NOB的富集有帮助。宋超[27]在NOB的活性受到四环素抑制的结论基础上进一步研究发现,在硝化污泥中加入较高浓度的四环素,NOB的数量比四环素浓度较低的组更多,硝化性能更好。其可能原因是:四环素刺激EPS的分泌,与EPS的—OH、C—O—C、C=O和C—N等官能团作用,诱导硝化污泥形成结构紧密的聚合体,对部分优势菌种起到保护作用[28-29];四环素被EPS吸附并通过微生物缓慢降解而减弱毒性效应[30];且四环素本身易变质失效。
-
1)以珠江穗石码头水样富集硝化菌群并分离纯化一株NOB菌株,NOB的亚硝酸盐氧化活性随重金属离子(Cu2+、Zn2+、Cd2+、Mn2+、Cr6+)、抗生素(卡那霉素、氨苄青霉素、链霉素、盐酸四环素)浓度升高而受到抑制效应增强。
2)在初始NOB相等情况下,与NOB纯培养物相比,硝化菌群富集物在重金属或抗生素胁迫下的亚硝酸盐氧化速率更快,稳定性更高,对重金属和抗生素的抗逆性更强,对于处理含氮废水有更好的应用潜力。
重金属和抗生素胁迫对亚硝酸盐氧化菌及硝化菌群活性的影响
Effects of heavy metal and antibiotic stresses on the activity of nitrite-oxidizing bacteria and nitrifying bacteria flora
-
摘要: 重金属和抗生素广泛存在工业废水、养殖水体中,对硝化细菌活性有不同程度的影响。为研究重金属和抗生素胁迫对亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)及硝化菌群活性的影响,采集珠江水样富集硝化菌群并分离纯化NOB,研究了不同浓度重金属离子(Cu2+、Zn2+、Cd2+、Mn2+、Cr6+)和抗生素(卡那霉素、氨苄青霉素、链霉素、盐酸四环素)对NOB亚硝酸盐氧化活性的影响,揭示了不同重金属和抗生素胁迫对NOB及硝化菌群富集物活性的影响。结果表明:第15代富集培养的硝化菌群中Nitrosomonas丰度由0.11%升高至10.04%,Nitrobacter丰度由0.014%上升到2.104%;经鉴定,分离纯化的NOB菌株与Nitrobacter winogradskyi相似性为99.58%;NOB的亚硝酸盐氧化活性随重金属离子、抗生素浓度升高而下降;在初始NOB量相等情况下,与NOB组相比,硝化菌群富集物实验组在重金属或抗生素胁迫下,亚硝酸盐氧化速率更快,稳定性更高,对重金属和抗生素的抗逆性更强,对于处理含氮废水的实际应用潜力更大。该研究结果可为NOB的研究和在工业、养殖业水体净化的开发应用提供参考。Abstract: Heavy metals and antibiotics are widely distributed in industrial wastewater and aquaculture water, which have varying degrees of impact on the activity of nitrifying bacteria. In order to study the effects of heavy metals and antibiotics on the nitrite oxidation of nitrite-oxidizing bacteria (NOB) and nitrifying bacteria flora, water sample of the Pearl River was collected to enrich and cultivate nitrifying bacteria flora and isolate NOB, then the effects of different concentrations of heavy metal ions (Cu2+, Zn2+, Cd2+, Mn2+, Cr6+) and antibiotics (kanamycin, ampicillin, streptomycin and tetracycline hydrochloride) on the nitrite oxidation activity of NOB were studied to reveal the effects of heavy metals and antibiotics stresses on the activities of nitrifying bacteria flora and NOB. The results showed that the abundance of Nitrosomonas in the nitrifying bacteria flora after the 15th times enrichment increased from 0.11% to 10.04%, and the abundance of Nitrobacter increased from 0.014% to 2.104%. The isolated and purified NOB was closely related to Nitrobacter winogradskyi, showing a similarity of 99.58%. The nitrite oxidation activity of NOB decreased with the increase of the concentration of heavy metal ions and antibiotics; in comparison with NOB, the nitrifying bacteria flora under the stress of heavy metals and antibiotics had a higher nitrite oxidation rate, more stable and stronger stress resistance to heavy metals and antibiotics, which indicates it has a greater potential on the practical application in nitrogenous wastewater treatment. The results provide a theoretical reference for the research of NOB and its development and application in industry and aquaculture water purification.
-
Key words:
- nitrite-oxidizing bacteria /
- nitrifying bacteria flora /
- heavy metal /
- antibiotic
-
随着工农业的迅速发展,氯代烃类有机物作为生产原料和溶剂被人类广泛地应用在工业生产、农药、干洗和医疗等行业[1],造成了一系列环境问题。氯代烃类在环境中随着雨水、径流等渗滤到土壤中[2],被土壤吸附一部分后渗漏到地下含水层,导致地下水污染[3],其中地下水中四氯乙烯、三氯乙烯及四氯化碳等污染尤为普遍[4-6]。本研究中选取一种典型氯代烃PCE作为研究对象,该物质是在常温下易挥发、非易燃的重质非水溶相液体(dense non-aqueous phase liquids,DNAPLs),化学性质稳定,且有很强的生物毒性和潜在的生物累积性,并具有刺激性、致敏性、致突变性、致畸性、致癌性等特性,已被较多国家列为优先控制污染物[7]。一旦PCE通过各种途径进入地下环境,会下渗到地下水深层,严重污染地下水资源,对生态环境和人体健康产生极大的危害[8]。1999年北京市地下水有机污染调查结果表明,北京地区有2处氯代烃污染区域面积超过10 km2,主要污染物为TCE和PCE,最高浓度分别为487.6 μg∙L−1和63.74 μg∙L−1,其中PCE的检出率较高[9]。为了保护生态环境及促进可持续发展,地下水中氯代烃污染问题亟待解决,地下水水质保护和污染修复刻不容缓[10]。
考虑到微生物修复技术具有易于原位修复、处理成本低、无二次污染且可以实现无害化等优点,故进一步研究微生物群落对PCE的降解非常必要[11]。近年来,国内外研究人员对氯代烃的生物降解进行了大量探索和研究[12-19]。在厌氧条件下,氯代烯烃可以作为某些细菌的终端电子受体,通过厌氧微生物作用发生还原脱氯,生成次级产物,最终达到无害化的修复目的,而加入一些有机质进行共代谢可以提高其降解速率[12-14]。有研究[15]发现,将厌氧细菌Y51株和好氧性混合株P. pseudocalcaligenes KF707-D3株综合运用可以将难生物降解的PCE完全分解。实际上,单一的厌氧菌或好氧菌很难彻底快速降解PCE[16]。迄今为止,仅发现Dehalococcoides mccartyi属的菌株能使PCE完全脱氯[17],且该属菌株对碳源要求较高,一般需要醋酸盐作为碳源[18],生长条件较为苛刻。然而,多种常见微生物如脱硫单胞菌,硫磺菌等可以协同合作将PCE还原脱氯[19]。
目前,对微生物修复氯代烃的研究主要集中在单一好氧菌株以及厌氧菌株的运用。因此,有必要研究地下水环境中微生物群落降解氯代烃的特性,从而进一步探索提高氯代烃生物降解速率的可行方法。尽管有很多学者研究某类共代谢基质条件下微生物菌株是否能够成功脱氯,但很少有学者针对微生物群落在不同共代谢基质条件下的脱氯能力开展相关研究[20]。因此,根据现阶段氯代烃修复的研究经验,本研究选取一种典型氯代烃PCE,旨在评估模拟地下水环境下降解菌群的共代谢脱氯能力。本研究采用振荡培养法[21]来筛选并鉴定出PCE优势降解菌群,对环境因素开展实验并对其进行了条件优化,探索了不同共代谢基质条件下PCE降解的规律,建立了反应动力学模型,比较了不同共代谢基质条件下微生物的脱氯能力。
1. 材料与方法
1.1 实验原料
四氯乙烯(C2Cl4)和甲醇(CH3OH)为色谱纯,酵母浸膏和维生素B12为生物试剂,乙醇(CH3CH2OH)、三水合磷酸氢二钾(K2HPO4∙3H2O)、七水合硫酸亚铁(FeSO4∙7H2O)、一水合磷酸二氢钠(NaH2PO4∙H2O)、氯化铵(NH4Cl)、七水合硫酸镁(MgSO4∙7H2O)、七水合硫酸锰(MnSO4∙7H2O)、七水合硫酸锌(ZnSO4∙7H2O)、乳酸钠(dl-C3H5O3Na)、葡萄糖(C6H12O6)、六水合氯化钴(CoCl2∙6H2O)、一水合次氮基三乙酸三钠(N(CH2CO2Na)3∙H2O)均为分析纯。
1.2 实验装置
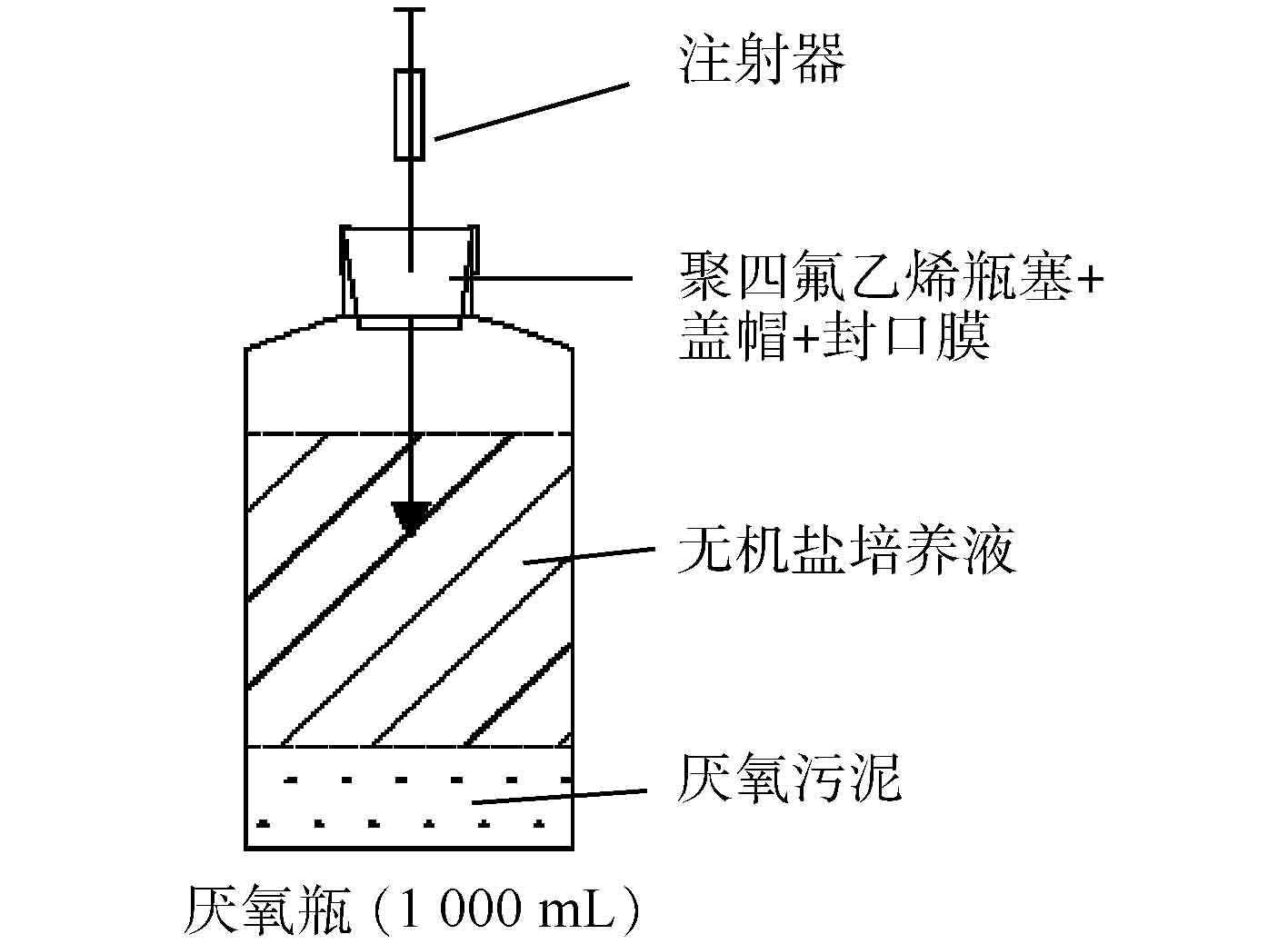
实验过程中使用的仪器设备:恒温振荡箱(MQL-621R,上海旻泉仪器有限公司)、厌氧培养箱(YQX-Ⅱ型,上海新苗医疗器械制造有限公司)、立式压力蒸汽灭菌锅(YM30型,上海三申医疗器械有限公司)、紫外可见分光光度计(TU-1810,北京普析通用仪器有限责任公司)、氮吹仪器(ANPEL DC12,上海安谱实验科技股份有限公司)、气相色谱仪(Agilent7820A,安捷伦科技有限公司)、Illumina Mi Seq平台(微基生物科技(上海)有限公司)。驯化实验采用厌氧瓶密封操作,实验装置见图1,可定期使用注射器采样。
1.3 实验方法
PCE降解菌群的驯化筛选。以南京某污水处理厂的厌氧活性污泥为菌种来源,采用图1的实验装置对厌氧活性污泥进行驯化培养,整个实验操作过程在厌氧培养箱中完成。实验配制无机盐培养基来模拟地下水[22],其组成成分为:K2HPO4∙3H2O 1.05 g∙L−1、NaH2PO4∙H2O 0.25 g∙L−1、NH4Cl 0.49 g∙L−1、N(CH2CO2Na)3∙H2O 0.03 g∙L−1、dl-C3H5O3Na 0.112 g∙L−1、MgSO4∙7H2O 0.05 g∙L−1、FeSO4∙7H2O 3 mg∙L−1、MnSO4∙7H2O 0.74 mg∙L−1、ZnSO4∙7H2O 0.74 mg∙L−1、CoCl2∙6H2O 0.25 mg∙L−1、维生素B12 0.05 mg∙L−1[23]。PCE降解菌群的驯化采用梯度驯化法[24],按PCE浓度由低到高进行,先将200 mL活性污泥接种到700 mL除氧灭菌后的无机盐培养基中(除非特殊说明,pH均在6.80~7.25),随后采用聚四氟乙烯瓶塞和铝卷曲盖密封血清瓶,并采用无菌注射器加入PCE溶液。PCE溶液浓度初次设定为0.5 mg∙L−1,然后放置于30 ℃、转速为30 r∙min−1的恒温振荡培养箱中进行培养驯化7 d,之后更新培养基并将浓度依次递增为1、2、3、4、5 mg∙L−1[22],每个阶段均培养7 d。
PCE降解特性研究。将100 mL无机盐培养基置于血清瓶中,所有培养基在使用前均利用氮气吹扫30 min,然后用高压灭菌锅在121 ℃下灭菌30 min,最后放入厌氧培养箱中冷却备用。将经过梯度驯化后获得的菌液按5%投加量接入含有100 mL无机盐培养基的血清瓶中,随后采用特氟隆表面橡胶隔膜(美国安捷伦公司)和铝卷曲盖密封血清瓶,PCE初始投加量设定为1 mg∙L−1,随后置于30 ℃、30 r∙min−1条件下恒温振荡器中培养。实验过程中每隔24 h采样1次,测定培养基中残留PCE的浓度以及吸光度,分析驯化所得菌群的PCE降解特性及菌群生长曲线。
环境因素对微生物群落降解PCE的影响。在保持与降解特性实验相应条件不变的前提下,分别研究不同温度(10、20、30 ℃)、不同pH(6、7、8)、不同PCE初始浓度(0.5、1、1.5、2、2.5 mg∙L−1)等条件对菌群降解PCE的影响。在相同的实验条件下,不接种菌液作对照,每组实验重复做3个平行样,取平均值。每隔24 h采样1次,测定培养基中残留PCE的浓度,采样结束后使用硅胶填缝密封盖上留下的针孔以防止PCE挥发。
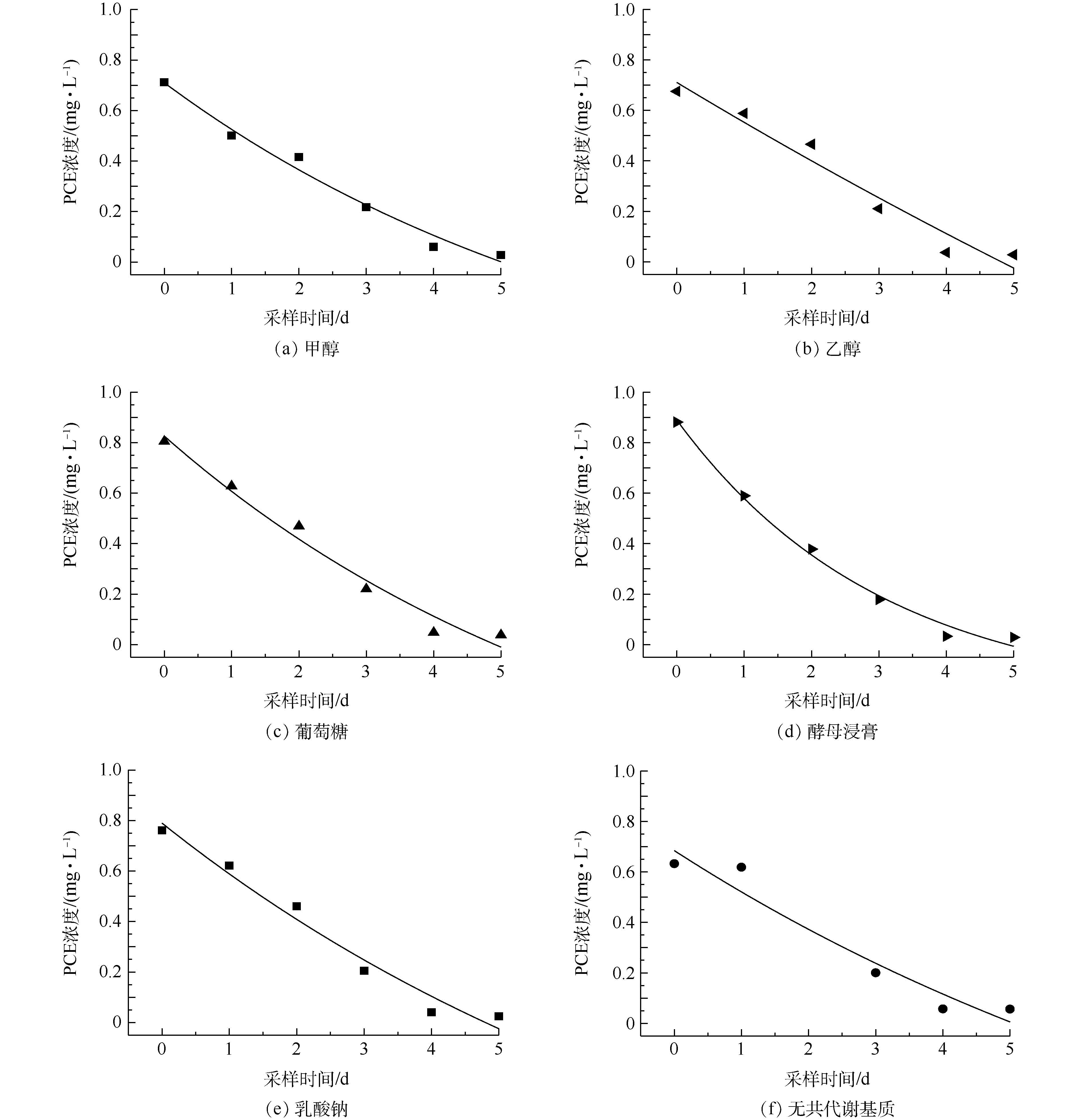
不同共代谢基质对微生物群落降解PCE的影响。为了探索各种共代谢基质对降解菌群性能的影响,将培养所得菌液按5%接种量加入100 mL的无机盐培养液,PCE初始投加量设定为1 mg∙L−1,再分别加入甲醇、乙醇、葡萄糖、酵母浸膏、乳酸钠[25]。其中,葡萄糖以及酵母浸膏浓度为1 g∙L−1、甲醇浓度为0.6 g∙L−1、乙醇浓度为20 mg∙L−1、乳酸钠浓度为0.77 g∙L-1[26]。在30 ℃、30 r∙min−1条件下振荡培养,每24 h采样检测,并利用实验结果建立动力学模型。
1.4 分析方法
实验中PCE浓度采用顶空气相色谱仪[27](Agilent 7820A,美国Agilent公司)及DB-624色谱柱测量。
实验中菌群浓度采用分光光度法[25]测定,取适量实验样品放入1 cm的比色皿中,利用紫外分光光度计测量其在600 nm处的吸光度(A600)。
实验中PCE降解菌群群落结构分析采用16S rDNA[28]来分析,按照柱式细菌基因组抽提试剂盒的使用操作说明,对混合培养体的菌液中的DNA进行提取[29],将纯化后的样品利用Illumina Mi Seq平台进行高通量测序。
2. 结果与讨论
2.1 菌群对PCE降解特性研究
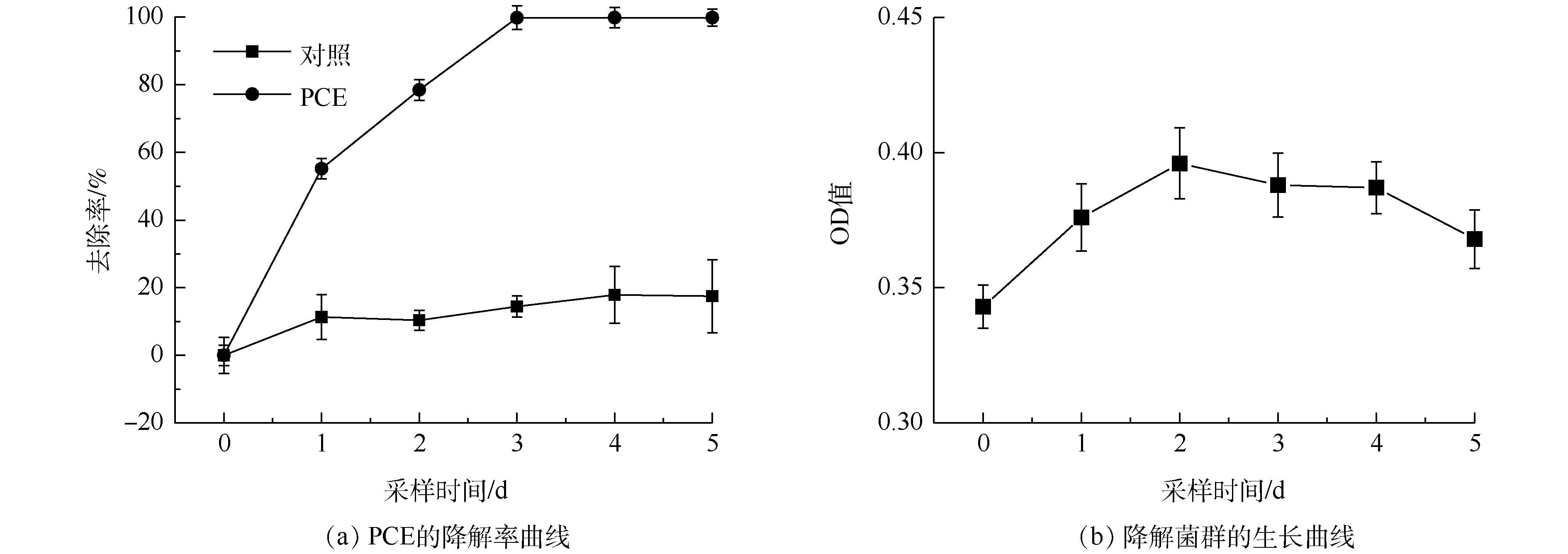
驯化期后PCE降解曲线及菌群生长曲线见图2。由图2(a)可知,PCE能得到高效降解并且去除率已明显高于90%。由图2(b)可知:降解初期(0~2 d),菌群在PCE存在条件下能以较快速度生长;随着采样时间的推移,中期(2~4 d)达到静止期,OD值缓慢下降;后期(4~5 d),由于PCE含量不足,菌群活性被抑制,OD值下降较快。筛选得到的菌群能够高效降解PCE,可以进行菌种鉴定以及环境因素影响实验。
2.2 PCE降解菌群的结构组成
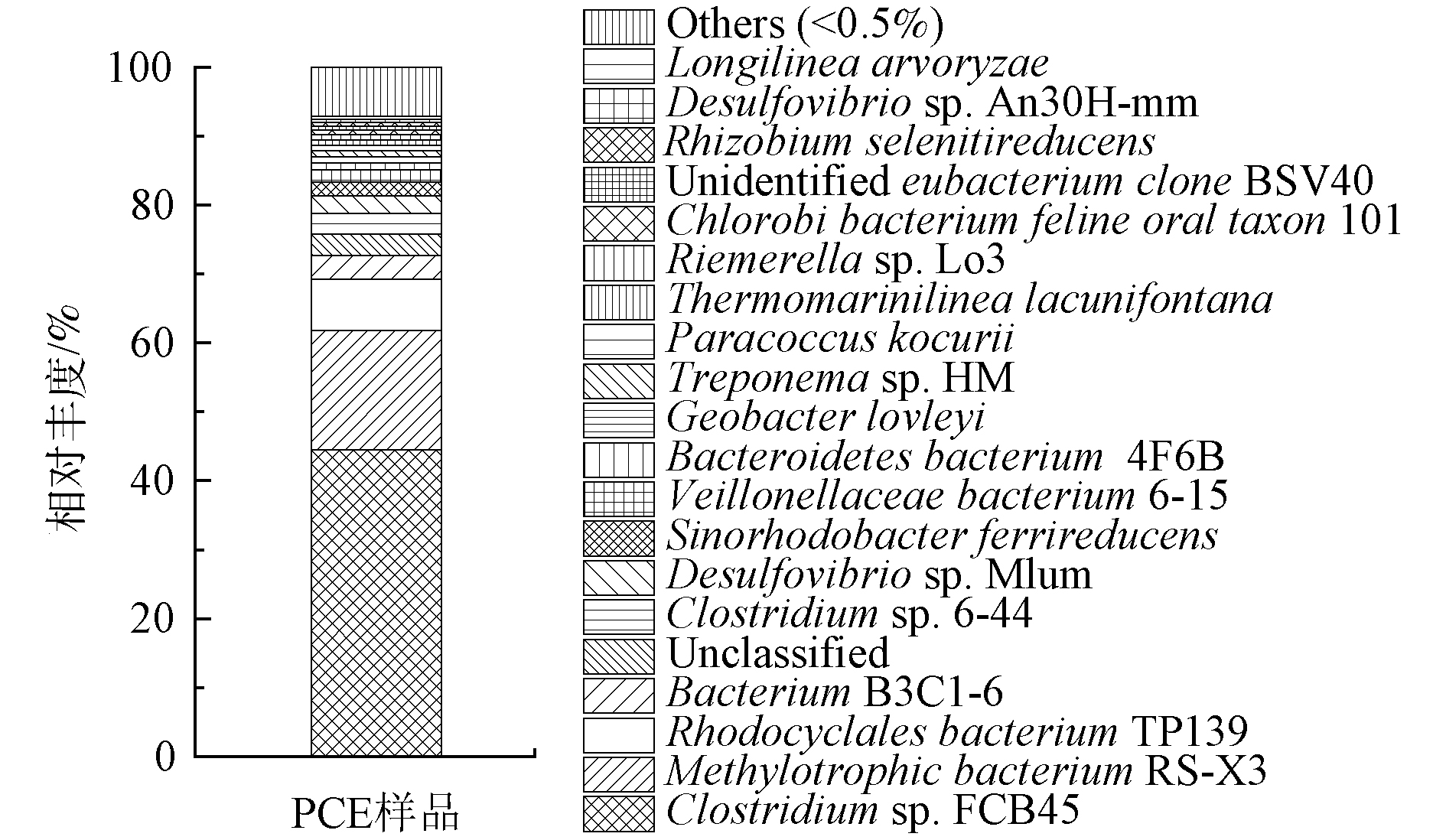
种水平下的样本群落结构组成分布见图3,菌种鉴定结果表明PCE的降解菌群群落结构复杂多样。该菌群中共有16个高于0.50%的种,分别为Clostridium sp. FCB45、Methylotrophic bacterium RS-X3、Rhodocyclales bacterium TP139、Bacterium B3C1-6、Clostridium sp. 6-44、Desulfovibrio sp. Mlhm、Sinorhodobacter ferrireducens、Veillonellaceae bacterium 6-15、Bacteroidetes bacterium 4F6B、Geobacter lovleyi、Treponema sp. HM、Paracoccus kocurii、Thermomarinilinea lacunifontana、Riemerella sp. Lo3、Chlorobi bacterium feline oral taxon 101及Rhizobium selenitireducens。其中,梭状芽孢杆菌(Clostridium sp. FCB45)含量最高,占总量的44.49%,成为优势菌种。这一结果证实了DAVID[12]在微生态研究中推测Clostridium属这种活性较高的梭状菌可以成为降解PCE的潜在微生物的结论。然而,因为这是由普通污水厂的厌氧污泥驯化而来的,故与LOFFLER等[30]在被PCE长期污染的沉积物中所观察到的Desulfuromonas和Dehalococcoides是PCE的优势降解菌有所不同。Methylotrophic bacterium RS-X3含量为17.34%,作为甲基营养菌不仅可以在氯化甲烷上生长[31],并且其被证实含有脱氯酶基因[32],因此,可推测在本研究中Methylotrophic bacterium RS-X3可以促进PCE的生物降解。而占总量7.39%的Rhodocyclales bacterium TP139作为能够利用多种有机化合物生长的多功能细菌的代表[33],首次在PCE降解菌群中被发现并检测到。
有研究表明,脱硫弧菌属(Desulfovibrio sp. Mlhm)可以参与几种氯代污染物的脱氯和硫酸盐还原,包括1, 2-二氯乙烷[34]、1-三氯乙烷[35]和氯仿[36],Treponema属(Treponema sp. HM)能够通过添加醋酸盐将五氯苯酚脱氯成氢气、二氧化碳和甲酸盐[37],Bacteroides属(Bacteroidetes bacterium 4F6B)可降解甲基叔丁基醚[38],Sinorhodobacter ferrireducens能利用肌醇、L-丙氨酸、4-羟基苯甲酸和L-脯氨酸作为碳源[39],Thermomarinilinea属(Thermomarinilinea lacunifontana)能在多种有机物存在时生长(包括明胶、甲壳素、谷氨酸等)[40]。这些菌株也在该菌群中被检测到,其含量分别为2.61%、0.85%、0.97%、1.99%和0.80%,其中Desulfovibrio、Treponema属为潜在PCE降解菌。
2.3 环境因素对降解的影响
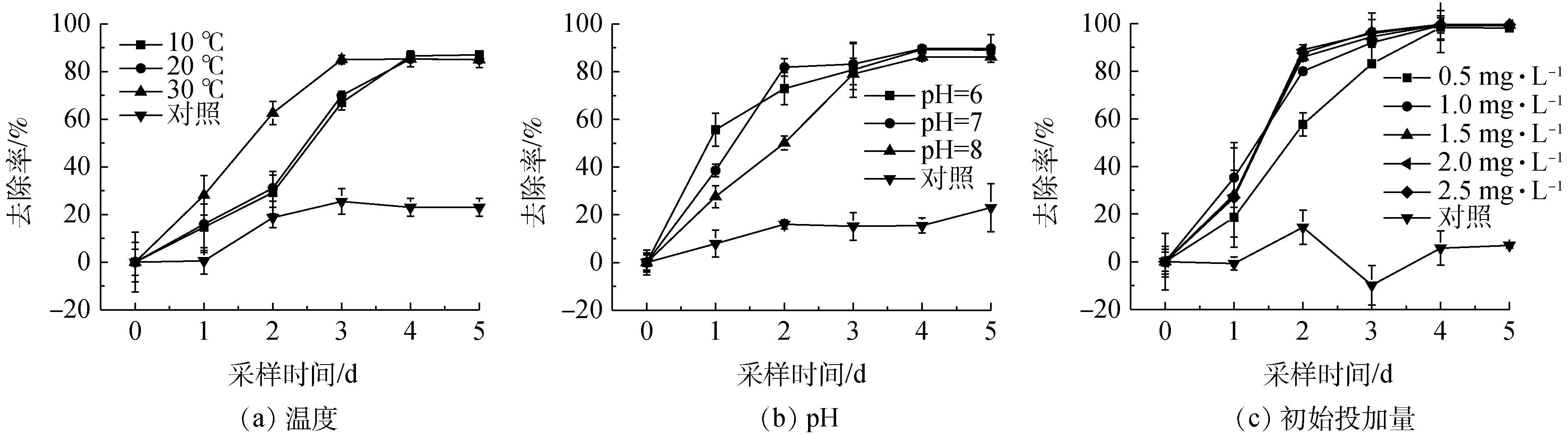
环境因素对PCE降解效果的影响见图4。由图4(a)可知温度对PCE降解率的影响不显著。数据显示3个温度梯度下去除率均高于80%,表明该菌群整体代谢活性较高,具有较宽的温度生态幅,适应不同温度的环境能力较强。在实验初期(0~3 d),菌群在10 ℃以及 20 ℃下对PCE的降解速率相比30 ℃较慢;在后期(4 d后),菌群在10 ℃和20 ℃时对PCE的降解率与其在30 ℃下的降解率相当。ZHANG等[41]也得出TCE去除率随温度的升高(从20 ℃上升到30 ℃)而增加的类似结论。SHARMA等[42]认为,低温下微生物需要更多的时间来矿化疏水性物质。因此,生物反应与化学反应都会减慢速率,而较高的温度会导致生物降解增加。一般地下水的平均温度约为15 ℃(我国西北地区冬季地下水水温仍处于10 ℃左右)[43-45],可以达到该菌群生长的适宜温度范围。
由图4(b)可知:菌群在降解PCE的过程中受非极端pH的影响不显著。在初始pH 6~8时,PCE的降解速率随着初始pH的变化呈现出一定的波动性,但在总体上体系中的微生物群落均能够实现PCE的有效降解。初始pH 7.0为PCE降解的最适值,因为弱酸以及弱碱性的条件不会对降解菌群活性产生抑制,所以在非极端pH的地下水环境中,此菌群也可以发挥作用。
由图4(c)可知:菌群在降解PCE的过程中受PCE初始浓度的影响不显著,但其降解速率存在一定波动性。在此PCE初始投加范围内,该菌群活性没有受到明显抑制,此浓度下的PCE毒性没有破坏菌群体内的酶、核酸以及DNA等的结构,所以菌群能正常进行新陈代谢,但当PCE初始浓度过低时,与酶结合的底物浓度偏低,会使微生物的活性降低,从而导致PCE降解速率下降[46]。
2.4 不同共代谢基质对降解的影响
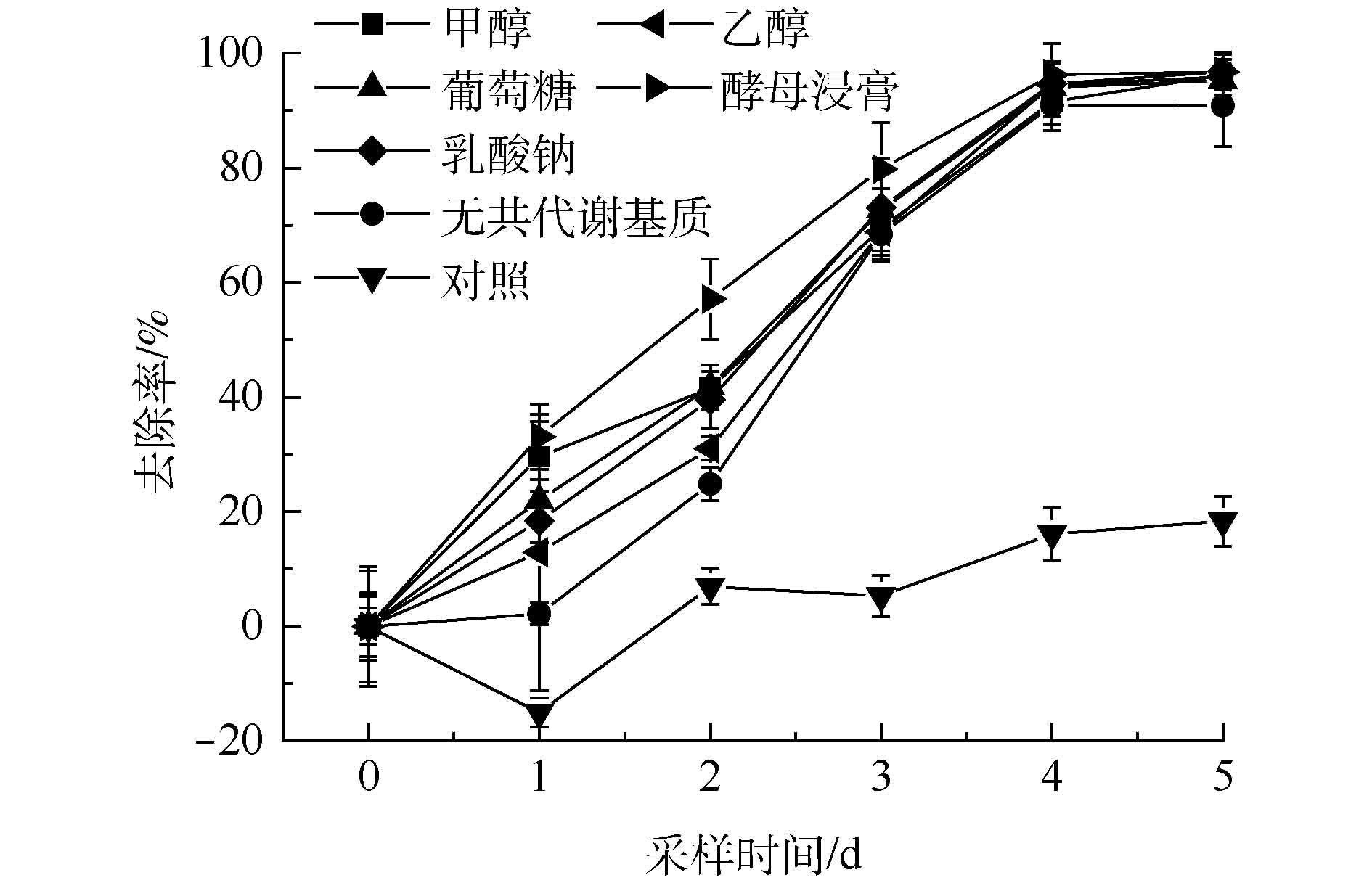
不同共代谢基质对PCE降解效果的影响见图5,其中,酵母浸膏作为共代谢基质时降解效果最好。为了比较不同共代谢基质对微生物脱氯能力的影响,需要建立动力学模型进行比较。一般情况下,反应的动力学方程见式(1),对应一级动力学模型[47]见式(2)。
dc/dt=−kcp(1) c=c0e−k(t−t0)(2) 式中:c为PCE浓度,mg·L−1;p为反应级数;k为反应速率常数,d−1;t为反应时间,d;c0为初始PCE浓度,mg·L−1;t0为初始反应时间,d。
PCE反应动力学模型见图6,根据一级反应动力学拟合方程得到的相关参数见表1。由图6和表1可知,共代谢基质强化的微生物降解过程全部符合一级反应动力学,R2均在0.928以上,除无共代谢对照组只有0.884外,整体拟合效果较好。根据表1进一步可得出,添加了酵母浸膏后实验的半衰期比不添加共代谢基质时减少了0.838 d,并且降解反应速率常数由0.327 d−1降至0.098 d−1,其他共代谢基质(除乙醇外)添加后降解反应速率常数均有提高。上述结果表明,这些共代谢基质的添加均提高了菌群的降解速率。添加不同共代谢基质后的PCE降解反应速率常数有以下关系:酵母浸膏>葡萄糖≈甲醇>乳酸钠>无共代谢基质>乙醇。以酵母浸膏为共代谢基质时,降解反应速率常数最大为0.327 d−1,半衰期为1.571 d,大于其他共代谢基质,所以在此实验条件下,酵母浸膏为最佳的共代谢基质。这可能是因为酵母浸膏含有丰富的维生素、各种氨基酸及核酸降解物等,可以作为促进微生物生长的氮素营养源[22]。乙醇作为共代谢基质时四氯乙烯的降解反应速率常数最小,还小于没有共代谢条件下的降解速率,这可能是因为乙醇对该菌群产生了活性抑制。乙醇因为其特殊的理化性质,会对简单节杆菌中的细胞色素酶等产生抑制作用,使降解菌的降解效率降低[48],乙醇还会改变乳酸杆菌细胞膜的通透性从而影响菌体的代谢活力[49]。因此,可推断同为革兰氏阳性[50]菌的Clostridium sp. FCB45(优势菌种)会出现相似的活性抑制,从而影响PCE降解速率。
表 1 不同共代谢基质对应的PCE的反应动力学模型方程及相关参数Table 1. Reaction kinetics equations and parameters of PCE degradation using different co-substrates共代谢基质 动力学模型 R2 反应速率常数k/d−1 半衰期t1/2/d 甲醇 c=1.39e−t7.02−0.682 
0.972 0.142 1.665 乙醇 c=4.38e−t27.23−3.67 
0.928 0.037 2.296 葡萄糖 c=1.62e−t6.875−0.792 
0.963 0.145 2.095 酵母浸膏 c=1.11e−t3.055−0.223 
0.988 0.327 1.571 乳酸钠 c=1.895e−t8.906−1.106 
0.955 0.112 2.161 无共代谢基质 c=1.746e−t10.155−1.061 
0.884 0.098 2.409 3. 结论
1)利用梯度驯化法获得可将PCE高效降解的菌群,此菌群可以在PCE长期选择压力下生存繁殖。菌种鉴定结果显示:在种水平上,梭状芽孢杆菌Clostridium sp. FCB45含量最高,成为群落中的优势菌种。该群落多样性高,组成复杂,群落稳定性高,易于管理。
2)当温度为30 ℃、pH为中性、PCE初始浓度为1 mg∙L−1和共代谢基质为酵母浸膏时,PCE降解效率最高可达96.75%。此群落可以在不同环境条件下(pH、温度等)表现出较高的降解率,该微生物群落有较宽的生态幅,在非极端环境条件下该群落均能发挥作用。
3)添加共代谢基质强化的微生物实验结果表明,反应模型均符合一级反应动力学,拟合度良好,降解反应速率常数由大到小顺序依次是:酵母浸膏>葡萄糖≈甲醇>乳酸钠>无共代谢基质>乙醇。该菌群在利用酵母浸膏作为共代谢基质时,降解速率常数最大可达0.327 d−1。本研究中酵母浸膏最大程度地提高了四氯乙烯的降解速率。
-
表 1 种子液qPCR结果及接种体积
Table 1. qPCR results and inoculation volume of seed liquid
种子液 nxrA拷贝数/(拷贝·mL−1) 接种量/% NOB 7.54×106±5.82×105 2.000 硝化菌群富集物 2.49×106±4.16×104 6.056 -
[1] BOYABAT N, ÖZER A, BAYRAKÇEKEN S, et al. Comparison of oxidation kinetics of nitrite-oxidizing bacteria: Nitrite availability as a key factor in niche differentiation[J]. Applied and Environmental Microbiology, 2015, 81(2): 745-753. doi: 10.1128/AEM.02734-14 [2] MEIKLEJOHN J. The Isolation of Nitrosomonas europaea in pure culture[J]. Journal of General Microbiology, 1950, 4(2): 185-191. doi: 10.1099/00221287-4-2-185 [3] 王勤. 重金属对生物脱氮的毒性效应研究[D]. 广州: 广州大学, 2009. [4] TIAN Z, PALOMO A, ZHANG H, et al. Minimum influent concentrations of oxytetracycline, streptomycin and spiramycin in selecting antibiotic resistance in biofilm type wastewater treatment systems[J]. Science of the Total Environment, 2020, 720: 137531. [5] KATIPOGLU-YAZAN T, MERLIN C, PONS M N, et al. Chronic impact of tetracycline on nitrification kinetics and the activity of enriched nitrifying microbial culture[J]. Water Research, 2015, 72(1): 227-238. [6] WIDDEL F, BAK F. Gram-negative Mesophilic Sulfate-Reducing Bacteria [M]. New York: Springer, 1992. [7] BAKER G C, SMITH J J, COWAN D A. Review and re-analysis of domain-specific 16S primers[J]. Journal of Microbiological Methods, 2003, 55(3): 541-555. doi: 10.1016/j.mimet.2003.08.009 [8] 王秀蘅, 任南琪, 王爱杰, 等. 铁锰离子对硝化反应的影响效应研究[J]. 哈尔滨工业大学学报, 2003, 35(1): 122-125. doi: 10.3321/j.issn:0367-6234.2003.01.030 [9] SOPHIE W, FRANCK P, XAVIER L R, et al. Development and application of a PCR-denaturing gradient gel electrophoresis tool to study the diversity of Nitrobacter-like nxrA sequences in soil[J]. FEMS Microbiology Ecology, 2008, 63(2): 261-271. doi: 10.1111/j.1574-6941.2007.00416.x [10] GRIFFITHS R I, WHITELEY A S, O'DONNELL A G, et al. Rapid method for coextraction of DNA and RNA from natural environments for analysis of ribosomal DNA- and rRNA-based microbial community composition[J]. Applied and Environmental Microbiology, 2000, 66(12): 5488-5488. doi: 10.1128/AEM.66.12.5488-5491.2000 [11] 中华人民共和国环境保护部, 中国国家标准化管理委员会. 土壤. 氨氮、亚硝酸盐氮、硝酸盐氮的测定. 氯化钾溶液提取-分光光度法: HJ 634-2012[S]. 北京: 中国环境科学出版社, 2012. [12] 中华人民共和国环境保护部, 中国国家标准化管理委员会. 水质 无机阴离子的测定 离子色谱法: HJ/T 84-2001[S]. 北京: 中国环境科学出版社, 2012. [13] LAWSON C, LüCKER S. Complete ammonia oxidation: An important control on nitrification in engineered ecosystems?[J]. Current Opinion in Biotechnology, 2018, 50: 158-165. doi: 10.1016/j.copbio.2018.01.015 [14] BERGMANN D J, HOOPER A B, KLOTZ M G. Structure and sequence conservation of hao cluster genes of autotrophic ammonia-oxidizing bacteria: Evidence for their evolutionary history[J]. Applied and Environmental Microbiology, 2005, 71(9): 5371-5382. doi: 10.1128/AEM.71.9.5371-5382.2005 [15] 王文超, 杨立中, 谭周亮. 重金属对废水生物硝化过程影响研究进展[J]. 环境科学与技术, 2013, 36(S2): 157-161. [16] 张宏扬. Cu(Ⅱ)对生物硝化过程和硝化菌群结构的影响机理研究[D]. 天津: 天津大学, 2013. [17] 张杉. 重金属镉对SBR系统水处理效果及微生物群落影响研究[D]. 北京: 北京化工大学, 2017. [18] 杜振峰. Cr(Ⅵ)对生物硝化过程和硝化菌群结构的影响机理研究[D]. 天津: 天津大学, 2013. [19] LIU Y, LAM M C, FANG H H. Adsorption of heavy metals by EPS of activated sludge[J]. Water Science & Technology, 2001, 43(6): 59-66. [20] CHUG R, MATHUR S, KOTHARI S L, et al. Maximizing EPS production from Pseudomonas aeruginosa and its application in Cr and Ni sequestration[J]. Biochemistry and Biophysics Reports, 2021, 26: 100972. doi: 10.1016/j.bbrep.2021.100972 [21] KUMAR M S, SWARNALAKSHMI K, ANNAPURNA K. Rhizobium Biology and Biotechnology[M]. Cham: Springer, 2017: 257-292. [22] SUN B, HAN P, TAO R, et al. Advances in Applied Biotechnology[M]. Cham: Springer, 2015: 295-303. [23] XING W, FANG L, CAI P, et al. Influence of extracellular polymeric substances (EPS) on Cd adsorption by bacteria[J]. Environmental Pollution, 2011, 159(5): 1369-1374. doi: 10.1016/j.envpol.2011.01.006 [24] RAJESH A, KUMAR] N. Biosorption of cadmium using a novel bacterium isolated from an electronic industry effluent[J]. Chemical Engineering Journal, 2014, 235: 176-185. doi: 10.1016/j.cej.2013.09.016 [25] HENNE K L, TURSE J E, NICORA C D, et al. Global proteomic analysis of the chromate response in Arthrobacter sp. strain FB24[J]. Journal of Proteome Research, 2009, 8(4): 1704. doi: 10.1021/pr800705f [26] ZHANG J, CHEN M, SUI Q, et al. Impacts of addition of natural zeolite or a nitrification inhibitor on antibiotic resistance genes during sludge composting[J]. Water Research, 2016, 91(15): 339-349. [27] 宋超. 四环素强化生物去除及其在自然水体中迁移转化规律的研究[D]. 济南: 山东大学, 2016. [28] 韩月, 李凯, 王志康, 等. SBR中纳米氧化锌和四环素复合投加系统对污泥胞外聚合物的影响[J]. 环境工程学报, 2019, 13(7): 1623-1633. doi: 10.12030/j.cjee.201810097 [29] 张微. 四环素与胞外聚合物的相互作用及其对污泥耐药性的影响 [D]. 上海: 东华大学, 2014. [30] 石义静. 硝化颗粒污泥的培养及其与四环素相互作用研究 [D]. 济南: 山东大学, 2013. -




 下载:
下载: