-
一段式短程硝化-厌氧氨氧化工艺的原理是利用AOB(aerobic ammonia-oxidizing bacteria,氨氧化细菌)将污水中部分
NH+4 氧化成NO−2 ,AnAOB(anaerobic ammoniaoxidizing bacteria,厌氧氨氧化菌)把剩余的NH+4 和NO−2 转化成N2,利用AOB和AnAOB的协同作用,在同1个反应器内完成短程硝化和厌氧氨氧化[1-2]。与传统硝化-反硝化相比,一段式短程硝化-厌氧氨氧化工艺具有工艺流程短、能耗低、无需外加碳源、污泥产量少、占地面积小等优点。自2002年,荷兰Delft工业大学研发至今,该工艺一直是污水处理领域最具创新性的工艺之一[3-5]。一段式短程硝化-厌氧氨氧化工艺已应用于污泥消化、焦化废水、垃圾渗滤液、养殖废水、化工废水等低碳氮比废水的处理领域[6-10]。实现好氧的AOB和厌氧的AnAOB高效富集,同时抑制NOB (nitrite oxidation bacteria,亚硝酸盐氧化菌)的生长是一段式厌氧氨氧化工艺成功启动和稳定运行的关键[11-12]。然而,如何在保证AOB与AnAOB的活性的情况下有效地抑制和淘汰NOB仍是亟待解决的问题[13-14]。LACKNER等[15]发现,在长期运行过程中,anammox工程常出现NOB大量繁殖的现象,导致脱氮效果恶化,
NO−3 -N的浓度升高,甚至最终造成反应系统崩溃。DE CLIPPELEIR等[16]发现,供氧量的控制不当容易引起系统脱氮率下降,并引起NOB急速生长,导致系统崩溃。有研究[17-18]表明,在低溶解氧状态下,保持体系内溶解氧浓度在较低水平能够使AOB比NOB在生长上更占优势。但LIU等[19]发现,仅通过低浓度的溶解氧很难实现对NOB的长期抑制。MIAO等[20]在研究一段式部分亚硝化-厌氧氨氧化处理中低浓度氨氮废水时发现,在低溶解氧条件仍会出现出水NO−3 -N浓度快速上升的现象。上述研究结果表明,仅靠低溶解氧并不能确保实现NOB活性的有效抑制,无法使反应系统内的AOB与AnAOB形成良好的协同作用,很难实现一段式短程硝化-厌氧氨氧化的顺利启动与稳定运行。CALDERON等[21]发现,纯氧曝气较之空气曝气具有氧传递速率高、抗冲击负荷好等特点。江雪姣[22]发现,纯氧曝气有利于活性污泥的生长;由于纯氧曝气传氧速率高、微生物氧化速率高、曝气池占地面积小等优点,纯氧曝气活性污泥法成功用于城市和工业污水处理中,在提高污水排放水质、增加处理能力、降低能耗等方面效果极佳[23]。然而,对于不同曝气气源对一段式短程硝化-厌氧氨氧化工艺的影响还鲜有研究。综上所述,本研究通过对曝气量的精确控制,探究了纯氧曝气与空气曝气对一段式短程硝化-厌氧氨氧化工艺启动过程的影响,考察了不同曝气方式对工艺脱氮性能、响应特征以及功能菌代谢活性等的作用效应和原理,以期为厌氧氨氧化工程的应用提供参考。
全文HTML
-
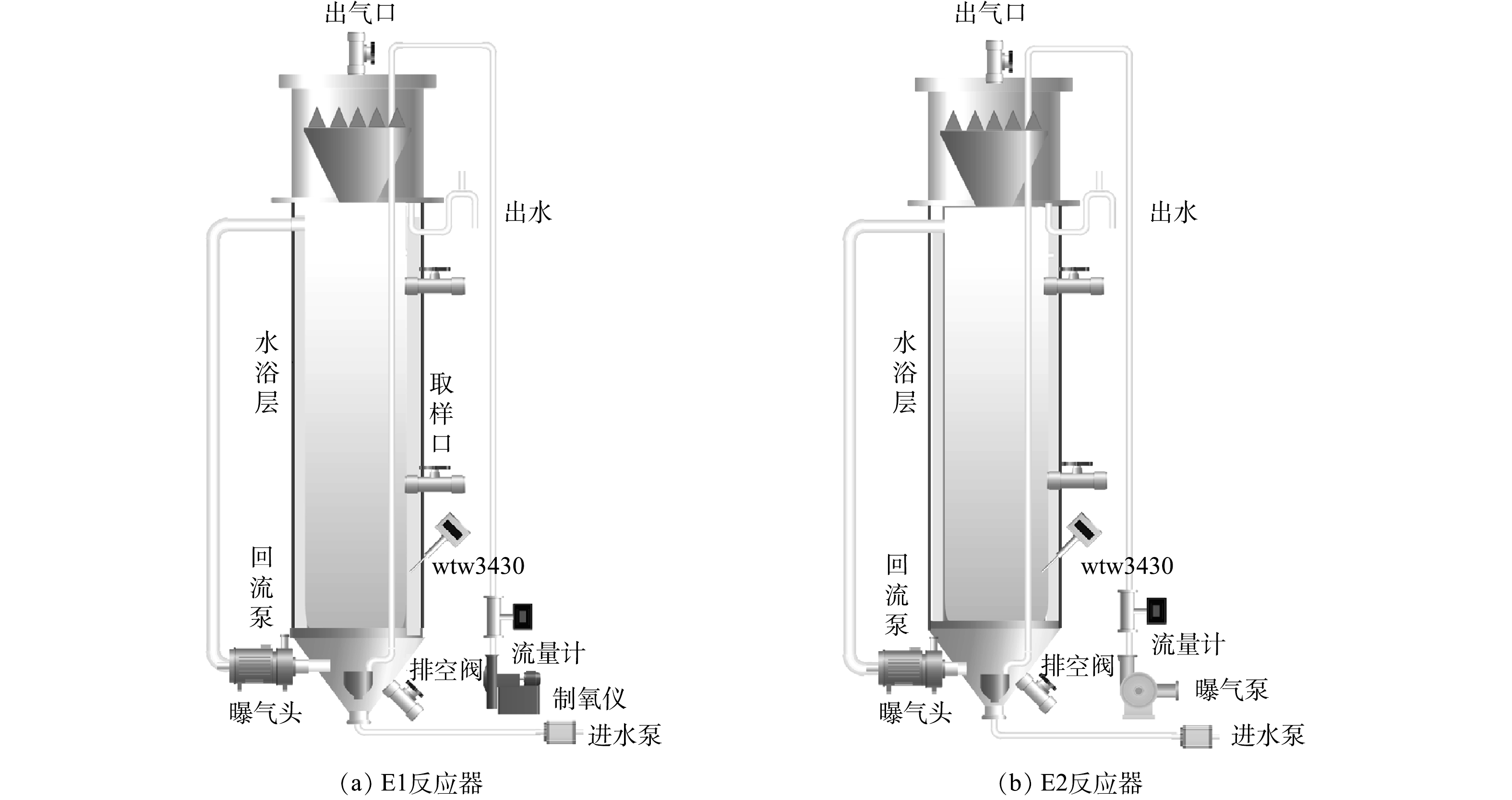
实验装置如图1所示,采用2套相同规格的小试EGSB(expanded granular sludge bed)反应器,E1反应器采用纯氧曝气,E2反应器采用空气曝气,2套反应器的其他配套装置相同。反应器主体为耐腐蚀有机玻璃材质,有效容积约为35 L;外设水浴加热套筒,通过实时温控维持反应器温度为(30±2) °C;反应器底部设有进水管、排泥管、回流管;主体反应区设有取样口,温度探头、DO探头等用于参数实时控制;反应区上部为三相分离器,用于气液固三相分离;分离器上方设有回流管、溢流堰、排水管及集气罩。反应器整体由锡箔纸包裹避光,以避免光照对于功能菌活性的影响以及光合藻类的生长。
反应器进水采用蠕动泵,稳流量进行基质供给,E1以制氧机进行氧气制备供给,E2以空气泵进行空气供给,采用连续曝气方式,通过气体流量计控制曝气量恒定;通过水浴套筒使反应器内部温度恒定在(30±2) °C。具体运行方式如表1所示。
-
接种污泥取自某厌氧氨氧化工艺的工程项目排泥,初始接种混合液悬浮固体(MLSS)质量浓度为6 000 mg·L−1,进水采用人工配制的模拟废水,分别以(NH4)2SO4和NaHCO3作为废水中
NH+4 -N和碱度的来源;营养液I和II作为营养物质:营养液I为5 000 mg·L−1 EDTA和5 000 mg·L−1 FeSO4;营养液II为15 000 mg·L−1 EDTA、430 mg·L−1 ZnSO4·7H2O、240 mg·L−1 CoCl2·6H2O、990 mg·L−1 MnCl2·4H2O、250 mg·L−1 CuSO4·5H2O、220 mg·L−1 Na2MoO4·2H2O、190 mg·L−1 NiCl2·6H2O、210 mg·L−1 Na2SeO4·10H2O和14 mg·L−1 H3BO4。营养液均按1.25 mL·L−1的质量浓度投加[24-26]。 -
在EGSB反应器中进行一段式短程硝化-厌氧氨氧化的启动与稳定运行,运行参数及策略如表1所示。通过精确控气与逐步提高进水
NH+4 -N与进水NO−2 -N的比值实现一段式短程硝化-厌氧氨氧化,通过活性测验测定2个反应器系统内各个菌种的反应活性;通过2个反应器的数据对比,分析不同气源曝气对一段式厌氧氨氧化工艺启动与运行的影响。 -
1) DO和pH均采用WTW在线测定仪测定;MLSS及MLVSS采用重量法测定,水样分析中
NH+4 -N的测定采用纳氏试剂光度法,NO−2 -N采用N-(1-萘基)乙二胺光度法,NO−3 -N采用紫外分光光度法,其余水质指标的分析方法均采用国标方法[27]。2)反应速率的测定。AOB反应速率测定:从2个反应器中各取400 mL泥水混合液,经去离子水淘洗后分别置于2个1 000 mL广口瓶中,定容至1 000 mL,维持温度为30 °C,进水
NH+4 -N为100 mg·L−1,充分曝入空气,每30 min取样测定活性。NOB反应速率测定:从2个反应器中各取400 mL泥水混合液,经去离子水淘洗后分别置于2个1 000 mL广口瓶中,定容至1 000 mL,维持温度为30 °C,进水NO−2 -N为50 mg·L−1,充分曝入空气,每30 min取样测定活性。3) AnAOB反应活性测定。从2个反应器中各取400 mL泥水混合液,经去离子水淘洗后分别置于2个1 000 mL广口瓶中,定容至1 000 mL,维持温度为30 °C,进水
NO−2 -N为50 mg·L−1,进水NH+4 -N为50 mg·L−1,缺氧搅拌,每30 min取样测定活性。最终测定MLSS和MLVSS。
1.1. 实验装置及运行条件
1.2. 接种污泥与模拟废水
1.3. 实验方法
1.4. 分析方法
-
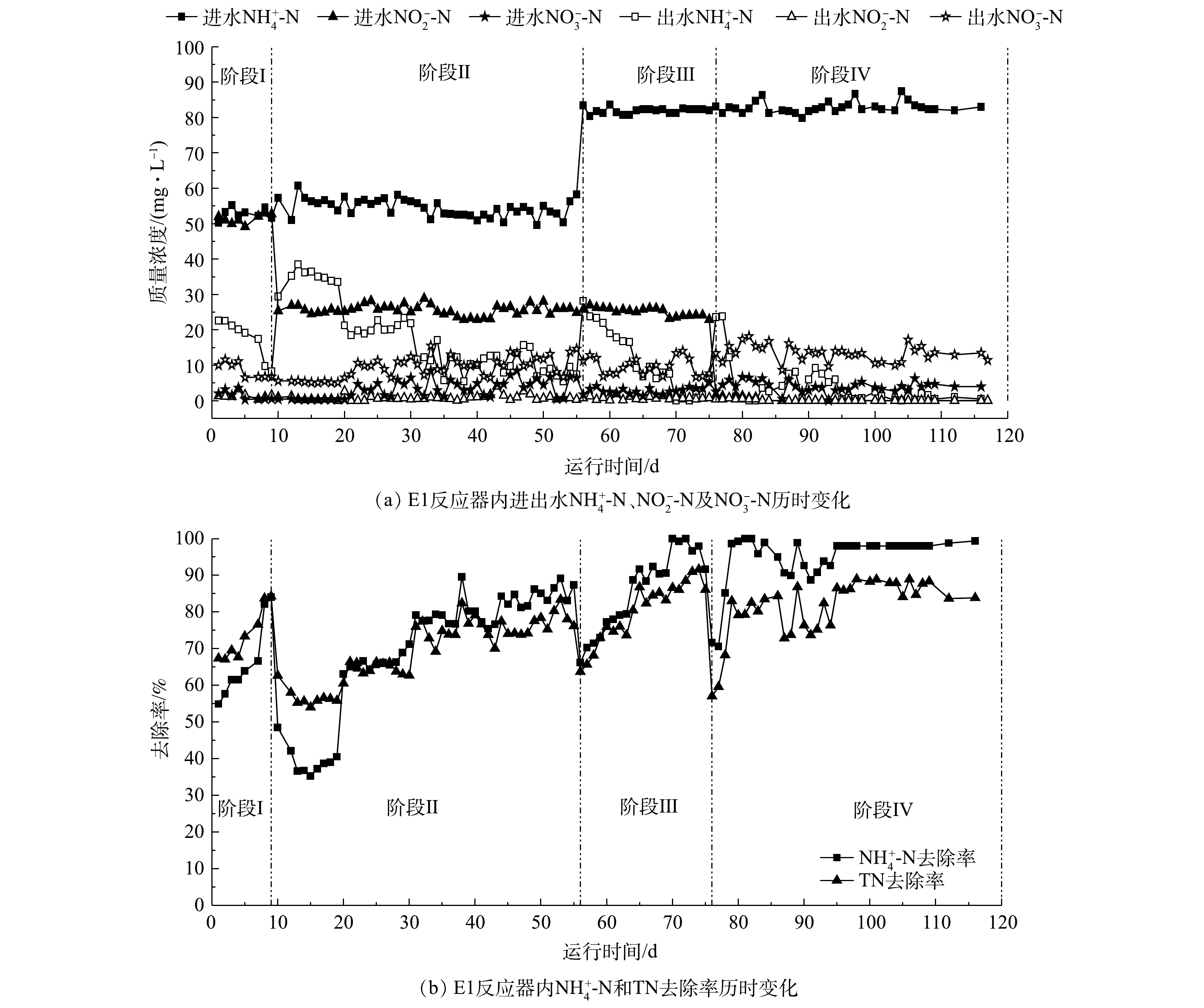
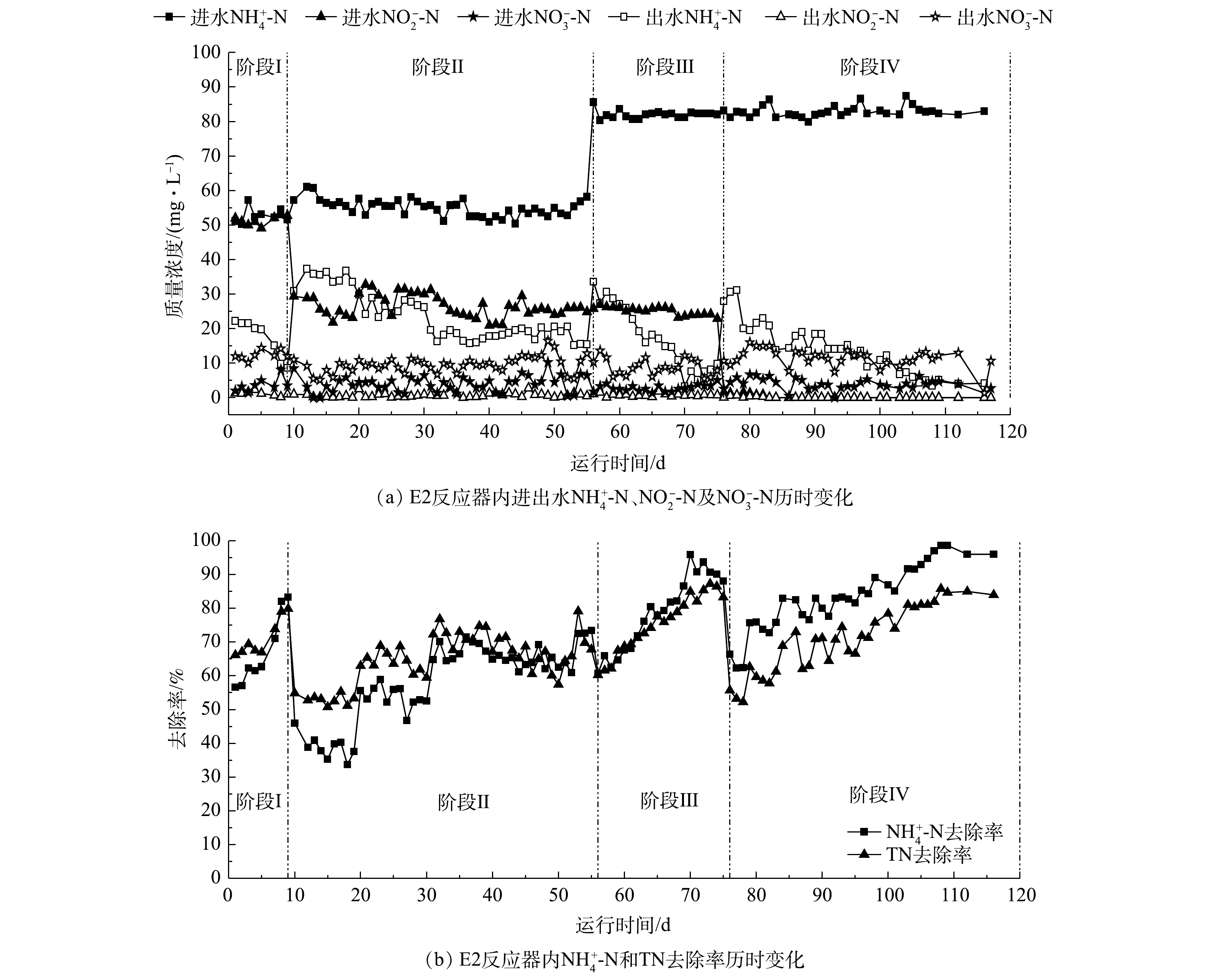
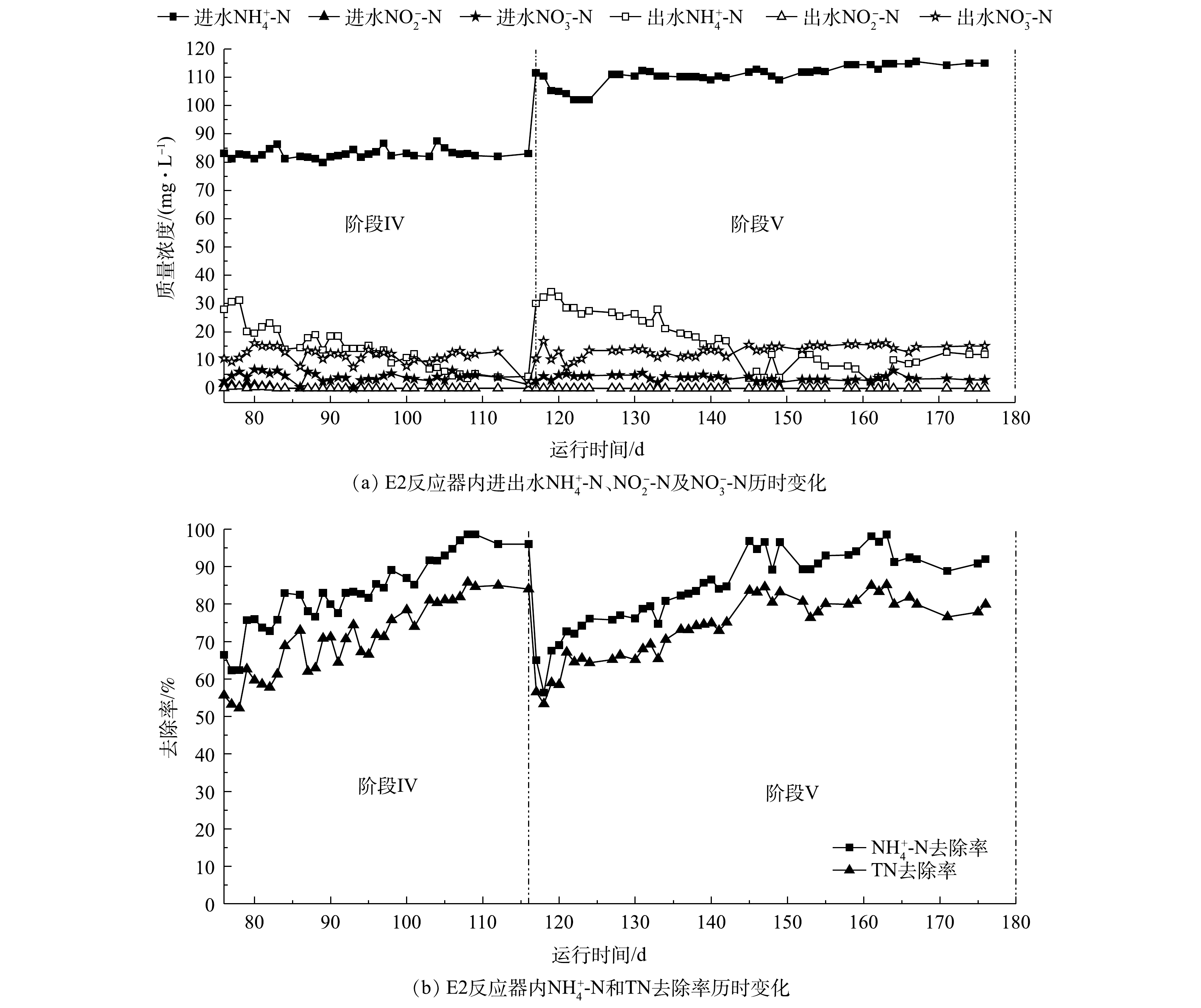
如图2~图4所示,经过116 d的驯化培养,通过逐步提高
NH+4 -N的进水负荷,降低NO−2 -N的进水负荷,配合精确控制供氧量,可成功将单纯的厌氧氨氧化工艺转化为完全的一段式短程硝化-厌氧氨氧化工艺。阶段Ⅰ(1~9 d)为anammox的驯化培养阶段,主要进水基质
NH+4 -N质量浓度为50 mg·L−1、NO−2 -N质量浓度为50 mg·L−1,E1和E2的曝气量分别控制在10 mL·min−1(氧气)和50 mL·min−1(空气)。如图2(b),图3(b)所示,反应器仅发生厌氧氨氧化反应,最终NH+4 -N和TN的去除率均在80%左右,但如图2(a),图3(a)所示,此时2反应系统内仍有10 mg·L−1出水NH+4 -N未被消耗,说明2反应器内AnAOB活性良好,AOB活性均有待提升。阶段Ⅱ(10~56 d)与阶段Ⅲ(57~76 d)为厌氧氨氧化工艺向一段式短程硝化-厌氧氨氧化工艺的过渡阶段。阶段Ⅱ主要进水基质
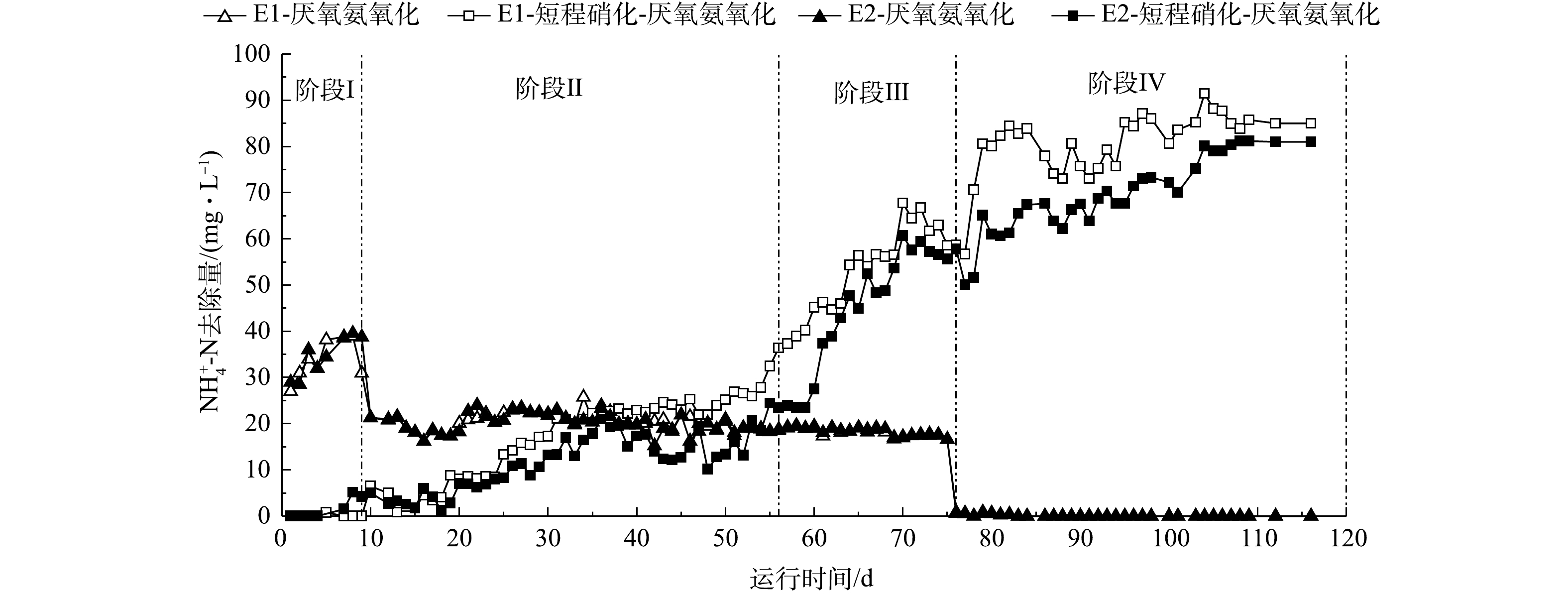
NH+4 -N质量浓度为50 mg·L−1、NO−2 -N质量浓度为25 mg·L−1,同时进行恒气量曝气,E1的曝气速率为15 mL·min−1(氧气),E2的曝气速率为 70 mL·min−1(空气),在不影响AnAOB活性的基础上驯化AOB的活性,并有效抑制NOB的活性。如图2(b)、图3(b)及图4所示,在阶段Ⅱ初期,2个反应器内出水NH+4 -N去除率仅为40%,而出水NO−2 -N基本为0,表明AOB活性不足是阻碍一段式短程硝化-厌氧氨氧化启动的主要原因;在第20和31 天,E1与E2反应器的NH+4 -N及TN去除率均有所提升,E1反应器的NH+4 -N去除率由40%提升至90%,而E2最终仅达到80%,E1和E2反应器内一段式短程硝化-厌氧氨氧化的NH+4 -N去除量分别达到36 mg·L−1和27 mg·L−1(图4),证明此阶段两反应器内AOB的活性有所提升;在阶段Ⅲ(57~76 d),将E1、E2反应器内的进水NH+4 -N提高至80 mg·L−1,进水NO−2 -N保持在25 mg·L−1,曝气量分别提高至25 mL·min−1(氧气)和130 mL·min−1(空气),在此阶段两反应器最终的NH+4 -N去除率在90%以上,TN去除率在80%以上,一段式短程硝化-厌氧氨氧化消耗NH+4 -N的质量浓度在50 mg·L−1以上。阶段Ⅳ(77~116 d)是完全的一段式短程硝化-厌氧氨氧化工艺,如图2及图3所示,保持进水
NH+4 -N的质量浓度为80 mg·L−1,停止在配水中投加NO−2 -N,继续以理论曝气量进行恒气量曝气,E1、E2均实现一段式短程硝化-厌氧氨氧化,2个反应器最终的氨氮去除率均在95%以上,总氮去除率均在85%以上,说明实现了一段式短程硝化-厌氧氨氧化工艺的启动。对比E1与E2反应器:在阶段Ⅱ,E1反应器在第31 天实现了近90%的
NH+4 -N去除率和80%的TN去除率,初步实现了AOB的驯养;E2反应器在第65 天才基本实现AOB的驯养;在阶段Ⅲ、Ⅳ,E1在7 d内完成了负荷提升,而E2的响应时间在25 d左右。在反应器的整个启动过程中,E1反应器在脱氮效果、启动速率上一直优于E2反应器,表明以氧气为气源启动一段式短程硝化-厌氧氨氧化工艺的效果更佳。这是因为纯氧曝气的氧转移速率是空气曝气的4.67倍[28],可快速恢复和增强水体中的好氧微生物的活力,因而E1反应器通过氧气曝气在抑制NOB的情况下迅速刺激AOB的增殖,实现了一段式短程硝化-厌氧氨氧化的快速启动。 -
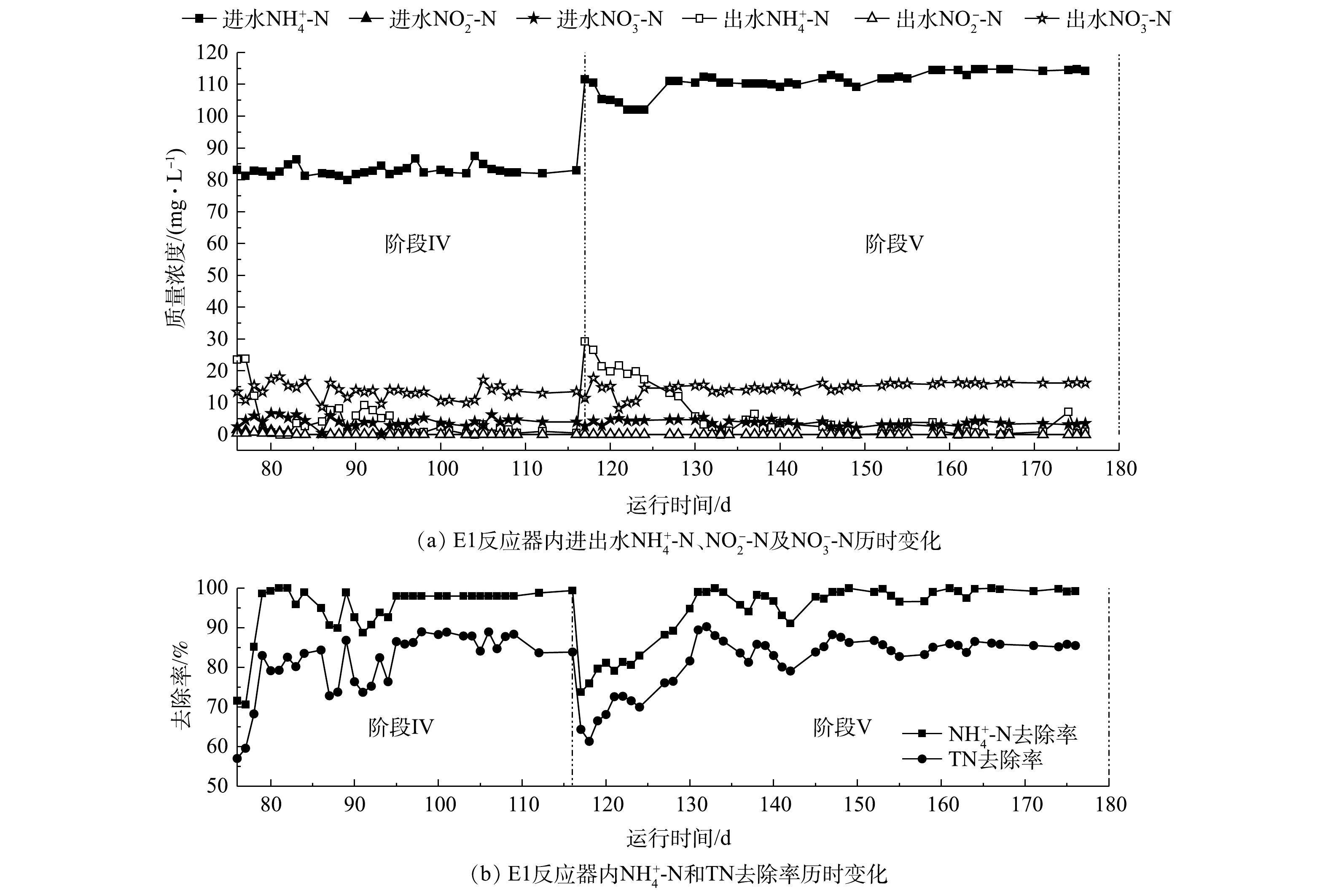
如图5和图6所示,两反应器的提升负荷与稳定运行用时100 d,在阶段Ⅳ(76~116 d)完成一段式短程硝化-厌氧氨氧化的启动;在阶段Ⅴ(117~176 d)将
NH+4 -N负荷提升至110 mg·L−1并长期运行。如图5(b)和图6(b)所示,在阶段Ⅳ,两反应器完成一段式短程硝化-厌氧氨氧化的启动后,NH+4 -N去除率均在95%以上,TN去除率均在85%左右,说明一段式短程硝化-厌氧氨氧化效果良好;而在阶段Ⅴ,将系统进水NH+4 -N的质量浓度提升至110 mg·L−1,E2反应器通过25 d的响应完成负荷提升,NH+4 -N去除率稳定在90%~95%,TN去除率在75%~85%,且如图6(a)所示,在第145天出水NH+4 -N开始出现波动;E1反应器在10 d内完成负荷提升,NH+4 -N去除率在95%以上,TN去除率为85%,在长达60 d的运行过程中,E1反应器表现出了更高的去除效率和更稳定的运行工况。这是因为纯氧曝气对比空气曝气,具有氧传递速率高、抗冲击负荷好等优点[17],因而在以氧气作为曝气气源的一段式短程硝化-厌氧氨氧化工艺的负荷提升与运行过程中,氧气曝气的反应系统在提升负荷时响应速度更快、抗冲击负荷能力更好且系统运行更加稳定。 -
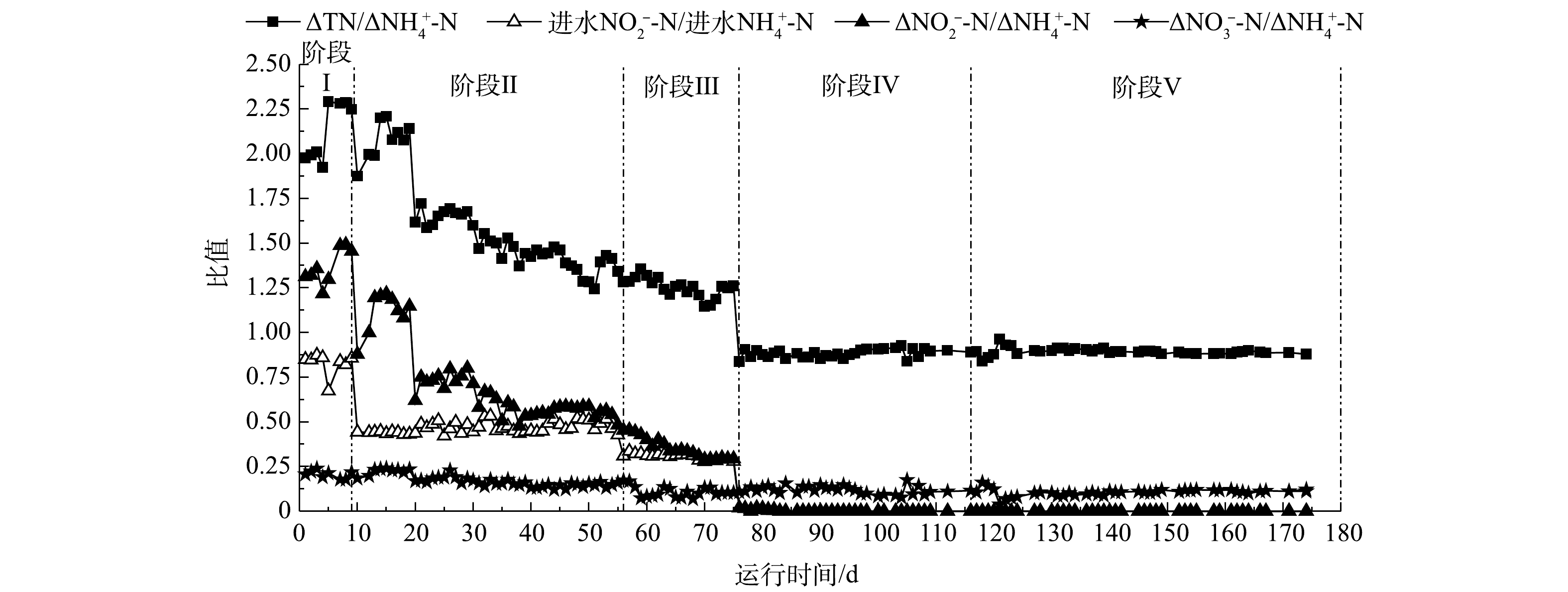
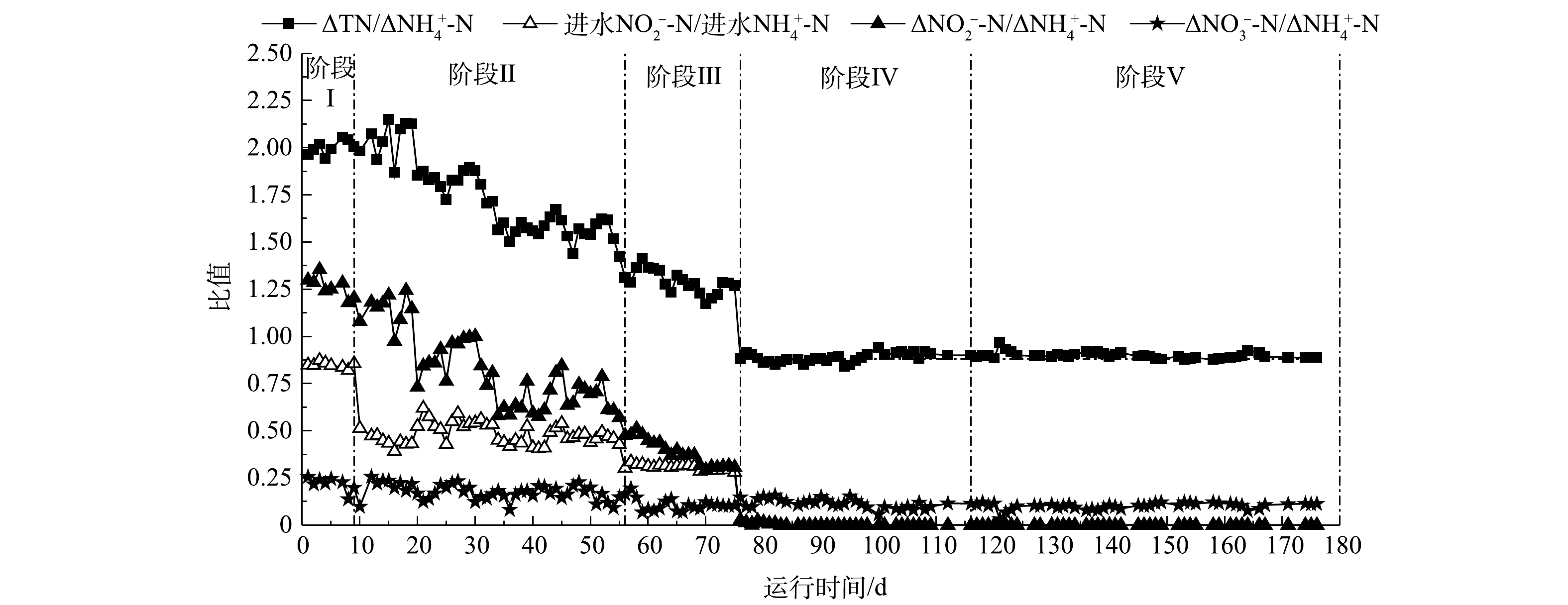
实验过程中对两反应器各阶段的化学计量比进行分析:一段式短程硝化-厌氧氨氧化的2个特征化学计量比值(ΔTN/Δ
NH+4 -N和ΔNO−3 -N/ΔNH+4 -N)的理论值分别为0.88和0.11[29-30]。当反应系统一段式短程硝化-厌氧氨氧化程度越高,其ΔTN/ΔNH+4 -N的比值越接近0.88,当ΔNO−3 -N/ΔNH+4 -N接近于0.11,证明NOB活性越低。当NOB活性上升时,ΔNO−3 -N/ΔNH+4 -N的比值将高于0.11。厌氧氨氧化反应也存在有2个特征化学计量比值(ΔNO−2 -N/ΔNH+4 -N、ΔNO−3 -N/ΔNH+4 -N),其理论值分别为1.32和0.26。通过这些特征化学计量比值的变化可以判断反应器中占优的脱氮途径,从而推测不同脱氮途径在反应器中的演变过程。如图7与图8所示,在阶段Ⅰ,两反应器内进行厌氧氨氧化反应,由于工况复杂,Δ
NO−2 -N/ΔNH+4 和ΔNO−3 -N/ΔNH+4 -N的实际值分别在1.25和0.24左右,与理论的1.32和0.26有一定差异;阶段Ⅱ和阶段Ⅲ为两反应器由厌氧氨氧化向一段式短程硝化-厌氧氨氧化的过渡阶段,随着进水NO−2 -N/进水NH+4 -N的比值降低,ΔNO−2 -N/ΔNH+4 -N逐步靠近进水NO−2 -N/进水NH+4 -N的比值,说明两个反应系统逐渐由单纯的厌氧氨氧化向一段式厌氧氨氧化转化。在进水NO−2 -N/进水NH+4 -N下降到0之后,两反应器开始进行完全的一段式短程硝化-厌氧氨氧化反应;在阶段Ⅳ和Ⅴ,当进水NO−2 -N/进水NH+4 -N变为0时,E1反应器内ΔTN/ΔNH+4 -N和ΔNO−3 -N/ΔNH+4 -N分别稳定保持在0.88和0.11左右,且在提升负荷和气量时比值未发生变化,表明NOB被有效抑制,一段式短程硝化-厌氧氨氧化活性极高。赵良杰[31]研究的反应系统内ΔNO−3 -N/ΔNH+4 -N一直在0.15左右,NOB保有一定的活性,在提高负荷与供氧量后NOB开始生长繁殖,最终成为优势菌种;杨晓欢[32]发现在每次提升负荷及提高气量时会有ΔNO−3 -N/ΔNH+4 -N升高的现象。与之相比,本研究中E1反应器的一段式短程硝化-厌氧氨氧化更加稳定。 -
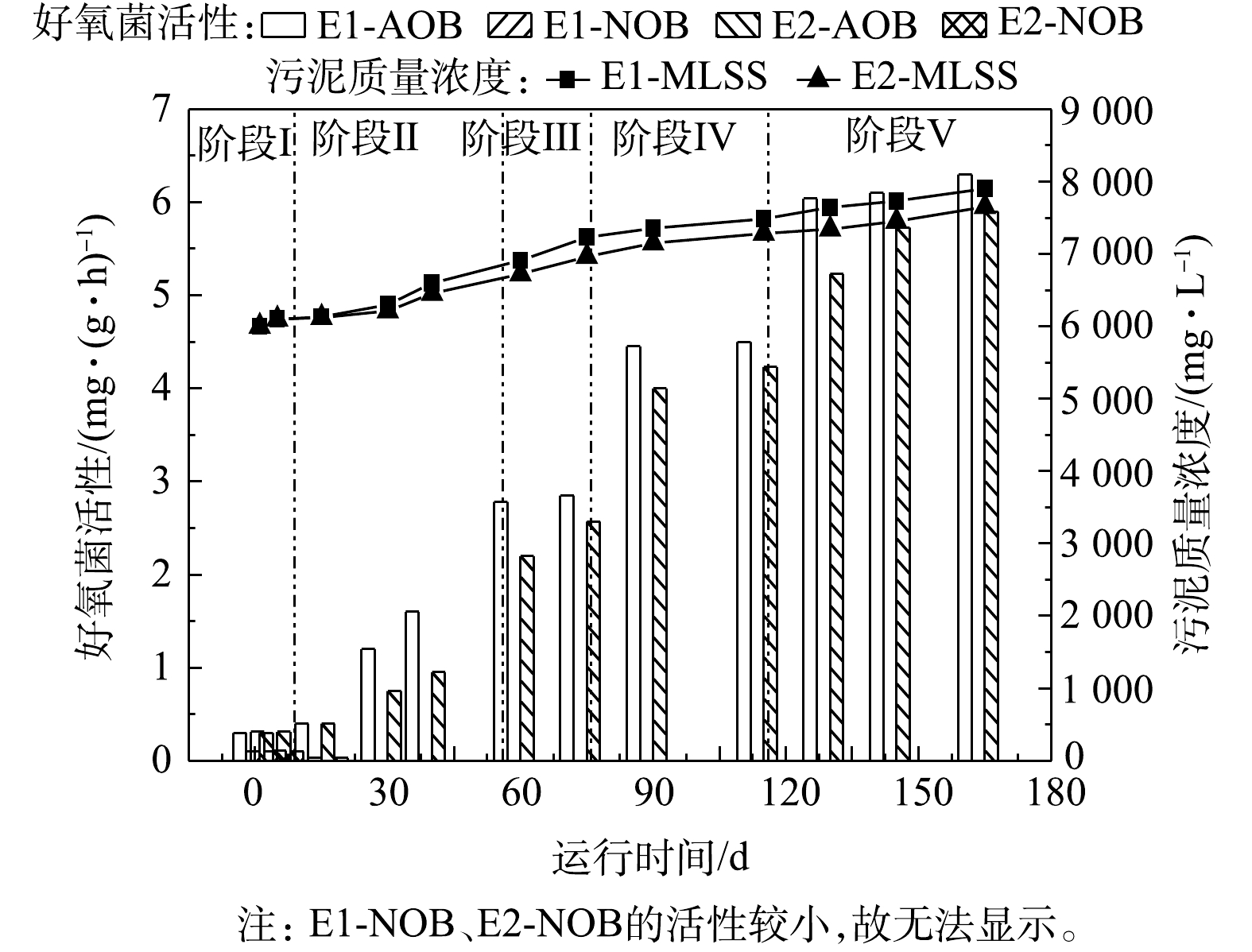
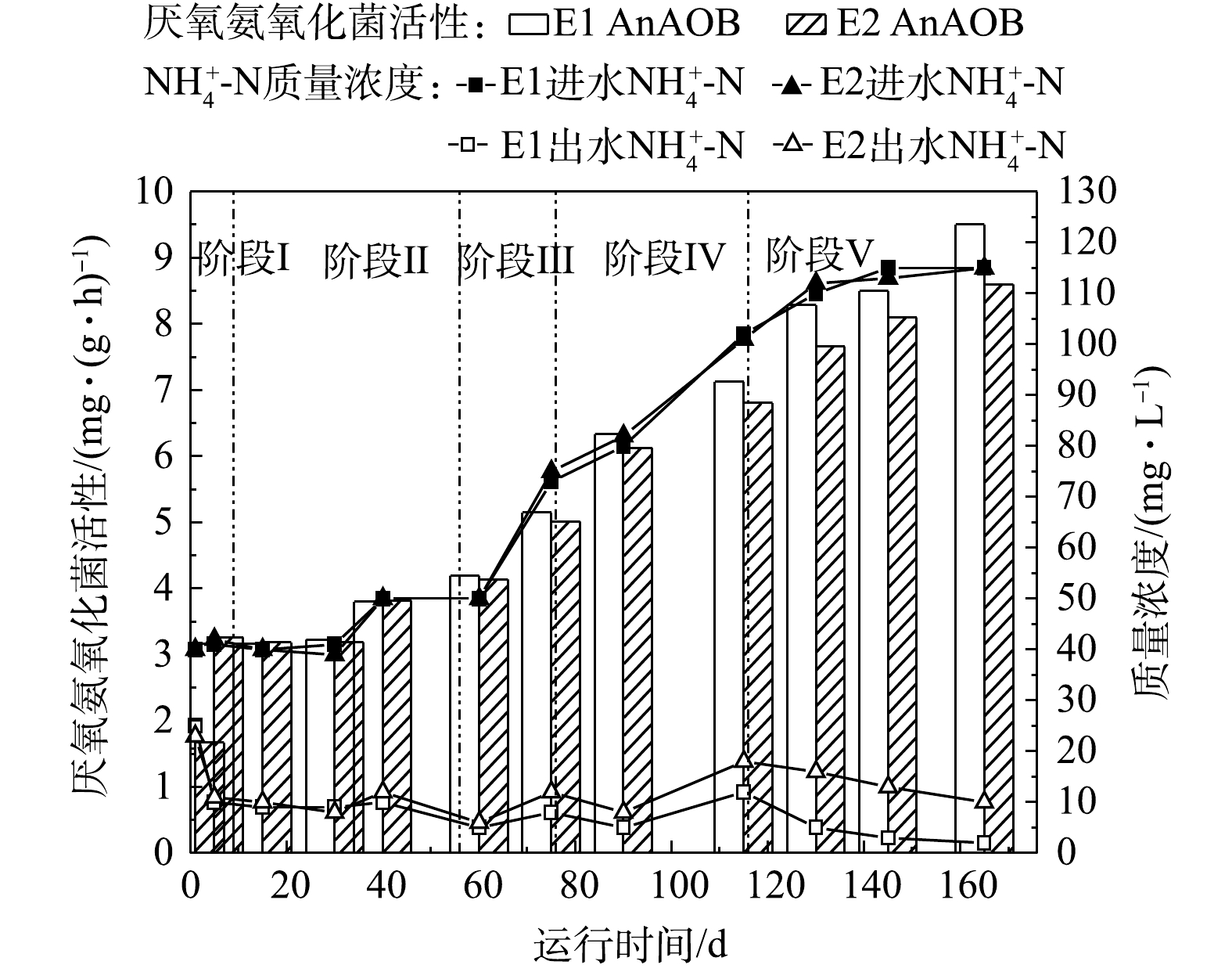
分别在第1、5、15、30、40、60、75、90、115、130、145 天测定两反应器的污泥质量浓度,通过烧杯实验测定反应器内各菌种的反应活性,结果如图9和图10所示。两反应器的污泥质量浓度由6 000 mg·L−1增长到7 800 mg·L−1,NOB活性基本被完全抑制,而AOB活性随着反应器的运行负荷增加而逐渐提升,E1、E2反应器内AOB的活性由0.3 mg·(g·h) −1分别提升至6.3 mg·(g·h)−1和5.9 mg·(g·h)−1,反应系统在实现NOB有效抑制的前提下,完成了AOB的驯化培养。E1、E2反应器的AnAOB活性由最初的1.5 mg·(g·h)−1分别提升至9.5 mg·(g·h)−1和8.6 mg·(g·h)−1。
在本研究中,随着反应进行,E1和E2反应器中的AnAOB和AOB活性均呈上升的趋势,而NOB活性受到抑制,表明反应系统内AOB与AnAOB形成了良好的协同作用;在各阶段,E1反应器中的AnAOB和AOB的活性均高于E2反应器,E1中AOB和AnAOB活性最终分别达到6.3 mg·(g·h)−1和9.5 mg·(g·h)−1。张凯等[33]对AnAOB进行培养时发现,AnAOB活性由初期的0.615 mg·(g·h)−1提升至7.74 mg·(g·h)−1。李冬等[34]研究CANON反应速率以及anammox速率变化与曝气密度的关系时发现,在曝气密度为3时anammox速率最高,为10.6 mg·(g·h)−1。杨京月等[35]在对AnAOB进行活性批次实验中发现,AnAOB对
NH+4 -N和NO−2 -N去除活性最高分别为0.106 kg·(kg·d)−1和0.169 kg·(kg·d)−1。MIAO等[36]在间歇曝气时发现AnAOB活性持续升高,由第105天的0.59 mg·(g·h)−1提升至第283 天的1.23 mg·(g·h)−1。与上述研究结果对比,在本研究中,AnAOB在E1反应器内活性提升速率以及活性峰值均有一定优势,表明以氧气为气源的E1反应系统更能刺激AOB与AnAOB的活性,使系统具有良好的稳定性与较高的脱氮效率。
2.1. 曝气方式对启动的影响
2.2. 不同曝气气源对系统负荷提升的作用效应
2.3. 反应系统化学计量比分析
2.4. 一段式短程硝化-厌氧氨氧化的启动与运行过程的活性分析
-
1)经过176 d的驯养,两反应器可成功实现一段式短程硝化-厌氧氨氧化的启动与稳定运行。其中,E1反应器
NH+4 -N去除率在95%以上,TN去除率在85%以上,其脱氮效能、响应速度和稳定性均优于E2反应器。2)以氧气为气源的E1反应器在实现一段式短程硝化-厌氧氨氧化后,其ΔTN/Δ
NH+4 -N和ΔNO−3 -N/ΔNH+4 -N稳定在0.11及0.88,在长期运行中表现出了极佳的稳定性。3)通过活性测定实验对两反应器内测定各菌种活性,E1反应器内NOB活性基本被抑制,AOB和AnAOB的活性分别提升至6.3 mg·(g·h)−1和9.5 mg·(g·h)−1。













 下载:
下载: