厌氧消化因其可将有机质转化为甲烷,已成为餐厨[1]、污泥[2]等有机废弃物以及高浓度有机废水处理[3]的主流技术。与中温 (35 ℃) 条件相比,高温 (55 ℃) 反应具有速率快、甲烷产率高以及病原体灭活效果好等优势[4]。然而在厌氧消化过程中,水解产酸速率大于产甲烷速率,高温条件会进一步加剧水解产酸与产甲烷过程的不平衡,造成挥发性脂肪酸 (volatile fatty acids,VFAs) 的过量积累,从而导致体系pH下降以及微生物代谢体系失衡,限制了高温厌氧消化系统的高效稳定运行。
研究表明,乙酸和丙酸是有机废弃物发酵过程最易积累的VFAs,其在酸化体系的总VFAs中的占比分别可达70%以上[5]。相较乙酸而言,虽然丙酸占比较低,但其生物毒性导致其在厌氧消化过程中降解较为困难。AMANI等[6]的研究发现,在高温条件下使用间歇式厌氧反应器处理剩余污泥,反应初始丙酸就在体系内积累,并且在第50 d反应结束时仍有40%~60%未被降解。高温条件下,89%的甲烷都被证实来自于乙酸的互营氧化途径[7],即在乙酸氧化菌和氢营养型产甲烷菌共同作用下以H2为电子载体的产甲烷过程,也被称为种间氢转移 (interspecies hydrogen transfer,IHT) 过程。研究表明IHT一般要在氢分压低于10−5 atm的条件下才能自发进行[8],然而过低的氢气浓度则不利于产甲烷菌维持其代谢活性,因此体系氢分压需要保持在一个合适的范围内。丙酸的甲烷化需要经历乙酸化与产甲烷即“两阶段”的互营氧化过程,其在热力学上可能更易受氢分压影响。因此,如何强化乙酸、丙酸的互营产甲烷过程是实现高温高负荷下厌氧消化系统稳定运行的关键。
近年来,随着直接种间电子转移 (direct interspecies electron transfer,DIET) 现象在厌氧消化系统中共同培养G. metallireducens和G. sulfurreducens时被发现[9],许多研究表明向厌氧消化系统中投加石墨[10]、磁铁矿[8]和生物炭[11]等导电材料强化更高效的DIET过程能够实现VFAs的快速降解。其中,生物炭可由有机废弃物制得,具有成本低廉、绿色环保等优势。在LI等[12]投加生物炭到苯酚降解产甲烷批次实验的研究中,生物炭可通过自身导电性和表面的氧化还原官能团触发DIET并强化互营氧化菌之间的电子传递,从而促进苯酚降解产甲烷并加快最大产甲烷速率。在LI等[13]针对餐厨垃圾与活性污泥共消化的研究中,生物炭可在高温厌氧消化系统中富集与DIET相关的菌属Methanosaeta和Methanosarcina。虽然现阶段的研究通常将生物炭对互营产甲烷的促进作用归因于DIET的作用,但生物炭能否通过改善热力学条件而强化IHT过程仍有待深入研究。当前,通过建立微生物生长动力学模型[14],以及过程热力学分析能够解析添加导电材料时的作用机制和能量代谢[15-16]。基于此,利用两阶段的微生物生长动力学及过程热力学解析,探明生物炭对反应过程热力学条件的改善以及微生物生长的影响对于解析生物炭的强化机制具有重要意义。
本研究拟通过生物炭介导下不同负荷乙酸与丙酸的高温互营产甲烷批次实验,并结合Gompertz方程与Monond方程分析,研究生物炭对于降解产甲烷以及微生物生长动力学影响。此外,还通过亨利定律计算反应过程的自由能,明晰生物炭促进IHT过程的热力学强化作用。结合生物炭性质探讨其增促互营产甲烷的作用机制,并为生物炭在厌氧消化中进一步的实际应用提供参考。
1. 材料与方法
1.1 生物炭的制备与表征
本研究制备生物炭所用的原材料木屑来自西安市某木材加工厂。将木屑在玻璃方舟内压实后放入管式气氛炉内保持无氧500 ℃下热解2 h,制得木屑生物炭。清洗表面灰分,烘干后筛选直径为0.25~1 mm颗粒,密封保存备用。
生物炭的理化性质与电化学性质见表1。生物炭产率依据原始木屑与最终所得生物炭样品的质量百分比计算;生物炭中固定碳、挥发性炭以及灰分的质量分数根据国家标准《木炭和木炭实验方法》 (GB/T 17664-1999) [17]测定;将生物炭配置为5%的炭水混合液,在室温下以100 r·min−1震荡24 h,使用便携式pH计 (pH-11B,日本Horiba公司) 测定混合液pH;比表面积由比表面积测试仪 (V-Sorb X800,北京金埃谱科技有限公司) 测定;元素组成由同位素质谱仪 (IsoPrime100,德国Elementar公司) 测定;将生物炭烘干研磨成粉末压片后采用傅里叶变换红外光谱分析仪 (Nicolet iS50,美国ThermoFisher公司) 测定官能团;对生物炭喷金处理后利用扫描电子显微镜 (quanta F50,美国FEI公司) 对生物炭表面形貌进行观察;用粉末电阻测定仪 (ST2722,苏州晶格电子有限公司) 使用四探针法测定生物炭导电性;电子交换容量通过电化学工作站 (CHI660E,上海辰华仪器有限公司) 进行测试。
1.2 种泥性质
本实验的接种污泥取自以餐厨垃圾为基质驯化的实验室稳定运行的CSTR反应器。实验前将接种泥取出,使用配制的营养液洗涤后加入500 mg·L−1葡萄糖为基质厌氧条件下放入55 ℃摇床中驯化14 d。装瓶前测定接种泥基本性质见表2,餐厨与营养液的组成成分参考了文献[18]。
1.3 生物炭对乙酸和丙酸的动力学影响
为了探究高温条件下生物炭对乙酸和丙酸互营产甲烷过程的动力学影响,研究分别以1 000、3 000、5 000、8 000和10 000 mg·L−1 (以COD计) 的乙酸、丙酸为基质。首先在120 mL血清瓶内分别加入50 mL接种泥以及0.5、1.5、2.5、4和5 mL浓度为200 g·L−1的基质储备液,使体系内基质与接种污泥的比例 (F/M) 分别为0.25、0.75、1.25、2和2.5,加水补充有效容积至100 mL,用橡胶塞和铝盖将血清瓶密封压实后,通入氮气2 min使瓶中维持厌氧。之后放入55 ℃恒温水浴摇床中,达到设定温度后使用玻璃注射器排出瓶内热胀冷缩产生的气体压力。实验组中生物炭投加量为10 g·L−1[18],各组均设置平行对照组。加碳组记为BC组,控制组即不加碳组记为CT组。每天测定气量、气组进行产甲烷情况分析,直至产气量小于累计产气量的1%时结束反应。
1.4 生物炭对乙酸和丙酸的热力学影响
在上述实验过程中,根据累计产气量情况在反应过程中间隔时间取样测定VFAs以及INT-ETS活性等指标。根据所测得的气体组分分压以及VFAs质量浓度等计算8 000 mg·L−1反应过程内各点热力学自由能值,用于分析生物炭对产甲烷过程热力学的影响。
1.5 物化分析方法
用5、20和50 mL玻璃注射器测量产气体积。CH4、CO2、N2和H2采用气相色谱法 (GC-PE680,美国peClarus公司) ,填充色谱柱固定相 (Porapak Q) 进样口温度为130 ℃,柱温箱温度为140 ℃,TCD温度为160 ℃,载气为氩气,流速4 mL·min−1;气体产量采用气体流量计;VFAs采用气相色谱 (GC-2014,日本Shimadzu公司) ,色谱柱为DB-FFAP,FID检测器温度为230 ℃,进样口温度为200 ℃,程序升温至100 ℃保持2 min,以10 ℃·min−1的速率上升到120 ℃并保持2 min,再以5 ℃·min−1的速率上升到200 ℃并保持2 min。总固体 (TS) 、挥发性固体 (VS) 采用重量法测定。碱度采用滴定法测定。混合液pH使用便携式pH计 (pH-11B,日本Horiba公司) 测定。体系内INT-ETS活性变化用氧化还原法[19]进行测定。
1.6 动力学特性解析
使用Gompertz方程对产甲烷结果进行拟合,得到产甲烷过程的动力学参数。Gompertz方程如式(1)[20]所示。
式中:P为某阶段t时刻产甲烷潜能,mL;P0为最大产甲烷潜能,mL;Rmax为最大产甲烷速率,mL·d−1;e=2.718281828;t0为延滞期,d;t为反应时间,d。
厌氧消化过程假设底物消耗为100%,微生物生长根据式(2) [14]进行计算。
式中:fe是微生物细胞合成电子的占比;fs是微生物细胞合成能量的占比, (fe+fs=1) ;CnHaOb代指反应碳源底物;NH3为反应氮源底物;C5H7O2N代指微生物生长所增加的细胞物质。
利用微生物生长与产甲烷的化学计量关系,可以计算出微生物的特定生长速率,如式(3) [14]所示。
式中:μ是特定的微生物生长速率;
dVCH4
 /dt为产甲烷速率,mg·d−1;X表示反应前后生物质质量浓度差,mg·L−1。
/dt为产甲烷速率,mg·d−1;X表示反应前后生物质质量浓度差,mg·L−1。
对上式进行非线性回归数据拟合,通过Monod方程进一步得到生长动力学参数,常用于描述微生物的生长,表示了底物浓度和微生物比生长速率之间的关系,如式(4) [14]所示。
式中:μm为最大比生长速率,d−1;Ks为底物半饱和常数,mg·L−1;S是底物质量浓度,mg·L−1。
根据单一反应的微生物生长计算模型[21-22],带入微生物生长速率公式和Monod方程中可以得到VFAs降解乙酸化与甲烷化过程微生物生长动力学参数,如式(5)~式(10)所示。
式中:fa为VFA用于生成乙酸的部分占比;fs1为VFA用于细胞生长的部分占比;C5H7O2N代指微生物生长所增加的细胞物质;NH3为反应氮源底物。
式中:dX1/dt为乙酸化微生物生长速率,d−1;dAcetate/dt为乙酸降解速率,mg·L−1·d−1;X1表示乙酸化反应前后生物质质量浓度差,mg·L−1。
式中:VFA为反应过程相应VFAs质量浓度,mg·L−1;μm1为拟合得到产乙酸过程微生物的最大增殖速率,d−1;Ks1为拟合得到产乙酸过程微生物的半饱和系数,mg·L−1。
式中:fCH4为乙酸用于生成甲烷的部分占比;fs2为乙酸用于细胞生长的部分占比;C5H7O2N代指微生物生长所增加的细胞物质;NH3为反应氮源底物。
式中:dX2/dt为产甲烷微生物生长速率,d−1;dCH4/dt为产甲烷速率,mL·d−1;X2表示产甲烷反应前后生物质质量浓度差,mg·L−1。
式中:Acetate为反应过程相应乙酸质量浓度,mg·L−1;μm2为拟合得到产甲烷过程微生物的最大增殖速率,d−1;Ks2为拟合得到产甲烷过程微生物的半饱和系数,mg·L−1。
1.7 热力学特性解析
本研究所涉及的反应方程与标准反应条件下吉布斯自由能见表3[23],对于式(11)所示的反应,实际反应吉布斯自由能的计算方法如式(12) [24]所示。
式中:ΔG是实际的吉布斯自由能;ΔGθ是在298 K和1 atm下的标准吉布斯自由能;R是普适气体常数,8.314 J·mol−1·K−1;T为实际温度,K;A、B、C、D为水相中各个物质浓度,mol·L−1;a、b、c、d为相应物质的化学计量数。
H+浓度由pH测得计算,反应中HCO3−浓度由碱度测得计算,如式(13) [25]所示。
式中:BA为碳酸盐碱度,g·L−1。
气体在液体体系内的溶解浓度由亨利定律计算,如式(14) [26]所示。
式中:c为某一物质在水相中的浓度,mol·L−1;H为亨利溶解度,mol·L−1·atm−1;p为该组分在气相中的分压,Pa。
2. 结果与讨论
2.1 生物炭对乙酸和丙酸互营产甲烷过程的影响
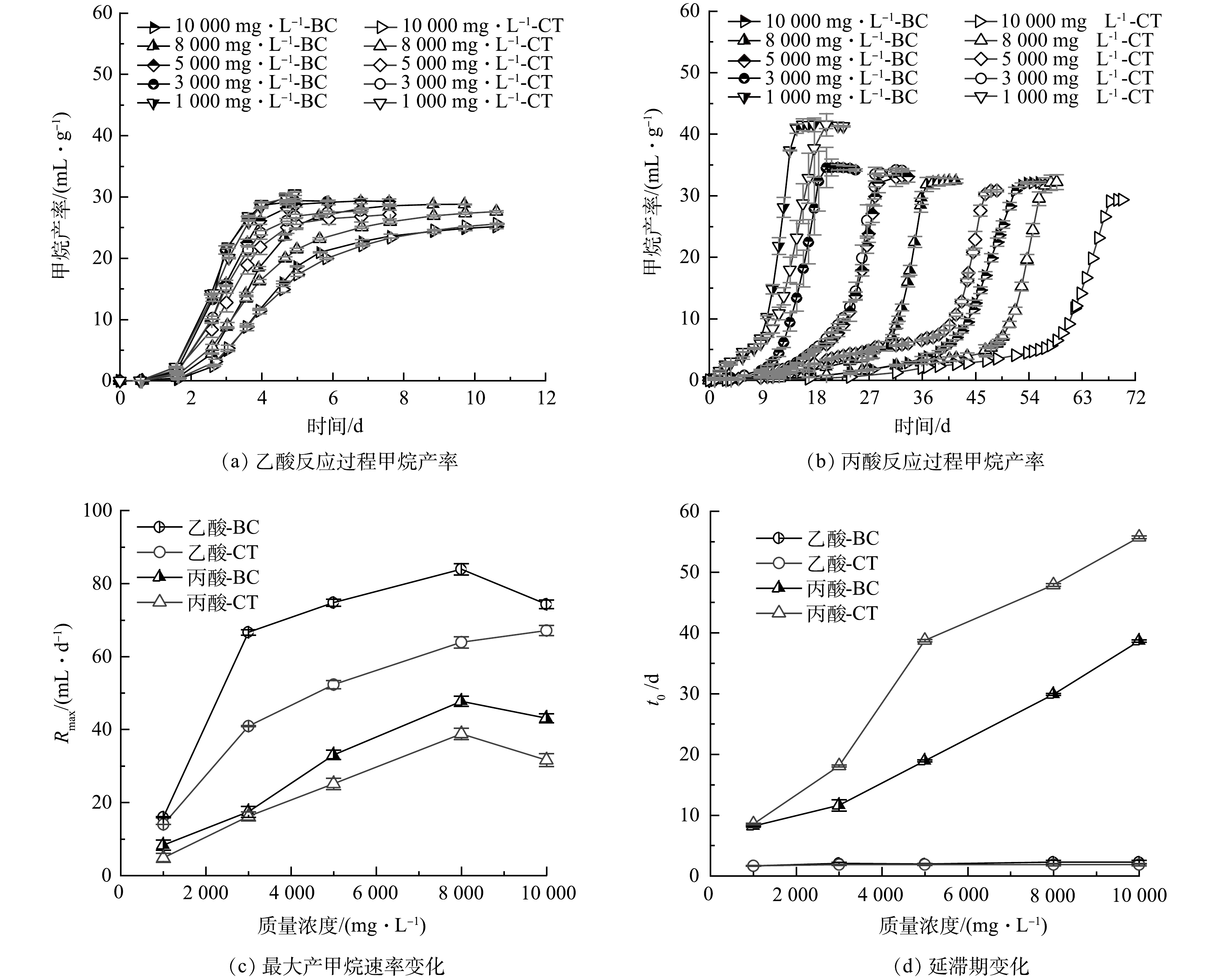
1) 不同质量浓度下乙酸和丙酸的产甲烷特性。图1(a)和图1(b)所示为乙酸和丙酸在高温情况下BC组和CT组不同质量浓度梯度实验的甲烷产率,可以看出,随着底物质量浓度梯度的增加,反应周期随之增加,甲烷产率随之下降,这可能是由于负荷升高从而影响微生物活性导致的[27]。添加生物炭明显促进了乙酸和丙酸降解产甲烷反应,但是对于丙酸的促进效果更显著,这是由于生物炭显著加快了丙酸反应进程导致的。此外,生物炭有利于互营氧化反应增效。丙酸代谢需完全依靠互营氧化过程,对乙酸而言虽然高温下以乙酸氧化 (syntrophic acetate oxidation,SAO) 为主,但乙酸裂解 (acetoclastic methanogenesis,AM) 过程仍然存在,这可能是丙酸增效更为明显的原因。采用Gompertz方程对累计产甲烷量拟合得到反应过程动力学参数见图1(c)和图1(d),可知:与CT组相比,BC组的最大产甲烷速率大大提升,1 000~10 000 mg·L−1的乙酸和丙酸的产甲烷速率分别提高了10.7%~62.8%和7.7%~36.4%,3 000 mg·L−1的乙酸最大产甲烷速率可达CT组的1.6倍。同时添加生物炭可以有效地使丙酸反应BC组t0缩短0.3~20 d,有利于产甲烷反应的快速进行。生物炭的添加明显促进了乙酸和丙酸互营产甲烷反应,而生物炭对于乙酸与丙酸产甲烷过程促进的差异可能是由于在高温下反应链延长所导致的[20],特别是在需要“两阶段”步骤才能产甲烷的丙酸反应中。
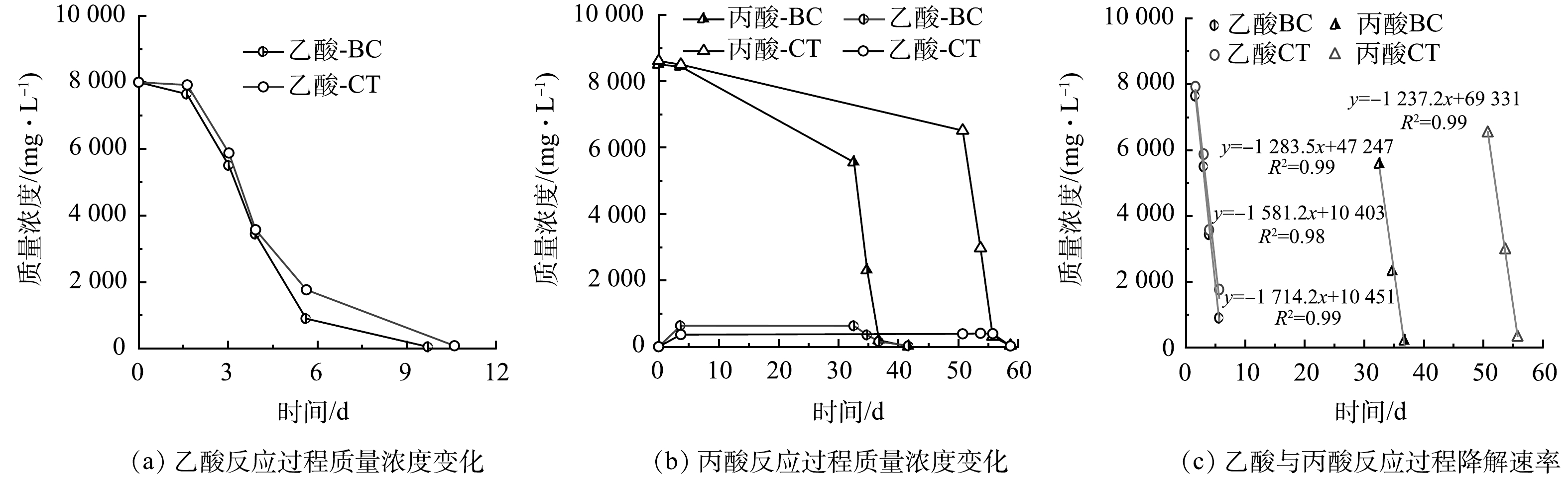
2) 乙酸和丙酸的降解特性。图2为生物炭促进效果明显且无质量浓度抑制的8 000 mg·L−1降解反应过程乙酸和丙酸质量浓度变化和降解速率。图2(a)所示在同一反应时间下,BC组乙酸质量浓度仅为CT组的51.0%~96.5%。对快速降解阶段质量浓度梯度接近于直线的部分进行线性拟合可知,CT组最大降解速率为1 581.2 mg·L−1·d−1,而BC组可达1 714.2 mg·L−1·d−1,生物炭使得乙酸降解速率提高了8.4%。图2(b)所示由于丙酸难降解而导致反应周期大大延长,CT组完全结束反应需59 d,而BC组仅需要42 d,说明生物炭加速了丙酸降解反应进程。图2(c)显示,CT组丙酸最大降解反应速率为1 237.2 mg·L−1·d−1,BC组为1 283.5 mg·L−1·d−1,生物炭使得丙酸降解速率提高了3.7%。
综上,生物炭对乙酸互营产甲烷效率的提升可归因于对乙酸降解的促进,而对丙酸互营产甲烷过程而言则是由于促进了丙酸的乙酸化过程,但更大程度地应归因于其促进了丙酸的甲烷化过程。丙酸降解过程中没有乙酸积累,所以乙酸化过程则是丙酸互营产甲烷的限速步骤。
2.2 生物炭介导下乙酸和丙酸互营产甲烷的微生物动力学特征
表4为产乙酸菌和产甲烷菌的最大比生长速率μm和半饱和系数Ks以及加碳组与控制组的差∆。对乙酸反应而言,生物炭促进了产甲烷过程的微生物生长与对体系的适应。与CT组相比,BC组μm2增加了48.1%,意味着生物炭提高了乙酸产甲烷过程微生物的增殖速率从而强化反应进行;Ks2减少了65.8%,说明生物炭使得体系内微生物更快的适应环境,即乙酸更快被利用而加快反应进程。生物炭对于乙酸互营产甲烷过程的微生物生长有明显的强化作用。与产甲烷速率结果相似,丙酸μm2小于乙酸μm2,且仅为乙酸μm2的29.6%,这说明丙酸抑制了原本较快的产甲烷微生物生长;丙酸Ks2远远大于乙酸Ks2,与产甲烷t0趋势相对应。生物炭使丙酸BC组μm2相比于CT组提升了113.8%,适当缓解了丙酸对产甲烷菌生长的抑制;同时BC组Ks2与CT组相比降低了43.9%,说明生物炭有利于微生物对不利的丙酸体系的适应。对乙酸化过程而言,生物炭的加入有利于乙酸化微生物的生长与乙酸化过程微生物的适应,BC组丙酸μm1和Ks1相比于CT组分别提高了17.6%和降低了63.8%。
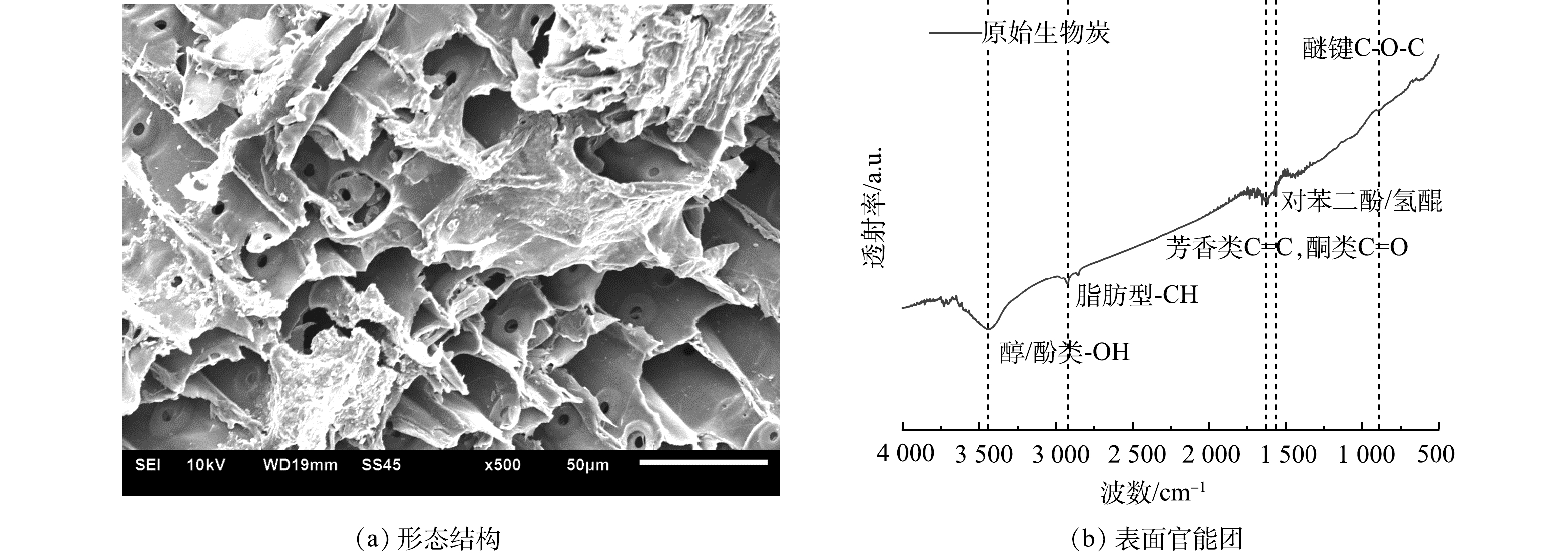
生物炭对微生物的生长有不同程度的促进作用,可能与生物炭自身丰富的孔隙结构 (如图3(a)所示) 有关[28]。一方面,可以有利于微生物的附着;另一方面,也可以在一定程度上避免微生物在不利的环境条件下 (比如高丙酸浓度) 与体系混合液直接接触。此外,燃烧所残留的灰分导致了生物炭的pH一般呈碱性,约为8.2~13.0。多个研究结果表明碱性生物炭有利于微生物在其表面富集[29-30],因此这可能是生物炭促进微生物生长的原因。
2.3 生物炭介导下乙酸和丙酸互营产甲烷的热力学特征
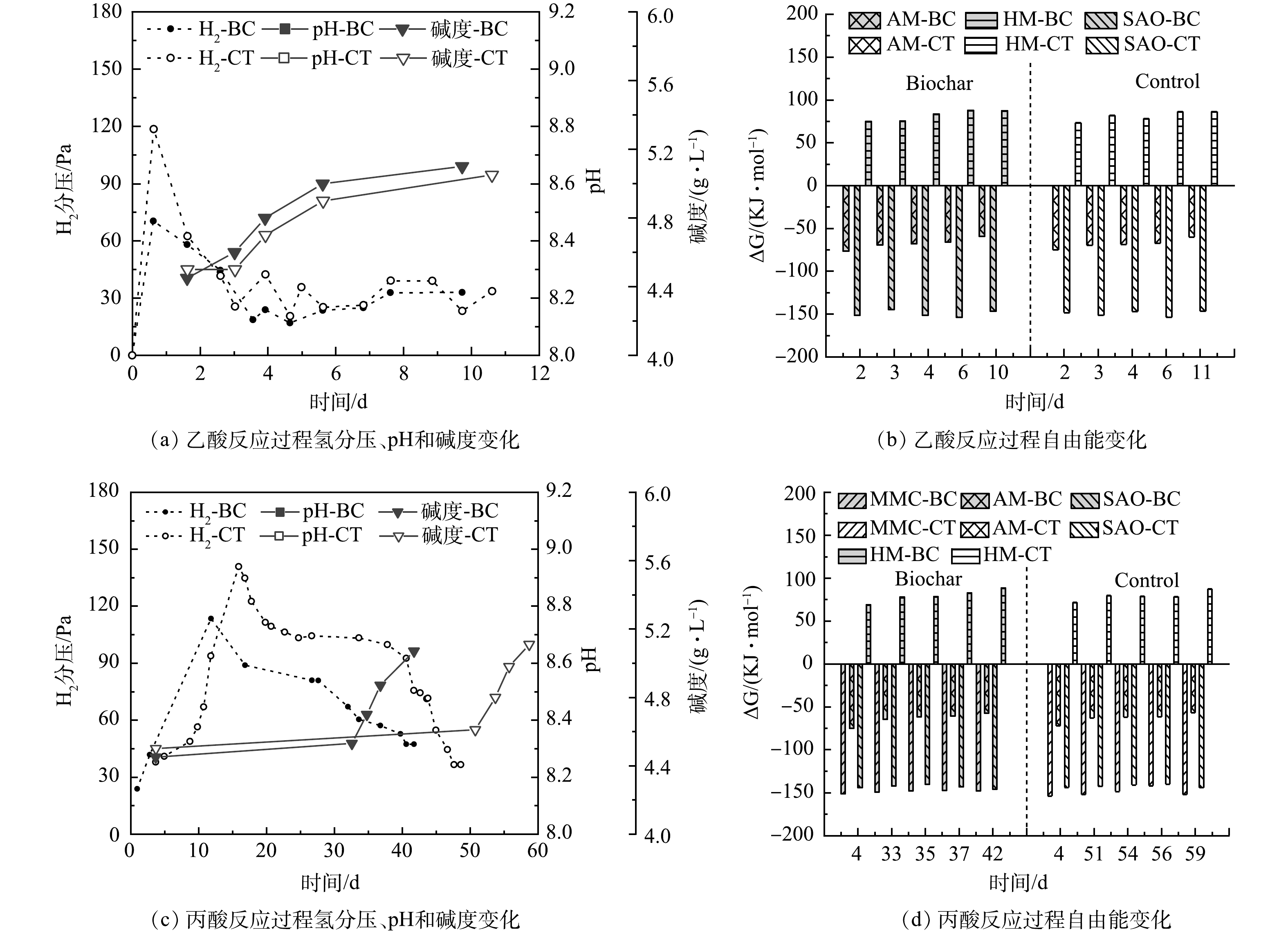
1) 乙酸互营产甲烷。选取生物炭促进程度大产甲烷速率快且无明显抑制的8 000 mg·L−1质量浓度进行自由能计算。图4(b)为乙酸反应过程自由能变化。实验初始加入固定质量浓度的乙酸,由于还未开始反应,H2和CH4体积分数低至1%~2%,虽然乙酸氧化反应标准吉布斯自由能为正 (+104.6 KJ·mol−1) ,但在实际环境条件以及微生物作用下使得反应实际自由能小于0[24],可自发进行。随着微生物对环境体系的适应,SAO反应开始发生,乙酸进一步生成H2、CO2,氢分压逐渐升高至118.5 Pa。与氢分压相关的SAO和氢营养型产甲烷 (hydrogenotrophic methanogens,HM) 反应自由能在各自氢分压升高时都有相应的上升或下降,后又由于氢分压的降低有所恢复。同时乙酸裂解反应由于乙酸被不断降解反应自由能由初始的-74.9 KJ·mol−1上升至-60.1 KJ·mol−1。
生物炭的添加使氢分压相比于CT组降低了40.6%,有利于降低高氢分压下限制电子传递的热力学壁垒。生物炭分别最大降低了2.8%和6.3%的SAO与HM反应自由能,这可能归因于生物炭对于高氢分压抑制的缓解,推动了IHT过程的进行与DIET过程共同作用来加速互营氧化产甲烷[31]。动力学的促进使得在同一反应程度下乙酸的质量浓度更低,从而SAO和AM反应自由能总体趋势升高,特别是与不断增加的CH4组分有关的AM反应。
2) 丙酸互营产甲烷。从反应方程看,丙酸氧化 (methyl-malonyl-CoA,MMC) 反应相比于乙酸反应受氢分压影响较小,开始降解时氢分压升高没有对反应自由能造成明显影响,但之后自由能还是随氢分压波动呈先上升后降低的趋势。随后产生的乙酸开始进行丙酸反应第二阶段的产甲烷过程,如图2(b)所示与乙酸反应不同的是,丙酸氧化产生的乙酸大部分都被利用产甲烷,体系内的乙酸质量浓度保持在一个相对较低的水平,这有利于热力学不利的丙酸降解 (ΔG−0) 能自发进行,但会使得丙酸互营氧化的SAO反应自由能相比于乙酸要略高。
图4(c)可知生物炭降低了丙酸降解过程19.4%的氢分压,缓解了高氢分压抑制的电子传递,通过强化IHT过程进一步促进反应发生,使同一反应程度下MMC反应自由能相比CT组最大降低了3.8%,同时氢分压的降低也使得丙酸的SAO反应自由能降低了2.1%。反应自由能与体系内反应物质量浓度密切相关,生物炭降低了反应过程氢分压,缓解了高氢分压对电子传递的抑制,降低了反应过程自由能,提升了热力学效能,通过强化IHT过程进一步促进反应发生。
2.4 生物炭强化乙酸和丙酸的作用机制
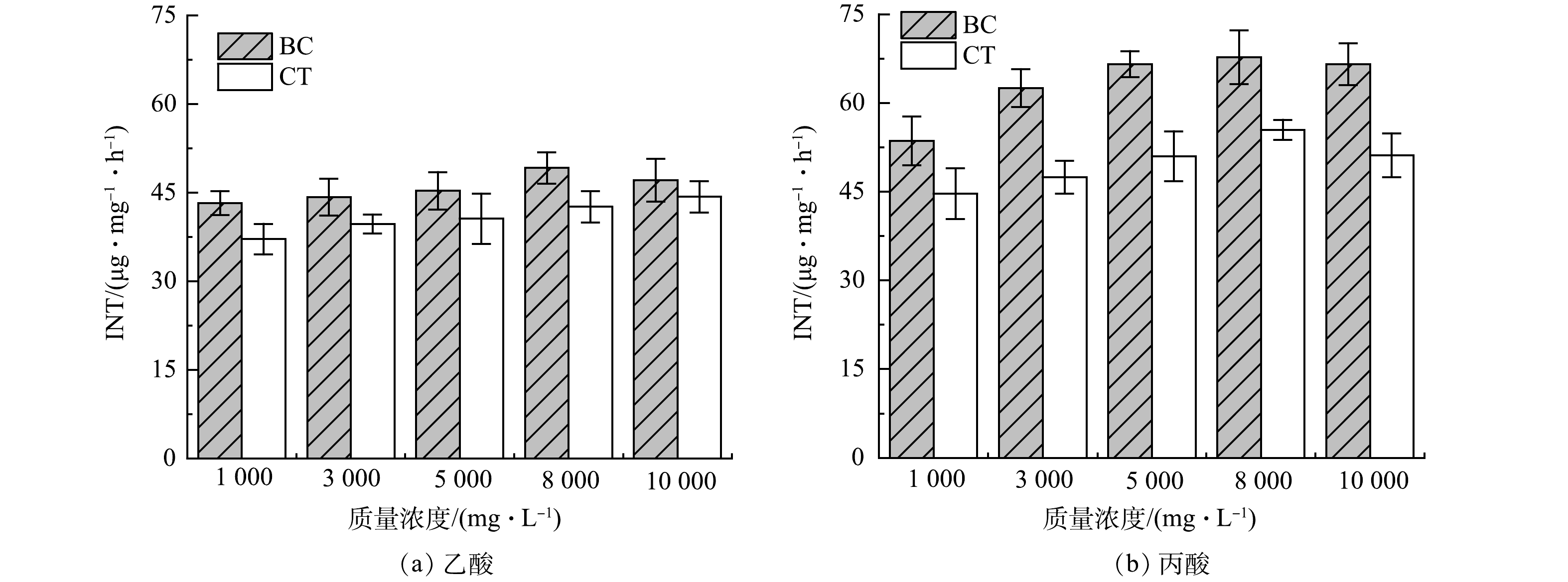
由图5可知,随着质量浓度增加,体系内INT-ETS活性值逐渐增大,乙酸由43.3 μg·mg−1·h−1上升至49.2 μg·mg−1·h−1,丙酸由53.6 μg·mg−1·h−1上升至67.7 μg·mg−1·h−1,这表明高负荷下能使微生物有更强的电子传递能力[32]。BC组INT-ETS活性普遍高于CT组,在3 000 mg·L−1丙酸反应时最高可达CT组的1.3倍,说明添加生物炭可以明显提升体系内微生物电子传递活性,这可能得益于生物炭丰富的官能团所蕴含的较强氧化还原能力。图3(b)为原始生物炭傅立叶红外表征,由图可知生物炭上含有酮类结构 (C=O) 与氢醌,这可能与具有氧化还原活性的电化学结构 (醌类/吩嗪类) 有关,使生物炭具备作为电子传递媒介的潜能[33]。由表1可知,生物炭供给电子能力 (electron donating capacity,EDC) 和接受电子能力 (electron accepting capacity,EAC) 分别为0.35和4.85 μmole−1·g−1,这使得生物炭可有效的作为传递电子的媒介,这有利于改善初始体系内乙酸和丙酸积累导致的电子传递受限,从而增强过程中胞外电子传递 (extracellular electron transfer,EET) 来促进互营氧化反应[34]。生物炭通过DIET作用一方面直接提升了反应的电子转移效率,另一方面使得反应快速正向进行,降低体系内氢分压用于产甲烷,有利于改善体系热力学效能从而推动IHT反应进一步强化互营产甲烷。
总之,生物炭有效地增强体系内产甲烷微生物的生长速率来强化反应进行,从而提升乙酸和丙酸降解产甲烷速率。生物炭还通过降低体系内氢分压来缓解乙酸和丙酸积累对互营反应的抑制作用,打破了IHT过程自由能的限制,提升了热力学效能。同时DIET过程和增强的IHT过程可提升电子传递能力进一步促进互营氧化反应。动力学与热力学的促进均有利于互营产甲烷反应过程,在这种双重促进作用下,乙酸和丙酸被快速稳定的利用降解产甲烷。
3. 结论
1) 生物炭显著加快了乙酸与丙酸互营产甲烷过程的降解速率和产甲烷速率,特别是需要“两阶段”才能完成的丙酸反应。此外,乙酸化过程是丙酸互营产甲烷的限速步骤。
2) 生物炭可提高乙酸化和甲烷化过程微生物的生长速率,同时可使反应过程微生物更好适应体系环境,这可能归因于生物炭自身丰富的孔隙结构以及其呈碱性的特性。
3) 生物炭自身具有氧化还原特性结构,可作为电子传递的媒介。生物炭通过DIET作用不仅提高了体系内的电子传递效率,还使得反应快速正向进行,降低了体系内氢分压用于产甲烷,有效缓解了高氢分压对于电子传递的抑制,有利于改善体系热力学效能从而推动IHT反应进一步强化互营产甲烷。
4) 在生物炭对互营产甲烷反应过程动力学和热力学的双重促进作用下,乙酸和丙酸能被快速稳定的利用降解产甲烷。



 DownLoad:
DownLoad: