-
厌氧氨氧化(anaerobic ammonia oxidation, Anammox)是指在缺氧条件下,Anammox菌利用
NO−2 -N氧化NH+4 -N,最终生成N2和少量NO−3 -N的过程[1-2]。一段式部分亚硝化-厌氧氨氧化工艺是将氨氮的亚硝化和厌氧氨氧化集成在一个反应器中,从而一步实现氨氮的高效去除。与传统硝化反硝化工艺相比,一段式部分亚硝化-厌氧氨氧化工艺具有无需消耗有机碳源、节省60%的曝气量和污泥产率低等显著优势[3-5]。目前,该工艺已成功用于处理高氨氮废水,如污泥消化液、垃圾渗滤液及畜牧业废水等[6-8]。截至2014年,全球已有100座以厌氧氨氧化工艺运行的污水处理工程,其中,88%采用一段式部分亚硝化-厌氧氨氧化[9]。一段式部分亚硝化-厌氧氨氧化稳定运行的关键在于维持反应器中氨氧化菌(ammonia oxidizing bacteria, AOB)和Anammox菌优势生长,同时抑制亚硝酸氧化菌(nitrite oxidizing bacteria, NOB)[10-11]。现有研究表明,在高氨氮环境下,通过控制溶解氧(dissolved oxygen, DO)、pH、游离氨(free ammonia, FA)、游离亚硝酸(free nitrite acid, FNA)和污泥龄[12-16]等均可实现抑制或者淘汰NOB,从而达到高氨废水的高效稳定脱氮。然而,在中低浓度(无厌氧消化的城市污水处理厂污泥水及部分工业废水)条件下,FA或FNA的浓度较低,对NOB的抑制作用减弱甚至消失。而有研究[17]发现,仅通过低溶解氧很难实现对NOB的长期抑制。MIAO等[18]在研究一段式部分亚硝化-厌氧氨氧化处理中低浓度氨氮废水时发现,在低溶解氧(0.17±0.08) mg·L−1条件下,出水
NO−3 -N浓度快速上升,TN去除率下降至14.7%,这表明低溶解氧并未有效抑制NOB。因此,探究在中低浓度下一段式部分亚硝化-厌氧氨氧化工艺的稳定运行具有重要意义。本研究采用序批式反应器(sequencing batch reactor, SBR),通过控制溶解氧浓度(0.2~0.4 mg·L−1),以间歇曝气的方式启动并连续运行一段式亚硝化-厌氧氨氧化,对反应器的脱氮性能进行了分析评价,同时测定了AOB、NOB和Anammox的活性变化,并采用荧光原位杂交 (fluorescent in situ hybridization, FISH)对污泥中功能微生物的群落结构进行了分析,以期为一段式部分亚硝化-厌氧氨氧化提供理论基础和潜在的技术支持。
全文HTML
-
SBR有效容积为5 L,水力停留时间(hydraulic retention time, HRT)为15 h,运行期间不排泥。反应器采用PLC控制系统实现自动控制,设定运行周期为6 h,其中进水10 min、反应时间300 min(曝气30 min(好氧)、搅拌45 min(缺氧),依次循环往复)、沉淀30 min、排水10 min、闲置10 min。反应温度为(35±1) ℃,DO控制在0.2~0.4 mg·L−1,pH维持在7.5~8.0。外部用锡箔纸包裹进行避光处理。
-
实验用水采用人工配制,其成分为200 mg·L−1
NH+4 -N (NH4Cl)、1000~2000 mg·L−1 KHCO3、180 mg·L−1 CaCl2·2H2O、100 mg·L−1 MgSO4·7H2O、50 mg·L−1 KH2PO4、微量元素Ⅰ和微量元素Ⅱ各1 mL·L−1。微量元素Ⅰ组分为5 g·L−1 EDTA、9.14 g·L−1 FeSO4·7H2O;微量元素Ⅱ组分为0.43 g·L−1 ZnSO4·7H2O、0.24 g·L−1 CoCl·6H2O、0.99 g·L−1 MnCl2·4H2O、0.25 g·L−1 CuSO4·5H2O、0.22 g·L−1 NaMoO4·2H2O、0.19 g·L−1 NiCl2·6H2O、0.21 g·L−1 NaSeO4·10H2O、0.014 g·L−1 H3BO3[19-21]。 -
亚硝化阶段反应器接种污泥取自实验室稳定运行的亚硝化反应器,接种量为1.2 g·L−1,AOB活性(以
NH+4 -N计,下同)为1 258.62 mg·(g·d)−1,NOB活性(以NO−2 -N计,下同)281.02 mg·(g·d)−1。通过溶解氧和FA的双重抑制实现亚硝化反应器的稳定运行,在亚硝化反应器出水NO−2 -N与NH+4 -N浓度之比接近1时,接种厌氧氨氧化污泥启动一段式部分亚硝化-厌氧氨氧化,反应器运行参数维持不变。Anammox接种污泥取自以SBR方式稳定运行的厌氧氨氧化反应器,Anammox活性(以NH+4 -N计,下同)为315.25 mg·(g·d)−1,该污泥颗粒化程度良好,外观呈红棕色,接种量为1.72 g·L−1,接种后的污泥浓度为2.92 g·L−1。 -
实验中各项常规水质指标测定按标准方法进行[22]。
NH+4 -N的测定采用纳氏试剂分光光度法,NO−2 -N的测定采用N-(1-萘基)-乙二胺分光光度法,NO−3 -N的测定采用紫外分光光度法。pH由在线式pH计(Inpro 4010,梅特勒)测定。DO由在线式溶氧仪(Inpro 6050,梅特勒)测定。MLSS和MLVSS均采用重量法。游离氨(FA)和游离亚硝酸(FNA)值[23]按照式(1)和式(2)进行计算。
式中:CFA为游离氨浓度,mg·L−1;CFNA为游离亚硝酸浓度,mg·L−1;
Ct,NH3 为总氨氮浓度,mg·L−1;Ct,NO2 总亚硝酸盐浓度,mg·L−1;T为温度,℃。 -
1)硝化活性测定。从反应器中取400 mL泥水混合液,经去离子水淘洗后分别置于2个500 mL广口瓶中,分别加入NH4Cl (
NH+4 -N为40 mg·L−1)、NaNO2(NO−2 -N为30 mg·L−1),随后用去离子水定容至400 mL,并在35 ℃条件下充分曝入空气,每间隔10 min从广口瓶中取样分别测定NH+4 -N和NO−2 -N的浓度,取样结束后,分别测量MLVSS并计算AOB和NOB的活性。2)厌氧氨氧化活性测定。从反应器中取400 mL泥水混合液,经去离子水淘洗后,置于500 mL广口瓶中,同时加入基质NH4Cl、NaNO2和微量元素(
NH+4 -N浓度为30 mg·L−1、NO−2 -N为40 mg·L−1),然后使用去离子水定容至400 mL,在35 ℃条件下采用高纯氮气进行曝气以维持缺氧环境,每间隔20 min取样测定NH+4 -N的浓度,pH控制在7.5~8.3,取样结束后,测量MLVSS并计算Anammox的活性。 -
Anammox菌和硝化菌的荧光原位杂交参照AMANN等[24]描述方法进行。杂交后的污泥样品通过激光共聚焦显微镜(TCS SP8, 莱卡)进行观察,并在100倍物镜下采集图像。实验所用探针如表1所示。
1.1. 实验装置及运行
1.2. 实验用水
1.3. 接种污泥及策略
1.4. 常规水质及工艺参数测定
1.5. 活性的测定
1.6. 荧光原位杂交
-
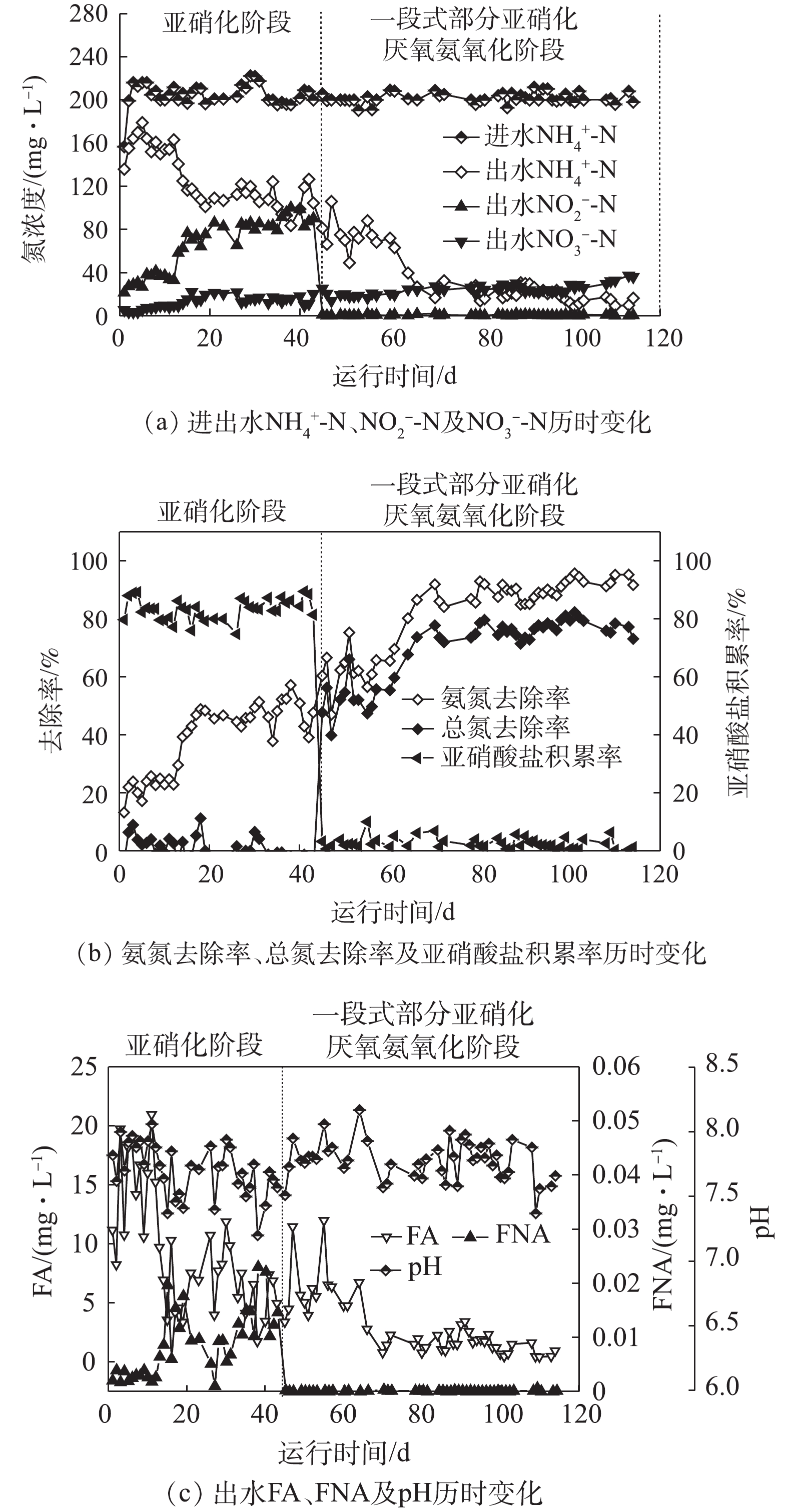
反应器连续运行110 d,运行效果见图1。在亚硝化运行阶段(0~44 d),通过控制DO和FA浓度实现了AOB的富集和NOB的抑制,从而获得较大的氨氧化速率和较高的亚硝酸盐积累率。在反应器运行初期(1~13 d),出水
NH+4 -N浓度较高,对应的FA浓度高达10 mg·L−1以上,此阶段内不仅NOB被完全抑制(FA阈值为1.0 mg·L−1),AOB也被部分抑制(FA阈值10 mg·L−1)[23];随着运行时间的延长,AOB逐渐适应,出水NH+4 -N浓度逐渐降低,NO−2 -N浓度逐渐增高,到第18 天时,出水氨氮浓度已经降至101.30 mg·L−1,NO−2 -N浓度达到83.23 mg·L−1,出水NO−2 -N与NH+4 -N浓度之比为0.82,亚硝酸盐积累率达到86%,其后出水NO−2 -N与NH+4 -N浓度之比稳定在0.8~1.03。在此期间,出水FA平均浓度为4.40 mg·L−1,大于NOB抑制阈值(1 mg·L−1)[23],反应器内溶解氧浓度为0.2~0.4 mg·L−1,由于AOB对氧的亲和力大于NOB,溶解氧优先被AOB利用[33-34],表明此阶段NOB受到DO和FA的双重抑制作用。反应器出水的pH维持在7.5~8.0,即使在NO−2 -N浓度为98.87 mg·L−1的情况下,FNA的浓度也小于NOB的抑制浓度(0.023 mg·L−1)[35],这说明采用FNA抑制NOB的策略只有在高氨废水时才有可能实现。当反应器接种厌氧氨氧化菌转入一段式亚硝化-厌氧氨氧化方式运行后(45~110 d),在曝气阶段,AOB可正常工作进行亚硝化;在停止供氧后,Anammox菌利用亚硝化产生亚硝酸,对氨进行氧化。因此,出水
NO−2 -N浓度迅速降低,而NO−3 -N浓度在增加,这说明亚硝化和厌氧氨氧化协同作用发生。随着运行时间的延长,污泥中的AOB活性逐渐增加,出水NH+4 -N浓度也逐渐降低。到70 d时,出水NH+4 -N为26.81 mg·L−1,NO−2 -N浓度在1 mg·L−1以下,NO−3 -N浓度为24.10 mg·L−1,反应器氨氮去除率和TN去除率分别达到86.60%和73.75%,其后反应器出水维持稳定,直至运行结束。在进入该反应阶段后,由于进行了Anammox反应,出水NH+4 -N浓度的降低使得出水中FA浓度相应降低,但FA浓度处于抑制NOB的阈值范围内,因此,NOB会受到FA的抑制作用,使系统中的Anammox菌能稳定利用AOB转化的亚硝酸盐进行Anammox反应,为一段式亚硝化-厌氧氨氧化反应器的稳定运行和获得较好的脱氮效果奠定了基础。韩志勇等[36]通过控制曝气时间和曝气量,采用MBR研究了一段式部分亚硝化-厌氧氨氧化处理氨氮废水的运行特性,在进水氨氮浓度为200 mg·L−1条件下,氨氮和TN去除率分别为88.91%和58.87%。而本研究采用SBR反应器在低溶解氧条件下,获得较高的AOB和Anammox活性(图2),成功实现了一段式部分亚硝化-厌氧氨氧化的稳定运行,从而获得较好的脱氮效果。 -
图2为一段式亚硝化-厌氧氨氧化阶段典型周期内DO、pH、氮素及FA浓度的变化。由图2可见,在进水结束后,由于进水中含有一定量的DO,首个好氧段的DO浓度可达0.6 mg·L−1以上,随着反应的进行,DO浓度快速下降并趋于稳定,而其余好氧段的DO浓度始终维持在0.2~0.4 mg·L−1,为亚硝化创造了良好的条件。在好氧段,氨氧化菌工作,
NH+4 -N被氧化为NO−2 -N,导致NH+4 -N下降和NO−2 -N增加;在随后的缺氧段,Anammox菌开始工作,利用好氧段产生的NO−2 -N氧化NH+4 -N,导致NH+4 -N和NO−2 -N浓度同时减少;其后循环往复,直至反应结束,此时,NH+4 -N浓度由周期起始时的95.76 mg·L−1降低到27.06 mg·L−1,NO−2 -N浓度在1 mg·L−1以下。由于好氧段部分NO−2 -N被NOB氧化为NO−3 -N和缺氧段厌氧氨氧化反应产生部分NO−3 -N,导致整个周期内NO−3 -N浓度持续上升,由周期起始最低时的20.76 mg·L−1增加到周期结束时的28.28 mg·L−1。在整个周期内,混合液中的FA浓度大于1 mg·L−1,大于FA对NOB的抑制阈值,从而使得NOB被部分抑制。在周期内DO和FA的浓度变化结果说明本反应器的操作达到了DO和FA对NOB的双重抑制,通过间歇曝气在SBR中实现了一段式亚硝化-厌氧氨氧化脱氮。值得注意的是,在好氧段
NH+4 -N浓度平均下降了约10 mg·L−1,而NO−2 -N浓度平均增加了5.61 mg·L−1,NO−3 -N浓度增加了不到1 mg·L−1,约40%的氮在好氧段损失(被Anammox菌转化为氮气),氮平衡计算结果间接表明,在好氧段发生了同步亚硝化-厌氧氨氧化过程。这一结果说明在连续曝气(低DO)的条件下,同样可实现一段式亚硝化-厌氧氨氧化。 -
图3和图4分别为反应器运行期间污泥浓度和各功能微生物活性变化。由图3可知,污泥浓度基本维持稳定,在亚硝化阶段污泥浓度维持稳定在1.2 g·L−1左右,接种厌氧氨氧化污泥后,污泥浓度稳定在2.8 g·L−1。由图4可知,在亚硝化阶段,AOB活性逐渐升高,由1 258.62 mg·(g·d)−1升至1 842.80 mg·(g·d)−1,而NOB活性由于受到溶解氧和FA的双重抑制而稳定在281.02~330.03 mg·(g·d)−1。在此阶段,AOB活性快速上升而NOB活性维持稳定,上述结果表明,反应器在成功富集培养AOB的同时,也有效抑制了NOB,从而实现了亚硝酸盐的稳定积累。
接种厌氧氨氧化污泥后,污泥浓度的增加,污泥中AOB和NOB所占份额下降而导致AOB和NOB的活性分别下降至526.13 mg·(g·d)−1和60.84 mg·(g·d)−1。由图4可知,随着反应器的运行,AOB活性总体呈现升高的趋势,最终活性达到815 mg·(g·d)−1。而此阶段NOB受到DO和FA的双重抑制,在与Anammox菌竞争
NO−2 -N时处于劣势,这使得NOB活性始终处于较低水平并呈下降趋势,最低下降至18.54 mg·(g·d)−1。Anammox活性在接种后略有下降,这主要是由于Anammox菌未适应好氧/缺氧交替环境,在运行一段时间后,Anammox活性开始恢复并缓慢增加,其平均和最大活性分别为113.09 mg·(g·d)−1和127.61 mg·(g·d)−1。由此可见,AOB和Anammox菌在反应器中优势生长,反应器内微生物之间形成良好的协同作用,系统具有良好的运行稳定性和较好的脱氮效果。李军等[37]采用间歇曝气模式启动一段式亚硝化-厌氧氨氧化反应器处理中低浓度废水,在稳定运行后,AOB和Anammox活性分别为403 mg·(g·d)−1和221 mg·(g·d)−1。MIAO等[38]研究认为,AOB活性是一段式部分亚硝化-厌氧氨氧化在间歇曝气模式下稳定运行的关键因素,Anammox活性随着AOB活性的增加而增加,反应器的脱氮效果也随之上升。本研究中AOB和Anammox活性逐渐上升,NOB活性逐渐下降,AOB和Anammox活性远大于NOB,更有利于一段式亚硝化-厌氧氨氧化反应器的长期稳定运行。 -
反应器中AOB、NOB及Anammox的FISH图像如图5所示。由图5可见,在亚硝化阶段,AOB所占份额较高,而基本检测不出NOB。这表明在亚硝化阶段通过低溶解氧和FA的双重抑制成功富集AOB的同时也达到了抑制NOB的目的,实现了亚硝化的稳定运行。在一段式亚硝化-厌氧氨氧化阶段中,AOB和Anammox菌所占份额明显高于NOB,这说明此阶段AOB和Anammox菌为反应器中的优势菌,从微生物角度表明一段式亚硝化-厌氧氨氧化反应器可实现良好的脱氮效果和长期运行稳定性。
2.1. SBR运行效果
2.2. 典型周期DO及氮浓度的变化
2.3. 污泥浓度及活性变化
2.4. 微生物污泥FISH分析
-
1)在温度为35 ℃、进水
NH+4 -N浓度为200 mg·L−1、DO浓度为0.2~0.4 mg·L−1条件下,一段式亚硝化-厌氧氨氧化反应器处理负荷(以TN计)可达到0.24 kg·(m3·d)−1,TN平均去除率为75.84%,成功实现了一段式部分亚硝化-厌氧氨氧化的稳定运行。2)反应器内AOB和Anammox菌形成良好的协同作用并有效抑制NOB,一段式部分亚硝化-厌氧氨氧化具有较好的运行稳定性。
3)一段式亚硝化-厌氧氨氧化反应器的成功启动并稳定运行,为Anammox技术处理中低浓度氨氮废水提供了参考。









 下载:
下载:










