-
我国以细颗粒物(PM2.5)和臭氧为表征的复合型污染问题日益突出,NOx作为重要前体物,亟需进一步减排[1]。电力行业首先启动超低排放改造,应用选择性催化还原法(SCR)技术实现了NOx的超低排放。而对于非电力行业众多工业炉窑,如焦化、砖瓦等,因其排烟温度低,工作负荷不稳定的特点,无法复制电力行业成熟的SCR技术。随着这些工业炉窑NOx排放标准的日益严格,迫切需要探索高效的脱硝方法[2]。湿式氧化脱硝方法,因其去除率高、操作管理方便、投资费用低,并可对废气中的重金属、SOx、PM等物质有较好的协同去除作用,已成为近年来研究的热点之一。
湿式氧化法典型的氧化剂主要有H2O2[3]、ClO2[4]、KMnO4[5]、NaClO2[6]等。虽然这些氧化剂有良好的脱硝效果,但在储存和运输的过程中存在一定的安全隐患,而且脱硝产生的废液容易造成二次污染,限制了湿式氧化法的广泛应用。近年来,部分学者[7-8]开始研究如何突破湿法氧化剂的循环利用难题,如探索通过电解NaCl产生具有氧化性的含氯活性物种(主要指有效氯,即相当于一定质量的氯气在水中所具有的氧化能力)用于烟气脱硝。通过循环电解方式,能在一定程度上减少脱硝废液的二次污染问题,采用现场制备方式,可解决氧化剂储存和运输方面的问题。目前,相关报道多集中于电解液中有效氯对脱硝效率的影响研究。YANG等[9]通过电解海水的方法制备含有效氯的氧化液,该氧化液对NOx的去除率可达98.9%,并发现氧化液中HClO吸收NO的能力强于ClO−。肖灵等[10]也得到了相似的结论,认为脱硝氧化液的活性成分主要是HClO,且pH对HClO的存在形式有重要影响。李艺春[11]通过电解NaCl溶液,研究了循环条件下的脱硝性能,在最佳条件下,NOx去除率在60 min内可保持在57.4%左右。以上研究多集中于NaClO电解液的脱硝研究,而针对氯酸钠(NaClO3)电解液的脱硝研究相对较少,尽管2种电解方式均是基于NaCl的电解,但2种电解液的产生方式及其产生的含氯氧化性物种浓度不同。因而,探索基于NaClO3电解液的烟气脱硝研究,可提供一种湿法氧化剂的循环利用方法,并为非电工业炉窑烟气脱硝提供一种新思路。
本研究基于NaClO3电解液的工业废气脱硝,重点考察有效氯浓度、pH、温度和NO体积分数等关键因素对脱硝性能的影响,探究了电解液循环脱硝的可行性及其循环利用方式对脱硝性能的影响规律,明确了NaClO3电解液应用于工业废气脱硝的可行性,以期为非电工业炉窑烟气湿法脱硝提供参考。
全文HTML
-
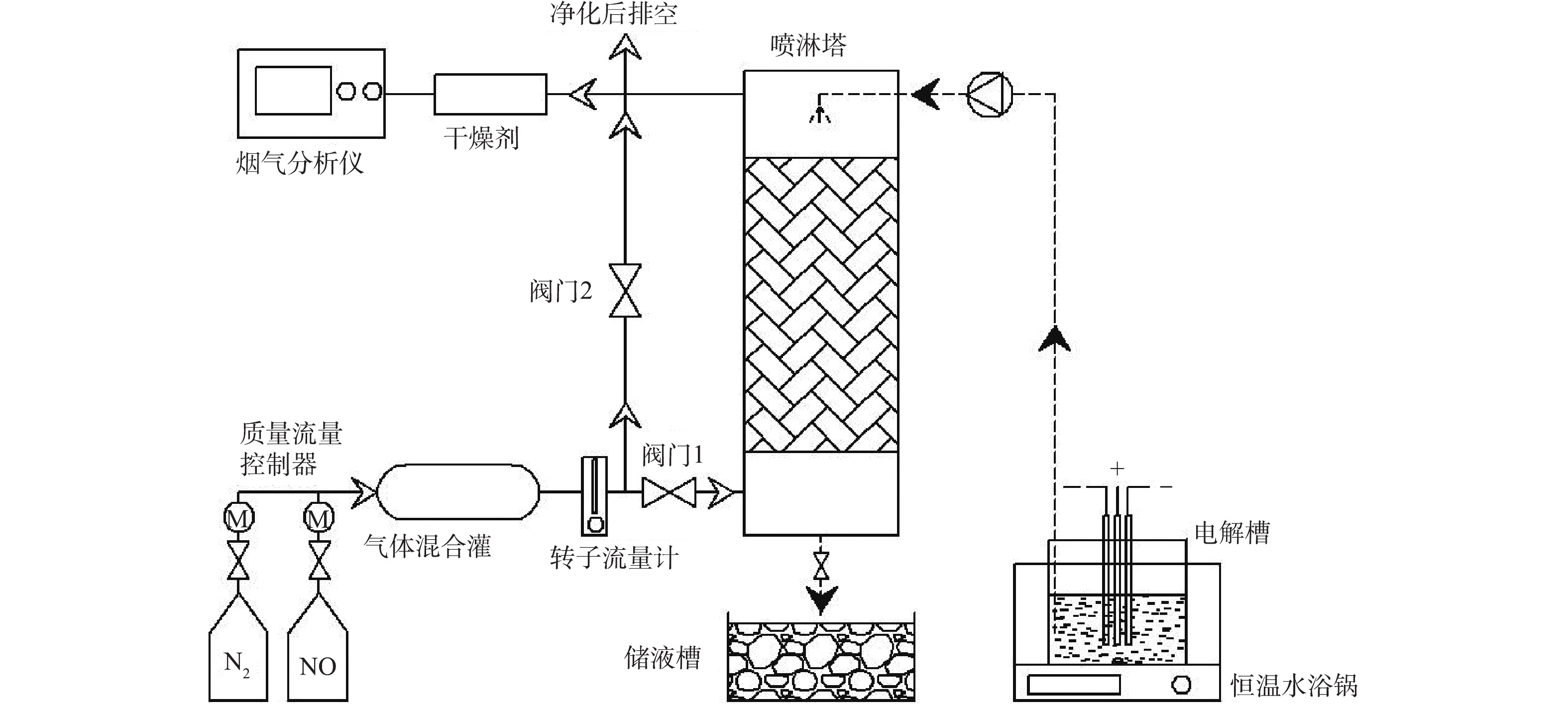
本研究实验系统如图1所示,系统主要包括无隔膜电解槽、模拟配气系统、自制喷淋塔以及烟气监测仪器。无隔膜电解槽放置于恒温水浴锅(DF-101S,郑州恒岩仪器有限公司)中,槽体为1 L玻璃烧杯,以RuO2-IrO2/Ti电极作为阳极(工业电解NaClO3常用阳极板),2块钛板作为阴极,电极有效尺寸为93 mm×70 mm×3 mm,3块电极板平行布置,电极间距3 mm,用直流电源电解(CP030015 LW-1530KD,龙威仪器)。模拟配气系统由气体钢瓶、质量流量计、气体混合罐和转子流量计构成。自制喷淋塔高300 mm,内径55 mm,采用单级喷淋,用蠕动泵(BT100-2J,兰格恒流泵)输送喷淋液,塔内填料高度130 mm,填料为直径16 mm聚丙烯材质鲍尔环。填料塔出口烟气检测仪器为1台烟气分析仪(Testo340,德图仪器)。本实验中包括非循环喷淋和循环喷淋2种喷淋形式。非循环喷淋时,喷淋后的废液直接进入储液槽中。循环喷淋是指在非循环喷淋的基础上,省去储液槽,将喷淋的废液直接回流到电解槽中,进而实现电解液的循环使用。
-
实验电解质由质量分数为8%NaCl与0.2%Na2Cr2O7组成。将含1 L溶液的电解槽放置于恒温水浴锅中,温度设置为20 ℃,转子转速为520 r·min−1。打开直流电源,启动电解槽电解,电流密度为2 000 A·m−2,电解时间为60 min,制备NaClO3电解液。实验所用药品皆为分析纯试剂,实验用水为去离子水。模拟工业烟气通过高纯N2与NO标准气体,经减压阀与流量计后进入气体混合罐混合后制得,气体流量为2 L·min−1。模拟烟气从喷淋塔底部进入,与通过蠕动泵输送(液体流量为196 mL·min−1)至自制喷淋塔顶部的电解液在塔内进行气液反应。反应后的烟气一部分进入烟气分析仪进行气体成分和浓度测量,采样时间为5 s,其余气体经净化后外排。每组实验结束后,先关闭NO阀门,用N2吹扫喷淋塔及气路,并清洗喷淋塔。用碘量法[12]测定电解液中有效氯浓度和NaClO3浓度。pH由pH计(PH808,希玛仪器)测量。烟气中NO浓度由烟气分析仪测量。
NO和NOx的去除率计算方法如式(1)所示。
式中:
η 为去除率;Cin 和Cout 分别表示NO或NOx进出口体积分数。
1.1. 实验系统
1.2. 实验方法
-
表1为电解液成分比较。通常采用无隔膜电解槽电解制备NaClO3,电解质为含有少量Na2CrO7的NaCl溶液。在电解过程中,阳极析出的Cl2与阴极所产生的OH−发生歧化反应,反应见式(2)。同时在溶液中发生水解及歧化反应,反应见式(3)和式(4)。
HClO和ClO−是合成NaClO3的重要中间体,NaClO3的合成主要通过式(3)和式(4)的反应[13]。Na2Cr2O7的添加抑制了HClO和ClO−在阴极的还原,反应见式(5)~式(7),提高了阴极的析氢反应效率,使有效氯浓度提高,进一步大幅提高了NaClO3的产率[14]。
本研究基于工业电解制备NaClO3的电解质,在自制小型无隔膜电解槽内电解NaCl,制备NaClO3。由表1可知,相比其他同样为实验室水平的电解槽装置,本研究在制备NaClO3过程中,选用析氧电位高的RuO2-IrO2/Ti电极作为阳极,且电解液中的Na2Cr2O7可提高阴极的析氢效率,使得本实验系统中的有效氯浓度较高,NaClO3浓度也远大于其他小型电解槽。本研究使用特定的稀释比例,考察NaClO3电解液中有效氯、pH、温度、NO体积分数对NOx去除率的影响,并讨论了NaClO3电解原液的脱硝特性。该结果对真实的NaClO3电解液脱硝具有一定的参考意义。
-
表2和表3反映了NOx氧化还原电对及标准电极电位和NaClO3电解液中氧化剂、反应式及标准电位[19]。
根据NO在溶液中溶解度低的特性,由表2、表3可以看出,若要将NO氧化为溶解度高、利于吸收的NO2,所需氧化剂的还原电势需高于1.049 eV。此外,由表2可知,还原电势高于1.049 eV的氧化剂亦可将NO氧化为最高价态,最终转化为
NO−3 。理论上,NaClO3电解液中能够将NO氧化为NO2的物质有Cl2、HClO和NaClO3。NO的主要去除途径[10,20-21]见反应式(8)~式(19)。Cl2氧化反应见式(8)~式(11),HClO氧化反应见式(12)~式(16),NaClO3氧化反应见式(12)和式(17),NaOH吸收去除NO2的反应见式(18),NaClO3吸收去除NO2的反应见式(19)。
2.1. NaClO3电解制备原理
2.2. NaClO3电解液脱硝过程
-
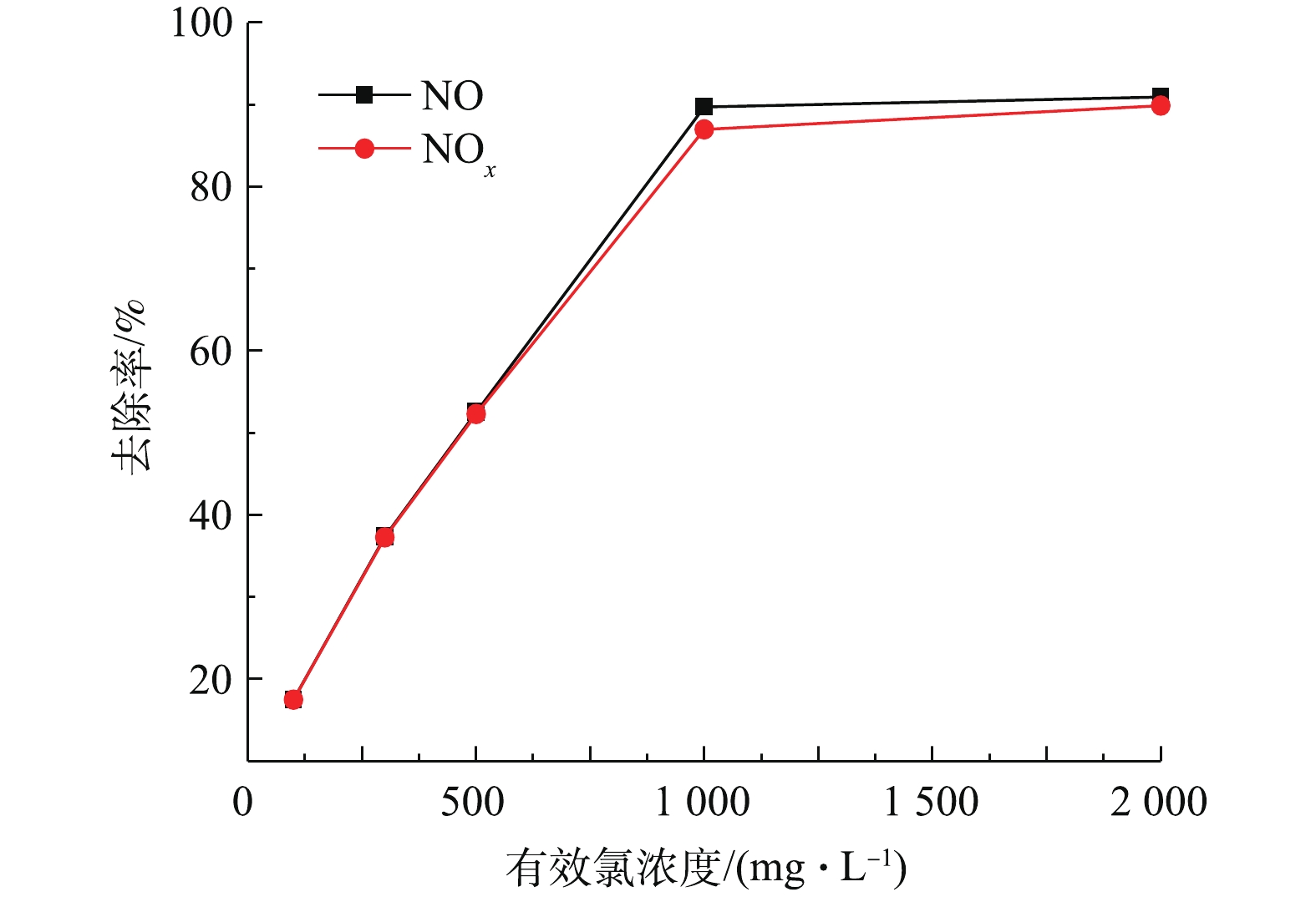
图2反映了在非循环喷淋条件下,NO体积分数为0.09%,电解液温度(T)为25 ℃,pH为3.1时NaClO3电解液中有效氯浓度对NOx去除率的影响。可以看出,随有效氯浓度的增加,NOx去除率不断提高。这是因为溶液的氧化能力在一定程度上由有效氯浓度决定。有效氯浓度从100 mg·L−1增加到1 000 mg·L−1时,NOx去除率增长明显,从17.5%迅速增加到87.0%。继续提高有效氯浓度至2 000 mg·L−1后,NOx去除率增幅变小,相比1 000 mg·L−1时只增加了2.9%。有效氯浓度低于1 000 mg·L−1时,溶液氧化能力不足以氧化吸收烟气中的NOx,所以随着有效氯浓度的增加,NOx去除率显著增加。而当有效氯浓度高于1 000 mg·L−1时,电解液氧化能力充足,NOx的去除率主要受气液传质速率控制,与液相中氧化物质浓度无关[22],此时继续提高有效氯浓度对提升NOx去除率的效果有限。
-
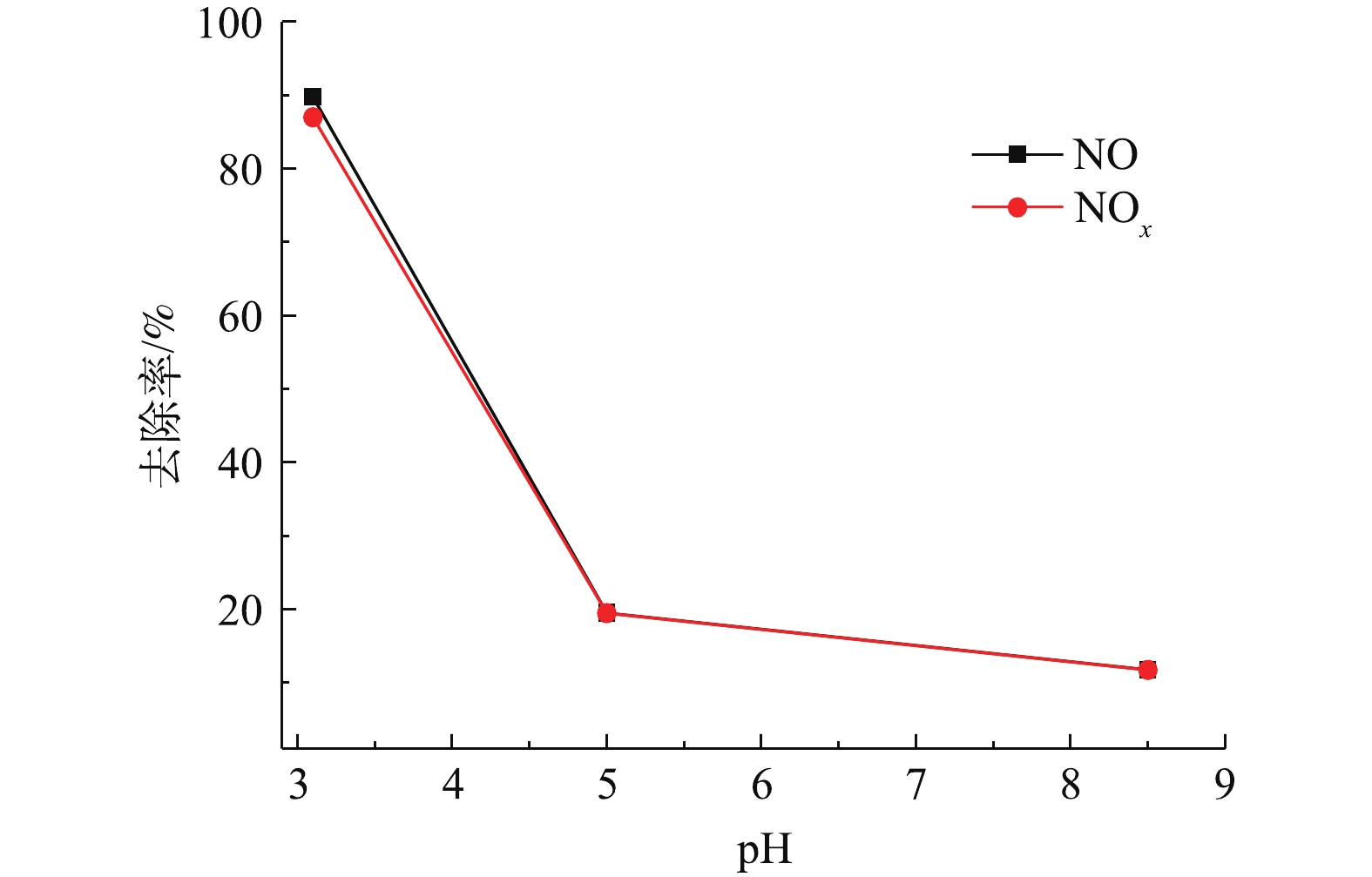
在湿式氧化脱硝工艺中,脱硝液pH是一个重要的运行参数。图3反映了在非循环喷淋条件下,NO体积分数为0.09%,T为25 ℃,有效氯浓度为1 000 mg·L−1时NaClO3电解液pH对NOx去除率的影响。可以看出,随着pH的不断增大,NOx去除率呈下降趋势。pH由3.1增加至5时,NOx去除率下降了67.6%,继续增大至pH为8.5时,NOx去除率仅为11.7%。这是因为NaClO3电解液中的有效氯以Cl2、HClO和ClO−的形式存在,而pH对电解液中有效氯的氧化还原电位有显著影响,随着pH的改变,电解液中有效氯中各成分占比发生改变[23]。当pH为3.1时,Cl2和HClO在有效氯中占比大,溶液的氧化还原电位高,且Cl2易挥发到气相中,与NO发生反应,反应见式(8)和式(9),因此,提高了NOx的去除率。当pH为5时,电解液中Cl2/HOCl的摩尔比迅速下降,生成越来越多的ClO−,而ClO−的氧化还原电位仅为0.89 eV,不仅不利于氧化NO,也导致NOx去除率下降。当进一步将pH提高到8.5时,根据反应式(20),电解液中HClO/ClO−的摩尔比逐渐降低,电解液的氧化性进一步减弱,因此NOx去除率随之下降。
-
电解液温度是影响NOx去除率的关键因素之一。图4反映了在非循环喷淋条件下,NO体积分数为0.09%,pH为3.1,有效氯浓度为1 000 mg·L−1时NaClO3电解液温度对NOx去除率的影响。可以看出,随着温度由25 ℃升高至65 ℃,脱硝效率呈先增大后降低的趋势。在25 ℃时,电解液对NOx的去除率为87.0%;当电解液温度由25 ℃升高到45 ℃时,NOx去除率增加了6.6%;继续升高温度至65 ℃时,NOx去除率相比于温度为45 ℃时下降了2.8%。这是由于电解液温度升高有助于提高化学反应速率,加强液相组分的扩散传质。而温度升高导致溶液中HClO、ClO−按照式(3)和式(4)合成NaClO3,导致NOx去除率降低。同时,温度也影响NO的溶解度,当温度升至65 ℃时,NO溶解度降低,NOx去除率相应地降低。
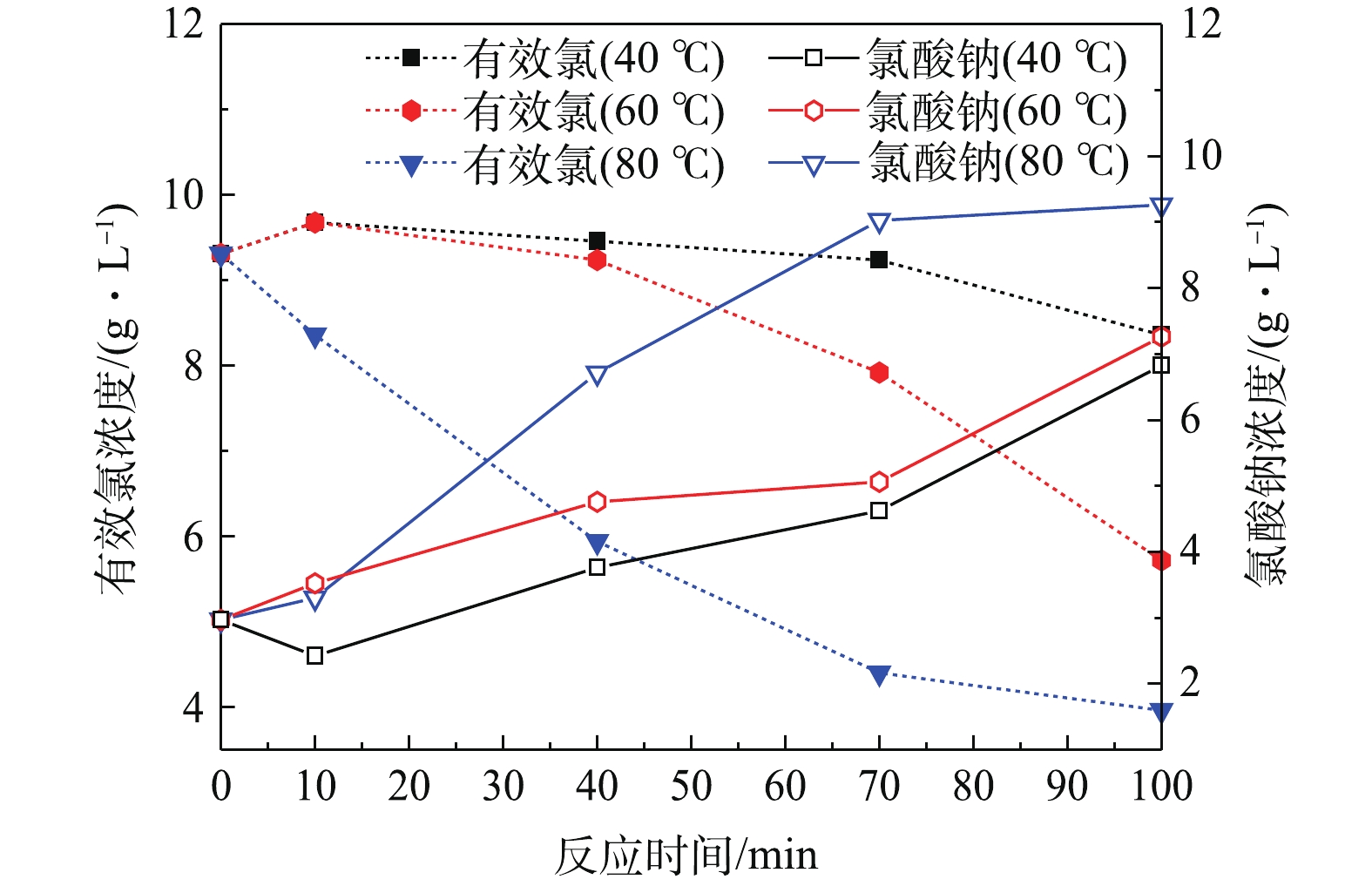
图5反映了NaClO3电解液在有效氯浓度为9.31 g·L−1,NaClO3浓度为2.97 g·L−1,不同温度的条件下,电解液中有效氯和NaClO3浓度随反应时间的变化规律。可以看出,有效氯浓度随反应时间的延长而逐渐降低,电解液为80 ℃时有效氯浓度下降趋势最明显,100 min内下降了57.5%。这可能因为高温促进了有效氯组分合成NaClO3的反应,反应见式(3)和式(4),从而导致NaClO3浓度升高。电解液温度为40 ℃时,有效氯浓度呈缓慢的下降趋势,对应的NaClO3浓度增量最少。温度升高至60 ℃和80 ℃时,电解液中NaClO3浓度不断提高,说明电解液温度越高越有利于有效氯组分向NaClO3的转化。
-
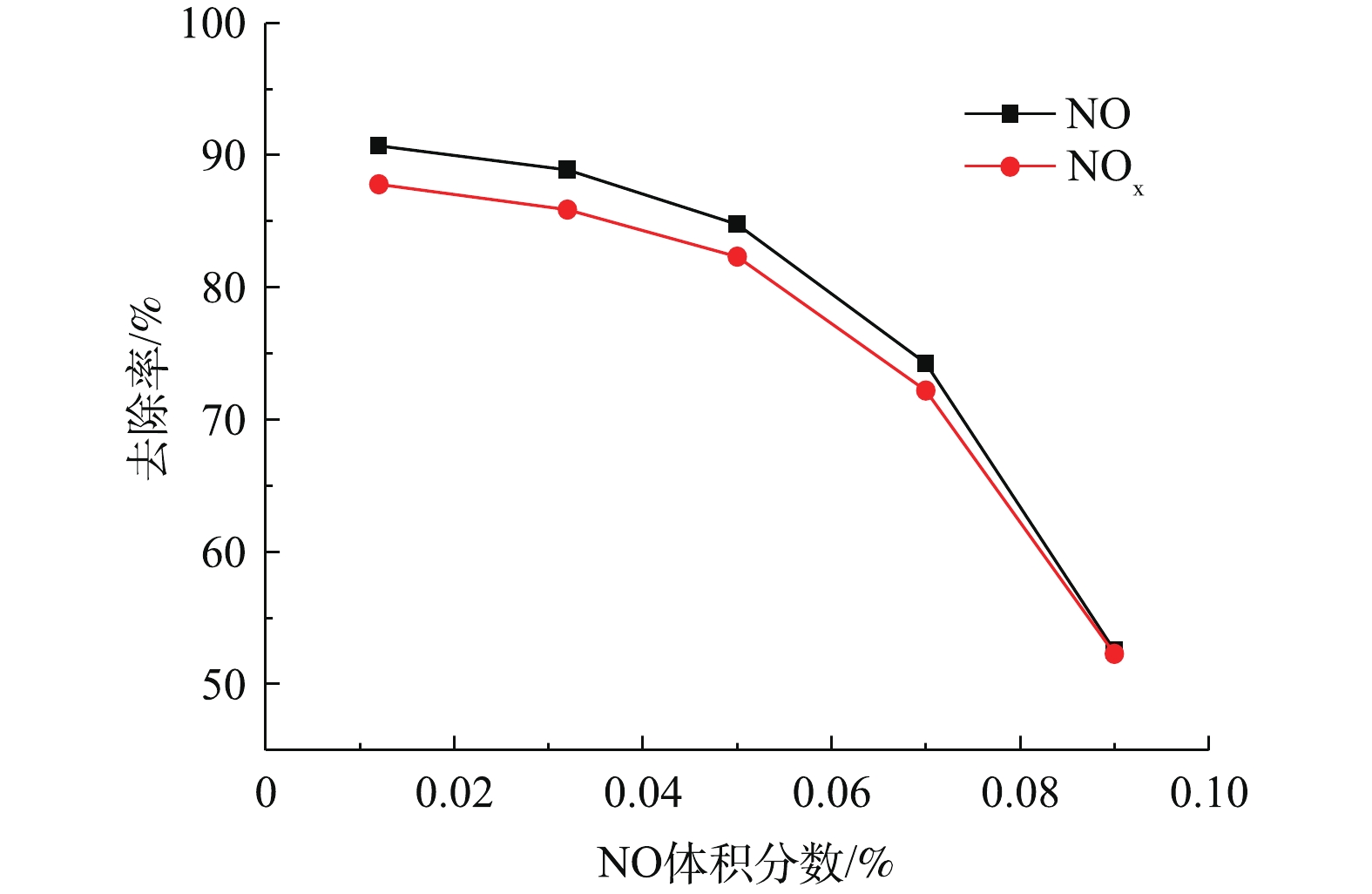
部分工业企业工作负荷不稳定,加之我国的煤质多变、品种众多,可导致烟气中NO体积分数波动。图6反映了在非循环喷淋条件下,T为25 ℃,pH为3.1,有效氯浓度为500 mg·L−1时NO体积分数对NOx去除率的影响。可以看出,NOx去除率随NO体积分数的增加呈下降趋势。随着NO体积分数从0.012%增加到0.09%,NO去除率迅速从90.7%下降至52.6%,NOx去除率从87.8%下降至25.3%。其原因可能是:由于有效氯浓度的限制,在高浓度NO的条件下,溶液中参与脱硝反应的活性组分(主要为Cl2、HClO)含量相对较少。尽管随着NO体积分数的增加,NO在气液界面的传质驱动力增大,但此时NOx去除过程主要受液膜控制,导致NOx去除率不断下降。当NO体积分数大于0.07%时,NOx去除率大幅下降。而NO体积分数为0.012%~0.05%时,NOx去除率保持在82.3%以上,并且NOx去除率变化不明显。以上实验结果表明,NaClO3电解液对工业废气中NO体积分数在0.05%以内波动时有良好的适应性。
-
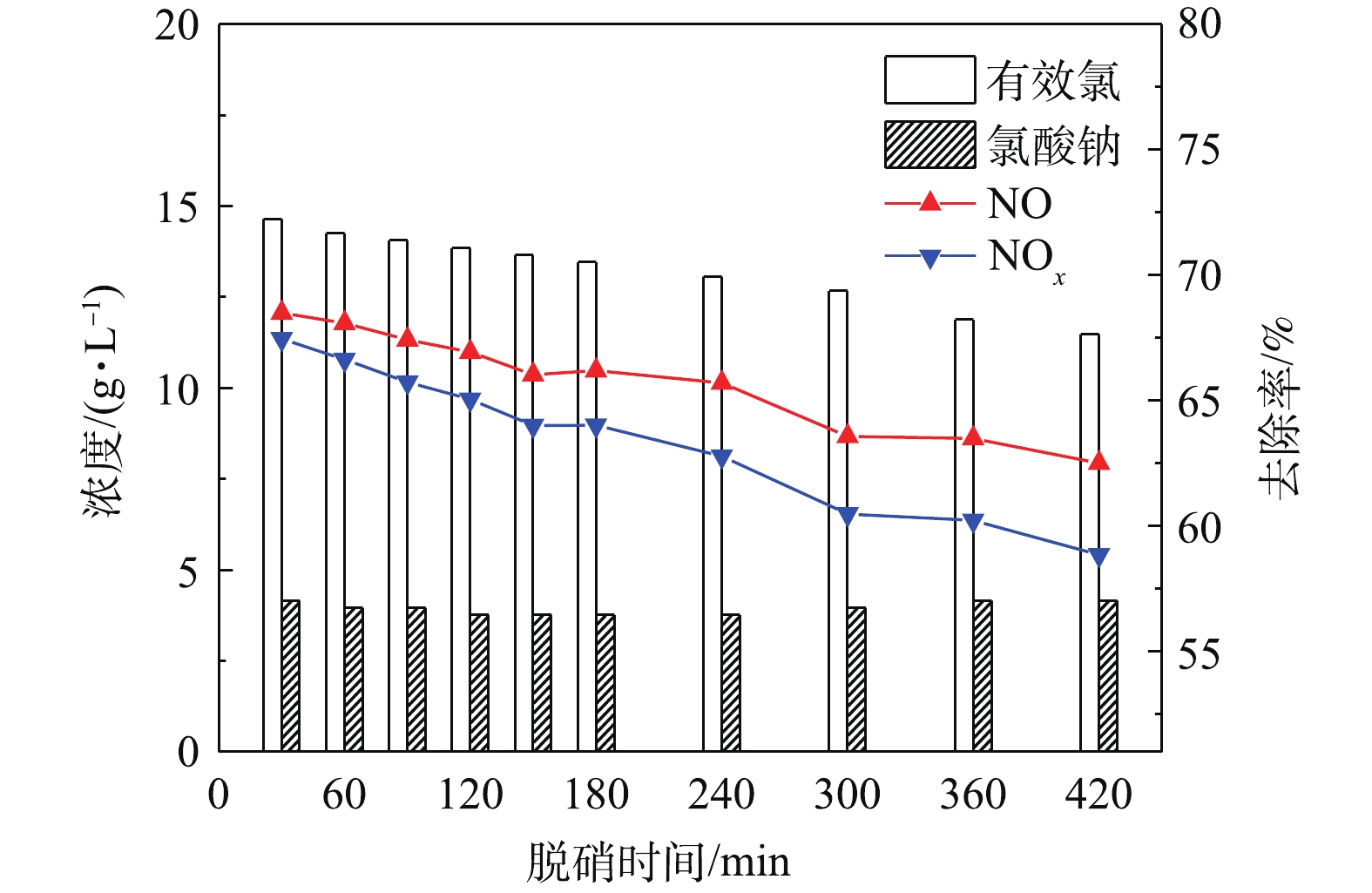
为避免脱硝液造成二次污染,本研究探讨了NaClO3电解液循环喷淋的可行性及其对NOx去除效果。图7反映了在循环喷淋条件下,NO体积分数为0.12%,T为25 ℃,pH为8.5,有效氯浓度为14.6 g·L−1时脱硝时间对NOx去除率的影响。可以看出,在0~420 min内,NaClO3电解液对NO和NOx去除率随时间的延长缓慢下降,分别保持在62.5%与58.9%以上,这表明NaClO3电解液能在较长的时间内保持较高的NOx去除率。随着循环电解液中有效氯的消耗,NO和NOx去除率逐渐下降。这可能是因活性分子HClO浓度降低,影响了NO的吸收速率,并且亚硝酸的积累和分解影响了NO2的吸收速率。另外,在循环脱硝420 min后,NaClO3浓度与尚未脱硝时的浓度接近,证明脱硝过程尚无NaClO3的消耗。这可能是因为在电解液条件下NaClO3氧化电位低,几乎不参与脱硝反应。GUO等[21]研究也发现NaClO3对NOx的氧化吸收能力差。循环脱硝后,电解得到的NaClO3浓度为13.9 g·L−1,与直接电解2次后的NaClO3浓度接近,两者只有5.4%的差距,说明溶液中脱硝过程对电解制备NaClO3没有显著的影响。
-
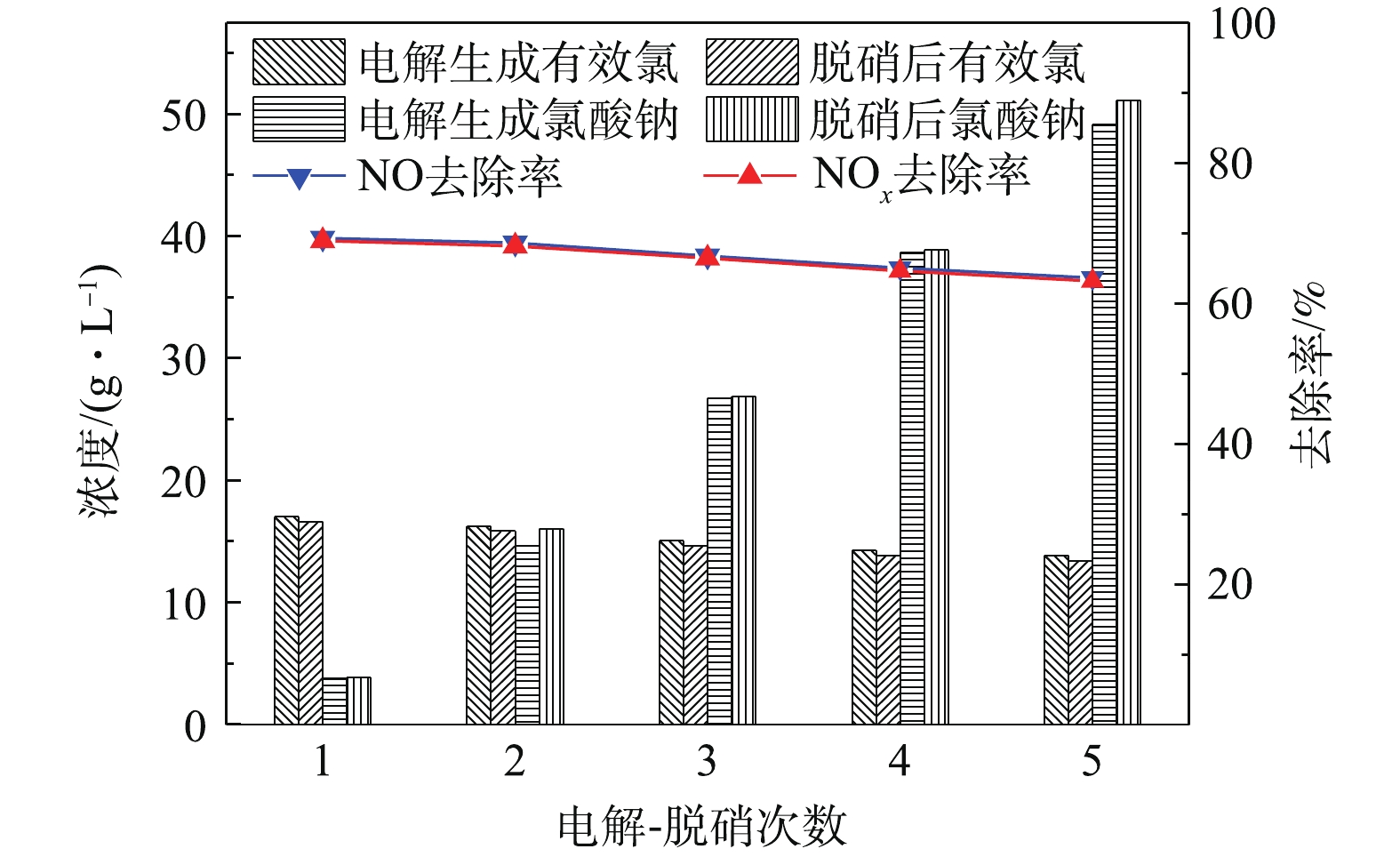
为研究电解次数对NOx去除率的影响,本研究考察了多次电解-脱硝对NOx去除率的影响以及电解-脱硝对含氯物种浓度的影响规律。实验中使用同一个1 L溶液进行多次电解、脱硝实验,整个过程中不补充其他物质,一次电解后进行一次脱硝。图8反映了在非循环喷淋条件下,NO体积分数为0.12%,T为25 ℃,pH为8.5,有效氯浓度为17.0 g·L−1时电解-脱硝次数对NOx去除率的影响。可以看出,随着NaClO3电解液电解次数的增多,电解液的NOx去除率无显著变化,保持在63.2%以上。其原因可能是,电解液有较高的有效氯浓度,其中脱硝活性成分充足。同时,随着电解次数的增多,累计电解时间延长,电解液有效氯浓度逐渐下降,NaClO3浓度逐步升高。有效氯浓度由初次电解产生的17.0 g·L−1降至第5次电解后的13.9 g·L−1。NaClO3浓度从初次电解产生的3.8 g·L−1增至第5次电解的49.1 g·L−1,NaClO3浓度相比初次电解增加了近11.9倍。有效氯浓度下降一方面是由于脱硝消耗有效氯成分,另一方面是由于有效氯发生反应转化为NaClO3,反应见式(3)和式(4)。所以,在本研究实验系统电解制备NaClO3的工艺中加入脱硝过程后,随着累计电解时间的延长,NaClO3浓度仍呈增长趋势。
本研究的NaClO3电解液脱硝可为工业NOx废气的治理提供了一种新思路,基于其可实现脱硝废液的再利用、节约资源的特性,可结合其他工艺可以作为一种深度脱硝工艺,对于部分工业NOx废气也可以作为一种预脱硝工艺。此外,本节电解-脱硝系统制备的NaClO3是绿色氧化剂ClO2的原料,对于基于含氯氧化剂脱硝的组合工艺应用也提供了一种氧化剂来源。
3.1. 有效氯浓度对NOx去除率的影响
3.2. pH对NOx去除率的影响
3.3. 温度对NOx去除率的影响
3.4. NO体积分数对NOx去除率的影响
3.5. NaClO3电解液循环喷淋的效果
3.6. 电解-脱硝次数对NOx去除率的影响
-
1)在本实验条件下,采用NaClO3电解液的脱硝工艺是可行的。提高电解液中有效氯浓度、降低电解液pH、减少NO体积分数均可有效地提高NOx去除率。在有效氯浓度2 000 mg·L−1条件下(pH 3.1,25 ℃),NOx去除率高达89.9%。
2)在NaClO3电解液温度超过45 ℃时,较高的温度可促进电解液中NaClO3合成,导致有效氯浓度降低,不利于NOx的去除。
3)在循环喷淋脱硝时,NaClO3电解液可在长时间内保持较高的脱硝效率,NO和NOx去除率在420 min内分别保持在62.5%与58.9%以上。
4)脱硝主要消耗电解液中有效氯,NaClO3浓度对NOx去除率的影响小,NaClO3能在电解-脱硝系统中保持稳定积累。




 下载:
下载: