-
石油作为现代社会最主要的能源之一,有工业血液之称[1]。然而,石油在生产、储运和使用的过程中也带来了许多环境问题,其中石油及其产品污染土壤的问题尤为突出,世界上98%的石油泄漏事故发生在陆地上[2]。土壤中的石油类污染物会对土壤的通透性、微生物群落及农作物生长造成影响,修复石油污染土壤对环境保护和土地可持续利用有着十分重要的意义[1]。
目前,高级氧化技术(advanced oxidation processes,AOPs)是修复石油污染土壤常用的方法之一[3]。在高级氧化技术中常用到的氧化剂为双氧水(H2O2)。但由于H2O2有稳定性差、易催化分解等缺点,导致其修复效果受到限制[4]。过氧化钙(CaO2)被称为固态H2O2,因其具有强氧化性、持久缓释性、残留物无害性以及微生物友好性而被广泛应用于土壤和地下水化学修复[5]。GOI等[6]用CaO2代替H2O2修复电气绝缘油污染的土壤,发现投加适量的CaO2可在21 d去除96%的绝缘油。ZHANG等[7]利用Fe(Ⅲ)催化CaO2降解地下水中三氯乙烯,在180 min内达到了99.95%的降解率。
基于H2O2和CaO2的高级氧化技术被广泛应用于去除土壤和地下水中的污染物,但关于其对土壤及地下水中微生物群落、植物等造成的影响的研究却相对较少[8]。本研究利用类Fenton氧化技术修复石油污染土壤,考察氧化剂种类(H2O2和CaO2)、氧化剂投加量、Fe(Ⅲ)及柠檬酸浓度对污染物去除效率的影响,通过比较CaO2/Fe(Ⅲ)/柠檬酸体系和H2O2/Fe(Ⅲ)/柠檬酸体系修复前后土壤原著微生物及植物生长情况的变化,评估2种类Fenton技术所产生的生态毒性效应。
-
实验材料:四氯化碳(CCl4,红外测油仪专用)、过氧化氢(H2O2,30%)、硫酸铁(Fe2(SO4)3)、柠檬酸(C6H8O7·H2O)、二氯甲烷(CH2Cl2)、乙醇(C2H5OH)、丙酮(CH3COCH3)为分析纯,并均购自国药集团化学试剂有限公司;过氧化钙(CaO2,75%)购自上海阿拉丁生化科技股份有限公司。
供试土壤:取自上海市东华大学松江校区校园园圃地表10~15 cm深的土壤,自然风干,去掉碎屑、石块、草根等杂物后,研磨并过20目筛。以0#柴油代替原油,取适量柴油溶于二氯甲烷后,加入过筛后的土壤中,振荡摇匀后,置于通风橱内,待二氯甲烷挥发完全后,在室温25℃下,老化1个月,制得模拟石油污染土壤,石油初始浓度为13.2 g·kg−1[9-10]。受试土壤理化性质如下:砂粒(>20 µm)14%、粉粒(2~20 µm)57.2%、黏粒(<2 µm)28.8%,pH=7.54、含水率1.44%、有机质含量3.22%。
实验仪器:OLB3000B红外分光测油仪(天津金贝尔科技有限公司);FA114A电子天平(上海豪晟科学仪器有限公司);HY-5A回旋式振荡器(常州朗越仪器制造有限公司);FE28 pH计(梅特勒-托利多仪器上海有限公司),SRG-800C恒温培养箱(杭州硕联仪器有限公司)。
-
在锥形瓶中加入5 g受试土壤,依次向瓶中加入25 mL去离子水、柠檬酸溶液、Fe(Ⅲ)溶液、氧化剂H2O2或CaO2,随后将锥形瓶放置在回旋振荡摇床中,转速为170 r·min−1,混合反应时间为24 h,取样测定土样中剩余柴油的含量。控制氧化剂投加量为166.67 mmol·L−1,柠檬酸浓度为27.78 mmol·L−1,Fe(Ⅲ)浓度为27.78 mmol·L−1,处理无外加柴油污染的土壤样品,考察CaO2/Fe(Ⅲ)/柠檬酸体系和H2O2/Fe(Ⅲ)/柠檬酸体系对土壤原著微生物的影响。取适量处理后土壤样品,离心,取下层固体装入无菌离心管中,在−80 ℃条件下保存用于高通量测序;另取相同处理土壤样品,在25 ℃恒温培养箱中培养48 h后,按上述操作进行高通量测序;再取适量处理后的土壤泥水混合物样品,放入恒温培养箱中,进行豌豆种子的萌发及培育实验,每份土壤样品培育60颗豌豆种子,待种子生长7 d后,测定植株的生长情况(发芽率、植株干重、株高、叶绿素含量)。每组实验设2个平行样,结果取平均值。
-
取反应后土水混合物样品,离心,使样品固液分离,使用四氯化碳萃取上清液,测得柴油浓度,取出下层底泥,置于培养皿,放置于通风橱中,待水分挥发完全后(室温下挥发时间为1 d左右),使用四氯化碳萃取并测得干燥土壤样品中柴油浓度,二者之和即为反应后土壤样品柴油浓度。该方法测得柴油回收率为90%~110%,可保证样品测定的柴油浓度接近原土壤的实际柴油浓度。
准确称取0.5 g土壤样品于25 mL比色管中,加入20 mL四氯化碳于比色管中,在35℃条件下,超声45 min,萃取土壤中的柴油,取一定量萃取液于10 mL比色管,稀释定容到可检测浓度范围后,利用红外分光测油仪测定溶剂中柴油的浓度。上清液中柴油浓度的测定参考文献中的方法[11]。
土壤中细菌16S rRNA高通量测序和分析参考王慕华等[12]的研究方法;豌豆植株的发芽率、干重、株高的测定参考SERA等[13]的研究方法;叶绿素的测定参考汪艳杰等[14]的研究方法。
-
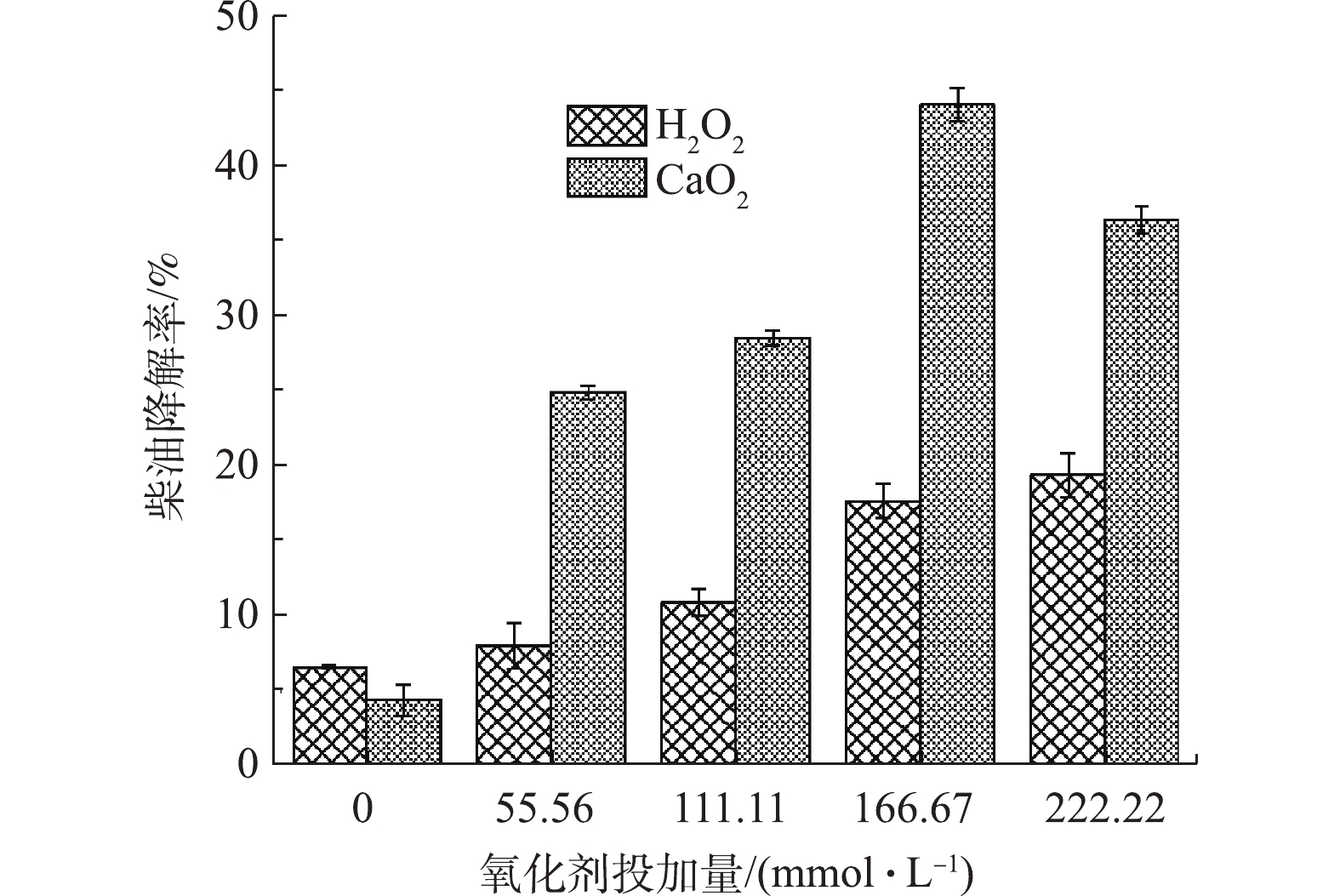
控制Fe(Ⅲ)浓度为27.78 mmol·L−1、柠檬酸浓度为27.78 mmol·L−1,投加不同浓度的CaO2或H2O2(55.56、111.11、166.67、222.22 mmol·L−1),探究氧化剂种类及投加量对污染物降解效果的影响。如图1所示,CaO2类Fenton法比H2O2类Fenton法对土壤中柴油的去除效果更好。当氧化剂投加量为166.67 mmol·L−1时,H2O2类Fenton法对柴油的去除率仅为17.65%,而CaO2类Fenton法对柴油的去除率为44.14%。这主要是由于CaO2在反应体系中,缓慢持续地释放H2O2,使得体系中H2O2的浓度长时间维持在较低水平,避免了短时间内过量的H2O2积累,造成H2O2发生分解(2H2O2→O2+2H2O)而失去氧化能力。而在H2O2类Fenton体系中,一次性投加的H2O2可发生自分解反应和体系中 · OH的清除反应(H2O2+ · OH→HO2 · +H2O),最终导致对污染物的去除效果变差。徐金兰等[3]在利用改性Fenton降解石油污染土壤时发现,将900 mmol·L−1的H2O2分4次投加对TPH的降解率比一次性投加900 mmol·L−1H2O2的TPH降解率,提高了2.2倍(由22%提高到49%)。因此,利用CaO2作为氧化剂代替H2O2,更有利于土壤中柴油污染的去除。
如图1所示,当CaO2的投加量由0增加至166.67 mmol·L−1时,土壤中柴油的降解率由4.33%提高到44.14%。这是因为随着CaO2投加量的增多,释放的H2O2及 · OH的浓度也会升高(CaO2+2H2O→H2O2+Ca(OH)2;H2O2+Fe(Ⅱ)→ · OH+Fe(Ⅲ)+HO-),从而促进了柴油的氧化降解。当CaO2的投加量由166.67 mmol·L−1增加至222.22 mmol·L−1时,土壤中柴油的降解率由44.14%下降至35.62%。这是因为过量投加CaO2会产生过量的H2O2,当H2O2浓度过高时,会发生自分解反应(2H2O2→O2+2H2O),并且多余的H2O2还会消耗 · OH等活性氧自由基(H2O2+ · OH→HO2 · +H2O),从而使目标物去除率有所下降。
-
控制CaO2浓度为166.67 mmol·L−1、柠檬酸浓度为83.33 mmol·L−1,改变Fe(Ⅲ)浓度(0、13.89、27.78、41.67、55.56 mmol·L−1),探究Fe(Ⅲ)浓度对CaO2类Fenton体系修复石油污染土壤的影响。由图2可知,土壤中柴油的降解率随着Fe(Ⅲ)浓度的增加,呈现先增加后略有下降的趋势。当Fe(Ⅲ)从0增加到27.78 mmol·L−1时,柴油的降解率从14.24%增加到35.92%,随着Fe(Ⅲ)浓度的升高,促进了Fe(Ⅲ)与H2O2的反应(H2O2+Fe(Ⅲ)→Fe(Ⅱ)+HO2 · +H+),产生更多的Fe(Ⅱ),进而促进更多的 · OH等活性氧自由基的生成(H2O2+Fe(Ⅱ)→ · OH+Fe(Ⅲ)+HO–),从而导致柴油去除率升高。进一步增加Fe(Ⅲ)浓度到55.56 mmol·L−1,柴油的降解率下降了3.34%。这可能是因为过量的Fe(Ⅲ)可与CaO2溶解产生的Ca(OH)2反应,生成Fe(OH)3胶体或沉淀物,将土壤颗粒表面包裹,不利于吸附在土壤表面的柴油与氧化剂接触反应,从而降低了柴油的去除率[15]。但由于上述Fe(Ⅲ)被H2O2还原为Fe(Ⅱ)的反应速率很低(约0.001 L·(mol·s)−1),反应生成的Fe(Ⅱ)可即时与H2O2反应被消耗,因此,过量的Fe(Ⅲ)未对柴油降解产生明显的抑制作用(H2O2+Fe(Ⅲ)→Fe(Ⅱ)+HO2·+H+)[4]。
-
控制CaO2浓度为166.67 mmol·L−1、Fe(Ⅲ)浓度为27.78 mmol·L−1,改变柠檬酸浓度(0、13.89、27.78、55.56、83.33 mmol·L−1),探究柠檬酸浓度对CaO2类Fenton体系修复石油污染土壤的影响。如图3所示,柴油的降解率随着柠檬酸浓度的升高呈现先升后降的趋势,当柠檬酸浓度从0增加到27.78 mmol·L−1时,柴油的降解率由22.19%增加到42.03%。这是因为柠檬酸与Fe(Ⅲ)可形成螯合物,使溶液中溶解态的Fe(Ⅲ)的浓度增加,从而促进氧化反应的进行。当进一步增加柠檬酸浓度至83.33 mmol·L−1,柴油降解率下降了16.67%。这是因为过量的柠檬酸作为有机物,会与柴油污染物竞争体系中的活性自由基等氧化剂,从而降低柴油的降解率[16]。综上所述,采用CaO2类Fenton体系降解石油污染的最优条件为:CaO2 166.67 mmol·L−1,Fe(Ⅲ) 27.78 mmol·L−1,柠檬酸27.78 mmol·L−1。在此条件下反应24 h,柴油的降解率可达44.14%。
-
Alpha多样性通过分析单个样品来反映微生物群落组成的多样性和丰度情况[17]。Alpha多样性包含多个衡量指标,分别通过不同的算法来估算微生物的多样性和丰度。其中,Shannon和Simpson指数常被用来反映物种的多样性程度,前者大小与多样性程度呈正相关,后者则与之呈负相关;Sobs、Chao1和ACE指数均被用来衡量微生物物种丰度的大小,其数值越高,物种的丰度越大;测序深度指数用于衡量各样本文库的覆盖率,其数值越高,则样本中物种被测出的概率越高。图4反映了类Fenton处理前后土壤原著微生物群落的丰富度和多样性变化情况。由图4可知,各样本的测序深度均在98%以上,说明测序结果反映了各样本微生物的真实情况。与未处理的土壤相比,H2O2类Fenton处理后的土壤的Shannon指数下降了21.77%,而CaO2类Fenton处理后的土壤的Shannon指数则上升了2.8%;H2O2类Fenton处理后的土壤的Simpson指数上升了350%,而CaO2类Fenton处理后的土壤的Simpson指数下降了25%。这表明,H2O2类Fenton处理对土壤微生物群落的物种多样性有明显的抑制作用,而CaO2类Fenton处理对土壤微生物群落的物种多样性有促进作用。另外,在物种丰度指数方面,与未处理的土壤相比,H2O2类Fenton处理后的土壤的Sobs、Chao1和ACE指数均有所下降,而CaO2类Fenton处理后的土壤的Sobs、Chao1和ACE指数则分别增加了14.78%、22.39%、21.32%。这表明,H2O2类Fenton处理对土壤微生物群落组成的丰富度有抑制作用,而CaO2类Fenton处理对土壤微生物群落组成的丰富度有明显的促进作用。
各样本在处理后继续恒温培养48 h的实验结果如图4(c)和图4(d)所示。可以看出,H2O2类Fenton处理组的微生物丰度和多样性水平在完成反应的48 h后有明显下降。以丰度指数Sobs和多样性指数Shannon为例,2种指数的降幅分别由最初培养的18.32%和21.77%增至培养48 h的49.36%和31.61%。与最初培养的结果类似,CaO2类Fenton处理组培养48 h的Alpha多样性指数与对照组相比有一定的提升。这表明H2O2类Fenton处理对土壤微生物可能造成一定程度的持续毒性作用。
造成以上结果的原因主要是:H2O2类Fenton体系反应速率快,反应程度剧烈,在短时间内,大幅提升了反应体系的氧化还原电位,从而抑制了微生物的生长;而CaO2类Fenton体系相对温和的反应机制降低了其对微生物的抑制作用。另有研究[18-19]表明,CaO2可以通过分解供氧、刺激生物酶活性、促进微生物代谢、降解污染物等多个方面来强化微生物修复效果。因此,CaO2类Fenton处理有益于提高土壤微生物群落的物种多样性及丰度。
-
图5反映了各实验组微生物群落组成在门水平上的差异性。可以看出,未经处理的原受试土样微生物群落的优势菌门组成为Actinobacteria (35.21%)、Proteobacteria (28.56%)和Acidobacteria (15.09%)。经H2O2类Fenton处理后,上述3种菌门所占比例均明显下降,分别下降了24.63%、25.39%和14.02%;而未处理前占极小比例(0.95%)的Firmicutes在处理后增加到79.4%,成为主要优势菌门且占比远高于其他优势菌门。相较而言,CaO2类Fenton处理后的Firmicutes占比同样有一定程度的提升,提升到16.22%,而在未处理前为主要优势菌门的Actinobacteria、Proteobacteria和Acidobacteria均有所下降,分别下降了2.37%、12.64%和4.25%。以上结果表明,CaO2及H2O2类Fenton处理影响了土壤微生物优势菌门的组成,类Fenton处理明显激活并促进了Firmicutes的生长,同时抑制了土壤原著优势菌群的生长。土壤中优势菌门的构成比例变化可能会影响土壤有机质的代谢。有研究[20]表明,Proteobacteria的相对丰度与土壤有机质含量呈显著正相关,其处理后相对丰度占比下降可能与土壤有机质含量的降低有关;Firmicutes可释放细胞胞外酶,促进半纤维素、纤维素和蛋白质的降解和水解,在土壤类富里酸的合成和腐殖化过程中起着重要作用[21-22]。因此,CaO2及H2O2类Fenton处理可能会促进土壤后期有机质的降解和腐殖化进程。
-
图6反映了CaO2及H2O2类Fenton处理对土壤中豌豆植株的发芽率、植株株高、干重和叶绿素含量的影响。由图6可知,相比于未处理的土壤,H2O2类Fenton处理后土壤培育的豌豆发芽率、植株株高、干质量和叶绿素含量与未处理相比分别下降了72.73%、93.22%、97.3%和98.59%;而CaO2类Fenton处理后土壤培育的豌豆发芽率、植株株高、干质量和叶绿素含量分别下降了5.45%、5.39%、10.02%和15.14%。以上结果表明,CaO2及H2O2类Fenton处理对豌豆的生长均有一定的抑制作用。相较而言,CaO2类Fenton处理对豌豆生长的影响比H2O2类Fenton处理的影响更小。这主要是因为CaO2类Fenton体系有更温和的反应机制。经2种类Fenton处理后,空白组、H2O2及CaO2类Fenton处理组的Eh分别为(116±4.2)、(557±11.3)和(297±18.2) mV,H2O2类Fenton处理组的Eh约为CaO2类Fenton处理组相应值的1.8倍,由此推测,H2O2类Fenton处理后,体系中残留的活性氧(ROS)浓度较CaO2类Fenton组更高,超出了豌豆种子抗氧化酶系统转化和降解ROS的能力,从而导致H2O2类Fenton组豌豆的发芽率等4项指标远低于未处理组。相反,CaO2类Fenton处理由于氧化剂本身的长效性及缓释性,体系中Eh维持较低水平且仍释放低水平的H2O2。
陈颖等[23]研究表明,低浓度的H2O2(0.5~5.0 mmol·L−1)可提高银杏细胞中SOD和CAT酶的活性;张晓龙等[24]使用1.5 mmol·L−1 H2O2处理黄瓜幼苗12 h,处理后,SOD、CAT等酶的活性增强,同时显著降低了O2·-的生成速率。GAO等[25]使用0.5 mmol·L−1 H2O2处理本研究同一品种豌豆植株,处理后,豌豆植株的株高和干重有所提高。结合上述研究分析,CaO2类Fenton处理24 h后,体系中低浓度H2O2可能在一定程度上增强了豌豆植株的抗氧化酶活性,并缓解了类Fenton体系对其造成的氧化胁迫作用,导致CaO2类Fenton组豌豆的生长及发育受到相对较小的抑制影响。
此外,CaO2类Fenton体系在反应中释放的钙离子在植物生长过程中也起着至关重要的作用,从而间接促进了豌豆植株的生长。CORPAS等[26]研究发现,钙离子是植物细胞多种代谢过程的关键性调控因子,植物细胞的过氧化物酶蛋白如分解H2O2的H2O2酶、乙醇酸循环中的乙醇酸氧化酶等活性均会受到钙离子含量的影响。因此,CaO2类Fenton体系比H2O2类Fenton体系对植物生长的毒性效应更小。
-
1) CaO2/Fe(Ⅲ)/柠檬酸类Fenton体系可有效降解土壤中柴油污染。在相同条件下,CaO2类Fenton体系较H2O2类Fenton体系具有更好的降解效果。
2)土壤中柴油的去除率会随着氧化剂的投加量、Fe(Ⅲ)浓度及柠檬酸浓度的增加而先增加后减少。当CaO2浓度为166.67 mmol·L−1,Fe(Ⅲ)浓度为27.78 mmol·L−1,柠檬酸浓度为27.78 mmol·L−1时,反应24 h后,土壤中柴油降解率达到44.14%。
3) CaO2类Fenton处理后土壤微生物群落的丰富度和多样性指数均有所提高,H2O2类Fenton处理后则均有所降低,2种处理方式均改变了土壤微生物群落的优势菌门组成及比例。
4) CaO2类Fenton处理和H2O2类Fenton处理前后豌豆的发芽率、植株干质量、株高和叶绿素含量均有所降低,其中CaO2类Fenton体系比H2O2类Fenton体系对植物生长的毒性效应更小。
CaO2及H2O2类Fenton降解土壤石油烃污染
Degradation of total petroleum hydrocarbons pollution in soil by CaO2/H2O2-Fenton-like system
-
摘要: 采用H2O2/Fe(Ⅲ)/柠檬酸类Fenton体系和CaO2/Fe(Ⅲ)/柠檬酸类Fenton体系修复土壤石油污染,考察了氧化剂种类、氧化剂投加量、Fe(Ⅲ)浓度和柠檬酸浓度对柴油降解效果的影响,并进一步研究比较了CaO2/Fe(Ⅲ)/柠檬酸和H2O2/Fe(Ⅲ)/柠檬酸2种修复方式对土壤原著微生物群落变化及豌豆植株生长所带来的生态毒性效应。单因素实验结果表明:在其他条件相同的情况下,CaO2类Fenton降解柴油效果优于H2O2类Fenton降解效果;柴油降解率随着氧化剂投加量、Fe(Ⅲ)和柠檬酸浓度的增大呈现先增后降的趋势。当CaO2浓度为166.67 mmol·L−1、Fe(Ⅲ)浓度为27.78 mmol·L−1、柠檬酸浓度为27.78 mmol·L−1时,反应24 h后,土壤中柴油降解率达到44.14%。生态毒性实验表明:CaO2类Fenton处理后土壤微生物群落的丰富度和多样性指数均有所提高,H2O2类Fenton处理后均有所降低,2种处理方式均在不同程度上改变了土壤微生物群落的优势菌门构成;CaO2及H2O2类Fenton处理均抑制了豌豆植株的生长,发芽率、植株干重、株高、叶绿素含量等测试指标均下降,其中H2O2类Fenton处理的抑制效果更为明显。进一步分析可知,CaO2类Fenton处理技术比H2O2类Fenton处理技术更适用于石油污染土壤修复。
-
关键词:
- CaO2类Fenton /
- Fe(Ⅲ) /
- 柠檬酸 /
- 石油烃 /
- 生态毒性效应
Abstract: In this study, H2O2/Fe(Ⅲ)/citric acid and CaO2/Fe(Ⅲ)/citric acid Fenton-like systems were used to degrade total petroleum hydrocarbons (TPH) in soil, and the effects of H2O2 and CaO2 dosages, Fe(Ⅲ) and citric acid concentrations on diesel oil degradation efficiency in soil were investigated. Furthermore, the ecotoxicological effects of these two remediation modes on the variation of indigenous microbial communities in soil and pea plant growth were compared. The results showed that under the situation of other conditions being equal, CaO2-Fenton-like system had a better performance on diesel oil degradation than H2O2-Fenton-like system. The diesel oil degradation efficiency increased first and then decreased with the increase of CaO2 dosage, Fe(Ⅲ) and citric acid concentration. At CaO2 dosage of 166.67 mmol·L−1, Fe(Ⅲ) concentration of 27.78 mmol·L−1, and citric acid concentration of 27.78 mmol·L−1, the diesel oil degradation efficiency in soil reached 44.1% at 24 h. The ecotoxicological impacts showed that CaO2 -Fenton-like treatment promoted soil microbial richness and diversity indexes, while H2O2 -Fenton-like treatment reduced them. This indicated that these two treatment modes changed the compositions of soil microbes and dominant bacterial phyla in varying degrees. The CaO2 and H2O2-Fenton-like treatments inhibited the growth of pea plants, and decreased the indexes of germination rate, shoot length, plant dry weight and chlorophyll content, and H2O2-Fenton-like treatment had more serious inhibition effects. In summary, the CaO2 Fenton-like treatment is more suitable for TPH-contaminated soil remediation than H2O2 Fenton-like treatment.-
Key words:
- CaO2-Fenton-like systems /
- Fe(Ⅲ) /
- citric acid /
- total petroleum hydrocarbons /
- ecotoxicological impacts
-
重金属污染场地,指长期进行矿产冶炼、电镀加工、不锈钢生产、仪表机械制造等产业的重金属企业厂区,因没有采取严格规范的环保措施[1],产生废气沉降、废液灌溉和废弃物堆积[2]等,从而直接或间接污染土壤的工业场地,直接或间接造成的被重金属元素污染土壤的工矿业场地。重金属污染具有隐蔽性强、潜伏期长、污染后果严重等特点[3]。据2014年发布的《全国污染土壤调查状况公报》[4](简称公报),我国土壤的总超标率达到了16.1%。其中,工矿业废弃地的土壤环境问题突出,比较典型且污染严重的地块类型有3种:重污染企业用地的招标点位占调查总数的36.3%;工业废弃地的超标点位占调查总数的34.9%;工业园区的超标点位占调查总数的29.4%。土壤污染主要由无机污染物造成。该公报列举了铜、汞、镍、镉、铬、砷、铅、锌8种重金属元素作为无机污染物,并对其进行了详细说明。
随着我国“退二进三”的城市化发展及产业结构升级,城市的工业污染场地引起人们关注,其中重金属是主要污染源,影响周边居民健康,制约土地资源的二次利用[5]。近年来,我国针对重金属污染场地的污染修复技术发展日渐成熟,基于已有的技术研究,董家麟[6]以国内外大量文献综合分析各项技术的优缺点及应用范围;宋立杰等[7]介绍且分析了各项修复技术的实施方法;晁文彪[8]通过研究专利技术对重金属污染修复技术的发展趋势作出了展望。但目前大多数研究聚焦于重金属污染土壤的整体技术发展现状,单独对场地修复技术进行研究的综述类文献较少。本研究对重金属污染场地修复技术专利(简称专利)进行了计量分析,探究各项技术的发展趋势。
1. 数据来源与分析方法
本研究是基于国家知识产权局专利检索及分析网站进行的检索,设计检索式以关键词“重金属”和“土壤”为主,排除了农、矿、垃圾、肥、污泥等几个关键词,此外,在中国知识资源综合数据库(简称中国知网)以同一个检索式进行二次检索,以专利公开日为日期标准,截取时间段为2002年1月1日—2019年5月24日的专利,筛选排除了农田土壤修复、土壤重金属检测方法、土壤重金属来源分析及风险评估方法等专利,得到关于重金属污染场地修复技术的公开专利1 556项。梳理筛选得到的专利,将专利的名称、公开日、授权日、公开号、研究机构、发明人、技术类型、目标重金属、应用效果、优点等录入Excel并利用筛选功能、查找功能进行公开年份(分析年度变化均以此为标准)、目标重金属、技术类型的统计;利用Origin软件制图。文中2019年的专利数量为2019年1月1日—2019年5月24日的专利数量总和,采用文献计量学方法系统总结了重金属污染场地修复技术的现状、特点及发展趋势。
2. 数据分析
2.1 专利总量的统计与分析
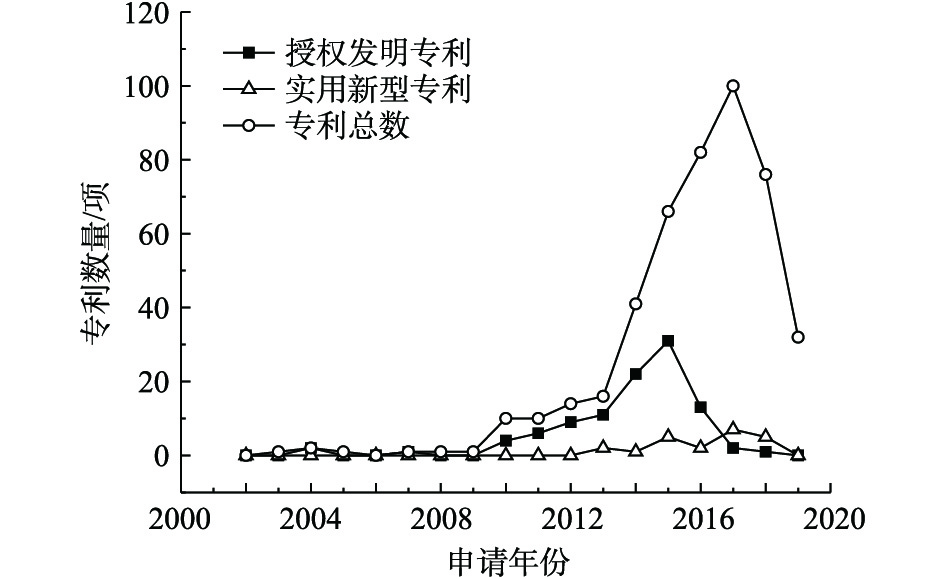
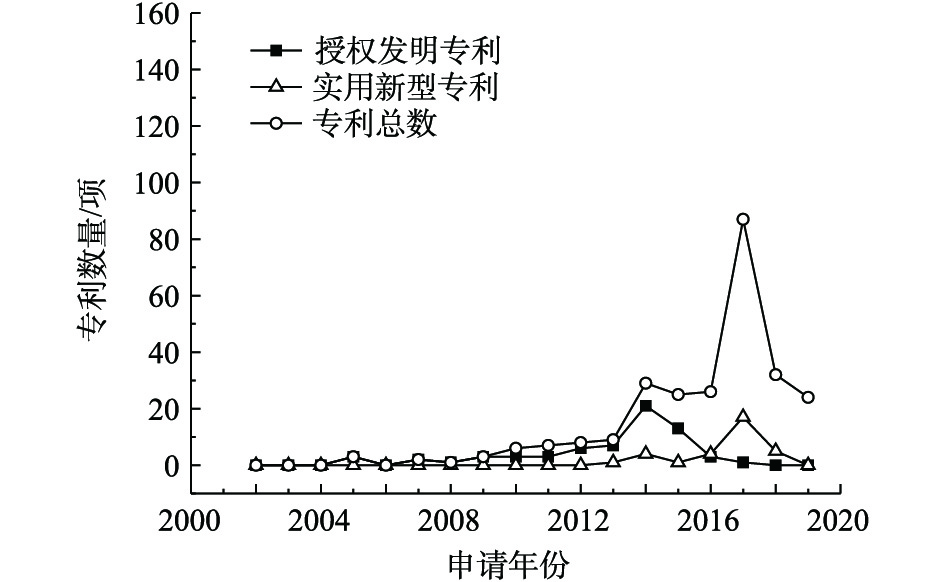
1)专利总量年度变化。2002—2019年公开的专利总数、授权发明专利数量及实用新型专利数量年度变化趋势见图1。公开专利的研究进程可以分为4个阶段。第1阶段为2002—2009年,该阶段公开的专利数量增长几乎停滞;第2阶段为2009—2013年,国内研究处于起步阶段,平均增长率约为16项·a−1;2013年进入了重金属污染场地修复的第3阶段,公开的专利数量快速增长,平均增长率为67项·a−1,尤其是2016—2017年,公开的专利数量增长了101项;第4阶段是2017年至今,公开的专利数量稍有回落,趋于稳定,2018年公开的专利数量为219项,2019年1—5月公开的专利数量为141项。第3阶段的公开专利数量增长可能因为2012年国家将土壤修复列入《“十二五”国家战略性新兴产业发展规划》(国发[2012]28号)的“先进环保产业发展路线图”,江苏省、广东省、重庆市、湖南省等地普遍关停了多家企业,开展了工矿企业搬迁原址场地土壤的修复[9],激发了土壤修复产业的活力。
在此期间,授权专利数量总体呈增长趋势,实用新型专利在2014年开始发展,专利数量占专利总数的比例逐渐增大,2014年占比为13.70%,2016年占比为14.64%,2017年占比为15.23%。这说明修复治理重金属污染场地的各项技术研究成熟后,研发具有自主知识产权、符合我国国情的重金属污染场地修复装置和设备也引起了人们重视。
2)专利总量区域分布和机构分布。申请公开专利数量占据全国前10名的区域见表1。由表1可知,江苏省、湖南省、广东省、北京市是主要的专利申请地区,被公开的申请专利数量分别为225、155、153和147项。这4个省份公开专利数量比较多,其主要原因为:第一,可能是因为当地科研机构多、科研氛围浓厚。全国范围内申请重金属污染场地修复技术专利的机构总数为611个,其中江苏省、湖南省、广东省、北京市的机构数量分别为71、58、72和64个,4个省份的机构数量总和近乎占据了全国研究机构总量的一半;第二,可能是当地的工业结构和产业需求促进了重金属污染土壤修复技术的发展。2011年,廖晓勇等[5]提出,我国达到工业规模级别的重金属冶炼企业及重金属压延加工企业数量众多,其中这类企业在江苏省的数量最多,浙江省、广东省、湖南省名列前茅,在产业结构调整和城市化发展的推动下,重金属污染场地的修复成了这些省份必须解决的问题,因此,修复技术的研究发展也相应较快。
表 1 区域专利数量前10名和区域机构数量前10名Table 1. Top 10 regions in patent numbers and top 10 regions in organizations区域 专利数量/项 区域 机构数量/个 江苏省 225 广东省 72 湖南省 155 江苏省 71 广东省 153 北京市 64 北京市 147 湖南省 58 上海市 92 上海市 38 浙江省 91 山东省 35 湖北省 86 湖北省 33 四川省 75 安徽省 32 山东省 66 浙江省 31 安徽省 57 四川省 29 3)公开专利的重金属研究对象及其适用技术分析。常见的重金属研究对象为镉、铅、铜、锌、铬、砷、汞、镍,其中研究镉、铬、铜、铅、锌等5种重金属的公开专利尤其多,用于处理镉、铅、铜、锌、铬、砷、汞、镍为主的污染场地的公开专利分别为324、257、186、163、140、91、77和58项,关于其余重金属污染场地修复技术的公开专利均不足50项,这说明以上列举的几种重金属的处理技术研究比较成熟。其中,铜、铬、锌、镍、锰等几种重金属的技术研究均是从生物修复技术起步,再扩展研究其他技术的应用。固化/稳定化技术在各类重金属污染场地的技术占比为31.48%~54.55%,可以普遍应用于各种重金属污染场地,适用性广;生物修复技术则常用于镉、铅、铜、锌、锰等几种重金属污染场地,技术占比为25.77%~41.18%,这主要取决于可筛选应用于不同重金属污染场地的生物资源丰富度;联合修复技术比较适用于铬污染场地,技术占比达到24.29%,对于一些其他重金属污染,如钴、锶、锑、铯、硒,这几种金属的联合修复技术研究也在2014年和2017年有所发展;淋洗修复技术常用于修复镉、铅、铜、锌、镍、砷、汞等重金属污染场地,技术占比均为10%~15%;物理修复技术在镍、锰、铬、铜、汞几种重金属污染场地应用得比较多,技术占比为9.09%~12.14%,主要是吸附修复技术和电动修复技术发展得比较好,热脱附修复技术主要应用在汞污染场地和砷污染场地中,磁分离修复技术则主要应用于铬污染场地、铜污染场地和铅污染场地。
2.2 各项技术的统计与分析
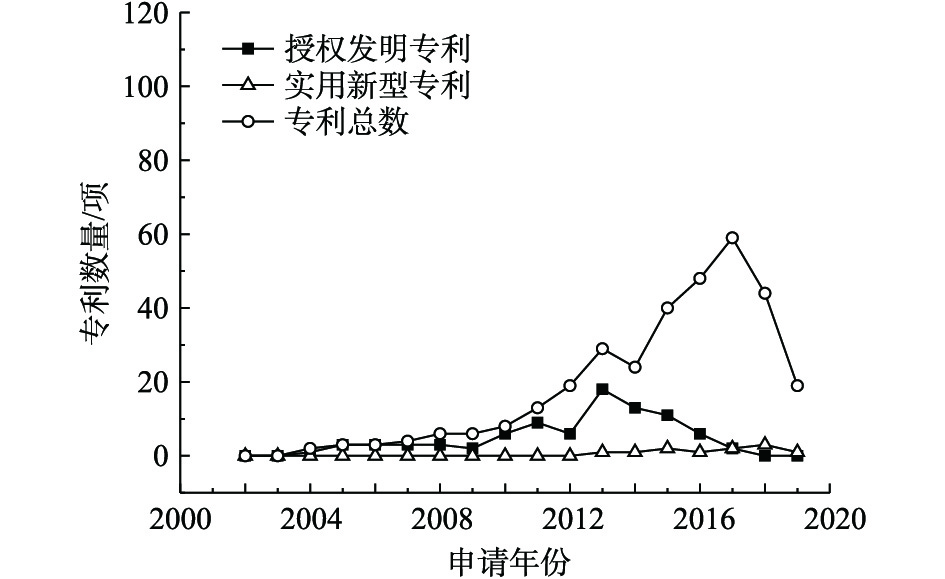
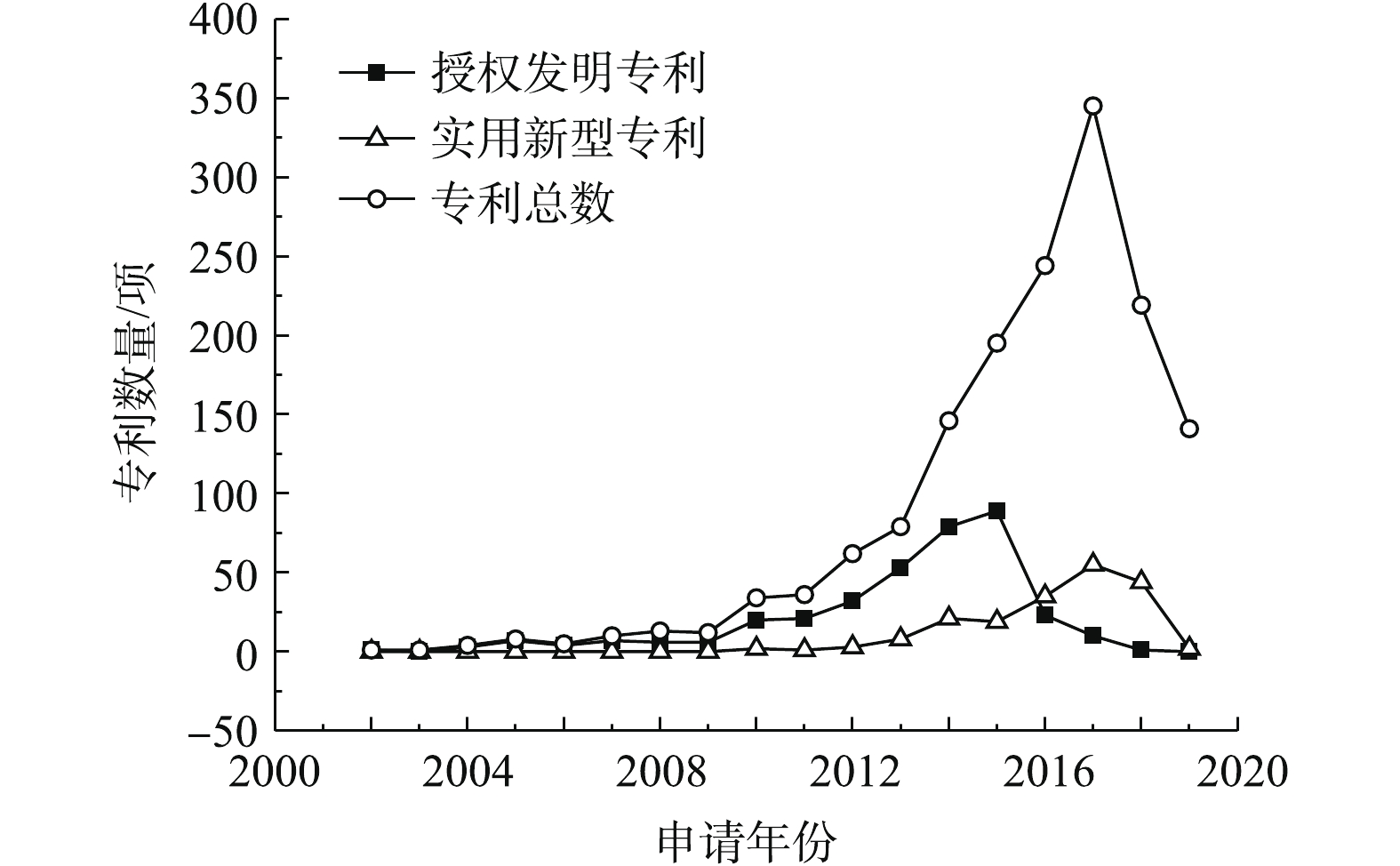
固化/稳定化技术修复重金属污染场地的公开专利总数、授权发明专利数量和实用新型专利数量统计结果见图2。该项技术在2010年才开始发展,整体呈现上升趋势,2013—2017年发展最为迅猛,近2年发展趋势有所回落。迄今为止,2015年固化/稳定化技术的授权发明专利数量最多,实用新型专利变化一直波动不大。固化/稳定化技术是一种高效、快速治理重金属污染场地的技术,该技术主要通过调节土壤pH、离子交换、螯合作用、络合作用、吸附作用等方式改变重金属离子的赋存形态,降低其生物有效性和生态毒性,从而达到固化/稳定化重金属的目的。近几年,固化稳定化技术的主要发展趋势是研发绿色环保固化/稳定化药剂、降低二次污染的风险。以往大量研究选用水泥、石灰等作为固化/稳定化修复药剂的主要成分进行修复,易出现土壤板结或过度石灰化的现象,既覆盖了重金属污染土壤的表面,影响治理效果,也不利于污染土壤的二次利用;部分研究选用化学药剂作为固化/稳定化修复药剂,易造成土壤盐碱化或者酸化、碱化土壤。因此,天然材料如秸秆、贝壳粉、木质素等材料的应用得到了重视。此外,国内重视以废治废、变废为宝的理念,对钢渣、废弃石膏、电石渣等进行利用,但由于易造成二次污染,材料逐渐由钢渣转变成具有生物可降解性的废料,如糖醛渣、农林废弃物、城市污水厂的污泥,降低成本和环境风险。
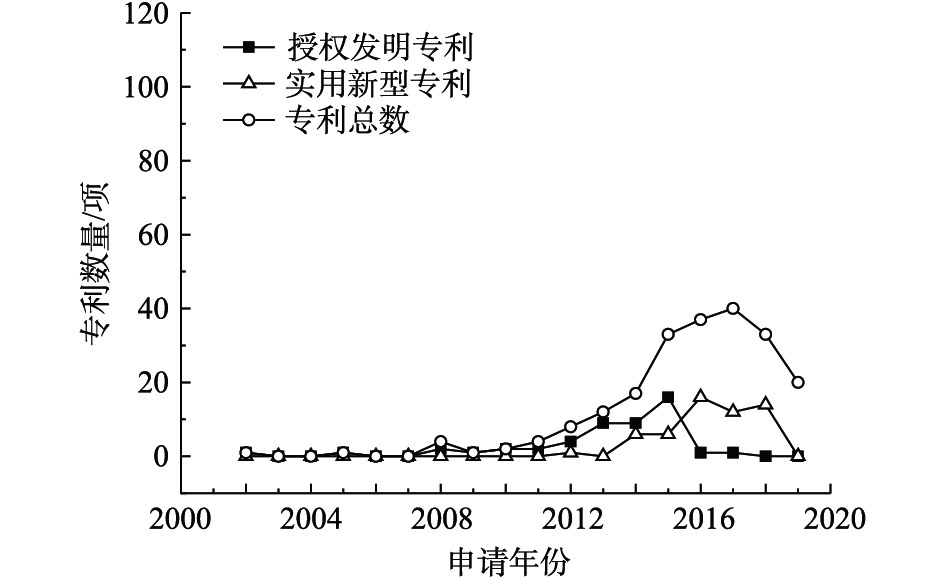
利用生物修复技术修复重金属污染场地的公开专利总数、授权发明专利数量和实用新型专利数量统计结果见图3。自2005年起,该项技术的专利总数基本呈现上升趋势,授权发明专利的数量在2013年后呈递减趋势,实用新型专利发展缓慢。生物修复技术是指利用自然界的生物资源,如通过微生物菌株、超累积植物和蚯蚓等吸收或移除土壤中的重金属,从而对重金属污染场地进行修复。该技术主要包括植物修复技术、动物修复技术、微生物修复技术、生物联合修复技术。目前,研究者偏向于发展动物和微生物辅助超累积植物吸收重金属为主的生物联合修复技术。近几年,研究重点主要包括3个方面:一是如何提高植物对重金属的吸收效率,常用方法包括施加生物炭基肥[10-12]、微生物复合菌剂[13-15]或动物[16-17]等;二是如何保证种子在重金属污染土壤中的存活率,现有的解决办法包括生态修复床[18-19]、人工包埋种子[20]、增加纤维丝隔离层[21-22]等;三是如何筛选生物资源,植物修复技术一般采用生物量大、生长迅速、重金属超累积容量大的植物,微生物修复技术则一般采用对重金属耐受性较高的菌株,例如芽孢杆菌和霉菌。
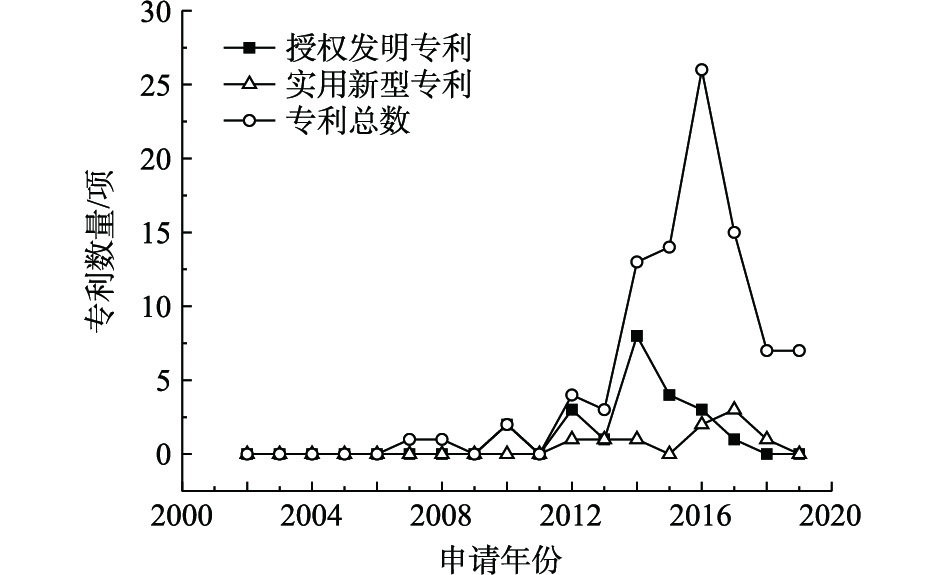
淋洗技术修复重金属污染场地的公开专利数量、授权发明专利数量和实用新型专利数量统计结果见图4。淋洗修复技术的公开专利在2011年开始发展,专利总数基本呈现上升趋势,2017年专利总数达到44项。淋洗修复技术主要是异位修复,须依赖装置设备,提高修复效果,降低淋洗剂用量[23-27]。其核心在于淋洗剂的选用和实际场地的实施,这2个要素决定了淋洗技术能否在重金属污染场地修复领域中广泛被应用。淋洗常选用酸溶液作为淋洗剂,但EDDS、聚环氧琥珀酸、柠檬酸、苹果酸等可生物降解的酸溶液价格昂贵,因此,常配合水、硝酸或盐酸、氯化铁水溶液、吐温80等其他淋洗剂使用,从而降低环境风险和药剂成本;场地实施一般利用振荡进行淋滤,为加快淋洗速度,郭红岩等[28]和郭军康等[29]开始研究通过微波/超声波等促进淋滤过程,目前,郭军康等[30]已同步设计了超声波强化萃取装置,但尚未有应用实例。
物理修复技术是指利用阻隔、吸附、电迁移、电泳、电渗析、热脱附、磁场效应等物理原理对重金属污染场地进行修复的技术,主要包括电动修复技术、吸附修复技术、阻隔修复技术、磁分离修复技术和热脱附修复技术。
电动修复技术的公开专利数量、授权发明专利数量和实用新型专利数量统计结果见图5。2017年之前电动修复技术的公开专利数量总体呈上升趋势,2017年达到最大值27项;授权发明专利数量有所波动,2017年前实用新型专利的数量呈持续上升的趋势。目前,电动修复技术的研究热点主要是电动装置的创新,既包括电极、电解液等的材料创新,也包括电动装置本身的结构组成创新。
吸附修复技术的公开专利数量、授权发明专利数量和实用新型专利数量统计结果见图6。2014年授权发明专利达到峰值,2015年实用新型专利开始发展。目前,研究比较成熟的有海藻酸钠制备吸附板和吸附微球[31-33]、农业废弃物制备生物炭[34-36]等,技术重点主要是对吸附材料进行改性提高其吸附效率,增大吸附容量;常用的原材料一般是黏土矿物,如凹凸棒土、膨润土、沸石、二元水滑石等,也有有机高分子材料,例如树脂、凝胶球等。
其他物理修复技术还包括磁分离修复技术、热脱附修复技术和阻隔修复技术等。磁分离修复技术只能应用于磁性重金属,2014年后,每年的公开专利数量维持在4~5项,2018年、2019年的公开专利总数均为6项;热脱附修复技术从2014年开始发展,整体呈缓慢的上升趋势,主要适用于含汞、砷的重金属污染场地,应用范围狭窄、耗能较高,研究重点是不同类型的热脱附装置[37-39],2014年开始发展,整体呈缓慢上升趋势;阻隔修复技术的公开专利数量保持波动。
联合修复技术的公开专利数量、授权发明专利数量和实用新型专利数量统计结果见图7,该项技术从2013年开始发展,公开专利数量总体呈现上升趋势,2017年,达到最大值为87项,主要集中为研究原位修复重金属污染的阻隔装置[40-42];授权发明专利的数量在2014年较多;实用新型专利则在2017年达到峰值。
联合修复技术指联合1种或2种以上技术进行重金属污染场地的修复治理,通常是以固化/稳定化技术、生物修复技术和淋洗修复技术为主,物理修复技术为辅进行。电动修复技术[43-46]、吸附修复技术[47-49]和热脱附修复技术[50-53]均常与淋洗修复技术联用,通过吸附等方式富集淋出液中的重金属后,淋出液可以进行回用,此外,其也常与生物技术联用,加快植物吸收重金属的速率;磁分离技术逐渐受到重视,该项技术配合固化/稳定化技术应用于重金属污染场地,可有效移除场地土壤中的重金属[54-55],配合淋洗技术使用则可以快速吸附淋出液的重金属,使得淋出液可以回用[56-59]。
3. 结论
1)近几年,研究者更加重视相关装置的发展,直接反映为实用新型专利的数量占比显著提高。
2)国内重金属污染场地修复技术的公开专利发展可分为4个阶段,2013—2017年发展迅猛,平均增长率为66项·a−1,近2年发展渐缓。其中,江苏省、北京市、广东省、湖南省的科研机构众多,公开专利总数也比较多。
3)综合适用对象范围、研究机构数量、公开专利数量及年份变化趋势等因素进行评估,可以看出,目前,发展较好的重金属污染场地修复技术依次为固化/稳定化技术、淋洗修复技术、物理修复技术,以废治废、降低成本仍然是研究热点。
-
-
[1] 黄曼曼, 邓百万, 武晓雨, 等. 石油污染土壤的微生物修复技术研究进展[J]. 黑龙江农业科学, 2017(4): 149-153. [2] 卢楠, 韩霁昌, 李刚, 等. 石油污染土壤生物修复技术进展[J]. 广东化工, 2016, 43(16): 131-132. doi: 10.3969/j.issn.1007-1865.2016.16.061 [3] 徐金兰, 宋少花, 黄廷林, 等. 柠檬酸改性Fenton氧化石油污染土壤的影响因素研究[J]. 西安建筑科技大学学报(自然科学版), 2015, 47(4): 605-608. [4] 丁宇, 张祥, 吕树光. Fe3+催化过氧化钙体系降解水中三氯乙烯[J]. 环境污染与防治, 2018, 40(4): 392-397. [5] LU S G, ZHANG X, XUE Y F, et al. Application of calcium peroxide in water and soil treatment: A review[J]. Journal of Hazardous Materials, 2017, 337: 163-177. doi: 10.1016/j.jhazmat.2017.04.064 [6] GOI A, VIISIMAA M, TRAPIDO M, et al. Polychlorinated biphenyls-containing electrical insulating oil contaminated soil treatment with calcium and magnesium peroxides[J]. Chemosphere, 2011, 82(8): 1196-1201. doi: 10.1016/j.chemosphere.2010.11.053 [7] ZHANG X, GU X G, LU S G, et al. Enhanced degradation of trichloroethene by calcium peroxide activated with Fe(III) in the presence of citric acid[J]. Frontiers of Environmental Science & Engineering, 2016, 10(3): 502-512. [8] REDE D, SANTOS L H, RAMOS S, et al. Ecotoxicological impact of two soil remediation treatments in Lactuca sativa seeds[J]. Chemosphere, 2016, 159: 193-198. doi: 10.1016/j.chemosphere.2016.06.002 [9] NDJOU’OU A C, CASSIDY D. Surfactant production accompanying the modified Fenton oxidation of hydrocarbons in soil[J]. Chemosphere, 2006, 65: 1610-1615. doi: 10.1016/j.chemosphere.2006.03.036 [10] 杨金凤, 陈鸿汉, 王春艳, 等. 生物通风技术修复柴油污染土壤的土柱模拟实验[J]. 环境工程学报, 2012, 6(2): 653-657. [11] 赵洲. 浅析《水质石油类和动植物油类的测定红外分光光度法》新旧标准的区别[J]. 环境科学导刊, 2012, 31(6): 131-133. doi: 10.3969/j.issn.1673-9655.2012.06.037 [12] 王慕华, 彭晓光, 麻杰, 等. 基于16S rRNA基因高通量测序的太原地区健康成年人肠道菌群结构分析[J]. 中国微生态学杂志, 2019, 31(7): 745-751. [13] SERA B, SERY M, GAVRIL B, et al. Seed germination and early growth responses to seed pre-treatment by non-thermal plasma in hemp cultivars (Cannabis sativa L.)[J]. Plasma Chemistry and Plasma Processing, 2017, 37(1): 207-221. doi: 10.1007/s11090-016-9763-9 [14] 汪艳杰, 胡志辉, 郭瑞, 等. 结荚期摘除叶荚对豇豆及其光谱荧光参数的影响[J]. 北方园艺, 2016, 40(23): 15-19. [15] 李佳, 曹兴涛, 隋红, 等. 石油污染土壤修复技术研究现状与展望[J]. 石油学报(石油加工), 2017, 33(5): 811-833. [16] ZHOU Y B, FANG X B, WANG T H, et al. Chelating agents enhanced CaO2 oxidation of bisphenol A catalyzed by Fe3+ and reuse of ferric sludge as a source of catalyst[J]. Chemical Engineering Journal, 2017, 313: 638-645. doi: 10.1016/j.cej.2016.09.111 [17] 樊坤, 伊艳杰, 刘阳, 等. 基于高通量测序分析驴皮肤病病灶中细菌菌群组成[J]. 动物医学进展, 2019, 40(6): 37-41. doi: 10.3969/j.issn.1007-5038.2019.06.007 [18] LEE M D, THOMAS J M, BORDEN R C, et al. Biorestoration of aquifers contaminated with organic compounds[J]. Critical Reviews in Environmental Control, 1989, 18: 29-89. [19] MALACHOWSKA-JUTSZ A, NIESLER M. The effect of calcium peroxide on the phenol oxidase and acid phosphatase activity and removal of fluoranthene from soil[J]. Water, Air and Soil Pollution, 2015, 226: 226-365. doi: 10.1007/s11270-015-2469-4 [20] 侯景清, 王旭, 陈玉海, 等. 乳酸菌复合制剂对盐碱地改良及土壤微生物群落的影响[J]. 南方农业学报, 2019, 50(4): 710-718. doi: 10.3969/j.issn.2095-1191.2019.04.05 [21] KONG X, YU S Y, XU S, et al. Effect of Fe0 addition on volatile fatty acids evolution on anaerobic digestion at high organic loading rates[J]. Waste Management, 2018, 71: 719-727. doi: 10.1016/j.wasman.2017.03.019 [22] LIU S J, XI B D, QIU Z P, et al. Succession and diversity of microbial communities in landfills with depths and ages and its association with dissolved organic matter and heavy metals[J]. Science of the Total Environment, 2019, 651: 909-916. doi: 10.1016/j.scitotenv.2018.09.267 [23] 陈颖, 杨华, 乐利, 等. 过氧化氢对银杏悬浮细胞黄酮含量及抗氧化酶活性的影响[J]. 中南林业科技大学学报, 2014, 34(12): 40-45. doi: 10.3969/j.issn.1673-923X.2014.12.008 [24] 张晓龙, 王闪闪, 王乃喜. 外源过氧化氢对弱光下黄瓜幼苗抗氧化酶的影响[J]. 长江大学学报(自然科学版), 2013, 10(17): 11-14. [25] GAO X T, ZHANG A, HEROUX P, et al. Effect of dielectric barrier discharge cold plasma on pea seed growth[J]. Journal of Agricultural and Food Chemistry, 2019, 67(39): 10813-10822. doi: 10.1021/acs.jafc.9b03099 [26] CORPAS F J, BARROSO J B. Peroxisomal plant metabolism-an update on nitric oxide, Ca2+ and the NADPH recycling network[J]. Journal of Cell Science, 2018, 131(2): 1-8. -






 下载:
下载: