-
近年来,随着我国医疗、畜禽和水产养殖等行业快速发展,抗生素的用量日益增加。磺胺甲噁唑(sulfamethoxazole, SMX)作为一种人工合成的广谱抗菌药物,频繁被用作渔药、兽药等大量排入环境水体中[1-3]。有关磺胺甲噁唑在不同水体环境中对不同对象造成的影响已有相关报道[4-6]。长期摄入SMX会损伤机体免疫力、影响动物发育、对地表水和地下水产生不可修复的损坏,严重破坏生态环境。
有研究表明,在废水处理中,传统的水处理技术如臭氧法[7]、离子交换法[8]对SMX的去除效果并不理想,光催化降解、生物降解等处理方法尽管已被证实能够有效去除SMX,但其价格昂贵且会生成中间产物[9-10]。吸附法是一种成熟的水处理方法,因吸附剂具有简单高效、可以重复利用等特点,故其应用较为广泛,被认为是能有效去除SMX的方法之一[11-12]。常见的吸附剂有活性炭、石墨烯、碳纳米管等,对污染物具有良好的吸附去除效果[13-14]。NAM等[15]用经过超声处理后的氧化石墨烯吸附磺胺甲噁唑,去除率约为30%。MOUNI等[16]用硫酸氧化改性杏壳活性炭吸附水溶液中Pb2+,最大吸附量为21.38 mg·g−1。但吸附剂的经济性、环保性是影响其广泛应用的首要条件,因此,将廉价易得的生物质制备成生物炭材料近年来广受关注。
松针作为生物炭材料的一种,具有四季均可采收、高产出量的特点,将废弃的松针用于磺胺甲恶唑的去除,既为水处理技术提供了一种新思路,又完成了废弃松针的资源化转化。AHMAD等[17]利用在300、500、700 ℃下制备得到的松针生物炭吸附三氯乙烯,结果表明,700 ℃制备得到的松针生物炭表面疏水性高、表面积大、有利于吸附,其对三氯乙烯的去除效果最好。改性会使生物炭的孔隙结构、比表面积等发生改变,合适的改性方法对废水中污染物的去除有实际应用意义。改性方法有许多,包括金属负载改性和氧化改性等[18]。常用的氧化剂有盐酸、硝酸、氢氧化钠、过氧化氢等。ZHANG等[19]用磷酸盐改性后的竹炭生物炭,其吸附Cd(Ⅱ)能力较原始竹炭提高近10倍,对Cd(Ⅱ)的去除率可达85.78%。张江等[20]使用海藻酸钠和氯化铁溶液制备改性石墨烯-生物炭复合材料吸附磺胺嘧啶,平衡时吸附量在20 mg·kg−1以上。本研究以常见的松针为原料,利用盐酸制备出松针生物炭,吸附去除水体中的磺胺甲噁唑,通过FT-IR、SEM、BET对其进行了微观表征,分别考察了PBC投加量、pH、阴离子等对SMX去除效果的影响,并采用吸附等温模型和吸附动力学模型进行分析研究,从而探讨了其吸附机制,为生物炭的实际应用提供参考。
-
松针收集于苏州某公园内,磺胺甲噁唑(C10H11N3O3S)购于Sigma-Aldrich,盐酸(HCl)、硫酸(H2SO4)、氢氧化钠(NaOH)均为分析纯,实验中用水为超纯水。
-
将松针剪至3 cm左右,在已有研究[21]的基础上改进后,用超纯水将表面杂质洗净,至上清液出水澄清,在100 ℃烘箱中干燥后取出备用。将干燥后的松针经10% HCl浸泡12 h进行改性处理,并将其超声清洗15 min,再以超纯水反复清洗至中性,再将干燥的松针置于恒温鼓风烘箱中,200 ℃下预氧化2 h,最后于箱式气氛炉中700 ℃条件下活化60 min,活化时通入氮气加以保护。冷却至室温后,将其取出并研磨,筛选>100目粒径,将其密封保存,记为PBC。
-
在进行吸附实验时,室温下,向100 mL浓度为0.04 mmol·L−1的SMX溶液中迅速加入0.04 g PBC,在磁力搅拌器上启动反应,并记为反应开始时间,在预定时间快速取样,经0.22 μm滤膜过滤。过滤液用高效液相色谱仪(HPLC)测定其浓度。采用NaOH和H2SO4调节溶液初始pH。
在进行重复利用实验时,准确称取0.2 g PBC,加入浓度为0.2 mmol·L−1的SMX溶液中,实验结束后过滤材料,烘干称重。根据实验后PBC剩余量,按照PBC与SMX质量比4∶1确定下一次实验中SMX浓度,重复吸附实验,实验共进行5次。
-
SMX浓度利用美国Agilent公司1260型高效液相色谱仪测定。流动相为乙酸(1‰)和甲醇,具体配比为60∶40,流速为1.0 mL·min−1,色谱柱为C18柱(4.6 mm×250 mm,5 μm),检测波长为225 nm,进样量为40 µL。采用美国FEI Quanta 250扫描电子显微镜(SEM)测定材料表面形貌特征;用美国Micromeritics ASAP2020全自动比表面积测定仪(BET)分析材料比表面积及孔隙结构;采用美国Thermo公司Nicolet 6700型傅里叶变换红外光谱仪(FT-IR)测定PBC表面活性官能团。
-
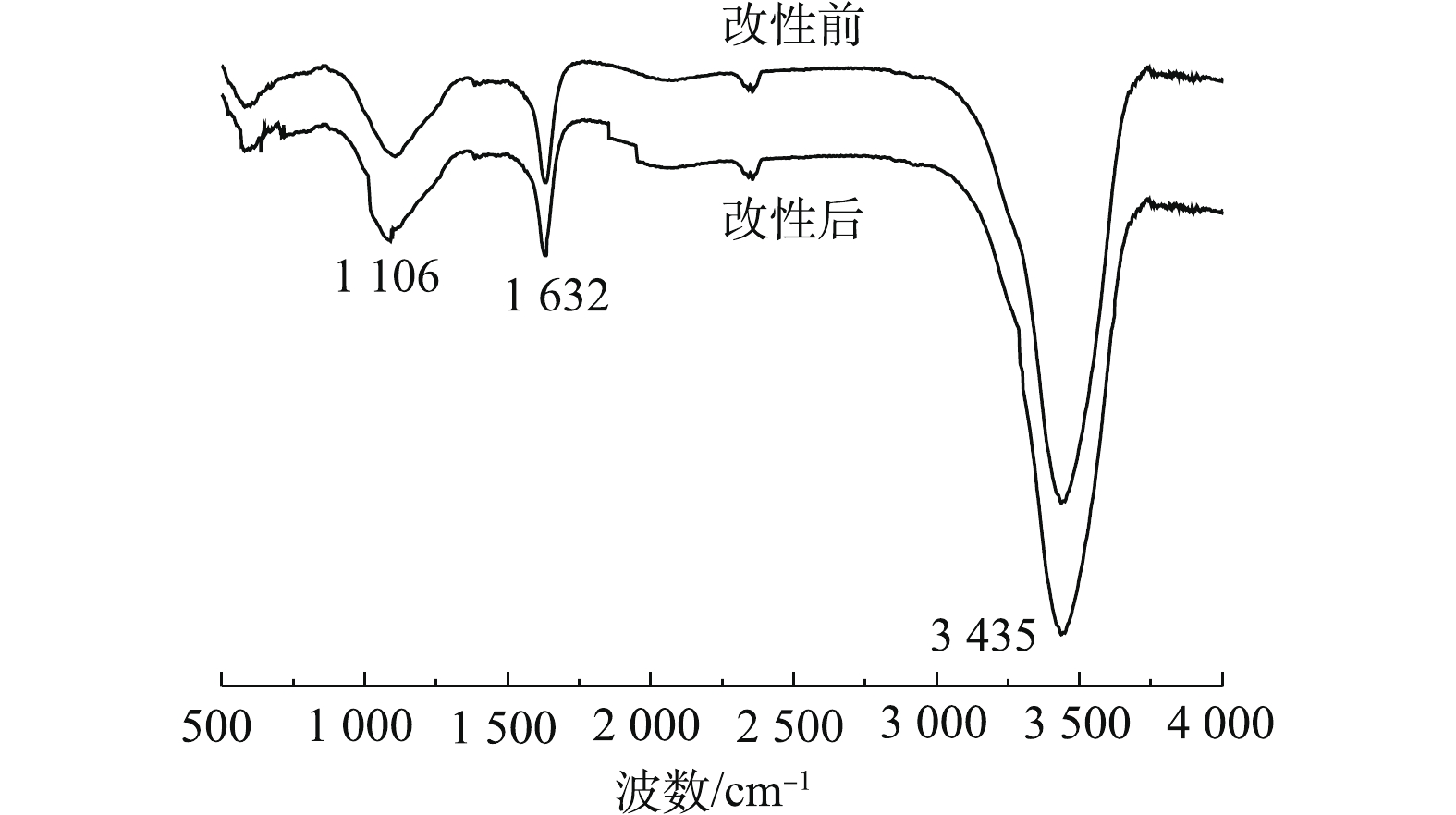
1)傅里叶红外光谱(FT-IR)分析。PBC改性前后的红外光谱如图1所示。可以看出,PBC在改性前后特征吸收峰的位置基本相同。在3 435 cm−1处的吸收峰为O—H的伸缩振动吸收峰;位于1 632 cm−1处的吸收峰可归于羧基的碳氧双键(C=O)产生的;在1 106 cm−1处为C—O对称伸缩振动峰。改性后在3 435、1 632和1 106 cm−1处吸收峰强度均有所增强,这说明改性有利于使PBC表面活性官能团含量增多。由此可见,PBC中主要含有羧基和羟基等含氧官能团,可以与SMX中的苯环电子形成氢键[22],有利于吸附的发生。
2)扫描电镜(SEM)分析。图2(a)和图2(b)分别为PBC改性前后的SEM图。由图2(a)可见,改性前的松针生物炭表面光滑,无明显孔隙结构;改性后的松针生物炭表面更加疏松、凹凸不平(图2(b)),颗粒物破碎程度加深,孔隙结构更加复杂,这些特征均有利于吸附反应的进行。
3)比表面积(BET)分析。比表面积和孔径结构测定结果见表1。由表1可知,PBC的比表面积在吸附前为391.0 m2·g−1,吸附后较吸附前降低了30.1%,PBC吸附后的微孔体积及平均孔深较吸附前也均有所降低。原因可能是吸附后的SMX附着在PBC表面,占据了PBC的吸附点位,堵塞了PBC的一些微孔。
-
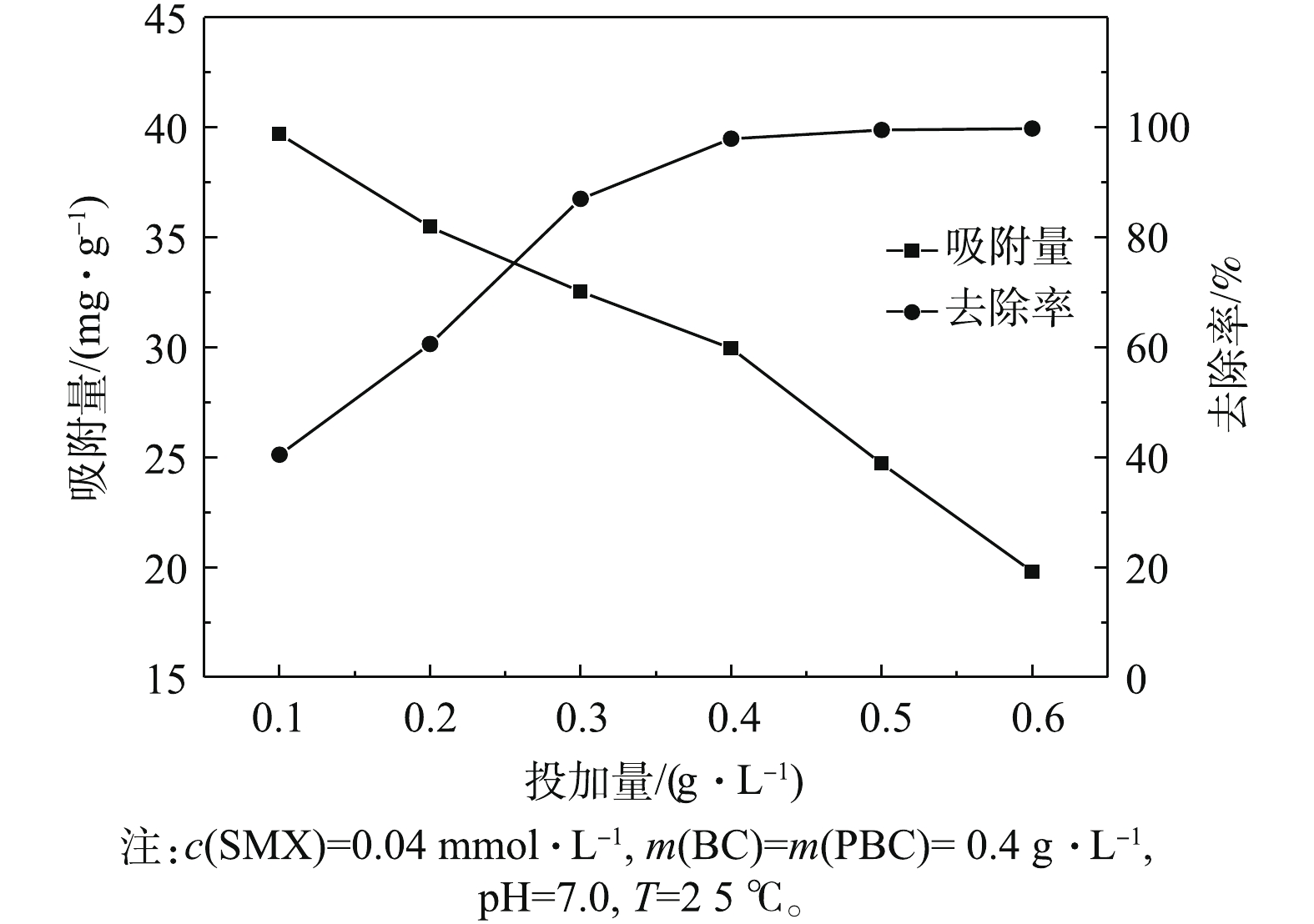
图3为PBC投加量对SMX去除效果的影响结果。分别选取0.1、0.2、0.3、0.4、0.5、0.6 g·L−1 PBC,反应达平衡后测得SMX平衡吸附量及SMX去除率。结果表明,在不同投加量条件下,PBC对SMX的去除率有所不同。随着PBC投加量的增加,对SMX的去除率呈先显著增大后逐渐趋于平衡的趋势。当投加量为0.5 g·L−1时,去除率可达到99.5%;当投加量继续增加到0.6 g·L−1时,去除率可高达100%,但在吸附过程中单位吸附量逐渐减少。其原因可能是,提高PBC投加量可降低吸附剂和吸附质之间的浓度梯度[23]。在PBC投加量较低时,PBC表面的吸附点位得到充分利用,PBC对SMX有较高的吸附量。随着投加量的增加,大量的吸附剂使SMX迅速吸附到PBC表面,导致溶液周边的SMX浓度降低,单位吸附容量下降。因此,选择0.4 g·L−1作为PBC最适投加量进行后续的实验。
-
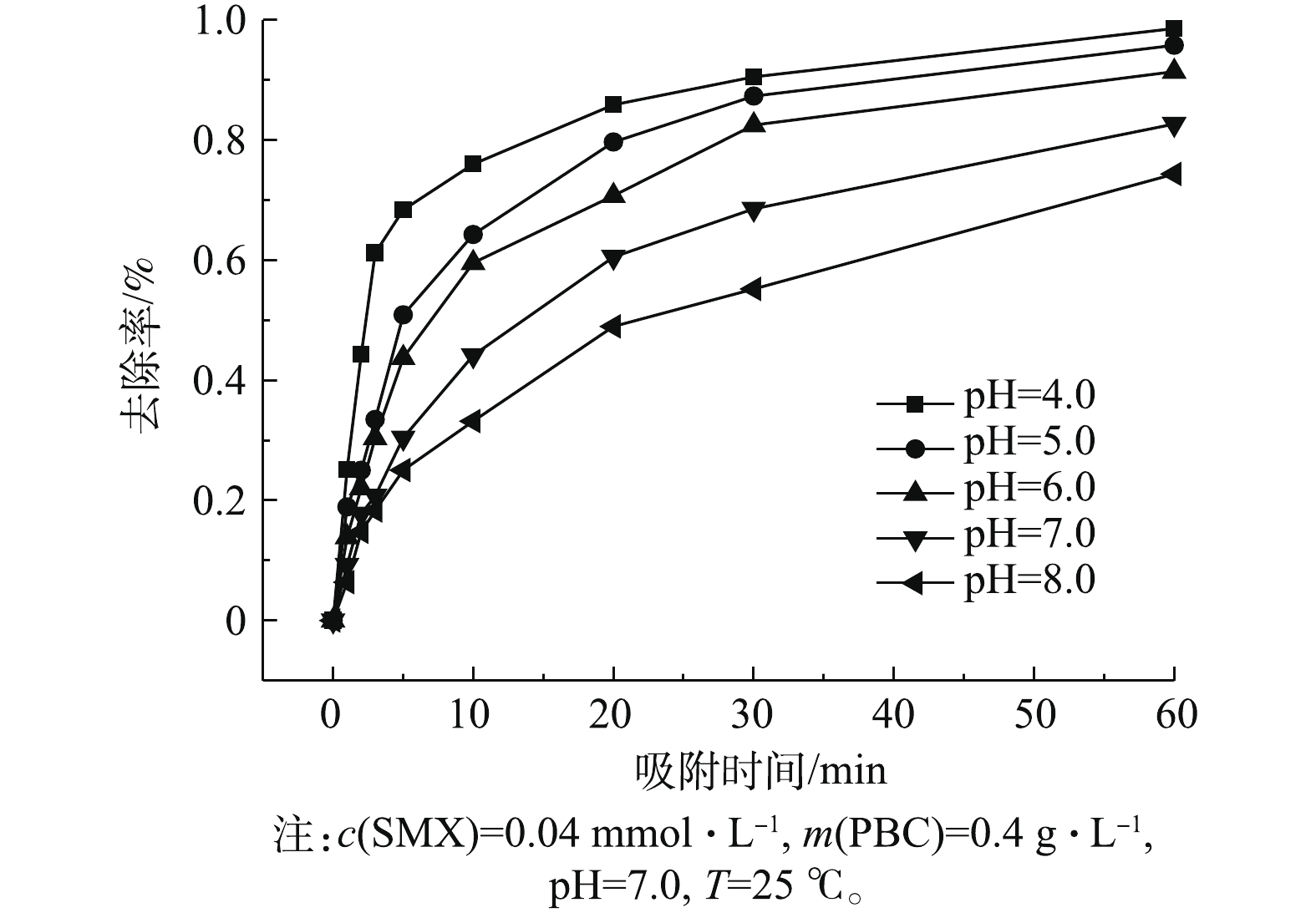
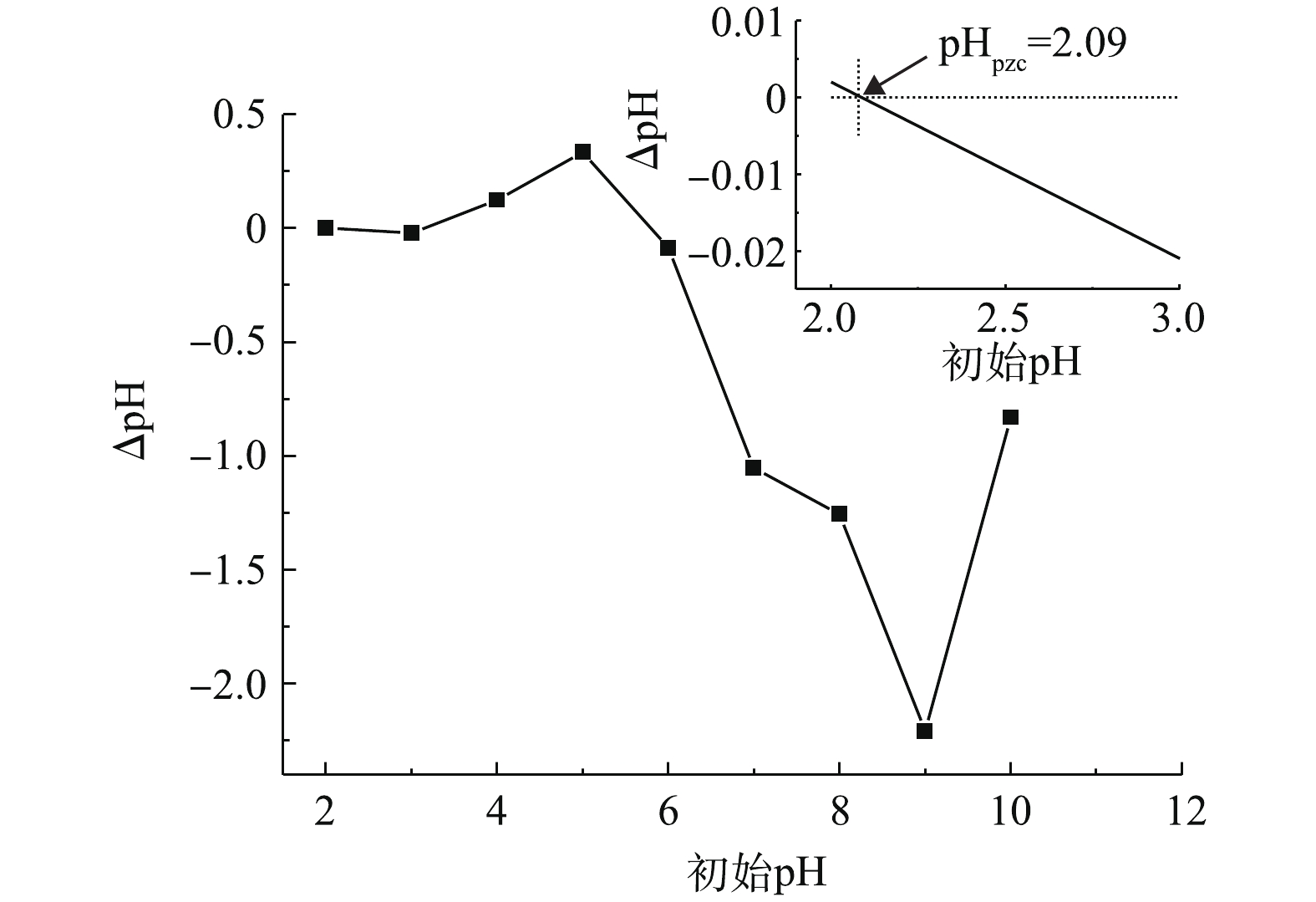
考察了初始pH(4.0~8.0)对PBC吸附SMX的影响,结果如图4所示。由图4可知:当pH为4.0~8.0时,随着pH升高,SMX去除率下降;当pH为4.0时,去除率达96.5%;当pH为8.0时,去除率降至76%。这可能与SMX的pKa有关。有研究[24]表明,SMX的pKa1为1.7,pKa2为5.6,当溶液pH小于pKa1时,SMX表面带正电荷;当pKa1<pH<pKa2时,SMX表面所带正电荷减少;当溶液pH>pKa2时,SMX以阴离子形态存在。PBC的零点电荷测定值为pHpzc=2.09(如图5所示),当溶液pH>pHpzc时,PBC表面带负电荷;当溶液pH为6.0、7.0和8.0时,pH>pKa2,此时SMX分子会与PBC发生静电排斥作用,故不利于吸附。因此,当溶液pH为4.0时,PBC对SMX的吸附效果最好。随着pH的增加,静电相互作用增强,吸附容量减弱,去除率也随之降低。有研究[25-26]也表明,溶液中pH的增加会降低黑碳对磺胺类抗生素的吸附能力。
-
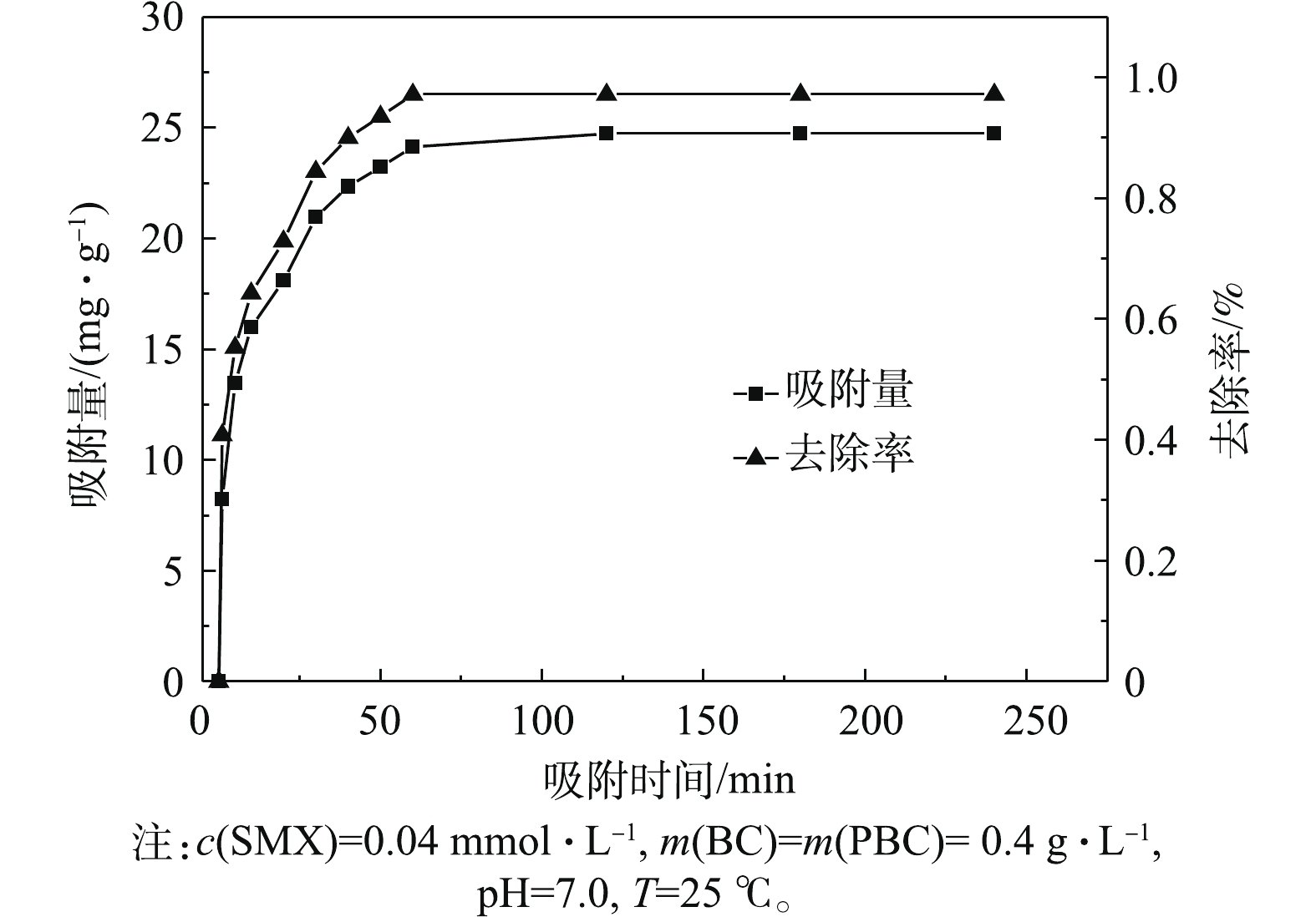
PBC对SMX的去除效果与吸附时间有关。为了使吸附反应彻底,实验须进行240 min,结果如图6所示,在0~60 min内,吸附容量和去除率都随时间增加明显增大,且吸附速率很快。当吸附60 min时,PBC对SMX去除率达97.1%,吸附容量为24.73 mg·g−1。当60 min以后,PBC去除率再无变化,证明吸附完全。当吸附时间为180 min时,吸附容量和去除率均无变化,说明吸附达平衡。可以解释为起初PBC表面的活性点位较多,使得SMX向PBC表面扩散速度很快。随着吸附时间的增加,吸附剂孔隙中的活性点位被SMX占据不断减少,吸附速率下降,从而使吸附过程趋于平衡。
-
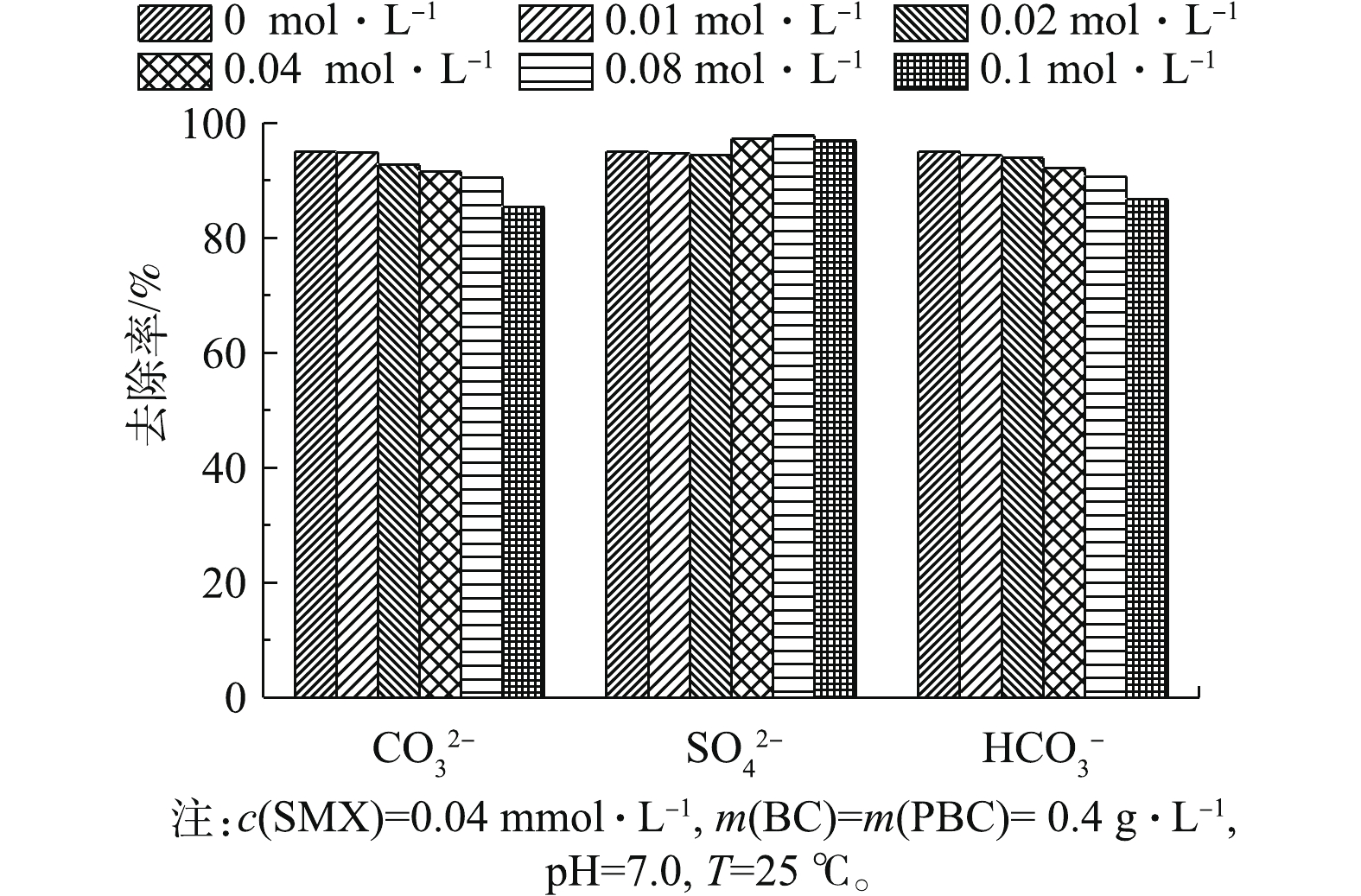
在实际应用中,天然水体中含有的
CO2−3 、SO2−4 、HCO−3 等阴离子可对材料的吸附性能造成不同程度的影响。本研究选用Na2CO3、Na2SO4和NaHCO3,考察了其在不同离子浓度下对PBC吸附SMX效果的影响,结果如图7所示。由图7可知,当CO2−3 和HCO−3 浓度从0 mol·L−1升高至0.1 mol·L−1时,SMX去除率分别降低了9.57%和8.56%,随CO2−3 和HCO−3 浓度的增加,PBC对SMX的去除率逐渐降低,这说明CO2−3 和HCO−3 浓度升高会抑制吸附反应的进行,CO2−3 抑制作用略强于HCO−3 。抑制原因可能归为2个方面:一方面,CO2−3 和HCO−3 阴离子会占据PBC表面的活性点位,阻碍吸附反应的进行;另一方面,CO2−3 和HCO−3 在水溶液中呈碱性。而有研究[27]表明,碱性环境不利于磺胺类抗生素的吸附,SO2−4 浓度增加对去除率影响变化不大,这可能因为SO2−4 在水溶液中是中性的,故就整个吸附进程来说,其对去除率的影响较小。 -
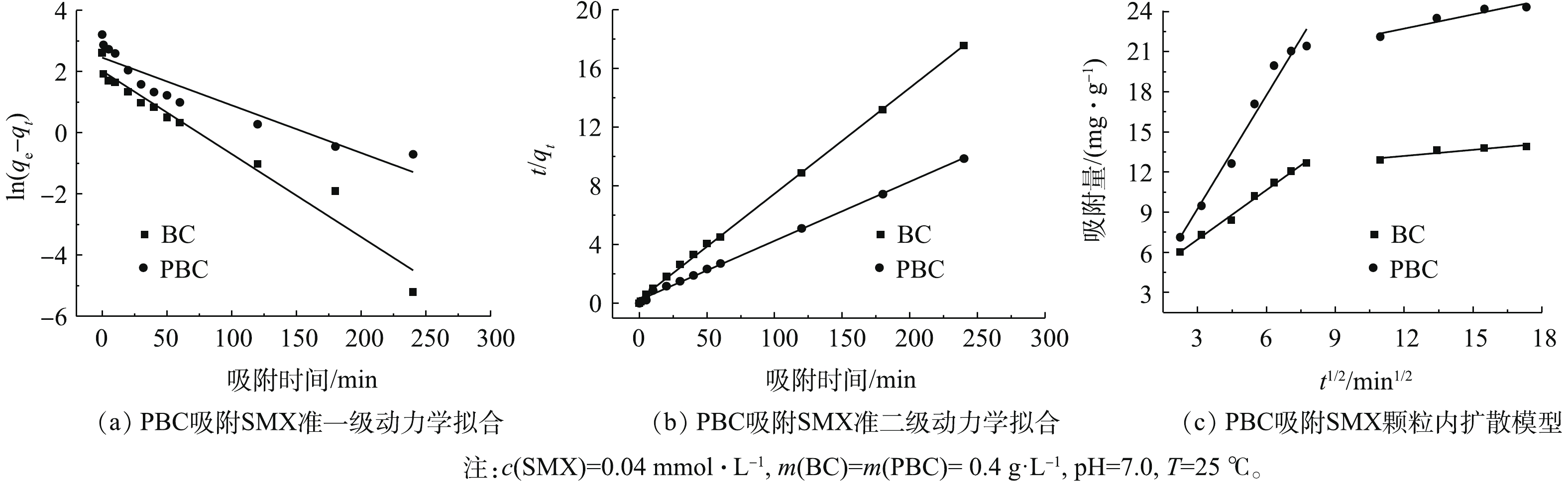
研究吸附动力学是了解吸附机制的重要途径。为了研究PBC对SMX吸附的动力学行为,分别利用准一级和准二级动力学模型对实验获得的吸附数据进行动力学拟合分析(图8)。准一级和准二级动力学模型拟合结果如图8(a)和图8(b)所示。表2列出了利用准一级和准二级动力学模型对实验数据进行拟合的结果,准二级动力学模型对SMX的实验数据拟合的可决系数较高(R2>0.99),且应用准二级动力学方程得出的qe的计算值与测得结果更为接近,这说明使用准二级动力学模型可以更好地描述此吸附过程。由表2可知,PBC对SMX的吸附量为24.79 mg·g−1,约为改性前的2倍。颗粒内扩散模型结果见图8(c)。由图8(c)可以看出,吸附过程分为2个阶段:第1阶段的斜率大,说明吸附速率快,原因是SMX分子直接在PBC表面占据其吸附位点;第2阶段直线缓慢上升,可能是由于PBC表面的吸附位点被占据,使得SMX分子只能在粒子内部扩散作用下进入到PBC内部占据其微孔点位[28]。拟合曲线不通过原点,表明表面扩散和颗粒内部扩散共同控制吸附进程。
-
吸附等温线模型反映了吸附平衡时吸附质分子在液相和固相间的分配情况,是描述吸附剂性能的重要指标。PBC对SMX的吸附过程可用2种吸附等温线模型描述。将等温吸附实验数据分别与Langmuir模型和Freundlish模型进行拟合,所得相关参数如表3所示。由表3可知,Freundlish模型的可决系数(R2>0.98)高于Langmuir模型的可决系数(R2>0.87),由此可见,PBC对SMX的吸附过程用Freundlish模型拟合效果更好。Freundlish模型描述了吸附质吸附于吸附剂表面的非均相多层吸附假设[29],模型参数n>1[30],说明PBC和SMX间有较强的吸附力。KF随温度升高而增加,说明此吸附过程为吸热过程。
-
在不同温度下PBC对SMX的吸附热力学参数如表4所示。由表4可知,3个温度条件下标准吉布斯自由能变(ΔG)均小于零,且随温度的升高,ΔG的绝对值增大。这说明PBC对SMX的吸附过程是自发进行的,且温度升高,自发趋势增大。焓变(ΔH)大于零,表明PBC对SMX的吸附反应为吸热反应,且升高温度有利于吸附反应进行。熵变(ΔS)大于零,这说明吸附体系的混乱程度增加, 吸附反应发生在固液两相界面上。
-
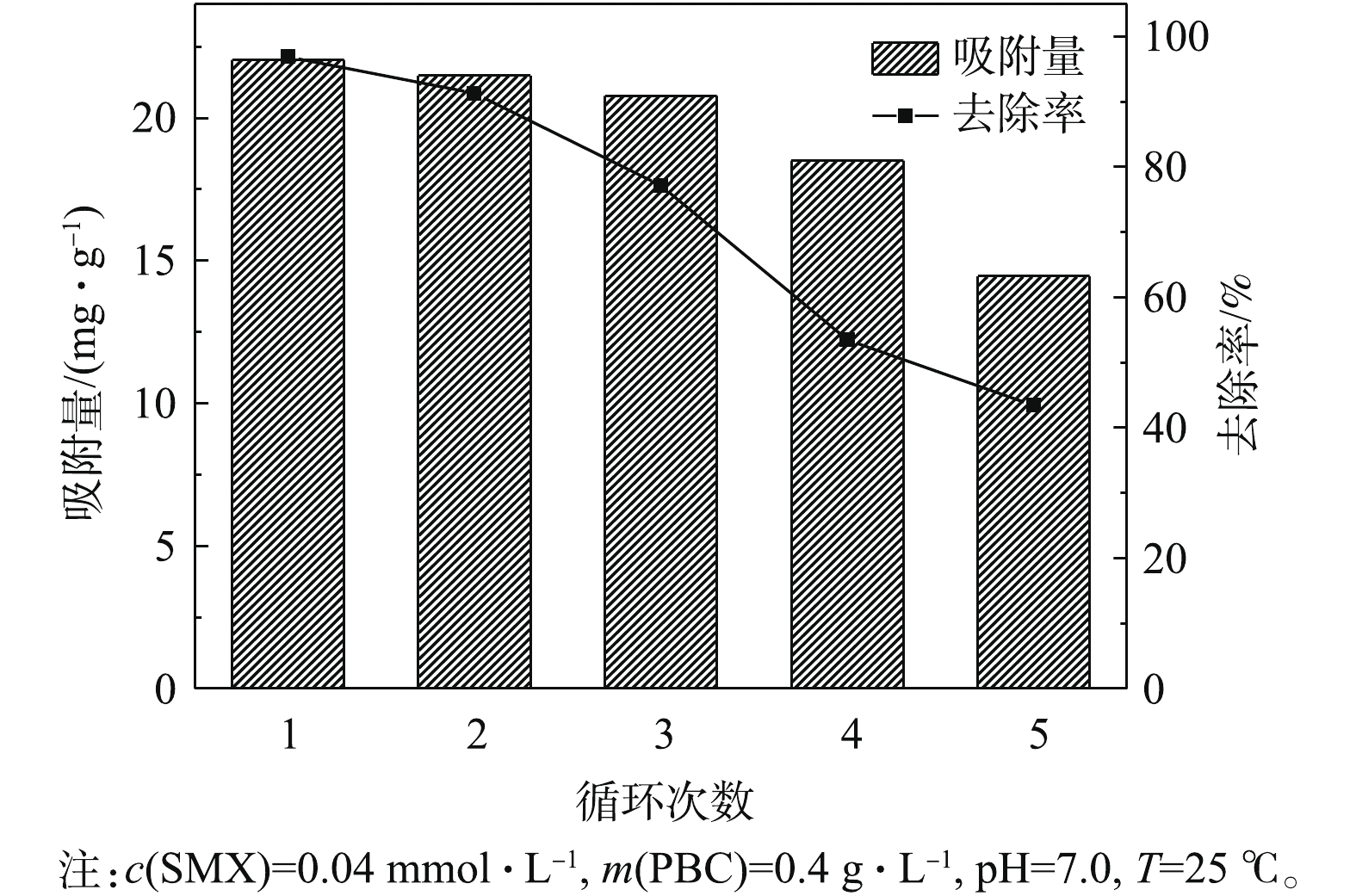
吸附剂的重复利用性能是衡量其经济价值的重要指标[31],通过5次实验考察了PBC的重复利用效果。由图9可知,PBC在第1、2和3次使用时,对SMX的去除率分别为96.9%、91.3%和77.1%。虽然PBC对SMX的吸附量和去除率均随着使用次数的增加在逐渐减少,但其仍具有较好的吸附效果。从第4次开始,PBC吸附性能明显有所下降,原因可能是PBC表面的吸附点位被SMX逐渐占据至饱和所致。但5次实验结束后,PBC吸附量仍为14.45 mg·g−1,去除率为43.4%,且保持稳定。由此可见,PBC是一种可回收、高效的吸附剂。
-
1)经盐酸改性后PBC表面更加粗糙疏松。经盐酸改性后的松针生物炭对SMX的吸附量约为改性前的2倍,这说明盐酸改性后的PBC对SMX的吸附性能具有显著提升。
2)在pH为4.0时,吸附剂对SMX的吸附效果最好;
CO2−3 和HCO−3 对SMX的去除起抑制作用,CO2−3 抑制作用更强;SO2−4 对吸附反应影响较小。3) PBC对SMX的吸附过程更符合准二级动力学模型学模型和Freundlish等温线吸附模型,吸附热力学参数表明PBC对SMX的吸附为自发的吸热反应。
4) PBC在循环使用5次后,对SMX的去除率仍在40%以上,依然维持着良好的吸附去除效果。因其具有吸附效果好、成本低、可回收等优点,因此,可以认为经盐酸活化后的松针炭可能是去除水中SMX最佳的吸附剂之一。
盐酸改性松针生物炭对磺胺甲噁唑的吸附性能
Adsorption performance of hydrochloric acid-modified pine needle biochar on sulfamethoxazolef
-
摘要: 以松针为原料,使用盐酸活化制备获得松针生物炭(PBC),将其用于吸附去除水体中的磺胺甲噁唑(SMX)。分别考察了投加量、pH、吸附时间、阴离子浓度等因素对PBC吸附性能的影响,采用吸附动力学模型和吸附等温模型对吸附过程进行了拟合分析。FT-IR、SEM和BET表征结果证明,经盐酸活化后的松针生物炭表面疏松多孔,含有羧基和羟基等含氧官能团。吸附实验结果表明:当PBC投加量为0.4 g·L−1时,吸附60 min后SMX去除率可达97.1%;当pH为4.0~8.0时,随着pH升高,PBC对SMX的去除率下降;
CO2−3 和HCO−3 对吸附反应起抑制作用,CO2−3 抑制作用更强,SO2−4 对吸附过程影响较小;PBC对SMX的吸附可用准二级动力学方程来描述,与Freundlich等温方程式拟合度更好(R2>0.98);热力学数据表明PBC对SMX的吸附过程是自发的吸热反应;5次实验后PBC对SMX的去除率仍在40%以上。考虑到PBC吸附效果好,可重复利用,说明PBC具有良好的应用前景,研究可为水污染治理的应用提供参考。Abstract: The pine needle biochar (PBC) was prepared with resource of pine needles and activation agent of hydrochloric acid, and was used to adsorb and remove sulfamethoxazole (SMX). The effects of dosage, pH value, initial pH, adsorption time and concentration of coexistence anions on the adsorption performance of PBC were investigated. The adsorption kinetics model and adsorption isotherm model were used to conduct the fitting analysis. The characterization results of scanning electron microscopy (SEM), Surface area analysis (BET) and Fourier transform infrared spectroscopy (FT-IR) demonstrated that the pine needle biochar activated by hydrochloric acid had loose and porous surface and contained oxygen functional groups such as carboxyl groups and hydroxyl groups. The removal rate of SMX reached 97.1% after 60min adsorption at PBC dosage of 0.4 g·L−1. Within the pH range from 4.0 to 8.0, SMX removal rate by PBC decreased as pH increased. BothCO2−3 andHCO−3 inhibited the adsorption reaction and the former was stronger.SO2−4 had slight effect on the adsorption process. The SMX adsorption by PBC could be described by quasi-second-order kinetic equation, and be better fitted by Freundlich isotherm equation (R2>0.98). The thermodynamic parameters indicated that the adsorption process of PBC to SMX was a spontaneous endothermic reaction. The SMX removal rate by PBC was still above 40% after five recycles. Considering the good adsorption and recycle effects, PBC has a good application prospect. This study can provide reference for its application in water pollution control.-
Key words:
- pine needle biochar /
- adsorption /
- sulfamethoxazole
-
随着时代不断发展,城市内涝频繁发生,排水管网淤堵问题备受人们关注。排水管道沉积物是污水中的可沉降颗粒物,在排水管网运行过程中,这些颗粒物在适当条件下发生沉降并逐渐积累,形成底层沉淀物沉积在排水管道中[1]。沉积堵塞排水管网的物质主要包括有机物、无机物以及固体垃圾[2]。管网沉积物中所含的有机质一般是复杂的高分子物质,如脂类、糖类、蛋白质、动植物腐殖质以及微生物等[3]。也有研究将管网沉积物分为3类:底层粗颗粒沉积物、有机层和生物膜[4]。其中,生物膜通常形成于水面附近的管壁,或受扰动作用较小的沉积物表面上,由覆盖在有机质上的微生物构成[5]。胞外聚合物(extracellular polymeric substances, EPS)作为微生物的重要组成部分,其主要成分为多糖、蛋白质、核酸、脂肪、胞外 DNA 等[6],具有粘性和吸附性,对排水管道的淤积及冲刷具有重要影响。传统的管网机械清淤方法均存在人工消耗量大,施工过程中影响道路交通等问题。因此,探究生物或化学方法来减缓管网中沉积物的沉积速率,降低管网清淤与维护频率是解决排水管网淤堵问题新的研究方向。
相关研究表明,利用纤维素酶或蛋白酶可破坏污泥EPS,促使污泥颗粒变得细小分散,污泥颗粒比表面积增大,酶与细胞接触面积增加,并且EPS 的分解还降低了其对污泥细胞的保护作用,进而提高了酶对污泥的水解效率[7]。YANG等[8]研究发现经酶解后,污泥细胞破解,胞内物质流出,大大提高了污泥后续厌氧消化的效率并缩短了污泥消化时间。此外,LU等[9]报道了酸性处理过程中污泥内部酶(蛋白酶和α-葡萄糖苷酶)的释放也可以增强厌氧发酵污泥的破解。
同时,在污泥处理方面,表面活性剂也有其不可或缺的作用。表面活性剂的增溶作用和分散作用[10]使胞外聚合物脱离污泥溶于液相[11];而表面活性剂结构中自带的疏水烷基可与细胞壁相互作用,导致细胞溶解,破坏细胞结构和EPS[12]。王怡等[13]研究表明,添加SDS(十二烷基硫酸钠)可以促进剩余污泥水解,EPS中溶解性蛋白质和多聚糖含量大幅增加,污泥的粒径变小、比阻变大。WANG等[14]研究发现阴离子表面活性剂SDS可以增加体系中的负电荷,EPS与SDS之间的静电排斥和疏水相互作用使污泥中的EPS大量释放。LUO等[15]研究了SDS与酶制剂联合作用对剩余污泥水解酸化的影响,结果表明,组合体系比单一SDS和单一酶体系更能有效促进污泥水解,SDS和复配酶体系优于SDS和单一酶体系的水解性能。由于表面活性剂联合生物酶技术不仅反应条件温和,对管道无腐蚀和破坏性,并且两者联合对管网中有机沉积物具有较好的水解作用,有利于降低沉积物间的黏性,促进有机质从固相向液相转移,强化其冲刷性能,从而为解决排水管网淤堵问题提供新的解决方法,但目前尚未有关于该方面的报道。
基于对排水管网中沉积物的性质分析,根据课题组前期研究结果,本研究在确定复配酶(α-淀粉酶∶中性蛋白酶=2∶3)投加量的质量百分比为8%的条件下,探究不同SDS投加量、反应温度、初始pH(7.28±0.3)和反应时间对SDS+复配酶体系对沉积物水解效果的影响,根据反应前后沉积物EPS、三维荧光、粒径和SEM(scanning electron microscope)表征结果对其水解沉积物的机理进行了深入分析;采用高通量测序技术对经复配酶(α-淀粉酶∶中性蛋白酶=2∶3)、SDS+复配酶(α-淀粉酶∶中性蛋白酶=2∶3)水解后的排水管网沉积物中微生物群落结构与功能菌群的影响进行了分析,探讨了不同方法对微生物群落结构的影响。
1. 材料与方法
1.1 污泥样品
实验所用管网沉积物取自天津市某排水管道检查井,取回的污泥样品封装于样品袋中,存放在4 ℃冰箱内里冷藏待用。该沉积物样品的相关特性指标为:有机质含量为 (56.39±0.81)%,pH=7.28±0.3;沉积物上清液中SCOD(soluble chemical oxygen demand)值为 (206.9±16.9) mg·L−1、氨氮为 (85.03±2.53) mg·L−1、多糖为 (18.14±2.16) mg·L−1、蛋白质为 (0.08±0.01) mg·mL−1。
1.2 实验试剂和仪器
所用试剂主要包括中性蛋白酶、α-淀粉酶、SDS、氯化钠、COD专用耗材、氢氧化钠、苯酚、氯化氢、无水乙醇、纳氏试剂等。其中,实验所用酶制剂基本性质及来源见表1,其他化学试剂均为分析纯,实验用水为去离子水。
表 1 生物酶基本性质Table 1. Basic properties of biological enzymes生物酶种类 酶活性/(U·g−1) 适宜温度/ ℃ 适宜pH 来源 中性蛋白酶 2×105 50~55 6.0~7.0 合肥博美生物科技有限公司 α-淀粉酶 4 000 60~70 6.0~7.0 上海源叶生物科技有限公司 实验主要仪器包括 YH-3BS远红外线恒温干燥箱(天津中环);SX-GO7103马弗炉(天津中环);MY3 000-6B混凝实验搅拌仪器(武汉梅宇仪器);721型可见分光光度计(上海佑科);VELOCITY 18R台式多功能离心机(Dynamica公司);FY-1C-N真空泵(浙江飞越);G9 800A三维荧光激发-发射光谱仪(美国安捷伦);PHS-3E型pH计(雷磁);HH-4电热恒温水浴锅(绍兴苏珀)。
1.3 实验方案
取100 mL排水管网沉积物置于250 mL烧杯内,通过0.1 mol·L−1的盐酸或氢氧化钠溶液调节pH至 5~10;将烧杯放入水浴锅预热,使沉积物到目标温度(4~65 ℃)后;加入8%(质量百分比,酶质量与沉积物干质量比)污泥的复配酶(α-淀粉酶:中性蛋白酶=2:3),并加入0、1%、2%、5%、8%和10%(质量百分比)的SDS;在200 r·min−1下搅拌,连续反应 0~6 h。反应结束后,取部分污泥进行有机质含量的检测,将剩余部分污泥置于离心管中,在4 000 r·min−1下离心15 min,离心后取上清液经0.45 μm滤膜过滤;检测滤液中SCOD、氨氮、多糖,每个实验重复3次,取平均值分析4个因素对SDS促进复配酶水解排水管网沉积物的影响,确定其最佳反应条件,并分析最佳反应条件下的上清液EPS、三维荧光光谱、沉积物表面结构形态和粒径的变化。
1.4 测定方法
氨氮采用纳氏分光光度法进行测定;溶解性化学需氧量(SCOD)采用快速消解分光光度法测定;多糖采用苯酚-硫酸法测定;蛋白质含量选用改良Lowry法测定;沉积物中有机质含量测定采用《中华人民共和国城镇建设行业标准》(CJ/T96-1999)中有机质灼烧法。EPS采用热提取法,EPS中各类物质变化采用三维荧光扫描光谱仪(安捷伦1260)检测;沉积物表面形态采用扫描电子显微镜 (7610F,日本电子株式会社) 分析。采用16s rRNA高通量测序方法表征微生物群落结构变化。
2. 结果与讨论
2.1 SDS投加量对沉积物水解效果的影响
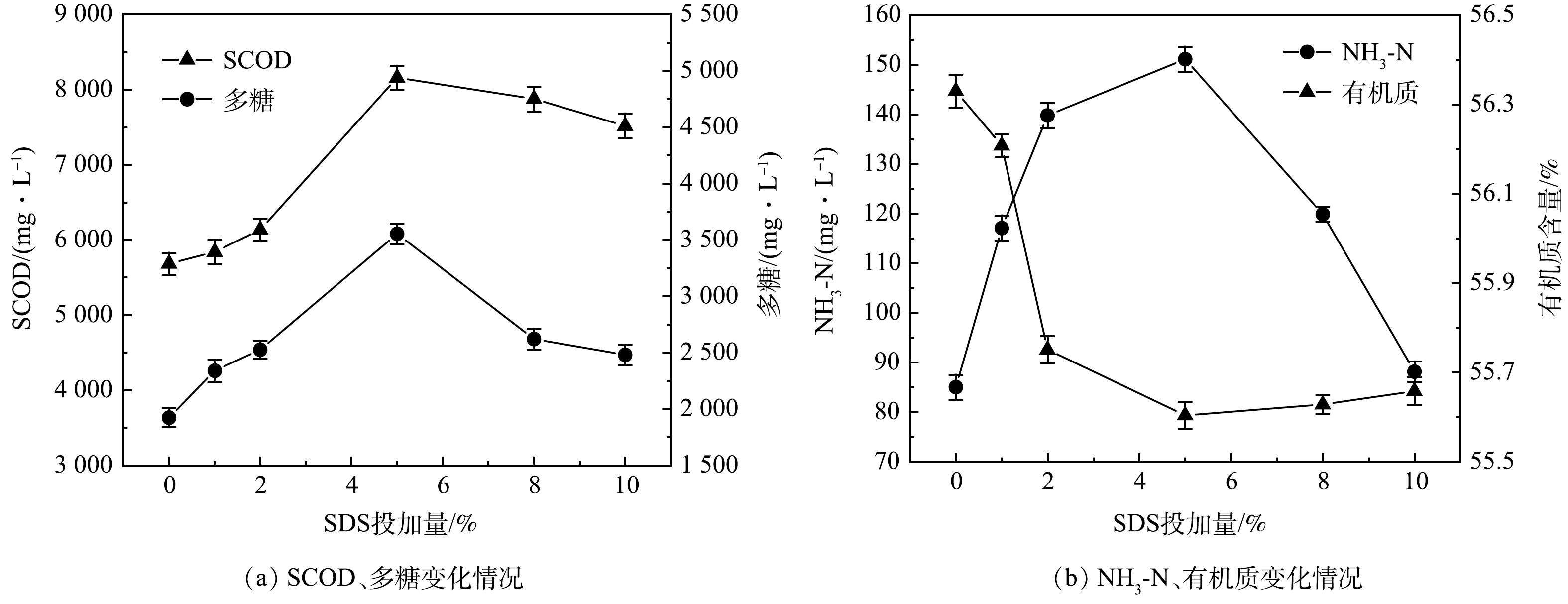
实验在原泥pH(7.28±0.3),8%(质量百分比)复配酶(α-淀粉酶:中性蛋白酶=2:3)、25 ℃反应2 h的条件下,SDS投加量对排水管网沉积物水解效果的影响结果见图1。由图1(a)可以看出,当SDS投加量在0%~5%时,SCOD与多糖浓度随SDS投加量增多而增长,在SDS投加量为5%时,SCOD和多糖达到峰值,分别由初始的5 686.9 mg·L−1和1 913.75 mg·L−1升至8 192.9 mg·L−1和3 561.29 mg·L−1;当投加量继续增加到10%,SCOD与多糖含量反而下降,在10%时,SCOD和多糖分别下降到7 545.9 mg·L−1和2 484.92 mg·L−1。由图1(b)可以观察到,氨氮与SCOD、多糖变化趋势相同,在SDS投加量为5%时,由原始的87.32 mg·L−1达到峰值的153.37 mg·L−1。有机质含量的变化与氨氮、SCOD、多糖变化趋势相反,在SDS投加量为5%时,有机质含量最低,为55.59%;当SDS投加量继续增大,有机质减量效果稍有提高,但与SDS投加量为5%时相差无几。有研究[16]表明,SDS作为酶调节分子,在较低剂量下可增强酶活性,在较高剂量下反而会抑制酶活性。这是由于SDS为阴离子表面活性剂,可以与带负电的沉积物发生静电排斥[14],在SDS含量为0%~5%,随投加量增加,沉积物更加分散,更利于复配酶与沉积物中有机质的接触,从而促进水解作用的发生;但当SDS投加过量时,SDS的烷基可与细胞壁结合,导致细胞破裂,从而部分影响微生物的活性,进而影响污泥水解效果[17]。因此,过低或过高的SDS均不利于生物酶对沉积物的水解。
2.2 反应时间对沉积物水解效果的影响
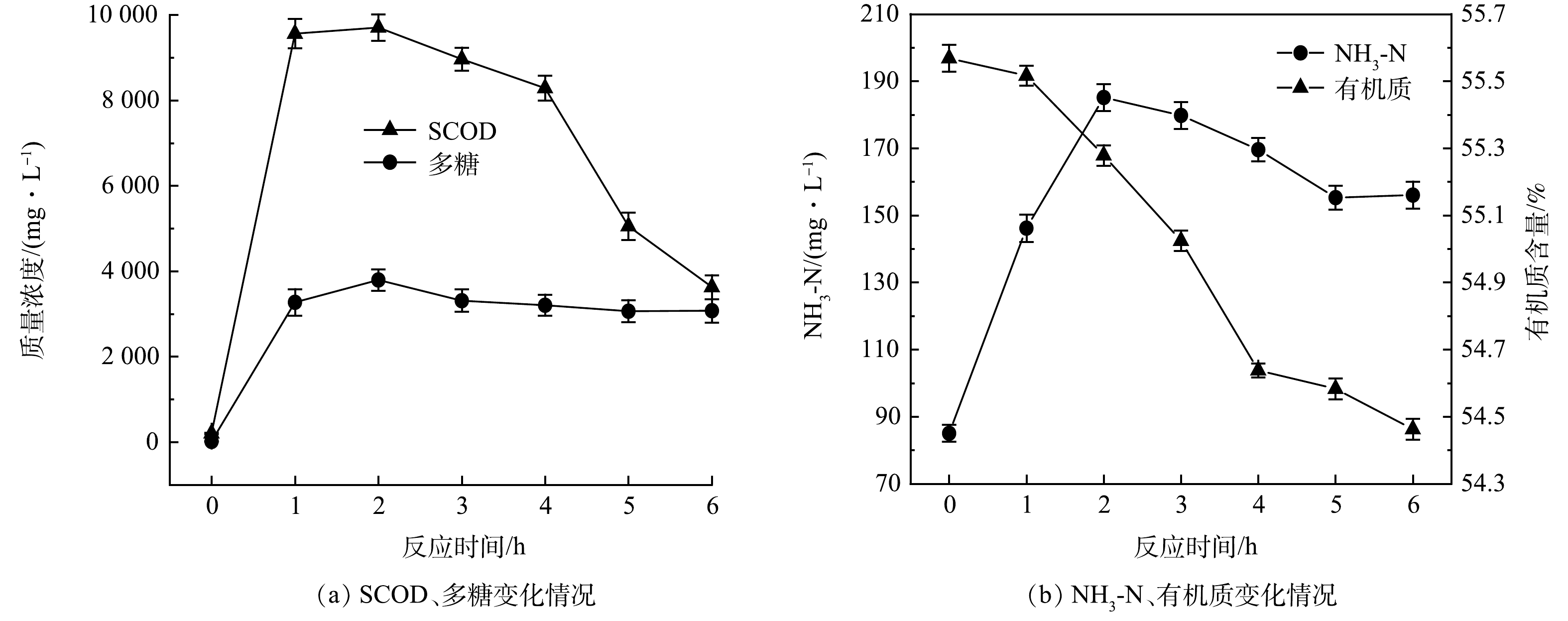
投加8%复配酶与5%SDS后,沉积物水解效果随反应时间的变化情况如图2所示。由图2可以看出,SCOD、多糖和氨氮随反应时间呈现先升高后下降的趋势。在反应2 h时,SCOD、多糖和氨氮含量分别由初始的211.3、18.38和87.32 mg·L−1升至9 726.5、3 868.84和185.12 mg·L−1。SDS的投加破坏了沉积物中微生物分泌出的EPS内部的非共价键,从而破坏沉积物结构,导致内部物质向外释放,促进了酶与沉积物之间的接触反应,从而使得SCOD、多糖和氨氮含量升高。随着反应时间继续延长,上清液中的SCOD、多糖与氨氮均开始了不同程度的下降,在6 h时,SCOD、多糖与氨氮质量浓度分别为3 581.5、3 056.05、156.09 mg·L−1。这可能是因为复配酶与SDS的协同作用随时间延长,沉积物的水解效果减弱,同时管网微生物对溶出物质进一步分解和利用[18],SCOD、多糖、氨氮的生成速率小于消耗速率,使得上清液中各物质浓度降低。有机质含量随反应时间呈现出一直下降的趋势,这说明水解反应在0~6 h内一直在进行,且在4 h后有机质分解速率变慢。综上所述,选择SDS协同复配酶水解排水管网沉积物的最佳反应时间为2 h。
2.3 温度对沉积物水解效果的影响
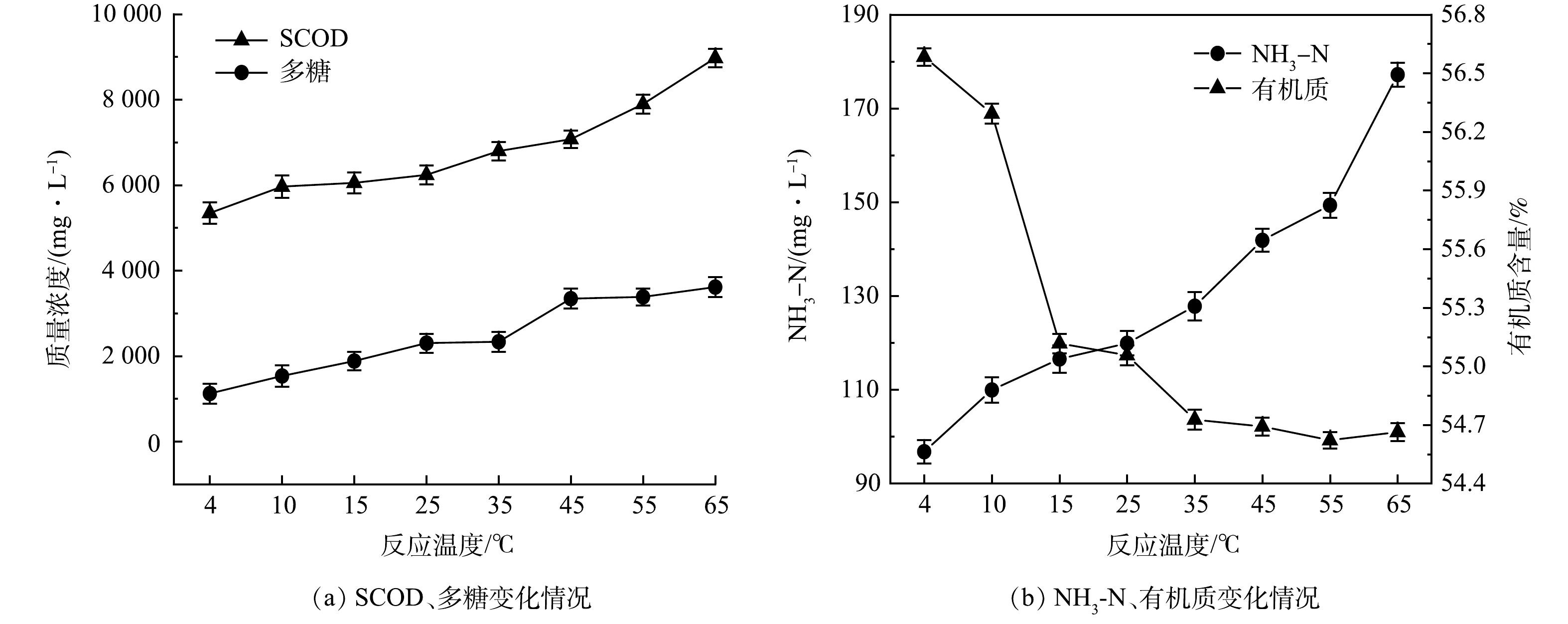
实验在原泥pH(7.28±0.3),反应2 h,5%SDS与8%复配酶协同作用下,考察了温度对沉积物水解效果的影响,结果如图3所示。从图3可以看出,在4~65 ℃内,SCOD和氨氮随温度的升高而升高,多糖先升高后趋于平缓,有机质含量随温度的升高逐渐下降,随后变得平缓。当温度由4 ℃升至65 ℃时,SCOD由5 341.0 mg·L−1逐步升至8 983.0 mg·L−1;多糖由1 100.96 mg·L−1升至3 649.16 mg·L−1;氨氮由96.44 mg·L−1升至176.84 mg·L−1。有机质含量在4~35 ℃内下降较快,由开始的56.58%下降到54.69%,降低了1.89%;在35 ℃后随温度的升高,有机质含量保持在54.65%左右。这可能是由于温度升高,中性蛋白酶和α-淀粉酶的活性基团逐渐被激活,酶制剂活性增强,并且在SDS的增溶作用下,酶制剂和沉积物的接触更加充分,水解效果更好。在上述SDS与复配酶的协同作用下,液相中的蛋白质被分解为多肽以及小分子氨基酸,碳水化合物被水解成多糖与单糖[19],水解效果增强,溶解性有机物浓度提高。
根据实验结果,在反应温度高于15 ℃时,SDS协同复配酶的水解效果较好,而市政污水管网常年在8~35 ℃,因此,综合考虑项目经济性和实用性,在实际应用过程中,生物酶水解排水管网沉积物可选择管网温度在15 ℃以上时进行。
2.4 pH对沉积物水解效果的影响
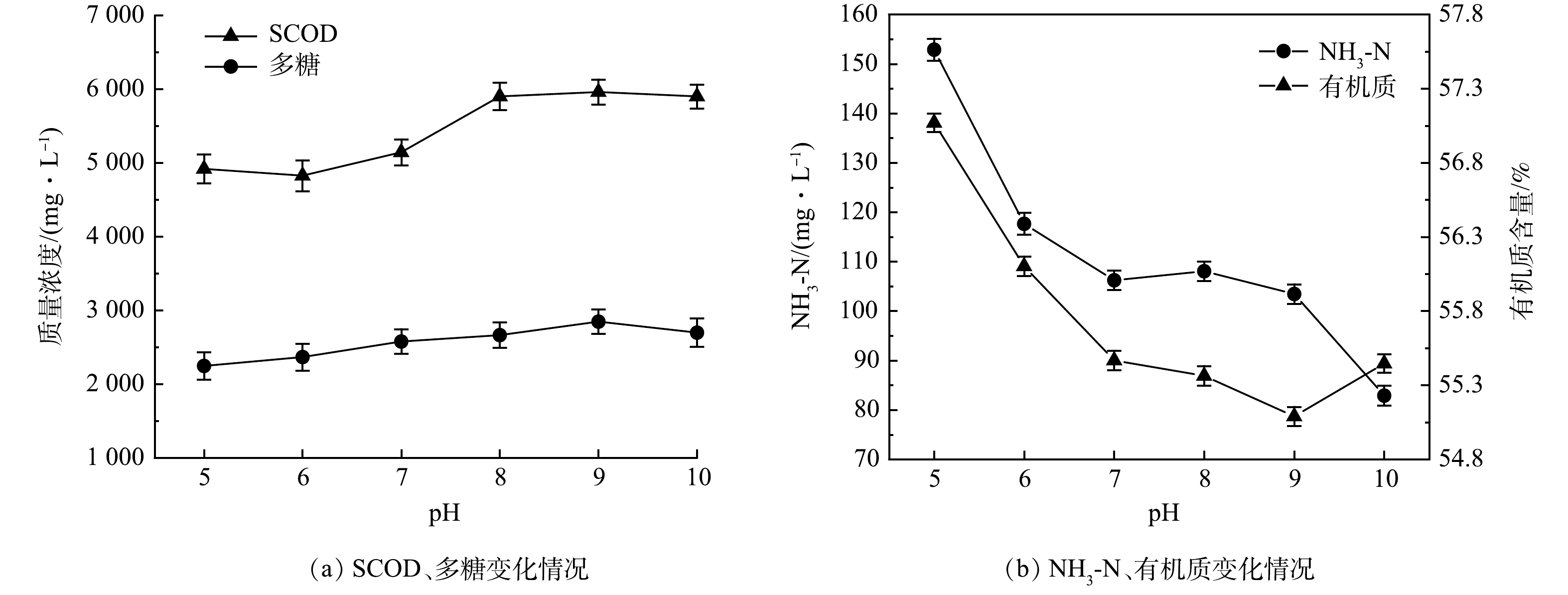
本实验考察了5%SDS与8%复配酶在25 ℃,反应2 h条件下,不同pH对沉积物水解效果的影响结果见图4。由图4(a)可以看出,SCOD与多糖在pH=5~6保持一个平稳的数值,当pH升高为8时,二者均有不同程度的提高,SCOD与多糖分别由pH=6的4 830.4 mg·L−1 和2 369.82 mg·L−1提高到pH=8的5 895.4 mg·L−1和2 660.64mg·L−1;当pH进一步升高为8~10时,SCOD与多糖含量几乎不变。由图4(b)可以看出,氨氮含量随pH增加而下降,氨氮由pH=5的152.87 mg·L−1降到pH=10的82.83 mg·L−1。这是由于碱性条件下氨氮容易从液相转移到气相中,从而使得氨氮含量出现大幅度下降[20]。在pH=5~9,有机质含量随着pH的增加逐渐下降,从57.08%下降到55.09%,当pH增加到10时,有机质含量出现回升。结合图4(a),在pH=10时SCOD、多糖含量变化不大,说明pH继续增大不能继续提升沉积物水解效果。在pH=7~9内,SDS+复配酶对排水管网沉积物的水解效果较好,而实际管网中沉积物pH大概在7~8,因此,在实际应用过程中不需要进行pH调节。
2.5 SDS协同复配酶对沉积物EPS的影响
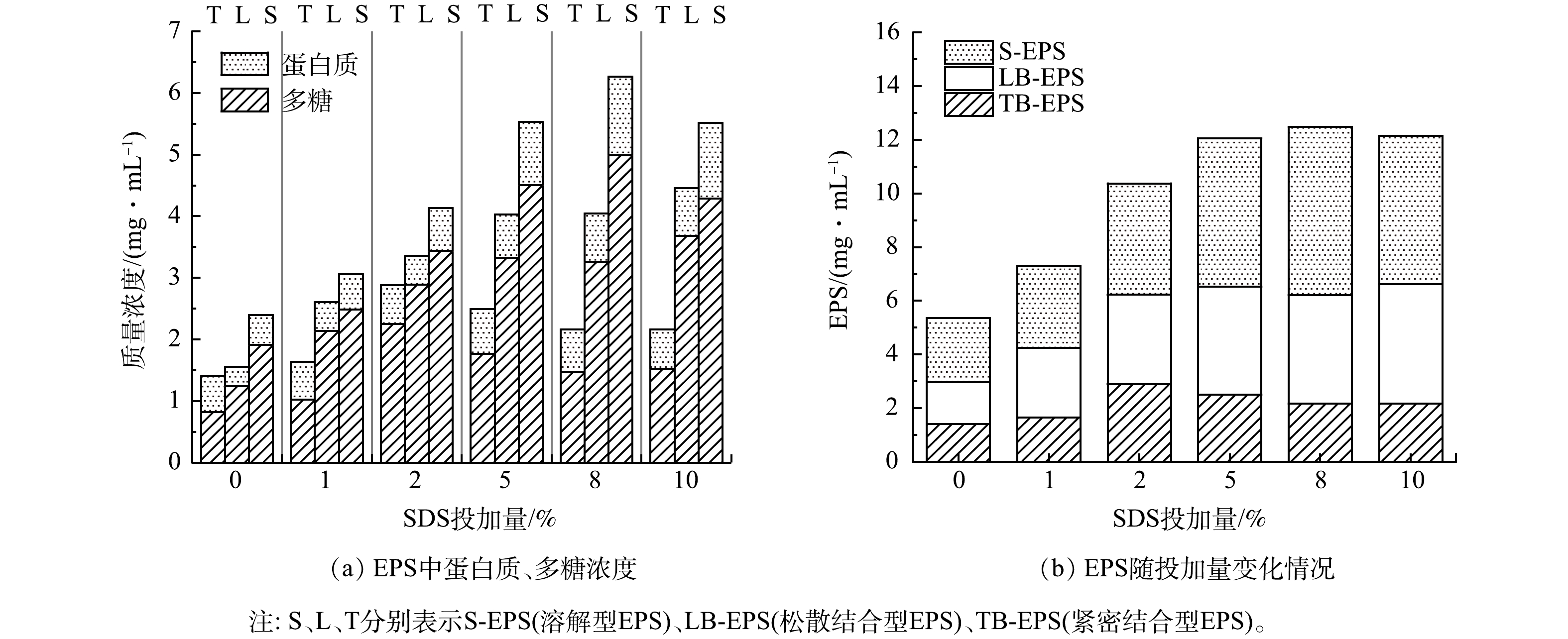
沉积物中存在微生物,微生物日常生长代谢会产生有粘性的EPS等物质,增加了沉积物的抗冲刷能力;同时,EPS还能吸附污水中的有机颗粒,增加排水管网沉积物厚度和管网淤堵的风险。复配酶可水解沉积物中蛋白类与糖类物质,SDS的两亲性可以改变界面处的能量关系,增加EPS的溶解[21]。研究了复配酶协同SDS水解管网沉积物对EPS及其蛋白质与多糖浓度变化的影响,结果见图5。从图5(a)可以看出,在复配酶投加量为8%,水解2 h条件下,沉积物上清液中TB-EPS(tightly bound EPS)、LB-EPS(loosely bound EPS)与S-EPS(soluble-EPS)的多糖与蛋白含量均随着SDS投加量的增加呈现先升高后下降的趋势,各层EPS总含量变化趋势为S-EPS>LB-EPS>TB-EPS,其中TB-EPS向S-EPS转移。有研究表明,表面活性剂的两亲性使得SDS有一定的的分散作用,可以通过其疏水性与细胞膜蛋白相互作用,这可能导致沉积物的侵蚀[22];当SDS与复配酶协同水解沉积物时,可以大大削弱LB-EPS与TB-EPS的结合[23],使得沉积物发生更严重的裂解和内部生物聚合物的释放,使不溶性的EPS剥离从而进入沉积物上清液中,同时内层TB-EPS向外部转移,TB-EPS含量下降,LB-EPS与S-EPS增多,EPS中可溶性蛋白质与多糖含量增加。
图5(b)为不同SDS投加量下EPS总量的变化情况。可以看出,随投加量增多,EPS含量先升高后基本不变。由于SDS具有增溶作用,大量大分子物质脱离沉积物固体溶解于液相[24],从而释放出更多的蛋白质、多糖等物质到EPS中,使其含量增多。但由于表面活性剂在较低剂量(0~5%)下增强酶活性,在较高剂量(5%~10%)下抑制酶活性[16],因此在SDS投加量高于5%后,随着SDS投加量进一步增加,复配酶失活,水解效果降低。
2.6 三维荧光光谱分析溶解性有机物的变化
中性蛋白酶与α-淀粉酶能够破解复杂的高分子物质,例如蛋白质、碳水化合物等,将一部分难降解物质水解,并释放之液相。而SDS具有增溶的特性,能够加快非液相物质溶解到水中的速度,同时也会释放被沉积物捕获的酶制剂,暴露出更多的底物[25],从而促进沉积物中有机质的水解,增加进入液相中溶解性有机物的含量。而三维荧光光谱可以分析污泥中溶解性有机物的种类及分布,不同区域和不同荧光强度代表不同物质及相应的浓度。
由图6可以明显看出,经SDS+复配酶组处理后的沉积物上清液EPS中,I~III区域荧光强度较复配酶组大幅度下降。表明在投加SDS后,酪氨酸、色氨酸与富里酸类物质含量减小甚至消失。左锦静[26]研究表明,SDS与蛋白质之间可以通过疏水作用自发结合,SDS作为淬灭剂对蛋白质进行淬灭,使得三维荧光光谱中蛋白质类物质几近消失;IV区域内的荧光强度和范围略有缩减,这可能是因为SDS具有抑菌性,随着反应时间的延长,导致沉积物中部分微生物死亡,可溶性微生物代谢产物含量降低;V区域所代表的腐殖酸类为五类可溶性有机物中的主要物质,与经复配酶处理后的沉积物上清液的三维荧光光谱图进行对比可以看出,SDS+复配酶的投加使得沉积物上清液中腐殖酸含量急剧增加,且又出现了一种新的腐殖酸物质(Ex/Em为390~440 nm/440~500 nm),这2种腐殖酸浓度由内向外逐渐递增。一方面,SDS的两亲性使得复配酶更容易接触沉积物内部,释放出更多的物质,如腐殖酸;另一方面,微生物对腐殖酸利用率较低,容易在EPS中沉积,沉积物释放出的可溶性微生物副产物等物质更容易被微生物利用或被上清液中溶解的复配酶水解成小分子物质,导致腐殖酸含量高,溶性微生物副产物含量低。有研究[27]表明,腐殖酸浓度可以反映EPS溶解的程度,这也说明沉积物中腐殖酸类物质占比较高,腐殖酸浓度越大,溶解性EPS越多,沉积物水解减量效果越好。
2.7 SEM表征
SEM可较直观的反映出沉积物水解前后表面微观结构的变化,经SDS+复配酶、复配酶水解后的沉积物表面结构变化如图7所示。沉积物在被SDS+复配酶、复配酶水解后均出现密集多孔的表面形态,说明SDS+复配酶与复配酶对沉积物均有明显的破坏效果。经SDS+复配酶处理后,沉积物表面层状更多,说明SDS的增溶作用会打破沉积物紧密连接的结构,使得复配酶能够与更深层的沉积物的接触反应,进而促进水解反应的发生。同时疏松多孔的表面形态使得沉积物更容易被水力冲刷,有利于达到延缓管网淤堵和沉积物减量化的目的。
2.8 SDS+复配酶对粒径变化的影响
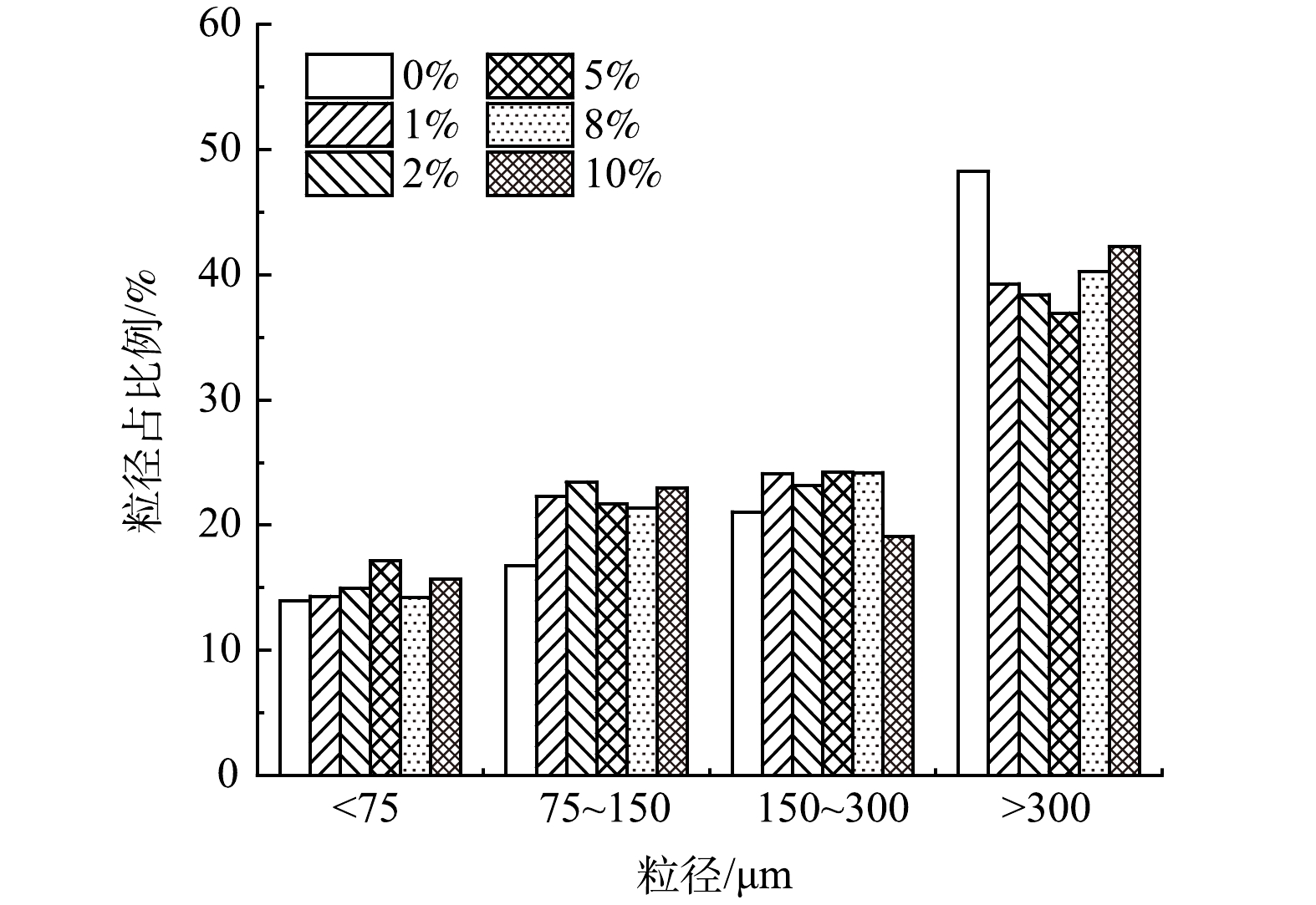
在复配酶投加量为8%的条件下,SDS投加量对沉积物粒径的影响结果见图8。可以看出,粒径>300 μm沉积物的质量占比由单独投加复配酶的48.25%下降到5% SDS投加量下的36.94%,随后SDS增加,此粒径沉积物的占比又增加;粒径在150~300 μm内的沉积物质量占比由独投加复配酶的21.05%升高到8%SDS的24.20%左右,随后其质量占比随SDS投加量增加而减小;粒径在75~150 μm内沉积物的质量分数由16.75%升至2%SDS下的23.5%,随后SDS投量增加,质量占比保持在22.0%左右;粒径<75 μm的沉积物质量分数占比由单独投加复配酶的13.95%升高到5%SDS的17.14%,随后SDS投量增加,其质量占比下降。
以上结果表明,在SDS+复配酶协同水解沉积物的过程中,随着SDS投加量的增加,在粒径>300 μm时,沉积物质量占比均有明显下降;小粒径占比增多。SDS的投加量在0%~5%内,投加量的增多会促进大颗粒物质向小颗粒转化。但当SDS投加量大于5%时,SDS对复配酶的水解起抑制作用,大颗粒向小颗粒转化效果变差。
2.9 SDS协同复配酶水解排水管网沉积物微生物分析
1)排水管网沉积物Alpha多样性。利用16S rRNA基因测序技术对原沉积物和分别经复配酶、SDS+复配酶处理沉积物的菌群结构进行Alpha多样性指数分析,结果见表2。OTUs大小可反应样品中物种多样性[28]。由表2可知,原泥OTUs数量最多,投加复配酶后,OTUs数量显著降低,而采用SDS+复配酶处理后,OTUs又有大幅度回升。表明单独采用复配酶可降低管网菌种数量,但采用SDS与复配酶联用可减少对管网中微生物多样性的影响。Shannon和Simpson指数也表明,经过复配酶处理后的样品中,这2个指数均出现明显下降,而经SDS+复配酶处理后的样品Shannon和Simpson指数与原泥相比相差不大,说明微生物多样性和均匀性没有出现很大改变。本次实验中4组样品的覆盖率均大于0.98,表明本次微生物测序的有效性和可靠性。
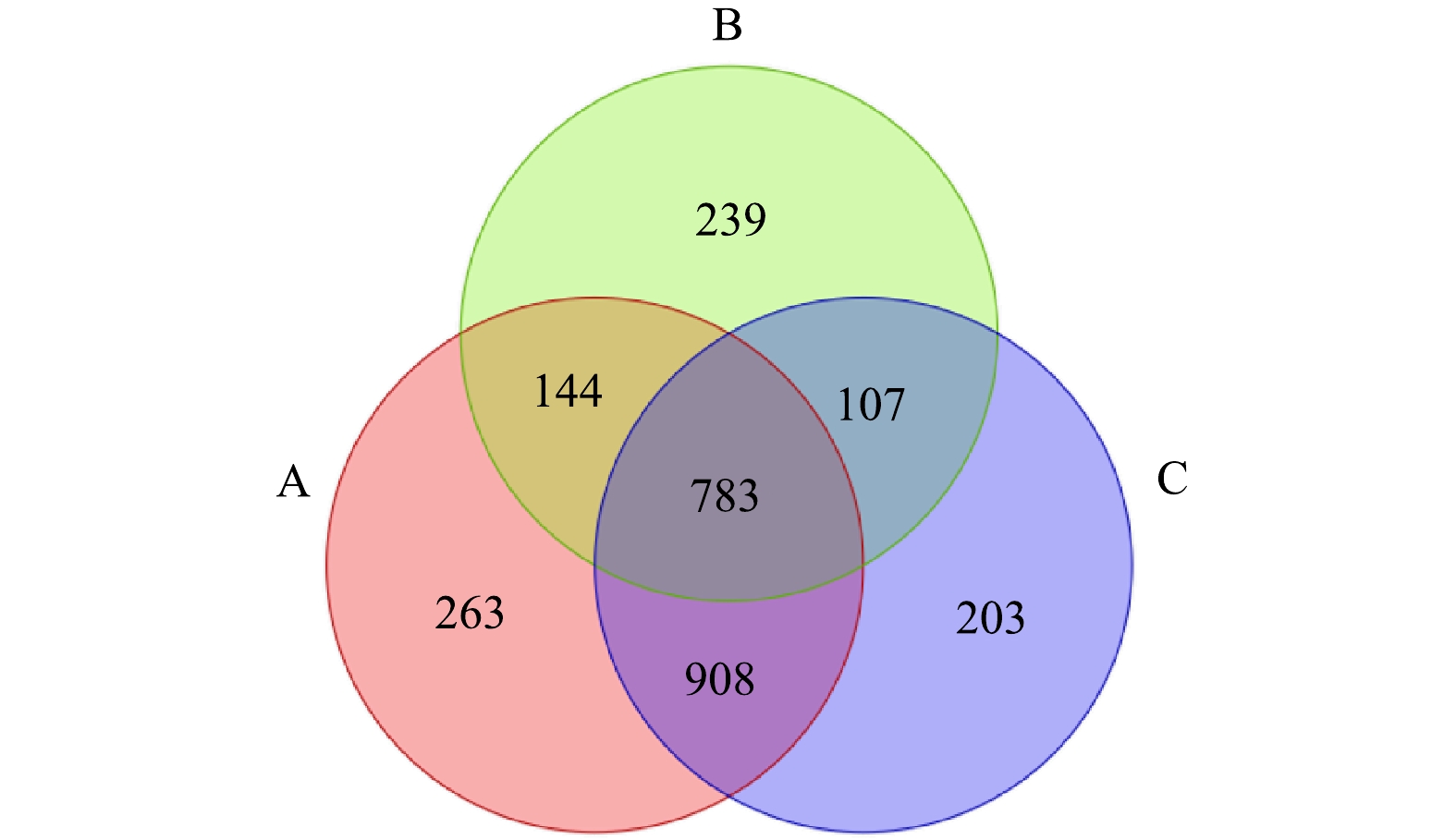
表 2 微生物alpha多样性指数分析Table 2. Microbial alpha diversity index analysis样本 OTUs Chao1 Shannon Simpson 覆盖率 原泥 1 471 2 090 6.52 0.95 0.98 复配酶 (中性蛋白酶:α-淀粉酶=2:3) 791 1 086 4.84 0.88 0.99 SDS+复配酶 (中性蛋白酶:α-淀粉酶=2:3) 1 294 1 934 6.22 0.95 0.98 2)基于OTU的微生物群落Venn图分析。各组样品间的OTU彼此关联,根据3组沉积物样品测定的OTU数据,绘制了3组样品OTUs的Venn图,以反映不同处理条件下沉积物样品的物种多样性差异[29]。由图9可以看出,原泥组(A)、复配酶组(B)和SDS+复配酶组(C)样品的OTU数目分别为2 098、1 273和2 001,相较于原泥,各组OUT数均有不同程度的降低,表明在投加酶制剂后,物质多样性出现了不同程度的下降[30],其中复配酶下降最明显,而SDS+复配酶与原泥相差较小,这也与表2的结果一致。Venn图的重叠部分代表了不同样品的共有OTU,可知 3 组样品的共有OTU数为783,占总OTU数(2 647)的29.58%,说明酶制剂的投加会对排水管网沉积物中的微生物丰富度和多样性造成一定的影响[31]。
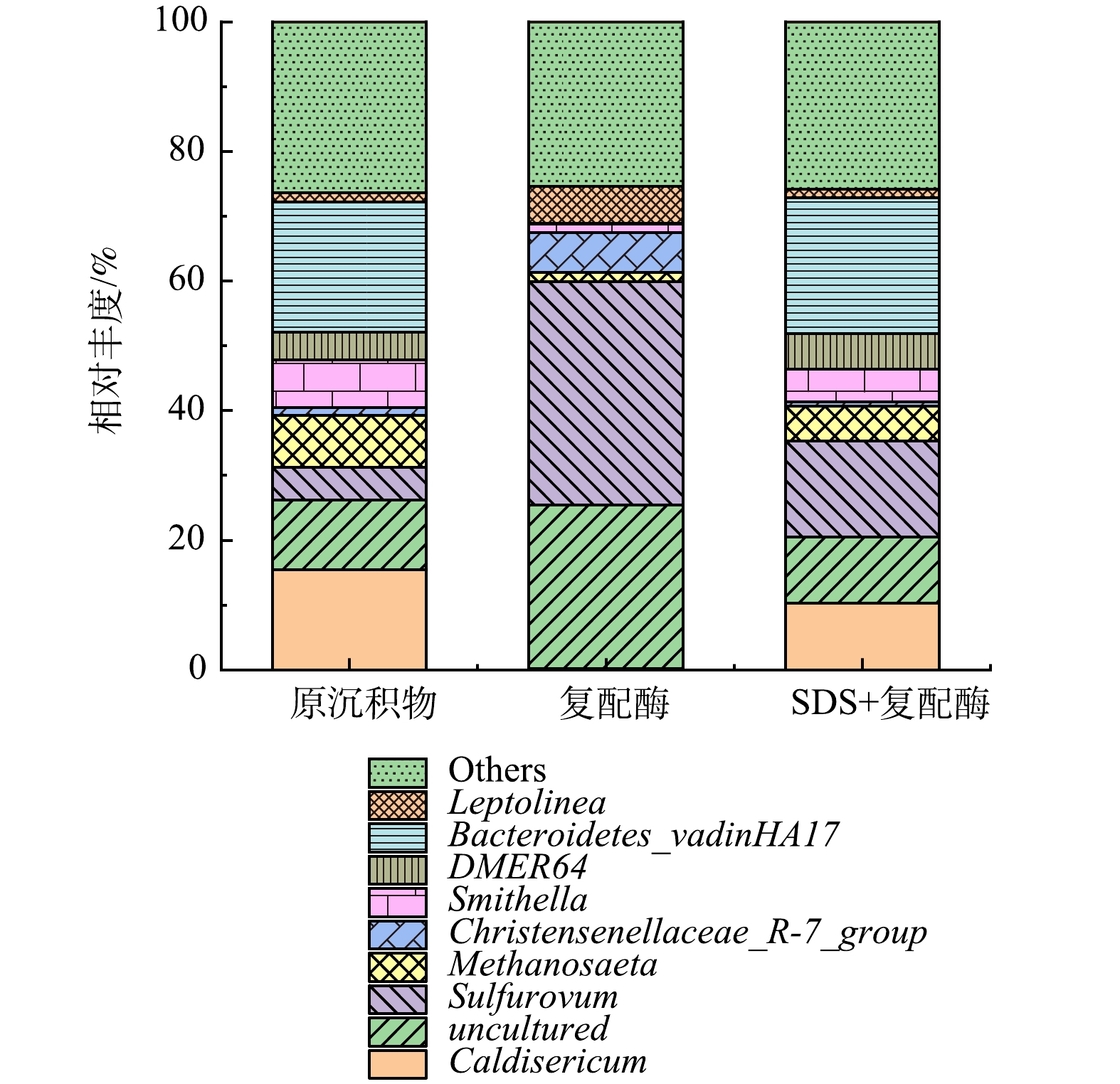
3)微生物属水平群落结构及功能菌群分析。观察了属水平上微生物群落结构演替(图10),沉积物经复配酶、SDS+复配酶处理后,Sulfurovum (反硝化硫菌)的相对丰度均有不同程度的增加,分别从原沉积物的5.02%增加为34.53%和14.85%,其中复配酶组增幅最大。这可能由于投加酶制剂后,沉积物中大分子物质溶出,氨氮升高,可能硝态氮也有所升高,有利于Sulfurovum的繁殖。Caldisericum(嗜热、硫代硫酸盐还原细菌)与Methanosaeta(甲烷丝菌属)在投加复配酶、SDS+复配酶后,相对丰度均出现下降的现象。Methanosaeta(甲烷丝菌属)在原沉积物、复配酶和SDS+复配酶中所占比例分别为8.09%、1.34%和5.33%。Methanosaeta属于产甲烷菌(MA)的一种,其新陈代谢会产生CH4和CO2,此菌种所占比例减少,一定程度上也会降低排水管道中CH4产量。Caldisericum的变化趋势与Methanosaeta相同,复配酶组、SDS+复配酶组相对丰度均小于原沉积物,表明经SDS+复配酶处理后会减少管网中H2S的产量,这有利于管网的后续维护。Uncultured表示未能在人工条件下获得纯培养的微生物。
3. 结论
1)采用SDS+复配酶可有效水解排水管网沉积物,在原泥pH(7.28±0.3)、25 ℃下反应2 h,沉积物上清液中SCOD、多糖和氨氮分别由初始的5 686.9、1 913.75和87.32 mg·L−1升至8 192.9、3 561.29和153.37 mg·L−1,有机质含量由56.32%降到55.59%,促进了有机质从固相向液相的转移。
2) SEM、EPS、粒径以及三维荧光光谱表征分析结果表明,SDS+复配酶处理管网沉积物后其内部紧实结构被破坏、粒径尺寸变小;在SDS投加量为0~5%内,随着投加量的增多,各层EPS总含量变化趋势为S-EPS>LB-EPS>TB-EPS,其中TB-EPS向S-EPS转移;与单独复配酶水解沉积物效果相比,SDS+复配酶水解沉积物过程中腐殖酸类物质由内向外转移,且荧光强度增强,溶解性EPS增多。这有利于破坏沉积物紧密连接的结构形态,降低沉积物黏性,增加被冲刷性能,延缓排水管网淤堵。
3) SDS+复配酶在一定程度上改变了沉积物中的功能菌群,使得沉积物中Sulfurovum相对丰度增加,而Caldisericum与Methanosaeta相对丰度下降,这对减少管网中CH4、H2S等的产生具有积极作用。SDS+复配酶对微生物的影响会降低管网内部的生化反应,有利于管网的后续维护。
-
表 1 PBC的比表面积与孔径结构分析
Table 1. Analysis of specific surface area and pore structure of PBC
样品 SBET/(m2·g−1) Vt/(cm3·g−1) Vmic/(cm3·g−1) dp/nm 吸附前 391.0 0.194 6 0.113 1 1.990 7 吸附后 273.2 0.104 7 0.098 0 1.963 8 表 2 PBC对SMX的吸附动力学拟合参数
Table 2. Kinetics parameters for SMX adsorption on PBC
样品 准一级动力学方程 准二级动力学方程 颗粒内扩散方程 qe/(mg·g−1) k1/min−1 R2 kF/(mg·g−1) n/(g·(mg·min)−1) R2 k3/(mg·(g·min1/2)−1) R2 BC 7.55 2.72×10−2 0.956 6 13.87 7.21×10−2 0.999 1 1.23 0.992 4 PBC 11.69 1.56×10−2 0.861 0 24.79 4.03×10−2 0.997 7 2.83 0.972 1 表 3 PBC对SMX的吸附等温线拟合参数
Table 3. Isotherms parameters for SMX adsorption on PBC
T/℃ Langumuie模型 Freundlich模型 qm/(mg·g−1) kL/(L·mg−1) R2 KF/(mg·g−1) n R2 283 43.43 2.03 0.874 7 19.44 4.28 0.980 2 298 44.59 2.28 0.893 2 22.62 4.15 0.983 2 313 45.79 2.41 0.874 3 24.57 4.03 0.980 6 表 4 PBC对SMX的吸附热力学参数
Table 4. Thermodynamic parameters of SMX adsorption on PBC
温度/K ΔG/(kJ·mol−1) ΔH/(kJ·mol−1) ΔS/(J·(K·mol)−1) 283 −6.98 5.77 45.14 298 −7.73 313 −8.33 -
[1] LIU L, HU S, SHEN G, et al. Adsorption dynamics and mechanism of aqueous sulfachloropyridazine and analogues using the root powder of recyclable long-root, Eichhornia crassipes[J]. Chemosphere, 2018, 196(3): 409-417. [2] 杨帅, 余晓敏, 郭学博, 等. 二氧化氯对典型磺胺类抗生素的降解机制[J]. 环境化学, 2019, 38(1): 38-45. [3] 陈哲, 吴立明, 苏怡. 生活饮用水中磺胺类抗生素污染现状及其控制的研究进展[J]. 上海预防医学, 2018, 30(5): 80-83. [4] 吴娜娜, 钱虹, 李亚峰. 水中磺胺类抗生素去除技术研究进展[J]. 建筑与预算, 2017, 10(6): 43-50. [5] QIU J R, ZHAO T, LIU Q Y, et al. Residual veterinary antibiotics in pig excreta after oral administration of sulfonamides[J]. Environmental Geochemistry & Health, 2016, 38(2): 549-556. doi: 10.1007/s10653-015-9740-x [6] LI X D, YU H X, XU S S, et al. Uptake of three sulfonamides from contaminated soil by pakchoi cabbage[J]. Ecotoxicology and Environmental Safety, 2013, 92(3): 297-302. [7] 郑吉, 周振超, 陈芳, 等. 3种常规消毒方法对磺胺类抗性基因削减效果的比较[J]. 环境科学, 2017, 38(4): 1497-1505. [8] LEVCHU I, RUEDA M J J, SILLANPÄÄ M. Removal of natural organic matter (NOM) from water by ion exchange: A review[J]. Chemosphere, 2017, 192: 90-104. [9] 刘吉开, 万甜, 程文, 等. 饮用水中典型磺胺类抗生素的深度处理工艺对比[J]. 净水技术, 2018, 37(7): 44-49. [10] WANG C, YAO X, WANG P, et al. Effects of water environmental factors on the photocatalytic degradation of sulfamethoxazole by AgI/UiO-66 composite under visible light irradiation[J]. Journal of Alloys & Compounds, 2018, 748(5): 314-322. [11] ZHANG C, LAI C, ZENG G M, et al. Efficacy of carbonaceous nanocomposites for sorbing ionizable antibiotic sulfamethazine from aqueous solution[J]. Water Research, 2016, 95(14): 103-112. [12] RUI L, ZHANG Y L, CHU W L, et al. Adsorptive removal of antibiotics from water using peanut shells from agricultural waste[J]. RSC Advances, 2018, 24(8): 13546-13555. doi: 10.1039/C7RA11796E [13] 王栋纬, 宋燕西, 冶晓凡, 等. 氧化石墨烯对磺胺甲恶唑和磺胺甲基嘧啶的吸附性能研究[J]. 分析化学, 2018, 46(2): 211-216. doi: 10.11895/j.issn.0253-3820.171279 [14] WU J, ZHAO H, CHEN R, et al. Adsorptive removal of trace sulfonamide antibiotics by water-dispersible magnetic reduced graphene oxide-ferrite hybrids from wastewater[J]. Journal of Chromatography B, 2016, 1029-1030: 106-112. doi: 10.1016/j.jchromb.2016.07.018 [15] NAM S W, JUNG C, LI H, et al. Adsorption characteristics of diclofenac and sulfamethoxazole to graphene oxide in aqueous solution[J]. Chemosphere, 2015, 136(3): 20-26. [16] MOUNI L, MERABET D, BOUZAZA A, et al. Adsorption of Pb(II) from aqueous solutions using activated carbon developed from Apricot stone[J]. Desalination, 2013, 276(1): 148-153. [17] AHMAD M, LEE S, RAJAPAKSHA A, et al. Trichloroethylene adsorption by pine needle biochars produced at various pyrolysis temperatures[J]. Bioresource Technology, 2013, 143(1): 615-622. [18] FENG Z, ZHU L. Sorption of phenanthrene to biochar modified by base[J]. Frontiers of Environmental Science & Engineering, 2018, 12(2): 1. [19] ZHANG S, ZHANG H, CAI J, et al. Evaluation and prediction of cadmium removal from aqueous solution by phosphate-modified activated bamboo biochar[J]. Energy & Fuels, 2017: 32(4): 4469-4477. [20] 张江, 孙宁宁, 张景环, 等. 改性石墨烯-生物炭复合材料对磺胺类抗生素的吸附[J]. 山东化工, 2017, 46(23): 39-39. doi: 10.3969/j.issn.1008-021X.2017.23.016 [21] 房聪, 房烽, 张黎明, 等. 秸秆活性炭活化过一硫酸盐降解酸性橙7[J]. 环境科学学报, 2018, 38(1): 242-250. [22] 朱青. 改性生物炭对水中磺胺嘧啶的去除试验研究[D]. 济南: 山东师范大学, 2018. [23] CICEK F, DURSUN O, AHMET O, et al. Low cost removal of reactive dyes using wheat bran[J]. Journal of Hazardous Materials, 2007, 146(1): 408-416. [24] LUCIDA H, PARKIN J E, UNDERLAND V B. Kinetic study of the reaction of sulfamethoxazole and glucose under acidic conditions: I. Effect of pH and temperature[J]. International Journal of Pharmaceutics, 2000, 202(1): 47-62. [25] ZHENG H, WANG Z Y, JIAN Z, et al. Sorption of antibiotic sulfamethoxazole varies with biochars produced at different temperatures[J]. Environmental Pollution, 2013, 181(56): 60-67. [26] TEIXIDÓ M, PIGNATELLO J J, BELTRÁN J L, et al. Speciation of the ionizable antibiotic sulfamethazine on black carbon (biochar)[J]. Environmental Science & Technology, 2011, 45(23): 10020-10027. [27] CHIOU C T, MALCOML R L, BRINTON T I, et al. Water solubility enhancement of some organic pollutants and pesticides by dissolved humic and fulvic acids[J]. Environmental Science & Technology, 1986, 20(5): 502-508. [28] TAQVI S I H, HASANY S M, BHANGER M I. Sorption profile of Cd (II) ions onto beach sand from aqueous solutions[J]. Journal of Hazardous Materials, 2007, 141(1): 37-44. doi: 10.1016/j.jhazmat.2006.06.080 [29] DANMALIKI G I, SALEH T A. Influence of conversion parameters of waste tires to activated carbon on adsorption of dibenzothiophene from model fuels[J]. Journal of Cleaner Production, 2016, 117: 50-55. doi: 10.1016/j.jclepro.2016.01.026 [30] 吕迪. 改性活性炭吸附水中内分泌干扰物双酚A的研究[D]. 杭州: 浙江工业大学, 2017. [31] LIU T, XIE Z, ZHANG Y, et al. Preparation of cationic polymeric nanoparticles as an effective adsorbent for removing diclofenac sodium from water[J]. RSC Advances, 2017, 61(7): 38279-38286. doi: 10.1039/C7RA06730E -













 DownLoad:
DownLoad: